摘要
背景
雄性不育(MS)在杂交种子生产中具有重要应用,并且在许多植物物种中观察到花药的流产。虽然大多数研究专注于影响雄性不育的遗传因素,但雄性无菌系中花粉流产的动态基因表达模式尚未完全阐明。此外,由于缺乏合适的血液无菌系统,仍然没有杂种OAT在商业地种植杂种繁殖的雄性不育系统。
结果
在这项研究中,我们通过杂交培养了一种雄性无菌燕麦线和近代的线,以阐明可能参与无菌性的基因的表达模式。第一个报道的CA雄性无菌(CAMS)OAT线用于交叉测试和杂交实验,并确认表现出由隐性基因控制的一种核不异性。两条线的燕麦雄蕊分别在四种不同的发育阶段进行了取样。对每个样品进行配对末端RNA测序并产生252.84GB序列。在所有样品中公共数据库中有295,462个unigenes,我们将燕麦雄蕊的组织学特征和转录组与不同发育阶段的两种燕麦线进行了比较。我们的结果表明,雄性无菌燕麦线的不育发生在雄蕊发育的早期阶段,主要归因于异源异常和过量的超氧化物的过度积累。
结论
据我们所知,本研究首次揭示了燕麦花粉败育CAMS和CA雄性可育(CAMF)系的动态表达谱,为进一步研究燕麦花粉败育和花药发育提供了有价值的资源。
背景
以探索杂种优势为基础的商业育种为果实大小、产量等数量性状的改良做出了巨大贡献。雄性不育在育种中有着广泛的应用,在杂交育种中表现出相当大的优势,特别是经济优势。高等植物的雄性不育是指不能产生可存活的雄性配子,导致花药败育和雄性性器官发育的不育。花粉发育过程中的任何变化,包括一系列的生理生化反应,都可能导致小孢子败育。植物的雄性不育根据遗传特性分为细胞质雄性不育(CMS)、核质雄性不育(GMS)和遗传细胞质雄性不育(GCMS) [28]. 同时,雄性不育也是研究雄蕊和花粉发育以及研究细胞质-核-基因组相互作用的重要模型[10].
据报道,超过617种植物存在雄性不育[25,28]强烈支持雄性不育的遗传模式,并且在许多植物中也发现了与雄性不育有关的大量基因。当通过将雄性不育基因从野生稻中转移雄性不育基因在水稻中成功培养了第一CMS线和杂种组合时,是一个里程碑54].随后,从不同生态品种中构建了一系列CMS系和GMS系[9,67]. 第一个小麦不育系于1959年建立[29],而只有通过CMS系统、光周期敏感不育系统和化学杂交剂才能产生有限的杂交小麦[35,63].与玉米和水稻相比[35,65]但由于缺乏实用的雄性不育性状来提高育种能力和降低成本,小麦商品化杂交仍受到限制[63].
燕麦(燕麦属漂白亚麻纤维卷),属于禾草科燕麦族,是人类消费和动物饲料的重要经济作物。燕麦也是一种有益于人类饮食的健康作物,具有改善肠胃功能等作用[55,64,促进葡萄糖代谢[2,降低胆固醇[7,64]. 燕麦的花序排列成松散的圆锥花序,由一系列从主轴开始的开花枝组成。燕麦小花由雌性卵巢和雄性雄蕊组成,其数目是3的倍数,并且是自受精的,这导致燕麦的自然杂交率较低。与其它禾本科植物(如小麦和大麦)相似,燕麦从穗的顶端到基部开花,使得在不同发育阶段收集植物的雄蕊成为可能。在培育六倍体燕麦等细胞质雄性不育系和转基因燕麦品系方面进行了大量的研究A.莎蒂瓦[12].然而,到目前为止,由于缺乏适合杂交育种的雄性不育系统,还没有杂交燕麦商业化种植[27].
为了阐明雄性不育的分子机制,本研究采用由隐性核基因控制的燕麦雄性不育系CA (CAMS)作为时间过程转录组策略。本研究所用的CAMS燕麦系和近等基因系是经过多年的长期育种培养而成的。介绍了花粉败育的动态基因表达模式,并通过综合转录组分析进一步鉴定了花粉败育的高表达基因和特定的生物学过程。为确定CAMS细胞系不育性的可能因素,结合CAMS形态特征实验,通过网络和相关通路的分析,确定参与花粉败育和花药发育的候选基因。本研究为在CAMS燕麦系中有效筛选与雄性育性相关的核隐性基因候选提供了有力的旁证,并为杂交燕麦的大规模商业化育种和杂交种生产奠定了基础。
方法
植物材料
本研究利用燕麦不育材料和粗燕麦种质资源,建立了近等基因系。用JEOL JSM-35C扫描电子显微镜(SEM)在25 kV下拍摄了不育燕麦材料的植株、雄蕊和花粉。中国山西省农业科学院于1994年首次在田间鉴定出不育燕麦,并命名为CA雄性不育(CAMS)燕麦品系[12];根据燕麦不育特性和细胞学鉴定,将其鉴定为隐性核不育植物。种质黑啤是美国普渡大学开发的早熟、高产、低蛋白质率、短秆品种[48,56].用Olympus数字显微镜对CAMS株系的花药、小孢子母细胞和小孢子进行了成像。这两种材料都高度适应中国北方的环境。
RNA分离
根据制造商的方案,使用TRIzol试剂(Invitrogen)分离总RNA,随后用oligotex (Qiagen)纯化mRNA。用DNase处理总RNA样品,以降解可能的基因组DNA污染。A260/A280和A260/A230(1.8-2.0)的比值用于确定RNA纯度,该纯度通过在Agilent 2100生物分析仪上使用RNA 6000 Pico LabChip Kit进行1.2%琼脂糖凝胶电泳评估。同时,计算28s - 18s rRNA比值(> 2)和RNA完整性数(RIN) (RIN > 7),使用Agilent 2100 Bioanalyzer评估RNA完整性。
cDNA文库制备和转录组测序
用偶联寡聚物(dT)的磁珠富集RNA样本中的mRNA,然后在5×片段缓冲液(Illumina, USA)中94°C降解为短片段。采用随机六聚体引物合成第一链cDNA,再与DNA连接酶、DNA聚合酶I、RNAse H、dNTPs反应体系合成第二链cDNA。采用磁珠提取双链cDNA,修复并在3’端添加核苷酸A(腺嘌呤)。最后,用测序适配器连接片段,进行PCR扩增富集。分别使用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System对文库的质量和定量进行评价。所有文库在BGISEQ-500测序平台上进行测序。
RNA-seq数据处理
为了获得干净的reads,对原始测序reads进行过滤,通过适配器去除质量较低的reads,即质量低于10的碱基超过20%的reads,以及未知碱基超过5%的reads。使用Trinity(2.8.4版)组装干净读取[23],然后用tiger Gene Indices聚类工具(TGICL)将RNA转录本聚类生成unigenes [43]. 为单基因执行功能注释,Blastn(版本2.2.23)和Blastx(版本2.2.23)[1]将ungenes与Nucleotide (NT)、nonredundant Nucleotide (NR)、EuKaryotic Orthologous Groups (KOG)、Kyoto Encyclopedia of Genes and Genomes (KEGG)和SwissProt数据库进行比对。接下来,Blast2GO(版本2.5.0)[11]采用NR标注进行基因本体(GO)标注,InterProScan (version 5.11-51.0) [45]受雇于Interpro注释。Transdecoder(版本3.0.1)(https://transdecoder.github.io)来识别每个单基因的候选编码区。提取最长的开放阅读框(open reading frame),然后用blast法在SwissProt和Hmmscan上搜索Pfam蛋白同源序列,预测编码区。为了识别转录因子(transcription factors, TFs),使用getorf [47]并与PLNTFDB的TF域对齐[46](http://plntfdb.bio.uni-potsdam.de.)使用hmmsearch [40].
使用Bowtie2(版本2.2.5)将Clean reads定位到unigenes [31],然后使用RSEM (version 1.2.12)计算每个unigene的每千碱基对测序的转录本片段数(FPKM)值[33].CMS系722HA与保持系722HB在不同时期的表达差异用NOIseq [58].差异表达基因(DEGs)由概率≥0.8和| log2 fold change |≥1的基因定义,并使用pheatmap R包(version 1.0.12)进行分级聚类评价[30.].主要成分分析(PCA)使用PCATOOLS R包进行,并通过MEV(版本4.9)进行共表达分析(http://mev.tm4.org),采用k-means方法。使用Stats R包(3.7.0版)对基因本体和通路功能富集进行超几何检验[59].使用Phyper进行GO功能性富集分析和KEGG途径官能富集分析。每个的假发现率(FDR)P计算值,具有FDR≤0.01的术语被定义为显着富集。转录因子的靶基因由Minet,Pearson R包确认,相关性(CLR)方法具有值≥2的相关性似然性。
实时定量PCR用于RNA-seq验证
从DEG列表中随机选取11条序列,使用Primer Premier 5.0软件(美国Premier Biosoft International, CA, USA)设计qRT-PCR引物(补充表1)具有以下参数:Tm 55 °C,引物长度范围为16-22核苷酸。反应体系(总体积为50 μL)的Bio-Rad C1000热循环器含有cDNA 4.0 微升,20 mmol·L-1 PCR正向引物和反向引物,SYBR®Premix Ex Taq II(Tli RNaseH Plus)荧光色素25.0 μL和ddH216.0 OμL。在95°C for 30 s, 95°C for 5 s, 55°C for 30 s, 72°C for 1:00的条件下进行PCR扩增,并在此过程中收集荧光数据。本研究选用常用于植物基因表达实验的内参基因β-肌动蛋白(β-actin)作为内参。PCR产物经1.2%琼脂糖凝胶电泳鉴定。
结果
CAMS系的形态特征
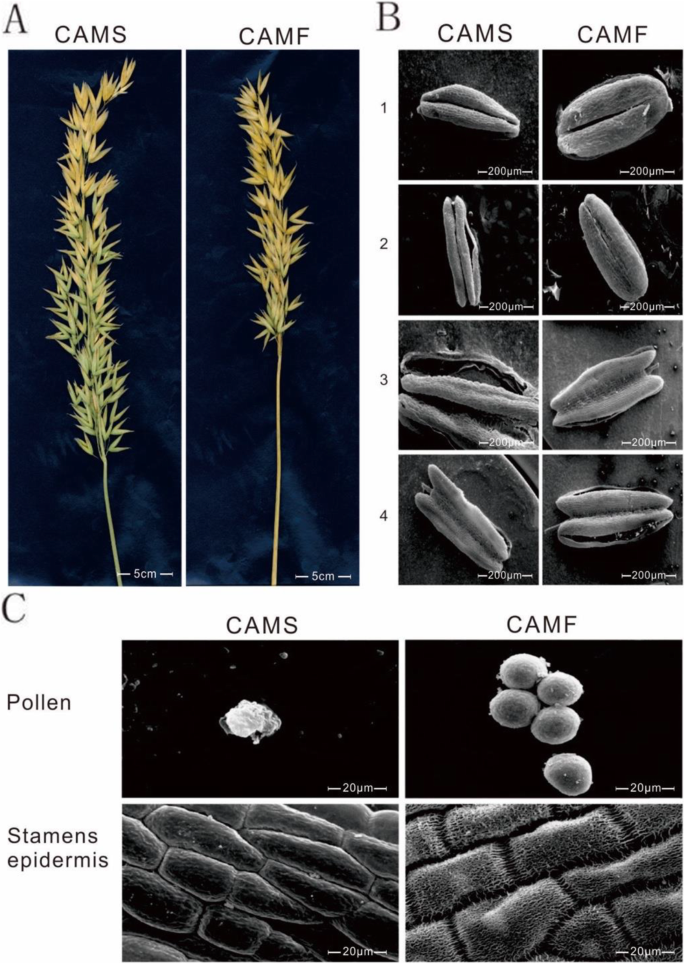
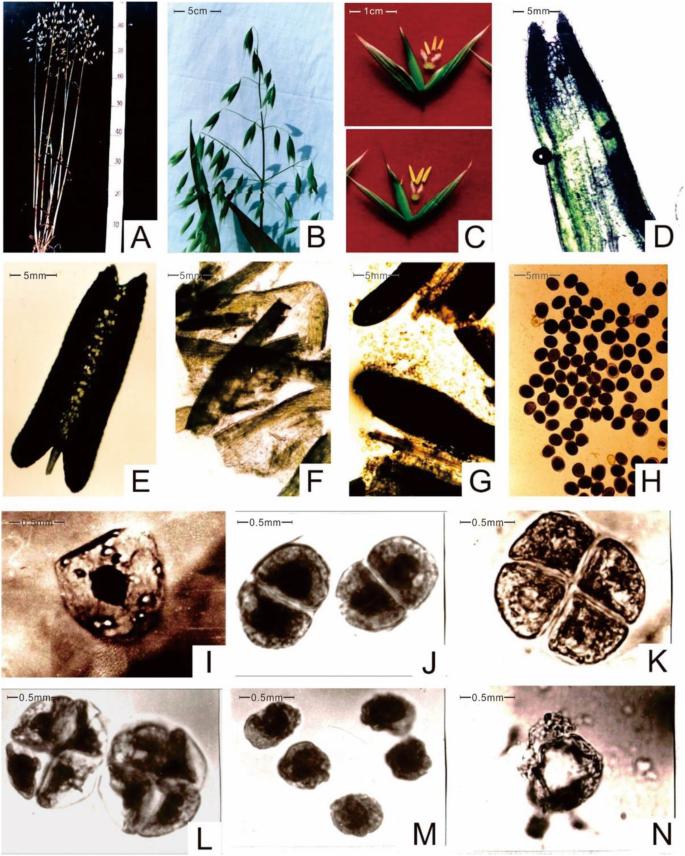
本研究使用的CAMS材料由崔林于1994年在高寒作物研究所燕麦试验田首次报道,该试验田所利用的肥沃材料命名为CAMF [12(图。1). 燕麦生根并直接向上生长到80-90 高度超过约85厘米 天(图。2一种),展示深绿色的叶子和紧凑的主茎,它在茎的碱基产生了许多分蘖(图。2B.).分蘖/植物的数量通常大约是三至五,并且短茎终止于调节穗,其在大约18厘米的穗状花序中布置。在穗内,每穗的平均穗状穗数为28,并且每个小尖头有三朵花(图。2C).第2朵花外长约2厘米的特殊短芒,成熟后颖片呈黄色。CAMS系与CAMF系在同一群体中的所有性状相同。
与CAMF线相反,CAMS线的颖片在前3–5处打开 花期短,花药浅绿色的CAMS系比CAMF系小。花丝的凸轮雄蕊拉长在7-10 花药在开花的第二天,花药不开裂,收缩成灰色的箭头状(图。2C),并且雌蕊正常,并与CAMF线保持一致。与填充正常花粉颗粒的无透明植物的不透明花香相比,当在显微镜下观察时,凸轮的透明花盆未填充花粉颗粒,表明凸轮线属于非沼泽型(图。1c,如图。2D-H.).
CAMS系花药中未检测到花粉
为了解CAMS系和CAMF系在小孢子母细胞减数分裂过程上的差异,在上午7 ~ 8时采集了两系的花粉粒。涂片结果表明,CAMS和CAMF细胞系经有丝分裂可形成正常小孢子母细胞,减数分裂可形成四分体。与CAMF系相比,CAMS系在四孢子早期处于正常状态。2i (k),而CAMS细胞系的小孢子母细胞在后期出现了明显的细胞质退化(图。2L.).CAMS系四孢子释放的小孢子在其外壁上没有继续发育,其外壁较正常厚,且大多变形,有几轮(图1)。2mn).CAMS细胞壁在花粉发育后期分解,呈现空性和非花粉特征。
隐性核基因遗传的雄性不育
为了研究CAMS系的基因型,在CAMS系和CAMF系之间进行杂交,结果表明所有的F1株都是可育的(表1).温室和大田F2群体中均出现不育株,说明温度、光照等环境因素对育性没有影响。但用于授粉的原始群体的CAMF系未发现育性分离,说明用于授粉的CAMF系是纯合的。结果表明,CAMS不育性状是稳定遗传的,不属于热敏或光敏不育。
此外,该CAMS系还与8个玉米品种进行了杂交A. Chinensis.和A.莎蒂瓦.在F1群体中,六种组合的生育能力完全恢复正常的种子设定率(表2), 2个组合显示约20%的不育系。其次,选择BC1和BC2两个杂交组合继续与亲本回交时,不育株的比例增加(表2)3.).而BC1和BC2的不育株率A. Chinensis.8006为亲本时,高于A.莎蒂瓦9203.CAMS系与其他品种杂交后,繁殖能力恢复,F1代出现不育株,说明燕麦CA不育性状的遗传不仅与核不育基因有关,还受到核恢复系基因的影响。从育性恢复组合中选择所有F1植株进行自交,产生F2植株。CAMF和CAMS植株F2代的分离比为3:14),表明雄性不育是由一对隐性核基因控制的。以F1株与CAMS株系进行杂交,获得BC1群体。BC1代的分离比为1:1,符合核基因控制性状的原则(表1)5).
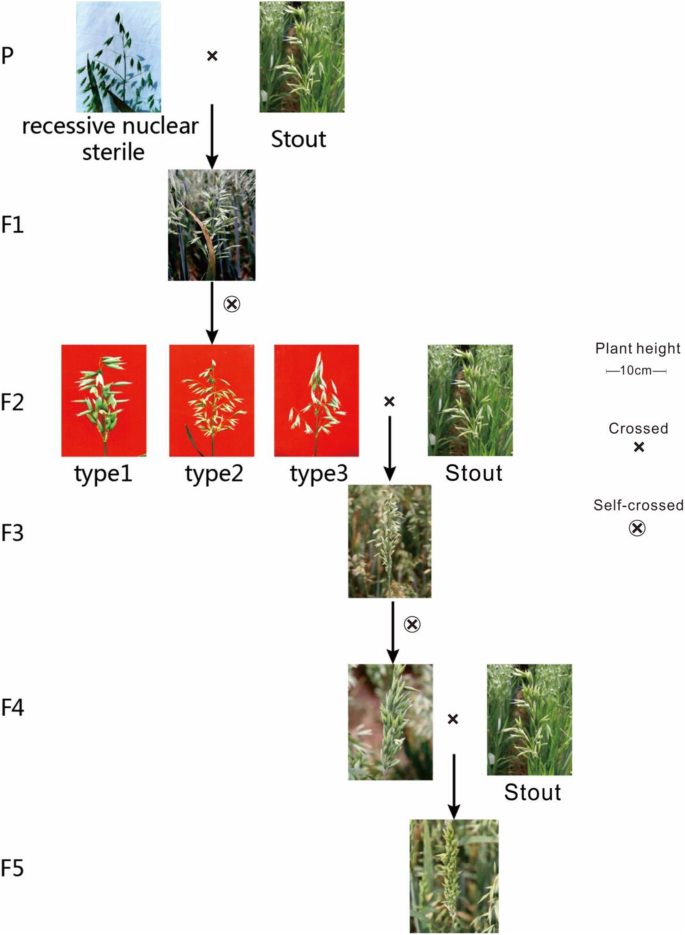
近等基因系的培养
为了向下转化不育植株的原始小穗,通过迭代重组自交系(A.莎蒂瓦L., 6n = 42, ACD)。将不育燕麦植株与燕麦种质Stout杂交,获得F1和F2(图1)。3.).在此步骤之后,不育F2材料与Stout回交,产生可育的BC1。然后自交bc1生成BC1F2。将不育株BC1F2与Stout回交获得BC2F1。使用类似于上面描述的协议,我们获得了BC2F1、BC3F1、BC4F1和BC5F1。最后,我们用连续自交的方法收获BC5F8细胞。
我们在20°C,65±20%相对湿度下进行BC5F8的盆栽种植,每天12小时照明和4000 Lx光强度。当穗状状长度为0-5厘米时,我们选择了五个尖峰。我们按照尺寸和颜色采样不同发展阶段的花草。将组织样品立即冷冻在液氮中并储存在-80℃。
花药样本收集和测序
为了鉴定在CAMS花粉败育过程中起关键作用的基因,我们对CAMS和CAMF花药进行了时间过程RNA测序。根据燕麦雄蕊花粉发生过程中出现的形态、解剖、生理和细胞学特征的时间采集样品(表1)6).CAMF和CAMS的花药在小花长0 ~ 5 cm时进行选择。CAMF和CAMS的雄蕊发育阶段分别为F1、F2、F3、F4和S1、S2、S3、S4。小穗取样时间为上午9时。有四个阶段用于我们的实验,特别是白色雄蕊(阶段1,凸轮和CAMF),绿色雄蕊(阶段2,凸轮和CAMF),绿色变成黄色的雄蕊(阶段3,凸轮和CAMF),淡黄色雄蕊(第四阶段,只有摄像头线),和暗黄色的雄蕊(阶段4,只为CAMF)(表6).立即将样品放入液氮中冷冻,在−80°C下保存30分钟。提取CAMS和CAMF总RNA,构建两个对端cDNA文库进行RNA测序(RNA-seq)。同时,提取每个样本的总RNA (CAMS和CAMF的第1 ~ 4阶段),生成cDNA文库,用于信号端RNA测序。共构建了24个cDNA文库。在BGISEQ-500平台上对CAMS和CAMF系的Sativa花药样品进行了测序。
转录组组装与注释
为CAMF和CAMS样品分别获得了总共943.06 m和932.54米的原始测序读数。过滤后,846.05米的高质量读数,96.85%Q20百分比,839.35个高质量读数,分别为CAMF和CAMS样品获得了97.16%Q20百分比。将DE Novo组装到295,462个未完成1511.8 BP的未来,其中230,590个unigenes(78.04%)长于500bp,173,160个未来(58.61%)长于1000 bp。
所有unigenes分别与NR、NT、GO、Swiss-Prot、Kyoto Encyclopedia of Genes and Genomes (KEGG)和Clusters of Orthologous Groups of proteins (COG)数据库进行比对,分别有191,958(64.97%)、162,676(55.06%)、139,482(47.21%)、134,608(45.56%)、146,769(49.67%)、分别有137,657(46.59%)个unigenes被注释。共有210,003个unigenes(71.08%)被注释在这6个数据库中的一个或多个数据库中。进一步分析转录因子和TF家族,发现MYB(612个基因;12.13%)是最大的TF家族,其次是bHLH(354个基因;AP2-EREBP基因328个,6.5%;NAC基因319个;6.32%) (补充表2).
为了鉴定可能导致花药雄性不育的候选雄性不育基因,我们还评估了与植物microRNA数据库(PMRD)(CUI,2012)的转录物。VLAST鉴定了四种转录物,并且与五个基因(六分析物)高度相似拟南芥.同时,82种转录物被鉴定为具有77个转录物的同源序列栽培稻.
FKPM计算与边缘检测
根据组装的转录组计算所有样本的FPKM值,其中至少有一个样本中FPKM值大于零的基因共有281,944个。不同样本在同一阶段的相关系数均≥0.9;因此,以同一时期的平均表达量作为该时期的代表性表达量,在至少一个样本中有26,866个基因的表达量≥10。根据发展的时间过程,对同一样品的相邻两个阶段之间和同一阶段的两个阶段之间进行DEGs识别,以fold change≥2.00,probability≥0.8 (表格7和如图。4). 其中,48213和26866个基因在至少一个样本中的表达水平分别大于5和10,且表达的DEGs数量也有所增加≥至少有一个阶段的10人占总数的90%以上。为了减少低表达基因的影响,DEGs与表达相关≥至少有一组中有10人被选作进一步分析。
凸轮线的无菌发生在雄蕊开发的早期阶段
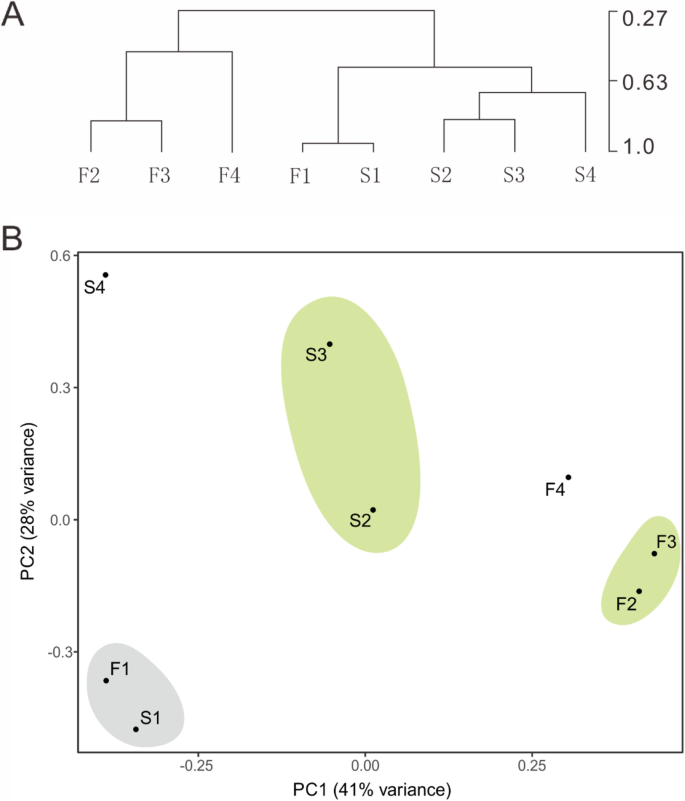
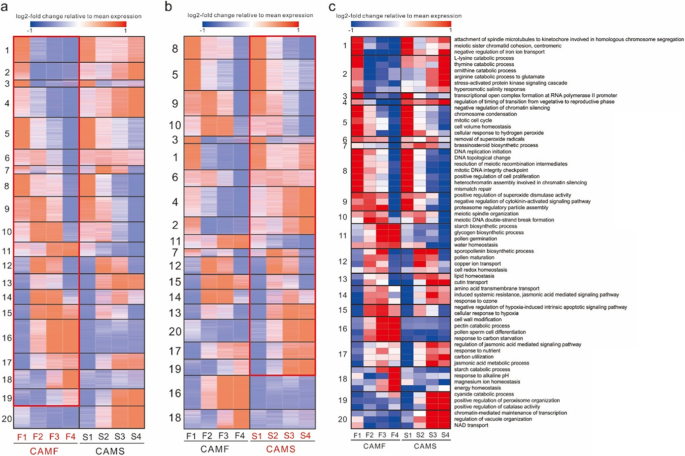
涂抹表明,凸轮线的四边形是正常的,并且在雄蕊发育的早期阶段与CAMF线保持,而在晚期的阶段观察到凸轮线微孔母细胞的显着细胞质降解。为了进一步检测,我们对28,942个基因进行了分层聚类和主成分分析(PCA)分析,表明第一阶段中的凸轮和CAMF的表达式模式非常相似,并且它们在第二个开始之间存在明显的差异阶段。CAMS和CAMF在第二和第三阶段中显示出完全不同的开发模式,并在第四阶段表现出明显的差异(图。4),证实凸轮线的无菌发生在雄蕊开发的早期阶段。
CAMS系的不育性与减数分裂和超氧化物有关
用log2 (FPKM+ 0.01)对28942个基因进行表达转化,并采用z分数法进行标准化,以进一步确定影响CAMS细胞系不育性的因素。对这些基因进行K-means聚类,将其聚为20个共表达模块,其中基因表达量由所有所含基因的平均z-score值决定,聚类后对每个模块进行GO富集。通过对28,942个基因的GO注释结果和z-score归一化FPKM对富集的GOs进行量化,通过包含基因的平均z-score计算GO表达量。最后,对每个模块和每个GO进行加权基因共表达网络分析(WGCNA)的相关分析,以0.9的相关系数过滤后,维持了354个GO BP项(图1)。5和补充表3.).
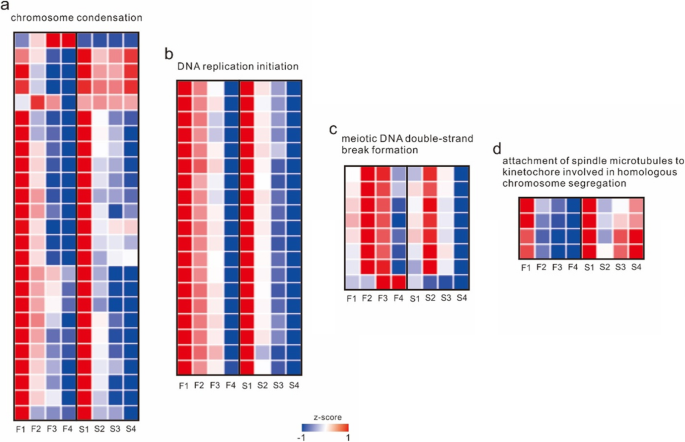
同时,利用上下文似然亲缘关系(context likelihood of relness, CLR)算法估计转录因子可能的靶基因。有11个模块在早期得到了高表达,其中4个模块与减速和分裂有关,分别是模块1、5、8和10。模块1在纺锤体微管附着于参与同源染色体分离和减数分裂姐妹染色单体聚合和着丝粒的着丝粒上显著富集。模块5被显著富集用于染色体浓缩,模块8被富集用于DNA复制起始和减数分裂重组中间体的分解。模块10显著富集减数分裂纺锤体组织和减数分裂DNA双链断裂形成(图。5和补充表3.).组合模块的功能和基因的FPKM,CAM的FPKM类似于第一个发育阶段的CAMF,而在第二阶段显着不同。在累积四个阶段的FPKM之后,与染色体缩合有关的基因的整体FPKM与凸轮线同源染色体隔离中所涉及的轴颈微管的基因均高于CAMF线的基因,而基因的表达水平凸轮线中的DNA复制和减数分裂DNA双链断裂形成有关。此外,与染色体缩合和主轴微管与涉及同源染色体隔离中的基因编组相关的基因在凸轮线中的所有发育阶段中高度表达,而它们仅在CAMF线中的第一和第二阶段中高度表达。凸轮线中的DNA复制和减数分裂DNA双链断裂形成相关的基因的表达显着低于第二和第三阶段的CAMF线中的(图。6补充表格4),与这些基因最相关的转录因子为MADS和alfinlike (补充表5).According to these modules, the direct reason for the sterility of CAMS was abnormal meiosis after the second stage, and module 5 also included genes related to the cell’s response to hydrogen peroxide, which were expressed at higher levels in the CAMS line, indicating that the cells of the CAMS line may contain more hydrogen peroxide.
与孢粉素生物合成相关的基因(模块12)在CAMS系和CAMF系中表达无显著差异,但淀粉合成和糖原合成相关的基因(模块11和模块16)在CAMF系各阶段均保持高表达。为减数分裂和花粉发育提供能量的基因,仅在CAMS株系早期高表达。在发育中后期,CAMF系(模块14)的抗性和胁迫响应相关基因的表达量高于CAMS系。抗性主要是诱导系统抗性,胁迫反应主要通过茉莉酸介导的信号通路进行。此外,CAMS系对缺氧的敏感性高于CAMF系。缺氧诱导的内在凋亡信号通路负调控及细胞对缺氧反应相关基因(模块15)在CAMF系中晚期高表达,而在CAMS系中仅在中期有可检测到的表达水平。摄像头线的减数分裂异常在第二阶段,诱导凸轮行进展在中后期阶段,如监管过渡时间的营养阶段的生殖阶段和brassinosteroid合成相关基因高表达在中间和晚期(无花果。5和补充表3.).
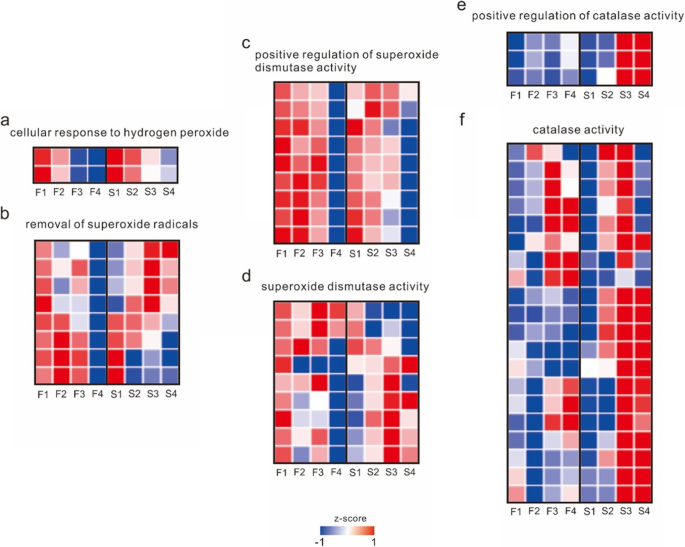
有五个与超氧化物相关的模块,包括模块5,在过氧化氢的细胞反应中显著富集;模块9,富集超氧化物歧化酶活性的正向调控;模块6,富集超氧自由基的清除;模块15,富集对缺氧诱导的内在凋亡信号通路的负调控;和模块19显著富集至过氧化氢酶活性的正调控(图。5和补充表3.).结合与这些功能相对应的所有基因的表达,这些基因的表达模式与减数分裂相关基因的表达模式不同,且CAMS系和CAMF系在第一阶段的表达差异最大。CAMS系中正调控超氧化物歧化酶活性、超氧化物歧化酶活性、过氧化氢酶活性及超氧化物自由基清除相关基因的表达量第一阶段高于CAMF系,超氧化物歧化酶活性及超氧化物自由基清除相关基因在前三个阶段表达量较高。总体上,CAMS细胞系后2期的基因表达量高于前2期。与细胞对过氧化氢反应相关的基因在CAMS系的前两个阶段高表达,而在CAMF系的所有阶段都高表达。CAMS系中与过氧化氢酶活性正调控相关的基因在后两个阶段均高表达,且显著高于CAMF系(图1)。7补充表格4).这些转录因子中最相关的是Tify和MADS (补充表5).综上所述,CAMS系的超氧清除能力在前期低于CAMF系,而在后期则有所不同。活性氧清除能力的缺乏导致了细胞中超氧化物的积累,影响了减数分裂,而CAMS系加速了超氧化物的清除能力,说明雄蕊在减数分裂后期可以继续发育。
QPCR确认
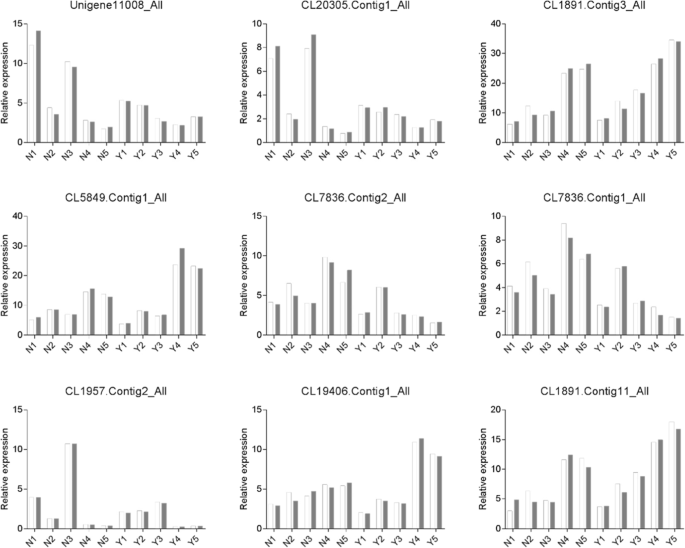
为了确认转录组测序分析结果,本研究采用qRT-PCR进行确认。为了得到准确可靠的结果,我们随机选择了9个基因。8),使用QRT-PCR标准化方法验证九种候选基因的表达模式。QRT-PCR结果中大多数候选基因的表达模式与RNA测序分析结果中的那些一致,证明了我们测序分析的可靠性。
讨论
一种复杂的机制治理了初始形态发生的男性生育能力通过花药裂开释放花粉的释放。花粉发育是一种复杂的过程,涉及开发,分化,减数分裂,细胞周期和花药的形态发生,涉及几种组织和细胞类型。Meiosis是孢子形成和花粉发育的第一阶段[21].减数分裂诱导雄性不育相关基因产物功能障碍[3.,34,42].
植物花粉墙在花粉的发展中起着至关重要的作用,而成熟的花粉从花药裂开释放。花粉细胞壁中的功能障碍可以诱导雄性不育[50,53].使用苯丙烷化生物合成途径的雄皂组沉积木质素的内皮细胞[14,22],这有助于壁增厚和花药开裂[51].Sporopollenin,Cutin,Suberin和木质素是花粉墙的主要结构部件[51]分泌绒毡层将胡萝卜素、黄酮醇和脂质沉积在花粉壁的外壁表面[49].
经过减少症后,微微孢子包围在胼e1,3-葡聚糖和花粉母细胞(PMC)壁上封闭在胼unes壁上,用纤维素,半纤维素和酯化果胶[50].花粉壁由几层化学成分不同的物质组成[37],在被子植物的生殖发育中很重要[24],大多数不育突变体是由花粉壁缺陷引起的[53].因此,这些细胞壁的形成和降解对花粉发育很重要[50].在我们的研究中,许多与细胞壁和细胞外区域相关的deg在氧化石墨烯中富集。
以前的研究表明,果酸酯酶可以将原子蛋白的去酯化转化为可溶性果胶和甲醇[36],这种酶对细胞壁的修饰和花粉管的生长也是必不可少的[5,6,18,26]. 在这项研究中,DEGs还富含果胶酯酶活性相关的GO术语。胼胝质是一种由1,3β-葡聚糖组成的细胞壁多糖,在细胞壁的形成中起着重要作用[16,44,60],而小孢子发生过程中胼胝质的代谢异常导致小孢子变性和雄性不育[17,32].在我们的研究中,DEGs在氧化石墨烯的多糖分解代谢过程和葡聚糖分解代谢过程中富集,表明雄蕊细胞壁功能障碍可能是燕麦雄性不育的重要原因。
肌球蛋白和肌动蛋白促进花粉管的生长,花粉管与质膜和细胞投射密切相关[8,19,61,62].同时,许多DEGs被确定为膜样结构和肌凝蛋白富集;因此,CAMS系花药发育中存在与膜和肌球蛋白相关的基因缺陷。
碳水化合物在花药和花粉发育中起着重要作用[20.]碳水化合物代谢或同化物供应的改变与花粉败育有关[15].与CAMF系相比,印度芥菜雄性不育系花药中的糖含量显著降低[4].改变碳水化合物水平和酶活性可以降低花药中糖和淀粉的积累,这是雄性不育系的特点[4,52].因此,在CAMS花药发育过程中,运输和碳水化合物代谢的类别占大多数,说明CAMS花药发育过程中细胞物质运输和碳水化合物代谢可能受到抑制。
花药和雄配子体的发育受复杂的基因表达模式的调控[38,51].作为花药壁的内层,Tapetum显示出高代谢活性,这可以满足花粉发育的必要营养素[51,57,它也与男性不育有关[67]. 本研究鉴定了与蛋白质、淀粉和蔗糖代谢、渗透调节、糖转运、脂质转运、类黄酮合成和细胞骨架结构有关的基因[51].
此外,我们还通过评估植物MicroRNA数据库(PMRD)数据库的转录物来探索候选性的候选基因[13].VLAST鉴定了四种转录物,并且与五个基因(六分析物)高度相似拟南芥.在这些基因中,CDC48,即细胞分裂周期48,编码一个细胞分裂控制(CDC)蛋白,据报道在花粉萌发和花粉管生长中具有功能[39].同时,测定82种转录物与77个转录物的同源栽培稻,其中PTC1、OsGSL5和Ugp2与植物雄性不育有关。PTC1,即持久绒毡层细胞1,是水稻绒毡层细胞死亡和花粉发育所必需的[1].OsGSL5编码胼胝质合酶1催化亚基,可能在小孢子发生过程中胼胝质合成中起重要作用[66].udp -葡萄糖焦磷酸化酶2 (OsUgp2)是水稻花粉偏好基因,在花粉成熟过程中淀粉积累中起关键作用[41].
结论
交叉回交试验证明,CAMS株系的性状受隐性核基因控制。PCA和HCL的结果分析表明,凸轮和CAMF线的表达模式非常类似于雄蕊发展的早期阶段和第二阶段开始时不同,表明不育的摄像头线发生在雄蕊发展的早期阶段,这也符合涂抹的结果。在K-means聚类中,与减数分裂和超氧化物相关的功能被多个模块显著富集,减数分裂相关基因的表达水平在第1阶段没有显著差异,而在第2阶段后有显著差异。同时,氢氧化反应相关基因的表达模式与减数分裂相关基因的表达模式相同,说明CAMS系的不育性主要是由减数分裂异常引起的,与超氧化物有关。我们进一步发现CAMS系早期超氧清除能力相关基因的表达量低于CAMF系,而CAMS系晚期超氧清除能力相关基因的表达量较高,表明CAMF系早期超氧清除能力高于CAMS系,CAMS系后期超氧清除能力高于CAMS系。CAMS系由于超氧化物清除能力不足,导致超氧化物在细胞中积累,影响细胞减数分裂。但在后期,CAMS细胞系的超氧化物清除能力加快,雄蕊得以发育。
数据和材料的可用性
本文中提到的所有数据和资料都是可用的。测序reads已提交给NCBI Sequence Read Archive (SRA),条目为SRR11431571-SRR11431594。
缩写
- 女士:
-
雄性不育
- CMS:
-
细胞质雄性不育
- 总经理:
-
基因的雄性不育
- GCMS:
-
Genic-cytoplasmic雄性不育
- 摄像头:
-
CA雄性不育
- CAMF:
-
CA男性肥沃的
参考文献
- 1.
altschul sf,gish w,miller w,myers ew,lipman dj。基本的局部比对搜索工具。J Mol Biol。1990年; 215(3):403-10。
- 2.
糖尿病患者的高碳水化合物,高纤维饮食。美国临床营养学杂志1979;32(11):2312-21。
- 3.
拟南芥减数分裂前期I的同源互作需要SOLO dancer基因编码一种新的周期素样蛋白。EMBO j . 2002; 21(12): 3081 - 95。
- 4.
Banga S,Labana K,Banga Sk。印度芥末(Brassica Juncea(L.)Coss的雄性不育。) - 生化特征。Al Appl Genet。1984; 67(6):515-9。
- 5.
博世米,张艾,高手PK。果胶甲基酯酶,花粉管生长调节剂。植物理性。2005; 138(3):1334-46。
- 6.
果胶甲基酯酶与花粉管中的果胶动力学。植物细胞。2005;17(12):3219 - 26所示。
- 7.
Braaten J,Wood P,Scott F,WolleNetz M,Lowe M,Bradley-White P,Collins M. Oat Beta-Glucan降低了高胆固醇受试者的血液胆固醇浓度。EUR J Clin Nutr。1994年; 48(7):465-74。
- 8.
Cárdenas L, Lovy-Wheeler A, Wilsen KL, Hepler PK.肌动蛋白聚合促进花粉管顶端流动的逆转。Cell Motil Cytoskeleton. 2005;61(2): 112-27。
- 9.
昌Z,陈泽,王,谢g,鲁俊,燕w,周j,唐x,邓xw。用核雄性不育基因构建杂交水稻育种和种子生产的雄性不育系统。PROC NATL ACAD SCI。2016; 113(49):14145-50。
- 10.
陈玲,刘永刚。作物雄性不育与育性恢复。植物生物学杂志。2014;65:569 - 606。
- 11.
Conesa A,Götzs,García-gómezJM,Terol J,TalónM,Robles MJB。BLAST2GO:功能基因组学研究中的注释,可视化和分析的普遍工具。2005; 21(18):3674-6。
- 12.
关键词:燕麦,雄性不育,发现,遗传鉴定《左武学报》。1999;25(3):296-300。
- 13.
[10] Cui X, Wang Q, Yin W, Xu H, Wilson ZA, Wei C, Pan S, Zhang D. PMRD:一个与植物雄性生殖相关的基因和突变体数据库。中国生物医学工程学报,2012;
- 14.
关键词:苯丙素途径,植物防御,基因组学Mol Plant Pathol. 2002;3(5): 371-90。
- 15.
Dorion S,Lalonde S,Saini HS。通过减少阶段水缺陷的小麦中雄性不育的诱导术后逆转酶活性和花药中碳水化合物代谢的变化。植物理性。1996年; 111(1):137-45。
- 16.
胼胝质与雌蕊活力和不亲和性的测定。理论应用,1983;67:1-10。
- 17.
关键词:矮牵牛,愈伤组织,雄性不育,愈伤组织酶,时间生物化学麝猫。1969;3(5):451 - 5。
- 18.
Franklin-Tong VE。花粉管生长的信号转导和调控。植物细胞。1999;11(4):727 - 38。
- 19.
Gibbon BC, Kovar DR, Staiger CJ。Latrunculin B对花粉萌发和试管生长有不同的影响。植物细胞。1999;11(12):2349 - 63。
- 20。
陈建平,陈建平,陈建平。碳水化合物代谢工程诱导植物雄性不育的研究进展[j] .应用生态学报,2018,29(9):1532 - 1536。中国国家科学研究院学报,2001;
- 21。
Goldberg RB, Beals TP, Sanders PM。花药开发:基本原理和实际应用。植物细胞。1993;5(10):1217。
- 22.
Grace SC, Logan BA。植物苯丙素途径的能量耗散和自由基清除。英国皇家银行伦敦分行2000;
- 23.
哈斯·布里等。利用trinity平台进行rna-seq从头转录本序列的构建,进行参考生成和分析。Nat Protoc。2013;8:1494 - 512。
- 24.
被子植物小孢子发生的壁型形成。Soc实验生物学,1971。
- 25.
开花植物雄性不育。Bibliogr。麝猫。18:101 - 166 . .1968.牛膝雌雄异株:模型的计算机模拟。大自然。1959;217:764-5。
- 26.
关键词:果胶甲基酯酶,拟南芥,花粉管,花粉管abstract:植物细胞。2005;17(2):584 - 96。
- 27.
Kaul,M. L.(1988)。禾本科(草家)。男性无菌在高等植物中,弹簧:431 - 614。
- 28.
Kaul,M. L.(2012)。高等植物中的雄性不育,Springer科学与商业媒体。
- 29.
Kihara在城市h(1959)。“杂种代换回交的育性和形态变异。
- 30.
Kolde R. Pheatmap:漂亮的热图。普通小麦。Proc X Int conr Genet. 2015; 1:42 - 71。
- 31.
Langmead B, Salzberg SL.快速缺口读对齐领结2。Nat方法。2012;9:357。
- 32。
被子植物细胞质雄性不育小孢子发生的解剖和细胞学研究。机器人启38 1972;(3):425 - 54。
- 33。
李斌,杜威CN。Rsem:从rna-seq数据中准确的转录本定量,有或没有参考基因组。Bmc生物信息学》2011。
- 34.
李硕,杨东,朱勇。杂种水稻雄性不育特性及其在杂交育种中的应用。植物生物学杂志。2007;49(6):791-804。
- 35.
Longin CFH, Mühleisen J, Maurer HP, Zhang H, Gowda M, Reif JC。自花受精谷物的杂交育种。中国生物医学工程学报,2012;
- 36.
MARKOVIČ, O.和H. JÖRNVALL(1986)。“果胶酯酶”。生物化学158(3):455-462。
- 37.
Mascarenhas JP。被子植物花粉发育的生物化学。机器人启41 1975;(3):259 - 314。
- 38.
雄配子体发育的控制。《植物学报》2004;16(增刊1):
- 39.
Mérai Z, Chumak N, García-Aguilar M, Hsieh T-F, Nishimura T, Schoft VK, Bindics J, Ślusarz L, Arnoux S, Opravil S. The AAA-ATPase molecular chaperone Cdc48/p97 disassembles sumoylated centromeres, decondenses heterochromatin, and activates ribosomal RNA genes. Proc Natl Acad Sci. 2014;111(45):16166–71.
- 40。
关键词:同源搜索,HMMER3,线圈-线圈区域,收敛演化2013;41(12): e121-1。
- 41.
Mu H,Ke J,Liu W,Zhuang,Yip W.udp-glucose Byrophorylase2(Osugp2),水稻花粉优先基因,在花粉成熟期间在淀粉积累中起着关键作用。Chin Sci Bull。2009; 54(2):234。
- 42.
noonomura K-I, Nakano M, Fukuda T, Eiguchi M, Miyao A, Hirochika H, Kurata N. The novel gene同源配对畸变IN RICE减数分裂中同源染色体配对的螺旋卷曲蛋白。植物细胞。2004;16(4):1008 - 20。
- 43.
黄晓明,梁峰,黄晓明,等。tiger基因指数聚类工具(tgicl):一个用于大型Est数据集快速聚类的软件系统。生物信息学。2003;19:651-2。
- 44。
Piršelováb,Matušíkovái.Callose:植物细胞壁多糖,具有多种生物功能。acta physiol植物。2013; 35(3):635-44。
- 45。
等。Interproscan:蛋白质域标识符。核酸杂志2005;33:W116-20。
- 46.
Plntfdb:一个整合的植物转录因子数据库。Bmc Bioinform。2007;42。
- 47.
浮雕:欧洲分子生物学开放软件套件。趋势麝猫。2000;16:276-7。
- 48.
关键词:燕麦,杂种,蛋白质,遗传Euphytica。1984;33(3):907 - 13所示。
- 49.
中国科学院植物研究所,北京:中国科学院植物研究所。足底。1982;155(5):400 - 8。
- 50。
Rhee Sy,Somerville Cr。拟南芥的四重奏突变体中的Tetrad花粉形成与花粉母细胞壁的果糖多糖的持续存在。工厂J. 1998; 15(1):79-88。
- 51。
陈建平,李建平。雄蕊结构与功能。北京:科学出版社。《植物细胞》2004;16(增刊1):S46-60。
- 52。
Sheoran IS, Saini HS。干旱诱导水稻雄性不育:与抑制花粉中淀粉积累相关的碳水化合物水平和酶活性的变化。《植物性繁殖》1996;9(3):161-9。
- 53.
史志华,张超,徐晓峰,朱军,周强,马丽娟,牛杰,杨志宁。AtTTP过表达影响ARF17的表达,导致拟南芥雄性不育。《公共科学图书馆•综合》。2015;10 (3):e0117317。
- 54.
李世成,杨荣平,中国杂交稻育种。水稻育种的创新方法:1979年国际水稻研究会议的论文精选。洛斯巴诺斯:国际水稻研究所;1980.
- 55.
Spencer H, Norris C, Derler J, Osis D.燕麦麸松饼对男性钙吸收和钙、磷、镁、锌平衡的影响。J减轻。1991;121(12):1976 - 83。
- 56。
燕麦回交系的性能。35 Euphytica。1986;(3):785 - 92。
- 57。
Suwabe K,Suzuki G,Takahashi H,Shiono K,Endo M,Yano K,Fujita M,Masuko H,Saito H,Fujioka T.分离雄性配子体和Tapetum在水稻中的分离转录om:激光微粉(LM)微阵列的有效性。植物细胞生理。2008; 49(10):1407-16。
- 58.
taazona S ., Garcã A- alcalde F ., Dopazo J ., Ferrer A., Conesa A.基因组研究》2011;21:2213-23。
- 59.
团队RC。R:用于统计计算的语言和环境。2013.
- 60
植物胼胝质合酶复合物。中国生物防治学报,2001;
- 61
Vidali L, Hepler P. Actin和花粉管生长。原生质。2001;215(1 - 4):64 - 76。
- 62。
维达利L,麦肯纳街,赫普勒PK。肌动蛋白聚合是花粉管生长所必需的。分子生物学细胞。2001;12(8):2534–45.
- 63。
王振中,李军,陈树文,衡宇,陈振中,杨军,周凯,何慧,邓晓文(2017)。“禾草科特有的MS1编码一种磷脂结合蛋白,用于面包小麦中的雄性生育。”国家科学院学报:2017:15570。
- 64。
韦尔奇,麦克维,莫非,C.低胆固醇血症和其他反应的燕麦麸摄入人体。Proc Nutr Soc. 1990;49:50。
- 65.
关键词:小麦,杂交育种,杂交小麦,种子产量实验机器人。2013;64(18):5411-28。
- 66.
Yamaguchi T,Hayashi T,Nakayama k,Koike S.胼conclys合成酶的基因表达分析,rho型小GTP结合蛋白与水稻花药中的胼commenced合成有关。Biosci Biotechnol Biochem。2006; 70(3):639-45。
- 67.
杨C, Vizcay-Barrena G, Conner K, Wilson ZA。绒毡层发育和花粉壁生物合成需要雄性不育1。植物细胞。2007;19(11):3530 - 48。
致谢
不适用
同意出版
不适用。
资金
国家自然科学基金(31501372)、中国农业科学研究院(中国农业科学院CAS07-A-2)(YGJPY2004、YGC2019FZ2)提供项目科研经费和资金使用情况审查。
作者信息
隶属关系
贡献
LZ有了这个想法并设计了这个研究。CL监督了这项研究。MM和LL进行数据采集和分析。LZ写了报告草稿。所有作者对报告进行了修改,并在提交前通过了最终版本。作者阅读并批准了最终稿件。
通讯作者
道德声明
伦理批准并同意参与
不适用。
相互竞争的利益
作者声明不存在与本文相关的商业利益冲突。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充资料
附加文件1:
补充表1。qRT-PCR的引物序列及其产物大小。
补充文件2:补充表2。
单基因转录因子注释。
补充文件3:补充表3。
K-means聚类分析不同聚类的GO - BP富集。
补充文件4:补充表4。
减数分裂相关基因和超氧化物相关基因的表达水平。
附加文件5补充表5。
基于CLR方法的转录因子中的靶基因。
权利和权限
开放获取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
张璐,马敏,崔璐。等。一种雄性不育系花粉败育的动态基因表达模式燕麦属漂白亚麻纤维卷通过不同发育阶段的转录组分析。BMC植物杂志21,101(2021)。https://doi.org/10.1186/s12870-021-02881-2
已收到:
接受:
发表:
关键词
- 燕麦
- 转录组
- 雄性不育系
- 近等基因系