摘要
背景
脱落酸(ABA)在植物非生物胁迫响应中发挥着重要作用,而ABA钝感4 (ABI4)是ABA信号通路中的关键转录因子。在拟南芥,Abi4负面调节耐盐性;然而,ABI4调节植物盐耐受的机制很差。我们以前的研究表明,ABI4直接与启动子结合维生素C有缺陷2(VTC2)基因,抑制转录VTC2和抗坏血酸(AsA)的生物合成。
结果
在本研究中,我们发现外源AsA处理可以缓解盐胁迫的敏感性ABI4 -overexpressing转基因植物。AsA含量降低,活性氧(ROS)水平升高ABI4 -盐胁迫下过表达的幼苗表明asa促进ROS清除与abi4介导的耐盐性有关。基因表达分析表明Abi4.是在盐胁迫早期诱导的,引起了减少VTC2表达式。因此,在相同的盐胁迫条件下,VTC2蛋白的丰度降低,并且在不存在Abi4.功能缺失突变体,提示ABI4对VTC2导致VTC2功能衰减。此外,AsA生物合成和循环途径中的其他编码基因对盐胁迫的响应也不同,说明AsA在盐胁迫下的稳态是复杂的。
结论
该研究通过调节ASA生物合成和植物中的ROS积累来阐明ABI4在盐胁迫耐受性的阴性调节。
背景
抗坏血酸(AsA)在植物生长发育中起重要作用[1,2].它是一种高效的非酶抗氧化剂,清除活性氧(ROS),不仅调节生长发育,还调节应激反应[3.,4,5,6].植物的生物合成及其调节机制已经获得了越来越关注的[7,8,9,10].它在植物叶片中的生物合成受光和暗的调节[11,显示出昼夜节律,并对季节变化作出反应[12,13].AsA含量也受温度的影响[14].此外,参与ASA生物合成的基因的转录表达是通过植物激素或次生代谢物调节[15].L-半乳糖途径是ASA生物合成的显性途径拟南芥.同源基因维生素缺陷2(VTC2),VTC5在该途径中编码键GDP-L-半乳糖磷酸化酶,和VTC2起主导作用[16,17,18].茉莉酸(Jasmonic acid, JAs)通过诱导表达促进AsA的生物合成VTC2[15,19].除了AsA的从头合成,AsA的回收也影响AsA的水平[17,20.].
盐胁迫限制植物生长和发展,植物已经发展了各种适应机制来处理它。在盐度应力下的细胞中产生大量的RO,这使得ASA的抗氧化能力更重要[6,21,22,23].前期研究发现,H2O2在AsA缺陷突变体中vtc1在盐胁迫下显著增加[24].锌指蛋白SlZF3促进了AsA的积累,增强了植物的耐盐性[25].许多研究也报道了外源供应AsA可以提高玉米、水稻和小麦等多种植物对盐胁迫的抗性[26,27,28],说明AsA在植物耐盐性中起积极作用。
脱落酸(ABA)被称为植物应激激素[29,30.].高盐度和干旱显著增加ABA水平,进而诱导许多参与胁迫反应的基因的表达[31].Abscisic acid INSENSITIVE 4 (Abscisic acid INSENSITIVE 4, ABI4)是ABA信号通路下游的重要转录因子[32].突变Abi4.首次从种子萌发过程中对aba不敏感突变体的筛选中分离出来[33], ABI4在种子中的转录本表达量较高,但在苗期表达量较低[34].ABA-deficient突变体的aba1,aba2,和aba3在盐或干旱胁迫下显示易萎的表型,但是Abi4.突变体表现出耐盐胁迫。植物过表达Abi4.的盐敏感性增加,因为ABI4下调Na+转运体HKT1; 1表达,表明植物的耐盐性与其减少地上部分钠积累的能力有关[35,36].叶绿体发育基因AtDPG1通过ABI4参与盐应激反应[37].因此,ABI4参与盐胁迫响应;但ABI4调控耐盐性的机制尚需进一步研究。
我们之前证明了ABI4直接结合到的启动子VTC2,抑制转录表达VTC2,然后缓解AsA生物合成[10].ABI4直接结合参与ROS产生和清除的关键基因,调节盐胁迫下种子萌发过程中ROS的代谢[38].我们发现ASA部分地回收了盐应激敏感性ABI4 -过表达植株,AsA含量较低,ROS积累较多。盐胁迫最初抑制了VTC2通过推广Abi4.表达式。因此,ABI4-VTC2协同调控盐胁迫下AsA的生物合成。揭示了ABI4响应盐胁迫的分子机制是通过调控AsA的生物合成和ROS的积累拟南芥.
结果
抗坏血酸有助于ABI4调节的盐胁迫敏感性
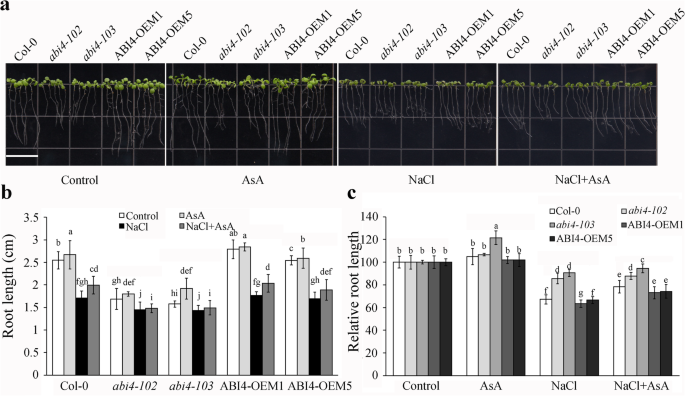
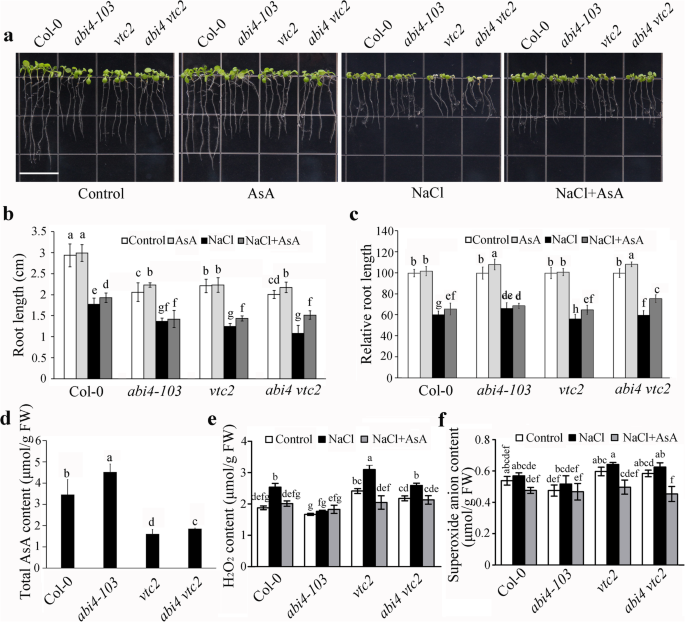
抗坏血酸对清除盐胁迫下积累的ROS具有重要作用,增强植物的耐受性[6].它被证明了Abi4.突变体表现出更高的耐盐性[35].我们之前证明了ABI4抑制AsA生物合成[10],因此我们通过提供外源AsA进一步分析AsA在abi4介导的盐胁迫响应中的作用。col0 3日龄幼苗,2个隐性敲除等位基因Abi4.(abi4 - 102和abi4 - 103)和两个Abi4.- c端截短肽线过表达谱(OEM1和OEM5) [39]转移到含40 μmol AsA或含或不含AsA的100 mM NaCl的1/ 2ms培养基上。再培养4天后观察幼苗的根长。在abi4-103中,不同基因型的根长仅在AsA处理下略有增加,而在盐胁迫下则有不同程度的根长减少(图4 - 103)。1一个)。statistical analysis indicated that, compared to Col-0 under normal growth conditions, the root lengths of theAbi4.突变体较短。根长度abi4 - 103和abi4 - 102与COL-0相比,盐胁迫下抑制较小,而ABI4-OEM1和ABI4-OEM5显示与COL-0幼苗相同的趋势。另外,用盐胁迫下的ASA补充部分回收COL-0和ABI4-OEM中的根部长度,但在不存在这种效果Abi4.突变体,可能是由于低浓度的外源AsA(图。1b和c)。这些结果表明AsA可以部分恢复abi4介导的盐抑制对根生长的影响。
抗坏血酸(AsA)缓解盐胁迫对abi4过表达幼苗根系生长的抑制作用。一个幼苗生长表型的COL-0,abi4 - 102,abi4 - 103和Abi4.在100 mM NaCl处理下,添加或不添加40 μM AsA的过表达细胞株。3日龄的幼苗转移到含或不含AsA的1/ 2ms培养基中,再生长4天。条= 1.4厘米。bCol-0的根长,abi4 - 102,abi4 - 103和Abi4.在100 mM NaCl处理下,添加或不添加40 μM AsA的过表达细胞株。值为平均值±标准差(n = 30).cCol-0的相对根长度,abi4 - 102,abi4 - 103和Abi4.- 与在控制条件下的那些相比,无论有或没有40μmAcAc的100mM NaCl处理下的大规模抑制线。值是±SDn = 3. The root length of all seedlings under control conditions were normalized as 100. Different letters indicate statistically significant differences among the indicated data (P< 0.05, Tukey’s检验方差分析)
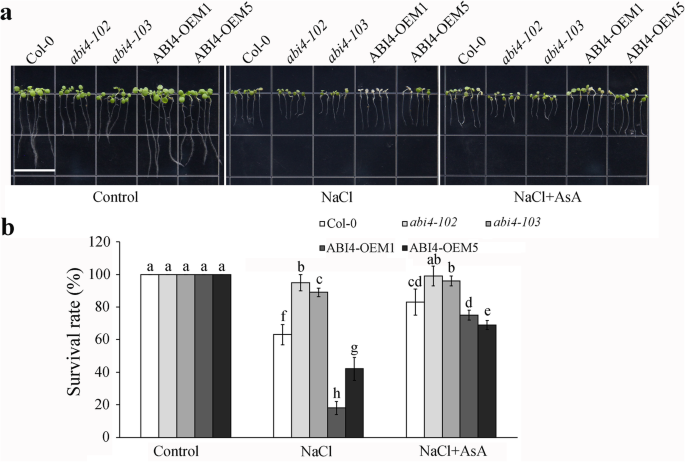
高盐度应力导致叶片漂白,甚至死于拟南芥[21我们观察了在150 mM NaCl下添加或不添加AsA的幼苗存活率。白化病的发生在Abi4.降低突变幼苗,而在150mM NaCl处理下,在OEM转基因中较高(图。2a).添加AsA显著提高了各基因型对盐胁迫的耐受性。在NaCl处理下,OEM1和OEM5的存活率分别约为18和42%,而在外源AsA处理下,OEM1和OEM5的存活率分别约为75和69%,显著高于Col-0幼苗(图2)。2b).补充AsA也可提高小鼠的存活率Abi4.突变体高盐度应力。这些结果表明,ABI4抑制的ASA合成介导盐应激敏感性Abi4.突变体和ABI4-OEM幼苗。
ABI4调控盐胁迫下抗坏血酸生物合成和活性氧清除
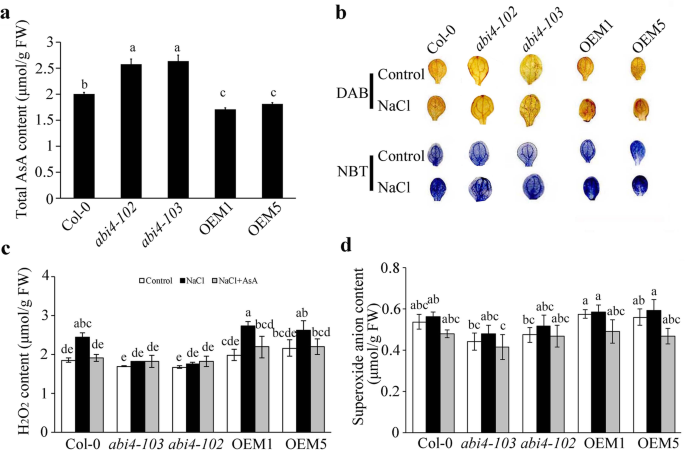
抗坏血酸在清除ROS方面发挥重要作用,显著提高植物的抗应激能力[40,41,42].我们之前发现Abi4.通过ABI4负调控AsA合成积累较少ROS [10].本研究测定了盐胁迫下7日龄幼苗的AsA和ROS含量。结果表明,盐处理下的AsA含量较高abi4 - 103ABI4-OEM1和ABI4-OEM5突变体幼苗的基因表达量低于Col-0(图2)。3.a).我们比较了在Abi4.敲除突变体和OEM转基因植株,在正常条件和NaCl处理下添加或不添加AsA。根据二氨基联苯胺(DAB)或硝基蓝四唑(NBT)染色,H2O2和O2-在OEM1和OEM5的叶子中累积多于Col-0和Abi4.两个条件下的突变体。相比之下,h2O2和O2-内容的abi4 - 103叶片数量显著低于Col-0植株(图。3.b)。定量分析表明h的水平2O2在盐胁迫处理下,所有基因型均显著增加Abi4.突变体中,ABI4-OEM积累的H2O2比Col-0在盐胁迫处理下的处理效果好(图。3.c). O的含量2-低于abi4 - 103在正常和盐胁迫条件下,随着外源AsA的添加,O2-在ABI4-OEM植株中积累量明显降低(图2)。3.d).这些结果表明Abi4.突变体和过度抑制植物有助于盐胁迫处理下的ROS累积。
ABI4促进盐胁迫下抗坏血酸(AsA)的合成和活性氧(ROS)的积累。一个Col-0中AsA含量abi4 - 102,abi4 - 103和Abi4.-过表达的细胞系在100 mM NaCl处理下。b二氨基苯甲酸(DAB)和Nitroblue四唑(NBT)在COL-0中ROS染色,abi4 - 102,abi4 - 103和Abi4.-过表达的幼苗,无论是否盐处理。的测量cH2O2和dO2-在Col-0,abi4 - 102,abi4 - 103和Abi4.盐处理或不处理过表达的细胞株。7日龄幼苗分别用100 mM NaCl(含或不含40 μM AsA)处理24 h。值一个,c和d为平均值±标准差(n= 3)。统计学上显著差异用不同的字母表示(P< 0.05, ANOVA with Tukey’s test)。FW,鲜重
盐胁迫负调控VTC2通过诱导表达Abi4.表达式
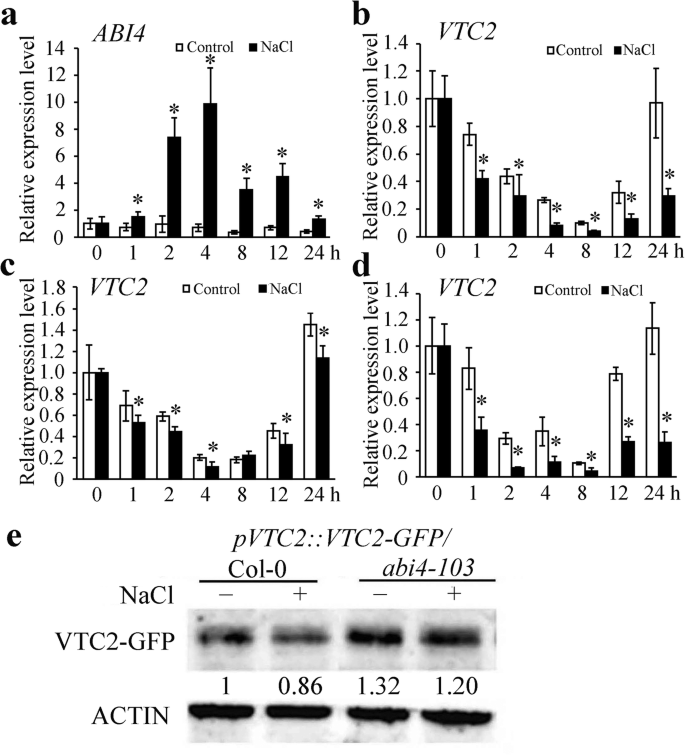
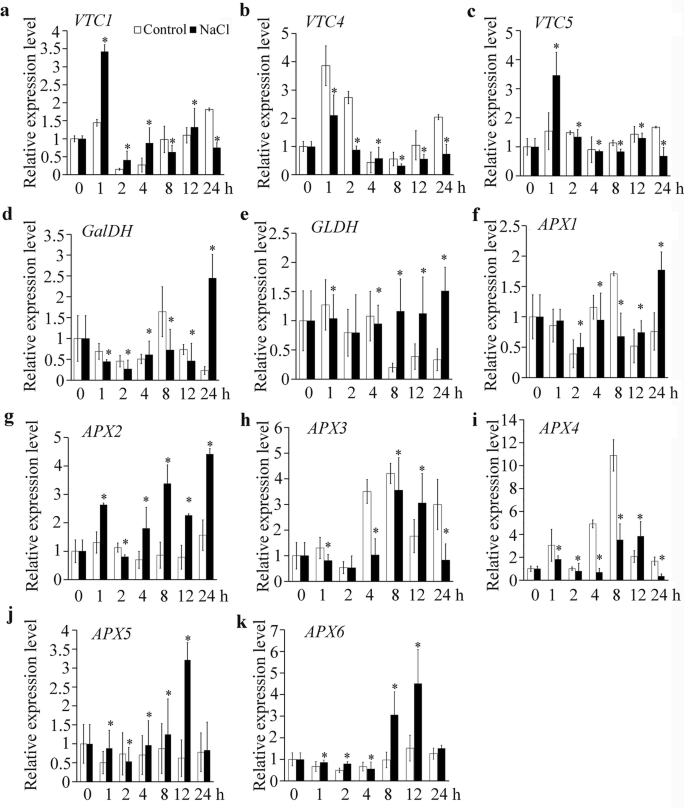
结果表明,盐胁迫诱导了水稻的生长Abi4.表达拟南芥幼苗射击[36].我们以前的研究表明ABI4抑制VTC2表达 [10].因此,有必要进一步检测基因表达VTC2盐胁迫下。表达Abi4.通过定量聚合酶链反应(qPCR)分析,在盐处理2 h至24 h时,可以快速且显著地诱导(图。4一个)。VTC2在COL-0的盐胁迫4小时的开始时明显抑制了表达(图。4B),而抑制被破坏abi4 - 103突变体(无花果。4c)ABI4-OEM1略微增加(图。4D,表明抑制VTC2盐胁迫的早期阶段的转录部分依赖于ABI4。
盐胁迫对其表达的影响Abi4.和VTC2.表达式Abi4.在Col-0一个,VTC2在Col-0b,VTC2在abi4 - 103c,VTC2在abi4-oem1d对200 mM NaCl处理下的幼苗进行qPCR分析。在归一化到内部控制之后施,转录水平Abi4.和VTC2与0 h的处理时间进行比较,0 h归一化为“1”。误差棒代表三个生物重复的标准差。星号表示差异有统计学意义(P < 0.05, Mann-Whitney U检验)。eCOL-0和VTC2蛋白水平的比较Abi4.幼苗。波段下的数字表示所探测波段的相对光强PVTC2 :: VTC2-GFP/Col-0无NaCl处理归一化为“1”。提取总蛋白PVTC2 :: VTC2-GFP/ col-0和PVTC2 :: VTC2-GFP/abi4 - 103幼苗在100 mM NaCl处理24 h后,用抗gfp抗体检测。以肌动蛋白检测作为负荷控制
在Col-0和Abi4.对盐胁迫处理下的突变体进行分析,验证其下调VTC2与VTC2的酶促功能相关的表达。我们检测到由此驱动的VTC2-GFP融合蛋白VTC2促销员在Col-0和的背景中abi4 - 103用抗gfp抗体处理或不处理NaCl的突变体。我们发现VTC2-GFP蛋白在abi4 - 103而在col0背景下,盐胁迫降低了这一水平,但变化不大abi4 - 103突变背景(图。4a).这些结果提示ABI4的转录抑制VTC2赋予盐压力早期阶段的ASA内容物和累积的RO。
我们还检测了盐胁迫下参与AsA合成和循环的其他基因的表达。的转录水平VTC1和VTC5盐处理1 h显著增加(图;5a和c)。ASA合成的L- GAL途径的其他关键基因通过盐下调(图。5在盐胁迫的前24 h,抗坏血酸过氧化物酶(APX)基因在盐胁迫下表达上调APX3和APX4(无花果。5F-5K)。结果表明,ASA含量下降与盐胁迫的早期阶段的ASA生物合成和再循环相关。
ABI4与VTC2协同调控耐盐性
根据Abi4.和VTC2基因表达对盐胁迫的响应,我们测定了耐盐性ABI4 VTC2.两个突变体来确认他们的协调工作。在正常条件下,双突变体的根长较Col-0短,根系生长受到抑制ABI4 VTC2.突变体比这更容易abi4 - 103而不是那样的vtc2在盐处理下(图。6a, b,和c)。进一步的统计分析表明,根长度abi4 - 103,vtc2和ABI4 VTC2.在NaCl处理下突变体相同,添加外源AsA后突变体部分恢复(图2)。6b).中AsA的内容vtc2和ABI4 VTC2.盐胁迫处理的突变体数量远少于Col-0(图。6d)和ROS积累ABI4 VTC2.高于Abi4.在盐胁迫下(图。6e和f)。这些结果表明VTC2下游的Abi4.在盐胁迫下调节AsA的生物合成和ROS的积累。
VTC2下游的功能Abi4.通过修饰抗坏血酸(AsA)的生物合成和活性氧的积累来调节盐胁迫下幼苗的生长。一个幼苗生长表型abi4 - 103,vtc2和ABI4 VTC2.在100 mM NaCl处理下,添加或不添加40 μM AsA的突变体。条= 1.4厘米。b根的长度vtc2 abi4 - 103和ABI4 VTC2.突变体(A)。c(b)中根长的相对值。COL-0的根部长度和正常生长条件下的所有突变体归一化为“1”。dCol-0中AsA的含量abi4 - 103,vtc2和ABI4 VTC2.在盐胁迫处理下。eH2O2和fO2-在Col-0,abi4 - 103,vtc2和ABI4 VTC2.在用或没有40μMASA的盐应激处理下。7日龄幼苗分别用100 mM NaCl(含或不含40 μM AsA)处理24 h。值是指±SD(n = 3)。统计上显着的差异由不同的字母表示(P <0.05,具有TUKEY测试的ANOVA)。FW,鲜重
讨论
研究表明,ABI4调控植物的耐盐性Abi4.突变体表现出盐胁迫抗性,这与植株芽部钠积累减少有关[35].然而,基于我们之前的研究表明,ABI4介导了AsA生物合成中乙烯和ABA的交联[10,目前尚不清楚AsA含量的增加是否与耐盐性的增强有关Abi4.突变体。植物的盐度损伤是部分通过盐诱导的ROS引起的[43].无论ABI4如何调节植物盐耐受的机制都没有报道氧化应激。在目前的研究中,我们发现在耐盐性中调节ABI4介导的ASA生物合成拟南芥.盐压力诱导Abi4.表达引起的减少VTC2胁迫早期AsA生物合成减少,ROS含量增加,导致幼苗生长受阻。因此,AsA参与了abi4介导的盐胁迫敏感性。
植物中累积的RO对植物生长和发展具有重要影响[6,44,45].如果应激早期产生的ROS没有被及时清除,就会造成严重的细胞损伤。研究表明,降低ROS清除能力会显著降低植物对盐胁迫的耐受性[46].这abi4 - 103突变体在体内累积了更多ASA,这可以减少ROS的损伤,而ABI4-OEM植物由于ASA含量下降而对盐更敏感。通过添加ASA,观察到在清除ROS中调节ASA并促进耐盐性和耐盐性的进一步证据。
植物中AsA合成途径的关键酶是VTC2,其活性对AsA合成有重要影响[9,47].在体内,VTC2的活性可通过转录和转录后水平调控[16].结合抑制VTC2在盐胁迫的早期表达和降低的VTC2蛋白质水平,VTC2蛋白的丰度更多Abi4.突变体中VTC2的酶活性较Col-0明显增强Abi4.突变体对盐胁迫下AsA的生物合成有促进作用。AsA和ROS的含量Abi4.表明ABI4对AsA生物合成的调控在盐胁迫响应中发挥了重要作用。因此,在盐胁迫的早期,AsA的生物合成被下调,从而导致ROS的积累,抑制幼苗的生长。随着ROS在盐胁迫下的积累,编码AsA生物合成最后两个步骤的基因,GalDH和GLDH,盐胁迫24 h诱导AsA生物合成并清除ROS。因此,参与AsA生物合成的酶在响应盐胁迫时可能具有复杂的调控模式。
同时,我们也检测了该基因的转录水平APX型AsA循环途径中的基因,这是保持ROS稳态的关键[48].APX in.拟南芥三种胞质(APX1, APX2, APX6),三种微粒体(APX3, APX4, APX5)和两种叶绿体(基质sAPX,类囊体tAPX)亚型[49].在这项研究中,大多数APX型在盐胁迫前2 h,除其他基因无显著变化外,其余基因均无显著变化APX2.基因APX1,APX2,APX5,APX6分别在盐胁迫处理12 h和24 h诱导,而APX3和APX4表明盐胁迫早期AsA含量的降低直接影响过氧化物酶体定位的APX3 [50]和叶绿体定位APX4 [51],同时积累的ROS可首先被胞质APXs消除。这些结果与之前的结论一致,即定位于不同细胞器的APXs具有不同的功能[52].这些结果表明,盐胁迫下的ASA介导的ROS消除仍需要进一步研究。
由于负面调节Abi4.在VTC2,盐敏感性的相似性ABI4 VTC2.双突变体vtc2表示VTC2下游的Abi4.在调节耐盐性方面。的反应Abi4.在盐胁迫下表达量下降VTC2导致AsA生物合成减少,ROS积累增加。增加的耐盐性Abi4.功能缺失突变体与高水平的AsA密切相关。
结论
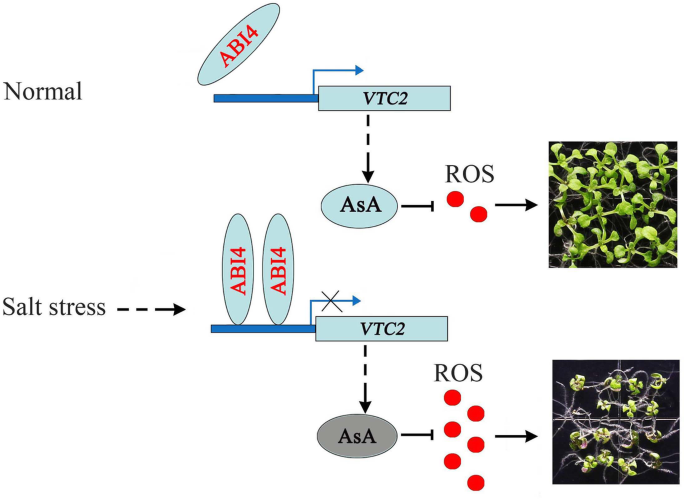
总之,我们的调查结果提供了对ABI4如何调节盐抑制幼苗生长的见解,以与VTC2协调。表达Abi4.在盐胁迫下,ABI4与VTC2抑制它的表达。因此,减少表达VTC2导致ASA生产和增加的ROS积累,最终抑制幼苗生长(图。7).在正常情况下,较低的表达水平Abi4.引起更高的VTC2扫除ROS的表达和ASA内容。在盐度压力下,Abi4.被诱导和抑制了VTC2表达式。表达减少VTC2盐胁迫早期AsA产量降低;因此,植物体内积累了更多的ROS。高水平的活性氧会导致幼苗生长受到抑制或死亡。因此,ABI4-VTC2模块在盐胁迫早期的协同调控导致了ROS的积累,抑制了幼苗的生长。
方法
植物材料及生长条件
拟南芥生态型哥伦比亚(Col-0)用于本研究中的所有实验。这abi4 - 103(CS3838),abi4 - 102(CS3837)从拟南芥生物资源中心获得。这vtc2突变体、ABI4-OEM1、ABI4-OEM5和pVTC2::VTC2-GFP转基因植物已被描述[10,40,53].植物在1/2 ms培养基上生长[54[含0.4% (w/v)植酸酯在16-h白光/8-h暗循环下22°C。
基因操作
双突变体ABI4 VTC2.是通过交叉产生的abi4 - 103和vtc2然后通过测序随后筛选来自交叉的F2后代。有关使用的引物的信息总结在补充表中1.
盐压力测定
将3天龄幼苗转移到含有100mM或150mM NaCl的1/2 MS培养基中,供应或没有40μmAsa。在盐处理四天后,采取了照片,其次是对根长和生存率的统计分析。对于基因表达检测,将7天龄幼苗转移到清洁过滤纸中,并用200mM NaCl用1/2 ms液体培养物处理。
用抗坏血酸含量测定
对于标准曲线,将0.175g抗坏血酸转移到1.5ml离心管中,1ml 6%的环氯酸(HClO4),制备1mm AsA溶液。AsA母液用6% HClO稀释40.1μM, 0.2μM, 0.4μM, 0.6μM, 0.8μM, 1μM AsA标准的解决方案。然后将每个200 μl标准品放入2ml离心管中,加入1800 μl 0.2 M丁酸钠缓冲液(pH =12.7)。在A点测量每个样品的吸收值265..
AsA含量的测量如前所述[28].用100mM NaCl处理7天幼苗24小时,然后将约0.1g样品加入到2ml离心管中,并在液氮中冷冻,用植物破碎机粉碎成粉末,含有1ml 6%HCLO。4加入并放入冰中搅拌5分钟。样品在12,000 rpm离心10分钟。然后将200 μl上清转移到含有1800 μl 0.2 M琥珀酸钠缓冲液(pH = 12.7)的新管中。在265 nm处用分光光度计测量OD1 (Optical Density 1)。再取200 μl上清加入另一支含有1800 μl 0.2 M琥珀酸钠缓冲液(pH = 12.7)和4u抗坏血酸氧化酶(Sigma)的试管中。混合后置于室温黑暗中20分钟,在265 nm处测量OD2。同时,在含有1800 μl 0.2 M琥珀酸钠缓冲液(pH = 12.7)和60 μl 1 M二硫苏糖醇(DTT)的试管中再加入200 μl上清液。混合后在室温(25℃)黑暗中放置30分钟,用分光光度计在265 nm处测量OD3。根据标准曲线OD1-OD2和OD3-OD1的值分别计算AsA的还原或氧化形式的浓度。两者之和为每个样品中总AsA浓度。
反应性氧气染色
将用水(对照)或盐(NaCl)处理过的幼苗放入试管中,放入2ml DAB染色溶液(包括1mg /ml DAB;50 mM NaAc-HAc, pH = 3.8)2O2或NBT溶液(含1mg /ml NBT;25 mM Hepes, pH = 7.6),然后抽真空10分钟。这些样品在37℃的黑暗中孵育约15分钟至数小时(根据染色程度),然后将植株转入75% (v/v)乙醇中去除叶绿素。
活性氧测量
7日龄幼苗转移到干净的滤纸上,用1/2 MS加或不加100 mM NaCl的液体培养24 h。0.1 g样品用液氮冷冻,然后用H2O2超氧化物含量按H2O2测量套件(Solarbio)和超氧化物测量套件(Solarbio)协议。
RNA提取和逆转录定量聚合酶链反应分析
用植物RNA分离迷你试剂盒(CWBIO)提取幼苗总RNA。RNA反转录使用HiScript II QRT Super mix for The qPCR (Vazyme Biotech), qPCR使用SYBR Green Master mix (Vazyme Biotech)和iQ5系统(Bio-Rad)。三份生物样品用三个独立的技术重复进行分析。施(AT3G18780)作为归一化的内参基因。用2犬−ΔΔct方法 [55].用三个独立的技术重复对三个生物学重复进行分析。误差棒代表三个生物重复的标准差。RT-qPCR所使用的引物见补充表1.
Western Blotting.
将7日龄幼苗转移到干净的滤纸上,用1/2 MS含或不含100mm NaCl的液体培养24 h。提取总蛋白,然后进行12% SDS/PAGE凝胶电泳。该蛋白通过湿罐转移转移到PVDF膜(BioRad),并使用抗gfp抗体(Abmart)进行检测。以抗ACTIN抗体(Abmart)作为负载对照。采用ImageJ软件进行定量分析。
统计分析
统计数据采用单因素方差分析(Tukey’s test,P< 0.05)和Mann- Whitney U检验(p < 0.05) in SPSS16.0 (Polar Engineering and Consulting,http://www.winwriap.com.).使用不同的字母和星形符号来表明统计学上显着的差异。
可用性数据和材料
可以通过联系相应作者来共享再现这些发现所需的所有数据和材料,wangjuan@caas.cn(J.W.)。
缩写
- 阿坝:
-
脱落酸
- AsA:
-
L-抗坏血酸
- APX型:
-
抗坏血酸过氧化物酶
- 轻拍:
-
Diaminobenzidine
- 绿色荧光蛋白:
-
Geen荧光蛋白
- 女士:
-
Murashige和Skoog.
- 电视台:
-
Nitroblue Tetrazolium.
- OE:
-
过表达
- QPCR:
-
定量聚合酶链反应
- ROS:
-
活性氧
参考文献
- 1.
植物抗坏血酸:化学、功能、代谢、生物利用度和加工效果。食品农业杂志.2000; 80:825 - 70。https://doi.org/10.1002/ (SICI) 1097 - 0010 (20000515) 80:73.0.CO; 2 - 6.
- 2.
植物中的抗坏血酸:生物合成和功能。生物化学学报2000;35:291-314。https://doi.org/10.1098/rstb.2000.0706.
- 3.
Wheeler GL,琼斯MA,Smirnoff N.高等植物中维生素C的生物合成途径。自然。1998年; 393:365-9。https://doi.org/10.1038/30728.
- 4.
牧师GM,KINDEL G,ANTONIW J,BERNARD S,Veljovic-Jovanovic S,Verrier PJ等。叶维生素C含量调节植物防御转录物并调节通过激素信号传导控制发展的基因。植物细胞。2003; 15:939-51。https://doi.org/10.1105/TPC.010538.
- 5.
Barth C, Gouzd ZA, Steele HP, Imperio RM。gdp -甘露糖焦磷酸化酶的突变导致对铵的条件过敏,导致拟南芥根生长抑制,铵代谢改变,激素稳态。J Exp Bot. 2010; 61:379-94。https://doi.org/10.1093/jxb/erj198.
- 6.
抗坏血酸:一种潜在的氧化剂清除剂及其在植物发育和非生物胁迫耐受性中的作用。前面。Plant Sci. 2017;8:613.https://doi.org/10.3389/fpls.2017.00613.
- 7.
来自维生素c的希望、幻灭和更多的希望。细胞分子生命科学,2004;61:209-19。https://doi.org/10.1007/s00018-003-3203-8.
- 8.
加里博士。L-抗坏血酸:支持植物生长和发育的多功能分子。Scientifica(开罗)。2013:795-964。https://doi.org/10.1155/2013/795964.
- 9.
王志强,王志强。抗坏血酸盐生物合成的调控。植物生物学杂志。2016;33:15-22。https://doi.org/10.1016/j.pbi.2016.04.010.
- 10.
Tabata K,Takaoka T,Esaka M.烟草中抗坏血酸相关酶的基因表达。植物化学。2002; 61:631-5。https://doi.org/10.1016/s0031-9422(02)9422(02)00367-9.
- 11.
于永文,王健,李胜,Kakan X,周勇,苗永春,王芳芳,秦辉,黄瑞芬。抗坏血酸在活性氧积累过程中整合了乙烯和脱落酸的拮抗调节。植物杂志。2019;4:1861 - 75。https://doi.org/10.1104/pp.18.01250.
- 12.
Dutilleul C, Garmier M, Noctor G, Mathieu C, Chétrit P, Foyer CH, de Paepe R.叶片线粒体调节整个细胞氧化还原稳态,设置抗氧化能力,并通过改变信号和日间调节确定抗应激能力。植物细胞。2003;15:1212-26。https://doi.org/10.1105/TPC.009464.
- 13.
Grace SC,Logan Ba。三种阔叶常绿物种的叶面抗氧化系统对生长辐照生长辐照程序的适应。植物理性。1996年;112:1631-1640。DOI:10.1104 / pp.112.4.1631.
- 14.
Richardson AC。高生长温度降低了猕猴桃水果碳水化合物和维生素C.植物细胞环境。2004; 27:423-35。https://doi.org/10.1111/j.1365-3040.2003.01161.x.
- 15.
Sasaki-Sekimoto Y,Taki N,Obayashi T,Aono M,Matsumoto F,Sakurai N,等。通过茉莉酸盐及其在胁迫下的抗氧化剂和防御化合物的代谢途径的协调活化拟南芥.植物j . 2005; 44:653 - 68。https://doi.org/10.1111/j.1365-313X.2005.02560.x.
- 16.
dodle J, Ishikawa T, Gatzek S, Rolinski S, Smirnoff N.两个基因拟南芥需要编码GDP-L-半乳糖磷酸化酶,用于抗坏血酸生物合成和幼苗活力。工厂J. 2007; 52:673-89。https://doi.org/10.1111/j.1365-313X.2007.03266.x.
- 17.
Smirnoff n,Conklin Pl,Loewus Fa。植物抗坏血酸生物合成:文艺复兴。Annu Rev植物Biol。2001;52:437-467。DOI:10.1146 / annurev.a.plant.52.1.437
- 18.
Yabuta Y,Mieda T,Rapolu M,Nakamura A,Motoki T,Maruta T.抗坏血酸生物合成的光调节取决于光合电子传输链,但与糖无关拟南芥.J. Exp. Bot. 2007; 58:2661-71。https://doi.org/10.1093/jxb/erm124.
- 19.
Bartoli Cg,Yu J,Gómezf,费尔南德州L,McONTOSH,Foyer Ch。抗坏血酸合成和积累中的光和呼吸之间的间相互关系拟南芥树叶。J Exp Bot。2006;57:1621-1631。DOI:10.1093 / jxb / erl005
- 20.
陈泽,年轻的te,ling j,chang sc,gallie dr。通过增强抗坏血酸回收,增加植物的维生素C含量。美国国家科学院学报。2003; 100:3525-30。https://doi.org/10.1073/pnas.063517100.
- 21.
张泽,王继,张立,黄雷。乙烯反应因子AterF98通过抗坏血酸合成的转录激活增强了盐的耐受性拟南芥.工厂J. 2012; 71:273-87。https://doi.org/10.1111/j.1365-313X.2012.04996.x.
- 22。
王军,于永文,张志军,权路得,张宏文,马光国,邓晓伟,黄瑞芬。拟南芥CSN5B与VTC1相互作用并调节抗坏血酸的合成。植物细胞。2013;25:625-36。https://doi.org/10.1105/TPC.112.106880.
- 23。
秦浩,王玉英,王军,刘辉,赵辉,邓扎,张志林,黄瑞芬,等。抑制GMPase基因的表达OsVTC1-1降低水稻苗期和生殖期的耐盐性。《公共科学图书馆•综合》。2016;11:e0168650。https://doi.org/10.1371/journal.pone.0168650.
- 24。
黄超,何伟,郭建军,常晓霞,苏鹏,张磊。拟南芥抗坏血酸缺失突变体对盐胁迫的敏感性。J. Exp. Bot. 2005;56: 3041 - 3049。doi: 10.1093 / jxb / eri301
- 25。
李义,楚泽,罗杰,周耶,蔡伊,陆烨,等。C2H2锌-FIFIGER蛋白SiZF3通过与CSN5B相互作用来调节ASA合成和耐盐性。植物Biotechnol J. 2018; 16:1201-13。https://doi.org/10.1111/pbi.12863.
- 26。
阿特户珥。,Khan A, Ashraf M. Inducing salt tollerance in wheat by exogenously applied ascorbic acid through different modes. J. Plant Nutr. 2009; 32: 1799–1817. doi:10.1080 / 01904160903242334
- 27。
外源抗坏血酸缓解渗透胁迫下玉米叶片脱落酸、脯氨酸和多胺的积累。植物生理学报。2015;37: 1 - 9. - doi:10.1 - 007 / s11738 - 015 - 015 - 1792 - 0.
- 28。
王艳艳,赵辉,秦辉,李志新,刘辉,王军,等。水稻根中抗坏血酸的合成通过清除活性氧在水稻耐盐性中发挥重要作用。国际分子生物学杂志。2018;19:33-47。https://doi.org/10.1007/s11738-015-015-1792-0.
- 29.
Vishwakarma KC,Updayay N,Kumar N,Yadav G,Singh J,Mishra RK等。植物中脱落酸信号和非生物胁迫耐受性:关于当前知识和未来前景的综述。前植物SCI。2017; 8:161。https://doi.org/10.3389/fpls.2017.00161.
- 30.
尹超,赵辉,马波,陈胜,张军。乙烯对水稻农艺性状的调控作用。前面。植物科学。2017;8:1676。10.3 - 389 / fpls.2017.01676。
- 31.
Fujita Y, Fujita M, Shinozaki K, Yamaguchi-Shinozaki K. aba介导的植物渗透胁迫的转录调控。植物学报2011;124:509-25。https://doi.org/10.1007/s10265-011-0412-3.
- 32.
Wind JJ, Peviani A, Snel B, Hanson J, Smeekens SC. ABI4:多功能激活和抑制因子。植物生态学报。2013;18:125-32。https://doi.org/10.1016/j.tplants.2012.10.004.
- 33.
芬克尔斯坦RR。两个新的突变拟南芥ABA响应基因座类似于Abi3.突变。工厂J. 1994; 5:765-71。https://doi.org/10.1046/j.1365-313X.1994.5060765.x.
- 34.
陈志强,陈志强,陈志强,等。种子和幼苗脱落酸信号转导的研究进展。植物细胞。2002;14:S15-45。https://doi.org/10.1105/tpc.010441.
- 35.
Shkolnik-Inbar D, Adler G, Bar-Zvi D. ABI4下调钠转运蛋白的表达HKT1 1在拟南芥根并影响耐盐性。工厂J. 2013; 73:993-1001005。https://doi.org/10.1111/TPJ.12091..
- 36.
李鹏,黄建军,于松,李勇,孙鹏,吴超,郑晨。拟南芥YL1/BPG2通过ABI4参与幼苗茎叶对盐胁迫的响应。科学。众议员2016;6:30163。https://doi.org/10.1038/srep30163.
- 37.
易j,赵dm,楚碧,yan jj,liu js,wu mj等。AtDPG1是否参与了盐胁迫反应拟南芥幼苗通过abi4。植物SCI。2019; 287:110-80。https://doi.org/10.1016/j.plantsci.2019.110180.
- 38.
罗晓峰,戴玉军,郑超,杨永忠,陈伟,王春春,等。ABI4-RbohD/VTC2调节模块促进活性氧(ROS)的积累,降低盐胁迫下种子的萌发。新植醇。2020;11。https://doi.org/10.1111/nph.16921.
- 39.
董志军,于勇,李胜,王杰,唐松,黄瑞夫。脱落酸通过abi4介导的ACS4和ACS8的转录抑制来拮抗乙烯的产生拟南芥.摩尔。2016;9:126-35。https://doi.org/10.1016/j.molp.2015.09.007.
- 40.
Kocsy G,Tari I,VankováR,Zechmann B,GalyásZ,PoórP,Galiba G.氧化还原控制植物生长和发展。植物SCI。2013; 211:77-91。https://doi.org/10.1016/j.Plantsci.2013.07.004.
- 41.
活性氧的种类、非生物胁迫与组合。植物j . 2017; 90:856 - 67。https://doi.org/10.1111/tpj.13299.
- 42.
Shabala S,Wu H,Bose J.盐胁迫感应和植物根的早期信号事件:当前的知识和假设。植物SCI。2015; 241:109-19。https://doi.org/10.1016/j.plantsci.2015.10.003.
- 43.
Inzé D, Van Montague M.植物的氧化应激。Curr Opin Biotech. 1995; 6:153-8。https://doi.org/10.1016/0958 - 1669 (95) 80024 - 7.
- 44.
门厅CH, Noctor G.抗坏血酸和谷胱甘肽:氧化还原中枢的心脏。植物杂志。2011;155:2-18。https://doi.org/10.1104/pp.110.167569.
- 45.
Venkatesh J, Park SW。l -抗坏血酸在缓解农作物非生物胁迫中的作用。机器人钉。2014;55:38。https://doi.org/10.1186/1999-3110-55-38.
- 46。
Conklin PL, Williams EH, Last RL。抗坏血酸缺乏的环境应激敏感性拟南芥突变体。美国国家科学院学报。1996; 93:9970-4。https://doi.org/10.1073/pnas.93.18.9970.
- 47。
Linster CL, Clarke SG。高等植物l -抗坏血酸的生物合成:VTC2的作用。植物科学进展。2008;13:567-73。https://doi.org/10.1016/j.tplants.2008.08.005.
- 48。
陶超,金旭,朱丽,谢强,王旭东,李洪波。水稻APX基因家族的全基因组研究及表达谱分析陆地棉为不同纤维发育阶段的氧化还原稳态维持提供了新的见解。Mol Gen Gen. 2018; 293:685-97。https://doi.org/10.1007/s00438-017-1413-2.
- 49。
Panchuk II,Zentgraf U,Volkov Ra。APX基因家族在叶片衰老过程中的表达拟南芥.足底。2005;222:926-32。https://doi.org/10.1007/s00425-005-0028-8.
- 50。
沉G,kuppu s,Venkataramani s,wangj,yan j,秋x,张H.含有ankyrin重复的蛋白2a是用于过氧化血膜结合的抗坏血酸过氧化物酶3的基本分子伴侣。植物细胞。2010; 22:811-31。https://doi.org/10.1105/tpc.109.065979.
- 51。
王媛媛,海克股份有限公司,豪泽文学学士。APX4基因座调控种子活力和幼苗生长拟南芥.足底。2014;239:909-19。https://doi.org/10.1007/s00425-014-2025-2.
- 52。
Teixeira FK, Menezes-Benavente L, Galvão VC, Margis R, Margis- pinheiro M. Rice抗坏血酸过氧化物酶基因家族编码不同亚细胞区隔的功能亚型。足底。2006;224:300-14。https://doi.org/10.1007/S00425-005-0214-8.
- 53。
Kerchev PI, Pellny TK, Vivancos PD, Kiddle G, Hedden P, Driscoll S.转录因子ABI4在抗坏血酸依赖的生长调控和茉莉酸依赖的防御信号通路调控中是必需的拟南芥.植物细胞。2011; 23:3319-34。https://doi.org/10.1105/tpc.111.090100.
- 54。
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志。1962;15: 473 - 497。1399 - 3054.1962.tb08052.x doi: 10.111 / j
- 55.
张j,xuid z,李m,杨m,qin h,阳j,吴S.时尚性细胞骨架组织确定多细胞的形态发生。Plos Genet。2019; 10:E1008438。https://doi.org/10.1371/journal.pgen.1008438.
致谢
我们非常欣赏克里德斯大学克里斯汀H.·林纳博士,请善良地提供vtc2突变体。我们要感谢编辑(www.editage.com)作英文编辑。
资金
基金资助:国家自然科学基金(no . 31670280);中央公益性科研机构基本科研业务费专项资金(no . 1610392020004);中国农业科学院农业科技创新计划项目。
作者信息
从属关系
贡献
J.W.和R.H.构思了这个项目。X. K, Y.Y., L. s.和X. L.进行了测定。X.K., J.W.和R.H.分析了数据。x·k和j·w写的手稿。J.W.和R.H.审阅了手稿。作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者宣称,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可以被解释为潜在的利益冲突。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
补充表1
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
余永强,李淑娟。等等。ABI4转录抑制的抗坏血酸调节VTC2在耐盐性拟南芥.BMC植物杂志21,112(2021)。https://doi.org/10.1186/s12870-021-02882-1.
收到了:
接受:
发表:
关键词
- Abi4.
- 盐胁迫
- 抗坏血酸
- VTC2
- ROS积累