- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
两个gydF4y2BaCyc2CLgydF4y2Ba成绩单(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)在菊花射线小花的花瓣和雄蕊发育中起着关键作用gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba文章编号:gydF4y2Ba105.gydF4y2Ba(gydF4y2Ba2021.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
菊花gydF4y2Ba是最受欢迎的观赏作物之一。Capitulum是菊花植物的主要装饰部分,包括螺旋边缘射线小花,一个有吸引力的花冠(花瓣)和径向雌雄同体圆盘小花,但没有雄蕊。在奥斯泰西物种中,Zygomorphic射线小花从放射体圆盘小花中演变。在此过程中,Zygomorphic Ligulate Corolla出现并且雄蕊中止了雄蕊。虽然分子遗传学研究在一定程度上澄清了雷福特的发展,但菊花中雷弗花卉发育的精确分子机制仍然不清楚。gydF4y2Ba
结果gydF4y2Ba
一个gydF4y2BaCYC2gydF4y2Ba例如基因,gydF4y2BaCyc2CLgydF4y2Ba,被克隆到了gydF4y2Ba其总黄酮gydF4y2Ba'五顿'。随后的分析显示替代剪接gydF4y2BaCyc2CLgydF4y2Ba,这发生在花分化阶段,导致生产gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在顶部芽。在此阶段之前,只有gydF4y2BaCyc2CL-1gydF4y2Ba在顶端芽中产生。荧光原位杂交分析标记gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2BaRNA表示gydF4y2BaCyc2CL-2gydF4y2Ba在最终的涉及分化阶段期间首先在涉及的组织中表达,但随后在容器和Floret Primordia中表达,因为花芽分化阶段进展。而且,gydF4y2BaCyc2CL-2gydF4y2Ba在花冠形成阶段在花序组织中高度表达,并且表达仍然高,直至花芽分化阶段结束。此外,过表达gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba转基因拟南芥抑制了雄蕊和花瓣的发育。因此,这两个gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba编码花瓣发育和雄蕊堕胎的候选监管机构,对菊花的雷福特发育很重要。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们的特征是替代的剪接转录物gydF4y2BaCYC2gydF4y2Ba- 细巧妙地关于表达和功能的基因。这里提出的数据对于澄清与之相关的监管机制是有用的gydF4y2BaCYC2gydF4y2Ba- 麦基基因,也可能对鉴定控制菊花中雷小花发育的关键基因和分子机制。gydF4y2Ba
背景gydF4y2Ba
Asteraceae是最大的开花植物家族,属于核心斯岛队的核心队逃税人的思考。Asteraceae物种的独特头部花序,称为Capitulum,通常由以下两种形态学和功能分化的小花香组成:双侧(Zygomorphic)射线小花和径向(放射体)圆盘小花[gydF4y2Ba18.gydF4y2Ba].边缘的射线小花舌状和雌性,有一个吸引的花冠(花瓣),但没有雄蕊。内有可育花粉粒的内盘小花呈放射状五边形,雌雄同体。在菊科植物中,左右对称的射线小花是从辐射对称的圆盘小花演化而来的[gydF4y2Ba41.gydF4y2Ba].在被子植物中,向双侧花对称的转变被认为是三个关键进化事件之一,并与特殊的花-传粉者相互作用的进化有关,这有助于开花植物谱系的多样化[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
Zygomorphic Meady ray Floret的发展是与牛肚菌群岛Capitulum的进化成功相关的重要事件,因为雷小花卉对粉丝器具有高度吸引力,并且可以显着提高延伸率[gydF4y2Ba44.gydF4y2Ba].在Zygomorphic女性雷小花的发展过程中发生了以下两个根本变化:Zygomorphic Ligulate Corolla出现并中止雄蕊。许多近期的系统发育和生物学研究都集中在这种特质上。gydF4y2Ba
在gydF4y2BaAntirrhinum Majus.gydF4y2Ba(Lamiales),分离出TCP转录因子环淋酸(CYC)和二甲瘤(DICH),并表征为花卉Zygomorphy的关键调节剂[gydF4y2Ba33.gydF4y2Ba].几个gydF4y2BaCYCgydF4y2Ba类似的tcp编码基因已在菊科植物中被鉴定出来gydF4y2Ba环淋巧gydF4y2Ba/gydF4y2BaTeosinte分支机构1gydF4y2Ba(gydF4y2BaCYCgydF4y2Ba/gydF4y2BaTB1gydF4y2Ba) - 般的亚家族被分为以下三个gydF4y2BaCYCgydF4y2Ba片状:gydF4y2BaCYC1gydF4y2Ba,gydF4y2BaCYC2gydF4y2Ba, 和gydF4y2BaCYC3gydF4y2Ba, 其中gydF4y2BaCYC2gydF4y2Ba支系基因经历了多次重复事件,导致这些基因在菊科谱系内的功能多样化[gydF4y2Ba43.gydF4y2Ba].10gydF4y2BaCYCgydF4y2Ba/gydF4y2BaTB1gydF4y2Ba在向日葵中确定的基因属于三个不同的枝条(gydF4y2BaCYC1gydF4y2Ba,gydF4y2BaCYC2gydF4y2Ba, 和gydF4y2BaCYC3gydF4y2Ba),这与对其他eudicot物种所确定的内容一致。以前的研究提出,基因重复和功能性发散极大地促进了向日葵的多样化gydF4y2BaCYCgydF4y2Ba基因家族[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].此外,系统发育分析gydF4y2BaCYCgydF4y2Ba- 样基因揭示了这些基因的不同聚氨酸可能已独立地募集以介导在不同的钙科物种中的Zygomorphy [gydF4y2Ba7gydF4y2Ba].在gydF4y2Ba格伯拉·亨格纳gydF4y2Ba,gydF4y2BaCYCgydF4y2Ba- 状同源物gydF4y2BaGhcyc2.gydF4y2Ba在边缘左右对称的射线小花中特异表达,但在中心最辐射对称的圆盘花中不表达。过度的gydF4y2BaGhcyc2.gydF4y2Ba导致圆盘花的生产在形态上与雷花相似。此外,据报道,Ghcyc2对花卉类型的分化很重要gydF4y2Bag .矮牵牛gydF4y2Ba[gydF4y2Ba2gydF4y2Ba].在gydF4y2Ba萨尼奥gydF4y2BaRAY1在调控束状或圆盘状小花特性方面起重要作用,而RAY2则促进束状小花的腹侧特性。的gydF4y2Baray1.gydF4y2Ba和gydF4y2Baray2.gydF4y2Ba基因属于一个亚科gydF4y2BaTCPgydF4y2Ba基因和gydF4y2Baray2.gydF4y2Ba可能是一个orthologgydF4y2BaGhcyc2.gydF4y2Ba在gydF4y2Bag .矮牵牛gydF4y2Ba[gydF4y2Ba34.gydF4y2Ba].在对向日葵突变体的先前研究中,agydF4y2BaCYCgydF4y2Ba例如基因,gydF4y2Bahacyc2c.gydF4y2Ba,在整个开花中表达,圆盘小花发育了双边对称性[gydF4y2Ba7gydF4y2Ba].因此,在Asteraceae物种中,一些gydF4y2BaCYC2gydF4y2Ba在射线型小花中特异表达的支系基因决定了小花的特性(即射线型小花或圆盘型小花)。例子包括gydF4y2BaGhcyc2.gydF4y2Ba在gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2Bahacyc2d.gydF4y2Ba和gydF4y2Bahacyc2c.gydF4y2Ba在向日葵和gydF4y2Baray1.gydF4y2Ba和gydF4y2Baray2.gydF4y2Ba在gydF4y2Ba寻常魅力gydF4y2Ba.gydF4y2Ba
在早期的研究中,通过对组织切片的分析来研究早期雄蕊的发育和随后的流产gydF4y2Ba非洲菊gydF4y2Ba物种。结果表明:在花盘型小花和射线型小花的雄蕊原基发育早期相似,但随后开始滞后于花盘型小花雄蕊原基的发育。此外,射线小花的雄蕊逐渐败育[gydF4y2Ba29.gydF4y2Ba].然而,关于雷小花中的雄蕊流产的分子机制很少。gydF4y2Ba
前体MRNA(前MRNA)的替代剪接(AS)使得能够产生可以编码各种蛋白质同种型的多种转录物的基因。由于蛋白质产生的改变,替代剪接具有深刻的功能后果。此外,大概可用于增强分子通用性。具体而言,它是影响几乎所有分析的生物学功能的关键基因调节过程。另外,正如基因组的编码势,并且代表了增加较高真核生物的蛋白质组学多样性和功能复杂性的重要转录后调节机制。此外,植物中的常见是常见的[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba].但是,无论gydF4y2BaCYC2gydF4y2Ba- 静物基因受到遗骸未知的影响。gydF4y2Ba
菊花gydF4y2Ba是最受欢迎的观赏作物之一,在世界各地都有种植[gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].主要装饰部分gydF4y2Ba其总黄酮gydF4y2Ba植物是大纲,其典型结构含有形态学上明显的射线和圆盘小花(补充图gydF4y2BaS1gydF4y2Ba).闪光小花,刺痛和Zygomorphic,具有艳丽的花冠(花瓣),缺乏雄蕊。他们的主要功能是吸引粉碎机。中央圆盘小花,径向对称和雌雄同体,具有肥沃的花粉颗粒,主要是繁殖所需的[gydF4y2Ba31.gydF4y2Ba].在这项研究中,一个gydF4y2BaCYC2gydF4y2Ba例如基因,gydF4y2BaCyc2CLgydF4y2Ba,被克隆到了gydF4y2Ba其总黄酮gydF4y2Ba'五顿'。as.gydF4y2BaCyc2CLgydF4y2Ba导致两个不同的转录物(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba),在花芽分化阶段开始后,在顶端芽中产生。在此阶段之前,只有gydF4y2BaCyc2CL-1gydF4y2Ba在顶部芽中产生。此外,gydF4y2BaCyc2CL-2gydF4y2Ba在最终的涉及分化阶段,首先在涉及的组织中表达。随着花芽分化阶段进行,gydF4y2BaCyc2CL-2gydF4y2Ba在容器和Floret Primordia中表达。涉及转基因拟南芥植物的研究表明过表达gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba能抑制雄蕊和花瓣的发育。因此,Cyc2CL可能在菊花的雄蕊败育和花瓣发育中起着重要的调控作用,可能是菊花小花发育的重要调控因子。本研究的结果对阐明菊花射线小花发育的分子机制具有重要意义,并为菊花及其相关品种的育种提供重要的候选基因。gydF4y2Ba
结果gydF4y2Ba
菊花分离gydF4y2BaCYCgydF4y2Ba同源物gydF4y2Ba
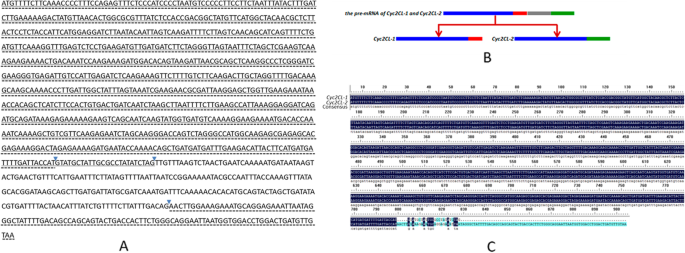
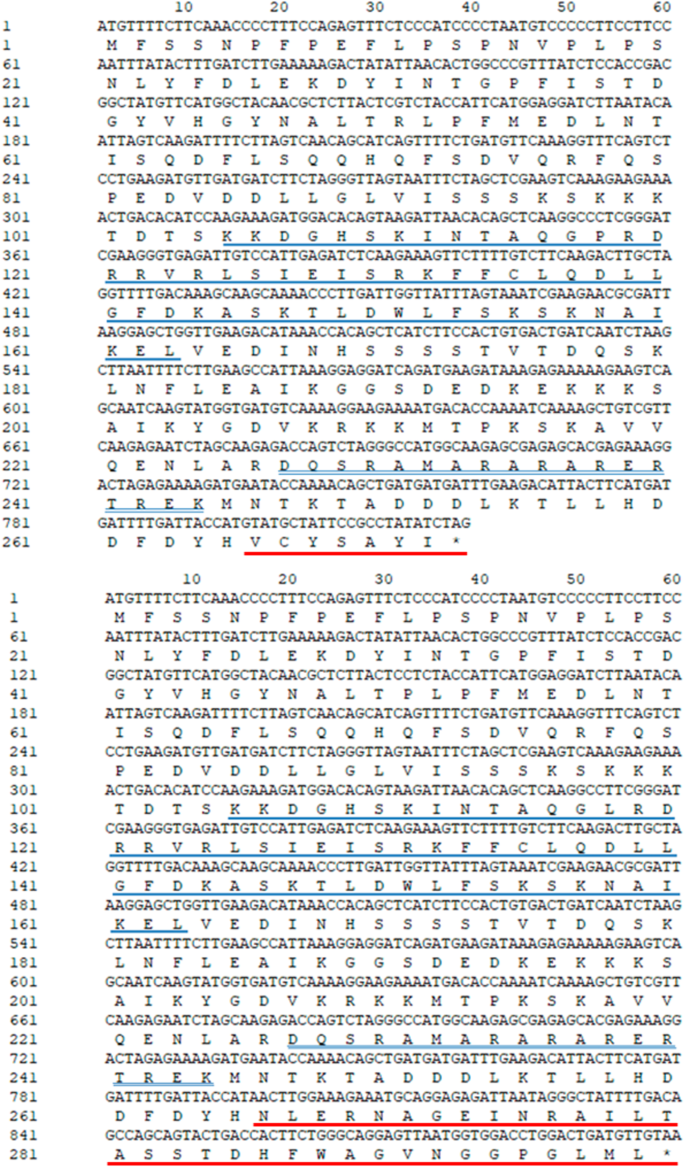
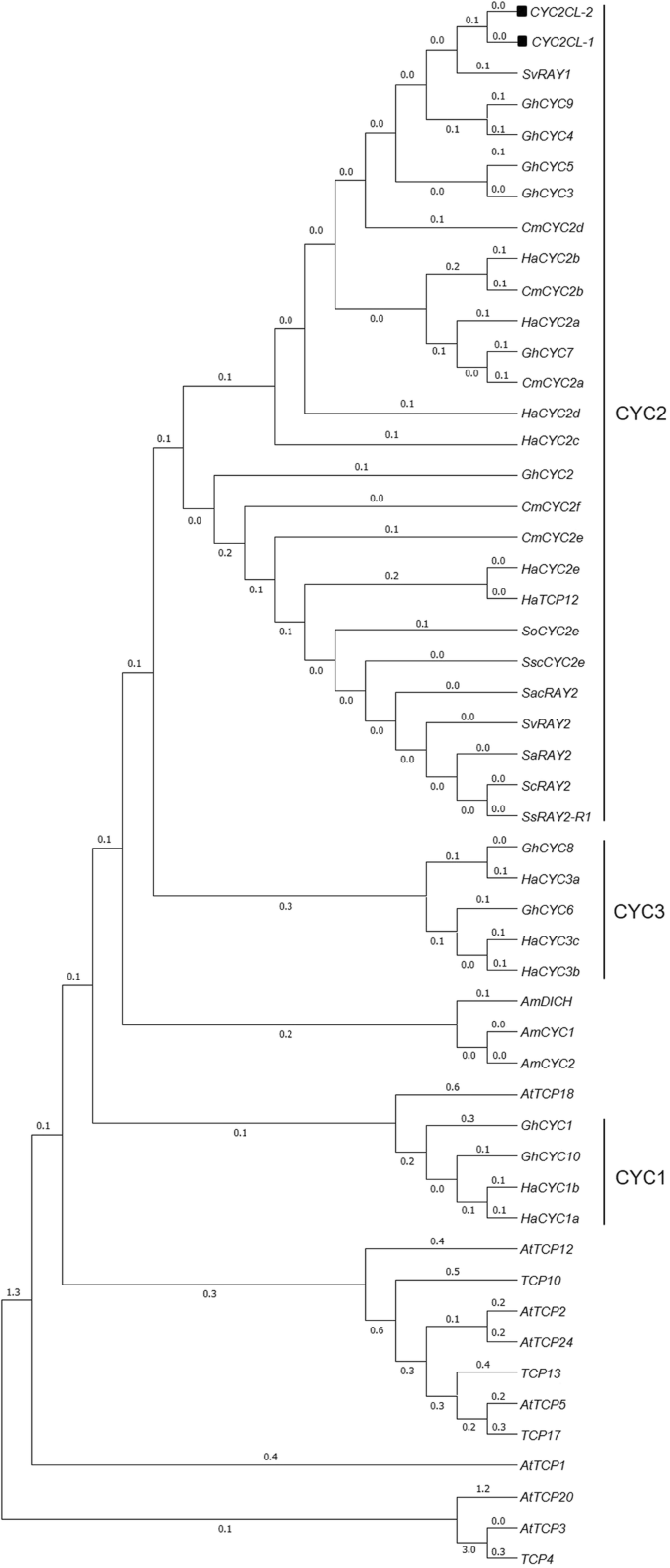
我们孤立前mRNA序列(1146 BP)和两个可选地拼接转录物(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba) 的gydF4y2BaCYCgydF4y2Ba- 麦基基因gydF4y2BaCyc2CLgydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).全长gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba基因组序列也被克隆(补充图gydF4y2BaS2gydF4y2Ba).如图所示。gydF4y2Ba1gydF4y2Bab,剪接变异来自于pre-mRNA转录本,选择性剪接产生两种类型的mRNA。的gydF4y2BaCyc2CL-1gydF4y2Ba外显子序列包含819 bp。关于gydF4y2BaCyc2CL-2gydF4y2Ba,第一个外显子为795 bp,与第一个外显子相似gydF4y2BaCyc2CL-1gydF4y2Ba外显子,而第二外显子由105bp组成,与部分gydF4y2BaCyc2CL-1gydF4y2Ba内含子。的gydF4y2BaCyc2CL-2gydF4y2Ba外显子用内含子序列(246bp)分开。因此,gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba有部分相似的外显子序列,但有不同的内含子序列。剪接位点gydF4y2BaCyc2CL-2gydF4y2Ba外显子和内含子与规范GT-AG接头位点一致,而剪接位点gydF4y2BaCyc2CL-1gydF4y2Ba外显子和内含子是非规范序列[gydF4y2Ba38.gydF4y2Ba].的gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba编码序列分别为819和900bp。编码的CYC2Cl-1和CYC2Cl-2氨基酸序列为89%(图。gydF4y2Ba1gydF4y2BaC)。推导的Cyc2Cl-1和Cyc2Cl-2氨基酸序列包括Cyc / Tb1亚家族成员的保守TCP和R结构域(图。gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).在系统发育分析中,gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba与另一个人聚集了gydF4y2BaCYC2gydF4y2Ba成员gydF4y2Ba其总黄酮gydF4y2Ba还有gydF4y2BaCYC2gydF4y2Ba- 麦基基因gydF4y2BaHelianthus Annuus.gydF4y2Ba,gydF4y2Bag .矮牵牛gydF4y2Ba, 和gydF4y2BaS. Ventgaris.gydF4y2Ba,暗示可能有好几种gydF4y2BaCYC2gydF4y2Ba菊科植物亚支基因复制事件(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
可变剪接的gydF4y2BaCyc2CLgydF4y2Ba在gydF4y2Ba其总黄酮gydF4y2Ba.gydF4y2Ba一个gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Bapre-mRNA序列。的gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba外显子分别用固体和虚线表示。三角形表示拼接位点。gydF4y2BabgydF4y2Ba可变剪接的gydF4y2BaCyc2CLgydF4y2Ba在gydF4y2Ba其总黄酮gydF4y2Ba.蓝杆表示常见的外显子序列gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba.红条和绿条表示gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba, 分别。灰色栏表示内含子序列。gydF4y2BacgydF4y2Ba对齐的gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2BamRNA序列gydF4y2Ba
Cyc蛋白的多序列对准gydF4y2Ba其总黄酮gydF4y2Ba和其他物种。TCP和R域由对齐序列下面的行表示。序列比对中基因的Genbank登录号如下:gydF4y2BaCYC2CL-1gydF4y2Ba(gydF4y2Ba菊花gydF4y2Ba,aiu94285.1),gydF4y2BaCYC2CL-1gydF4y2Ba(gydF4y2Ba其总黄酮gydF4y2BaBAC11907.1),gydF4y2BaGhcyc2.gydF4y2Ba(gydF4y2Ba格伯拉·亨格纳gydF4y2Ba,ACC54347.1),gydF4y2Bahacyc2a.gydF4y2Ba(gydF4y2BaHelianthus Annuus.gydF4y2Ba,abv26442.1),gydF4y2BaHACYC2B.gydF4y2Ba(gydF4y2Bah . annuusgydF4y2Ba,abv26443.1),gydF4y2Bahacyc2c.gydF4y2Ba(gydF4y2Bah . annuusgydF4y2Ba,abv26444.1),gydF4y2Bahacyc2d.gydF4y2Ba(gydF4y2Bah . annuusgydF4y2Ba,abv26445.1),gydF4y2Bahacyc2e.gydF4y2Ba(gydF4y2Bah . annuusgydF4y2Ba,abv26446.1),gydF4y2BaGhcyc3.gydF4y2Ba(gydF4y2Bag .矮牵牛gydF4y2Ba,ACC54348.1),gydF4y2Baghcyc4.gydF4y2Ba(gydF4y2Bag .矮牵牛gydF4y2Ba,ACC54349.1),gydF4y2BaGhcyc5.gydF4y2Ba(gydF4y2Bag .矮牵牛gydF4y2Ba,aex07362.1),gydF4y2BaGhcyc7.gydF4y2Ba(gydF4y2Bag .矮牵牛gydF4y2Ba,aex07364.1),gydF4y2BaGhcyc9.gydF4y2Ba(gydF4y2Bag .矮牵牛gydF4y2Ba,aex07366.1),gydF4y2BaSvRAY1gydF4y2Ba(gydF4y2Ba寻常魅力gydF4y2Ba,ACJ71723.1),和gydF4y2BaSvRAY2gydF4y2Ba(gydF4y2BaS. Ventgaris.gydF4y2Ba,ACJ71727.1)gydF4y2Ba
系统发育树gydF4y2BaCYCgydF4y2Ba基因gydF4y2Ba其总黄酮gydF4y2Ba和其他物种。用于构建系统发育树的基因的GenBank登录号如下:gydF4y2BaGhcyc5.gydF4y2Ba: AEX07362.1,gydF4y2Bahacyc2c.gydF4y2Ba: ABV26444.1,gydF4y2BaGhcyc3.gydF4y2Ba: ACC54348.1,gydF4y2BaGhcyc7.gydF4y2Ba: AEX07364.1,gydF4y2Bahacyc2a.gydF4y2Ba:ABV26442.1,gydF4y2BaSvRAY1gydF4y2Ba:ACJ71723.1,gydF4y2Bahacyc2d.gydF4y2Ba:ABV26445.1,gydF4y2BaGhcyc9.gydF4y2Ba:AEX07366.1,gydF4y2Baghcyc4.gydF4y2Ba:ACC54349.1,gydF4y2BaGhcyc2.gydF4y2Ba:ACC54347.1,gydF4y2BaSvRAY2gydF4y2Ba: ACJ71727.1,gydF4y2Bahacyc2e.gydF4y2Ba: ABV26446.1,gydF4y2BaHACYC2B.gydF4y2Ba: ABV26443.1,gydF4y2BaCYC2CL-1gydF4y2Ba23438.1:计算机辅助设计,gydF4y2BaCYC2CL-2gydF4y2Ba:AAK21248.1,gydF4y2Bacmcyc2a.gydF4y2Ba:Ku595430.1,gydF4y2BaCMCYC2B.gydF4y2Ba:Ku595431.1,gydF4y2Bacmcyc2d.gydF4y2Ba: KU595426.1,gydF4y2Bacmcyc2e.gydF4y2Ba:Ku595427.1,gydF4y2Bacmcyc2f.gydF4y2Ba:Ku595429.1,gydF4y2BaGhCYC10gydF4y2Ba:AEX07367.1,gydF4y2BaGhcyc1.gydF4y2Ba:ACC54346.1,gydF4y2Bahacyc1b.gydF4y2Ba:ABV26441.1,gydF4y2Bahacyc1a.gydF4y2Ba:ABV26440.1,gydF4y2Bahacyc3a.gydF4y2Ba:ABV26447.1,gydF4y2BaGhcyc8.gydF4y2Ba:AEX07365.1,gydF4y2BaGhcyc6.gydF4y2Ba:AEF59025.1,gydF4y2BaGhcyc8.gydF4y2Ba:AEX07365.1,gydF4y2BaGhcyc6.gydF4y2Ba:AEX07363.1,gydF4y2Bahacyc3c.gydF4y2Ba: ABV26449.1,gydF4y2Bahacyc3b.gydF4y2Ba: ABV26448.1,gydF4y2Baamdich.gydF4y2Ba: AAF12817.1,gydF4y2BaAmcyc1.gydF4y2Ba: Q9SBV9.1,gydF4y2BaAmcyc2.gydF4y2Ba: O49250.1,gydF4y2Baattcp3.gydF4y2Ba:AEE32909.1,gydF4y2Baattcp5.gydF4y2Ba:AED97405.1,gydF4y2Baattcp2.gydF4y2Ba: AEE84040.1,gydF4y2BaAtTCP24gydF4y2Ba:AEE31193.1,gydF4y2BaAtTCP20gydF4y2Ba:AEE77254.1,gydF4y2BaAtTCP18gydF4y2Ba: OAP04988.1,gydF4y2Baattcp1.gydF4y2Ba: OAP12772.1,gydF4y2BaAtTCP12gydF4y2Ba: AEE34841.1,gydF4y2Baattcp4.gydF4y2Ba:EU550941.1,gydF4y2BaAtTCP10gydF4y2Ba:EU550953.1,gydF4y2BaAtTCP13gydF4y2Ba: XP_020886906.1,gydF4y2BaAtTCP17gydF4y2Ba: NM_001342977,gydF4y2BaSscCYC2egydF4y2Ba:gydF4y2BaMG593448gydF4y2Ba.gydF4y2Ba1gydF4y2Ba,gydF4y2BaSocyc2e.gydF4y2Ba: MG593440.1,gydF4y2Ba克拉克拉gydF4y2Ba: JQ351921.1,gydF4y2BaSacray2.gydF4y2Ba:JQ351929.1,gydF4y2BaSaRAY2gydF4y2Ba: JQ351911.1,gydF4y2BaSsRAY2-R1gydF4y2Ba:FJ356704.1和gydF4y2BaHatcp12.gydF4y2Ba:XP_022034966.1.gydF4y2Ba
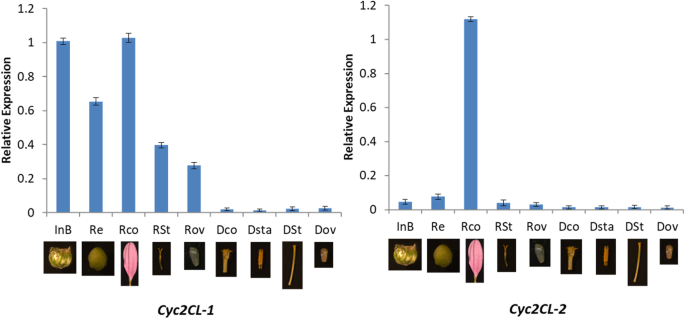
菊花的表达分析gydF4y2BaCYCgydF4y2Ba同源物gydF4y2Ba
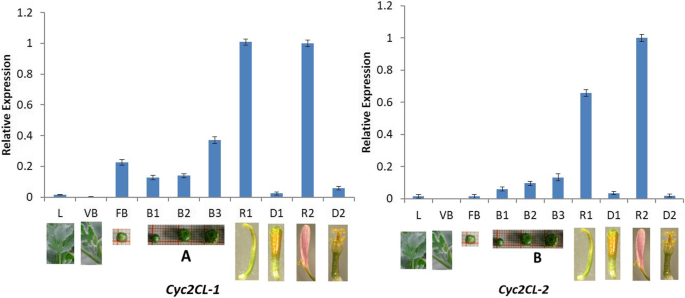
进行定量实时聚合酶链反应(QRT-PCR)测定以分析表达水平gydF4y2BaCYCgydF4y2Ba类似基因在菊花的花部分。相对较低的gydF4y2BaCyc2CL-1gydF4y2Ba在叶子和植物芽中检测到表达水平,而gydF4y2BaCyc2CL-2gydF4y2Ba在营养芽中表达不明显(图。gydF4y2Ba5gydF4y2Ba).在菊花花蕾发育过程中gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba表达量有增加的趋势。此外,gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在射线小花中表达量高,而在圆盘小花中表达量低。这些结果表明gydF4y2BaCyc2CL-2gydF4y2Ba在营养芽中没有表达,但是在开始花芽分化时表达。各种花组中基因表达模式的分析显示gydF4y2BaCyc2CL-1gydF4y2Ba在射线小花的花冠、总苞片和花托中表达量较高,在雌蕊(柱头、花柱和子房)中表达量相对较高。gydF4y2Ba6gydF4y2Ba).相比之下,gydF4y2BaCyc2CL-2gydF4y2Ba主要表达于射线小花的花冠。两个都gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在花盘小花组织中表达量极低,包括花冠、雄蕊和雌蕊(柱头、花柱和子房)(图。gydF4y2Ba6gydF4y2Ba).因此,这两个gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba主要表达于花的生殖器官,弱表达于营养器官。这与之前的调查结果一致gydF4y2Ba非洲菊gydF4y2Ba物种和向日葵[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
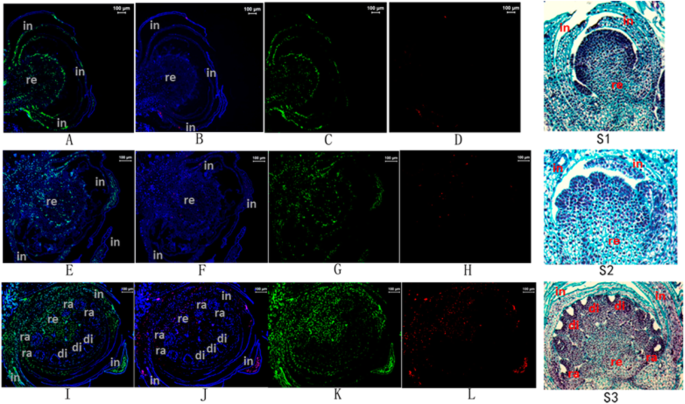
标记的原位杂交(鱼类)分析的荧光分析gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2BaRNA表示gydF4y2BaCyc2CL-2gydF4y2Ba在总苞分化的最后阶段,总苞组织中表达量低(图。gydF4y2Ba7gydF4y2BaB,D)。在Floret Primordia分化阶段,gydF4y2BaCyc2CL-2gydF4y2Ba在多种组织中表达,包括包含的含量,容器和Floret Primordia。在花冠形成阶段,遵循花芽分化阶段,gydF4y2BaCyc2CL-2gydF4y2Ba在花序组织中高度表达。在鱼类测定阴性对照中不可检测到荧光,其中有感应探针gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba使用RNA(补充图gydF4y2Ba3.gydF4y2Ba).因此,gydF4y2BaCyc2CL-2gydF4y2Ba在花芽分化阶段,也在其他组织中表达。qRT-PCR数据证实,在花芽分化阶段之前,gydF4y2BaCyc2CL-2gydF4y2Ba没有表达。但是,不像gydF4y2BaCyc2CL-2gydF4y2Ba,gydF4y2BaCyc2CL-1gydF4y2Ba在相对较高的水平的所有花序组织中表达。gydF4y2Ba
标记的原位杂交图像的荧光gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba花序中的RNA。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-1gydF4y2Ba在最终的包含分化阶段期间RNA。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-2gydF4y2Ba在最终的包含分化阶段期间RNA。gydF4y2BaS1gydF4y2Ba:花蕾总苞分化终期的石蜡切片图像。gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-1gydF4y2Ba在Floret Primordia分化阶段的RNA。gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-2gydF4y2Ba在Floret Primordia分化阶段的RNA。gydF4y2BaS2gydF4y2Ba:小花原基分化时期花芽的石蜡切片图像。gydF4y2Ba我gydF4y2Ba,gydF4y2BakgydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-1gydF4y2Ba在花冠形成阶段的RNA。gydF4y2BajgydF4y2Ba,gydF4y2BalgydF4y2Ba标记的鱼形象gydF4y2BaCyc2CL-2gydF4y2Ba在花冠形成阶段的RNA。gydF4y2BaS3gydF4y2Ba:花冠形成时期花蕾的石蜡切片。花序组织用DAPI染色(蓝色)。RNA探针gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba以绿色和红色表示。在:意味着;回复:容器;ra:ray floret;和迪:圆盘小花gydF4y2Ba
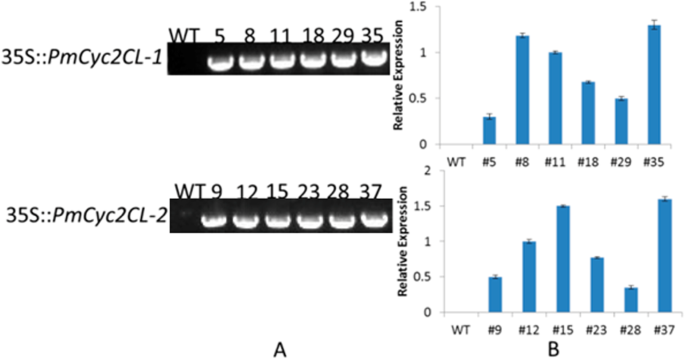
菊花的形态效应gydF4y2BaCYCgydF4y2Ba转基因拟南芥中的同源物gydF4y2Ba
分别表达的两个构建体gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在35S启动子控制下(35S::gydF4y2BaCyc2CL-1gydF4y2Ba和35s ::gydF4y2BaCyc2CL-2gydF4y2Ba)根据花卉浸渍方法插入拟南芥中,导致42和48个独立的35s ::gydF4y2BaCyc2CL-1gydF4y2Ba和35s ::gydF4y2BaCyc2CL-2gydF4y2Ba植物,分别。与野生型拟南芥相比,大部分转基因拟南芥植株生长较弱,很多幼苗死亡(补充图)gydF4y2Ba4gydF4y2Ba).随机选取6个转基因植株进行转基因表达水平的测定gydF4y2BaCyc2CL-1gydF4y2Ba-overexpressing (OE)和gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥系采用qRT-PCR分析(图1)。gydF4y2Ba8gydF4y2Ba).的六个gydF4y2BaCyc2CL-1gydF4y2Ba-eoe线,最高和最低gydF4y2BaCyc2CL-1gydF4y2Ba在第35行和#5中检测表达水平。在六个中gydF4y2BaCyc2CL-2gydF4y2Ba-eoe线,最高和最低gydF4y2BaCyc2CL-2gydF4y2Ba分别在#37和#28中检测表达水平(图。gydF4y2Ba8gydF4y2Ba).基因表达数据证实了这一点gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在转基因拟南芥(Figs。gydF4y2Ba9gydF4y2Ba和gydF4y2Ba10.gydF4y2Ba).根据gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba表达水平,gydF4y2BaCyc2CL-1gydF4y2Ba-OE拟南芥系#35和#8以及gydF4y2BaCyc2CL-2gydF4y2Ba选择-OE拟南芥系#37和#15进行表型分析。在分析gydF4y2BaCyc2CL-1gydF4y2Baoe和gydF4y2BaCyc2CL-2gydF4y2Ba- 奥拟南芥线,雄蕊中止,花瓣非常短或不存在,而雌蕊和萼片是正常的。此外,野生型植物有六个雄蕊,但是gydF4y2BaCyc2CL-1gydF4y2Ba- Ooe Arabidopsis植物只生产了两个雄蕊中止并缺乏花粉颗粒(图。gydF4y2Ba9gydF4y2Bae).野生型拟南芥有4个花瓣,这与野生型拟南芥的花瓣发育受到抑制形成鲜明对比gydF4y2BaCyc2CL-1gydF4y2Baoe拟南芥植物。在审查中gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥系,花瓣生长,但明显短于野生型,表明花瓣发育受到严重抑制gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥系(图。gydF4y2Ba10.gydF4y2Bae).类似于gydF4y2BaCyc2CL-1gydF4y2Ba- 奥拟南芥线,gydF4y2BaCyc2CL-2gydF4y2Ba- 奥拟南芥系列产生了两个中止和缺乏花粉颗粒的雄蕊。另外,在该过程中检测到正常的雌蕊和萼片gydF4y2BaCyc2CL-2gydF4y2Baoe拟南芥植物。因此,gydF4y2BaCyc2CL-1gydF4y2Baoe和gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥株系表型相似。在这两种株系中,花瓣和雄蕊发育异常,雄蕊流产,导致花粉产量减少。然而,雌蕊和萼片在gydF4y2BaCyc2CL-1gydF4y2Baoe和gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥系发育正常。对功能描述gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba关于它们对土生物的抑制作用gydF4y2BaTCPgydF4y2Ba基因,qRT-PCR分析完成比较gydF4y2BaTCP2.gydF4y2Ba,gydF4y2BaTCP3.gydF4y2Ba,gydF4y2BaTCP4.gydF4y2Ba,gydF4y2BaTCP10gydF4y2Ba, 和gydF4y2BaTCP24gydF4y2Ba野生型拟南芥植物和转基因植物之间的表达水平,用于随后对表型分析的[gydF4y2Ba27.gydF4y2Ba].结果表明,这些基因在野生型和转基因拟南芥植株中表达相似(补充图)gydF4y2Ba5gydF4y2Ba).这些结果暗示Cyc2Cl-1和Cyc2Cl-2对于雄蕊和花瓣发育很重要,但对转基因拟南芥植物中的雌蕊和萼片发育没有影响。gydF4y2Ba
拟南芥植物的表型过表达gydF4y2BaCyc2CL-1gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba野生型花。gydF4y2BabgydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-1gydF4y2Ba.雌蕊和萼片正常增长。gydF4y2BacgydF4y2Ba过表达拟南芥的花序gydF4y2BaCyc2CL-1gydF4y2Ba.花序具有正常的雌蕊和萼片,但花瓣和雄蕊不会正常生长。gydF4y2BadgydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-1gydF4y2Ba.花瓣和雄蕊发育受到抑制。gydF4y2BaegydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-1gydF4y2Ba除去萼片后。花瓣在这朵花中没有发展。耻辱是正常的,但雄蕊中止了。gydF4y2BafgydF4y2Ba拟南芥植物overexpressinggydF4y2BaCyc2CL-1gydF4y2Ba
拟南芥植物的表型过表达gydF4y2BaCyc2CL-2gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba野生型花。gydF4y2BabgydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-2gydF4y2Ba.雌蕊和萼片正常增长。gydF4y2BacgydF4y2Ba过表达拟南芥的花序gydF4y2BaCyc2CL-2gydF4y2Ba.花序具有正常的雌蕊和萼片,但花瓣和雄蕊不会正常生长。gydF4y2BadgydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-2gydF4y2Ba.花瓣和雄蕊发育受到抑制。gydF4y2BaegydF4y2Ba拟南芥植物过度表达的花gydF4y2BaCyc2CL-2gydF4y2Ba在萼片被移除之后。花瓣异常短。耻辱是正常的,但雄蕊中止了。gydF4y2BafgydF4y2Ba拟南芥植物overexpressinggydF4y2BaCyc2CL-2gydF4y2Ba
讨论gydF4y2Ba
选择性剪接的发现gydF4y2BaCyc2CLgydF4y2Ba这是揭示菊花鳐花发育的微妙分子机制的重要一步gydF4y2Ba
Asteraceae雷福特发育的遗传控制gydF4y2Ba
先前的研究涉及gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2BaS. Ventgaris.gydF4y2Ba, 和gydF4y2Bah . annuusgydF4y2Ba表示一些人gydF4y2BaCYC2gydF4y2Ba在Ray Florets中专门表达的CLADE基因决定了射线或圆盘小花的生产。最初是花卉对称性的监管机制的特征gydF4y2Ba答:majusgydF4y2Ba.两个部分冗余gydF4y2BaCYC2gydF4y2Ba假字,gydF4y2BaCYCgydF4y2Ba和gydF4y2Ba你gydF4y2Ba,确定花的背部身份,并控制花瓣和雄蕊螺纹中的Zygomorphy(单摩尔摩)的建立[gydF4y2Ba32.gydF4y2Ba,gydF4y2Ba33.gydF4y2Ba].最近有一项重要的研究专注于监管职能gydF4y2BaCYCgydF4y2Ba- 影响Asteraceae,Leguminosae,Gesneriaceae和其他植物家族的Zygomorphic花的基因。gydF4y2Ba
在奥斯特科伊,gydF4y2BaCYCgydF4y2Ba类基因包括在gydF4y2BaCYC1gydF4y2Ba,gydF4y2BaCYC2gydF4y2Ba, 和gydF4y2BaCYC3gydF4y2Ba亚克士。功能研究证实了这一点gydF4y2BaCYCgydF4y2Ba类基因在控制器官生长方面很重要,在细胞增殖和/或扩张中都是积极和消极的调节因子[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba46.gydF4y2Ba].一些研究已经证实了这一点gydF4y2BaCYCgydF4y2Ba同源基因在控制花瓣生长中起着保守的作用,它们表达域的变化决定了是左右对称的花还是辐射对称的花[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba33.gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba].在gydF4y2BaS. Ventgaris.gydF4y2Ba,gydF4y2Bah . annuusgydF4y2Ba, 和gydF4y2Bag .矮牵牛gydF4y2Ba, CYC作为花对称调节因子,在决定小花在头状花序内的特征(即圆盘小花或射线小花)中起着关键作用[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].重复事件大大增加了多样性gydF4y2BaCYC2gydF4y2Ba菊科的分支基因。另外,6,6,和5gydF4y2BaCYC2gydF4y2Ba已识别出来的CLADE基因gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2BaS. Ventgaris.gydF4y2Ba, 和gydF4y2Bah . annuusgydF4y2Ba, 分别。一些gydF4y2BaCYC2gydF4y2Ba在射线小花中特异表达的类基因是形成射线小花所必需的。例如,在gydF4y2Bah . annuusgydF4y2Ba,两个gydF4y2Bahacyc2c.gydF4y2Ba和gydF4y2Bahacyc2d.gydF4y2Ba是在射线小花中特别表现出来的。在gydF4y2Bag .矮牵牛gydF4y2Ba, 的gydF4y2BaCYC2gydF4y2Ba例如基因,gydF4y2BaGhcyc2.gydF4y2Ba,gydF4y2BaGhcyc3.gydF4y2Ba,gydF4y2Baghcyc4.gydF4y2Ba,gydF4y2BaGhcyc5.gydF4y2Ba, 和gydF4y2BaGhcyc9.gydF4y2Ba在Ray / Trans Floret中特别表达[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].以前的调查显示过度表达gydF4y2BaGhcyc2.gydF4y2Ba在转基因素中导致光盘小花,具有雷小花的特征[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba].同样,在gydF4y2BaS. Ventgaris.gydF4y2Ba,两个gydF4y2BaCYC2gydF4y2Ba思工基因,gydF4y2Baray1.gydF4y2Ba和gydF4y2Baray2.gydF4y2Ba,也特别是在雷小花中表达,两种基因都介绍了射线或圆盘小花的发展[gydF4y2Ba26.gydF4y2Ba].因此,以往的研究gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2BaS. Ventgaris.gydF4y2Ba, 和gydF4y2Bah . annuusgydF4y2Ba表示一些人gydF4y2BaCYC2gydF4y2Ba在Ray Florets中专门表达的思科基因确定了射线或圆盘小花的生产。这些基因包括gydF4y2BaGhcyc2.gydF4y2Ba在gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2Bahacyc2d.gydF4y2Ba和gydF4y2Bahacyc2c.gydF4y2Ba在gydF4y2Bah . annuusgydF4y2Ba, 和gydF4y2Baray1.gydF4y2Ba和gydF4y2Baray2.gydF4y2Ba在gydF4y2BaS. Ventgaris.gydF4y2Ba.gydF4y2Ba
鉴定gydF4y2BaCYC2gydF4y2Ba进化枝基因(gydF4y2BaCyc2CLgydF4y2Ba)及其两份转录物(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)表现为射线小花和圆盘小花gydF4y2Ba
在这项研究中,一个菊花gydF4y2BaCYC2gydF4y2Ba例如基因(gydF4y2BaCyc2CLgydF4y2Ba)它的两个可选择拼接转录物(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)被揭示了。as.gydF4y2BaCyc2CLgydF4y2Ba在花芽分化阶段在花芽顶端开始。qRT-PCR基因表达分析证明,在营养生长阶段,gydF4y2BaCyc2CL-1gydF4y2Ba是在低水平表达的,然而gydF4y2BaCyc2CL-2gydF4y2Ba不表达。因此,gydF4y2BaCyc2CLgydF4y2Ba在营养生长期期间也不拼接。然而,花芽分化阶段的开始导致上调gydF4y2BaCyc2CL-1gydF4y2Ba表达水平以及诱导gydF4y2BaCyc2CL-2gydF4y2Ba表达,但水平较低。在随后的芽发育阶段,gydF4y2BaCyc2CL-1gydF4y2Ba表达最初下调,但随后逐渐增加,因为所发育的芽(图。gydF4y2Ba5gydF4y2Ba).类似地,gydF4y2BaCyc2CL-2gydF4y2Ba随着芽的发展,表达水平也增加。当花朵绽放,gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在光线小花中最受表达,而它们在圆盘小花中弱食。因此,在花芽分化阶段的某些时候,gydF4y2BaCyc2CLgydF4y2Ba或者拼接以产生gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba.gydF4y2Ba
据信菊花花芽分化均包括枝尖端阶段,初始和最终的含有分化阶段,初始和最终的小型小型分化阶段,以及花冠形成阶段[gydF4y2Ba30.gydF4y2Ba].在本研究中,进行了鱼标分析gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba进行RNA以鉴定截图的特定发育阶段和组织gydF4y2BaCyc2CLgydF4y2Ba被开始生产gydF4y2BaCyc2CL-2gydF4y2Ba.我们检测到低gydF4y2BaCyc2CL-2gydF4y2Ba在最终的包含阶段的诱导过程中的表达水平(图。gydF4y2Ba7gydF4y2BaB,D)。在随后的Floret Primordia分化阶段,gydF4y2BaCyc2CL-2gydF4y2Ba除了涉及组织之外,在容器和Floret Primordia中表达(图。gydF4y2Ba7gydF4y2Baf, h)。在花冠形成阶段,gydF4y2BaCyc2CL-2gydF4y2Ba在花序组织中高表达(图。gydF4y2Ba7gydF4y2Baj, l)。因此,我们确定gydF4y2BaCyc2CL-2gydF4y2Ba首先在花芽分化阶段的其他组织中制备。gydF4y2Ba
我们的QRT-PCR分析证实了gydF4y2BaCyc2CLgydF4y2Ba在花芽分化阶段开始,导致生产gydF4y2BaCyc2CL-2gydF4y2Ba.随着芽体的发育gydF4y2BaCyc2CL-2gydF4y2Ba表达水平增加。这些结果与FISH分析的结果一致。此外,gydF4y2BaCyc2CL-1gydF4y2Ba在所有花序组织中均有表达,且高于gydF4y2BaCyc2CL-2gydF4y2Ba.在向日葵,gydF4y2Bahacyc2c.gydF4y2Ba在雷花朵和管状花卉生殖器官中表达,包括雄蕊,耻辱,风格和卵巢[gydF4y2Ba43.gydF4y2Ba].但是,与...不同gydF4y2BaCYC2gydF4y2Ba特异性表达的CLADE基因gydF4y2Bag .矮牵牛gydF4y2Ba,gydF4y2Bah . annuusgydF4y2Ba, 和gydF4y2BaS. Ventgaris.gydF4y2Ba雷福特,两者gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在圆盘小组组织中弱表达。gydF4y2Ba
两个都gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba可能对调节雄蕊和花瓣的生长很重要gydF4y2Ba
在菊花中,外层射线小花在花瓣类型和内层圆盘小花具有不同的方向。另外,Floret类型的布置和组合确定了Daedal Capitula类型。此外,花头类型和花瓣类型独立发展。因此,在特定类型的花头中存在不同的花瓣类型。菊花花瓣和花头类型的复杂性表示涉及的特征分子机制gydF4y2BaCYCgydF4y2Ba疏片监管机构。黄等人。[gydF4y2Ba22.gydF4y2Ba]克隆六gydF4y2BaCYC2gydF4y2Ba两个菊花品种的FgydF4y2Ba1gydF4y2Ba后代。他们观察到这一点gydF4y2BaCYC2gydF4y2Bagene-overexpressinggydF4y2Ba菊花Lavandulifolium.gydF4y2Ba线状,部分反式小花花瓣较短,雄蕊异常,形态与射线小花相似[gydF4y2Ba22.gydF4y2Ba].陈等。[gydF4y2Ba8gydF4y2Ba]分析了六个gydF4y2BaCYC2gydF4y2Ba一些钙科般物种中的基因并评估了效果gydF4y2BaCLCYC2D.gydF4y2Ba超表达在gydF4y2Bac . lavandulifoliumgydF4y2Ba.他们证明了构成表达的表达gydF4y2BaCLCYC2D.gydF4y2Ba在雷福特发展期间抑制花冠增长[gydF4y2Ba8gydF4y2Ba].因此,gydF4y2BaCYCgydF4y2Ba基因可能具有多种功能,其编码的蛋白质可能相互作用以调控菊花小花的发育。gydF4y2Ba
表型分析gydF4y2BaCyc2CL-1gydF4y2Baoe和gydF4y2BaCyc2CL-2gydF4y2Ba- 拟南芥系核实雄蕊被中止,并且花瓣非常短或不存在,与正常的雌蕊和萼片相反。替代剪接可导致来自单个基因的多个mRNA的产生,从而增加高真核生物的蛋白质组学多样性。它也是调节在高等植物生长和发展过程中基因表达的重要机制[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba].这里呈现的数据意味着gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba可能发挥与雄蕊和花瓣生长相关的关键监管角色。gydF4y2Ba
观察到的抑制作用gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba雄蕊和花瓣生长的表达与先前研究的结果一致。在gydF4y2Ba答:majusgydF4y2Ba,两个gydF4y2BaCYCgydF4y2Ba和gydF4y2Ba你gydF4y2Ba在年轻花卉公司的背面表示,从而延缓花瓣和雄蕊生长。在稍后阶段,gydF4y2BaCYCgydF4y2Ba在整个背侧区域表达,促进花瓣叶生长,抑制雄蕊发育[gydF4y2Ba33.gydF4y2Ba].在gydF4y2BaPrimulina heterotrichagydF4y2Ba,当鲜花在花卉发育期间有多叶,两个gydF4y2BaCYC2gydF4y2Ba思工基因,gydF4y2BaCYC1CgydF4y2Ba和gydF4y2BaCyc1d.gydF4y2Ba,高表达于背瓣和背侧雄蕊。此外,大量转录gydF4y2BaCYC1CgydF4y2Ba在晚期开发阶段的横向雄蕊中,与背部和侧向雄蕊的流产有关。两个都gydF4y2BaCYC1CgydF4y2Ba和gydF4y2BaCyc1d.gydF4y2Ba可以调节背部瓣尺寸的减少和背侧/侧向雄蕊的流产[gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba].Fabio等人。确认了gydF4y2Bah . annuusgydF4y2Ba,gydF4y2Ba的地盘gydF4y2Ba和gydF4y2Ba欣赏gydF4y2Ba这些基因是建立花盘花和射线花花冠对称的关键,但也影响心皮和雄蕊的发育。此外,功能缺失突变gydF4y2BaCYCgydF4y2Ba据报道,基因导致雌雄同体管状的雷小花,取代正常的无菌雷小花[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba].另一项研究表明gydF4y2BaCYCgydF4y2Ba- 般的基因有助于调节雄蕊和查克分化,可能通过它们与控制细胞周期和花器官标识的基因相关[gydF4y2Ba15.gydF4y2Ba].在gydF4y2Bag .矮牵牛gydF4y2Ba,异位过度表达gydF4y2BaGhcyc2.gydF4y2Ba破坏雄蕊的发育,导致圆盘花获得扩大和明显融合的花瓣[gydF4y2Ba2gydF4y2Ba].gydF4y2Ba
nag等人。[gydF4y2Ba36.gydF4y2Ba]证实了表达的gydF4y2BaTCP4.gydF4y2Ba(即,必须适当地控制miR319a的关键目标,以确保正常的花瓣和雄蕊开发,高gydF4y2BaTCP4.gydF4y2Ba表达水平破坏拟南芥的花瓣和雄蕊发育。异位表达gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba同样抑制花瓣和雄蕊的发育。因此,CYC和TCP靶基因在菊花和拟南芥中可能是保守的。gydF4y2Ba
潜在的分子机制gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba功能还有待揭示gydF4y2Ba
我们确定了一个gydF4y2BaCYC2gydF4y2Ba进化枝基因(gydF4y2BaCyc2CLgydF4y2Ba)及其两份转录物(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)并评估该基因在拟南芥中该基因的异位表达对功能表征的影响gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba.然而gydF4y2BaCyc2CL-1gydF4y2Baoe和gydF4y2BaCyc2CL-2gydF4y2Ba-OE拟南芥株系表型相似,但在转基因拟南芥植株中,这两个转录本的功能差异并不明显,可能是由于菊花和拟南芥在花的类型和分子机制方面存在巨大差异。菊花有一个头状花序,由双侧(左右对称)的射线小花和径向(辐射对称)的圆盘小花组成,而拟南芥只产生一种放射状的花。此外,菊花的基因调控机制比拟南芥更为复杂。的调节功能gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba不能完全基于转基因拟南芥植物的表型变化进行彻底分析。因此,我们无法阐明基础的精确分子机制gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba功能。未来的调查应该检查过度表达和沉默的后果gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在菊花中阐明调节功能gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba与射线小花的发育有关。此外,我们的qRT-PCR分析显示gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba花冠区域和鲜花的生殖器官的表达水平,但表达这些基因的精确花器官区域应在未来的研究中原位RNA杂交确定。还应进行与Cyc2Cl-1和Cyc2Cl-2相互作用的蛋白质的分析以及下游靶基因,以提供对菊花中的雷福特发育的分子机制的新见解。gydF4y2Ba
方法gydF4y2Ba
植物材料和RNA提取gydF4y2Ba
本研究中使用的个体植物均来自组织培养来自菊花品种的杂交种(即,gydF4y2Ba其总黄酮gydF4y2Ba‘芬丹’,这是一种地被菊花品种)。本实验在北京林业大学温室(116.3°E, 40.0°N)进行长日照条件(16小时光照/8小时黑暗)180天,然后在24±1℃的短日照条件(8小时光照/16小时黑暗)下进行培养。在长日照条件下,大约100个营养芽的收获时间为上午9:00-12:00。当植物第一次暴露在短日照条件下时,每周上午9:00-12:00采收约100个顶芽,直到可见花芽形成,之后每周上午9:00-12:00采收100个花芽,直到射线小花形成可见颜色。一些收获的植物组织立即被放入液氮中,并在−70°C保存,以备随后的RNA提取步骤。对其他植物组织进行处理并进行FISH分析。用RNeasy Plant Mini Kit (Qiagen,北京,中国)提取总RNA。用NanoDrop ND2000分光光度计测定提取的RNA的数量和质量。gydF4y2Ba
隔离gydF4y2Ba菊花CYC2gydF4y2Ba基因和系统发育树木的构建gydF4y2Ba
特异性的简并引物gydF4y2BaCYC2gydF4y2Ba基因(表格gydF4y2Ba1gydF4y2Ba)是基于的gydF4y2BaCYC2gydF4y2BaNCBI数据库中的同源物[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].用3'和5'族CDNA扩增试剂盒(Takara,Japan)获得全长cDNA序列。用DNAsecure Plant Kit(天根,北京,中国)从收获的组织中提取总DNA。用RNAPREP纯试剂盒(植物)(天根)从菊花植物中提取总RNA。通过PCR扩增靶序列,其在50μl包含2μLcDNA(40ng)的50μl的最终反应体积中完成,0.4μlAQDNA聚合酶(Promega),1μl前底漆(10μm),1μl反向引物(10μm),5μl10×PCR缓冲液(Promega),1μLDNTP(10mm),3μlMgClgydF4y2Ba2gydF4y2Ba(25 mM), ddH 36.6 μlgydF4y2Ba2gydF4y2BaO. PCR条件为:94℃,5 min;30个循环94°C 30 s, 58°C 30 s, 72°C 1分钟;72°C 10分钟。将扩增的基因序列与pMD18-T载体连接并插入gydF4y2Ba大肠杆菌gydF4y2BaDH5α细胞,之后通过测序验证插入的片段的精度。的gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在Genbank数据库中沉积了编码序列(登录号:KP696775.1和KP696776.1)。我们获得了gydF4y2BaCYCgydF4y2Ba类似NCBI数据库中的序列。MEGA程序(版本10)[gydF4y2Ba28.gydF4y2Ba[基于涉及基于JTT矩阵的模型的最大似然方法,用于构建系统发育树[gydF4y2Ba23.gydF4y2Ba].gydF4y2Ba
QRT-PCR测定中的基因表达分析gydF4y2Ba
两种转录物的丰富(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)在QRT-PCR测定中研究了不同发育阶段的菊花,用Pikoreal实时PCR系统(Thermo Fisher Scientific,Germany)完成。分析这一点gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在不同发育阶段的茎尖和芽的表达模式中,我们采集了营养芽(即营养生长期的顶端芽)、花芽(横切直径约2 mm)和花发育阶段的芽(第一阶段:芽横切直径约3 mm;第二阶段:芽横切直径约5 mm;第三阶段:芽横切直径约6 ~ 7 mm,外束小花可见颜色;无花果。gydF4y2Ba5gydF4y2Ba).分析这一点gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba在不同花卉发育阶段的雷和圆盘小花中的表达模式,我们在早期和全开花阶段收集了射线和圆盘小花。在早期的阶段,颜色在光线和圆盘小花中可检测到。在完整的开花阶段,雷和圆盘小花绽放。此外,分析gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba采集了射线小花的总苞片、花托、花冠和雌蕊(柱头、花柱和子房),以及圆盘小花的花冠、雄蕊和雌蕊(柱头、花柱和子房)。gydF4y2Ba6gydF4y2Ba).收集野生型和转基因拟南芥植物的叶子分析gydF4y2BaCYC2gydF4y2Ba和gydF4y2BaTCPgydF4y2Ba基因表达水平。我们为每个组织收集了三次生物学重复。QRT-PCR与Sybr Premix EXQ(Takara)和Pikoreal实时PCR系统(Thermo Fisher Scientific)完成。每种反应在含有2μL的2μL的含量为20μl的含量为2μL的第一链cDNA中制备每种反应。QRT-PCR条件如下:95°C为30秒;40循环为95°C,5秒,最佳退火温度为30 s,60°C为30秒。的gydF4y2Ba其总黄酮gydF4y2Ba蛋白磷酸酶2A基因(gydF4y2BaPP2AcsgydF4y2Ba)作为内参基因。qRT-PCR引物详细见表gydF4y2Ba2gydF4y2Ba.拟南芥特异的QRT-PCR引物gydF4y2BaTCPgydF4y2Ba基因列于补充表gydF4y2Ba1gydF4y2Ba.QRT-PCR测定以三种生物重复完成,每次重复中都会在三份中分析样品。gydF4y2Ba
载体构建与拟南芥转化gydF4y2Ba
全长gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba用基因特异性引物通过PCR扩增cDNA序列(表gydF4y2Ba3.gydF4y2Ba).将扩增子插入PGEM-T载体(Promega)中,之后通过测序确认插入的片段的精度。的gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba然后用限制酶消化序列并将其亚克隆到Pcambia1304中并改性Pcambia1304载体。将得到的质粒插入中gydF4y2Ba根癌土壤杆菌gydF4y2BaEHA105细胞,然后用花浸法转化拟南芥(Col-0)细胞[gydF4y2Ba11.gydF4y2Ba].将推定的转基因系筛选在含有50mg / L潮霉素的Murashige和Skoog培养基上。潮霉素抗性幼苗(TgydF4y2Ba0gydF4y2Ba一代)在14天后转移到土壤中,并在长期条件下在21-23℃下生长。T.gydF4y2Ba3.gydF4y2Ba随后对发电设备进行了分析。Col-0种子来自拟南芥生物资源中心(gydF4y2Bawww.arabidopsis.orggydF4y2Ba).gydF4y2Ba
荧光原位杂交gydF4y2Ba
表达gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba对不同发育阶段的茎尖和芽进行了FISH分析。我们设计了基于lna的探针来靶向成熟细胞gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2BamRNA序列(表gydF4y2Ba4gydF4y2Ba).使用感测探针作为鱼类测定阴性对照(补充表gydF4y2Ba2gydF4y2Ba).在不同发育阶段收集的芽膜和芽用4%多聚甲醛溶液固定在30分钟,之后制备冷冻组织切片。将固定载玻片用PBS洗涤两次,用蛋白酶K在37℃处理10分钟,然后在70,85和100%乙醇中脱水5分钟。在78℃下的变性处理5分钟后,将探针加入到载玻片中,并在潮湿的条件下在42℃下在42℃下杂交过夜。将载玻片在43℃下用50%甲酰胺/ 2×SSC洗涤,然后在室温下用2×SSC洗涤,以消除非特异性和重复的RNA杂交。最后,将载玻片用DAPI(Sigma)染色10分钟,然后用Zeiss LSM 700 Meta共聚焦显微镜观察。gydF4y2Ba
可用性数据和材料gydF4y2Ba
在当前研究期间生成和/或分析的数据集可在NCBI的GenBank存储库中获得(登录号:KP696775.1和KP696776.1)。gydF4y2Ba
缩写gydF4y2Ba
- 作为:gydF4y2Ba
-
可变剪接gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Berger Ba,Thompson v,Lim A,Ricigliano v,罗马人v。横跨Knautia MaceDonica Capitula的双侧对称性,与腹腔内基因的腹侧瓣膜表达的变化相关。evodevo。2016; 7:1-10。gydF4y2Ba
- 2。gydF4y2Ba
Broholm SK, Sari TH, Laitinen RAE, Albert VA, Teeri TH, Paula E. A TCP域转录因子控制着非洲菊(菊科)花序沿径向轴的花型规格。美国国家科学学会主办。2008; 105:9117-22。gydF4y2Ba
- 3.gydF4y2Ba
Carlson SE, Howarth DG, Donoghue MJ。续断科类cycloidea基因的多样性:对头状花序进化的启示《BMC进化生物学》2011;11:1-13。gydF4y2Ba
- 4.gydF4y2Ba
关键词:高等植物,选择性剪接,生理意义原生质。2013;250:639-50。gydF4y2Ba
- 5。gydF4y2Ba
Chapman Ma,Leebens-Mack JH,Burke Jm。向日葵条环藻基因家族基因重复后阳性选择和表达分歧。mol Biol Evol。2008; 25:1260-73。gydF4y2Ba
- 6。gydF4y2Ba
查普曼MA,Shunxue T,Rthe D,Savithri N,Hunter S,Barb Jg,Knapp Sj,Burke Jm。梵高向日葵花对称的遗传分析揭示了菊科植物中CYCLOIDEA基因的独立补充。Plos Genet。2012A; 8:E1002628。gydF4y2Ba
- 7。gydF4y2Ba
MA Chapman, Tang S, Draeger D, Nambeesan S, Shaffer H, Barb JG, Knapp SJ, Burke JM。梵高向日葵花对称的遗传分析揭示了菊科植物中CYCLOIDEA基因的独立补充。公共科学图书馆麝猫。2012 b; 8: e1002628。gydF4y2Ba
- 8。gydF4y2Ba
陈俊,沉C-Z,Guo Y,Rao G-Y。图案化果实Capitulum:花对称Cyc2基因的重复和差异表达。前植物SCI。2018; 9:551gydF4y2Bahttps://doi.org/10.3389/fpls.2018.00551gydF4y2Ba.gydF4y2Ba
- 9。gydF4y2Ba
结合系统发育和共tenic分析,研究真核植物TCP ECE基因的进化。《公共科学图书馆•综合》。2013;8:e74803。gydF4y2Ba
- 10。gydF4y2Ba
cyiterne HL, Reyes E, Le Guilloux M, delchin E, Simonnet F, Sauquet H, Weston PH, Nadot S, Damerval C. the structure of CYCLOIDEA-like genes in Proteaceae, a basal eudicot family, with multiple shifts in花对称。安机器人。2017;119:367 - 78。gydF4y2Ba
- 11.gydF4y2Ba
阵伤SJ,弯曲AF。花卉浸液:一种简化的介导方法介导的植物植物植物的转化。植物J细胞摩尔Biol。1998; 16:735-43。gydF4y2Ba
- 12.gydF4y2Ba
Dilcher D.朝着新的合成:Agiosperm化石花的主要进化趋势。美国国家科学学会主办。2000; 97:7030-6。gydF4y2Ba
- 13。gydF4y2Ba
向日葵(Helianthus annuus)花冠对称性突变影响心皮和雄蕊发育。机器人。2005;83:1065-72。gydF4y2Ba
- 14。gydF4y2Ba
向日葵不稳定管状射线花等位基因:向野生型回归的遗传。植物品种。2007;126(5):548 - 50。gydF4y2Ba
- 15.gydF4y2Ba
Fambrini M,Pugliesi C. Cycloidea 2 Clade基因:用于控制花卉对称,花序架构和生殖器官发展的关键球员。植物mol biol报告。2017; 35:20-36gydF4y2Bahttps://doi.org/10.1007/S11105-016-1005-Z.gydF4y2Ba.gydF4y2Ba
- 16。gydF4y2Ba
关键词:向日葵,多对称,雌雄同体,花蕾,转座子,失活遗传。2011;139(11 - 12):1521 - 9。gydF4y2Ba
- 17。gydF4y2Ba
Fambrini M, Salvini M, Basile A, Pugliesi C.转座子依赖性的文森特·梵高的向日葵:例外揭示。《创世纪》。2014;52(4):315 - 27所示gydF4y2Bahttps://doi.org/10.1002/dvg.22743gydF4y2Ba.gydF4y2Ba
- 18。gydF4y2Ba
Garcês HM, Spencer VM, Kim M. M. RAY3, SvDIV1B和SvRAD对Senecio vulgaris小头状花序小花对称性的控制。植物杂志。2016;171:2055 - 68。gydF4y2Ba
- 19。gydF4y2Ba
GU C,Chen S,Liu Z,Shan H,Lu H,Guan Z,Chen F.菊花中定量实时PCR的参考基因选择,对生物和非生物应激进行定量实时PCR。莫尔生物科技。2011; 49:192-7。gydF4y2Ba
- 20。gydF4y2Ba
Hileman LC。双边花对称 - 如何,何时何地?CurrOp植物BIOL。2014; 17:146-52。gydF4y2Ba
- 21.gydF4y2Ba
罗马DG,Donoghue MJ。“ece”(CYC / TB1)的系统发育分析揭示了预测核心销售的重复性。美国国家科学学会主办。2006; 103:9101-6。gydF4y2Ba
- 22.gydF4y2Ba
黄D,Li X,Sun M,张T,Pan H,Cheng T,Wang J,Zhang Q. Cyc类基因的鉴定与表征在菊花MoriFolium雷射线裂纹发育中的调控中。前植物SCI。2016;gydF4y2Bahttps://doi.org/10.3389/fpls.2016.01633gydF4y2Ba.gydF4y2Ba
- 23.gydF4y2Ba
琼斯DT,泰勒WR,桑顿JM。从蛋白质序列中快速生成突变数据矩阵。中国生物医学工程学报。1992;8(3):275-82。gydF4y2Ba
- 24.gydF4y2Ba
JunTheikki-Palovaara I,Tähtiharjus,Lan T,Broholm Sk,Rijpkema As,Ruonala R,Kale L,Albert VA,Teeri Th,Elomaa P.Gerbera Hybrida(Asteraceae)调控中的复制Cyc2 Clade基因的功能多样化.工厂J. 2014; 79:783-96。gydF4y2Ba
- 25.gydF4y2Ba
Kalyna M,Simpson CG,Syed NH,Lewandowska D,Lewandowska D,Marquez Y,Kusenda B,Marshall J,Fulter J,Cardle L,McNicol J.替代剪接和废话介导的衰变调节拟南芥中重要调控基因的表达。核酸RES。2012; 40:2454-69。gydF4y2Ba
- 26.gydF4y2Ba
Kim M,Cui Ml,Cubas P,Gillies A,Lee K,Chapman Ma,Abbott RJ,Coen E.调节基因控制物种之间转移的关键形态和生态特征。科学。2008;322:1116-9。gydF4y2Ba
- 27.gydF4y2Ba
Koyama T,Ohme-Takagi M,Sato F.通过抑制拟南芥TCP转录因子的活性来产生锯齿和波浪花瓣。植物信号表现。2011; 6(5):697。gydF4y2Ba
- 28.gydF4y2Ba
Kumar S, Stecher G, Li M, Knyaz C, Tamura KMEGAX。跨计算平台的分子进化遗传学分析。《生物学报》2018;35(6):1547-9gydF4y2Bahttps://doi.org/10.1093/molbev/msy096.gydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
Laitinen Ra,Brohholm S,Albert Va,Teeri Th,Elomaa P.疯子箱基因表达的模式在格伯拉·雪林(奥斯特科伊)中的疯子箱基因表达标志花卉型发育。BMC植物BIOL。2006; 6:11。gydF4y2Ba
- 30.gydF4y2Ba
李芳芳,陈思敏,陈fd,方文敏,刘志林,张芳。海葵型菊花花发育的组织结构观察。园艺学报,2010,37:1961 - 8。gydF4y2Ba
- 31。gydF4y2Ba
刘虎,孙某,杜D,潘H,程T,王继,张Q,高y。菊花和圆盘小花中差异表达基因的全转录组分析。BMC基因组学。2016; 17:1-17。gydF4y2Ba
- 32。gydF4y2Ba
罗东平,张国平,张国平,等。花的不对称性及其防治。植物学报,2011,40(1):1 - 5。细胞。1999;99:367 - 76。gydF4y2Ba
- 33。gydF4y2Ba
罗永平,陈建平,陈建平。花不对称的起源。植物学报。大自然。1996;383:794-9。gydF4y2Ba
- 34。gydF4y2Ba
关键词:形态性状,调控基因,物种间转移,生物信息学科学。2008;322:1116-9。gydF4y2Ba
- 35。gydF4y2Ba
Mizzotti C,Fambrini M,Caporali E,Masiero S,Pugliesi Ca.环淋酸类基因旋转蛋白向日葵决定了一种能够在假蒽腾的周边产生填充的achenes的anunvusual floret型。植物学。2015; 93:171-81。gydF4y2Ba
- 36。gydF4y2Ba
miR319a靶向TCP4对拟南芥花瓣的生长发育至关重要。自然科学学报,2009;106(52):22534-9gydF4y2Bahttps://doi.org/10.1073/pnas.0908718106gydF4y2Ba.gydF4y2Ba
- 37。gydF4y2Ba
Preston JC, Hileman LC。花对称进化的发育遗传学。植物科学学报,2009;gydF4y2Ba
- 38。gydF4y2Ba
Pucker B,Brockington SF。RNA-SEQ支持的基因组分析揭示了植物基因组中的非规范剪接位点。BMC基因组学。2018; 19(1):980。gydF4y2Ba
- 39。gydF4y2Ba
Reddy Asn,Marquez Y,Kalyna M,巴塔A.植物中替代拼接景观的复杂性。植物细胞。2013; 25:3657。gydF4y2Ba
- 40。gydF4y2Ba
Silva Jat。Chrysanthemum:组织培养,冷冻保存,采后技术,遗传学和转基因生物技术进展。Biotechnol adv。2003; 21:715-66。gydF4y2Ba
- 41。gydF4y2Ba
STUESSY TF,URTUBEY E.亚家族BARNADESiodeae(菊科)的科罗拉形态的系统发育意义。植物群。2006; 201(5):340-52gydF4y2Bahttps://doi.org/10.1016/j.flora.2005.07.009gydF4y2Ba.gydF4y2Ba
- 42。gydF4y2Ba
Syed NH,Kalyna M,Marquez Y,Barta A,棕色JW。植物的替代拼接 - 年龄到期。趋势植物SCI。2012; 17:616-23。gydF4y2Ba
- 43。gydF4y2Ba
Tähtiharjus,rijpkema as,vetterli a,vetterli a,Albert va,Teeri Th,Elomaa P. Cyc / Tb1基因家族的Envolution and Diomationsion在奥斯特逸(奥尔布拉(多样)和向日葵(Heliantheae)中的比较研究。mol Biol Evol。2012; 29:1155-66。gydF4y2Ba
- 44。gydF4y2Ba
Torens R,MéndezM,GómezJM。单体性的性系统在哪里适合DIOECY的演变?来自最大的Anviospers家族的见解。新植物。2011; 190:234-48。gydF4y2Ba
- 45.gydF4y2Ba
夏y,洪博,博玲,志静q,秋g,赖w,杨d,尹铮w.系zh·镧系周边的双阳性自动调节反馈环的演变与花卉起源有关Zygomorphy。植物细胞。2012; 24:1834-47。gydF4y2Ba
- 46.gydF4y2Ba
Yafei Z,Kai P,Barbara Da,Oriane H,Annette B,Paula E. Cyc / TB1-Like TCP同源物的进化多样化及其对罂粟科(Basal eudicots)中分支和花卉形态控制的招募。新植物。2018; 220(1):317-31。gydF4y2Ba
- 47.gydF4y2Ba
杨X,庞H-B,刘B-L,邱Z-J,GAO Q,Wei L,Dong Y,Wang Y-Z。CYC2 CLADE基因中双阳性自动调节反馈环的进化与花卉Zygomorphy的起源有关。植物细胞。2012; 24:1834-47。gydF4y2Ba
- 48.gydF4y2Ba
杨X,赵X,李C,刘继,邱泽,董y,王Y.Teosinte分支趋势表达潜在的调节性差异化细胞因子基因岩浆果皮盆栽荔枝花的瓣膜变化相关。家庭Gesneriaceae。植物理性。2015; 169:2138-51。gydF4y2Ba
致谢gydF4y2Ba
我们承认在我们的研究中为他的宝贵的帮助和支持,康格林教授。我们感谢李文峰,Edanz编辑中国(gydF4y2Bawww.liwenbianji.cn/ac.gydF4y2Ba)编辑本手稿的草稿的英文文本。gydF4y2Ba
资金gydF4y2Ba
该研究由北京自然科学基金会(6194033)和北京农业科学学院(QNJJ201817)的自然科学基金(QNJJ201817)提供资金。所有资助机构都没有参与研究和收集,分析和对数据的解释和撰写手稿的设计。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
H L和QX Z设计了整个实验;H L进行了实验并写了稿件;H L,M S,HT P,TR C和J W分析了数据。所有作者阅读并认可的终稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
刘,H.,Sun,M.,Pan,H.gydF4y2Ba等等。gydF4y2Ba两个gydF4y2BaCyc2CLgydF4y2Ba成绩单(gydF4y2BaCyc2CL-1gydF4y2Ba和gydF4y2BaCyc2CL-2gydF4y2Ba)可能在菊花的雷福特的花瓣和雄蕊开发中发挥关键作用。gydF4y2BaBMC植物BIOL.gydF4y2Ba21日,gydF4y2Ba105(2021)。https://doi.org/10.1186/s12870-021-02887-0.gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02887-0.gydF4y2Ba
关键词gydF4y2Ba
- 菊花gydF4y2Ba
- 雷小花gydF4y2Ba
- 阀瓣小花gydF4y2Ba
- CYC2gydF4y2Ba例如基因gydF4y2Ba
- 雄蕊堕胎gydF4y2Ba
- 可变剪接gydF4y2Ba