抽象的
背景
最近的研究表明,淀粉酶-胰蛋白酶抑制剂(ATIs)和某些碳水化合物(FODMAPs,可发酵寡糖、二糖、单糖和多元醇)在促进小麦敏感性方面发挥了重要作用。迄今为止,还没有关于小麦颖果发育过程中ATIs积累的研究。收集了普通小麦的颖果。在8个不同的籽粒发育阶段,研究籽粒中ATI和FODMAP含量的组成变化。
结果
对收获的颖果进行了大小、蛋白质和碳水化合物浓度的分析。用MALDI-TOF MS对ATIs进行进一步表征,用酶解法评价其胰蛋白酶抑制作用。结果表明,ATI在花后1周左右开始积累,随后逐渐增加,直到生理成熟。然而,在花后约4周,ATIs的酶抑制活性未被检测到。碳水化合物分析表明,短链果聚糖在籽粒发育早期丰富,非水溶性碳水化合物在籽粒发育后期增加。
结论
这些结果为籽粒灌浆和成熟过程中复杂的代谢提供了新的见解,特别是对ATI含量以及对胰蛋白酶的抑制潜力的研究。ATI的积累和其生物活性发展之间的时间滞后可能是由于其组装为二聚体和四聚体,这似乎是其抑制潜力的关键。
背景
淀粉酶 - 胰蛋白酶抑制剂(ATIS)是水溶性谷物蛋白,其在有机溶剂中还具有良好的溶解度,例如氯仿 - 甲醇(CM)混合物[1].ATIs被确定为非乳糜小麦敏感性(NCWS)和其他小麦相关疾病的致病蛋白[2].这些疾病的特征在于肠道和肠外症状,与小麦和其他含麸质食物的消费紧密相关[3.那4.].由于没有明确的NCW诊断生物标志物,难以获得普遍性的精确编号,但基于少数可用的数据,普遍存在估计为0.6〜10%(审查见[5.])。
研究发现,ATIs通过直接激活人体细胞中的特异性促炎受体(即TLR4)来启动先天免疫反应,导致严重的炎症和免疫反应[2那6.].另外,ATI具有抑制胃肠系统,淀粉酶和胰蛋白酶中两种重要的消化酶的活性,从而导致消化的显着损害[7.].由于这种抑制特性,ATIs和其他代谢蛋白被认为是植物自身自然防御机制的关键。它们位于谷物种子的胚乳中,通过阻断病原真菌或入侵害虫的淀粉酶和胰蛋白酶的活动来保护淀粉和蛋白质储备[1那8.那9.].根据其聚集程度,ATIs可以分为单体、二聚体和四聚体形式。这些聚集体通过非共价分子内相互作用(包括二硫化物键和疏水相互作用)稳定下来,形成紧凑的3d结构,对热加工和蛋白质水解具有很高的抗性[6.那10].ATIS的抑制活性强烈依赖于3D结构和聚集状态[1].
除了ATIs,可发酵碳水化合物,即所谓的FODMAPs(可发酵寡糖、二糖、单糖和多元醇),也与NCWS有关,并被怀疑引发肠易激综合征(IBS),引起类似的,但只是肠道症状[11].在FODMAPs中,果聚糖在小麦和以小麦为基础的产品中最为丰富。其他FODMAPs,如游离果糖和半乳糖寡糖,包括棉子糖、水苏糖和毛蕊花糖,也被发现存在于小麦中,但数量可以忽略不计[12].
尽管最近的研究提供了有关蛋白质组学的宝贵信息[13那14那15]及正在发育的谷物的果聚糖代谢[16那17那18]但到目前为止,谷物填充和成熟期间的ATIS的代谢尚未彻底调查。在本研究中,面包小麦谷物(小麦l .)简历。“阿诺德”在籽粒开花至成熟的8个发育阶段收获,以显示籽粒灌浆过程中ATIs和碳水化合物的变化。了解ATI和FODMAP在籽粒灌浆过程中的合成和调控,对育种具有重要意义。
结果
内核的增长
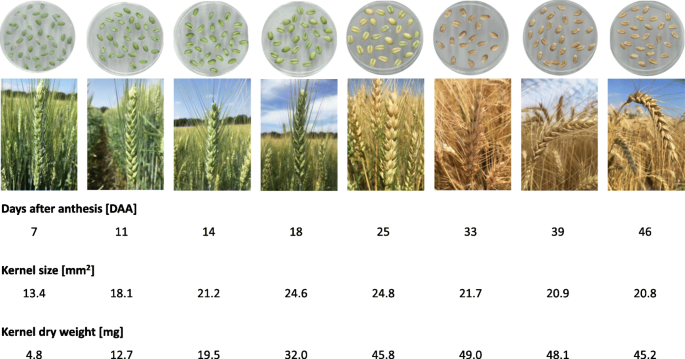
在到期成熟时,从开花前46天研究了小麦内核发展。图2中示出了开发尖峰和粒的图像以及它们对应的核尺寸和仁干重的图像。1.7 ~ 25 DAA样品穗部未成熟,33 ~ 46 DAA样品穗部和籽粒已接近成熟。盛花期/晚花期(BBCH鳞片65-67)后7天采收的颖果处于水熟期向早期乳期过渡。18 DAA收获的颖果正处于乳期后期向面团期早期过渡阶段。取7 ~ 18个DAA的样品仍呈明显的绿色,取25个DAA的样品正处于软面团阶段,开始变黄。取样33至46 DAA的耳朵失去了所有的绿色。总体而言,在籽粒灌浆成熟过程中,籽粒粒径从13.4 mm逐渐增大2到20.8毫米2最大可达24.8毫米2在25 DAA。果仁大小在生长后期的轻微下降与成熟前的最后脱水阶段相对应。与籽粒大小同时发生的是,干粒重从4.8 mg/粒增加到45.2 mg/粒,在33 DAA时最大为49.0 mg/粒(图3)。1和附加文件1:图S1)。基于8个采样日期的籽粒生长分析和成分监测,将籽粒发育分为3个阶段:细胞分裂和膨大(开花至14 DAA)、籽粒灌浆(14 - 25 DAA)、籽粒成熟和干燥(25-46 DAA)1:图S1)。
籽粒发育过程中蛋白质的积累
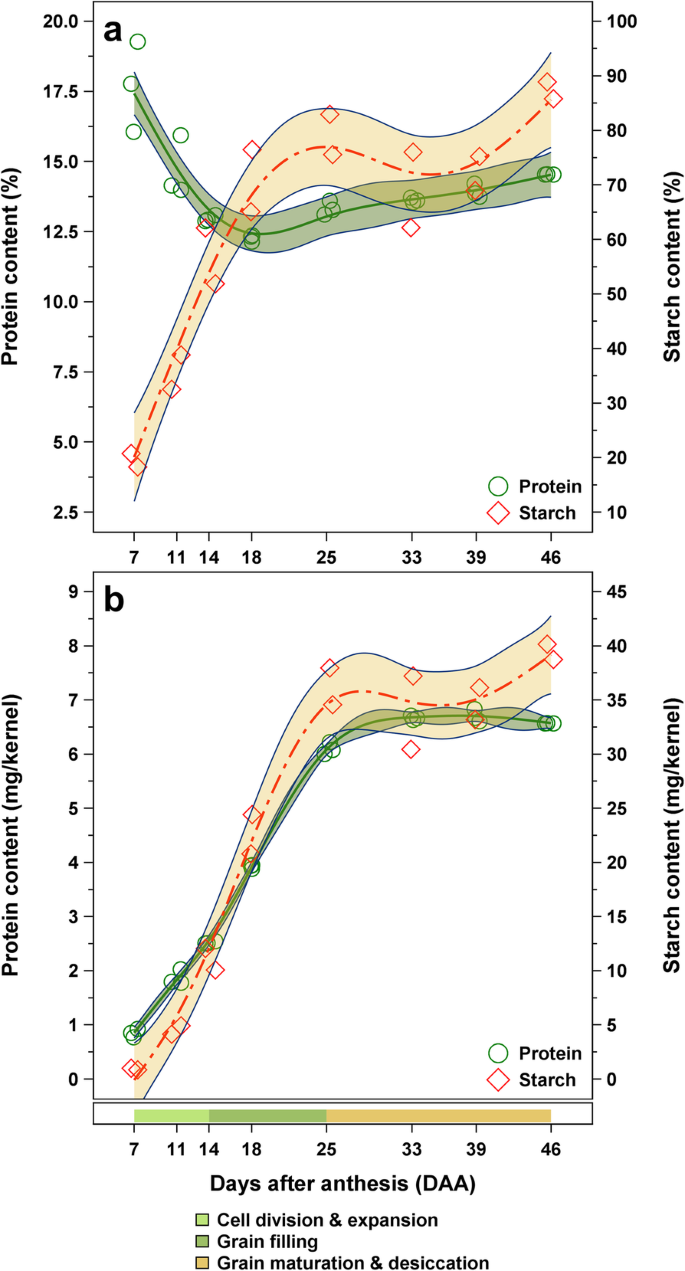
杜马斯和Bradford方法以及RP-HPLC源的显影小麦核的蛋白质含量如表所示1和无花果。2.反相高效液相色谱显示非麸质蛋白包括ATIs在八个发育阶段的分离,可在附加文件中找到2:图S2。总的来说,粗蛋白质浓度在本研究的时间范围内(即7 ~ 46 DAA)表现出相当大的变化(12-18%)。在籽粒发育初期,粗蛋白质含量由17.7下降到12.3%(图2)。2a),而核尺寸和干燥的内核体重很大(附加文件1:图S1)。在达到最低的12.3%后,进一步积累蛋白质,最终成熟时达到14.5%。而每100克面粉的蛋白质含量在最初下降后略有上升(图。2a),单粒蛋白质含量在籽粒发育的第一阶段稳步增加,直到最终达到6.6 mg/粒(图1)。2b)。对其他特征的单个内核的浓度列于其他文件中3.:表S1和附加文件4.S2:表。相反,盐溶性蛋白(即白蛋白和球蛋白)的含量在8个成熟阶段中保持相对稳定,在1.2 - 1.9%之间1).
从小麦核中提取的ATI蛋白质通过RP-HPLC量化。在第二个发育阶段的第一和唯一边缘数量中,没有检测到ATIS。因此,在波动发生后1周之前不会发生初始ATI累积。随后,浓度逐渐增加,直至谷物成熟度,并导致46 daa的最大ATI浓度为0.7g / 100g(表1).
MARDI-TOF MS的ATIS表征
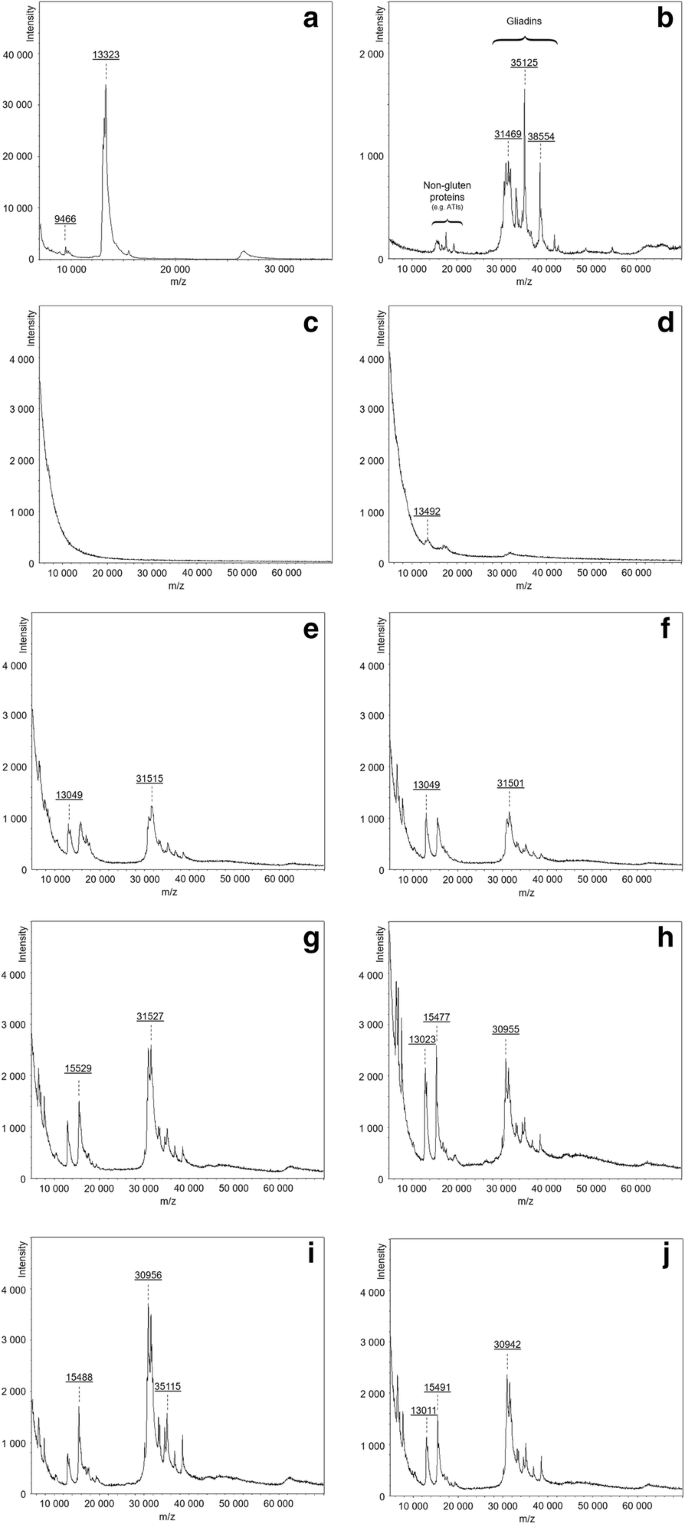
通过MALDI-TOF MS分析样品提取物,以验证ATIS的存在。由于ATI聚集体通过相当弱的非共价力稳定,因此,由低或高pH,变性或有机试剂容易破坏,以其单体形式鉴定和定量ATIS。样品的光谱显示在图2中。3..小麦α-淀粉酶抑制剂(AAI)标准(图。3.a),购自Sigma-Aldrich,在12-14 kDa附近有很强的峰值积累,表明存在几个不同的aai和CM蛋白,分子量相近。检测到15.5 kDa左右的一个小峰,可归为CM3蛋白[19].26-27kDa的宽峰代表[2 m + h]+检测到的atis的离子。此外,在AAI标准光谱中发现了具有较低分子量(分别约6kDA和10kDA的左右6kDa和10kDa)的不同信号,这是由AAI标准中存在的大量杂质产生的[20.那21].pwg gliadin分离物(图。3.b)显示了一个典型的麦胶蛋白模式,大多数α - /ß-麦胶蛋白在30 - 40 kDa,少量ω-麦胶蛋白在40 - 55 kDa。除了谷蛋白型蛋白外,PWG谱还显示了ATIs和燕麦蛋白样蛋白的存在,这一发现最近被Lexhaller等人证实[22].由于ATIS是相当小的蛋白质,其范围为13至18 kda [20.那23]该区域中的样品峰主要以较小程度的蛋白质/球蛋白级分(例如venin样蛋白)的ATIS和其他蛋白质分配[24].来自7 DAA的第一个样品揭示了完全没有ATIS和其他储存蛋白质。只有10kDa低于10kDa的基线的未定义和强劲增加,可能是由中间肽和游离氨基酸产生的[25].4天收集的第二个样品显示较弱的峰强度约为13,16和32kDa,这表明该蛋白质的生物合成。采用14和18aA的样品呈现出同时为合成的ATI积累的清晰,其由峰值> 30kDa表示。Atis和Gliadins产生的信号强度的比较揭示了后期发育阶段的趋势,这可能受到MALDI-TOF分析的手动样品制备的影响。
描述ATI的功能
胰蛋白酶抑制活性(TIA)通过酶学分析描述了ATIs的生物学功能[20.].尽管ATIs出现较早,但抑制活性开始较晚,取7 ~ 18 DAA样品未检测到TIA(表1)1).在25AA中获得初始抑制活性,然而,未作为达到适当定量的最小抑制(即40%)的最小抑制。后期发育阶段的样品显示出从79.1mg / kg至89.7 mg / kg的相当大的活动。
HPAEC垫的碳水化合物量化
在不加热的情况下在水中进行来自熟化小麦核的可溶性单,二聚糖和寡糖的提取。为了进一步了解碳水化合物的组成,将不溶性残基与2.5M TFA进行强酸水解。结果,将不溶的碳水化合物脱聚至单体并通过HPAEC垫容易地易于定量。样品的碳水化合物组合物的变化如图2所示。4.和表2.
可溶性碳水化合物简介
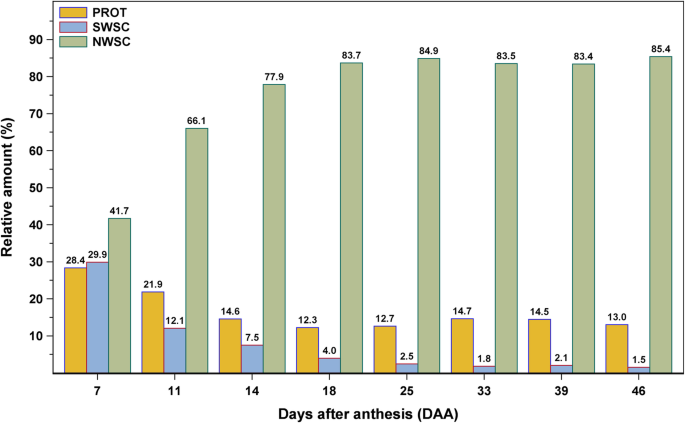
总的来说,可溶性碳水化合物的总量在整个籽粒发育过程中从18.7下降到1.7%。除蔗糖含量在籽粒发育初期呈下降趋势外,所有单糖、二糖和寡糖的含量均呈下降趋势,但蔗糖含量仅在籽粒发育初期呈下降趋势,但最终达到0.7%。棉子糖的浓度范围在46天内保持相对稳定,而其他半乳糖寡糖如水苏糖和毛白糖在发育后期不能检测到或只有非常少量。葡萄糖和果糖浓度的变化过程基本相同,在细胞分裂和膨胀阶段变化最大,葡萄糖和果糖浓度分别为4.8%和8.1%。在籽粒发育过程中,这两种浓度均显著降低,导致成熟籽粒中葡萄糖和果糖含量较低。蔗糖和葡萄糖、果糖含量在灌浆过程中略有下降,但在籽粒成熟和脱水过程中显著升高。由于葡萄糖、果糖和蔗糖的相互作用,单糖(葡萄糖和果糖之和)与蔗糖的比值发生了变化。除游离葡萄糖和果糖浓度外,果实中果糖含量的变化在籽粒发育过程中最为显著。低分子量果聚糖(GF2-GF4)的含量在乳汁期(7 - 11 DAA)从初始浓度的1.3迅速下降到0.6%(表2)2).在乳房阶段仅减少到最终量的0.3%发生后。
不溶性碳水化合物组成
正如Pritchard等人所描述的[26,阿拉伯糖和木糖单糖的总和代表阿拉伯木聚糖的数量。在本例中,测定了水不可提取阿拉伯木聚糖(WU-AX)的含量,通常是小麦粉中水可提取阿拉伯木聚糖(WE-AX)的两倍[27].通常,在颗粒填充物和7.0至7.4%的颗粒灌装和7.4%的时间内增加了Wu-Ax浓度,最大为18岁,最高12.5%(表2).阿拉伯木聚糖可以根据其分子结构进行分类,其典型表现为阿拉伯糖与木糖的比例(ARA/XYL)。ARA/XYL在0.5 ~ 1.0之间。除WU-AX外,粮食样品中还检测到少量(0.3 ~ 0.6%)水不可提取半乳糖(见表2)2).
籽粒样品中的不溶性小麦淀粉用酸水解后的葡萄糖量表示,因为第一次用水萃取应去除籽粒样品中的游离葡萄糖和β-葡聚糖。因此,葡萄糖在水不溶性残渣中主要来源于淀粉。与经典的淀粉定量方法相比,本研究中使用的方法可能也包括其他不溶性葡萄糖多糖,如纤维素,在较小程度上。在整个灌浆和成熟过程中,淀粉浓度从19.6增加到87.3%(表2)2).虽然在谷物发育的前两相(从19.6至79.3%)中,该量大幅增加(从19.6〜79.3%),谷物成熟和干燥相的样品在69.1和87.3%之间显示出相当恒定的值(图。2a).在单个核的基础上监测了一个类似的积累过程(图。2b)。通常,颗粒中的淀粉积聚的过程与相应的干核重量高度相关。还发现粗蛋白质含量与淀粉浓度呈负相关(表3.).
讨论
本研究在小麦发育过程中采集样品,以监测ATIs的积累以及碳水化合物组分的变化。这些结果揭示了它们在特定发育阶段的表达谱。
核生长和粗蛋白质积累
Verspreet等人的确定干核重量和核心大小。[17]和Gegas等。[28]揭示了本研究报告的成熟小麦颗粒的类似值,干重为51.4±1.8 mg / kernel [17],平均核尺寸为22.8±3.6 mm2[28], 分别。
通常,基于样品中的总氮含量计算的相对粗蛋白质含量在早期籽粒在成熟核中的14.5%下降到17.7%(图。2一种)。在未成熟的小麦的早期研究中据报道了粗蛋白的类似下降[17那25那29].此外,詹宁斯和莫顿[25[谷物的开始,在谷物的开始,在蛋白质中存在约50%的总氮,而剩余的一半主要存在于游离氨基酸中。然而,随着在晶粒发育过程中的游离氨基酸和肽的量降低,发现总氮化合物的大部分由蛋白质组成,除了发育第一阶段的核[25].蛋白质的合成和组装是小麦胚乳在籽粒发育过程中的主要功能,在籽粒发育的早期阶段占主导地位[14].在早期晶粒发育的早期晶粒发育的强烈Maldi-TOF MS信号在其上减少,在其上证实了在谷物填充开始时在谷物填充的开始和转化为粒状成熟期间具有较高质量的蛋白质的较大肽的存在。设计杜马斯方法以通过燃烧确定氮含量,并用于将氮含量转化为粗蛋白质含量的因子(即5.7)。由于提到的方法,粗蛋白质含量包括所有氨基酸,肽和蛋白质,其尺寸无关。
在籽粒发育的前三分之一,总粗蛋白质含量的下降可能是由于NWSC的大量积累,主要是淀粉积累(图2)。4.).在此之后,在籽粒灌浆和成熟阶段,粗蛋白质大量积累,这在之前的其他研究中已经提到[17那25那29].蛋白质在生长后期的轻微增加可能是由于成熟前的最后干燥。籽粒粗蛋白质含量与籽粒大小呈显著负相关(见表)3.),作为籽粒大小约25毫米的样品2显示最低的蛋白质浓度(图。1和无花果。2a).盐溶性蛋白的呈现值为1.2 ~ 1.9%,与前期研究中所呈现的alglo含量一致[19].白蛋白和球蛋白浓度在整个晶粒发育中保持相对稳定(表1)并且与粗蛋白质含量没有明显相关(表3.).通常,来自最终成熟度的总蛋白质和盐可溶性蛋白质的含量与CV的颗粒相似。来自2017年和2018年的“Arnold”由Call等人提出的。[19].籽粒生长和蛋白质积累的结果与籽粒发育的一般知识基本一致。
ATI积累和胰蛋白酶抑制
如表所示1,ATI含量从7 DAA稳定增加,直到最终成熟。这些发现符合芬尼等人。[13,他描述了在大麦种子发育过程中ATIs的逐渐积累。这种现象可能与它们在谷类植物防御系统中的功能作用有关。由于它们的作用是保护种子的淀粉和蛋白质储备,它们的积累预计将与籽粒灌浆同时进行。Vensel等人也使用二维凝胶电泳-质谱法分析小麦蛋白[14探讨了蛋白质的统治性,参与压力和防御,包括淀粉酶和胰蛋白酶抑制剂,在谷物发育的后期。然而,与2017年和2018年在2017年和2018年的相同小麦品种的值相比,检测到的ATIS略低,分别为1.3和1.1g / 100g [19].ATI浓度的轻微下降可能是由于替代了大豆胰蛋白酶抑制剂(TI)作为BSA的校准标准。一般来说,简单的反相高效液相色谱法用于ATI定量被认为高估了ATI的数量,因为avenin样蛋白是共洗脱的,因此,这些结果中包括[19].
Arnold样品的MALDI光谱证实了RP-HPLC的结果,7 DAA时没有检测到ATIs, 11 DAA后仅检测到边缘信号。14 DAA的样品显示,在醇溶蛋白合成的同时,有明显的ATI积累。这些发现与Carbonero等人的研究结果相反[1他声称ATI的合成先于储存蛋白质的合成。然而,本研究尚未确定贮藏蛋白的数量。
尽管通过MALDI-TOF MS在早期的阶段可以检测到ATIS,但RP-HPLC的定量证明了在开花后不久的样品含有相当低的浓度。然而,从初始ATI发生的某种时间延迟,直到ATIS的生物活性在整个谷物发育中显而易见。虽然所拍摄的样品25和33 DAA表现出类似的ATI浓度(0.6g / 100g),但它们在其胰蛋白酶抑制潜力(分别为79.6mg / kg)中显着不同。基于这种差异,可以针对ATI浓度和相应的胰蛋白酶抑制不观察到相关性(表3.)因为早期的研究也证明了[19].发生的时间延迟可能是由于ATIS与二聚体和四聚体的先前组装,这似乎对生物学功能至关重要[1].基于所获得的结果,可以将ATIS的生物活性的形成分配到18至33 daa之间的成熟期。为了进一步缩小这一时期,可以在后续研究中更频繁地进行样品收集。通常,胰蛋白酶在后期发育阶段的抑制潜力与CALL等人的结果密切相关。[19] 66.2-84.6 mg / kg和call等人。[20.] CV的73.2 mg / kg。“阿诺”。与来自其他品种的TIA值相比,CV。'Arnold'的特征在于中胰蛋白酶抑制活性[19那20.].
碳水化合物的组成变化
在本研究成熟颗粒中发现的可溶性糖的水平与CALL等人的结果相当。[30.],其研究发现了0.03%葡萄糖,0.07%的果糖,0.8%蔗糖和0.3%紫红色,在奥地利收获和收获的19次冬季面包小麦品种。通常,已知碳水化合物代谢在谷物发展中是一种丰富的过程[14].果仁成熟过程中可溶性单糖和双糖的减少反映了它们逐渐向贮藏多糖的转化,事实上,淀粉浓度从19.6增加到87.3%(见表)2).
在粮食发育过程中,短链果聚糖的含量降低了约80%。成熟谷物中显示的水平与Peukert等人的结果一致[18结果表明,在大麦籽粒发育过程中,酮糖(GF2)的降解率为0.26 ~ 0.01%,nystose (GF3)的降解率为0.18 ~ 0.16%。可能是后来产生了分子量更高的果聚糖,这是导致这种还原的原因。Fraberger等人[31结果表明,同一小麦品种的全粉聚合度(DP)最高可达15。“阿诺”。众所周知,未成熟的小麦籽粒中富含果聚糖,据报道,与未成熟的小麦籽粒相比,成熟小麦的果聚糖减少率为50-90% [16].但需要指出的是,本研究仅测定了低分子量果聚糖(GF2-GF4)。果聚糖因其有益健康和理化性质,在科学文献中引起了广泛的关注。由于未成熟的麦粒中含有大量的果聚糖,人们讨论了如何利用在乳期收获的麦粒生产功能性食品[32那33].然而,这些产品可能并不适合患有肠易激综合征(IBS)的人,因为果聚糖被怀疑会引发IBS症状[11].
就像Verspreet等人进行的研究[17], AX浓度在细胞分裂膨大期迅速增加,灌浆期保持相对稳定,略有下降,但在成熟和干燥期AX含量稳定在7.4-7.9%范围内(表2)2).通过Cetiner等人获得了成熟晶粒中的Wu-Ax的可比较结果。[34均值为现代小麦品种的平均值为7.2%。与CleMput等人报告的典型平均值相比,本研究中的ARA / XYL略微增加。[35].然而,ARA/XYL在WU-AX中似乎增加了,这是由于更密集的分支[36].此外,阿拉伯半乳聚糖中的阿拉伯糖未被考虑在定量中,这可能导致ARA/XYL掺假。AX是已知的小麦细胞壁的主要成分,这反映在本研究中发现的高含量。在本研究中发现的水不可提取半乳糖(WU-GAL)的低浓度可以追溯到半乳糖寡糖,它们在细胞壁结构中以少量的数量嵌入,正如mare和Stone所示[37].
在文献中,发现淀粉含量很少超过72%的小麦干物质[38].该研究中发现的增加可能是由于施加的单冷水提取步骤引起的不完全β-葡聚糖或纤维素去除引起。然而,蛋白质和碳水化合物组分的总和不超过干燥核重量的110%,这是考虑到针对每个Caryopsis样品测定的许多分析性状的测量不确定性是可接受的。
结论
结果在谷物填充和成熟过程中,对复杂的成分变化进行了见解,特别强调蛋白质和阿蒂含量,以及Atis朝向胰蛋白酶的抑制作用。通常,发现ATI浓度和活性在整个晶粒发育中增加,而Fructans在未成熟的小麦内核中丰富。尽管ATI单体的积累开始于晶粒发育的第一阶段,但在胰蛋白酶抑制方面只能在3周大约3周后检测到胰蛋白酶抑制方面的生物活性。该结果支持假设ATIS的生物学功能强烈依赖于其聚集状态和构象。然而,必须提到,ATIS的免疫原性潜力主要基于它们的特定促炎受体的激活。晶粒发育过程中的环境条件的变化可以另外改变ATI合成率并最终影响谷物的免疫原性潜力。虽然有几项研究有助于了解调节谷物发育过程中蛋白质表达的复杂基因网络,但ATI合成的生化机制仍需要进一步研究。在最近的研究研究中,胰蛋白酶抑制的复杂性令人印象深刻地证明:虽然通过基因沉默于三个主要的ATI基因的基因沉默,但TIA增加了总ATI浓度[39].
方法
植物材料
面包小麦(小麦L.,2n = 6x = 42,BBAADD,CV。'阿诺德')kernels were collected in 2019 from a field trial in Tulln an der Donau, Austria (48°18′42.2“ N, 16°03’06.8” E) at eight selected intervals over a period of 7 weeks during the grain filling and maturation stage. No permission was required to collect the plant samples. Fertilization (i.e. 67.5 kg N ha−13月21日,43.2 kg N hm−1和植物保护(即1.35 l公顷除草剂处理)−14月8日和25克−1苯磺隆+ 0.25 l ha−1进行Arylex和Fluroxypyr在5月27日)以确保最佳的植物生长。5月31日发生了一个,并且在开花(DAA)后7天开始植物的手工收集。对于每个样品,将至少50种植入分蘖切割并用液氮冷冻以抑制进一步的反应或酶活性。在分析之前,通过Freezone 6冷冻干燥器(Labconco,堪萨斯城,Mo,USA)进一步冻干了冷冻核。由于该干燥过程,本研究中获得的所有数据都基于核的干重。Caryopses的采样和环境条件的细节在附加文件中呈现5.:表S3。未受精的卵巢被排除在分析之外。
测定干粒重量和粒大小
加权至少20个冷冻干燥的核,以确定每个发育阶段的平均核重量。使用imageJ2软件进行数字图像分析,通过数字图像分析来确定成熟内核样本的核大小[40].采用定义的长度尺度和椭球模型同时进行校准,以进行适当的核尺寸量化。报告的值是平均值±SEM,测量了至少20个核。
蛋白质测定的样品制备
用于分析的颖果从穗中手工收集,并使用CryoMill (Retsch GmbH, Haan, Germany)在液氮下研磨,在分析前冷冻并在−18°C下储存。ATI的测定,每10 mL提取1 g全麦面粉2次n -己烷以除去样品脂肪和叶绿素,尤其是来自相当不成熟的样品,这可能与分光光度测量相互作用。随后,用含有1.3mM磷酸盐缓冲液(pH7)的150mM NaCl溶液萃取ATIS和其他盐溶性蛋白质。在旋转20秒的悬浮液后,在架空振荡器中剧烈摇动萃取10分钟。在组合所得上清液之前,通过离心(3000g,10分钟)分离非可溶性颗粒。对每个样品进行两次样品制剂。
测定蛋白质含量
如CALL等人所述测定研磨的全麦面粉的粗蛋白质含量。[19使用DuMaster D-480 (Büchi Labortechnik AG, Flawil, Switzerland)。此外,根据Call等人的研究,采用Roti®-Quant法(卡尔罗斯,卡尔斯鲁厄,德国)使用氯化钠提取物测定alglo的含量[20.].
RP-HPLC定量ATIS
如先前的研究中所述,进行提取物中的ATIS的定量[19[色谱过程中的一些变化(有关详细信息,请参阅附加文件6.:表S4)。简而言之,将制备的ATI提取物注射到具有DAD检测器的5000系列的日立HPLC系统上,以及HALO C18柱(Advanced Materials Technology,Wilmington,De,USA),具有1000埃孔径(150×2.1 mm with 2.7 μm particle size) including a corresponding guard column. A gradient with water (solvent A) and HPLC-grade acetonitrile (ACN) (solvent B), both modified with 0.1% trifluoroacetic acid (TFA), was applied at 45 °C with a flow rate of 0.35 mL min−1.检测在214nm处进行。选择纯度至少为98%(Carl Roth)的BSA,以建立外部校准,因为它还用于样品提取物中的血糖凝块的定量。应用的分析程序将量化大多数Atis,但也是其他蛋白质。由于未进行蛋白质鉴定,因此不能提供在分配的保留时间内测定的蛋白质的详细数量或蛋白质清单。
ATI表征
根据CALL等人分析含有ATIS和其他盐溶性蛋白质的样品萃取物,用于其胰蛋白酶抑制活性(TIA)。[20.].显示出低抑制但未达到最低抑制40%的样品被宣布为较低的LOQ。Tia值以Mg抑制胰蛋白酶在Mg / kg样品中表达。
根据呼叫等人,MALDI-TOF MS进一步表征了不同发育阶段的样品。[20.经过一些修改。用氯仿-甲醇溶液(等比)从脱脂全麦面粉中提取蛋白质。获得的提取物在50°C的氮气流下蒸发至干燥,再悬浮在含有0.1% TFA的乙腈-水(等比例)溶液中。按照生产商的说明,使用从默克公司购买的C4 ZipTips(床容积0.6 μL,总移液管容积10 μL)进行蛋白的纯化和富集。
碳水化合物分析
为了确定整个晶粒发育的碳水化合物代谢的变化,在架空振荡器中在5ml水中将50至100mg样品萃取10分钟。通过离心除去不溶的组分,例如淀粉和沉淀的蛋白质(3000g,10分钟)。在色谱分析之前通过0.2μm过滤器过滤萃取物。为了获得有关不溶性碳水化合物组分的进一步信息,将离心后的不溶性残基在100℃下在摇动水浴中用5ml 2.5m TFA水解2小时。如先前由Fraberger等人描述的。[31],通过卡雷兹沉淀和随后的离心去除蛋白。样品提取液加入NaOH调整pH为> 6,过滤后注入色谱系统。
根据Fraberger等人的说法,为了量化样品提取物中碳水化合物的浓度,使用了HPAEC-PAD [31].Dionex™ICS-6000 DC系统(Thermofisher Scientific,Sunnyvale,CA,USA)配备Carbopac™PA210(2×150mm,4μm)和Carbopac™PA20快速(2×100mm,4μm),相应的保护柱用于分离不同的碳水化合物。用200mM NaOH和200mM NaOH / 500mM Na-乙酸盐的梯度洗脱以0.2ml / min的流速,在30℃的塔温下使用。色谱条件的细节显示在附加文件中8.:表S5。采用DP 3-5 (Megazyme, Bray, Ireland)中的半乳糖、葡萄糖、果糖、蔗糖、棉子糖、麦芽糖和较小的果聚糖进行标定,标定范围为0.5 ~ 50 mg/L。
环境数据集合
测试场地的气候数据是由A733遥测单元(ADCON, Klosterneuburg, Austria)收集的,该单元配备了温度、湿度、风、辐射和降水传感器。生长季节(2018年10月19日至2019年7月16日)的温度和降水情况见补充文件9.:图。S4。
统计分析
样品至少被提取两次,并根据之前实验中确定的各自性状测量的重现性分析一到两次。所有统计分析均采用SAS 9.4软件(SAS Institute, Inc., Cary, NC)进行。采用MIXED程序进行方差分析,DAA为固定效应。平均比较采用Tukey-Kramer方法计算。差异与p-值< 0.05为显著性。应用CORR计算性状间的相关系数。使用TEMPLATE创建统计图。
数据和材料的可用性
在本文中未包含在本文中的其他数据或其附加文件的附加数据可根据相应作者的要求提供。
缩写
- AAI公司:
-
α-淀粉酶抑制剂
- ALBGLO:
-
白蛋白+球蛋白含量
- ARA / XYL:
-
阿拉伯糖和木糖的比例
- ATIs航站:
-
淀粉酶 - 胰蛋白酶抑制剂
- 斧头:
-
阿糖基木聚糖
- BBCH:
-
Biologische Bundesanstalt für土地与Forstwirtschaft, Bundessortenamt and Chemische industrial
- BSA:
-
牛血清白蛋白
- DAA:
-
几天后开花
- DP:
-
聚合程度
- FODMAPS:
-
可发酵的寡核苷酸,二 - ,单糖和多元醇
- 安全系数:
-
短链果寡糖
- FRU:
-
果糖
- GAL:
-
半乳糖
- 女朋友x:
-
葡萄糖和果糖单位数量
- GLU:
-
葡萄糖
- 肠易激综合症:
-
肠易激综合症
- LOQ:
-
量化的限制
- 发作:
-
麦芽糖
- NCWS:
-
非腹腔小麦敏感性
- NWSC:
-
非水溶性碳水化合物
- 防:
-
粗蛋白含量
- raf:
-
奖金
- SEM:
-
标准错误的平均值
- STA:
-
水苏糖
- 往下:
-
蔗糖
- 组织:
-
三氟乙酸
- 蒂雅:
-
胰蛋白酶抑制活动
- TLR4:
-
toll样受体4
- TSN:
-
可溶性总氮
- SWSC:
-
小水溶性碳水化合物
- 版本:
-
赘言
- WU-AX:
-
防水性Arabinoxylans
- WU-GAL:
-
Water-unextractable半乳糖
参考
- 1.
Carbonero P,Díazi,Vicente-Carbajosa J,Alfonso-Rubi J,Gaddour K,Lara P.谷物α-淀粉酶/胰蛋白酶抑制剂和转基因昆虫抗性。在:Scarascia Mugnozza GT,Porceddu E,Pagnotta Ma,编辑。作物质量与抵抗的遗传和育种。DONDRECHT:KLLWER学术出版商;1999. p。147-58。https://doi.org/10.1007/978-94-011-4475-9_17.
- 2.
Junker Y,Zeissig S,Kim S,Barisani D,Wieser H,Leffler D等人。小麦淀粉酶胰蛋白酶抑制剂通过激活Toll样受体4. J Exp Med激活肠道炎症。2012; 209:2395-408。https://doi.org/10.1084/jem.20102660.
- 3.
亲吻Kucek L, Veenstra LD, amnuaychewa P, Sorrells ME。麸质基础指南:现代基因型和加工如何影响小麦的敏感性。食品科学与食品安全。2015;14:285-302。https://doi.org/10.1111/1541-4337.12129.
- 4.
Scherf KA。小麦过敏、非乳糜麸质/小麦敏感(NCGS)和乳糜泻中的免疫反应性谷物蛋白食品科学。2019;25:35-41。https://doi.org/10.1016/j.cofs.2019.02.003.
- 5.
小麦和其他谷物中的淀粉酶-胰蛋白酶抑制剂作为非乳糜泻麸质敏感性效应的潜在激活剂。J Med Food. 2018; 21:207-14。https://doi.org/10.1089/jmf.2017.0018.
- 6.
等。关键词:人工神经网络,神经网络,神经网络营养小麦淀粉酶-胰蛋白酶抑制剂通过激活骨髓细胞促进肠道炎症。胃肠病学。2017;152:1100 - 13. e12汽油。https://doi.org/10.1053/j.gastro.2016.12.006.
- 7。
杜家乐,马志强,李志强,等。小麦α -淀粉酶/胰蛋白酶双功能抑制剂与哺乳动物消化酶的相互作用:结合的动力学、平衡和结构特征。食品化学。2016;213:571-8。https://doi.org/10.1016/j.foodchem.2016.07.020.
- 8。
Chen Z-Y,Brown RL,Lax Ar,克利夫兰TE,Russin JS。玉米胰蛋白酶抑制剂抑制植物 - 致病性真菌大肠杆菌.应用环境微生物学报1999;65:1320-4。https://doi.org/10.1128/AEM.65.3.1320-1324.1999.
- 9。
瑞安加利福尼亚州。植物中的蛋白酶抑制剂:用于改善昆虫和病原体的防御的基因。Annu Rev phytopathol。1990年; 28:425-49。https://doi.org/10.1146/annurev.py.28.090190.002233.
- 10。
Altenbach SB, Vensel WH, Dupont FM。美国面包小麦品种Butte 86表达的低分子量α -淀粉酶/蛋白酶抑制剂基因谱。BMC Res Notes. 2011;4:242。https://doi.org/10.1186/1756-0500-4-242.
- 11.
Catassi C,Alaedini A,Bojarski C,Bonaz B,Bouma G,Carroccio A等。非乳糜蛋白含量敏感性(NCGS)和小麦敏感肠敏细胞综合征(IBS)的重叠区域:更新。营养素。2017; 9:1268。https://doi.org/10.3390/nu9111268.
- 12.
Grausgruber H,Lovegrove A,Shewry P,BékésF.Fodmaps在小麦。在:igrejas g,ikeda t,guzmánc,编辑。小麦质量改善加工和人类健康。Cham:Springer;2020. p。517-34。https://doi.org/10.1007/978-3-030-34163-3_21.
- 13.
Finnie C,Melchors,Roepstorff P,Svensson B.谷物灌装和大麦种子成熟的蛋白质组分析。植物理性。2002; 129:1308-19。https://doi.org/10.1104/pp.003681.
- 14.
Vensel WH,Tanaka CK,Cai N,Wong JH,Buchanan BB,Hurkman WJ。小麦胚乳代谢蛋白质谱的发育变化。蛋白质组学。2005; 5:1594-611。https://doi.org/10.1002/pmic.200401034.
- 15.
郭国光,吕东,闫晓东,葛鹏,李旭东,等。面包小麦品种发育籽粒的蛋白质组特征(小麦l .)。BMC植物BIOL。2012; 12:147。https://doi.org/10.1186/1471-2229-12-147.
- 16.
高果寡糖在硬粒小麦植株发育过程中的含量变化。植物Biosyst。2008;142:656-60。https://doi.org/10.1080/11263500802411304.
- 17。
Verspreet J, Hemdane S, Dornez E, Cuyvers S, Pollet A, Delcour JA,等。小麦发育过程中碳水化合物的贮藏与结构分析(小麦L.)使用定量分析和显微镜的晶粒。JAgric Food Chem。2013; 61:9251-9。https://doi.org/10.1021/jf402796u.
- 18。
陈志强,陈志强,陈志强,等。大麦发育过程中果聚糖代谢的时空动态。植物细胞。2014;26:3728-44。https://doi.org/10.1105/tpc.114.130211.
- 19。
引用本文:L, Kapeller M, Grausgruber H, Reiter E, Schönlechner R, D’amico S.小麦品种和育种对小麦蛋白质组成的影响。中国科学(d辑:地球科学)2020;https://doi.org/10.1016/j.jcs.2020.102974.
- 20.
请致电L, Reiter EV, Wenger-Öhn G, Strnad I, Grausgruber H, Schönlechner R,等。小麦中胰蛋白酶抑制活性定量测定的酶学分析方法的发展。食品化学。2019;299:125038。https://doi.org/10.1016/j.foodchem.2019.125038.
- 21。
Geisslitz S, Ludwig C, Scherf KA, Koehler P.靶向LC-MS/MS显示,除单粒小麦外,所有小麦品种中α-淀粉酶/胰蛋白酶抑制剂作为非乳糜麸敏感性的可能触发因子的含量相似。中国农业科学(英文版),2018;https://doi.org/10.1021/acs.jafc.8b04411.
- 22。
Lexhaller B,Colgrave Ml,Scherf Ka。液相色谱 - 串联质谱法,小麦,黑麦和大麦谷蛋白类型的表征及相对定量。前植物SCI。2019; 10:1530。https://doi.org/10.3389/fpls.2019.01530.
- 23.
Tchewonpi Sagu S,Huschek G,Boenick J,Homann T,Rawel HM。小麦提取α-淀粉酶/胰蛋白酶抑制剂的新方法(小麦L.),基于Plackett-Burman和Box-Behnken设计的优化。分子。2019;24:3589。https://doi.org/10.3390/molecules24193589..
- 24.
张勇,曹雪梅,朱海峰,齐鹏,佘梅,等。小麦燕麦蛋白及其对小麦枯萎病的显著抗性。bioRxiv。2018.https://doi.org/10.1101/406694.
- 25.
詹宁斯AC,莫顿RK。小麦胚乳发育过程中氨基酸和蛋白质的合成。生物科学,1963;16:318-31。https://doi.org/10.1071/BI9630318.
- 26.
Pritchard JR,Lawrence GJ,Larroque O,Li Z,Laidlaw HKC,Morell Mk等。小麦β-葡聚糖和阿拉伯氧基含量的调查。j sci食物agr。2011; 91:1298-303。https://doi.org/10.1002/jsfa.4316.
- 27.
芬尼斯SM,Bettge Ad,Morris CF.品种和环境对软麦水溶性和水不溶性阿拉伯毒蛇的影响。谷物化学。2006; 83:617-23。https://doi.org/10.1094/cc-83-0617.
- 28.
GEGAS VC,Nazari A,Griffiths S,Simmonds J,Fish L,Orford S等人。小麦粒度和形状变异的遗传框架。植物细胞。2010; 22:1046-56。https://doi.org/10.1105/tpc.110.074153.
- 29。
小麦籽粒发育过程中蛋白质组成的变化。中国农业科学2001;52:485-93。https://doi.org/10.1071/AR00101.
- 30.
请致电L, D 'Amico S, Grausgruber H, Schönlechner R. Fruktane in alten und neuen österreichischen Weizensorten。Getreide Mehl und Brot. 2018; 1/2018:2-6。
- 31.
Fraberger v,致电LM,Domig KJ,D'Amico S.酵母发酵的适用性,以减少FODMAPS和其他FODMAPS。营养素。2018; 10:1247。https://doi.org/10.3390/nu10091247.
- 32.
Mujoo R,NG PKW。从面粉烘烤的面包的生理化学性质与富含果糖的未成熟麦粉。J Food Sci。2003; 68:2448-52。https://doi.org/10.1111/j.1365-2621.2003.tb07044.x.
- 33。
Casiraghi MC,Zanchi R,Canzi E,Pagani Ma,Vianro T,Benini L等。未成熟小麦籽粒(IWG)饼干的益生元潜力和胃肠效应。Antonie Van Leeuwenhoek。2011; 99:795-805。https://doi.org/10.1007/s10482-011-9553-6.
- 34。
Cetiner B, Tömösközi S, Török K, Salantur A, Koksel H.古老和现代面包小麦的阿拉伯木聚糖组成和物理性质的比较(小麦L.)和Landraces基因型。谷物化学。2020; 97:505-14。https://doi.org/10.1002/cche.10265.
- 35.
Cleemput G, Roels SP, Van Oort M, Grobet PJ, Delcour JA。不同面包品质的欧洲小麦粉中水溶性阿拉伯木聚糖结构的异质性。谷物化学1993;70:324-9。
- 36.
格鲁彭H,科美林克FJM, Voragen AGJ。小麦粉中水不可提取的细胞壁物质;阿拉伯木聚糖的结构模型。谷物科学1993;18:111-28。https://doi.org/10.1006/jcrs.1993.1040.
- 37.
马里斯DJ,石头学士。小麦胚乳细胞壁的研究。三世Galactose-rich多糖。生物科学,1973;26:1005-7。https://doi.org/10.1071/BI9731005.
- 38.
Maningat CC, Seib PA, Bassi SD, Woo KS, Lasater GD。小麦淀粉:生产、性能、改性及用途。在:BeMiller J, Whistler R,编辑。淀粉-化学与工艺。3版。伯灵顿:学术出版社;2009.p . 441 - 510。https://doi.org/10.1016/B978-0-12-746275-2.00010-0.
- 39.
Kalunke RM,Tundo S,SestiLi F,CamerLengo F,Lafiandra D,Lupi R等。在CM3,CM16和0.28 ATI基因中沉默的面包小麦RNAi转基因中的过敏潜力降低。int j mol sci。2020; 21:5817。https://doi.org/10.3390/ijms21165817.
- 40.
Rueden CT,Schindelin J,Hiner MC,Dezonia,沃尔特AE,Arena et等人。imagej2:imagej用于下一代科学图像数据。BMC生物信息学。2017年; 18:529。https://doi.org/10.1186/s12859-017-1934-z..
确认
作者要感谢EQ GmbH提供的MALDI-TOF MS设备,以及Tulln an der Donau可再生资源化学研究所的Stefan Böhmdorfer提供的CryoMill。
资金
本研究由FFG(奥地利研究促销机构),Femtech项目(FFG项目编号为875537)。这些资金用于通过奖学金汇集数据。该研究的出版是由Boku Vienna开放式通道发布基金支持的支持。
作者信息
隶属关系
贡献
LC写了稿件,计划实验,进行了碳水化合物和数据分析。EH负责大多数分析实验和数据采集。ER实质上修改了工作并帮助监督了该项目。SD计划并进行实验;他实质性地促进了这项研究的概念,并参与了写作稿件。HG构思了该研究并进行了现场试验。所有作者都有助于起草,阅读和批准最终手稿。
作者的信息
LC目前是作物科学系的博士后研究员,致力于多瑙河过敏研究集群(DARC)中较少致敏植物的开发。HG是DARC的一名教员,领导着作物科学系的谷物育种项目。ER是奥地利健康和食品安全局饲料分析和质量检测部门的负责人。SD是后一个机构的研究员。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1图S1:
面包小麦种子发育过程中籽粒性状的变化。“阿诺”。一个晶粒尺寸 (n> 20)和b粒重(n > 20).
附加文件2图S2
采用反相高效液相色谱法(214 nm)测定面包小麦籽粒盐水提取物。“阿诺”。啊分别在出平坦的7,11,14,18,25,33,39和46天中收获的晶粒。
附加文件3表S1。
蛋白质含量,组成和表征面包小麦的颗粒(小麦l .)简历。' Arnold '在单一内核的基础上。
附加文件4表S2。
面包小麦的SWSC(小水溶性碳水化合物)和NWSC(非水溶性碳水化合物)在整个籽粒发育过程中的组成变化。' Arnold '在单一内核的基础上。
附加文件5表S3。
样本细节包括采收时间和花期至采收期间的环境数据。
附加文件6表S4。
反相高效液相色谱法测定ATI的色谱条件。
附加文件7
小麦AAI标准品的反相高效液相色谱(214 nm)。
附加文件8表S5。
HPAEC垫的碳水化合物分析的色谱条件。
图S4。
测试网站的气候数据Tulln An der Donau于2018年10月19日至2019年7月16日的生长季节。蓝宝标志每月代表总降水量;图中的固体红线和各个值表示平均每月温度,而最小和最大每日温度装置由浅红色带表示。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
呼叫L,海德尔,E,达米科,S。et al。淀粉酶 - 胰蛋白酶抑制剂的合成与积累及面包小麦籽粒发育过程中碳水化合物谱的变化(小麦l .)。BMC植物杂志21,113(2021)。https://doi.org/10.1186/s12870-021-02886-x
收到了:
公认:
发表:
关键字
- ATI新陈代谢
- FODMAPs
- 粮田开发
- 胰蛋白酶抑制
- 小麦的敏感性