摘要
背景
甾醇是真核细胞膜的结构和功能成分。植物产生一种复杂的固醇混合物,其中β-谷甾醇、豆甾醇、樟脑甾醇和某些茄科植物中的胆固醇含量最高。许多研究表明,豆甾醇与β-谷甾醇的比值在植物发育过程中以及逆境胁迫下发生变化,表明豆甾醇可能在这些过程的调控中发挥作用。在西红柿里(番茄茄),与β-谷甾醇比的变化与编码甾醇C22-去饱和酶(C22DES)的唯一基因的诱导相关,该酶特异性地参与β-谷甾醇转化为Stigmasterol。然而,尽管这种酶的生物学兴趣,但仍然缺乏关于其结构和功能相关的几个相关方面的知识。
结果
在这项研究中,我们报告了番茄C22DES在内质网(ER)中的亚细胞定位基于共聚焦荧光显微镜和细胞分离分析。模拟研究还表明C22DES由两个分化良好的结构域组成:一个锚定在内质网膜上的N端跨膜螺旋结构域(TMH)和一个朝向胞浆的球状结构域(或催化结构域)。尽管TMH足以靶向和保留内质网中的酶,但在缺少N-末端跨膜结构域的情况下,球状结构域也可能相互作用并保留在内质网中。观察到缺失TMH的C22DES的截短版本在酶活性上是不活跃的,这表明N末端膜结构域对酶活性是必需的。对植物C22DES的TMH区进行的硅内分析揭示了几种可能参与底物识别和结合的结构特征。
结论
总体而言,这项研究有助于扩大目前关于植物C22DES结构和功能的知识,并揭示与植物甾醇代谢相关的新型方面。
背景
甾醇是类异戊二烯衍生的脂质,在调节膜的流动性、通透性和功能方面起着重要作用[1.,2.]. 甾醇共享一个基于环戊烷-全氢菲环系统的共同结构,在C3位有一个羟基,在C10和C13位有一个甲基,在C17上有一个可变长度的侧链[3.]. 与其他真核生物不同的是,植物的特点是产生大量的甾醇,这些甾醇与C17的侧链性质不同,其中β-谷甾醇、豆甾醇和樟脑甾醇含量最高,在某些茄科植物中也有胆固醇。在植物中,甾醇以自由形式存在,也以共轭形式存在,如甾酯、甾苷和酰基甾苷。游离甾醇和甾苷主要存在于质膜(PM)中,而甾酯则在胞质脂滴中积累[4.].
众所周知,甾醇对PM的功能至关重要,因为它们调节PM的物理化学性质,以及微结构域(也称为脂筏)的形成,这些微结构域参与许多相关的细胞过程,例如细胞间相互作用、信号转导、膜转运、蛋白质运输和应激反应[5.,6.]. 在植物中,PM的正确功能取决于植物体内平衡的樟脑甾醇、β-谷甾醇和豆甾醇的水平[7.]. 特别是,β-谷甾醇/豆甾醇比值的变化被认为会影响不同的发育过程和应激反应[7.].β-谷甾醇和豆甾醇的区别在于豆甾醇侧链C22位置的双键1.:图S1)。然而,尽管这些甾醇具有高度的结构相似性,但它们对PM的物理化学性质有不同的影响[8.].富马斯托醇富含膜不易渗透,因此显示出泄漏减少[9,10].因此,PM中的β-豆甾醇水平在植物发育和胁迫响应过程中可能受到严格的调控[11,12,13].
豆甾醇是甾醇生物合成途径中24乙基分支的最终产物,通过甾醇c22 -去饱和酶(C22DES)的作用由β-谷甾醇合成(附加文件1.:图S1)[11,14].C22DES,也称为CYP710,属于细胞色素P450(CYP)蛋白质家族,其包括所有生物体中涉及许多生物合成和异骨途径的酶。CYP蛋白共享一个常见的催化中心,包括血红素铁结合结构域。NADPH通过CONCHROME P450还原酶的作用作为C22DES催化的反应物中的电子给体作为电子供体,膜结合的蛋白质在ER膜中定位[14,15,16].C22DES与具有甾醇14去甲基化酶活性的CYP蛋白CYP51系统发育相关。CYP51是植物、酵母和动物甾醇生物合成途径的共同产物[17,18]进化的证据表明,这些酶已经存在于最古老的真核生物中[19]. 由于C22DES在甾醇生物合成途径中作用于CYP51下游,因此有人提出它是由CYP51基因复制进化而来的[19,20].
植物C22DES被克隆并在十年前的生化水平上表征[14,21,22].然而,与这种酶仍然未知的酶有几个功能和结构方面。其中一个涉及其亚细胞定位的阐明,这方面是特别显着的,考虑到C22DES可以在de Novo甾醇生物合成期间和/或在PM中存在的β-谷甾醇上合成的β-谷甾醇作用自由或共轭形式)。虽然众所周知,在er中发生游离甾醇生物合成[23,24,25] PM在甾醇途径的最后步骤中的参与尚未排除[3.]. 迄今为止所描述的所有植物CYP蛋白都是膜结合的,主要定位于内质网。然而,一些特殊的CYP蛋白已被报道在其他亚细胞定位,如线粒体,质体和PM[26,27]. 因此,阐明C22DES的亚细胞定位是植物甾醇代谢中的一个重要问题。与C22DES特性相关的其他重要方面是鉴定与酶的细胞内靶向以及其膜拓扑结构和催化功能有关的结构和功能基序。其中一些问题已在本研究中使用番茄C22DES解决,之所以选择该研究,不仅是因为这种植物是世界上最重要的作物之一,还因为与其他植物物种相比,番茄含有编码这种酶的单一基因[11,17].
结果
番茄C22DES定位于ER
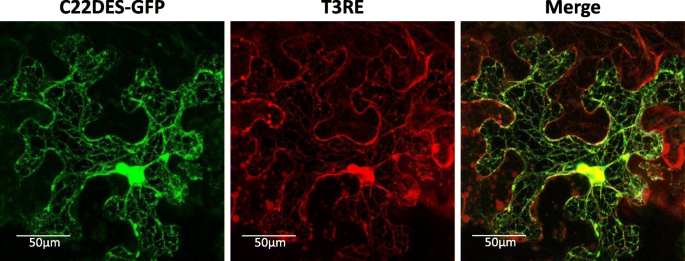
为了确定C22DES的亚细胞定位,一个包含整个番茄C22DES编码序列的嵌合蛋白融合在绿色荧光蛋白(GFP)的N末端(C22DES-GFP)瞬时表达于细胞中烟草树叶。共聚焦荧光显微镜显示,C22DES-GFP具有典型的ER样结构。这种荧光模式与在共表达T3RE蛋白的细胞中观察到的荧光模式基本相同,T3RE-RFP被用作ER定位的特异性标记[28] (图。1.). 实际上,合并两个通道的荧光显示了两个图像的明显重叠。
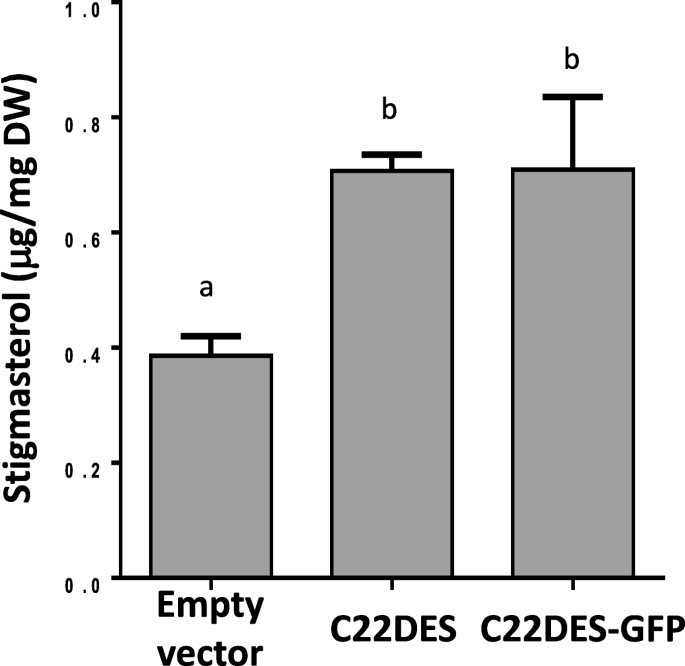
为了确保C末端GFP标签既不影响C22DES的正确靶向也不是其催化活性,农药的Stigmasterol水平N底栖动物测定表达天然C22DES或嵌合C22DES-GFP变体的叶片,并将其与以空表达载体作为对照的农业渗透叶片进行比较。如图。2.两种情况下,豆甾醇总含量均以相似的方式增加约75%。这些结果表明,嵌合酶被正确地靶向到亚细胞室(s),它的底物(β-谷甾醇)被发现,也提供了一个体内试验来评价一系列C22DES-GFP衍生物的活性如下所述。
番茄C22DES的三维建模
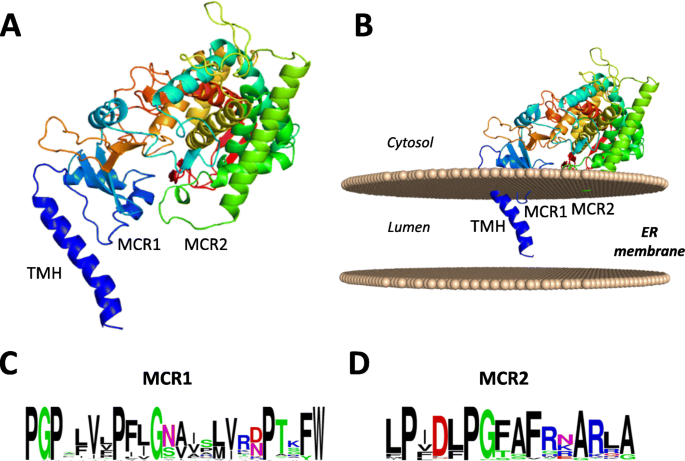
番茄C22DES的三级结构用100%的信心建模,使用了单一的得分模板酿酒酵母Lanterol14α-脱甲基酶(CYP51)晶体结构[29]以前有报道称是内质网膜结合酶[30]. C22DES的整体三级结构与酵母CYP51非常相似,尽管在N端区域观察到显著差异。而在CYP51中,它是由一个N端的两亲性α-螺旋和一个跨膜α-螺旋组成的[29]在C22DES中,这个区域较短,包含一个假定的跨膜α-螺旋(残基1-28),称为TMH(图。3.a) 是的。此外,利用膜蛋白取向数据库(OPM)的ppmweb服务器,建立了C22DES与细胞膜的相互作用模型[31],预测了蛋白质序列中的另外两个膜接触区域,即MCR1(残基38–58)和MCR2(残基227–233)(图。3.A和B)。MCR1是富含脯氨酸的基序,位于TMH附近,并在不同植物物种的C22DE中高度保守(图。3.c),而MCR2的保守性较小(图。3.d),并定位于所有植物C22DES预测的长两亲α-螺旋附近的球状结构域(图)。3.a和b)。这些结果与我们先前的发现一致,即功能性番茄C22DES定位于细胞内质网膜N底栖动物细胞。
预测番茄C22DES的三级结构。A.番茄C22DES总体预测倍数。B预测C22DES在二油酸磷脂酰胆碱(DOPC)膜中的取向。指出了预测的N端跨膜螺旋(TMH)和膜接触区MCR1和MCR2。c和d从植物C22DES蛋白质的比对中获得的一致性MCR1和MCR2序列的序列标志,如附加文件所示2.S1:表
TMH足以将番茄C22DES靶向并保留在ER膜中
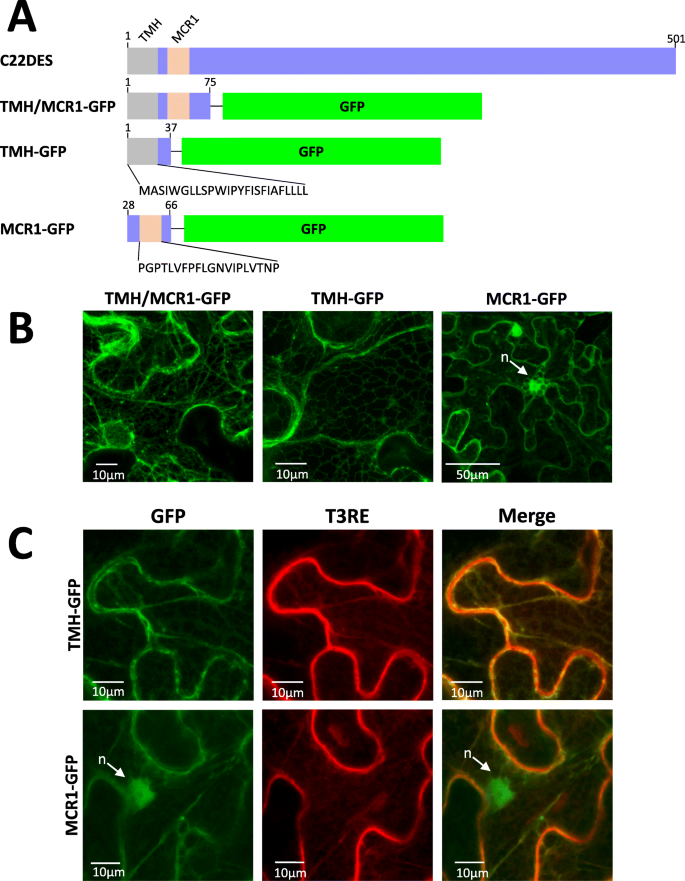
为了研究番茄C22DES(TMH和MCR1)N端预测的ER相互作用序列的作用,在GFP的N端融合了含有残基1至75(包括TMH和MCR1)、残基1至37(仅包括TMH)和残基28至66(仅包括MCR1)的氨基酸序列(图。4.一种)。由于其与TMH的紧密接近,因此包括在这些研究中包括在这些研究中及其与ER膜的预测相互作用(图。4.b)。通过共聚焦显微镜在瞬时表达后分析所得嵌合蛋白(分别的嵌合蛋白(TMH + MCR1-GFP,TMH-GFP和MCR1-GFP)的亚细胞定位N底栖动物树叶。TMH的荧光分布 + MCR1-GFP和TMH-GFP导致典型的内质网定位模式(图。4.b)。相反,MCR1-GFP显示与荧光的胞质定位相容的荧光也呈现核(图。4.b) 是的。然而,MCR1-GFP也显示出与T3RE的重叠(图。5.c) 是的。这些结果与MCR1可能赋予MCR1-GFP与内质网相互作用的能力的事实相一致,通过这种方式加强了该基序在C22DES与内质网相互作用中的功能作用。绿色荧光在细胞核中的定位可以解释为至少部分表达的MCR1-GFP以可溶性形式存在于胞浆中。
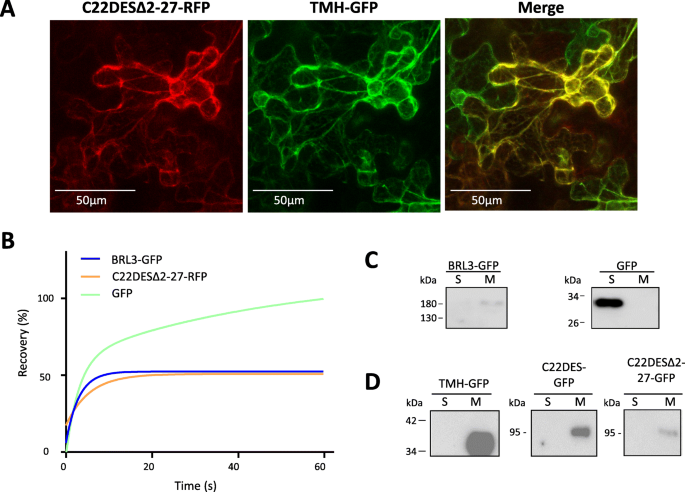
ER中C22DES球状域的靶向和保留。A.共焦光学切片显示C22DESΔ2–27-RFP(左)和TMH-GFP(中)的荧光在N底栖动物树叶。合并的图像显示在右侧。B表示C22DESδ2-27-RFP,BRL3-GFP和GFP的荧光回收率的FRAP曲线。荧光恢复曲线表示从归一化的数据集至少6个独立漂白点斑点的最佳拟合。(C)可溶性(S)和膜(M)细胞组分免疫印迹分析的裁剪图像N底栖动物瞬时表达BRL3-GFP的叶片(≈153 kDa)和GFP(≈26.8 kDa)分别作为膜结合蛋白和可溶性对照蛋白。完整长度的污点在附加文件中给出6.:图S4。C从可溶性(S)和膜(M)细胞组分的免疫印迹分析中截取的图像N底栖动物缺乏表达C22DESδ2-27-GFP(≈84.2KDA),TMH-GFP(≈34KDA)和C22DES-GFP(≈87.2KDA)。全长墨水显示在附加文件中7.:图S5
番茄C22DES的球状结构域在没有TMH的情况下与ER相互作用
据报道,几种CYP蛋白的球状结构域在不存在跨膜结构域的情况下与ER膜相互作用[32,33,34,35].为了确定番茄C22DES中的情况,缺少TMH区(残基2至27)的酶的N-末端截短形式与RFP的N-末端和所得蛋白质(C22DESδ2-27-RFP)瞬时表达以及TMH-GFPN底栖动物叶子。C22DESΔ2-27-RFP的荧光分布呈典型的网状结构,与TMH-GFP共定位(图。5.一种)。这些结果表明,在没有TMH的情况下,番茄C22DES的球状结构域在ER中相互作用并保留在ER中。光漂白(FRAP)分析后的荧光回收[36,37]使用融合到GFP的油菜素类固醇受体BRL3(BRL3-GFP)来强化这些结果[38[分别为膜结合和细胞溶质对照蛋白的GFP。如图1所示。5.b、 C22DESΔ2–27-RFP显示出与BRL3-GFP相似的回收率,从而证实了其作为完整膜蛋白的行为。与此结果一致,免疫印迹分析使用抗GFP抗体的胞浆和膜部分获得从N底栖动物瞬时表达TMH-GFP、C22DES-GFP和C22DESΔ2–27-GFP的叶片表明它们存在于膜部分(图。5.C和D)。在免疫斑分析中,使用C222DESδ2-27-GFP代替C22DESδ2-27-RFP,因为抗GFP抗体不识别RFP。
番茄C22DES活性需要TMH
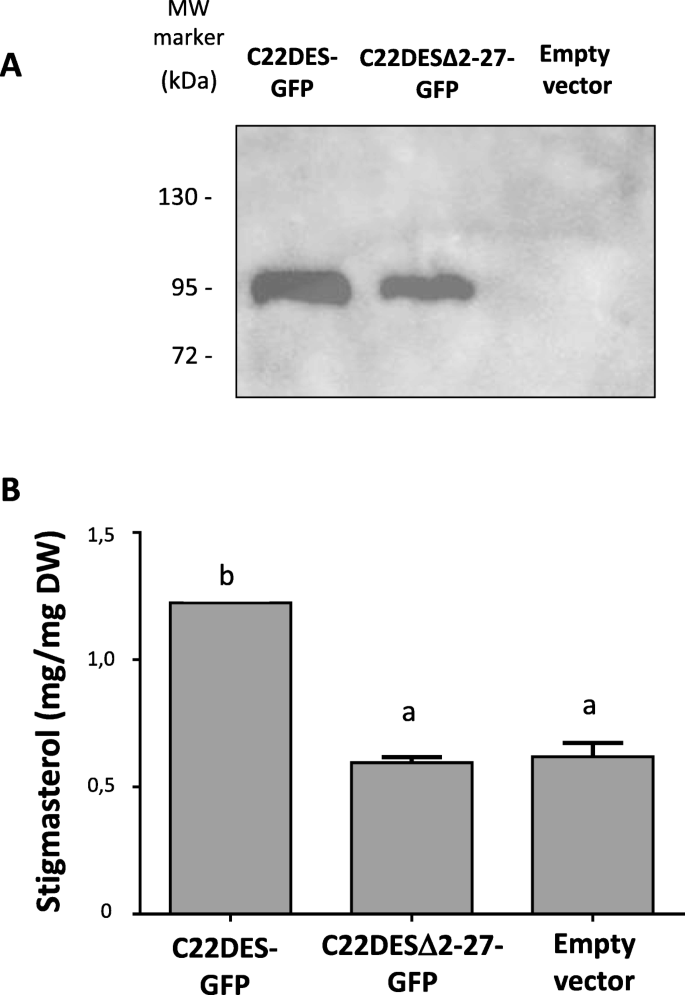
上述结果表明,TMH除了将酶锚定在内质网外,还可能具有其他功能。为了探讨这一可能性,C22DESΔ2–27-GFP瞬时表达于N底栖动物叶子评估其酶活性。C22DES-GFP并联表示为阳性对照。通过使用抗GFP抗体的免疫印迹分析测定两种蛋白质的表达(图。6.a) 是的。与预期一样,表达C22DES-GFP的样品显示总豆甾醇含量增加(图。6.b)。然而,在C22DESΔ2-27-GFP的情况下,脊柱甾醇含量与用空表达载体滤成的叶片中发现的液体(图。6.B),表明酶活性是必要的。
C22DESΔ2–27体内酶活性测定(A.)来自C22DES-GFP(≈87.24KDA)和C22DESδ2-27-GFP(≈84.22KDA)的免疫斑分析的裁剪图像N底栖动物叶子。全长污染在附加文件中呈现8.:图S6。B甾醇甾醇水平在甾醇总分数N底栖动物叶子表达C22DES-GFP和C22DESδ2-27-GFP。值是三种技术复制的平均值±SD(n = 3)。小写字母表示相对于表达空向量的叶样本中的平均值之间的差异(单向ANOVA与Dunnett的多个比较测试)
来自不同植物物种的C22DES的N-末端区域可能与酶活性相关的特征
来自不同植物物种的C22DES的序列对准表明,TMH的长度和序列均不受保守差(图。7.).然而,对这些序列进行仔细检查揭示了所有植物C22DES蛋白共享的几种常见特征的存在。其中一个是N-末端半部的大量苏氨酸和丝氨酸残留物(图。7.).这可能是相关的,因为一些研究已经描述了羟基化残基在蛋白质跨膜结构域中的作用,通过与其极性侧链的羟基相互作用来提供与其他膜组分的底物特异性或正确的缔合[39,40]. 另一个共同特征是在TMH的N端半部分中存在一个或多个脯氨酸残基(图。7.).由于脯氨酸残留物在α-螺旋中诱导约30度的转弯,因此大多数植物C22DES的TMH序列可以在其N末端的一半中具有一个或多个转弯。
植物C22DES N末端区域的多重序列比对。附加文件中列出的27种植物C22DES的N末端序列比对2.:如表S1所示。氨基酸残基在右边编号。星号表示所有序列中保守的残基。冒号表示性质极为相似的氨基酸基团之间的保守性,而句号表示性质极为相似的氨基酸基团之间的保守性。连字符表示为优化对齐而引入的间隙。番茄TMH序列以蓝色突出显示;脯氨酸(P)以红色显示,丝氨酸(S)和苏氨酸(T)残基以洋红色显示。还显示了CRAC1基序(包括保守的Q27和Y30残基)和MCR1序列。CRAC1中的支链氨基酸[亮氨酸(L)、缬氨酸(V)和异亮氨酸(I)]显示为绿色,酪氨酸(Y)显示为青色,二元酸残基[精氨酸(R)和赖氨酸(K)]显示为黄色。Soly,solanum lycopersicum;KLNI,Klebsormidium nitens;Semo,Selaginella Moellendorffii;Pisy,Pinus sylvestris;Sppo,Spirodela polyrhiza;orsa,oryza sativa;Deca,Dendrobium catenatum;Phda,Phoenix Dactylifera;Anco,Ananas Comosus;Amtr,Amborella trichopoda; Bevu, Beta vulgaris; Kafe, Kalanchoe fedtschenkoi; Potr, Populus trichocarpa; Cicl, Citrus clementina; Gora, Gossypium raimondii; Arth, Arabidopsis thaliana; Frve, Fragaria vesca; Ergu, Erythranthe guttata; Cusa, Cucumis sativus; Glma, Glycine max; Paso, Papaver somniferum; Jure, Juglans regia; Nenu, Nelumbo nucifera; Daca, Daucus carota; Cyca, Cynara cardunculus; Vivi, Vitis vinifera; Eugr, Eucalyptus grandis
图2中所示的对准。7.还显示谷氨酰胺和酪氨酸残基(对应于番茄序列的Q27和Y30)的保存以及在TMH和MCR1之间存在短延伸的带正电荷残基。有趣的是,保守的酪氨酸残基和带正电荷的残余物被鉴定为由共有--L / V-X1-5-y-X1-5-R / K定义的胆固醇识别/相互作用氨基酸(CRAC)基序的元素[41] (图。7.).CRAC主题通常在膜蛋白的跨膜螺旋中发现。在C22DES的N-末端区域中鉴定的该推定的CRAC基质(以下简称Crac1)还包括上述保守的谷氨酰胺残基。
植物C22DES的球状结构域包含胆固醇识别/相互作用氨基酸一致基序
植物C22DES(附加文件2.:表S1)揭示了球状结构域中存在其他保守的胆固醇识别/相互作用氨基酸共识基序。除了已经描述的CRAC基序之外,球状结构域还包含所谓的CARC基序,它们对应于CRAC基序的镜面反射序列,并且由一致性的K/R-X1–5-Y/F-X1–5-L/V)定义。CARC基序也可以结合胆固醇,尽管方向相反[42].两个CRAC图案(CRAC2和CRAC4),三个CARC图案(CARC1,CARC2和CARC3)和其中CRAC主题和CRAC3 / CARC4)的植物C22DES的球状结构域(附加文件3.:图。S2)。鉴定如此大量推定的胆固醇相互作用基序令人惊讶的是,引起假设,至少在某些情况下,它可以仅反映这些共有局部的松弛。由于在膜蛋白的球状域中报道的功能性CRAC和CARC基序在α-螺旋中发现[43,44]只有在预测α-螺旋(Carc2,Carc3,Crac2和Crac3 / Carc4)中只有那些图案只有那些图案(附加文件4.:图S3)可能在C22DES中起作用。其中,CARC2、CARC3和CRAC3/CARC4可能是特别有趣的,因为它们存在于两亲α-螺旋中,并且位于球状结构域上部的催化位点附近(附加文件)4.:图S3)。
讨论
结果表明,番茄C22DES是一种内质网驻留蛋白。番茄C22DES的3D模型使用系统发育相关的羊角甾醇14α-去甲基酶(CYP51)的晶体结构,CYP51是一种也参与甾醇代谢的酶,被认为是世界上最古老和最保守的P450之一,预测了N端疏水跨膜结构域和两个短序列(MCR1和MCR2)的存在,它们位于球状结构域中,也与内质网膜相互作用(图。3.). 利用融合到GFP的C22DES衍生物进行的亚细胞定位研究表明,TMH足以将C22DES靶向并保留在ER中(图。4.和5.d)。这些研究还显示出球状结构域可以在不存在TMH的情况下在ER膜中保持并保留在ER膜中(图。5.).植物C22DES中MCR1和MCR2的序列保护(图。3.C和D)支持与ER膜相互作用的这些序列的作用。
C22DES球状结构域在内质网中的相互作用和保持机制有待进一步研究。然而,它们可能涉及MCR1和MCR2与内质网膜的疏水相互作用和/或其与其他内质网驻留蛋白(如NADPH-细胞色素P450还原酶)的相互作用,这是CYPs功能所必需的[27,45]. 一些CYP蛋白之间的相互作用形成异二聚体,以及CYPs与细胞色素b5和UDP-葡萄糖醛酸转移酶(UGT)1A等其他蛋白之间的相互作用也有报道[46,47,48,49,50].
尽管表现为整体膜蛋白,但观察到番茄C22DES的球状结构域酶活性失活(图。6.)显示酶活性也需要TMH。考虑到GNANASEKARAN等人最近的工作,这一结果意外地意外。(2015)显示CYP720B4的N-末端区域,植物细胞色素P450涉及异化酸生物合成,对于在表达时对该酶的活性不是必需的N底栖动物叶子。然而,CYP的N-末端跨膜结构域的功能作用仍然是一个有争议的问题。因此,虽然已经报道了缺乏N-末端锚定区域的一些重组CYP在体外是活性的,但在体内测定中没有检测到活性[34,51,52].CYP的N末端区域的差异行为可以至少部分地与其基板的性质和亚细胞可用性相关。这将解释为什么一些Cyps在体外测试条件下显示出基质的体外测试条件,但在体内测定条件下没有底物的可用性是限制因子的影响。此外,已经提出了一些Cyps的N-末端膜结构域在催化期间参与球状结构域相对于膜的正确定位。因此,据报道,当位于ER膜的疏水芯内时,球状结构域的瞬时倾斜是允许CYP与它们的基板相互作用的必要要求[53,54]. 在C22DES的特殊情况下,可以推测它不能与其底物(β-谷甾醇)相互作用,除非TMH提供球状结构域的正确锚定,以允许其在催化过程中在ER膜内倾斜。
尽管TMH在番茄C22DES活性中的基本作用,但发现植物C22DES的N-末端区域的长度和氨基酸序列保守令人惊讶(图。7.).然而,对这些序列的详细检查揭示了两种守护特征,其可能与酶活性相关:i)胆固醇识别/相互作用氨基酸共分(CRAC)基序和II)富含丝氨酸和苏氨酸残留物的存在N末端的TMH。胆固醇结合结构域一直是许多研究涉及计算方法探索动物蛋白的跨膜区域的研究,他们与胆固醇的相互作用有良好的证据[41,42].第一个鉴定的基序被称为胆固醇识别/相互作用氨基酸共识(CRAC)并满足共识(L / V)-X1 - 5- (y)-x1 - 5- (r / k),(其中x是任何氨基酸)[41,42,55].另一个名为Carc的胆固醇绑定基序对应于CRAC主题的镜像版本与共识序列(K / R)-X1 - 5- (y / f)-x1 - 5-(左/右)[42,55].尽管CRAC MOTIF最初被鉴定并在动物蛋白中表征[55,56,57,58]植物中还证明了其胆固醇结合功能[59]. 有趣的是,最近在1型胆囊收缩素受体中发现了一个能够与β-谷甾醇相互作用的CRAC基序[60]. 因此,存在于植物C22DES(CRAC1)N末端区域的CRAC1基序可能有助于酶与内质网膜中存在的β-谷甾醇的相互作用。胆固醇结合区的另一个特征是丝氨酸和苏氨酸残基的存在。此外,对几种胆固醇结合蛋白的结构分析表明,这些氨基酸的亲水侧链可能与胆固醇分子的C3羟基相互作用[61]. 因此,TMH N端的丝氨酸和苏氨酸残基可能会增强C22DES与内质网中β-谷甾醇的相互作用,从而促进其与CRAC1基序的相互作用。
考虑到其他参与甾醇生物合成的酶,如SMT1、CPI1、HYD1和DWF/DIM,C22DES在内质网中的定位并不意外[5.,62,63,64]以及细胞色素P450还原酶,细胞色素P450的生理氧化还原伙伴,也定位于这个细胞室[65]. 然而,C22DES在内质网中的定位提出了一个问题,即这种酶如何作用于PM中β-谷甾醇的主要细胞池。这一过程可能涉及内质网与PM在称为内质网-PM接触点的结构上物理相互作用的能力,在该结构中,两种膜紧密接触[66,67,68]. 位于一个细胞膜上的酶可能作用于另一个细胞膜上的底物,即在跨境活动,并非史无前例[69,70,71.,72.]. 有趣的是,最近报道了参与调节脂质稳态的特异性ER-PM接触位点,包括磷脂和甾醇[73.].此外,涉及脂质生物合成的酶已经在ER-PM接触位置局部化,并显示有助于它们的形成[72.,74.].然而,据我们所知,植物中甾醇或脂质稳态的ER-PM接触地点的参与尚未在植物中报道,尽管已经提出了PM局部番茄酰基-CoA:甾醇酰基转移酶(Slasat1)可以采取行动在跨境在其底物环青蒿醇的内质网脂质双层中,在内质网-间质网接触部位产生环青蒿酯[75.].在植物C22DES的球状结构域中存在几个保守的CRAC / CARC基序表明,它们可以在酶与PM中存在的β-谷甾醇的相互作用作用。在这方面,考虑到已经描述了这种类型的结构而且作为膜相互作用域而且作为脂质结合位点的局部结构,CARC2,CARC3和CRAC3 / CARC4的定位可能是相关的,这类结构不仅可以作为膜相互作用域而且作为脂质结合位点[76.]. 研究这些CARC和CRAC基序对PM中β-谷甾醇的C22DES活性的贡献是进一步研究这种酶的功能特性和植物甾醇代谢调控的一个有趣的问题。
细胞和代谢工程方法旨在改变植物中豆甾醇的水平是植物生物学和生物技术领域一个非常具有挑战性的课题[11,77.].从这个意义上讲,该领域的进展肯定会受益于在遗传,细胞和生物化学水平的C22DES表征的新进步中受益。虽然本工作中进行的结构和功能研究代表了对此目的的重大贡献,但我们认为这方面的未来研究应特别注意,更好地了解考虑到不同的C22DES活动中的细胞和分子机制植物细胞端膜系统中存在的β-谷甾醇池。
结论
番茄C22DES是一种完整的内质网膜蛋白,其N端有一个跨膜α-螺旋。两个短序列能够与内质网膜相互作用(MCR1和MCR2)也被预测在球状结构域。TMH对内质网膜上酶的靶向和保留是足够的。然而,在体内C22DES活性所需的TMH缺乏的情况下,球状结构域也可以相互作用并保留在内质网膜中。TMH区域包含一个高度保守的胆固醇识别/相互作用氨基酸共识(CRAC)基序,富含苏氨酸和丝氨酸残基。这些特征可能与内质网膜上存在的β-谷甾醇对酶催化位点的识别和摄取有关。总的来说,这里的结果表明C22DES与内质网膜之间存在复杂的相互作用模式,这对于适当的酶功能是必不可少的。C22DES与PM中β-谷甾醇主要细胞池相互作用的分子机制尚不清楚,值得进一步研究。
方法
植物材料
烟草植物(从巴塞罗那农业基因组学研究中心的植物生长服务处获得)在标准温室条件下生长(14 h灯亮26 ± 1. °C和10 21岁时天黑 ± 1. °C)每12罐 直径厘米。
克隆与质粒构建
以35S:C22DES质粒为模板,通过PCR扩增了番茄C22DES与GFP和RFP框内融合所用的所有缺失终止密码子的蛋白质编码序列,该质粒先前在实验室获得,包含C22DES的开放阅读框编码(GenBank:NM\ U 001247585)。所有PCR反应均采用高保真AccuPrime进行™ Taq-DNA聚合酶(Invitrogen)和特异引物对(附加文件5.:表S2)。利用Gateway®技术(Invitrogen)将扩增产物纯化并克隆到pDONR207供体载体中,得到的pENTRY质粒转化为具有化学活性的Top10E大肠杆菌用于所有克隆步骤的细胞。对得到的pENTRY质粒中的cDNA序列进行测序,以确认没有来自扩增过程的突变。将验证的序列亚克隆到二元载体pEarleyGate103中[78.]和pGWB454[79.]使用Gateway®技术在CAMV35S启动子的控制下分别在C-Terminus下产生GFP和RFP融合。通过限制映射和DNA序列分析证实所获得的构建体。
土壤N。边沁叶
通过在3-5周龄的叶子中表达C22DES融合来进行亚细胞定位测定法进行C22DES融合物或RFP蛋白N底栖动物在标准温室条件下(26±1°C下14小时光照,21±1°C下10小时黑暗),在直径为12厘米的单个盆中生长。不同GV3101的悬浮液渗透叶片A.肿瘤学家含有相应重组表达质粒的菌株[80,81.],如下制备。每个构建体的单个阳性菌落接种到3ml补充有抗生素(利福平50μg/ ml,庆大霉素25μg/ ml和质粒选择性抗生素)的3ml YEB培养基中,并在28℃和250rpm处温育过夜。连续旋转振动器。将1:100稀释过夜培养物接种到25ml含有相同抗生素的YEB培养基中并在相同条件下孵育。将培养物在4℃下以5000rpm离心15分钟,并将细菌颗粒重悬于浸润缓冲液(10mm,pH 5.6,10mM mgSO中4.和150 μM乙酰丁香酮)以达到最终OD600一、转型期的文化A.肿瘤学家菌株与培养物分开混合A.肿瘤学家表达HC-Pro的菌株[82.]以1:1的比例渗透到N底栖动物用注射器离开。对于共表达分析,将含有不同表达质粒的菌株以相同比例混合,并与HC-Pro混合(混合从未达到OD)600高于1)。在上述温室条件下,农农烟植物被培养3-4天。
共聚焦显微镜
用Olympus FV 1000共聚焦激光扫描显微镜,采用60倍浸水NA:1.20物镜,将渗入土壤的叶片切成小块,并对远轴表皮进行分析。Ramírez-Estrada等人描述了荧光可视化的发射窗口和用于图像采集的条件[83.].如Ramírez-Estrada等人所述,还进行了光漂白后的荧光恢复(FRAP)分析。[83.]
甾醇分析
N底栖动物从三个独立的农业渗透植物叶片冷冻在液氮中,地面与研钵和杵和冻干。样品(30 mg)与内标物混合[2.5] 5μg胆甾醇 μg棕榈酰胆甾醇,5 μg胆甾烷基-β-D-葡萄糖苷和5 μg棕榈酰-β-D-葡萄糖基-胆甾烷醇溶于氯仿-甲醇(2:1)],并用氯仿-甲醇(2:1)萃取,如Ramírez-Estrada等人所述[83.]. 如Lara等人(2018)所述,通过TLC分离游离甾醇、甾酯、甾苷和酰基甾基葡糖苷组分,并通过GC-MS测定其甾醇组成[75.].从每个样品中提取的四个甾醇级分中存在的那些计算总脊酸水平。
免疫印迹分析
可溶性(S)和膜(M)蛋白质组分N底栖动物如以前报道的那样,从大约10克的组织样本中获得了农业浸润的叶子[83.].如Bradford等人所述测定蛋白质浓度。,1976 [84.]. T组分的等效蛋白质量(超速离心前的样品)(约20 μg),M组分(约5 μg)和S组分(约20 用10%聚丙烯酰胺SDS凝胶电泳(TGX)对每个叶片样品进行分离™ 快播™ 凝胶(Bio-Rad)。SDS-PAGE电泳后,将蛋白转移到0.45μmol/L的培养基上 μm硝化纤维素膜(Amersham,GE Healthcare),使用Trans-Blot®Turbo™ 传输系统(Bio-Rad)。如Ramírez Estrada等人所述,使用兔抗GFP抗体(Invitrogen)进行免疫印迹[83.].
蛋白质结构的电子分析
C22DES(NP001234514.1)的3D结构使用Phyre2 fold recognition server建模[85.] (http://www.sbg.bio.ic.ac.uk/phyre2). 三级结构的预测是用羊角甾醇14α-脱甲基酶(Erg11p)进行的酿酒酵母[蛋白质数据库(PDB)ID:c4lxjA]作为模板,具有100%的置信度。对于膜-蛋白质相互作用,使用PPM web服务器从膜中蛋白质的取向(OPM)数据库中对预测的3D模型进行取向[31] (https://opm.phar.umich.edu/ppm_server).
蛋白质序列分析
S圣女果C22DES蛋白序列从索尔基因组网络网站 (http://solgenomics.net/)并作为查询使用BLAST工具在植物僵尸(https://phytozome.jgi.doe.gov),基诺梅奈(https://www.genome.jp/),ncbi.(https://www.ncbi.nlm.nih.gov/),广场(https://bioinformatics.psb.ugent.be/plaza/)以及集合植物(http://plants.ensembl.org)网站。使用的同源物的登录号列于附加文件中2.:表S1。蛋白质比对使用Clustalx v 2.0[86.]默认设置和Genedoc.软件用于对齐可视化和手动版。序列夹杂物的标准在最终取向上选择来自每个植物家族的一个C22DE,优选地C22DES是单拷贝基因。对于具有一个以上C22DES同源序列的植物物种,仅选择其中一个是基于每个同源序列与来自单一拷贝物种的C22DES的最高相似性。
对于序列徽标生成,使用WebLogo web服务器[87.] (https://weblogo.berkeley.edu/).
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发表的文章[及其补充信息文件]中。在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- 爆破:
-
基本局部对齐搜索工具
- C22DES:
-
甾醇C22去饱和酶
- CARC:
-
CRAC镜面序列
- 坚固:
-
胆固醇识别/相互作用氨基酸共识
- CYP编号:
-
细胞色素P450
- 数据仓库:
-
净重
- 呃:
-
内质网
- FRAP公司:
-
光漂白后的荧光恢复
- 气相色谱-质谱:
-
气相色谱 - 质谱
- 绿色荧光:
-
绿色荧光蛋白
- HCPRO公司:
-
HC-Pro消声抑制器
- 主控室:
-
膜接触区
- 外径600:
-
600时的光密度 纳米
- OPM:
-
膜中蛋白质的定位
- PCR:
-
聚合酶链反应
- 下午:
-
等离子体膜
- 招标书:
-
红色荧光蛋白
- 标准偏差:
-
标准偏差
- 十二烷基硫酸钠:
-
十二烷基硫酸钠
- SDS-PAGE:
-
SDS-聚丙烯酰胺凝胶电泳
- 薄层色谱法:
-
薄层色谱法
- TMH公司:
-
跨越式螺旋图案
参考
- 1.
Demel Ra,De Kruyff B.甾醇在膜中的功能。生物学习生物魔Acta。1976; 457:109-32。
- 2.
Hartmann-Bouillon M-A,Benveniste P.甾醇生物合成能力从玉米COREOPTILES的纯化膜级分。植物化学。1978; 17:1037-42。
- 3.
哈特曼文学硕士。植物甾醇与膜环境。植物科学趋势。1998;3(5):170–5.
- 4.
Ferrer A,Altabella T,Arróm,Boronat A.植物中共轭甾醇的新兴作用。Prog Lipid Res。2017; 67:27-37。
- 5.
布蒂,格雷贝。植物中依赖固醇功能的细胞过程。植物生物学。2009;12:705–13.
- 6.
Malinsky J,Opekarovám,Grossmanng,Tanner W.膜微膜,筏和植物和真菌的耐洗涤剂膜。Annu Rev植物Biol。2013; 64:501-29。
- 7。
Valitova JN、Sulkarnayeva AG、Minibayeva FV。植物甾醇:多样性,生物合成和生理功能。生物化学。2016;81(8):819–34.
- 8。
Grosjean K,蒙布兰特S,贝尼尔,Simon-Plas F,Gerbeau-Pissot P.植物脂质对膜组织的差异效果。J Biol Chem。2015; 290(9):5810-25。
- 9。
格伦瓦尔德C。游离甾醇、甾酯和甾苷对膜通透性的影响。植物生理学。1971;48(5):653–5.
- 10
Halling KK,Slotte JP。通过差分扫描量热法测定的磷脂双层植物甾醇膜特性,共振能量转移和洗涤剂诱导的溶解。Biochim Biophys Acta。2004; 1664:161-71。
- 11
Aboobucker SI,苏扎WP。植物为什么把谷甾醇转化为豆甾醇?前植物科学。2019;10:艺术。第354号。
- 12
Griebel T,Zeier J.在β-谷甾醇对植物 - 病原体相互作用中的蛋白甾醇转化的作用。工厂J.2010; 63(2):254-68。
- 13
番茄果实在低温和非低温条件下的脂质变化。植物化学。1991;30(3):757 - 61。
- 14.
Morikawa T,Mizutani M,OHTA D.细胞色素P450亚家族CYP710A基因在植物中编码甾醇C-22去饱和酶。Biochem Soc Trans。2006; 34(6):1202-5。
- 15.
Kida Y,Ohgiya S,Mihara K,Sakaguchi M。内质网NADPH-细胞色素P450还原酶的膜结构。Arch Biochem Biophys公司。1998;351(2):175–9.
- 16.
Park JW,Reed Jr,Brignac-Huber LM,返回WL。细胞色素P450系统蛋白位于内质网的不同区域中。Biochem J. 2014; 464(2):241-9。
- 17.
Morikawa T,Mizutani M,Aoki N,Watanabe B,Saga H,Saito S等人。细胞色素P450 CYP710A在拟南芥和番茄中编码甾醇C-22去饱和酶。植物细胞。2006; 18:1008-22。
- 18。
OHTA D,Mizutani M.甾醇C22-去饱和酶及其生物作用。异戊二烯合成植物和微生物:新概念和实验方法;2013. p。381-91。
- 19。
纳尔逊博士细胞色素P450多样性在生命之树。Biochim Biophys Acta蛋白质组学。2017;1866(2018):141–54.
- 20
陈W,李米克,杰伊特C,金S-C,陈F,yu J-h。真菌细胞色素P450单氧基酶:它们的分布,结构,功能,家庭扩张和进化起源。基因组Biol Evol。2014; 6(7):1620-34。
- 21
Arnqvist L, Persson M, Jonsson L, Dutta PC, Sitbon F.在转基因拟南芥中,CYP710A1和CYP710A4的过表达增加了豆甾醇水平,而谷甾醇水平下降。足底。2008;227:309-17。
- 22
Morikawa T、Saga H、Hashizume H、Ohta D。在Physcomitrella patens中编码甾醇C22去饱和酶的CYP710A基因作为植物甾醇生物合成途径进化保守性的分子证据。足底。2009;229:1311–22.
- 23
本维尼斯特P。甾醇的生物合成和积累。植物生物学年鉴。2004;55:429–57.
- 24
藤冈S,横田T。油菜素类固醇的生物合成与代谢。植物生物学年鉴。2003;54:137–64.
- 25
植物甾醇在植物生长发育中的作用。脂质研究进展2003;42:163-75。
- 26.
马舒勒、杜安H、比尔金M、阿里S。透过玻璃看拟南芥细胞色素p450:植物生物化学的窗口。植物化学版次。2006;5:205–37.
- 27.
Šrejber M,NavrátilováV,PaloncýováM,Bazgier V,Berka K,Anzenbacher P等,《膜附着哺乳动物细胞色素P450:膜对结构、药物结合和与氧化还原伙伴相互作用的影响概述》。金诺格生物化学。2018;183:117–36.
- 28.
Forés O, Arró M, Pahissa A, Ferrero S, Germann M, Stukey J, et al.;拟南芥表达Arvp的两种功能亚型,Arvp是一种参与细胞脂质稳态调节的蛋白。生物化学与生物物理学报,2006;
- 29.
Monk BC,Tomasiak TM,Keniya MV,Huschmann FU,Tyndall JDA,O'Connell JD,et al.跨越细胞色素P450的单个膜的结构表明相对于双层来定向催化结构域的限制。国家科学院学报。2014;111(10):3865–70.
- 30
奥特·RG、阿森斯塔德·K、赫拉特尼克·C、莱特纳·E、伯格勒·H、达姆·G。羊角甾醇C-14去甲基酶Erg11p缺失酵母中甾醇中间体的通量。生物化学生物物理学报。2005;1735:111–8.
- 31
Lomize MA,Pogozheva ID,Joo H,Mosberg HI,Lomize AL.OPM数据库和PPM web服务器:膜中蛋白质定位的资源。核酸研究,2012年;40:370–6.
- 32
Gnanasekaran T, Vavitsas K, Andersen-Ranberg J, Nielsen AZ, Olsen CE, Hamberger B等。异海松酸途径在本他烟中的异源表达及相关细胞色素P450酶n端修饰的影响生物医学工程学报2015;9(24):1-10。
- 33
Mustafa G,Nandekar PP,Camp TJ,Bruce NJ,Gregory MC,Sligar SG等。跨膜螺旋突变对细胞色素P450膜相互作用和功能的影响。生物物理杂志。2019;116:419–32.
- 34
Sagara Y,Barnes HJ,Waterman先生大肠杆菌功能性细胞色素P450C17缺少其疏水性氨基端子信号锚定。拱生物学生生物糖。1993; 304:272-8。
- 35
Yabusaki Y、Murakami H、Sakaki T、Shibata M、Ohkawa H。P450单加氧酶的基因工程修饰:P450/还原酶融合酶氨基末端疏水区和铰链区的功能分析。DNA。1988;7(10):701–11.
- 36
bunt g,wouters fs。用荧光标记的活细胞内分子活性的可视化。INT转速cytol。2004; 237:205-77。
- 37
戈林西北,乔杜里D,海曼AA,烧烤西南。膜相关蛋白的FRAP分析:横向扩散和膜胞质交换。生物物理杂志。2010;99:2443–52.
- 38.
Caño-Delgado A,Yin Y,Yu C,Vafeados D,Mora GarcíA S,Cheng J-C等。BRL1和BRL3是拟南芥中新的油菜素类固醇受体,在维管分化中发挥作用。发展。2004;131(21):5341–51.
- 39.
丹尼克·伯吉斯,法官。人去甲肾上腺素转运体跨膜区7丝氨酸突变对底物结合和转运的影响。神经化学杂志。1999;73(2):656–64.
- 40
马丁内斯加里卡,胡安内斯马,伊瓜尔JC,明加罗一世,巴尼翁MC。Rot1蛋白中的跨膜丝氨酸残基对酵母细胞的生存能力至关重要。生物化学杂志。2014;458:239–49.
- 41。
Epand RM, Thomas A, Brasseur R, Epand RF。胆固醇与划分成膜域的蛋白质的相互作用:综述。In:胆固醇结合和胆固醇转运蛋白;2010.p . 253 - 78。
- 42
di scala c,baier cj,埃文斯ls,威廉姆森ptf,fantini j,禁止fj。CARC和CRAC胆固醇识别基序在烟碱乙酰胆碱受体和其他膜结合受体中的相关性。在:膜的当前主题。1 ed。剑桥:elsevier公司;2017; 80:3-23。
- 43
Jamin N,Neumann J-M,Ostuni MA,VU TKN,Yao ZX,Mutail S等人。外周期苯二氮杂Zepine受体的胆固醇识别氨基酸共有序列的表征。mol内分泌。2005; 19(3):588-94。
- 44
Singh Ak,McMillan J,Bukiya An,Burton B,Parrill Al,Dopico Am。SLO1亚基细胞溶质C尾部的多种胆固醇识别/相互作用氨基酸共分(CRAC)基序决定了Ca2 +和电压 - 门控K +(BK)通道的胆固醇敏感性。J Biol Chem。2012; 287(24):20509-21。
- 45
Scott EE、Wolf CR、Otyepka M、Humphreys SC、Reed JR、Henderson CJ等。蛋白质-蛋白质和蛋白质-膜相互作用对P450功能的作用。药物代谢处置。2016;44:576–90.
- 46
Locuson CW,Wienkers LC,Jones JP,Tracy Ts。CYP2C9与细胞色素B5的蛋白质相互作用:对催化偶联的影响。药物元。2007; 35(7):1174-81。
- 47
Subramanian M,Low M,Locuson CW,Tracy TS.CYP2D6-CYP2C9蛋白质-蛋白质相互作用和异构体对底物结合和催化作用的选择效应。药物代谢处置。2009;37(8):1682–9.
- 48
Subramanian M,Tam H,郑H,Tracy Ts。CYP2C9-CYP3A4蛋白质 - 蛋白质相互作用:疏水性N末端的作用。药物元。2010; 38(6):1003-9。
- 49
我是S-C,Waskell L。微粒体细胞色素P450 2B4与其氧化还原伙伴细胞色素P450还原酶和细胞色素b5的相互作用。Arch Biochem Biophys公司。2011;507(1):144–53.
- 50
Nelson CH、Peng C-C、Lutz JD、Yeung CK、Zelter A。细胞维甲酸结合蛋白和CYP26B1之间的直接蛋白质相互作用和底物通道。费布斯莱特。2016;590(16):2527–35.
- 51
谢勒U、卡夫R、施罗德K-L、舒克W-H。微粒体细胞色素P450 52A3可溶性和功能性胞质结构域的产生。生物化学杂志。1994;269(17):12779–83.
- 52
克拉克BJ,Waterman Mr。牛氨基氨基 - 末端序列是在COS1细胞中表达官能杂液的表达所需的牛氨基末端序列。J Biol Chem。1991; 266(9):5898-904。
- 53。
Berka K、PaloncýováM、Anzenbacher P、Otyepka M。人细胞色素P450在脂膜上的行为。物理化学学士。2013;117:11556–64.
- 54
yu x,cojocaru v,mustafa g,salo-ahen omh,lepesheva gi,wade rc。CYP51的动态:功能和抑制剂设计的影响。j mol识别。2015; 28(2):59-73。
- 55
Fantini J,Di Scala C,Baier CJ,禁止FJ。血浆膜中蛋白质 - 胆固醇相互作用的分子机制:拓扑(倾斜)和共有(CARC / CRAC)结构域的功能区别。化学物理脂质。2016; 199:52-60。
- 56
Li H,Yao Z-X,Degenhardt B,Teper G,Papadopoulos V。外周型苯二氮卓受体胆固醇识别/相互作用氨基酸共识(CRAC)的胆固醇结合和HIV-TAT-CRAC肽对类固醇生成的抑制。美国国家科学院学报。2001;98(3):1267–72.
- 57
Jafurulla M、Tiwari S、Chattopadhyay A。G蛋白偶联受体中胆固醇识别氨基酸一致性(CRAC)基序的鉴定。生物化学Biophys Res Common。2011;404:569–73.
- 58
Di Scala C、Chahinian H、Yahi N、Garmy N、Fantini J。阿尔茨海默病β-淀粉样肽与胆固醇的相互作用:淀粉样孔形成的机制研究。生物化学。2014;53(28):4489–502.
- 59
Tan S,Zhang P,Xiao W,Feng B,Chen L-Y,Li S,等。TMD1结构域和CRAC基序决定MxIRT1与耐去污膜的结合和解离。交通。2017;19:122–37.
- 60。
Desai Aj,Dong M,Miller LJ。β-谷甾醇对升高膜胆固醇诱导1型胆囊蛋白受体功能障碍的有益效果。Clin Nutr。2016; 35(6):1374-9。
- 61
罗森豪斯·丹茨克A。深入了解胆固醇与离子通道结合的分子要求。当前顶层内存br。剑桥:爱思唯尔公司;2017;80:187–208.
- 62
Klahre U、Noguchi T、Fujioka S、Takatsuto S、Yokota T、Nomura T等。拟南芥DIMINUTO/DWARF1基因编码一种参与甾体合成的蛋白质。植物细胞。1998;10:1677–90.
- 63
Souter M、Topping J、Pullen M、Friml J、Palme K、Hackett R等。拟南芥的水螅突变体在甾醇谱、生长素和乙烯信号传导方面存在缺陷。植物细胞。2002;14:1017–31.
- 64
卡兰F,Fujioka S,Nelson T.甾醇甲基转移酶SMT1,SMT2和SMT3通过非溴烷类产品影响拟南芥开发。植物理性。2010; 153:741-56。
- 65。
杨永强,杨永明。植物nadph -细胞色素P450氧化还原酶。植物化学。2010;71:132-41。
- 66
王P,霍斯C,胡赛PJ。植物内质网-质膜接触部位。植物科学趋势。2017;22(4):289–97.
- 67
Manford AG、Stefan CJ、Yuan HL、MacGurn JA、Emr SD。内质网-质膜栓系蛋白调节细胞信号传导和内质网形态。开发单元。2012;23:1129–40.
- 68
臧杰,张T,侯赛平,王平。植物内质网膜接触部位的光学显微镜观察。微生物学杂志。2020;0(0):134–9.
- 69
Stefan CJ,Manford AG,Baird D,Yamada-Hanff J,Mao Y,EMR SD。OSH蛋白调节ER-血浆膜接触位点的磷酸阳性代谢。细胞[互联网]。2011; 144:389-401。https://doi.org/10.1016/j.cell.2010.12.034.
- 70
HAJ FG,SABET O,Kinkhabwala A,Wimmer-Kleikamp S,Roukos V,Han H-M等。通过内质网 - 结合蛋白 - 酪氨酸磷酸酶1b调节细胞 - 细胞接触区域的信号传导。Plos一个。2012; 7(5):艺术。不。E36633。
- 71。
Mehrshahi P、Stefano G、Andaloro JM、Brandizzi F、Froehlich JE、DellaPenna D。跨细胞器互补重新定义了内质网和叶绿体的生化连续性。美国国家科学院学报。2013;110(29):12126–31.
- 72。
Tavassoli S,Chao JT,Young BP,Cox RC,Prinz WA,De Kroon AIPM,等。质膜-内质网接触位点调节磷脂酰胆碱的合成。EMO代表,2013年;14(5):434–40.
- 73
Quon E,Sere YY,Chauhan N,Johansen J,Sullivan DP,Dittman JS等。内质网质膜接触位点整合了甾醇和磷脂的调节。公共科学图书馆。2018;16:1–41.
- 74
Prinz Wa,Toulmay A,Balla T.膜接触地点的功能宇宙。NAT Rev Mol Cell Biol。2020; 21(1):7-24。
- 75
Lara JA、Burciaga Monge A、Chávez A、Revés M、Lavilla R、ArróM等。番茄甾醇酰基转移酶生物合成的鉴定和特性。前植物科学。2018;9月(5月):1日至18日。
- 76
Stolowich NJ,Petrescu Ad,Huang H,Martin GG,Scott Ai,Schroeder F.甾醇载体蛋白-2:结构揭示了功能。细胞mol寿命。2002; 59:193-212。
- 77。
Sharma A,Rana S,Clood,Misra P,Dhar Mk,Lattoo Sk。甾醇δ22-去饱和酶的表征和过表达,一种关键酶调节脊索甾醇的生物合成,并用含有甘露花糖苷的糖苷(L.)Dunal。植物SCI。2020; 301:1-11。https://doi.org/10.1016/j.plantsci.2020.110642.
- 78。
Earley KW, Haag JR, Pontes O, Opper K, Juehne T, Song K,等。植物功能基因组学和蛋白质组学的通道兼容载体。植物j . 2006; 45(4): 616 - 29。
- 79
Nakagawa T,Suzuki T,Murata S,Nakamura S,Hino T,Maeo K,等。改进的网关二元载体:高性能载体,用于在植物转基因分析中创建融合构建体。Biosci Biotechnol Biochem。2007; 71(8):2095-100。
- 80
火花IA,散迹J,Kearns A,Hawes C.烟草植物中的荧光融合蛋白的快速,瞬态表达以及稳定转化的植物的产生。NAT PROTOC。2006; 1(4):2019-25。
- 81
Wydro M、Kozubek E、Lehmann P。烟草叶片瞬时农杆菌介导基因表达系统的优化。生物化学学报。2006;53(2):289–98.
- 82
Goytia E、Fernández Calvino L、Martínez García B、López Abella D、López Moya JJ。在瞬时表达系统中产生对蚜虫传播有促进作用的李痘病毒HC。维罗尔将军。2006;87:3413–23.
- 83。
Ramírez-estrada k,Castillo n,Lara Ja,Arróm,鲍罗纳特A,Ferrer A等人。番茄UDP-葡萄糖甾醇糖基转移酶:编码酶的细胞溶质和膜相关形式的一种发育和应激受调节基因的家族。前植物SCI。2017; 8(六月):1-21。
- 84。
布拉德福德mm。利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物化学。1976; 72:248-54。
- 85
Kelley LA, Mezulis S, Yates CM, Wass MN, Sternberg MJE。蛋白质建模、预测和分析的Phyre2网站门户。Nat Protoc。2015;10(6):845 - 58。
- 86
Larkin Ma,Blackshield G,Brown NP,Chenna R,McGettigan Pa,McWilliam H,等。Clustal W和Clustal X 2.0版。生物信息学。2007; 23(21):2947-8。
- 87
克鲁克斯GE, Hon G, Chandonia J-M, Brenner SE。WebLogo:一个序列logo生成器。基因组研究》2004;14:1188 - 90。
确认
LGG获得了西班牙经济与竞争部(Ministerio de Economia y Competitividad)的博士奖学金(参考BES-2014-070425)。我们还感谢农业基因组学研究中心(CRAG)的显微镜和成像、基因组学和植物生长设施的工作人员。
基金
这项工作由Feder / Ministerio De Ciencia,InnoverCiónyFencia-Agencia Estatal deInvestigaCión(西班牙),2017SGR710的Grants / Ministerio de Cenencia提供资金来自Generaltat de Catalunya,并由Centitat de Catalunya的Cerca计划。我们还通过“R&D中的卓越中心”2016-2019(SEV-2015-0533),您还承认西班牙Ministio deCongonyíay的财政支持。该资助者尚未参与研究的设计,在收集,分析和解释数据以及写作稿件中。
作者信息
从属关系
贡献
AB、TA和AF构思设计了本研究;LGG在甾醇分析中发挥了MA的作用。LGG和AB写了手稿。所有作者均已阅读并批准稿件。
通讯作者
道德宣言
道德认可和参与同意
不可镀钱。
出版许可
不可镀钱。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:补充图S1
,C22DES催化反应。
补充文件2:补充表S1
,用于序列分析的植物C22去饱和酶列表。
附加文件3:补充图S2
植物C22DES球状结构域中存在保守的CRAC和CARC基序。
附加文件4:补充图S3
番茄C22DES三维结构预测中可能相关的CRAC和CARC基序的定位。
补充文件5:补充表S2
制备本研究结构所用的引物和载体。
附加文件6:补充图S4
,图2中所示的Western印迹的全长图像。5.C
附加文件7:补充图S5
,图2中所示的Western印迹的全长图像。5.D
附加文件8:补充图S6
,western blot的全长图像如图所示。6..
权利和权限
开放存取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
Gutiérrez-garcía,L.,Arró,M.,Altabella,T.等等。番茄甾醇C22去饱和酶的结构与功能分析。BMC植物杂志21,141(2021)。https://doi.org/10.1186/s12870-021-02898-7.
收到:
认可的:
出版:
关键词
- 西红柿
- 甾醇新陈代谢,斯蒂姆沃斯醇
- β-谷甾醇
- 细胞色素P450
- 甾醇C22-去饱和酶,内质网