- 研究GydF4y2Ba
- 开放获取GydF4y2Ba
- 出版:GydF4y2Ba
与甲藻相比,在剧烈波动的光照条件下进行光合作用驯化可以加快硅藻的生长GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba,商品编号:GydF4y2Ba164GydF4y2Ba(GydF4y2Ba2021GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
硅藻占全球初级生产力的20%,能够适应动态环境。在浮游植物的年度演替中,硅藻总是比甲藻开花早。然而,硅藻如何适应动态环境,特别是在不断变化的光照条件下,仍然不清楚。GydF4y2Ba
结果GydF4y2Ba
比较了红潮硅藻在波动光照条件下的生长和光合作用GydF4y2Ba骨骼肿itaTumGydF4y2Ba赤潮甲藻GydF4y2BaAmphidinium carterae.GydF4y2Ba那GydF4y2BaProrocentrum磷比GydF4y2Ba那GydF4y2Ba米基莫托伊GydF4y2Ba、模型硅藻GydF4y2BaPhaeodactylum tricornutumGydF4y2Ba那GydF4y2Ba海链藻GydF4y2Ba和模型Dinoflagellate.GydF4y2Ba共生菌GydF4y2Ba.硅藻生长得更快,并始终保持较高的光合作用水平。质子梯度调节5 (Proton Gradient Regulation 5, PGR5)是硅藻光合电子流的特异性抑制剂,是波动光下保护其光合器官的重要机制。相比之下,鞭毛藻对该抑制剂不敏感。因此,我们研究了在模型硅藻中,PGR5是如何在光波动下发挥作用的GydF4y2BaP三角菌GydF4y2Ba通过敲除和过表达PGR5。PGR5的过表达降低了光系统I受体侧限制(Y (NA)),增加了在严重波动光下的生长速率GydF4y2BaPGR5.GydF4y2Ba.GydF4y2Ba
结论GydF4y2Ba
硅藻适应于比堇青树更好的光线状况。PGR5在硅藻中可以调节它们的光合电子流量,并在严重的光照波动下加速它们的生长,支持在先锋绽放的动态环境下的快速生物量积累。GydF4y2Ba
背景GydF4y2Ba
在上升季节期间绽放为海洋提供了一年的生产力,并促进了全球生化循环[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba].在早春,先驱硅藻绽放主要来自熔化的海冰或沉积物,这些冰或沉积物被带到Euphotic区[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].随着硅藻绽放经济衰退,物质和能量转化为海洋沉积物和随后的丁食地植物或浮游植物的盛开[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba]. 然而,硅藻和甲藻之间的年华演替机制尚不清楚。GydF4y2Ba
为了确定连续水华的必要因素,人们进行了许多研究,并对监测数据进行了分析。用甲藻代替硅藻的一个关键原因是营养[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba]. 溶解硅酸盐的减少加速了硅藻生物量的下降,低营养增加了甲藻的竞争力[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba].硅藻华的形成需要(但不确定)足够的硅酸盐[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba14GydF4y2Ba]. 冬末的气温也不足以让硅藻在这个季节开花[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba]. 一些研究人员认为[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba]还有风[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba]可以是多产硅藻的刺激,需要进一步验证。但是,这些独立因素可能不适用于所有情况[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba21GydF4y2Ba].因此,迄今为止,不确定为什么硅藻盛开在短期内形成大规模生物量,哪个因子发出盛开的到达。由于风,湍流,上升系统,波浪和表面镜头效应而导致光波波动[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba24GydF4y2Ba]是在海洋调查中被监控但忽视的重要环境因素[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].GydF4y2Ba
值得注意的是,硅藻偏好并适应这些动态环境,尤其是波动条件波动。暂时增强的风可以在几天内加速硅藻的生长[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba]. 此外,硅藻比甲藻更能适应湍流环境[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba].分层后湍流减小被认为是甲藻水华的先决条件[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba27GydF4y2Ba]. 此外,冬季和春季波高越大,硅藻的光波动就越剧烈。先锋硅藻被吹到浅水中,水华主要发生在50分钟内 从表面看,我甚至可以集中精力在表面上[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba],而甲藻水华通常在地下,深度超过10 米[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba].海面光强达到2000 μmol mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba有时甚至更多[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba]. 然而,在深度约为10的情况下,照度有时可以降低到1% 米[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba33GydF4y2Ba,尤其是硅藻藻华[GydF4y2Ba14GydF4y2Ba]. 最后,硅藻在上升流系统中占绝对优势[GydF4y2Ba35GydF4y2Ba那GydF4y2Ba36GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba38GydF4y2Ba那GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba].硅藻可以在高强度上升流区域和上升流压力时期占据主导地位[GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba].相比之下,Dinoflagellates富含稳定地区,并且只能容忍中等和周边升降区域[GydF4y2Ba40GydF4y2Ba],上升流松弛期[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba45GydF4y2Ba那GydF4y2Ba48GydF4y2Ba那GydF4y2Ba49GydF4y2Ba,或向下沉过渡时期[GydF4y2Ba45GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].除了营养和温度,其他更复杂的因素也会影响硅藻和鞭毛藻水华的演替。这些特殊而多变的条件意味着硅藻面临着复杂或多重的压力,尤其是波动的光线[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].GydF4y2Ba
关于水华演替的生物学机制的知识仍然有限。硅藻被认为具有特殊、高效、适应性强的光合作用[GydF4y2Ba51GydF4y2Ba那GydF4y2Ba52GydF4y2Ba那GydF4y2Ba53GydF4y2Ba].藻黄质- chl a/c复合物(FCP)是硅藻中所特有的,在低光下能有效地捕获光能,在高光下能耗散多余的能量[GydF4y2Ba54GydF4y2Ba].然而,只有很少的研究关注这些海洋光合生物是如何对光波动作出反应的[GydF4y2Ba55GydF4y2Ba].在目前的研究中,比较了三种硅藻的生长和光合作用和在轻度波动的光(MFL)和严重波动的光(SFL)条件下进行的四种硅藻土。硅藻表现出比波动光下的四种丁基曲素更高的生长率和更稳定的光合活性。还发现硅藻对质子梯度调节(PGR)5 / PGR11依赖性循环电子流量(CEF)的抑制剂敏感,响应光波动的潜在路径[GydF4y2Ba56GydF4y2Ba那GydF4y2Ba57GydF4y2Ba那GydF4y2Ba58GydF4y2Ba,而鞭毛藻没有参与这项工作。GydF4y2Ba
Phaeodactylum tricornutumGydF4y2Ba被用作模型,以研究硅藻的响应如何在海洋中波动而导致由于其完整的基因组序列和预发达的变换技术[GydF4y2Ba59GydF4y2Ba那GydF4y2Ba60GydF4y2Ba那GydF4y2Ba61GydF4y2Ba].过度的GydF4y2BaPGR5.GydF4y2Ba与以往陆地和淡水光合作用的研究结果不同,sFL只能促进生长和降低光合速率。我们的结果表明,海洋硅藻特殊的光合作用使其能够更好地生长和适应汹涌的海面和强烈的上升流系统。GydF4y2Ba
结果GydF4y2Ba
波动光下海洋硅藻和甲藻的生长和光合活性GydF4y2Ba
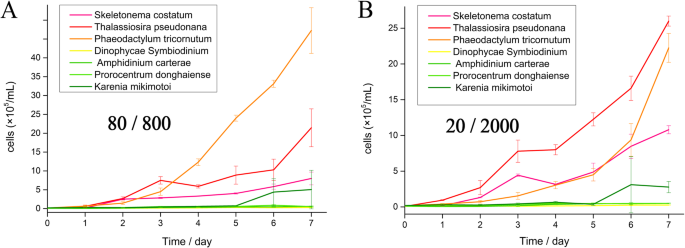
模拟了上升流季节海水表面的光环境,研究了海洋硅藻的生长速率GydF4y2BaP三角菌GydF4y2Ba还有甲藻GydF4y2Bap .磷比GydF4y2Ba和GydF4y2BaK三木通GydF4y2Ba相比。在漏液和漏液条件下,3种硅藻的生长速度都快于4种鞭毛藻。GydF4y2Ba1GydF4y2Ba).GydF4y2Ba
赤潮硅藻生长曲线GydF4y2BaS中肋骨GydF4y2Ba赤潮甲藻GydF4y2Ba答:carteraeGydF4y2Ba那GydF4y2Bap .磷比GydF4y2Ba,GydF4y2BaK三木通GydF4y2Ba、模型硅藻GydF4y2BaP三角菌GydF4y2Ba那GydF4y2BaT. Pseudonana.GydF4y2Ba和模型Dinoflagellate.GydF4y2Bad . SymbiodiniumGydF4y2Ba下GydF4y2Ba一种GydF4y2Ba加入1分钟的明亮光(800μmol光子M后GydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(80 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)以及GydF4y2BaB.GydF4y2Ba强光(2000 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(20 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).培养实验重复三次GydF4y2Ba
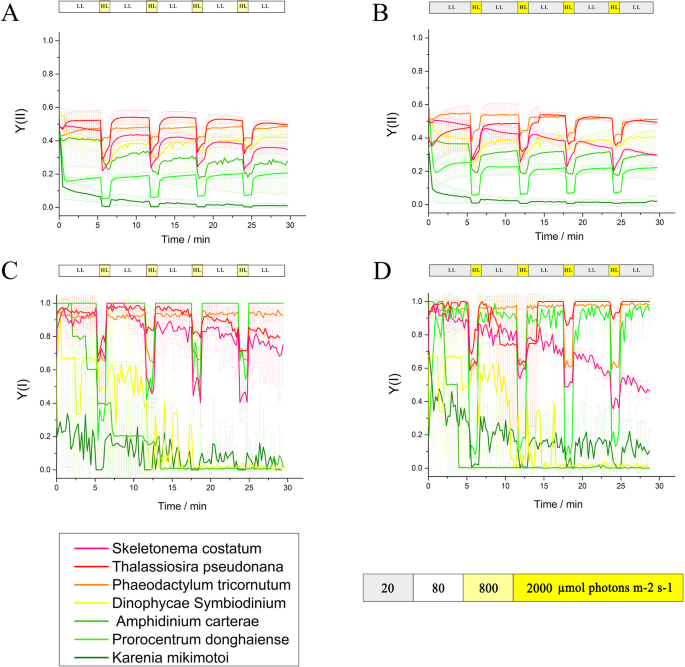
为了研究这些藻类在动态光胁迫下的光合活性,测定了PSI和PSII产量及相关参数。与鞭毛藻相比,硅藻的Y(I)和Y(II)波动较小且更稳定,且在强弱光之间持续转换。当被突然的强光照射时,他们也会保持较高的活跃水平。打开被测光后,Y(II)值为GydF4y2Bap .磷比GydF4y2Ba和GydF4y2BaK三木通GydF4y2Ba迅速下降,小于0.3(图。GydF4y2Ba2GydF4y2Ba). 三种甲藻的Y(NA)无规律地增加。在轻度光照波动条件下,硅藻的Y(NA)值低于对照GydF4y2BaK三木通GydF4y2Ba,而GydF4y2Bap .磷比GydF4y2Ba, Y(ND)值较高(图SGydF4y2Ba1GydF4y2Ba).GydF4y2Ba
一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba叶绿素和GydF4y2BaCGydF4y2Ba那GydF4y2BaD.GydF4y2Ba赤潮硅藻的P700荧光GydF4y2BaS中肋骨GydF4y2Ba赤潮甲藻GydF4y2Ba答:carteraeGydF4y2Ba那GydF4y2Bap .磷比GydF4y2Ba,GydF4y2BaK三木通GydF4y2Ba、模型硅藻GydF4y2BaP三角菌GydF4y2Ba那GydF4y2BaT. Pseudonana.GydF4y2Ba和模型Dinoflagellate.GydF4y2Bad . SymbiodiniumGydF4y2Ba下GydF4y2Ba一种GydF4y2Ba那GydF4y2BaCGydF4y2Ba加入1分钟的明亮光(800μmol光子M后GydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(80 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).GydF4y2BaB.GydF4y2Ba那GydF4y2BaD.GydF4y2Ba强光(2000 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(20 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).实验重复三次GydF4y2Ba
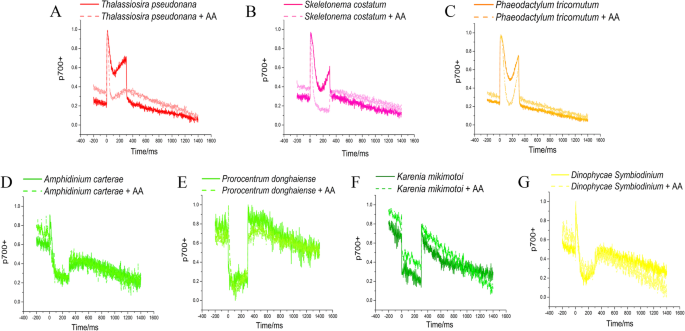
在深色适应后的第一个SP下测量P700的快速动力学,AA用于抑制PGR5 / PGR1-调节的CEF途径。硅藻中的P700在SP期间保持高氧化水平并对AA敏感(图。GydF4y2Ba3.GydF4y2BaSGydF4y2Ba1GydF4y2Ba).GydF4y2Ba
P700在300℃下的快速动力学 暗适应后ms-SP有无10 赤潮硅藻中的μM抑制剂抗霉素A(AA)GydF4y2BaB.GydF4y2BaS中肋骨GydF4y2Ba赤潮甲藻GydF4y2BaD.GydF4y2Ba答:carteraeGydF4y2Ba那GydF4y2BaE.GydF4y2Bap .磷比GydF4y2Ba,GydF4y2BaFGydF4y2BaK三木通GydF4y2Ba、模型硅藻GydF4y2BaCGydF4y2BaP三角菌GydF4y2Ba那GydF4y2Ba一种GydF4y2BaT. Pseudonana.GydF4y2Ba和模型Dinoflagellate.GydF4y2BaGGydF4y2Bad . SymbiodiniumGydF4y2Ba.使用原点9.0将数据归一化到[0,1]GydF4y2Ba
PGR5的生长和光合参数被敲低并过表达GydF4y2BaP三角菌GydF4y2BamFL和sFL下GydF4y2Ba
由于硅藻对抑制剂AA敏感,我们使用了GydF4y2BaP三角菌GydF4y2Ba,模型硅藻具有稳定且有效的转化方法,研究了硅藻中的PGR5是否响应了光波动。生物信息学分析表明,代表的61-132个碱基对区域GydF4y2BaPGR5.GydF4y2Ba在里面GydF4y2BaP三角菌GydF4y2Ba是保守的,前20个碱基形成一个潜在的信号肽,用SignalP-3.0 (GydF4y2Bahttp://www.cbs.dtu.dk/services/SignalP-3.0/GydF4y2Ba).叶绿素,肾小球,肾小球和硅藻土的PGR5在与蓝藻相同的进化分支上,但陆地绿色植物的植物在另一个分支上。发现硅藻pgr5更接近phaeophyta和肾小球酵母pgr5。在Dinoflagelate中发现了类似于PGR5的蛋白质。然而,缺少几个保守的部位,特别是与图案1中的那些相比,观察到其他植物和藻类中没有与序列的同源性(图。GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
我们构建了5oE-1和5KN-I1,并使用PCR扩增,定量PCR和Western印迹分析验证它们。选定的藻类菌株中的沉默或过度表达效应是显着的(图SGydF4y2Ba3.GydF4y2Ba).在每个栽培处理中,GydF4y2BaPGR5.GydF4y2Ba保持过表达和敲低效应,但在波动的光照下PGR5表达明显高于恒定光(CL)条件下的波动。GydF4y2Ba
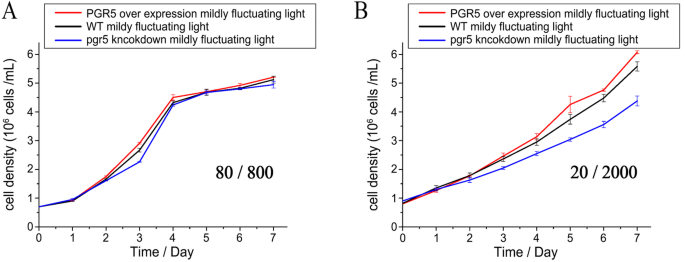
增长GydF4y2BaP三角菌GydF4y2Ba在波动光下进行了下一步研究(图。GydF4y2Ba4.GydF4y2Ba).WT、5OE-1和5KN-i1在漏液条件下没有差异。相反,在sFL条件下,5KN-i1的生长速度受到了显著限制,而5OE-1的生长速度得到了提高。GydF4y2Ba
增长曲线下GydF4y2Ba一种GydF4y2Ba加入1分钟的明亮光(800μmol光子M后GydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(80 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)以及GydF4y2BaB.GydF4y2Ba强光(2000 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)至每5分钟弱光(20 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).培养实验重复3次。所示值为三次生物重复的平均值GydF4y2Ba
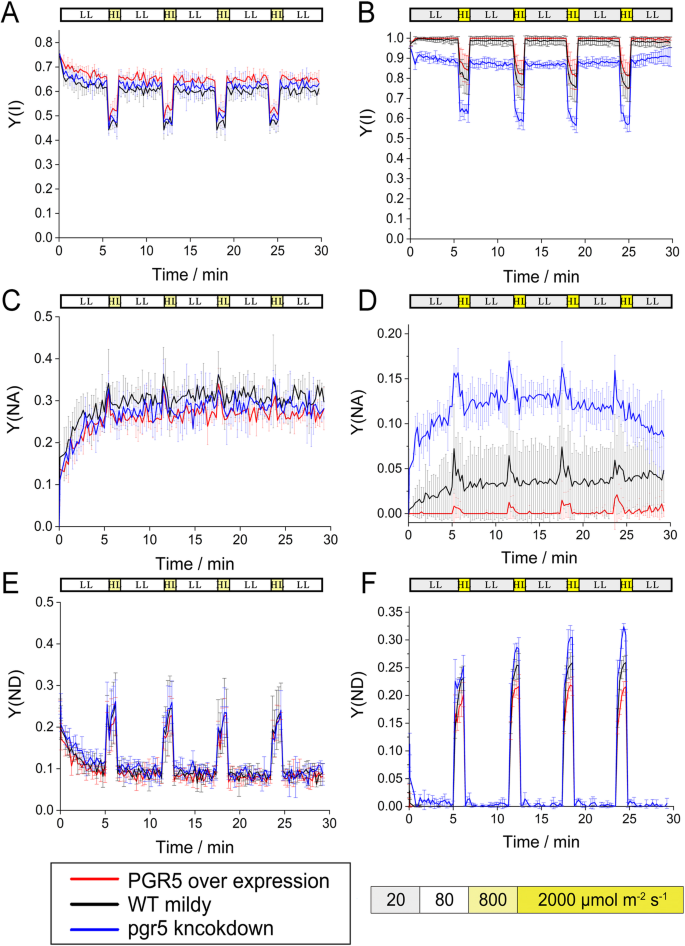
测定了WT、5OE-1和5KN-i1在漏液和sFL下的光合参数。漏液和sFL的P700参数差异显著(图。GydF4y2Ba5.GydF4y2Ba).在漏液条件下,WT、5OE-1和5KN-i1的PSI产率基本相同,但5KN-i1的PSI产率由于供体侧限制的增加而略有增加。但在sFL下,5KN-i1的PSI受体侧受到严重限制,而5OE-1的限制较低。强、弱光条件下的Y(NA)值、暗、暗条件下的Y(ND)值与强光条件下的Y(ND)值的变化趋势相同。GydF4y2Ba
P700的光合参数。GydF4y2Ba一种GydF4y2Ba那GydF4y2BaCGydF4y2Ba和GydF4y2BaE.GydF4y2Ba:在漏液条件下,加入1分钟的强光(暗黄色,800 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)到每5分钟的低光(白色,80μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba);GydF4y2BaB.GydF4y2Ba那GydF4y2BaD.GydF4y2Ba和GydF4y2BaFGydF4y2Ba:在添加1后的sFL下 强光最小值(亮黄色,2000) μmol/mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)每5个 最低微光(灰色,20 μmol/mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).所示值是至少三次生物重复的平均值。GydF4y2Ba一种GydF4y2Ba和GydF4y2BaB.GydF4y2Ba:Y(i),psi产量;GydF4y2BaCGydF4y2Ba和GydF4y2BaD.GydF4y2Ba: Y(NA), PSI接受方限制;GydF4y2BaE.GydF4y2Ba和GydF4y2BaFGydF4y2Ba: Y(ND), PSI供方限制GydF4y2Ba
其他光合特性在WT、5OE-1和5KN-i1之间也表现出较大的差异。GydF4y2Ba6.GydF4y2Ba).5KN-i1的1-qL和NPQ在强光下降低,5KN-i1的Y(II)在强光下增加,而5OE-1的NPQ和1-qL在强光下增加。在sFL条件下,WT、5OE-1和5KN-i1之间的NPQ差异更明显,但总体上较小。然而,在sFL下,1-qL差异较小。Y(II)值也不同,5KN-i1的Y(II)值在漏液条件下最高,与WT和5OE-1的Y(II)值相等。此外,5KN-i1中的1-qL在mFL下由暗转暗时增加,而5OE-1中的1-qL降低。GydF4y2Ba
PSII的光合参数,GydF4y2Ba一种GydF4y2Ba那GydF4y2BaCGydF4y2Ba和GydF4y2BaE.GydF4y2Ba:在漏液条件下,加入1分钟的强光(暗黄色,800 μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)到每5分钟的低光(白色,80μmol光子mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba); 和GydF4y2BaB.GydF4y2Ba那GydF4y2BaD.GydF4y2Ba和GydF4y2BaFGydF4y2Ba:在添加1后的sFL下 强光最小值(亮黄色,2000) μmol/mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)每5个 最低微光(灰色,20 μmol/mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba).所示值是至少三次生物重复的平均值。GydF4y2Ba一种GydF4y2Ba和GydF4y2BaB.GydF4y2Ba: NPQ,非光化学淬火;GydF4y2BaCGydF4y2Ba和GydF4y2BaD.GydF4y2Ba:Y(II),PSII光能的实际转换效率;GydF4y2BaE.GydF4y2Ba和GydF4y2BaFGydF4y2Ba:1-qL,PQ氧化还原状态GydF4y2Ba
讨论GydF4y2Ba
硅藻对波动光的适应能力强于甲藻,这支持了硅藻在浮游植物演替的先锋开花过程中的优势GydF4y2Ba
许多研究人员专注于海洋浮游植物盛开的继承。他们认识到耗尽营养,尤其是硅酸盐,可以引起硅藻毛衰退和随后的丁络石绽放[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba11GydF4y2Ba]. 然而,早期硅藻水华的关键因素仍然存在争议[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba21GydF4y2Ba].研究人员试图确定一些因素,以提高先锋藻华的竞争力,并在几天内支持硅藻生物量的巨大增长[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba62GydF4y2Ba].GydF4y2Ba
除了营养,温度,风和光线之外还在调查,并被认为是先锋绽放的影响力。然而,所有这些传统因素都是矛盾的,并在一些海洋调查中被区域限制。虽然Dinoflageles的规模随着氮气或磷酸含量的增加而扩增,但不能取代硅藻的先驱作用[GydF4y2Ba63GydF4y2Ba那GydF4y2Ba64GydF4y2Ba那GydF4y2Ba65GydF4y2Ba那GydF4y2Ba66GydF4y2Ba].甲藻可以在冬天开花,也可以在硅藻开花后迅速开花[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba67GydF4y2Ba那GydF4y2Ba68GydF4y2Ba那GydF4y2Ba69GydF4y2Ba]当硅藻开花时,由于温度较低,沟鞭藻囊可能发芽缓慢。温度升高对促进开花期和增加捕食压力有相反的作用[GydF4y2Ba2GydF4y2Ba]. 有时,风可以减少开花[GydF4y2Ba2GydF4y2Ba],光线似乎失去了对花朵的影响。实际上,光照强度的平均值并不能很好地反映实际的光环境。除了环境影响外,硅藻和甲藻在适应和生长方面的差异也很重要。硅藻的高生长速率是早期开花的关键[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba68GydF4y2Ba那GydF4y2Ba70GydF4y2Ba]. 近年来,一些研究表明,硅藻在漫长、寒冷、黑暗的环境中具有很强的适应和恢复能力,支持了冬末开花[GydF4y2Ba71GydF4y2Ba那GydF4y2Ba72GydF4y2Ba那GydF4y2Ba73GydF4y2Ba].事实上,对复杂和动态环境的适应在大规模的春季水华中也很重要,因为强大的海岸上升流和没有稳定层结的剧烈波浪。GydF4y2Ba
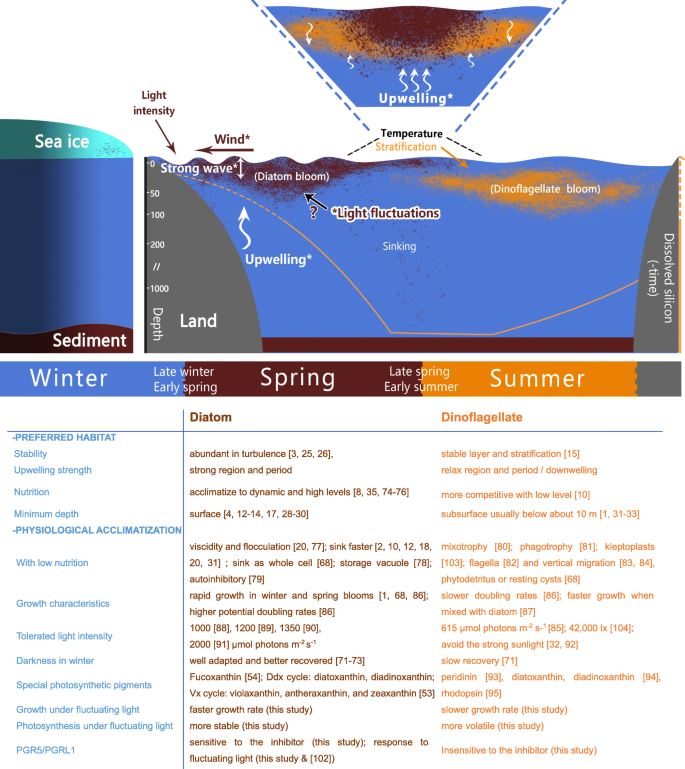
因此,目前的研究表明,光波动和硅藻更好地适应波动的光,除了传统上已知的,也可能是硅藻优势在先锋开花的原因(图。GydF4y2Ba7.GydF4y2Ba[GydF4y2Ba74GydF4y2Ba那GydF4y2Ba75GydF4y2Ba那GydF4y2Ba76GydF4y2Ba那GydF4y2Ba77GydF4y2Ba那GydF4y2Ba78GydF4y2Ba那GydF4y2Ba79GydF4y2Ba那GydF4y2Ba80GydF4y2Ba那GydF4y2Ba81GydF4y2Ba那GydF4y2Ba82GydF4y2Ba那GydF4y2Ba83GydF4y2Ba那GydF4y2Ba84GydF4y2Ba那GydF4y2Ba85GydF4y2Ba那GydF4y2Ba86GydF4y2Ba那GydF4y2Ba87GydF4y2Ba那GydF4y2Ba88GydF4y2Ba那GydF4y2Ba89GydF4y2Ba那GydF4y2Ba90GydF4y2Ba那GydF4y2Ba91GydF4y2Ba那GydF4y2Ba92GydF4y2Ba那GydF4y2Ba93GydF4y2Ba那GydF4y2Ba94GydF4y2Ba那GydF4y2Ba95GydF4y2Ba那GydF4y2Ba96GydF4y2Ba那GydF4y2Ba97GydF4y2Ba那GydF4y2Ba98GydF4y2Ba那GydF4y2Ba99GydF4y2Ba])。然而,在过去几年中研究了陆地和淡水中的光合生物中的动态光,但海藻的关键机制仍然未知。硅藻在动态环境中的优势表明,适应波动光的潜在机制,这赋予了更喜欢稳定环境的DinoFlagellates的优势。具有足够的营养和没有温度限制,硅藻在短期内具有比轻度和严重光波动在短期内的短期内的增长优势更多(图。GydF4y2Ba1GydF4y2Ba),它可以在强大的升高系统或湍流海面上支持硅藻的快速绽放和绝对优势。GydF4y2Ba
传统的硅藻和甲藻水华季节演替模型(不排除区域和年差异的特殊性以及未来气候变化的影响)。上半部分为硅藻和鞭毛藻水华的分布及环境因素。底部列出了目前已知的与演替相关的生物学特性。溶解硅的曲线参考了以前的工作[GydF4y2Ba10GydF4y2Ba].图形代表了盛开的连续(光,风和晚期硅酸盐浓度)的监测,决定性,非生物因子,虚线代表因子不足(温度和早期硅酸盐浓度)。星号表示与波动的环境因子相关GydF4y2Ba
光合作用是生长响应动态环境胁迫的重要生理过程[GydF4y2Ba56GydF4y2Ba硅藻表现出比鞭毛藻更有效的光合作用和在光波动条件下更强的抗性(图。GydF4y2Ba2GydF4y2Ba). 在强光和弱光之间的动态变化中,硅藻的PSI和PSII能够稳定这些波动并保持高水平的活性。硅藻能更有效地利用突然出现的强光(即使在阳光饱和的情况下)[GydF4y2Ba14GydF4y2Ba那GydF4y2BaOne hundred.GydF4y2Ba])因此,实际PSII和PSI产量高于甲藻。即使在饱和光照下,有效的光合作用也能维持海洋表面巨大的生物量和足够的适应能力。即使在sFL下,硅藻也保持较低的PSI受体限制(GydF4y2Ba图。S1GydF4y2Ba)这表明它们能更有效地调节波动光下的过剩电子,从而使它们具有更强的抵抗和利用波动光来适应强上升流周期和强上升流区域的能力。GydF4y2Ba
这些结果表明,光的波动会影响硅藻和鞭毛藻之间的竞争。GydF4y2Ba
光合作用可以支持先锋硅藻在波动光下的快速生长GydF4y2Ba
光合作用对光波动的适应意味着可以促进生长的硅藻中的分子机制。认为硅藻缺乏FLV(一种型黄酮蛋白),这是响应于淡水藻类波动的波动的关键蛋白[GydF4y2Ba56GydF4y2Ba那GydF4y2Ba101GydF4y2Ba]. 值得注意的是,在硅藻蛋白质组中已经报道了另一种抗光波动的潜在关键蛋白PGR5[GydF4y2Ba120GydF4y2Ba]. 本研究发现,PGR5在硅藻对波动光的适应中起重要作用。GydF4y2Ba
抗霉素A是PGR5 / PGRL1的有效和特异性抑制剂,其取决于CEF。以前,测量了硅藻基CEF待低,并且CEF(取决于PGR5 / PGR11),响应于由于中等治疗而响应光照波动[GydF4y2Ba55GydF4y2Ba]. 此外,在波动的光照下,PGRL1水平的增加或降低并没有导致硅藻光合作用和生长的增强[GydF4y2Ba102GydF4y2Ba]. 在硅藻中添加AA后,P700的氧化还原状态明显低于甲藻(图。GydF4y2Ba3.GydF4y2Ba),表明PGR5/PGRL1是硅藻对各种光胁迫的关键响应,硅藻具有更有效的CEF。虽然鞭毛藻含有PGR5同源基因,但它没有或几乎没有功能,这可能是由于中核基因组中有丰富的转移基因,可能是与PGRL1的融合基因[GydF4y2Ba103GydF4y2Ba],或最小保守c端序列(GydF4y2Ba图。S2GydF4y2Ba).GydF4y2Ba
在目前的研究中,PGR5蛋白水平提高了sFL条件下的光合电子流和生长速率[GydF4y2Ba15GydF4y2Ba]充满阳光[GydF4y2Ba15GydF4y2Ba那GydF4y2BaOne hundred.GydF4y2Ba]). 在5KN-i1、WT和5OE-1的轻度光照波动下,未发现显著的生长差异(图。GydF4y2Ba4.GydF4y2Baa) 是的。然而,在sFL条件下,5KN-i1的生长速率显著下降,而5OE-1则迅速增长。这意味着硅藻中的PGR5对光的强度波动很敏感,这一点以前被低估了。光合作用也显示出同样的结果,尤其是PSI[Y(NA)]的受体侧限制(图。GydF4y2Ba5.GydF4y2Ba).事实上,PGR5通过Cyt b6f或PQ的ATP生成和电子传递来增加ATP/NADPH的产生比例,从而阻止了受体侧PSI的过度还原。与以往研究动态光对陆生植物和淡水藻类的影响相比,本研究发现硅藻对不同光波动强度的特殊响应与偏好海面集中的水华和强烈的上升流系统有关。事实上,硅藻总是面临频繁和巨大的光强度变化,因为高细胞浓度的遮蔽,风搅动,和表面透镜效应。这些结果也揭示了光合作用在硅藻生长中的重要作用。因此,我们认为硅藻对波动光的特殊适应机制可能是其开拓自然的必要条件。GydF4y2Ba
结论GydF4y2Ba
研究表明,光的波动是硅藻和鞭毛藻中浮游植物演替的关键因素。硅藻在生长和光合作用方面都比甲藻更能适应波动的光。因此,在较强的上升流、波浪和风条件下,硅藻对动态环境的适应性较好,在先锋开花中生长提前。硅藻中的PGR5在强光波动下起着至关重要的作用,支撑着硅藻在多变环境下的光合适应性和生长。研究结果也将为海洋光合生物对动态光的响应机制提供补充。GydF4y2Ba
材料和方法GydF4y2Ba
品系、栽培和生长监测GydF4y2Ba
硅藻GydF4y2Ba骨骼肿itaTumGydF4y2Ba和恐龙GydF4y2BaAmphidinium carterae.GydF4y2Ba那GydF4y2BaProrocentrum磷比GydF4y2Ba,GydF4y2Ba米基莫托伊GydF4y2Ba是红潮种类,而硅藻GydF4y2BaP三角菌GydF4y2Ba和GydF4y2Ba海链藻GydF4y2Ba还有甲藻GydF4y2Ba共生菌GydF4y2Ba是模型物种。在21±1℃的温度下含有F / 2培养基的无菌人造海水中生长七藻。光/暗循环设定为12 h / 12h。在以前关于波动光的研究中[GydF4y2Ba56GydF4y2Ba那GydF4y2Ba57GydF4y2Ba那GydF4y2Ba101GydF4y2Ba],漏磁条件范围为100 ~ 10%的强光低于鞭毛虫的耐受水平(图。GydF4y2Ba7.GydF4y2Ba) [GydF4y2Ba104GydF4y2Ba].细节,1分钟的明亮光(800μmolmGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)加入到每5分钟的低光(80μmolmGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)在漏磁处理中。在100%的sFL条件下,波动幅度较大,光照强度较高[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba]至1%[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba33GydF4y2Ba]在饱和的阳光下。A 1级 强光最小值(2000) μmol MGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba),每5min加入低光(20 μmol mGydF4y2Ba−2GydF4y2Ba SGydF4y2Ba−1GydF4y2Ba)。GydF4y2Ba
用血细胞计计算藻类的细胞密度,并对野生型(WT)、GydF4y2BaPGR5.GydF4y2Ba过表达藻类(5OE-1),和GydF4y2BaPGR5.GydF4y2Ba击倒藻类(5KN-i1)GydF4y2BaP三角菌GydF4y2Ba在730 nm波长(UV-1800,岛津,日本)测量吸光度。在指数生长中期,将所有藻类菌株离心后,在−80℃下快速冷冻。GydF4y2Ba
叶绿素和P700荧光参数监测GydF4y2Ba
在指数生长阶段,用Dual-PAM-100(Walz,Effeltrich,德国)仪器和WinControl软件1监测叶绿素荧光参数 h后开始光照循环,在相同条件下用来培养藻类。叶绿素荧光和P700的测定均采用双通道装置。藻类在黑暗中保存了10年 测量前最小值。抗霉素A(AA,10 μM)[GydF4y2Ba105GydF4y2Ba]. 最小荧光(FGydF4y2Ba0.GydF4y2Ba),最大荧光(FGydF4y2BamGydF4y2Ba在饱和闪光饱和之后,最大荧光(FGydF4y2BamGydF4y2Ba(在光合有效辐射下)测量并用于计算以下值:GydF4y2Ba
有效的PS II活动:GydF4y2Ba
光化学猝灭系数:GydF4y2Ba
同样,P700信号的最大变化(PGydF4y2BamGydF4y2Ba)光合有效辐射下P700信号的最大变化(PGydF4y2BamGydF4y2Ba'),零p700信号(pGydF4y2Ba0.GydF4y2Ba),利用饱和脉冲后P700总还原率计算光系统I (PSI)供体侧限制(Y[ND])、受体侧限制(Y[NA])和PSI产量,公式如下:GydF4y2Ba
系统发育分析和转化GydF4y2Ba
这GydF4y2BaPGR5.GydF4y2Ba序列GydF4y2BaP三角菌GydF4y2Ba(基因编号:7199723)从国家生物技术信息数据库中心下载。其他物种的蛋白质序列从国家生物技术信息中心和UNIPROT数据库下载。相似序列GydF4y2BaPGR5.GydF4y2Ba使用NCBI-BLAST [GydF4y2Ba106GydF4y2Ba(WGS项目:BASF01、BGNK01、BGPT01、GAFO01、GBSC01、GFLM01、GFPM01、GHKS01、GICE01、IADN01、IADM01、VSDK01)和RNA-seqGydF4y2BaProrocentrum磷比GydF4y2Ba(加入:PRJNA374496)[GydF4y2Ba107GydF4y2Ba那GydF4y2Ba108GydF4y2Ba那GydF4y2Ba109GydF4y2Ba那GydF4y2Ba110GydF4y2Ba那GydF4y2Ba111GydF4y2Ba那GydF4y2Ba112GydF4y2Ba那GydF4y2Ba113GydF4y2Ba那GydF4y2Ba114GydF4y2Ba那GydF4y2Ba115GydF4y2Ba那GydF4y2Ba116GydF4y2Ba]. 使用ClustalW进行比对后,用MEGA 7.0构建最大似然进化树。GydF4y2Ba
使用Meme Suite 5.1.1(使用MEME Suite 5.1.1)含有157bp部分序列(预测。GydF4y2Ba117GydF4y2Ba]和3′非翻译区(UTR)GydF4y2BaP三角菌GydF4y2Ba然后用HindIII(感官)和EcoRI(反感官)消化产物。将该序列反向插入pPha-T1载体的多克隆位点[GydF4y2Ba118GydF4y2Ba](FcpA促进剂后,强效促进剂响亮[GydF4y2Ba119GydF4y2Ba])应用EcoRI和HindIII限制性内切酶消化GydF4y2BaPGR5.GydF4y2Ba击倒GydF4y2BaP三角菌GydF4y2Ba. 矢量GydF4y2BaPGR5.GydF4y2Ba通过克隆全长产生过表达GydF4y2BaPGR5.GydF4y2Ba基因,并把它插入向前的方向。GydF4y2Ba
金颗粒(50 微升/3 mg)含20 μL亚精胺(0.1 M) ,50岁 微升氯化钙GydF4y2Ba2GydF4y2Ba(2.5 M)和5 μg质粒(约10 μL)用于粒子轰击(BIO-RAD Biolistic PDS-1000/H2粒子传递系统,CA,美国)转化[GydF4y2Ba51GydF4y2Ba那GydF4y2Ba61GydF4y2Ba].在低光下恢复24小时后,将藻类转移到含有Zeocin(100μg/ mL)的平板上。在20-30天后,检出单个藻类菌落并裂解直接聚合酶链反应(PCR)以验证序列整合。然后在含有Zeocin(100μg/ ml)的液体培养基中培养各种菌落。GydF4y2Ba
实时PCR分析GydF4y2Ba
利用Real-time PCR验证目的序列已整合到基因组中,并确定目的序列GydF4y2BaPGR5.GydF4y2BamRNA表达水平(GydF4y2Ba图S3GydF4y2Ba).RNA提取及实时荧光定量PCR分析方法参照Wu等[GydF4y2Ba105GydF4y2Ba]. 使用RNA制备纯植物试剂盒(富含多糖和多酚)从冷冻藻类中获得总RNA(中国北京天根)。使用纳米光度计(德国慕尼黑IMPLEN)和1%琼脂糖凝胶电泳评估RNA质量。使用带有gRNA擦除器的PrimeScript RT试剂盒(Takara,中国北京)进行逆转录。以cDNA为模板,在iQ5多色实时PCR检测系统(Bio-Rad,Hercules,USA)和Bio-Rad光学系统软件中使用FastStart-Essential-DNA-Green-Master(Roche)进行定量PCR。内部对照为RPS(核糖体蛋白小亚基30S)基因(GydF4y2Ba表S1GydF4y2Ba).GydF4y2Ba
十二烷基硫酸钠聚丙烯酰胺凝胶电泳及免疫印迹分析GydF4y2Ba
蛋白质水平用westernblot分析定量。类囊体膜蛋白的提取按照Grouneva等人描述的方法进行[GydF4y2Ba120GydF4y2Ba].冷冻藻类(采自指数生长期中期左右的新鲜藻类)用液氮碾碎,300×离心GydF4y2BaGGydF4y2Ba加入提取缓冲液(10)后去除细胞碎片和杂质 毫米MES,2 毫米KCl,5 mM不适用GydF4y2Ba2GydF4y2BaEDTA和1米D-山梨糖醇;pH 6.5)。在萃取缓冲液中再次研磨沉积物并以300×离心GydF4y2BaGGydF4y2Ba.收集所有上清液,20000 ×离心GydF4y2BaGGydF4y2Ba. 沉淀物在裂解缓冲液中洗涤两次(与提取缓冲液相同,只是不含GydF4y2BaD.GydF4y2Ba-山梨醇),然后悬浮在储存溶液(25 mmtris-HCl和20%甘油;酸碱度 7.0). 所有溶液在4℃预冷 ℃保存类囊体膜蛋白− 80 摄氏度。叶绿素法和BCA法(GydF4y2Ba图S3GydF4y2Ba)对蛋白质进行定量分析 μg Chl或50 用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法分析μg蛋白质(不同条件下的色素变化)[GydF4y2Ba121GydF4y2Ba那GydF4y2Ba122GydF4y2Ba]. 抗PsaB(光系统I P700叶绿素a载脂蛋白A2)和ATPB(ATP合成酶亚单位β,叶绿体)的抗体购自Agrisera(瑞典Vännäs),并在我们实验室制备了抗PGR5的抗体(抗原肽序列:TKLIKKAKVNGDTLGF)。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。在这项工作中使用的序列可在NCBI数据库中获得(GydF4y2Bahttp://www.ncbi.nlm.nih.govGydF4y2Ba)或uniprotb/TrEMBL数据库(GydF4y2Bahttps://www.uniprot.org/GydF4y2Ba). NCBI注册号为330250863、164449273、1387830212、586688763、196168724、393690734、357144276、573956334、1435170242、1394909989、1373914553、971519293、1331346858、926775414、675355490、158308814、219867356、1189386569、1395913517;UniProtKB/TrEMBL标识符为I1ZIR9、A1YSQ5、D7G229、B8C035、B7FVH9;NCBI组件登记号为BASF01、BGNK01、BGPT01、GAFO01、GBSC01、GFLM01、GFPM01、GHKS01、GICE01、IADN01、IADM01、VSDK01、PRJNA374496。GydF4y2Ba
改变历史记录GydF4y2Ba
01年5月2021年GydF4y2Ba
已发表对本文的更正:GydF4y2Bahttps://doi.org/10.1186/s12870-021-02984-wGydF4y2Ba
缩写GydF4y2Ba
- PGR5:GydF4y2Ba
-
质子梯度调节5GydF4y2Ba
- 漏磁场:GydF4y2Ba
-
轻微波动的光GydF4y2Ba
- 同声传译:GydF4y2Ba
-
严重波动的光GydF4y2Ba
- 氯:GydF4y2Ba
-
恒亮GydF4y2Ba
- 重量:GydF4y2Ba
-
野生型GydF4y2Ba
- 5o-1:GydF4y2Ba
-
PGR5过表达藻类GydF4y2Ba
- 5KN-i1型:GydF4y2Ba
-
PGR5敲低藻类GydF4y2Ba
- AA:GydF4y2Ba
-
抗霉素AGydF4y2Ba
- CEF:GydF4y2Ba
-
循环电子流量GydF4y2Ba
- FLV:GydF4y2Ba
-
一种型黄酮蛋白)GydF4y2Ba
- Y(一):GydF4y2Ba
-
PSI屈服GydF4y2Ba
- Y(不适用):GydF4y2Ba
-
PSI接收器侧限制GydF4y2Ba
- Y (ND):GydF4y2Ba
-
PSI供体侧限制GydF4y2Ba
- 净产品质量:GydF4y2Ba
-
非光化学猝灭GydF4y2Ba
- Y (II):GydF4y2Ba
-
PSII的实际光能转换效率GydF4y2Ba
- 1–秋林:GydF4y2Ba
-
PQ氧化还原状态GydF4y2Ba
工具书类GydF4y2Ba
- 1.GydF4y2Ba
斯特罗姆SL,弗雷德里克森KA,布莱特KJ。阿拉斯加东部沿海海湾春季浮游植物:盛花期和低潮期的光合作用和产量。深海研究第二部分。2016;132:107–21.GydF4y2Ba
- 2.GydF4y2Ba
气候驱动了波罗的海浮游植物春季开花的时间、组成和规模的变化。6.中国海洋大学学报(自然科学版)GydF4y2Ba
- 3.GydF4y2Ba
Treguer P、Bowler C、Moriceau B、Dutkiewicz S、Gehlen M、Aumont O、Bittner L、Dugdale R、Finkel Z、Iudicone D等。硅藻多样性对海洋生物碳泵的影响。自然地理。2018;11(1):27–37.GydF4y2Ba
- 4.GydF4y2Ba
(1)拉丰(Lafond)等。巴芬湾中上层硅藻春末开花发育。Elementa-Sci人类学。2019;7。GydF4y2Ba
- 5.GydF4y2Ba
Dutkiewicz A,Muller路,O'Callaghan S,Jonasson H。世界海洋海底沉积物普查。地质学。2015;43(9):795–8.GydF4y2Ba
- 6.GydF4y2Ba
刘颖,赵伟,李超,苗浩。2010年春季东海藻华演化期游离多胺含量变化。海洋科学进展,35(3):461 - 468。中国海洋湖沼学报。2017;35(1):215-23。GydF4y2Ba
- 7.GydF4y2Ba
张G,梁S,Shi X,Han X.氨基酸在硅藻期间溶解有机氮生物利用度,在长江河口及其相邻架子中的氨基酸达到丁络石绽放。Mar Chem。2015; 176:83-95。GydF4y2Ba
- 8.GydF4y2Ba
贝诺伊斯顿A-S、伊巴巴尔茨FM、比特纳L、吉迪L、扬O、达奇维奇S、鲍尔C。硅藻的演化及其生物地球化学功能。菲洛斯运输公司。2017;372(1728):20160397.GydF4y2Ba
- 9.GydF4y2Ba
哈钦斯达,布鲁兰KW。沿海上升流区铁限制硅藻生长和硅氮吸收比。自然。1998;393(6685):561–4.GydF4y2Ba
- 10.GydF4y2Ba
关键词:硅同位素,表面海洋,相互作用,影响,克尔格伦高原Biogeosciences。2014;11(5):1371 - 91。GydF4y2Ba
- 11.GydF4y2Ba
张YQ,林X,施XG,林LX,罗H,LI L,LIN SJ。与Phytoplankton政权相关联的MetaTransfriptomic签名从硅藻土偏移到丁氏素绽放。前微生物。2019; 10。GydF4y2Ba
- 12.GydF4y2Ba
Allen JT、Brown L、Sanders、Moore CM、Mustard A、Fielding S、Lucas M、Rixen M、Savidge G、Henson S等。大西洋东北部硅酸盐上升流促进硅藻碳输出。自然。2005;437(7059):728–32.GydF4y2Ba
- 13.GydF4y2Ba
春季硅藻华期间养分消耗和出口通量Si/N比值的变化过程。J Oceanogr。2005;61(6):1059 - 73。GydF4y2Ba
- 14.GydF4y2Ba
Carvalho F, Fitzsimmons JN, Couto N, Waite N, Gorbunov M, Kohut J, Oliver MJ, Sherrell RM, Schofield O. Testing the canyon hypothesis:评估南极西部半岛企鹅觅食热点浮游植物生长的光和营养控制。Limnol Oceanogr。2020;65(3):455 - 70。GydF4y2Ba
- 15.GydF4y2Ba
符文。挪威西部Boknafjorden的浮游植物生态学研究。II光合作用的环境调控。浮游生物学报1989;4:4。GydF4y2Ba
- 16.GydF4y2Ba
穆辛达CM,芬克尔ZV,欧文AJ。哪些环境因素控制着浮游植物的数量?贝叶斯变量选择方法。Ecol模型。2013;269:1–8.GydF4y2Ba
- 17.GydF4y2Ba
peter JCH, Haas H, Peperzak L, Wetsteyn LPMJ。北海浮游植物的限制因素。水科学技术,1991;24(10):261-7。GydF4y2Ba
- 18.GydF4y2Ba
关键词:硅藻水华,风致硅藻水华,初级生产力,短期变化abstract:微生物学报。2009;56(3):205-15。GydF4y2Ba
- 19.GydF4y2Ba
Sorooshian A, Padro LT, Nenes A, Feingold G, McComiskey A, Hersey SP, Gates H, Jonsson HH, Miller SD, Stephens GL等。关于海洋生物群排放、气溶胶和海洋云团之间的联系:加州海岸的机载、地面和卫星测量。全球生物地球化学学报。2009;GydF4y2Ba
- 20GydF4y2Ba
Kiorboe T、Lundsgaard C、Olesen M、Hansen JLS。春季浮游植物水华期间的聚集和沉积过程——检验凝聚理论的现场试验。1994年3月决议;52(2):297–323.GydF4y2Ba
- 21。GydF4y2Ba
Alderkamp A-C, van Dijken G, Lowry K, Connelly T, Lagerström M, Sherrell R, Haskins C, Rogalsky E, Schofield O, Stammerjohn S, et al。在南极洲阿蒙森海冰沼的春季浮游植物开花期间,铁的可用性驱动光合作用速率。Elementa。2015;3:000043。GydF4y2Ba
- 22。GydF4y2Ba
Leeuwe MAV、Sikkelerus BV、Gieskes WWC。南极硅藻和绿色鞭毛虫光适应波动辐照度的分类群特异性差异。3月计划。2005;288(1):9–19.GydF4y2Ba
- 23。GydF4y2Ba
关键T,麦卡锡A,Campbell Da,六C,Roy S,Finkel ZV。细胞尺寸权衡管理海洋植物浮游植物的轻型剥削策略。环境微生物。2010; 12(1):95-104。GydF4y2Ba
- 24。GydF4y2Ba
Croteau D, Guérin S, Bruyant F, Ferland J, Campbell DA, Babin M, Lavaud J.对比强光和黑暗下北极硅藻的非光化学猝灭模式,与光生态位占据一致。Limnol Oceanogr。2021;66 (S1)。GydF4y2Ba
- 25。GydF4y2Ba
Smayda TJ。有害藻华:它们的生态生理学和与海洋浮游植物藻华的一般相关性。42 Limnol Oceanogr。1997;5(第二部分):1137 - 53。GydF4y2Ba
- 26。GydF4y2Ba
Berdalet E、Peters F、Koumandou VL、Roldan C、Guadayol O、Estrada M。甲藻对定量小尺度湍流的种特异性生理响应1。2007;43(5):965–77.GydF4y2Ba
- 27。GydF4y2Ba
浮游植物在不稳定环境中作为生存选择的生命形式。Oceanol学报。1978;1(4):493 - 509。GydF4y2Ba
- 28。GydF4y2Ba
亚马逊河羽流中微生物的真核基因表达模式与羽流水体的生物地球化学平行。论文Theses-Gradworks。2014.GydF4y2Ba
- 29。GydF4y2Ba
Capone DG,Hutchins Da。浅层海洋沿海上升政权的微生物生物化学。NAT GEOSCI。2013; 6(9):711-7。GydF4y2Ba
- 30GydF4y2Ba
关键词:生物合成,浮游植物,浮游细胞,脂肪酸,生物动力学3月化学2000;70(4):243 - 56。GydF4y2Ba
- 31GydF4y2Ba
Olesen M.硅藻春天绽放的沉降和地下叶绿素最大的比较。Mar Biol。1995年; 121(3):541-7。GydF4y2Ba
- 32.GydF4y2Ba
Levandowsky M、Kaneta PJ。甲藻的行为。生物甲藻。1987:360–97.GydF4y2Ba
- 33.GydF4y2Ba
Lim AS,Jeong HJ,Ok JH,You JH,Kang HC,Kim SJ。光照强度和温度对混合营养甲藻生长和摄食率的影响。马比尔。2019;166(7):98.GydF4y2Ba
- 34.GydF4y2Ba
陈建平,张建平,李建平,等。植物光合作用的光抑制机制。植物学报,2014,49(5):973 - 978。植物生理学杂志,1994;45(1):1 - 6。GydF4y2Ba
- 35.GydF4y2Ba
Keating K: Monterey Bay硅藻和鞭毛藻的季节变化,用HPLC法分析化学税法测定CA。2013年加州海洋资助学院计划。GydF4y2Ba
- 36.GydF4y2Ba
Kudela RM, Cochlan WP, Dugdale RC。上升流过程中浮游植物对光的碳氮吸收反应。浮游生物学报1997;19(5):609-30。GydF4y2Ba
- 37.GydF4y2Ba
Buck KR、Uttalcook L、Pilskaln CH、Roelke DL、Villac MC、Fryxell GA、Cifuntes L、Chavez FP。产软骨藻酸的硅藻伪菱形藻的生态研究。项目经理。1992;84(3):293–302.GydF4y2Ba
- 38.GydF4y2Ba
查韦斯。加利福尼亚中部1992年厄尔尼诺爆发的强迫和生物影响。地球物理研究。1996;23(3):265–8.GydF4y2Ba
- 39.GydF4y2Ba
Abrantes F.硅藻综合组织作为葡萄牙表面沉积物中的上升指标。Mar Geol。1988; 85(1):15-39。GydF4y2Ba
- 40GydF4y2Ba
Margalef R。上升流区的浮游植物群落。西北非洲的例子。水性食道菌。1978:3(3).GydF4y2Ba
- 41GydF4y2Ba
Lampe Rh,Cohen Nr,Ellis Ka,Bruland Kw,Maldonado Mt,Peterson Td,直到CP,Brzezinski Ma,Bargu S,Thamatrakoln K.浮游植物的分歧基因表达,以回应升值。环境微生物。2018; 20(8):3069-82。GydF4y2Ba
- 42GydF4y2Ba
Barber R,史密斯R:江苏河,AR,AR,Ed的沿海Upwelling生态系统。,海洋生态系统的分析。在GydF4y2Ba.GydF4y2Ba:伦敦,学术出版社;1981年。GydF4y2Ba
- 43GydF4y2Ba
威尔克森F、杜格德尔R、库德拉R、查韦斯F。加州蒙特利湾的生物量和生产力:大型浮游植物的贡献。深海二级顶级海洋生物。2000;47(5–6):1003–22.GydF4y2Ba
- 44GydF4y2Ba
Hood RR,Abbott先生,Huyer A,Kosro PM。加州北部海岸过渡带温度、流量、浮游植物生物量和物种组成的表面模式。海洋地球物理杂志。1990;95(C10):18081–94。GydF4y2Ba
- 45。GydF4y2Ba
Álvarez-Salgado XA, Nieto-Cid M, Piedracoba S, Crespo BG, Gago J, Brea S.花开的起源和命运GydF4y2Ba骨骼肿itaTumGydF4y2Ba在维戈河(西班牙西北部)冬季上升流/下降流序列期间。2005年3月决议;63(6):1127–49.GydF4y2Ba
- 46。GydF4y2Ba
Alvarez-Salgado XA, Rosón G, Pérez FF, Pazos Y. Rías Baixas(西班牙西北部)沿岸上升流季节的水文变化。地球物理学报,1998;GydF4y2Ba
- 47。GydF4y2Ba
Blanton JO, Tenore KR, Castillejo F, Atkinson LP, Schwing FB, Lavin A.上升流与西班牙西海岸贻贝生产的关系。1987;45(2): 497-511。GydF4y2Ba
- 48。GydF4y2Ba
投手G,博伊德A。南部本格拉上升流系统中的跨陆架和近岸甲藻分布和赤潮形成机制。有害的有毒藻华。1996:243–6.GydF4y2Ba
- 49。GydF4y2Ba
黄志明,张建平,李建平,等。海藻水华动力学与物理过程的关系。见:有害藻类生态学。施普林格;2006.p . 127 - 138。GydF4y2Ba
- 50GydF4y2Ba
Smayda T,教练。上升流系统中的甲藻水华:播种、变异以及与硅藻水华行为的对比。程序海洋学家。2010;85(1–2):92–107.GydF4y2Ba
- 51GydF4y2Ba
Bailleul B、Berne N、Murik O、Petroutsos D、Prihoda J、Tanaka A、Villanova V、Bligny R、Flori S、Falconet DGydF4y2Ba等GydF4y2Ba质体和线粒体之间的能量耦合驱动硅藻的二氧化碳同化。GydF4y2Ba自然GydF4y2Ba2015, 524(7565):366−+.GydF4y2Ba
- 52GydF4y2Ba
决赛G,莫罗H,保龄球C。真核浮游植物光合作用的基因组研究。植物科学趋势。2010;15(10):565–72.GydF4y2Ba
- 53GydF4y2Ba
Kuczynska P、Jemiola Rzeminska M、Strzalka K。硅藻中的光合色素。破坏毒品。2015;13(9):5847–81.GydF4y2Ba
- 54GydF4y2Ba
王伟,于丽娟,徐超,Tomizaki T, Zhao S, Umena Y, Chen X, Qin X, Xin Y, Suga M, et al. .硅藻中蓝绿色光捕获和能量耗散的结构基础。科学。2019:363(6427)。GydF4y2Ba
- 55GydF4y2Ba
Grouneva I,Muth Pawlak D,Battchikova N,Aro EM.硅藻中波动光诱导的相对类囊体蛋白质丰度变化GydF4y2Ba海链藻GydF4y2Ba.蛋白质组学杂志。2016;15(5):1649-58。GydF4y2Ba
- 56.GydF4y2Ba
Jokel M、Johnson X、Peltier G、Aro EM、Allahverdiyeva Y。猎杀主要玩家GydF4y2Ba莱茵衣藻GydF4y2Ba在波动光下生长。植物j . 2018; 94(5): 822 - 35。GydF4y2Ba
- 57.GydF4y2Ba
Suorsa M, Jarvi S, Grieco M, Nurmi M, Pietrzykowska M, Rantala M, Kangasjarvi S, Paakkarinen V, Tikkanen M, Jansson S等。质子梯度调节5对于拟南芥光合系统I适应自然和人工波动的光照条件至关重要。植物细胞,2012;24(7):2934 - 48。GydF4y2Ba
- 58.GydF4y2Ba
Yamori W、Makino A、Shikanai T。光系统I周围循环电子传递在波动光下维持水稻光合作用中的生理作用。Sci代表英国。2016;6.GydF4y2Ba
- 59.GydF4y2Ba
Bowler C, Allen AE, Badger JH, Grimwood J, Jabbari K, Kuo A, Maheswari U, Martens C, Maumus F, Otillar RP,等。这GydF4y2Ba三角褐指藻GydF4y2Ba基因组揭示了硅藻基因组的进化史。自然。2008;456(7219):239–44.GydF4y2Ba
- 60GydF4y2Ba
Depauw Fa,Rogato A,D'Alcala Mr,Falciatore A.探讨了海洋硅藻中光的反应的分子基础。J Exp Bot。2012; 63(4):1575-91。GydF4y2Ba
- 61GydF4y2Ba
Zaslavskaia LA, Lippmeier JC, Kroth PG, Grossman AR, Apt KE。硅藻的转化GydF4y2BaPhaeodactylum tricornutumGydF4y2Ba(硅藻纲)具有多种可选择的标记和报告基因。J Phycol。2000;36(2):379 - 86。GydF4y2Ba
- 62GydF4y2Ba
Dore Je,Letelier Rm,Church MJ,Lukas R,Karl DM。夏季Phytoplankton绽放在寡营北太平洋亚热带狂欢节:历史观点和最近的观察。Prog Oceanogr。2008; 76(1):2-38。GydF4y2Ba
- 63GydF4y2Ba
崔yd,张h,林sj。在甲醛甲状腺氨基甲酸甲酸甲酯缺血中磷剥夺下的非光化学淬火的增强。前微生物。2017; 8。GydF4y2Ba
- 64GydF4y2Ba
周志新、余瑞聪、周明杰。东海微藻水华从硅藻到甲藻的季节演替:数值模拟研究。Ecol模型。2017;360:150–62.GydF4y2Ba
- 65GydF4y2Ba
周勇,张勇,李芳,谭力,王杰:营养盐结构变化影响东海硅藻与甲藻的竞争与演替。GydF4y2Ba总体环境的可持续性GydF4y2Ba2017,574(1月1日):499–508。GydF4y2Ba
- 66GydF4y2Ba
周志新、余瑞聪、孙聪、冯敏、周明杰。长江流量和黑潮入侵对东海硅藻和甲藻水华的影响。地球物理研究杂志,2019年;124(7):5244–57.GydF4y2Ba
- 67GydF4y2Ba
A, Hense I, Kremp A. warning A, Hense I, Kremp A. A. modeling of life - flagellates: A case study with Biecheleria baltica. A, Hense I, Kremp A. A.浮游生物学报,2013;35(2):379-92。GydF4y2Ba
- 68GydF4y2Ba
关键词:气候变化,浮游植物群落,年际变化,扩散限制Limnol Oceanogr。58 2013;(2):753 - 62。GydF4y2Ba
- 69。GydF4y2Ba
carryto JI, Carignan MO, Montoya NG, Cozzolino E, Akselman R. Mycosporine-like amino acids and叶黄素循环色素促进了阿根廷Grande Bay地区(受臭氧空洞影响地区)的甲藻原棘藻的大规模春季开花发育。J Marine systems . 2018; 178:15-28。GydF4y2Ba
- 70.GydF4y2Ba
K,Markager S。波罗的海春季水华发生的生理生态生长特征和模拟。船舶系统。2008;73(3–4):323–37.GydF4y2Ba
- 71.GydF4y2Ba
van de Poll WH、Abdullah E、Visser RJW、Fischer P、Buma AGJ。硅藻和鞭毛虫的特定分类单元暗存活影响极地夜间和早春的北极浮游植物组成。利莫诺海洋学家。2020;65(5):903–14.GydF4y2Ba
- 72.GydF4y2Ba
kamp a,de beer d,nitsch jl,lavik g,stief p.硅藻呼吸硝酸盐以存活的黑暗和缺氧条件。P美国国家科学研究院。2011; 108(14):5649-54。GydF4y2Ba
- 73.GydF4y2Ba
larour T, Morin P-I, Sciandra T, Donaher N, Campbell D, Ferland J, Babin M.解耦合光捕获、电子传递和碳固定支持了北极硅藻新gracilis在长时间黑暗后的快速恢复。极地杂志》2019。GydF4y2Ba
- 74GydF4y2Ba
豪斯H,弗兰兹JMS,索默U。N:P化学计量的变化影响秘鲁上升流中浮游植物的分类组成和营养质量。《海洋研究》2012年;73:74–85.GydF4y2Ba
- 75GydF4y2Ba
Falkowski pg,理发形式Rt,Smetatek VV。海洋初级生产的生物地球化学控制与反馈。科学。1998年; 281(5374):200-7。GydF4y2Ba
- 76GydF4y2Ba
田勇,张明江,钱培元。两种温度和五种盐度组合下塔马山历山德拉甲藻(alexandra tamarense)、卡氏异骨藻(raphidophyteHeterosigma carterae)和肋骨骨架硅藻(osteonema costatum)的竞争。中国海洋湖沼学报。2003;21(3):245-50。GydF4y2Ba
- 77GydF4y2Ba
Kiørbee T、Tiselius P、Mitchell Innes B、Hansen JL、Visser AW、Mari X。上升流诱导硅藻水华期间低垂直通量的密集聚集形成。利莫诺海洋学家。1998;43(1):104–16.GydF4y2Ba
- 78GydF4y2Ba
Raven J:液泡:成本效益分析。:GydF4y2Ba植物学研究进展。GydF4y2Ba25卷:爱思唯尔;1997: 59 - 86。GydF4y2Ba
- 79GydF4y2Ba
王杰、张勇、李赫、曹杰。实验室培养中中肋骨条藻和东海原甲藻的竞争相互作用。浮游生物研究杂志,2012年;35(2):367–78.GydF4y2Ba
- 80。GydF4y2Ba
Burkholder JM,Glibert PM,Skelton HM。混合养殖,富营养水域中有害藻类种类的主要营养方式。有害藻类。2008; 8(1):77-93。GydF4y2Ba
- 81。GydF4y2Ba
Stoecker D,Tillmann U,Granéli E:有害藻类的吞噬功能。在:GydF4y2Ba有害藻类的生态学。GydF4y2Ba由Granéli E, Turner JT编辑。柏林,海德堡:施普林格;2006: 177 - 187。GydF4y2Ba
- 82。GydF4y2Ba
芬切尔汤姆。甲藻如何游泳。原生生物。2001;152(4):329–38.GydF4y2Ba
- 83GydF4y2Ba
Eppley RW,Holm-Harisen O,Strickland JDH:关于垂直迁移的一些观察到Dinoflagellates。1968年。GydF4y2Ba
- 84GydF4y2Ba
库伦JJ,霍里根SG。硝酸盐对沟鞭藻的日垂直迁移、碳氮比和光合能力的影响。马比尔。1981;62(2):81–9.GydF4y2Ba
- 85GydF4y2Ba
Domingues RB,Anselmo TP,Barbosa AB,Sommer U,Galvao HM.光作为混浊河口淡水潮区浮游植物生长和生产的驱动力。河口海岸陆架。2011;91(4):526–35.GydF4y2Ba
- 86GydF4y2Ba
熔炉M。海洋浮游植物原位生长速率:测量方法、群落和物种生长速率。浮游生物研究杂志,1990年;12:1117–51.GydF4y2Ba
- 87GydF4y2Ba
K k,Seike Y,日期Y.在德国湖南湖(III)中的红潮。有机物质在底部沉积物间质和排泄中的有机物质的刺激作用GydF4y2Ba骨骼肿itaTumGydF4y2Ba论企业的成长GydF4y2Baprorocentrum最小值GydF4y2Ba. 日本浮游生物公报。1990;37:35-47页。GydF4y2Ba
- 88GydF4y2Ba
关键词:硅藻,碳取向,碳取向,硅藻abstract: the Carbon Orientation in the DiatomGydF4y2BaPhaeodactylum tricornutumGydF4y2Ba:碳限制和光子通量密度的影响。前植物科学。2019:10(471).GydF4y2Ba
- 89GydF4y2Ba
Anning T, MacIntyre HL, Pratt SM, Sammes PJ, Gibb S, Geider RJ。海洋硅藻肋骨骨架的光适应。Limnol Oceanogr。2000;45(8):1807 - 17所示。GydF4y2Ba
- 90.GydF4y2Ba
关键词:南极硅藻,短角毛藻,光适应,氧化应激J Phycol。2008;44:957 - 66。GydF4y2Ba
- 91.GydF4y2Ba
Cartaxana P、Cruz S、Gameiro C、Kühl M。潮间带小型底栖生物光合作用在昼夜重现期的调节受到硅藻迁移模式的强烈影响。前微透镜。2016:7(872).GydF4y2Ba
- 92.GydF4y2Ba
武汉三峡库区丁食物油画盛开的研究。2006年。GydF4y2Ba
- 93.GydF4y2Ba
Klinger CM, Paoli L, Newby RJ, Wang MYW, Carroll HD, Leblond JD, Howe CJ, Dacks JB, Bowler C, Cahoon AB等。鞭毛藻细胞质转录本编辑具有系特异性,但趋向保守。基因组生物学进展。2018;10(4):1019-38。GydF4y2Ba
- 94.GydF4y2Ba
Evens TJ、Kirkpatrick GJ、Millie DF、Chapman DJ、Schofield OME。赤潮有毒甲藻裸藻在自然光照下的光生理响应。浮游生物研究杂志,2001年;23(11):1177–94.GydF4y2Ba
- 95.GydF4y2Ba
施XG,Li L,Guo CT,Lin X,Li MZ,Lin SJ。罗霉素基因表达受甲藻氏素卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉粒子的光谱和光强度调节。前微生物。2015; 6。GydF4y2Ba
- 96.GydF4y2Ba
关键词:光抑制,PSI,光保护机制植物生理学杂志。2016;57(7):1405-14。GydF4y2Ba
- 97.GydF4y2Ba
Leister D,Shikanai T。植物抗霉素A敏感循环电子流途径的复杂性和蛋白质复合物。前植物科学。2013;4:161.GydF4y2Ba
- 98GydF4y2Ba
Storti M、Alborsi A、Gerotto C、Aro E-M、Finazzi G、Morosinotto T。循环和伪循环电子输运在光动力学变化中的作用GydF4y2BaPhyscomitrella patens.GydF4y2Ba. 植物细胞环境。2018;0(0).GydF4y2Ba
- 99GydF4y2Ba
吉拉德,Ryther JH。海洋浮游硅藻的研究。一。GydF4y2BaCyclotella娜娜GydF4y2Ba赫斯特,还有GydF4y2Ba塞子征收GydF4y2Ba(cleve)gran。可以j microbiol。1962; 8:229-39。GydF4y2Ba
- 100。GydF4y2Ba
Lavaud J, Strzepek RF, Kroth PG.不同硅藻的光保护能力不同:与水下光气候波动相关的硅藻空间分布的可能后果。Limnol Oceanogr。2007;52(3):1188 - 94。GydF4y2Ba
- 101。GydF4y2Ba
Allahverdiyeva Y, Mustila H, Ermakova M, Bersanini L, Richaud P, Ajlani G, Battchikova N, Cournac L, Aro EM. Flavodiiron蛋白Flv1和Flv3能够在波动光下促进蓝藻生长和光合作用。P美国国家科学研究院。2013年,110(10):4111 - 6。GydF4y2Ba
- 102。GydF4y2Ba
周L,高,吴S,韩D,王H,顾W,胡Q,王J,王G.PGRL1过度表达GydF4y2BaPhaeodactylum tricornutumGydF4y2Ba抑制生长,降低PSII活性。植物j . 2020; 103(5): 1850 - 7。GydF4y2Ba
- 103GydF4y2Ba
Hehenberger E,Gast RJ,Keeling PJ。尿素膜脂肪醛酸酯和瞬态和完全集成的体积胚生之间的尖端点。P美国国家科学研究院。2019; 116(36):17934-42。GydF4y2Ba
- 104GydF4y2Ba
于早Q、钱江H、严Z、雷Z。有毒赤潮甲藻塔玛亚历山大藻日垂直迁移的实验室研究。中国海洋湖沼学。1997;05:458–67.GydF4y2Ba
- 105GydF4y2Ba
吴Sc,黄艾,张,围朗,赵pp,林ap,王gc。酶活性突出氧化戊糖磷酸途径在CO 2浓度下脂质积累和Phaeodactylum Tricornutum的生长的重要性。Biotechnol生物燃料。2015; 8。GydF4y2Ba
- 106GydF4y2Ba
Johnson M,Zaretskaya I,Raytselis Y,Merezhuk Y,Mcginnis,Madden TL.NCBI Blast:更好的网络界面。2008GydF4y2Ba
- 107GydF4y2Ba
Ladner JT,Barshis DJ,Palumbi SR。两种共同发生蛋白质的蛋白质演变 - 辛酸肝硬化酸性耐热性耐热耐受遗传基础的探讨。2012; 12(1):217。GydF4y2Ba
- 108GydF4y2Ba
Shoguchi E、Shinzato C、Kawashima T、Gyoja F、Mungpakdee S、Koyanagi R、Takeuchi T、Hisata K、Tanaka M、Fujiwara M、Hamada M、Seidi A、Fujie M、Usami T、Goto H、Yamasaki S、Arakki N、Suzuki Y、Sugano S、Toyoda A、Kuroki Y、Fujiyama A、Medina M、Coffroth MA、Bhattacharya D、Satoh N。微小共生藻核基因组的初步组装揭示了甲藻的基因结构。电流生物学。2013;23(15):1399–408.GydF4y2Ba
- 109GydF4y2Ba
林、陈、宋B,钟X, X,李W,李L,张Y,张H,霁Z, Cai M,壮族Y, X,林L,小王,小王Z,刘X, Yu年代,曾P,郝H,邹Q,陈C,李Y, Y,徐C,孟年代,徐X,王J,杨H,坎贝尔哒,Sturm NR, Dagenais-Bellefeuille年代,kawagutii共生菌基因组揭示了鞭毛藻基因表达和珊瑚共生。科学。2015;350(6261):691 - 4。GydF4y2Ba
- 110.GydF4y2Ba
Rosic N, Ling EWS, Chan C-KK, Lee HC, Kaniewska P, Edwards D, Dove S, Hoegh-Guldberg O.揭开珊瑚-藻类共生的秘密。ISME j . 2015; 9(4): 844 - 56。GydF4y2Ba
- 111.GydF4y2Ba
翔T、纳尔逊W、罗德里格斯J、托勒特D、格罗斯曼AR、普兰特J。2015;82(1):67–80.GydF4y2Ba
- 112.GydF4y2Ba
Shi X, Lin X, Li L, Li M, Palenik B, Lin S.揭示了鞭毛藻应对磷酸盐胁迫的多层面机制。ISME j . 2017; 11(10): 2209 - 18。GydF4y2Ba
- 113.GydF4y2Ba
Shoguchi E、Beedessee G、Tada I、Hisata K、Kawashima T、Takeuchi T、Arakaki N、Fujie M、Koyanagi R、Roy MC、Kawachi M、Hidaka M、Satoh N、Shinzato C。两个不同的共生菌基因组揭示了防晒霜生物合成的基因簇和最近丢失的基因的保守性。BMC基因组学2018;19(1).GydF4y2Ba
- 114.GydF4y2Ba
Yuyama I、Ishikawa M、Nozawa M、Yoshida M、Ikeo K。随着藻类共生体的增加,转录组学的变化揭示了珊瑚-藻类共生体建立的详细过程。Sci代表,2018年;8(1).GydF4y2Ba
- 115.GydF4y2Ba
王X,牛X,陈Y,孙Z,韩A,娄X,葛J,李X,杨Y,詹J,Gonçalves RJ,关W。太阳紫外线胁迫下甲藻的转录组测序。有害藻类。2019;88:101640.GydF4y2Ba
- 116.GydF4y2Ba
Silva Lima AW、Leomil L、Oliveira L、Varasteh T、Thompson JR、Medina M、Thompson CC、Thompson FL.巴西贻贝内共生体共生菌的遗传研究。共生。2020;80(2):183–93.GydF4y2Ba
- 117GydF4y2Ba
蒂莫西B,埃尔坎C。通过期望最大化拟合混合模型来发现生物聚合物中的基序。1994GydF4y2Ba
- 118GydF4y2Ba
Zaslavskaia LA, Lippmeier JC, Kroth PG, Grossman AR, Apt KE。用各种选择标记和报告基因转化硅藻肽Tricornutum Tricornutum(Bacillariophyceee)。J phycol。2010; 36(2):379-86。GydF4y2Ba
- 119GydF4y2Ba
Apt KE,Grossman AR,Kroth Pancic PG.三角硅藻藻藻指藻的稳定核转化。分子遗传学管理。1996;252(5):572–9.GydF4y2Ba
- 120.GydF4y2Ba
Grouneva I,Rokka A,Aro Em。两种海洋硅藻的类囊体膜蛋白质组概述了光合作机的硅藻和特异性特征。J蛋白质组。2011; 10(12):5338-53。GydF4y2Ba
- 121GydF4y2Ba
郑泽,高斯,王戈克。远红光诱导LHCSR的表达,以触发透晶绿色大甲术中的非平淡细胞淬火GydF4y2Ba增生尺骨GydF4y2Ba. 藻类研究,2019年;40GydF4y2Ba
- 122。GydF4y2Ba
Ritchie RJ。一致的丙酮,甲醇和乙醇溶剂的分光光度叶绿素方程组。Photosynth Res。2006; 89(1):27-41。GydF4y2Ba
致谢GydF4y2Ba
我们感谢松田佑助和克里斯·鲍勒的贡献,感谢他们为我们提供的载体。我们感谢Shikanai Toshiharu和Yingzhong Tang提供的有用建议。我们也感谢俞志明的捐赠GydF4y2BaP东海恩斯。GydF4y2Ba我们感谢Wiley编辑服务对本文的编辑(GydF4y2Bahttps://wileyeditingservices.com/en/GydF4y2Ba).GydF4y2Ba
资金GydF4y2Ba
国家重点研发计划项目(no . 2018YFD0901500);中国科学院海洋重大科学研究中心重点部署项目(no . COMS2019Q02);山东省科技支撑计划项目(no . 2018GHY115019);基金资助:中国科学院海洋实验生物学重点实验室杰出青年科研基金资助项目(No. 713513516);国家自然科学基金项目(41676157和41976097)。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
G.W.和S.G.构思了研究,L.Z.设计了这项工作。L.Z.,S.G.,S.W.,W.G.,L.W.和J.W.进行实验并分析数据。L.Z.S.G.和G.W.起草修改了手稿和所有作者批准的作者。所有作者阅读并认可的终稿。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准并同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者声明没有相互竞争的利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商说明GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
本文的原始在线版本已修改:作者确定了图3与图4相同。实际上,图3从未从原始提交的稿件改变到修订和证明过程。提交和修订中,图3的顺序和传说也没有改变。图3的损失是由于在排版过程中的粗心操纵。GydF4y2Ba
补充资料GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
赤潮硅藻的Y(NA)(PSI受体侧限)、Y(ND)(PSI供体侧限)和1–qL(PQ氧化还原态)GydF4y2BaS中肋骨GydF4y2Ba赤潮甲藻GydF4y2Ba答:carteraeGydF4y2Ba那GydF4y2Bap .磷比GydF4y2Ba,GydF4y2BaK三木通GydF4y2Ba、模型硅藻GydF4y2BaP三角菌GydF4y2Ba那GydF4y2BaT. Pseudonana.GydF4y2Ba和模型Dinoflagellate.GydF4y2Bad . SymbiodiniumGydF4y2Ba(下GydF4y2Ba一种GydF4y2Ba)在加入强光(800 μmol光子mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)每5分钟微光(80μmol/mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba) 和 (GydF4y2BaB.GydF4y2Ba)在加入较强光(2000 μmol光子mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)每5分钟微光照(20μmol/mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba).GydF4y2Ba
附加文件2:图S2。GydF4y2Ba
植物和藻类PGR5的保守序列和进化关系。已知的信号肽序列加下划线。使用MEME MOTIF ELICITITION工具(5.0.5版)识别图案。Dinoflagellates的缺失的保守部位显示用红十字会。该序列在NCBI数据库中可用(GydF4y2Bahttp://www.ncbi.nlm.nih.govGydF4y2Ba)或uniprotb/TrEMBL数据库(GydF4y2Bahttps://www.uniprot.org/GydF4y2Ba)如下所示。真双子叶植物:拟南芥(gi:330250863)、黄瓜(gi:164449273)、青蒿(gi:1387830212)、棉花(tr:I1ZIR9);Amborella:毛足Amborella trichopoda(gi:586688763);裸子植物:火炬松(gi:196168724);单子叶植物:普通小麦(gi:393690734)、短梗稻(gi:357144276)、短穗稻(gi:573956334)、玉米(gi:1435170242)、玉米(gi:1394909989);苔藓:Physcomitrella patens(gi:1373914553);克雷伯氏菌:硝化克雷伯氏菌(gi:971519293);绿藻门:社会四巴藻(gi:1331346858)、忽略单缝藻(gi:926775414)、原鞘小球藻(gi:675355490);蓝藻:Acaryochloris marina MBIC1017(gi:158308814),蓝藻属PCC 7425(gi:219867356);红藻门:脐紫菜(gi:1189386569)、条斑鹿蹄草(tr:A1YSQ5)、江蓠(gi:1395913517)、褐藻门:硅藻外果皮(tr:D7G229);硅藻:假纳海链藻(tr:B8C035),三角褐指藻(CCAP 1055/1株)(tr:B7FVH9);甲藻:使用NCBI-BLAST(BASF01、BGNK01、BGPT01、GAFO01、GBSC01、GFLM01、GFPM01、GHKS01、GICE01、IADN01、IADM01、VSDK0、PRJNA374496)鉴定序列。GydF4y2Ba
附加文件3:图S3。GydF4y2Ba
相对(GydF4y2Ba一种GydF4y2Ba) 80 μmol光子m下PGR5的RNA水平GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba以及(GydF4y2BaB.GydF4y2Ba) WT、5OE-1和5KN-i1在不同光照条件下的类囊体膜蛋白(PGR5、PsaB和AtpB)水平。采用BCA法定量(50 μg蛋白,~3 μg Chl)。CL:在80 μmol光子m下的恒光GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba; mFL:轻度波动光:加入1分钟的强光(800μmol/m)GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)每5分钟微光(80μmol/mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba); sFL:严重波动光:添加1分钟强光(2000μmol/m)GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)每5分钟微光照(20μmol/mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba).采用SPSS 23.0进行方差分析(P<0.01)。GydF4y2Ba
附加文件4:表S1。GydF4y2Ba
.转基因构建中的引物。限制站点以粗体显示。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.“创作共用公共领域”豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用本文GydF4y2Ba
周磊,吴松,顾伟。GydF4y2Ba等。GydF4y2Ba在剧烈波动的光照条件下进行光合作用驯化,可以使硅藻比鞭毛藻生长得更快。GydF4y2BaBMC植物杂志GydF4y2Ba21,GydF4y2Ba164 (2021). https://doi.org/10.1186/s12870-021-02902-0GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
内政部GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-02902-0.GydF4y2Ba
关键词GydF4y2Ba
- 硅藻.GydF4y2Ba
- 甲藻GydF4y2Ba
- 波动的光GydF4y2Ba
- 先锋绽放GydF4y2Ba
- PGR5.GydF4y2Ba
- Phaeodactylum tricornutumGydF4y2Ba
- 浮游植物水华演替GydF4y2Ba