摘要
背景
柳枝稷(黍virgatumL.)是一个重要的生物能源和饲料作物。SwitchGrass的突出性质使得通过性繁殖来维持基因型即可。SwitchGrass中的当前无形的传播协议具有各种限制。需要一种简单且高效的营养传播方法,以宣传大型自然系列对基因组关联研究(GWAS)。
结果
结果表明,柳枝稷节点培养快繁是一种快速无性繁殖的方法。细菌和真菌污染是结菌培养失败的主要原因。表面消毒后的孵育液和培养基中添加杀菌剂植物防腐剂混合物(PPM, 0.2%)和杀菌剂苯甲酰(5 mg/l),可显著减少细菌和真菌污染。此外,继代培养前“修剪枝条”对大多数基因型的茎蘖增殖均有积极的影响。利用优化的节点培养程序,我们成功地从柳枝稷GWAS面板中进行了3个独立的实验,获得了330个基因型。不同基因型间茎蘖诱导效率和茎蘖生长存在较大差异。另外,我们开发了一个在足底节点培养法,通过刺激气生腋芽生长成芽直接在亲本植株上,6周内可产生生根植株。通过避开组织培养步骤,避免外部激素的使用在足底节点文化方法人工、经济、容易掌握,成功率高。产生的植物在足底节点培养方法与种苗相似,可直接用于各种实验。
结论
在本研究中,我们优化了柳枝稷节点培养方案,最大限度地减少细菌和真菌污染,并增加芽的增殖。通过这种改进的方案,我们成功地在不同的柳枝稷GWAS面板中繁殖了四分之三的基因型。此外,我们建立了一个新的和高通量在足底节点培养法。这些方法为研究人员加速柳枝稷的无性繁殖提供了更好的选择。
背景
柳枝稷是一种暖季C4多年生草,广泛分布于北美洲东部和中部[1].传统上用于牧草生产,恢复草地,以及土壤保护,它也被指定为美国的生物能源作物,因为它的生物量产量高,非生物应力耐受性和对边缘地的适应性[1,2,3.,4].柳枝稷是一种高度杂合异交的异源多倍体种,具有较高的基因型和表型变异[5,6].
柳枝稷是不相容的[7,这意味着无性繁殖是维持基因型的唯一途径。许多植物品种自然地进行营养繁殖[8].它被园艺家和农业公司广泛应用于迅速克隆植物。例如,已经评估了Nodal外植体的体外拍摄倍增,以便与所需的特征快速繁殖核桃和山核桃栽培品种[9,10].柳枝稷和许多其他草一样,可以从母枝上产生侧枝或分支,称为“分蘖”。分蘖从基部不伸长节间的腋芽发育而来[11].为了简单,SwitchGrass中最常见的营养传播方法是通过分蘖。然而,当耕断的数量小和/或需要繁殖大量植物时,通常进行通过节点培养或组织培养的营养传播。SwitchGrass的几种植物再生系统主要基于品种Alamo [12,13,14,15,16].起始材料包括成熟的颖果、幼嫩的叶段、花序、幼苗和节段。最近报道了一种利用水培系统进行柳枝稷无性繁殖的简化节点培养技术,该技术不需要离体组织培养[17].在这些方法中,节点培养法,直接从节点产生芽,很少有机会诱导体细胞无性系变异,因为它避免了在愈伤组织培养的再生系统中发生去分化和再分化[14].它也适用于大量基因型的高通量培养。然而,组织培养过程中的污染是一个挑战,因为外植体中的内生细菌和真菌通常不会被表面消毒杀死[18,19,20.].
作为一项大型全基因组关联研究的一部分,我们需要繁殖一组436个深度测序的四倍体柳枝稷基因型。为此,我们开发了一个改良版前Planta.节点文化过程减少污染和提高效率。此外,一种新的高吞吐量在足底建立了节点培养方法。
结果
抗菌药物和杀菌剂对结菌培养过程中微生物污染的影响
分蘖繁殖是柳枝稷最简单的繁殖方法。然而,当起始材料有限和/或需要大量无性系植株时,获得分蘖可能是不可行的。我们需要生成30-40个基因型的柳枝稷GWAS面板的温室和温室实验。由于缺少分蘖,我们开始进行节点培养,以产生无病无性系分株。
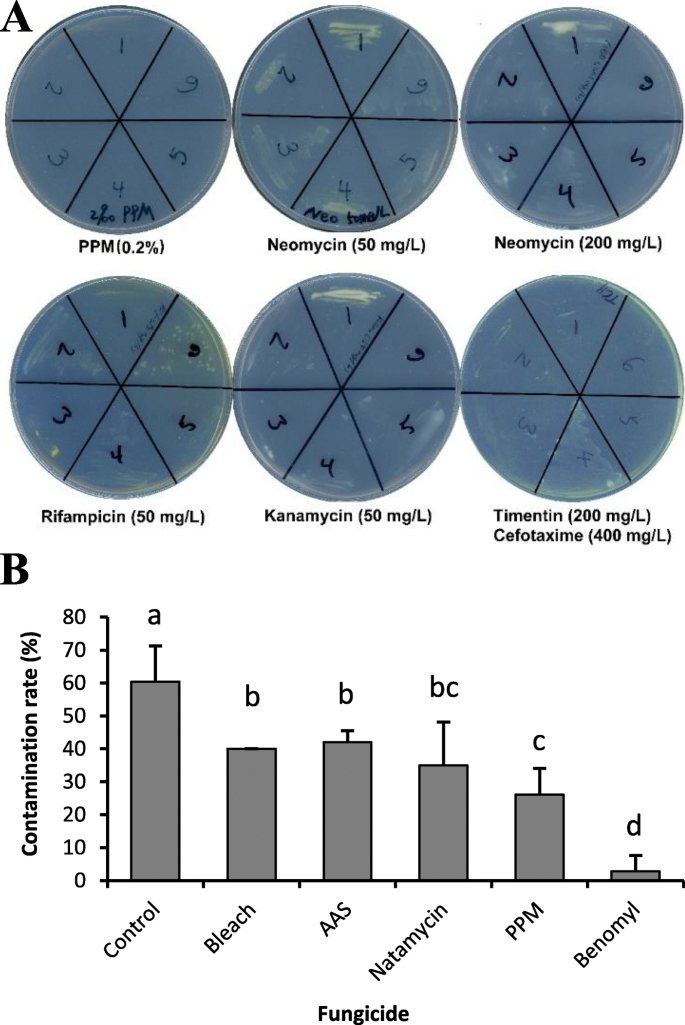
在一项试验中,我们尝试按照已发表的节点培养程序繁殖12种柳枝稷基因型[14],导致严重的细菌和真菌污染,即使亲本植物是健康的,在温室条件下生长。为了控制细菌污染,我们测试了不同抗生素对从污染节点培养板分离的6个不同菌落的抑制作用(图)。1A).在含有0.2%植物防腐剂混合物(PPM, Caisson Labs,一种强劲的广谱杀菌剂)的培养基中,所有6个菌株的生长都被完全抑制,而只有一或两种菌株在添加其他抗生素(包括新霉素(50或200 mg/l),利福平(50 mg/l),卡那霉素(50 mg/l),timentin (200mg /l)和头孢他辛(400mg /l)联合用药。值得注意的是,在节点培养的整个过程中,应该在节点培养基中添加0.2% PPM,因为我们发现在茎传代培养基中不添加PPM或降低PPM至0.1%会导致后期爆发细菌污染。大多数基因型的枝条在0.2% PPM条件下生长正常,而约2%的GWAS基因型对0.2% PPM敏感,叶片呈黄色或叶尖呈棕色。
为了抑制真菌污染,在灭菌后的浸泡液和组织培养基中加入5种抗真菌剂。与未处理对照相比,所有杀菌剂处理的污染率都有所降低,其中Benomyl (5 mg/l, Sigma)处理的效果最为显著(图2)。1B).在培养板上放置2周后,Benomyl处理可完全抑制大部分真菌污染。在GWAS面板中,Benomyl (5 mg/l)处理对所有基因型均未观察到对植物生长的负面影响。
节点文化协议的优化
对节点培养方案进行优化,以减少污染,提高培养成功率(图1)。2).首先,收集健康的、未损坏的和成熟的(完全拉长的)节点片段,从第二个拉长的节点到(但不包括)顶部节点。根据我们的经验,使用离地面非常近的节或叶鞘受损的节会增加污染率,而在绝育过程中,柔软的幼嫩节更容易受到伤害,顶部的节通常会产生花序。其次,在漂白剂灭菌40分钟后,加入0.2% PPM和5 mg/l Benomyl的无菌水中浸泡节点材料,以减少细菌和真菌污染。处理后的节点样品在4°C下保存过夜,最长保存5天。该处理对芽的诱导无不良影响。第三,在茎节培养基中添加0.2% PPM和5 mg/l Benomyl,并使茎节与培养基紧密接触,是控制茎节污染的关键。此外,在培养基上放置的时间越长,细菌和真菌污染越严重。因此,我们避免了节点样品在培养基上的保存时间超过2周。第四,拔除新梢进行继代培养时,每枝的基部不动,从上剪至末长0.5 ~ 1.0 cm。 By trimming the shoot, more shoots were induced in most genotypes tested (FigureS1).而对于生长速度慢的,直接转移芽进行继代培养,不修剪。采用相同的含0.2% PPM和5 mg/l苯甲酰的节点培养基继代培养。培养3-4周后,会发育出多条芽。重复传代步骤会产生更多的芽。最后,在生根阶段,不施用生根激素,因为在多基因型上施用生根激素(Garden Safe TakeRoot生根激素,Lowe’s)没有显著的促进作用。
Alexandrova等人的优化节点培养程序[14].在诱导芽前加入预处理步骤。在预处理液和节点培养基中加入PPM(0.2%)和Benomyl (5 mg/l)进行污染控制。对于生长快的基因型,建议在继代前修剪枝条
Expressgrass GWAs人群通过节点文化传播
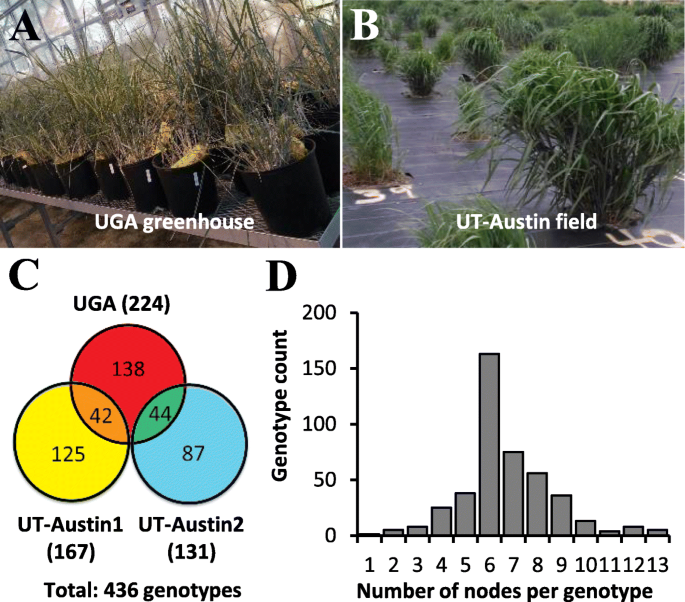
柳枝稷GWAS种群包括436个深度测序基因型,由Thomas Juenger小组在德克萨斯大学奥斯汀分校(University of Texas at Austin)的野外收集和维护,同时在佐治亚大学(University of Georgia)的温室中也种植了一个副本。为了无性繁殖这个种群,我们进行了三个节点培养实验(图。3.).在第一个实验中,从UGA温室中取样224种基因型的节点。从170个基因型引起射击,其中149种基因型具有成功的根再生。由于节点培养产生或少量植物,在接下来的两个实验中重新采样86种基因型。在第二和第三采样实验中,分别从UT-Austin场图中收集来自167和131基因型的节点。其中,从150和67个基因型引起芽,分别从128和64种基因型中产生生根植物(表1).在UT-Austin1实验中,42个再培养基因型中有29个(图2)。3.C)从节培养中培养出有根植物;在UT-Austin2实验中重新取样的44个基因型中有21个(图)。3.c)生产生根植物。对于大多数基因型,节点从一到三个分蘖收集。每个基因型采样的节点的数量范围为一至13个,大多数基因型产生4至10(图。3.d).总结(表1),共取样436个基因型,其中330个基因型通过节点培养成功繁殖,繁殖效率为75.7%。
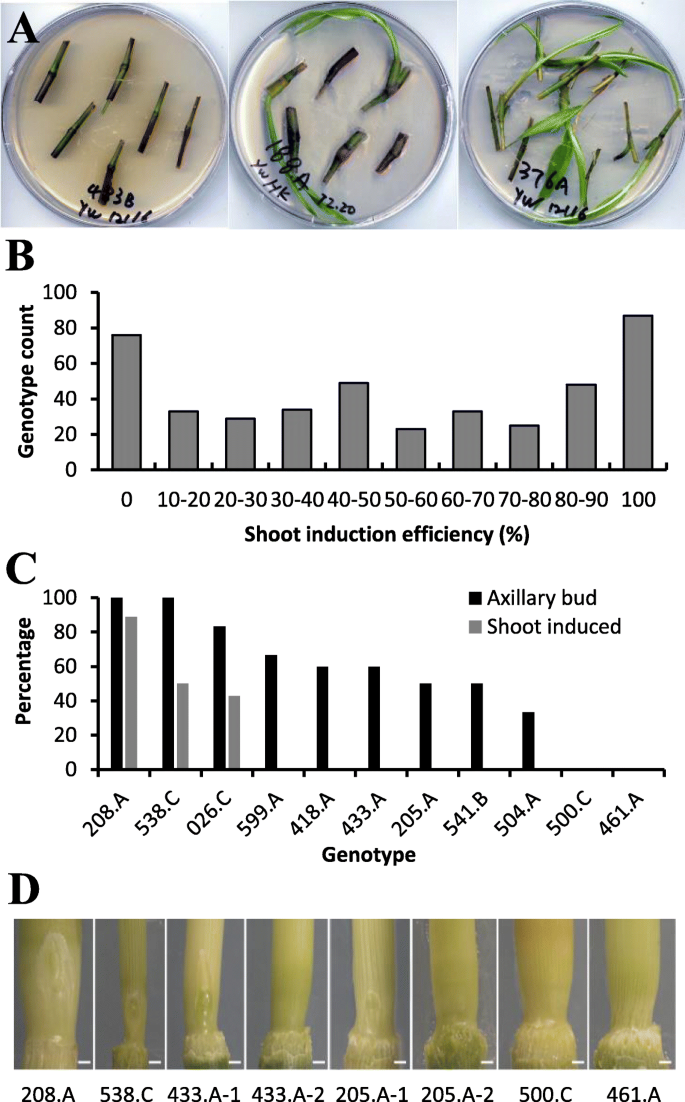
分析了GWAS群体的茎蘖诱导效率,发现不同基因型间存在较大差异(图2)。4a).虽然效率跨度为0 ~ 100%,但基因型数量分布不均匀(图2)。4b)。七十六种基因型显示出零感应效率,而89个基因型效率为100%。在节点培养中失效的基因型中,小部分(约10%)是由于在节点培养期间的早期芽诱导阶段的严重细菌或真菌污染引起的。然而,即使在没有任何可见的污染的情况下,即使在没有任何可见的污染的情况下,许多基因型也没有产生芽。为了了解低芽诱导效率是否与低腋芽形成率相关,我们检查了11个基因型中的腋芽(图。4C和D)。对于基因型208.a,所有节点都具有腋芽,89%的节点得到射击。基因型538.c的腋芽率为100%,但只有一半的节点在节点培养过程中产生芽。类似地,026.C的腋芽率为次芽诱导速率的两倍。六种基因型的腋芽率为33%至67%,尽管在任何中没有诱导芽。从11个基因型(500.c和461.a)中没有腋芽,也没有诱导芽。
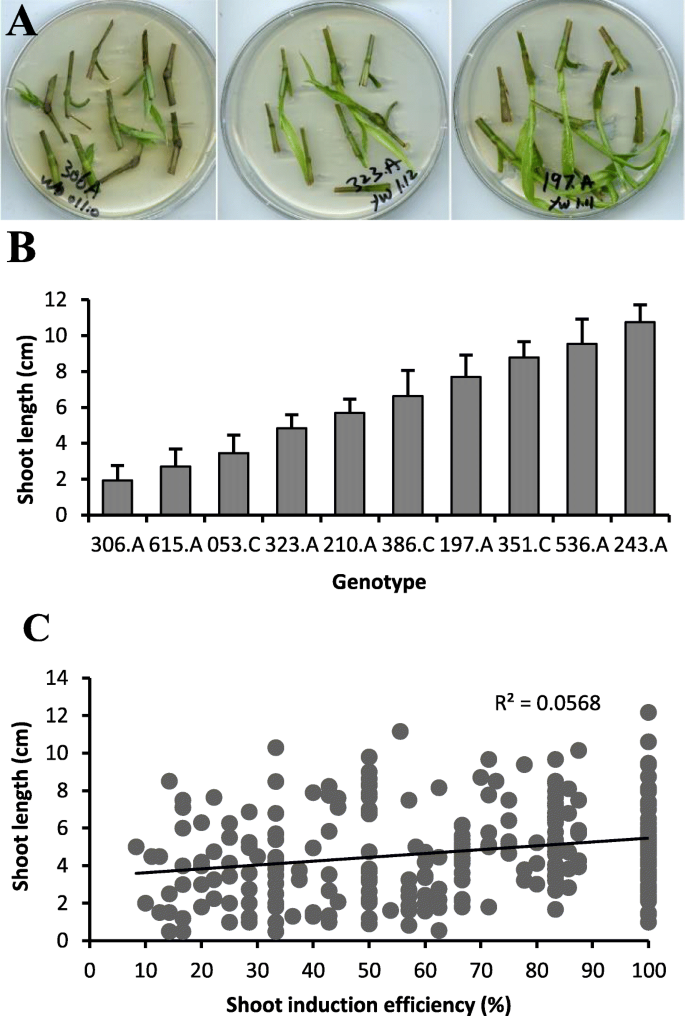
不同基因型之间的生长速率差异很大。5a).培养14 d后,有的基因型的茎长在2 cm以下,有的基因型的茎长在10 cm以上(图1)。5b).生长缓慢的植株在后期生长缓慢,即使它们在下一个传代过程中存活下来,也很少有机会生根。然而,在茎长和茎诱导效率之间没有观察到显著的相关性(图。5c)。
一种新型的、高通量的开发在足底节点文化过程
除了优化平板上的节点培养程序外,我们测试了一种水培节点培养系统,正如之前从柳枝稷[17,稍作修改。将5个基因型无菌节段的下半部分浸泡在1/4 Murashige and Skoog (MS)液体培养基中,培养4周后不产生新梢(图)S2A).在采用上述优化的节点培养方法进行的平行试验中,每个基因型均以100%的效率诱导出芽(图1)S2B).此外,我们尝试直接培养来自6个基因型的节段(不灭菌)在灭菌的地表:砂:珍珠岩(2:2:1)混合物中。经过2周的培养,一些芽从一个基因型出现,但他们很快停止生长。大多数淋巴结样本在培养结束时变黄,并被真菌污染(图)S2C).在另一项试验中,当来自3个基因型的节段直接在无土培养基中培养时,216个节段的70%。A, 80%从251.C, 92%从250。B在2周内发芽。6周后,超过一半的照片来自216。A和251.C死了,幸存的人变得虚弱。相比之下,所有的射击都是250。B存活,80%发育出根(图)S2D).以上直接节点培养试验中所检测的所有基因型均显示,采用优化的节点培养方法培养时,茎蘖诱导效率为100%。
在完整的柳枝稷植株中,基部腋芽发育成分蘖,而来自细长节的气生腋芽由于顶端优势而停止生长并保持休眠。然而,我们发现,如果去掉分蘖的顶部,在切分位置正下方原本处于休眠状态的腋芽会伸长并生长成新梢。利用这个特点,我们开发了一个简单而高效的在足底柳枝稷无性繁殖的节培养过程(图。6).它包括三个简单的步骤。首先选择至少有3个伸长节的分蘖,然后在第二个伸长节上方3cm处修剪每个分蘖。在2周内,在亲本上靠近扦插位置的节上通常会有新梢生长。其次,至少有一片叶子的新梢通过在相同节点下3厘米处剪下收获。第三,将新枝移栽到无土培养基上生根。不同基因型芽的生根能力不同(图)S3).10个基因型中有7个在4周内生根率高(92-100%)(见表)2).一些基因型,如003。E和003.C的植株需要5周或更长时间才能生根。的在足底淋巴结培养法操作简便、快速、有效。由于该方法简单,我们将其作为柳枝稷繁殖的常规方法,成功繁殖了100多个基因型。
讨论
柳枝稷不同营养繁殖方法的优缺点
在柳枝稷等异交植物中,营养繁殖是维持基因型的唯一选择。柳枝稷几种无性繁殖方法各有优缺点。分蘖繁殖是柳枝稷基因型克隆最简单的方法,也是其他方法繁殖失败的基因型克隆的唯一途径。然而,分蘖分离会引起干扰,并可能损害亲本植株。通常,母株需要几个月的时间才能长出合适的分蘖丛。此外,柳枝稷各基因型间分蘖力差异较大,难以形成完整的基因型集合。而节间培养法是快速克隆柳枝稷基因型最有效的方法,对亲本的依赖和伤害小。例如,一些基因型可以在4个月内从一个节段产生多达7根植物丛。通过这种方法产生的新植株比母株“干净”得多,因为在培养过程中,大多数害虫、病原体和内生菌都被清除了。然而,由于节点培养过程中受到严重的真菌或细菌污染,腋芽缺乏或芽无法生长,部分基因型无法通过该方法进行繁殖。 In this study, 106 out of 436 genotypes (24.3%) failed to produce new clones via node culture.
通过绕过组织培养步骤在足底结瘤培养法人工成本低,不受细菌和真菌污染,产生的苗更旺盛,生根率高(~ 100%)。类似于分蘖繁殖,这种方法严重依赖于亲本,害虫和病原体可以从亲本转移到新的无性系。值得注意的是,通过分蘖或在足底节点直接培养法可以用于实验,而植物通过节点组织培养生产需要生长在盆栽媒体一段时间(3个月在我们的例子中)删除6-Benzylaminopurine激素的影响,文化中加入,之前被用于各种实验。
影响柳枝稷节点培养效率的因素
上述所有营养繁殖方法都依赖于柳枝稷产生腋芽的能力,腋芽是由叶腋分生组织产生的[21].根据腋芽在茎上的位置,腋芽可以分为两类:基部芽,自然长成分蘖;气生芽,通常在进入休眠状态前长出几片叶子[11,22].所有的节点培养方法都利用腋芽,通过在培养基中施用外源细胞分裂素(如基于组织培养的方法)或去除顶端优势(如在足底方法)。此外,从培养基或通过母株提供的矿物质和碳水化合物促进腋芽的生长。与基于组织培养的方法进行了比较在足底节点培养方法中,其他各种直接节点培养方法的成功率较低(图1)S2)可能是由于缺乏碳水化合物和激素的外部供应。通过各种其他直接节点培养方法培养一个特定基因型的可培养性可能会受到节点内部激素水平以及碳水化合物和其他营养物质在节点内部的储存状态的影响,这取决于基因型、生长条件(田间或温室)或发育阶段(年轻或老)。因此,在选择最优节点文化方法时,需要综合考虑各种因素。
在SwitchGrass Gwas人群中观察到分蘖和节点培养性的大变化。一些基因型未能发展腋芽,另一些未能在测试的条件下从腋芽开发芽。Weaver等人。(2014)发现,当水培水时,芽形成率在阿拉胺基因型中变化,并显示出在所有十个的低位置(第二和第三基础节点)的节点中观察到的最高拍摄率(60-100%)的位置效果基因型[17].芒茎繁殖过程中也观察到类似的节点位置对茎出苗的影响[23].然而,以同一品种Alamo为研究对象,Alexandrova et al.(1996)报道,无论在什么位置,从所有节点上诱导芽的频率都是相似的[14].虽然在我们的研究中,不同位置的节点在一起培养,但没有观察到位置效应,76和89个基因型的诱导率分别为0和100%。结果表明,腋芽是根茎再生的必要条件,但不是根茎再生的充分条件。不同的柳枝稷基因型产生腋芽和从腋芽发育出芽的能力不同,这可能是柳枝稷节培养力差异较大的原因。这些研究表明,基因型是影响节点培养效率的主要因素。
另一个显著影响可培养性的因素是母株的健康状况。在三个节点培养实验中,重叠基因型的可培养性存在显著差异(图。3.C)可能与母本植物的健康状况直接相关。当2018年12月初从UGA采集节点样本时,这82种基因型的许多母株都是老的和不健康的,它们刚刚从UT-Austin田地转移到UGA温室。相比之下,UT-Austin1实验中42种再培养基因型的母植物在2019年4月底取样时是新出现的健康植物。在UT-Austin2实验中,2019年7月中旬采集样品时,大多数母株都感染了锈病,因此,在随后的节点培养中观察到更高的真菌污染率。
除培养过程中真菌污染率高外,UT-Austin2实验中培养效率相对较低的另一个原因(Table1)可能为基因型,其中大部分为旱地生态型,茎秆比低地生态型细得多。因此,我们的研究表明,培养方案、基因型和母本条件可能是影响节体培养成功率的重要因素。
关于以组织培养为基础的无性繁殖,早期的研究表明,生长调节剂、培养基成分和补品、硬化混合物和培养条件是影响培养系统效率的重要因素[9,10,24,25,26,27,28,29].这些研究还指出,不同品种对培养处理的响应不同,表明优化的培养方案很大程度上取决于品种(或基因型)。在本研究中,根据12个基因型的结果,优化了离体结瘤培养过程,所有基因型的诱导率和生根率均在100%左右在维托节点培养过程(图。2).拍摄感应,我们评估媒体包含四个组合6-Benzylaminopurine(4.4μM, 8.9μM)和物质(4.5μM, 8.9μM),两个组合的物质(4.5μM, 8.9μM)和2,现在也是酸(4.5μM),两种糖,麦芽糖(20 g / l, 30 g / l),蔗糖(20 g / l, 30 g / l),和零糖。对全MS盐和半MS盐、麦芽糖(20 g/l)、蔗糖(20 g/l)、6-苄基氨基嘌呤(0.9 μM)、硫代azuron (0.9 μM)、IBA (4.9 μM, 9.8 μM)、IAA (5.7 μM, 11.4 μM)、NAA (2.7 μM)和无生长调节剂的培养基进行了生根试验。然而,这些努力都没有导致当前文化协议的进一步改进。利用优化后的节点培养方法进行GWAS群体的大规模离体繁殖,75%的基因型成功。对于因严重污染而失败的基因型,未来可能会测试新型灭菌剂,如精油、银纳米颗粒、百里香酚和香芹酚[30.].部分柳枝稷基因型因枝条生长势弱、生根能力差而失败。这与一些核桃基因型在快繁过程中茎生活力低但生根能力强的研究结果形成了对比[31].通过优化节点培养方案,一些失败的基因型可能是可以培养的,但这将是耗时的。对于基因型顽固性或在遗传上不适合淋巴结培养的,应考虑其他方法。
柳枝稷腋芽和芽形成的研究意义
植物生长和建筑的灵活性是植物适应当前环境条件的适应策略的一部分。植物的茎生结构在很大程度上取决于腋生分生组织的数量和活性以及由腋芽发育而来的枝条的生长特征[21].地上部分枝性状直接影响地上部构型和生物量产量。在柳枝稷中,分蘖对枝生物量的贡献很大,而在完整的植株中,气生枝很少发育,但在某些条件下可能是重要的生物量贡献,例如在枝的顶部被放牧或收获后。植物分枝是由一个复杂的调控网络在遗传上控制的,其中包括植物激素和转录因子[21,22,32].许多研究表明,毒素,细胞分裂素和胞嘧啶和胞嘧啶是对腋芽激活的控制的核心[22,32].在草莓跑草中,高水平的生长素维持腋芽的休眠,而细胞分裂素打破休眠,促进腋芽分生组织[33].在SheckGrass中,证据表明了miR156-SPL4组件主要调节空中腋芽的形成和控制茎的结构[11].miR156过表达或下调SPL4柳枝稷通过稳定的转化促进了气生芽的形成,改变了枝结构[11].柳枝稷GWAS群体在节培养过程中分蘖能力、腋芽形成和对茎蘖诱导的响应等方面具有丰富的变异,是研究腋芽和茎蘖形成机制和基因的良好资源。
结论
本研究为加速柳枝稷GWAS板无性繁殖,优化了通过节点培养的微繁殖方法,以减少微生物污染,提高繁殖效率。用0.2% PPM和5 mg/l Benomyl处理节段,表面消毒后和培养过程中可显著降低细菌和真菌污染,提高培养成功率。继代培养前修剪芽能促进大多数基因型的芽增殖。采用优化的节点培养方法,柳枝稷GWAS面板436个基因型中有330个成功克隆,成功率为75.7%。此外,我们开发了一种简便、高通量的在足底节培养法是指在母株生根前,将气生腋芽诱导成芽,跳过组织培养步骤,只包括修剪节、采芽和生根三种简单操作。据我们所知,在足底本研究提出的节点培养方法是一种新颖的方法。此外,该方法在其他植物物种中也有很大的应用潜力,因为不同植物物种的顶端发育现象广泛存在,控制芽休眠的潜在机制也普遍存在[22,32].考虑到各种无性繁殖方法的优缺点,本研究不仅为柳枝稷研究人员提供了更多无性繁殖工具,也为其他植物无性繁殖研究提供了潜在的帮助。我们首次证明了通过节点培养进行大型和多样化的柳枝稷自然集落的快繁是可行的。
方法
采集植物材料和节点样品
本研究中使用的柳枝稷GWAS种群的所有资料最初由UT-Austin的Thomas Juenger博士提供[34].为了繁殖GWAS群体,我们进行了三个节点培养实验。在第一个实验中,2018年12月初从佐治亚的一个温室中收集了节段。第二次和第三次实验的节点取样分别于2019年4月下旬和7月中旬进行,均来自UT-Austin领域。采样后,立即保存于50ml Falcon锥形离心管中,4℃保存后使用。
污染控制用抗生素和杀菌剂的试验
从污染节点培养外植体中根据颜色和生长速度选出6株不同的内生细菌。细菌在结瘤培养基上划线(见表)S1)补充有各种抗生素,包括新霉素(50或200毫克/升,植物霉菌实验室),利福平(50mg / L,Phytotech Lab),卡那霉素(50 mg / L,Phytotech Labs),所以时间素(200 mg /L,Phytotech Labs)和头孢噻(400 mg / L,Phytotech Labs)和0.2%PPM(植物防腐剂混合物,沉箱实验室),并在28°C下孵育5天。对于抗真菌试验,在无菌水(作为对照)中浸泡过夜后,含有0.2%漂白剂的无菌水,0.1%AAs(抗生素抗催化溶液,Sigma),10mg / L纳米霉素(Phytotech Labs)。,0.2%ppm,或5mg / l苯甲基(甲基1-(丁基碳酰亚甲酰基)-2-苯并咪唑烷基甲酸盐,sigma)。接下来,在含有相同浓度的含有相同杀菌剂的节点培养基上培养治疗的节节外植体。在培养2周后计数真菌污染。在Microsoft Excel中进行ANOVA和LSD测试,以确定杀菌剂治疗中的统计学意义。
节点文化协议
本研究中的节点培养协议是在Alexandrova等人发表的基础上修改的[14].从每个茎节上方和下方3cm处切除健康和干净的结,然后用30% (v:v)商用漂白剂(含0.1%吐温20)在室温下100转振荡40分钟进行表面消毒,然后用无菌水漂洗两次。然后将节点样品浸泡在含0.2% PPM (v:v)和5 mg/l苯甲酰的无菌水中,在4°C下过夜或5天。然后将每个节段从两端各1 cm处剪去,用手术刀纵向切成两半,然后转移到节点培养液中(见表)S1),含0.2% PPM (v:v)和5 mg/l苯甲酰,切割面朝下,接触牢固但未完全出现在培养基中。在24°C、16 h光周期、200 μmol m条件下培养2周−2年代−1光强度。下一步将新长出的芽分离到同一培养基上进行增殖。在3-4周内就可以生根或继代。枝条在盆栽培养基Metro-Mix 360中生根,在温室中,26℃,光照16 h, 300-500 μmol m−2年代−1光照强度,80%的湿度条件下。在高湿度条件下,采用自动喷水系统每30分钟喷雾8秒,或用圆顶覆盖并定期浇水。生根后转入另一温室,在26°C / 22°C昼夜温度、14 h光周期、300-500 μmol m−2年代−1光强度。
在足底节点文化协议
首先,选择至少有3个伸长节的分蘖,在第二个伸长节上方剪短3厘米。其次,生长2周后,在节下3cm处采收从扦插位置正下方的节节处冒出的带1片或2片叶子的新梢。为了减少蒸腾作用,如果叶片过大,就会部分修剪。最后,将枝条移栽到Metro-Mix 360上,在上述高湿度条件下生根。
其他改进的直接节点培养方法
对柳枝稷GWAS群体的5个基因型进行了改良的水培节培试验。对于每一个基因型,20节段采样从植物生长在温室高贵的研究所,LLC。灭菌和预处理后,一半的节点样本每个基因型培养在盘子里“节点文化协议”后,半在50毫升猎鹰锥形离心管培养,下半部分浸泡在5ml 1/ 4ms液体培养基中。在24°C、16 h光周期、200 μmol m条件下培养两种处理的结瘤细胞−2年代−1光强度。在另一项试验中,从6个柳枝稷基因型各收集15-20个节段(每个节段下面3cm和上面3cm),直接培养在消毒的turface:sand:perlite(2:2:1)混合物中,每个节段完全埋在培养基中(2cm深)。同样,3种柳枝稷基因型的10-20个节点样本在Metro-Mix 360中直接培养。所有新生长的节点都在温室中相同的高湿度条件下进行生根。
数据收集和分析
培养14 d后,计数可见芽数,测量芽长。柳枝稷基因型的诱导芽数除以培养节数,计算其诱导芽数。如果一个节点的两个半部分产生了两个或两个以上的芽,它们就被算作一个。为了分析修剪茎叶对茎叶增殖的影响,将茎叶从顶部修剪至0.5 - 1cm长,然后移栽传代。再培养4周后,统计芽数。学生的t检验确定了两种处理(修剪和不修剪)之间的统计学显著差异。腋芽检查:用手小心地将鞘从淋巴结节段取出,在徕卡S6D立体显微镜下观察腋芽并拍照。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。在本研究中使用和/或分析的数据集可从通讯作者在合理要求。
缩写
- GWAS:
-
基因组协会研究
- PPM:
-
植物混合防腐剂
- 可能:
-
德克萨斯大学奥斯汀分校
- 佐治亚大学:
-
佐治亚大学
- 女士:
-
Murashige和斯库
- 原子吸收光谱法:
-
抗生素抗催化溶液
- CBI:
-
生物能源创新中心
- 能源部:
-
能源部
- Ober:
-
生物与环境研究办公室
参考
- 1.
沃格尔KP。柳枝稷。在:Moser LE, Burson BL, Sollenberger LE,编辑。温暖的季节(C4)草。阿格龙Monogr 45。麦迪逊:ASA-CSSA-SSA;2004.p . 561 - 88。
- 2.
洛杉矶Kszos McLaughlin SB柳枝稷的发展(黍virgatum)作为美国的生物能源原料。生物质生物能源。2005;28:515-35。
- 3.
帕里什DJ, Fike JH。用于生物燃料的柳枝稷的生物学和农学。植物科学学报2005;24:423-59。
- 4.
Sanderson MA, Adler PR, Boateng AA, Casler MD, Sarath G.在美国将柳枝稷作为生物燃料原料。中国植物科学(英文版)2006;86:1315-25。
- 5.
柳枝稷的遗传多样性及其遗传结构研究(黍virgatuml .)的人口。基因资源作物学报。2013;60:1057-68。https://doi.org/10.1007/s10722-012-9903-x.
- 6.
徐旭,程建峰,王志刚,等。柳枝稷植物结构和适应基因的自然变异(黍virgatuml .)。BMC Evol Biol. 2018;18:91。https://doi.org/10.1186/s12862-018-1193-2.
- 7.
Talbert Le,Timothy DH,Burns JC,罗林斯Jo,Moll Rh。expressGrass中遗传参数的估计。农作物科学。1983; 23:725-8。
- 8.
PokapūAkoranga Pūtaiao。营养植物传播。科学学习中心2013。从检索https://www.sciencelearn.org.nz/resources/1662-vegetative-plant-propagation.
- 9.
斯蒂文斯ME,皮尤PM。快速在体外顽抗种的芽的增殖胡桃黑质生物医学工程学报。2018;37(4):534 - 538。
- 10。
Vahdati K,Ajamgard F,Rahemi M,Driver J.商业山核桃栽培种植的研究进展。int j水果sci。2020; 20(3):1-12。
- 11.
郭建军,傅聪,刘胜,等。的miR156-SPL4模块主要调控气生腋芽的形成,控制茎生结构。新植醇。2017;216(3):829 - 40。https://doi.org/10.1111/nph.14758.
- 12.
登切夫警局,康格尔BV。柳枝稷愈伤组织再生植株的研究。细胞生物学杂志1994;34:1623-7。
- 13.
登切夫警局,康格尔BV。柳枝稷离体培养:2,4- d、盐酸吡氯仑联合苄胺对愈伤组织诱导和再生的影响。植物细胞组织器官邪教。1995;40:43-8。
- 14.
Alexandrova KS, Denchev PD, Conger BV。柳枝稷节培快繁技术研究。作物科学。1996;36:1709-11。
- 15.
Alexandrova KS, Denchev PD, Conger BV。柳枝稷节段花序的离体发育。作物科学。1996;36:175-8。
- 16.
Conger BV的Gupta SD。在体外从平面的完整幼苗中分化多个枝条。体外细胞驱动生物植物。1998年; 34:196-202。
- 17.
Weaver JM, Sujo LSM, Feldmann KA。柳枝稷(黍virgatumL.)基因型。生物序列。2014; 7:1351-7。https://doi.org/10.1007/s12155-014-9470-4.
- 18.
老吉米尔,查尔顿,贝尔,克里希纳穆蒂,杜兰特。俄克拉何马州北部天然高草草原柳枝稷内生真菌群落的多样性美国:https://doi.org/10.1007/s13225-010-0085-6.
- 19.
夏颖,Amna A, Opiyo SO。煤矿柳枝稷可培养内生真菌群落及其对植物生长的影响《公共科学图书馆•综合》。2018;13 (6):e0198994。https://doi.org/10.1371/journal.pone.0198994.
- 20。
柳枝稷内生细菌的分离与鉴定黍virgatumL.)品种。J appl microbiol。2013; 114(3):836-53。https://doi.org/10.1111/jam.12088.
- 21。
王B,史密斯SM,Li J.射击建筑的遗传调节。Annu Rev植物Biol。2018; 69:437-68。
- 22。
王志强,王志强,王志强,等。信号整合在植物分枝调控中的应用。《细胞生物学》2011;12:211-21。
- 23.
Boersma Nn,Heaton Ea。温度,照明和节点位置对Miscanthus X Giganteus茎秆繁殖的影响。GCB生物能源。2012; 4:680-7。https://doi.org/10.1111/j.1757-1707.2011.01148.x.
- 24.
基于种子组成的核桃组培培养基优化。环境科学与技术。2009;50(2):148-53。
- 25.
核桃改良快繁技术(英文)胡桃regia研究了以核桃仁矿物含量为基础的最佳生长培养基。Acta Hortic。2009;839:117-24。
- 26.
Sharifian S,Vahdati K,Mirmasoumi M,Ghaem Maghami SA。甘油糖醇对组织培养波斯核生物的影响。Acta Hortic。2009; 812:189-95。
- 27.
Gotea R, Gotea I, Sestras R, Vahdati K。在体外几种核桃栽培品种的繁殖。公告Uasvm园艺。2012; 69(1):167-71。
- 28.
王志强,王志强,王志强,等。不同通气浓度对波斯核桃幼苗生长和植株解剖结构的影响。acta Hortic science & technology . 2014;1(2): 111-20。
- 29.
(1)核桃分枝和生根的影响因素胡桃regial .)。Acta botanica yunnanica(云南植物研究). 2017;https://doi.org/10.17660/ActaHortic.2017.1155.77.
- 30.
关键词:百慕达草,精油,银纳米颗粒,杀菌在体外文化。中国生物医学工程学报。2014;1(2):131-40。https://doi.org/10.22059/ijhst.2014.52784.
- 31.
Vahdati K,Rezaee R,Mirmasoumi M.一些侏儒和早期成熟的核桃基因型的微催化。生物技术。2008; 8:171-5。
- 32。
泰希曼,莫尔。沙平植物建筑。植物学报2015;6:1-18。https://doi.org/10.3389/fpls.2015.00233.
- 33。
关键词:草莓,生长素,腋芽,生长发育,细胞分裂素BMC Plant Biol. 2019;19:528。https://doi.org/10.1186/s12870-019-2151-x.
- 34。
张丽萍,张丽萍,张丽萍,等。QTL x环境交互作用是柳枝稷跨大纬度梯度适应差异的基础。中国科学院院刊2019;116:12933-41。https://doi.org/10.1073/pnas.1821543116.
确认
感谢佐治亚大学的Katrien M. Devos博士、Ali Missaoui博士和Thomas H Pendergast Iv博士,以及德克萨斯大学奥斯汀分校的Tom E Juenger、Jason Bonnette和Nicholas Ryan博士为我们提供了用于节点培养的植物材料。我们感谢密歇根州立大学的David B Lowry博士分享柳枝稷节点培养协议和在节点培养期间真菌污染控制的建议。我们感谢诺贝尔研究所有限责任公司的王雪岩、马库斯·格里菲斯、马特·霍根和迈克尔·克罗伊德在UT-Austin2实验中的节点样本收集或数据收集方面的帮助。
资金
这项工作得到了生物能源创新中心(CBI)的资助,该中心是美国能源部(DOE)的一个研究中心,由能源部科学办公室的生物和环境研究办公室(OBER)资助。该研究还得到了诺布尔研究所有限责任公司的支持,提供研究设施和服务。资助机构没有参与研究的设计、数据收集和解释,也没有撰写手稿。
作者信息
隶属关系
贡献
YW,YK和WD收集的SwitchGrass节点样本;YW和WD执行了节点文化实验;YW做了所有其他实验,并收集和分析数据;yw起草了稿件;YK,MCS和MKU批判性修订了手稿。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
嫩枝修剪对嫩枝增殖的影响。通过在继代培养前修剪枝条,四种基因型中有三种诱导出了更多的枝条。意义(*p≤0.05,* *p≤0.01),采用学生检验,样本量为5 ~ 7。
附加文件2:图S2。
测试了其他节点培养方法。(A)采用韦弗等人改良的水培法培养5个基因型柳枝稷节点2周[17].(B)通过优化的节点培养方法,相同的5个基因型在培养2周后,芽的诱导效率为100% (A)。(C)来自6个基因型的节点在turface:sand:perlite(2:2:1)混合培养3周。(D)来自3个基因型的淋巴结在Metro-Mix 360中培养6周。
附加文件3:图S3。
基因型显示不同的生根速度。(A-D)四种基因型的芽,由小说产生在足底节点培养方法,植根于28天。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王勇,董伟,萨哈,M.C.et al。柳枝稷快速无性繁殖节点培养方法的改进黍virgatuml .)。BMC植物杂志21,128(2021)。https://doi.org/10.1186/s12870-021-02903-z
已收到:
接受:
发表:
关键字
- 节点文化
- 在足底节点文化
- 微体繁殖
- 营养繁殖
- 腋芽
- 柳枝稷
- 黍virgatuml