抽象的
背景
已经认识到,一定数量的栖息地干扰是促进自然杂交的促进因素,迄今为止,我们不知道在优先占据干扰栖息地的植物中探索杂交和生殖障碍的任何研究。Buddleja.植物(也称为蝶形灌木)通常会在干扰的栖息地中生长,并且已经提出了几种具有杂交起源的物种,仅仅基于形态学证据。
结果
在本研究中,我们测试了这个假设B.×Pararii.包括? ?在内的三个类群的两个同域居群是否有自然杂交的起源B.×Pararii.和它的父母(B.德国人和b . crispa)加4参考父母群,使用四种核基因和三个叶绿体卵子间隔物以及10个形态特征。我们的结果表明,在这两个网站上B.×Pararii.可能是杂交之间的B.德国人和b . crispa此外,我们确认所检查的大多数混合动力车是f1.s。这些植物是f1.S通过形态进一步支持,因为没有检测到过侵占性的字符。b . crispa被发现是来自CPDNA证据的Bahe(BH)人口中的母亲父母。然而,在Taji(TJ)人群中,由于分享到的共同的CPDNA单倍型,杂交方向难以建立B.德国人和b . crispa然而,由于支持“Si×SC规则”的交叉特定授粉处理结果,我们仍然预测了类似的单向杂交模式。
结论
主要是f1.杂交种可以成功地阻碍基因流动,从而在典型的分布中维持家长物种的物种边界Buddleja.,即在干扰的栖息地。
背景
植物自然杂交是一种常见的现象,被认为在植物多样性和物种形成中起着重要的作用[1.,2.,3.,4.].许多实证研究专注于自然杂交的发作,并检查了包括生殖障碍的问题[5.,6.[有时涉及适应转移的回复和迟发[7.,8.,9或通过基因沼泽加速灭绝[10,11,12].以前假设是罕见的现象,但最近发现是常见的,是存在主要由F组成的杂种1.年代(13,14,15,16,17],由于固有的不兼容性,包括F1.杂种不育和/或不育[4.,13,18]和外在选择,由于强烈的栖息地选择,具有杂种的其他基因分型[13,14,19,20.].一定数量的栖息地干扰可能能够促进自然杂交的发生[21,22,23],一方面打破了物种间原有的生态隔离,促进了杂交,另一方面也为杂交提供了适宜的栖息地。然而,到目前为止,我们还没有发现任何关于优先占据干扰生境和/或新交替生境的植物杂交和繁殖障碍的研究。
与后期发生的混合动力车不同,这通常表现出广泛的形态方差,因为遗传偏析,F1.由于亲本基因组的完全结合,来自特定亲本物种的杂种往往具有相似的形态[15]. 因为这个,F1.■往往是不准确的形式被描述为新物种,尤其是主要涉及形态的分类家。这是一个例子红杜鹃从云南,中国长期被视为一个好物种[24].然而,最近,它已经确认了其混合起源,并且类型局部性的人口研究表明,大多数混合动力器都是f1.年代(13].
属Buddleja.L.(Scrophularaceaceae),包含100多种物种,广泛分布于美洲,非洲和亚洲的热带,亚热带和温带地区[25,26].中国-喜马拉雅地区是这个属的多样性中心,超过75%的亚洲Buddleja.在该区域发生的物种[27,28]. 此外,大多数Buddleja.物种更愿意在干扰的栖息地(例如,道路的两侧和河岸),这是先驱植物的典型[29,30.,31]和一些物种(例如B. Davidii.)如果被引入新的环境,可能会变得具有侵入性[32,33,34].由于分布和花期的大量重叠,以及传粉者的共享,种间杂交被认为是属中较为常见的[25,26,29].然而,迄今为止,只有一例自然杂交通过分子数据得到证实[24].
Buddleja wardiiC. marand最初被C. marand在1929年描述为来自西藏的一个新种[35].Leeuwenberg [29]随后审议b . wardii在SympaTric物种之间成为一个杂交b . crispa和B.德国人,基于样品型和Ludlow C.S.的形态特征。4098(BM,E,K),以及这两个物种是唯一的其他Buddleja.在该地区发现的物种。决定时的一个重要特征B.×Pararii.植物是叶子有时是交替的,甚至在同一植物上有时是相对的,即使在相同的杆上也是如此(图。1.).B.×Pararii.在人类活动频繁的地区,如人工水道沿线或农田之间的山脊上发现,人为干扰可能很严重。
这项研究的目的是检验假设B.×Pararii.这些植物是自然杂交的,在西藏的两个地点。我们使用了3个叶绿体DNA区域和4个核基因用于以前的研究Buddleja.(nrETS.,gapC2,PPR24,PPR123)[16,36回答下列问题:1)是b . wardii植物实际上是杂交的b . crispa和B.德国人在这两个地点?2)如果是,这两个杂交带的遗传模式是否存在差异,这两个杂交带都存在严重的生境干扰;3)杂交带的遗传结构是否为亲本物种之间的繁殖隔离机制提供了线索?
结果
形态分析
在叶长(L)、叶宽(W)和叶长/叶宽比(L/W)三个性状中,推定杂种个体的叶长和叶宽两个形态性状均处于中间值B.德国人和b . crispa(桌子1.). 长宽比明显大于对照组B.德国人比在另外两个分类群中(表1.).在7个花性状中,花冠筒宽度(TW)和花药高度(AH)分别为:花冠筒宽度(TW)和花药高度(AH)B.×Pararii.介于两个假定亲本物种的值之间,而herkogamy(HE)在三个分类群之间没有显著差异(表1)1.). 其余4个花色性状,花冠筒长(TL)、花冠裂片长(CLL)、花冠裂片宽(CLW)和花柱长(SL)均表现出相似的花型特征,其中花冠筒长(TL)、花冠裂片长(CLL)、花冠裂片宽(CLW)和花柱长(SL)的花型特征最为明显B.德国人具有比测量的值更低的值b . crispa或B.×Pararii.(桌子1.).
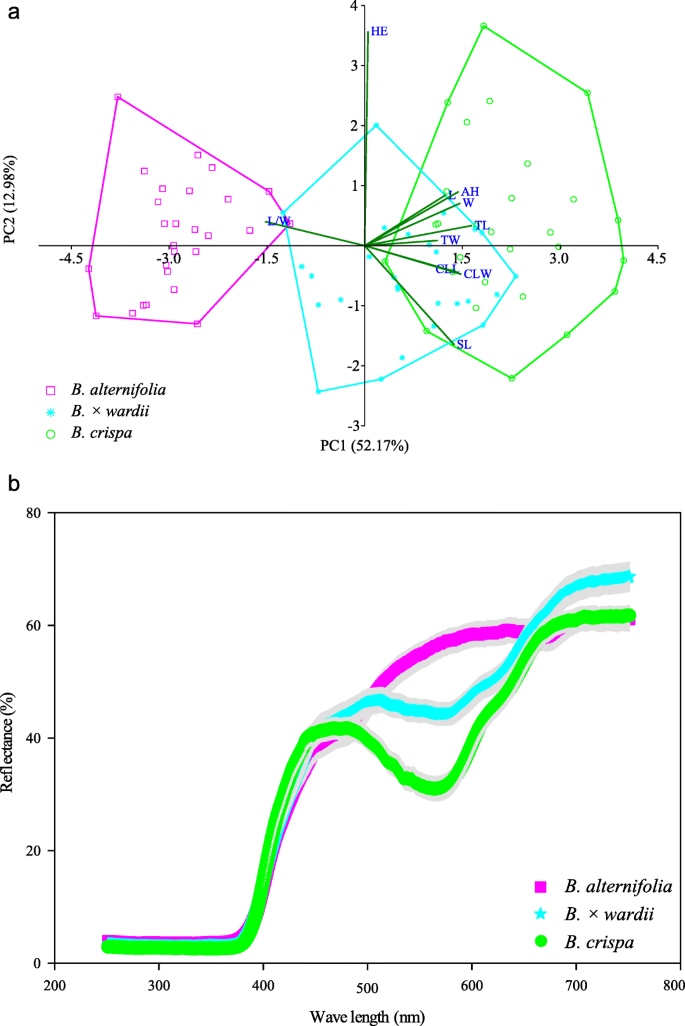
这两个推定的父母种类在形态上显然是明显的。在10个形态特征的PCA中,总共有前两个主要成分解释了总数的52.17和12.98%。基于PC1和PC2的二维散点图显然显示了分离B.德国人和b . crispa.个人B.×Pararii.在两个父母种之间落下,略微重叠B.德国人有很大的重叠b . crispa.除HE外,其余9个性状的相关系数差异不大(0.29 ~ 0.38)。2.一个)。
花瓣颜色反射
三种研究类群的花冠反射光谱存在差异。这两个b . crispa和B×德钦滇紫草发现在485nm处的反射光谱中具有明显的峰值,变化极低。然而,反射谱中没有明显的峰值B.德国人(图。2.b)。
授粉治疗
两种间隙的交叉授粉治疗,其中b . crispa或B.德国人作为母种,结实率、平均单果种子数、平均结实种子数和平均单果结实种子数存在显著差异。当b . crispa是母体植物,较高的水果套装(64.71%vs 6.45%),每粒的种子数量越多(43.42±16.01 vs 6.5±0.71),种子套更高(68.79%vs 0)和每个水果的剧烈种子更多(在将这些参数与交叉特定授粉进行比较时,观察到26.90 vs 0)B.德国人作为母体植物(补充表1.).另外,当产生相对大量的种子时b . crispa进行了卵花授粉,表明自交亲和的繁殖系统(结实率:48.68%),而在B.德国人遭到手工自我授粉。
四种核基因的序列分析
NrETS.
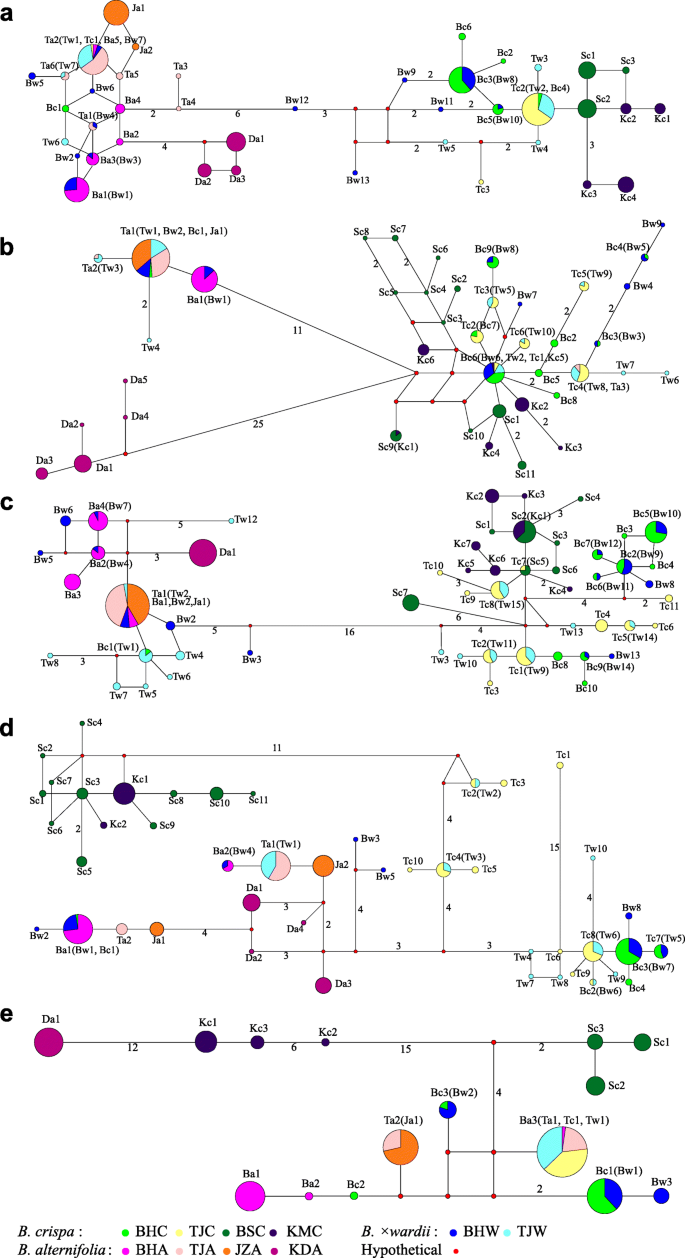
nr的总长度ETS.区域对准在所有个体中为380bp,包括30个核苷酸取代和1-BP插入/缺失(对于变异部位,请参见补充表S.2.).这些变异位点产生了40个单倍型,其中Ba 5个,Bc 6个,Bw 13个B.德国人,b . crispa和B.×Pararii.在BH群体中分别发现了6种(Ta)单倍型,3种(Tc)单倍型和7种(Tw)单倍型。在4个参考群体中,JZA、KDA、BSC和KMC的样本分别代表2个(Ja)、3个(Da)、3个(Sc)和4个(Kc)特异单倍型。通过单倍型网络分析确定了两个主要的聚类,其中有6个核苷酸突变。一个集群主要由来自B.德国人和B×德钦滇紫草由5个来自BHA的单倍型、1个来自BHC的单倍型、7个来自BHW的单倍型、6个来自TJA的单倍型、1个来自TJC的单倍型、3个来自TJW的单倍型和所有的单倍型组成B.德国人从异地种群中。另一个群体主要由单倍型组成b . crispa和B×瓦尔第,包括5个BHC单倍型、6个BHW单倍型、2个TJC单倍型、4个TJW单倍型和全部单倍型b . crispa来自各种群体(图。3.一个)。
单倍型网络ETS.(A.),gapC2(B),PPR24日(C),PPR123(D),cpdna(E).每个分类单元的单倍型以其居群和种名的首字母表示(“Ba”、“Bc”和“Bw”表示)B.德国人,b . crispa, 和B×德钦滇紫草分别来自波黑人口;而“Ta”、“Tc”和“Tw”指的是B.德国人,b . crispa, 和B×德钦滇紫草分别来自TJ种群;" Da ", " Ja ", " Sc "和" Kc "指的是B.德国人来自KD和JZ,还有b . crispa来自BS和KM。分离两个相邻单倍型的突变的数量由连接线上给出的数量表示,对于只有一个突变步骤的人省略该数量,并且节点大小与每个单倍型的频率成比例。彩色圆圈代表不同物种的单倍型,如下:绿色,黄色,深绿色和深蓝色代表b . crispa;粉红色、玫瑰色、橘色和洋红色代表B.德国人;蓝色和炉甘石蓝色代表B.×Pararii..小红色圆圈代表假设或未拼接的单倍型
两倍的单倍型b . crispa聚集在一起B.德国人群集,并在BHCR2,BHCR7和TJCR13中发现,显示来自两个簇的不同单倍型。除了两个人,BHWI9和TJWI1,所有B×德钦滇紫草具有两种单倍型的个体分为两种发散簇,主要含有来自两者的单倍型B.德国人和b . crispa从BH和TJ人口。剩下的两个个体只有一个与之共享的单倍型b . crispa在这个位点是纯合的(图。3.a、 表2.).
胞质基因2.
总长度gapC对于所有个体,2区域对准为606bp,包括67个核苷酸取代,一个2-BP和1-BP插入/缺失(用于变异部位,参见补充表S.2.).从这些基因座中观察到总共41个单倍型,其中一个(Ba),九(BC)和九(BW)单倍型属于B.德国人,b . crispa和B.×Pararii.在BH居群中有3个(Ta)、6个(Tc)和10个(Tw)单倍型,分别。在4个参考群体中,JZA、KDA、BSC和KMC样本分别具有1个(Ja)、5个(Da)、11个(Sc)和4个(Kc)特异单倍型。单倍型网络分析显示了三个主要的聚类,其中一个聚类包含了KDA的所有单倍型,第二个聚类包含了BHA的一个单倍型,BHC的一个单倍型,BHW的两个单倍型,TJA的两个单倍型,TJW的三个单倍型,JZA的唯一单倍型与TJA的主单倍型相同。第三类为BHC的8个单倍型,BHW的7个单倍型,TJC的6个单倍型,TJW的7个单倍型和所有的单倍型b . crispa从异地种群中。
为了b . crispa在TJ和BH群体中,有两个个体(BHCR2和BHCR7)在第二个聚类中发现了单倍型,但所有其他单倍型都在第三个聚类中发现。为了B.德国人其中,有两个个体TJAL6和TJAL12在第三个聚类中发现了单倍型,其他所有单倍型都在第二个聚类中发现。所有B.×Pararii.个人但一个(BHWI9)显示出来自第二和第三簇的两种发散单倍型,并且大多分享两者中发现的单倍型B.德国人和b . crispa从BH和TJ人口。剩余的个体BHWI9是来自第三簇的单倍型纯合(图。3.B,表格2.).
PPR24
总长度PPR所有个体的24个区域对准为647bp,包括70个核苷酸取代(对于变异部位,见补充表S.2.).该位点单倍型数量最大,为53个。B.德国人,b . crispa和B.×Pararii.在BH群中分别有四(BA),十(BC)和14(BW)单倍型,而在TJ人群中,这些物种中存在一种(TA),11(TC)和15(Tw)单倍型.对于四种参考群体,来自JZA,KDA,BSC和KMC的样本分别具有一个(JA),一种(DA),七(SC)和七(KC)特异性单倍型。在单倍型网络分析中,用16个核苷酸取代鉴定出两个主要簇。一个群集含有来自BHC的四个单倍型,来自BHC的七个单倍型,来自BHW的七个单倍型,来自TJA的唯一单倍型,来自TJW的八个单倍型和每个引用群体中的每一个的独特单倍型。B.德国人.其他群体含有来自BHC的九个单倍型,来自BHW的七个单倍型,来自TJC的七个单倍型,来自TJW的七个单倍型,以及所有单倍型b . crispa从异地种群中。一个b . crispa个人(BHCR7)和所有B.×Pararii.个体表现出两个不同的单倍型,分别来自两个群落(图1)。3.C,表格2.).
PPR123
序列比对后PPR123区长度为735 bp,包括59个核苷酸替换(变异位点,补充表S2.). 共鉴定出45个单倍型,其中Ba基因2个,Bc基因4个,Bw基因8个B.德国人,b . crispa和B.×Pararii.在BH群体中,TJ群体中有2个(Ta)、10个(Tc)和10个(Tw)单倍型,分别。对于四个参考群体,JZA,KDA,BSC和KMC的样品分别具有两个(JA),四(DA),11(SC)和两种(KC)特异性单倍型。如单倍型网络分析所示,所有单倍型都将其聚集成四组,其中七个,六个或13个变体。第一个疏水蛋间由BHC的BHC,来自BHC的五个单倍型,来自BHW的五个单倍型,来自TJA的两个单倍型,来自TJA的单倍型和所有单倍型B.德国人从异地种群中。第二个疏水膜由BHC的三个单倍型,来自BHW的三个单倍型,来自TJC的五个单倍型和来自TJW的七个单倍型。第三个疏水蛋白组成来自TJC的五个单倍型和来自TJW的两个单倍型。其余的思工包括所有单倍型b . crispa来自各种群体(图。3.d)。
所有单B.德国人个体属于第一类。为b . crispaBHC和TJC中的个人,只有一个来自BHC集群,与来自BHCR7的第一个人一起聚集在一起(TJCR3 / 5/6 / 9/10 / 11/11 / 11/11 / 11/11 / 11/11 / 11/11 / 11/11 / 10/11 / 11/12/15 / 10/11 / 11/12/15 / 10/11 / 11/12 / 13/15)落入第二和第三簇,四个人(TJCR1 / 4/8/16)的单倍型在第二个疏水网中聚集,两个人(TJCR2 / 14)在第三个疏水网中具有单倍型。个人的B.×Pararii.在美国,除BHWI9外,其他所有BHWI9都有两个不同的单倍型,其中一个来自第一个聚类,与BHWI9共享主单倍型B.德国人另一个来自第二个或第三个聚类,与第二个或第三个聚类共享主要单倍型b . crispa.剩下的BHWI9个体在第二个分枝中有两个单倍型(图。3.D,表格2.).
结合叶绿体区域的序列分析
CPDNA片段对准的组合对齐长度(包括rpl公司16,的环境D级-的环境T的环境S码-TRNF.M) 2014年 包含38个核苷酸替换,一个1-bp,一个2-bp和一个6-bp插入/缺失(变异位点见补充表S)2.).在所有样品中发现总共15个单倍型,其中三(KC),三(SC)和一个(DA)分别对KMC,BSC和KDA的参考群体特异。单倍型网络分析表明,这三种参考种群与其他群体不同,至少七种DNA碱基变体。来自TJ的所有人只有两种单倍型,其中一个单倍型来自TJA(TJAL2 / 3/4 / 8/11)的六个人,并与来自参考人口JZA的唯一单倍型(JA)分享,而另一个在剩余的42个个体中发现单倍型与个体BHAL13中发现的单倍型一致。每个分类群在BH人口中有三个单倍型,其中两个(BA),一个(BC)和一个(BW)是特定的B.德国人,b . crispa和B×德钦滇紫草分别是。大多数来自BHW的个体(75%)与其他个体共享单倍型b . crispa(六氯),虽然它们与B.德国人.剩下的四个B.×Pararii.个体(25%)有一个独特的单倍型,与优势单倍型相差一步b . crispa(图。3.e,表格2.).
newhybrids分析
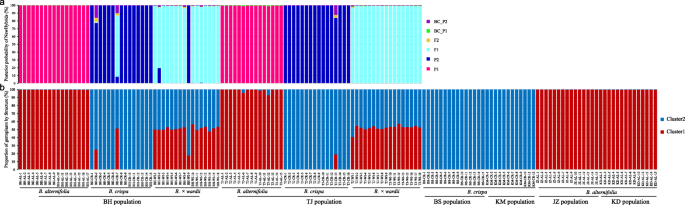
用新whybrids对3个类群中的4个核基因进行分析,结果表明,这些个体在形态上被鉴定为B.×Pararii.来自TJ和BH的大多数人都是F.1.杂交种B.德国人和b . crispa. 在BH,33个具有假定亲本形态的个体中有31个被分配到具有高后验概率的纯亲本物种(> 98.8%). 除了两个(BHWI2和BHWI9)外,所有来自BHW的个体都被鉴定为F1.S, >的后验概率为96.8%。BHWI2经鉴定为F型1.后验概率为77.8%,BHWI9为b . crispa后概率为99.7%(图。4.一个)。
在TJ人口,只确定了TJCR13b . crispa,低概率为84.0%,其余假定亲本个体均为高后验概率的纯亲本(> 99.0%)。所有假定的杂种均鉴定为F1.后验概率> 97.4%(图。4.a).因此,在两个种群中,有3个个体被鉴定为回交b . crispa概率低于16%,远低于它们的概率b . crispa或f.1.s、 因此杂交没有发生在F1.一代。
人口结构分析
所有个人的总共213个变异基因座的结构分析表明最高值△当K = 2时获得k,表明所有152个个体聚集成两种类型的遗传簇。当k = 2,对于四个参考分配群体,所有来自kmc和bsc的个体形成纯簇(q≥0.999),而来自KDA和JZA的所有个体形成另一个纯簇(Q≥0998)。
如图所示。4.b、 在BH群体中,所有的个体在形态上都被确定为B.德国人聚集成一个簇,其高比例含有一个遗传组分(Q≥0997)。除了两个个人,BHCR2和BHCR7,所有人被确定为b . crispa形成另一个含有另一种遗传成分的聚类≥0.998. 在BHCR2和BHCR7中,与BHC群体个体共有的遗传成分比例分别为0.755和0.510。全部B.×Pararii.个体从两个簇(Q = 0.494±0.084的BHA)显示出大约相等的比例,期望BHWI9,其显示来自BHC簇的0.820个遗传组分的比例。
和波黑的人口相似,大多数B.德国人(TJA)和b . crispa(TJC)来自TJ人口含有高比例的不同遗传成分(Q≥0.988,TJA;Q≥0.999,TJC)。其余的三个人中,TJAL6和TJAL12的概率分别包含0.959和0.931的含量为0.959和0.931,而TJCR13含有来自TJC的遗传组分的可能性为0.830。所有人B.×Pararii.(TJW)具有类似于TJA和TJC(Q = 0.523±0.033的遗传成分的比例相似的比例(Q = 0.523±0.033)。
讨论
在四个被评估的数量形态性状中,B.×Pararii.显示父片物种之间中间的字符,而剩下的五个字符与那些相似b . crispa不同于B.剑神。没有观察到透明性状,这表明非常早的一代杂种具有有限的遗传分离。色谱加性B×德钦滇紫草在亲本种的每个分化的核基因(表2.),以及利用newwhybrids对基因型的估计进一步证实了这一点B.×Pararii.个人应该被认为是f1.s。因此,来自形态学和分子标记的证据使我们拒绝了假设B.×Pararii.经历了足够的遗传重组对于建立二倍体杂交物种至关重要[37].或者,F.1.S可以成功地阻碍父母种类之间的基因流动,从而维持物种边界B.德国人和b . crispa在分布区重叠的地区。有趣的是,我们发现两种亲本物种都经常出现在受干扰的生境中,因此中间生境的经验假设被认为是建立杂种的关键,因为假设亲本物种的本地生境的杂种适合度都较低[21].
最传统上认为自然杂交的先决条件,即Sympatric分布,重叠开花时期(B.德国人从四月到六月,而b . crispa从三月至八月)[38,39]和共享的粉丝器(蜜蜂,大黄蜂和蝴蝶)[40](个人观察)在B.×Pararii.[1.[所有人都促进了两个家长物种之间的自然杂交。另一个有利于自然杂交之间的因素B.德国人和b . crispa是他们是二倍体,2n = 38 [27,这可能会促进杂交[41,42].此外,Buddleja.在亚洲是一个年轻的思工,在喜马拉雅山的隆起期间开始大约10 mA多样化[27,43它们之间的生殖隔离可能不完整。
我们从未发现孤立的人群B.×GUNDII,在我们的两个研究人群中,它都和假定的父母一起生长。因此,很可能B.×Pararii.不是自我可持续发展[44,45].综合来看,我们的证据表明B.×Pararii.不应该被认为是一种混合物种。因此,我们建议将来的文献避免了这个名字b . wardii.
尽管F1.在研究领域确认了显性杂交区,CPDNA的遗传模式不同。在大多数血管植物中,叶绿体DNA是母体遗传的[46].对BH人群的cpDNA测序表明b . crispa和B.德国人每一种都有自己特定的叶绿体DNA单倍型B×德钦滇紫草个体具有相同的单倍型b . crispa.在剩下的四个中看到的独特单倍型B×德钦滇紫草个体(BHWI8/11/15/16)可能与亲本未抽样多态性有关。关于杂种cpDNA不对称遗传的解释,已经提出了几种假说,包括繁殖系统、开花时间、传粉者行为和接触区亲本类群的局部丰度差异[5.,47,48.,49.].对于目前的研究,我们没有证据表明传粉者的行为数据与不对称杂交有关。有一种假说认为自交不亲和的物种可能比自交不亲和的物种更常见地扮演母亲的角色[13],已被称为“SI×SC规则”[50.].以前的研究已经证实了自相容性b . crispa从归因于地瘤授粉的大量种子集,类似于外交之后的[40],自花授粉处理未获得种子B.德国人.另外,开花高峰期在b . crispa在那之前吗B.德国人,只有非常有限的重叠。通过对从西藏引种到昆明植物园的两种亲本植物个体开花时间的观察,b . crispa几乎完成开花时B.德国人开始.由于缺乏纯合的花粉,具有早期开花时间的物种更容易在开花结束时具有更多的异质特异性花粉。因此,更容易成为杂种的母体父母[13,51.]假设共享粉碎机没有对一个父母的探访偏好。
另外,在TJ杂交区中,无法从CPDNA结果识别母体父母(仅有6个人B.德国人具有与其他个体不同的单倍型,这三个类群的所有其他个体都具有相同的单倍型)。因为几乎所有的混血儿都是F1.只有极少数低概率回交给父母(新杂种:B.德国人: 0;b . crispa:1;结构:B.德国人: 2;b . crispa:1),拒绝了对重复回复的解释,这对该杂交区中的CPDNA模式有贡献。我们观察到> 500成熟B.德国人<100b . crispaTJ的个人。CPDNA的单倍型可以通过历史事件(例如瓶颈)来解释,降低CPDNA的单倍型多样性,这需要进一步研究。另外,由于叶绿体基因的缓慢的进化,可能难以在密切相关的物种对中鉴定任何杂种的母体母体可能是困难的[52.,53.在快速自适应辐射期间,祖先多态性的或血管多态性的不完全分类(ILS)Buddleja.[43]. 然而,如上所述,b . crispa由于“SI×SC规则”,可以是TJ中的母体植物。
结论
在西藏海拔3400米以上的两个地点,对两种蝴蝶灌木的杂交模式进行了调查。形态分析和分子分析都支持这一假设,即假定的杂种植物主要是F1.S,它可以进一步有效地促进亲本植物之间的几乎完全的生殖隔离。自兼容的育种系统和早期的峰开花时期b . crispa可能使它成为更常见的母本,这是由杂交后代的cpDNA分析支持的。总的来说,本研究提供了有关维持生殖隔离的见解,特别是对于在干扰生境中同域生长的先锋植物,迄今为止在自然杂交研究中基本上被忽视。
方法
本研究的种类和植物材料
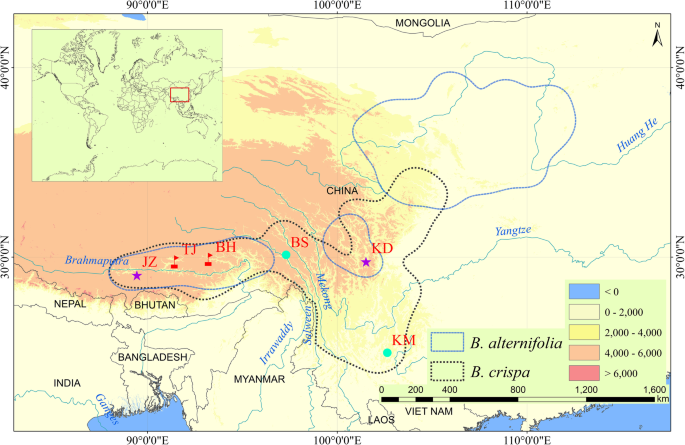
这两个b . crispa和B.德国人是生命力旺盛的落叶灌木或小乔木,高2-4米。b . crispa是在热/暖谷的广泛种类,在森林边缘,在暴露的悬崖上,在暴露的悬崖上,在Himalaya-Hengduan地区的海拔1400-4300米的岩石裂缝中,在岩石裂缝中26,54.].B.德国人分布在中国西北部,整个西藏到黄土高原,自然发现沿河岸边生长或在1500-4000米的海拔地区灌木丛中的溪流中的溪流。26,55.].生态,b . crispa和B.德国人非常容易受到栖息地干扰的影响[29,54.,55.]. 这两个物种占据相似的栖息地,经常出现在同一个地方,它们的海拔范围重叠[38,54.,55.].两者都是二倍体,染色体数目为2n = 38 [27,29,56.,57.],并在春天开始开花(b . crispa:3月至8月;B.德国人:四月至六月)[38,39].
所有形态特征和分子分析材料均在野外采集。在中国西藏拉萨和林芝,形态介于B.德国人和b . crispa被发现与沿着Brahmaputra河的两个分支的这两个物种的SympaTric群体共同发生:Ni-Yang River和Lhasa River(图。5.).在这项研究中,我们抽取了17,15,16个B.德国人,b . crispa和B.×Pararii.来自林芝市巴河镇(BH),以及15、16和17名B.德国人,b . crispa和B.×Pararii.从拉萨塔吉县(TJ)进行分子分析。此外,四个异域种群B.德国人和b . crispa作为纯亲本群体取样,以供参考:B.德国人西藏日喀则江子县、四川藏族自治州康定县(Garzê);b . crispa来自云南昆明的西山和西藏昌都的巴苏县。抽样信息见表3.. 采用中国植物区系(FOC)进行特异性鉴定[38]. 优惠券标本存放于中国科学院昆明植物研究所植物标本室(补充表S)3.).在两个采样的人群中,许多人(超过500个)B.德国人个体被发现。然而,在伯克希尔哈撒韦和东京,这两个城市的人口规模估计b . crispa而假定的杂交种每群体不到100株。
形态特征的测量和数据分析
每胞分类群随机选择30个成年植物,并从长期,营养,目前生长的枝条中间的一片新鲜成熟的叶子从6月份采样。针对这些取样叶中的每一个测量三叶形态特征:1)叶长度(L);2)叶宽(W);3)叶长度与叶宽(L / W)的比率。4月30日植物的开花期间从30个植物(每人一朵花)的开花期间,从30株植物中测量七种形态花卉字符从30株植物中测量:4)花冠长度(TL);5)花冠宽度(TW,花冠筒顶部的直径);6)花冠叶长度(CLL);7)花冠叶宽度(CLW);8)花药高度(啊,从雄蕊顶部到卵巢开始);9)风格长度(SL,从柱顶的顶部到卵巢底部); 10) herkogamy (HE, separation between tip of style and base of stamen). These 10 characteristics were measured using digital calipers to the nearest 0.01 mm (Supplemental Table S4.).
用修剪后的平均值来计算每个分类单元30个个体的平均值[58.].单向ANOVA用于分析SPSS统计数据三个分类群中的这些特征16.0 [59.],并采用标准F统计量确定均数之间的差异显著性。当数据不满足方差齐性标准时,使用Welch统计量。事后Tamhane的测试进行了两两比较。数据在过去(Palaeontology Statistical)软件中进行二维Procrustes拟合。3.26 [60.]为了标准化地标坐标,然后是形状主成分分析(PCA),以对测量的形态特征(叶子和花卉特征)进行多变量分析[61.].
花瓣颜色分析
为了评估这三种植物在不同波长下的光反射模式,使用USB2000+微型光纤光谱仪和DH2000氘卤素光源(Ocean Optics, Dunedin, FL, USA)对花冠颜色进行光谱测量。在250 nm到750 nm的范围内以0.45和0.55 nm的增量进行测量[62.].我们选择了30个花瓣(每个分类单元30个个体中每一朵花),并对每个花瓣进行一次测量(补充表S5.).
人工杂交和种子萌发
B.德国人昆明植物园于2020年春季成功引进西藏植物,并于2020年春季开花。进行了人工杂交试验B.德国人和b . crispa以这些物种为亲本,进行了三种种间异花授粉处理(表S1.).对于所有治疗,随机选择超过10个花序,总共有1-3张花朵和总共24,31和34个单花,然后是人工阉割,手工授粉和袋装。在它们破裂之前收获胶囊,并且计算了水果的数量。在胶囊自然开阔后,计算每种水果的种子数量。
采集两种授粉处理的种子,均匀播种在直径9 cm的一次性无菌培养皿中,内衬3张滤纸,用蒸馏水浸湿。每个培养皿最多播种50粒种子,种子在20℃下在植物生长室内进行12小时的光周期萌发(MTI-202;日本东京利技会有限公司)[63.].
DNA提取,PCR扩增和DNA测序
使用改性的十六烷基三甲基铵(CTAB)方法将总DNA从约50mg干燥的叶中提取[64.],然后在进一步分析之前储存在-20°C。三个低拷贝核基因(gapC2,PPR24,PPR123),编号ETS.区域,三个质体区域(rpl公司16,的环境D级-的环境T的环境S码-的环境FPCR扩增成功的Buddleja.在之前的出版物中被选择进行测序[16,36,65.].NrETS.,gapC2,PPR是核核糖体外部转录间隔物的一部分gapC基因家族和五肽重复基因家族。所有引物的序列见补充表S6..
采用2 × Taq PCR Master-mix (Tiangen)或KOD-FX DNA聚合酶(forPPR24)。PCR条件设定如下:94℃的初始变性4分钟;然后将32个循环为94℃,30s,相应的退火温度为52至54℃,40 s,72℃为50秒;和72℃的延伸步骤10分钟。通过在1.2%琼脂糖凝胶上运行它们后,将PCR产物送到ABI 3730DNA分析仪(Applied Biosystems)上的DNA测序。序列已在Genbank沉积在Genbank中,登录号MT7333350-MT733514和MW591352-MW591467。此外,序列数据ETS.和gapC从Liao等发表的论文中获得了12个KMC个体的2个基因[16].
数据分析
DnaStar中的程序SEQMAN™用于对准,组装和DNA序列的比较[4.,16].DNASP ver中的阶段。用5.10.01推断单倍型,并计算单倍型的数量[66.,67.,68.].对于阶段的少数单倍型估计,我们选择具有最高分析概率的单倍型(补充表S7.).网络版本。用5.0.1.1构建各基因的单倍型网络[61.]. 纽弗。1.1用于每个个体的基因型等级推测:双亲种,F1.年代和F2.s、 回交到每个亲本种[69.](补充表S8.).
用程序Structure ver测定基因组的混合比例。2.3.4使用默认设置[70,71.].分析使用从1到15的不同簇(K)数量进行运行,每个K执行8次迭代,一个老化100,000次,一个MCMC 100,000次迭代(补充表S9).结构收割机网ver。用0.6.94得到不同类群的最优K [72.,73.](补充图S1.). 在8次独立运行中,估计每个个体的建议聚类数的隶属系数,并使用Microsoft Excel 2016生成总体结构图。
可用性数据和材料
支持本研究结果的数据集包含在本文中及其附加文件中。
缩写
- ANOVA:
-
方差分析
- 背景:
-
脱氧核糖核酸
- cpdna:
-
叶绿体DNA
- 聚合酶链反应:
-
聚合酶链反应
- 密度:
-
马尔可夫链蒙特卡罗
参考
- 1.
自然杂交和进化。纽约:牛津大学出版社;1997.
- 2.
里瑟博格LH。杂交在进化中的作用——旧酒换新皮。中国生物医学工程学报,1995;
- 3.
杂交在植物物种形成中的作用。植物生物学年鉴。2009;60:561–88.
- 4.
张瑞,刘涛,吴武,李玉克,赵吕,黄ls,石舍,周遥。红树林蕨类植物中自然杂交的分子证据Acrostichum. BMC植物生物学。2013;13:74.
- 5。
周RC,龚X,Boufford D,Wu CI,Shi Sh。试验植物中单向杂交的假设:观察Sonneratia,工业和橐吾.BMC EVOL BIOL。2008; 8:149。
- 6。
魏YK,黄烨,李GB。SympaTric中的生殖隔离鼠尾草分享唯一粉碎机的物种。生物方向SCI。2017; 25(6):608-14(中文)。
- 7。
arnold ml。(1993)虹膜纳尔逊:同源杂种的起源和遗传组成。李建平。生物多样性研究进展[J] .生物工程学报。1993;
- 8。
Yan LJ,GAO LM,LI DZ。自然杂交之间的分子证据Rhododendron spiciferum和R. Spinuliferum.(杜鹃花科)。系统演化。2013;51(4):426-34。
- 9。
Zhang W, Dasmahapatra KK, Mallet J, Moreira GR, Kronforst先生直升机蝴蝶物种。基因组医学杂志。2016;17(1):25。
- 10.
塔内娜S,Hiramatsu M,Okubo H.之间的杂交和不对称杜鹃eriocarpum和r . indicum在日本西南部的Yakushima岛上。j植物res。2008; 121(4):387-95。
- 11.
托斯图斯科M,Pascual Ma,Owens GL,Ostevik KL,Moyers Bt,Hübners,Heredia Sm,Hahn Ma,Sastys C,Bock DG,Rieseberg LH。杂交和灭绝。evol。2016; 9(7):892-908。
- 12.
吴瑞兹,邹诗,谭GW,胡泽,王毅,宁ZL,吴文,刘啊,他,周rc。分子鉴定自然杂交之间Melastoma malabathricum和瓜育瘤BENCRARA在马来西亚沙捞越。ECOL EVOL。2019; 9(10):5766-76。
- 13.
zahg, Milne RI, Sun H.红杜鹃:主要由F1.S在云南,中国。Ann Bot。2010; 105:89-100。
- 14.
米尔尼·里,特齐奥格鲁S,雅培R。以可育F为主的杂交区1.S:物种障碍的维护杜鹃.摩尔生态。2003;12(10):2719 - 29。
- 15.
Milne Ri,Abbott RJ。两种干涉中的生殖隔离杜鹃物种:后F的低频频率1.在阿尔卑斯杂交区中的杂种基因型。Mol Ecol。2008; 17(4):1108-21。
- 16。
廖RL,马YP,龚WC,陈G,孙WB,周RC,Marczewski T。两种植物分布边缘的自然杂交和非对称渐渗Buddleja.有大量重叠的物种。植物生物学杂志。2015;15:146。
- 17。
张宁宁,马彦平,Folk RA,于俊杰,潘永忠,龚旭。三种同域分布区物种边界的维持橐吾(Senecioneae菊科)物种。植物生物学杂志。2018;60(10):986-99。
- 18。
张南,俞吉,王毅,龚X.三种密切相关的分组物种中不对称杂交的分子证据。AOB植物。2018; 10:PLY011。
- 19。
Kyhos DW、Clark C、Thompson WC。混合性Encelia Laciniata(Compositae,Heliantheae)和分散后选择对人口组成的控制。SYST BOT。1981; 6(4):399-411。
- 20.
长野Y,平尾AS,Itino T。两种紫罗兰杂交区的遗传结构,辽宁堇菜Hemsl。和v比塞蒂maxim .: f的主导地位1.窄接触范围内的个人。植物规格BIOL。2015; 30(3):237-43。
- 21.
栖息地的杂交。进化。1948;2:1-9。
- 22
Grant PR, Grant BR。物种形成的。大自然。2014;507(7491):178 - 9。
- 23
杂交是对基因组的一种入侵。生态学报。2005;20(5):229。
- 24
方美,方RZ,何美,胡LZ,杨HB,张伯伦DF。杜鹃花。作者:吴哲,瑞文博士,编辑。中国植物志,第14卷。北京和圣路易斯:科学出版社和密苏里植物园;2005年。260–455.
- 25
诺曼·埃姆·佛陀科。纽约:纽约植物园出版社;2000
- 26
斯图尔特·巴德莱哈斯。波特兰:木材出版社;2006
- 27
陈刚,孙文斌,孙洪Buddleja.中国喜马拉雅地区的(佛手科)及其生物地理意义。Bot J Linn Soc.公司。2007;154(3):305–12.
- 28。
GE J,CAI L,BI GQ,Chen G,Sun WB。表征完全叶绿体基因组Buddleja Colvilei.和b . sessilifolia:对Buddleja..分子。2018;23(6):1248。
- 29。
Leeuwenberg AJM。非洲XVIII的律膜河。Buddleja.2非洲和亚洲种的修订。瓦赫宁根:Mededelingen Landbouwhogeschool;1979.
- 30.
龚WC,陈G,刘CQ,Dunn Bl,Sun WB。与内部的花香气味比较Buddleja Fallowiana和Buddleja officinalis(Scrophulariaceae)。生物学习系统系统。2014; 55:322-8。
- 31。
Raja S,Ramya I.关于民族科医药学,植物化学和药理学的综述白背枫.国际药学杂志2016;7(12):4697-709。
- 32。
Sheppard AW, Shaw RH, Sforza R.欧洲传统生物防治的20种环境杂草:对采用的机会、法规和其他障碍的回顾。杂草研究》2006;46(2):93 - 117。
- 33.
泰伦-霍尔塞尔NG,瓦特女士,侵入性的大佛布什(蝴蝶)。机器人启2009;75(3):292 - 325。
- 34.
Wittig R.频率大佛弗兰克(德国的佛手莲科植物。弗洛拉。2012;207:133–40.
- 35.
马奎尔和CVB。F船长收藏的植物。1924-25年喜马拉雅山东部和西藏的金顿区。1929;48(321):149–229.
- 36.
Chau Jh,O'Leary N,Sun WB,Olmstead RG。基于多种核和塑性标志物的部落BuddleJeae(Scrophulariaceae)的系统发育关系。Bot J Linn Soc。2017; 184(2):137-66。
- 37.
马一平,张长青,张建林,杨建军。自然杂交德拉瓦伊杜鹃和r . cyanocarpum(杜鹃花科),从形态学,分子和生殖证据。植物生物学学报。2010;52(9):844-51。
- 38.
李PT, Leeuwenberg AJM。马钱科。正确答案:吴征,Raven PH,编辑。中国植物志,第15卷。北京:科学出版社;1996.320 - 38页。
- 39。
王海,张奇,李昕,赵浩,施Xb。快速传播Buddleja alternifolia.贵州阿里斯科。2010; 38(6):30-1。
- 40.
龚威克,陈克,vereecken nj,dunn bl,ma yp,太阳wb。花卉香味组成预测五个蝴蝶灌木丛中的蜂授粉系统(Buddleja.,盲味的科动物。植物BIOL。2014; 17:245-55。
- 41.
寇yx,小k,赖克,王yj,张玉。自然杂交Torreya jackii和t .茅(Taxaceae)在中国东南部。J Syst Evol。2017; 55(1):25-33。
- 42.
宁红,潘玉忠,龚晓。天然杂交的分子证据Ligularia Nelumbifolia和Cremanthodium stenoglossum(菊科Senecioneae)。植物学。2019;97(1):53 - 69。
- 43.
Chau Jh。系统学Buddleja.玄参科:系统发育关系、历史生物地理学和系统基因组学。华盛顿:华盛顿大学;2017.
- 44.
Abbott RJ。性,向日葵和形态。科学。2003; 301(5637):1189-90。
- 45.
Feliner GN, Alvarez I, Fuertes-Aguilar J, Heuertz M, Marques I, Moharrek F, Pineiro R, Riina R, Rossello JA, Soltis PS, Villa-Machio I同倍体杂交物种形成罕见吗?经验主义的观点。遗传。2017;118(6):513 - 6。
- 46
Morgensen HL。种子植物中细胞质遗传的影响。我是J机器人。1996年; 83(3):383-404。
- 47
马彦平,米尔恩R,张昌全,杨建军。一种不寻常的杂交模式,涉及狭窄的特有种杜鹃云南,中国的物种(Ericaceae)。我是J机器人。2010; 97(10):1749-57。
- 48
MA YP,Xie WJ,Tian XL,Sun WB,Wu ZK,Milne R.西北云南西北两种异构族新族物种之间的单向杂交和生殖障碍。Ann Bot。2014; 113:753-61。
- 49
童志勇,黄树青。6个共花授粉前和授粉后的相互作用脚笛物种通过异质型花粉转移。新植物。2016; 211(4):1452-61。
- 50。
刘易斯D,克劳LK。开花植物中单侧间隙不相容。遗传。1958; 12(2):233-56。
- 51。
张建军,黄树青。不对称杂交的证据,尽管授粉前和授粉后生殖障碍两个硅宾物种。AOB植物。2016; 8:PLW032。
- 52。
Wolfe KH,Li WH,夏普PM。植物线粒体、叶绿体和核dna的核苷酸替换率差异很大。国家科学院学报。1987;84(24):9054–8.
- 53。
Drouin G,Daoud H,XIA J.种子植物线粒体,叶绿体和核基因组中的同学取代的相对速率。mol phylocyet evol。2008; 49(3):827-31。
- 54。
岳LL,陈G,孙WB,孙H。植物系统地理学Buddleja Crispa.(BuddleJaceae)及其与中国西南部排水系统演变的相关性。我是J机器人。2012; 99(10):1726-35。
- 55。
王杰,张jg,徐y,吴慧,太阳gp。干旱灌木的生物学特性研究Buddleja alternifolia.中国野生植物资源。2007;26(6):23-5。
- 56。
摩尔rj。洛纳西亚州的细胞霉素研究I.律孢子瘤中的染色体数量和系统发育。我是J机器人。1947年; 34(10):527-38。
- 57.
摩尔R.多倍体,系统发育和旧世界的光周期Buddleja..进化。1961;15(3):272 - 80。
- 58.
Marczewski T,MA YP,张XM,Sun WB,Marczewski AJ。为什么人口信息对于分类物至关重要?涉及杂交群和相关品种的案例研究。AOB植物。2016; 8:PLW070。
- 59.
SPSS软件。SPSS统计16.0。芝加哥:SPSS公司。;2007
- 60.
Hammer Ø, Harper DAT, Ryan警局。过去:古生物统计软件包的教育和数据分析。Palaeontol电子。2001;4(1):9。
- 61.
Bandelt HJ,Forster P,RöhlA.中位数加入网络,用于推断内部化学性。mol Biol Evol。1999; 16(1):37-48。
- 62.
MA YP,Wu ZK,Dong K,Sun WB,Marczewski T.授粉生物学紫胶杜鹃(杜鹃花科):中国云南西北部特有的高山植物。系统进化杂志。2015;53(1):63–71.
- 63.
孙文斌,江平,孙文斌。光照和温度对种子萌发的影响Buddleja Crispa..植物生理学通讯。2002;38(6):557-8。
- 64.
道尔JJ,道尔JL。一种用于少量新鲜叶片组织的快速DNA分离方法。植物化学通报。1987;19(1):11–5.
- 65.
Borg AJ,McDade La,SchönenbergerJ.分子系统血症和Thunbergioideae(Acanthaceae)的形态学演变。分类。2008; 57(3):811-22。
- 66.
Librado P, Rozas J. Dnasp v5:一个全面分析DNA多态性数据的软件。生物信息学。2009;25(11):1451 - 2。
- 67.
关键词:种群数据,单倍型重建,统计方法,单倍型张学军。2001;30(4):531 - 531。
- 68.
单倍体型推断中连锁不平衡的衰减及缺失数据推断。张学军。2005;30(3):449-62。
- 69.
安德森EC,汤普森EA。利用多位点遗传数据识别物种杂种的一种基于模型的方法。遗传学。2002;160(3):1217–29.
- 70。
Hubisz MJ, Falush D, Stephens M, Pritchard JK。利用样本群信息推断弱总体结构。生态资源学报。2009;9(5):1322-32。
- 71。
Pritchard JK、Stephens M、Donnelly P。利用多位点基因型数据推断群体结构。遗传学。2000;155(2):945–59.
- 72。
厄尔达,冯霍尔德BM。结构收割机:一个网站和程序的可视化结构输出和实现埃文诺方法。保存基因资源。2012;4(2):359–61.
- 73。
Evanno G,Regnaut S,Goudet J.使用软件结构检测个人的簇数:模拟研究。Mol Ecol。2005; 14(8):2611-20。
致谢
我们感谢陶丽丹女士在实地调查中的帮助,感谢编辑和匿名审稿人对手稿的评论。
资金
国家自然科学基金(No. 31770240);中国科学院青年创新促进会(No. 2018428);云南省中青年学术技术带头人后备人才(批准号:2018HB066)和云南省“万人计划”(批准号:2018HB066)ynwr - qnbj - 2018 - 174)。创始人只提供了资金支持,并没有参与实验的设计、数据的收集、分析和解释,决定出版,或手稿的准备。
作者信息
从属关系
贡献
YM和RL收集了植物材料并写了稿件;RL进行实验并分析了数据;YM和WS设计了实验并修改了稿件。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意事项
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:表S1。
不同处理的结实率和结实率B.德国人和B. Crispa。
附加文件2:表S2。
部分的可变位点和插入ETS.,gapC2,PPR24,PPR所有研究中的单倍型基因和叶绿体代骨间隔物。
附加文件3:表S3。
三个标本信息Buddleja.研究中的分类群。
附加文件4:表S4。
10单向ANOVA和主成分分析的形态特征数据。
附加文件5:表S5。
花瓣反射光谱B.德国人,b . crispa, 和B.×Pararii..
附加文件6:表S6。
本研究中使用的引物序列。
附加文件7:表S7。
单倍型和基因型B.德国人和b . crispa在四个核基因和组合的叶绿体区域(CPDNA)。
附加文件8:表S8。
六种遗传簇的概率来自新杂交分析。
附加文件9:表S9。
两个遗传簇从结构分析中的概率。
附加文件10:图S1。
ΔK值用于结构分析。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
廖,R.,Sun,W.&Ma,Y。西藏两只蝴蝶灌木丛之间的自然杂交:F的主导地位1.杂交促进了强烈的生殖隔离。BMC植物BIOL.21,133 (2021). https://doi.org/10.1186/s12870-021-02909-7
已收到:
认可的:
发表:
关键字
- 蝴蝶灌木丛
- Buddleja.
- 杂交
- F1.-优势杂种
- 生殖隔离