抽象的
背景
叶绿体是植物光合作用的工厂,是作物生物量和经济产量的关键。然而,叶绿体的发育是一个复杂的过程,由细胞核和质体之间的交叉通信协调,其潜在的生物发生机制尚未完全揭示。斑纹突变体为识别参与叶绿体发育的基因或因素提供了理想的模型。绿色区域存在发育良好的叶绿体,而白色区域含有叶绿素缺乏的未分化的质体。与白化植物不同的是,斑纹突变体可以存活到成熟,并使研究叶绿体生物发生的信号通路成为可能。大麦中的等位变异,爷爷1(GPA1),长期被鉴定但尚未遗传表征。
结果
我们对它进行了特征分析和基因分析爷爷1.a.(gpa1.a)突变体。使用透射电子显微镜(TEM)评估叶绿体超微结构,并确认叶绿体生物发生在白色部分中断gpa1.a.确定…的精确位置GPA1,构建了高分辨率的基因图谱。利用大麦50 k iSelect SNP阵列对分离个体进行基因分型,并将连锁SNP转化为pcr标记进行遗传定位。的GPA1该基因定位于与光合作用或叶绿体分化功能相关的基因簇内的2H染色体。组合成的gpa1.a突变体,我们鉴定了该基因簇中的大缺失,消除了推定的体液末端氧化酶(PTOX)。
结论
在这里,我们的特征和转基地映射了gpa1.a大麦中引起杂色表型的突变。ptox编码基因在分隔区是一个很有前途的候选基因GPA1.因此,本研究为该品种的克隆提供了基础GPA1,这将提高我们对叶绿体生物发生的分子机制的理解,特别是在单子叶植物。
背景
作为植物细胞中的特征细胞器,叶绿体对于植物光合作用至关重要,对生物质和经济产量产生重大影响。越来越多的研究表明,通过合成二次代谢物和防御植物激素,例如反应性氧,一氧化氮,茉莉酸和水杨酸,越来越多地对植物免疫产生重要贡献。1,2].为了限制病原体感染,叶绿体可以导航到渗透部位并直接抑制宿主细胞入侵[3.].因此,了解叶绿体的生物发生是必要的,以满足不断增长的人口压力下不断增长的粮食需求。
叶绿体与未分化的囊泡的未开发的囊泡的分化,含有未分化的囊泡并缺少堆叠的囊体(Grana),叶绿素的安装平台。叶绿体生物发生是高度复杂的,通过蒽曲面(叶绿体)和逆行(叶绿体到核)的信号传导来策划[4,5].超过95%的人〜在叶绿体中发现的3000个蛋白质被核基因编码并在细胞溶质中的合成后进口到叶绿体中,表明叶绿体发育主要受核基因组织的控制[6].因此,这些核基因的鉴定和功能表征对于了解叶绿体生物合成的调控机制具有重要意义。斑驳突变体为识别参与叶绿体发育的基因或因素提供了理想的模型[7].绿色区域存在发育良好的叶绿体,而白色区域含有叶绿素缺乏的未分化的质体。与白化植物不同的是,斑纹突变体可以存活下来结种,并能研究细胞核和质体之间的交叉通信。
两个代表拟南芥杂色突变体,雇佣(即时通讯) 和组合成2(var2),为理解植物叶绿体的生物发生提供了基本视角[8,9,10,11,12].的即时通讯突变体是由核编码的体积末端氧化酶(PTOX)的函数丧失引起的,通常存在于囊体膜中。该塑料喹啉氧化酶还具有Mitochondria中替代氧化酶(AOX)的同源性[8,9].的VAR2基因,也称为丝状温度敏感H2(FtsH2),将叶绿体靶向ATP依赖性锌金属蛋白酶酶与其同源大肠杆菌FtsH [13].IM和var2在光保护中的角色以及光合电子传输链的氧化还原状态的调节[8,10,14,15].这些蛋白的缺乏导致了高光下的光损伤/光氧化质体,特别是在白色部分。此外,ftsh介导的蛋白水解参与了ROS激活的逆行信号转导[16].
含有杂色突变体中致力叶绿体的绿色部分可能表明存在补偿机制以逃避突变的缺陷。抑制筛查即时通讯和var2背景技术已经确定了恢复杂色表型的几个第二位点突变。抑制器即时通讯包括类囊体膜蛋白(氯仑抑制剂2-2,CRR2-2)和植物组合和模块化蛋白质(PCMP)家族成员(质子梯度调节5,PGR5)[17.].PCMP家族与在细胞细胞RNA的编辑和成熟中运行的五氢肽重复(PPR)蛋白质密切相关。CRR2-2和PGR5还需要替代电子传输途径,可在叶绿体生物发生期间缓解光仪和光合作用[18.].大多数已识别var2抑制剂涉及叶绿体翻译或rRNA加工和编辑,例如叶绿体局部化的假尿嘧啶合酶(Variegation1,SVR1)的抑制剂,叶绿体CLPP / R蛋白酶(SVR2)的CLPR1亚基,一种叶绿体翻译引发因子2(傅-gaeri1,fug1),叶绿体翻译伸长因子Ef-g(雪豆细胞1,sco1)和ppr蛋白(svr7)[19.].虽然斑驳突变体和抑制因子的筛选使许多与叶绿体发育相关的基因得以克隆,但在叶绿体生物发生和斑驳机制方面的知识仍存在重大空白。
由于单圈和双象状植物之间的叶绿体开发的差异,单像的杂色突变体表现出叶片上交替的白色和绿色带的条带表型。大麦 (大麦芽无性系种群。vulgare)是第四大最重要的谷物作物,用作饲料谷物,人类食品,以及麦芽和酿造工业的原料。它也是植物基因组学研究中有价值的模型单子叶植物。化学和辐射诱变技术为大麦改良和基因组研究提供了丰富的遗传材料(http://www.nordgen.org/).从各种来源到常见背景中的表征突变的瞬间已经产生了一系列近似的近代素(NIL),具有单一突变等位基因,为快速基因识别提供了强大的工具[20.].已经发现了一些杂色突变体,但很少有基因特征[21.],包括等位基因突变体爷爷(GPA.或全科医生)于20世纪40年代确定[22.,23.,24.].
与形态标志物固定的等位质测试和联系研究平均绩点基因在染色体2(2HL)的长臂上[20.,25.].然而,基因控制的GPA.突变体尚未被调查。的gpa1.a等位基因是由品种Lyallpur(Gsho 519)中的自发突变引起的,并且它被引入Bowman背景以迟发[20.].使用BW397,弓箭手携带空gpa1.a突变,我们对其进行了特征分析并精细地绘制了GPA1本研究中的基因。据透露,叶绿体生物发生在突变体中的白色条纹上有缺陷,而且GPA1基因位于与光合作用或叶绿体分化相关的基因簇中。分隔区域代码中的一种基因用于调用PTOX与IM的辅助PTOX拟南芥,我们发现,发生在该基因的大缺失在BW397中完全破坏了其功能。因此,这种PTOX编码基因被认为是一个有希望的候选者GPA1.本文提供的高分辨率遗传图谱为该基因的克隆奠定了基础,这将进一步加深我们对叶绿体生物合成的分子机制的理解。
结果
表型表征的GPA1突变体
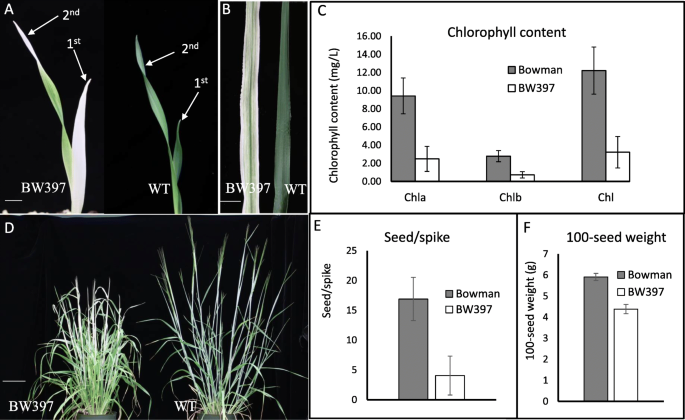
通常,幼苗GPA1第一片叶子为白化病,第二片叶子的顶端出现褪绿(图)。1一种)。然后,条纹图案随第二叶的膨胀而发展(图。1A和B)。条纹偶尔会发生在第三个和后续叶子上。与视觉差异一致,化学分析也表明BW397的条纹叶片中叶绿素A,B和总量的水平显着低于WT弓贩植物的水平(图。1C)。成人BW397植物生产白化病或条纹旗叶,尖峰,AWNS甚至花药(图。1d和附加图。1),突变体比WT短得多(图。1d).与野生型的18粒/穗相比,突变体的育性降低,平均为4粒/穗(图1)。1e).以百粒重衡量,BW397的种子大小仅为WT的3/4。1F)。除了条纹叶片表型外,GPA1突变导致大麦生长和发育的全身效应。
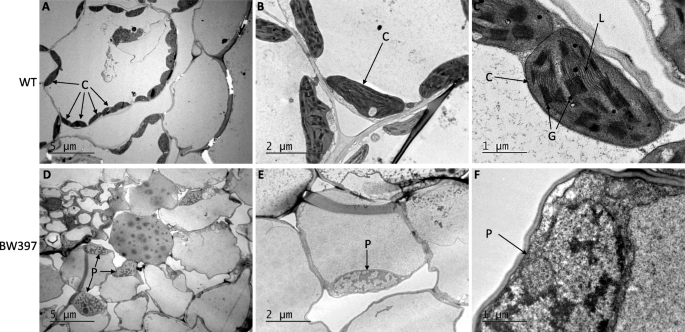
为了证实条纹表型与叶绿体生物发生缺陷有关,我们使用透射电镜(TEM)比较了Bowman和BW397的叶绿体超微结构(图。2).如预期的那样,在WT细胞中开发了许多具有良好组织的类囊体的正常叶绿体(图。2类囊体排列在基粒堆中,基粒堆之间由基质片层连接(图1)。2C)。相反,白化细胞部分中的BW397细胞含有少量未开发的体积素(图。2d)。在常规叶绿体中的骨架中的薄片,在突变体中没有很好地显得(图。2d,e和f)。在这些未分化的塑性化体积中也缺少堆叠的麦拉拉和囊体膜(图。2e和f)。因此,BW397的白色条纹中的叶绿体生物发生被废除GPA1突变。
基因映射GPA1
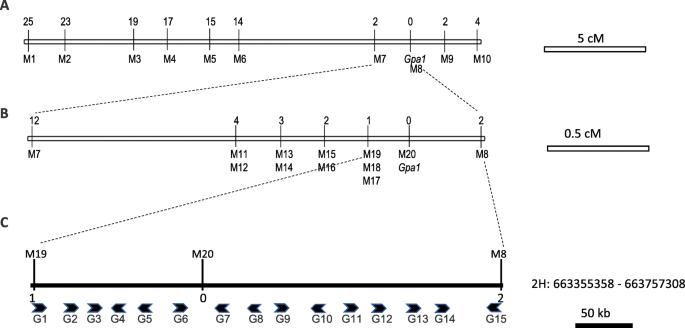
总共510个F2来自Bowman和BW397之间的交叉的植物用于遗传绘图GPA1.其中,条纹133,剩下的377 f2植物表现出正常的绿叶颜色。条纹/绿色的分离率为1:3(χ2 = 0.316, df = 1, andP= 0.57),表示GPA1突变是单术隐性。作为基因定位和标记发现的即时策略,SNP阵列分析用于Genotype 48 F.2植物(24条纹和24个绿色)与父母线一起。作为GPA1基因锚定到2h [20.),我们在2H染色体上的snp位点上鉴定了1013个多态性标记(附加表)1).
48 f的初始基因型分析2后代透露了GPA1该基因位于JHI-Hv50k-2016-139,629和JHI-Hv50k-2016-142,540位点两侧的~ 5.56 Mb区域(附加表)1).为了提高定位的分辨率,我们利用此前共定位于剥离表型的SSR标记富集了该区域[20., 2H共识图上已知snp [26.],并在该区域内指定50 k标记(表1).额外的104 f分析2用这些标记进一步对后代进行基因分型GPA1M4和M6之间的基因(图。3.a).当我们将隔离人口增加到5102植物,植物GPA1区域通过M19和M8缩小到410kb区域(图。3.b),其中一个共分离SNP M20被识别。
物理的本地化GPA1
根据参考基因组组装,在精细定位区间内鉴定出15个假定的蛋白质编码基因[27.] (桌子2).其中,三个辅导性编码酰基蛋白硫酸酶1样蛋白(HORVU.MOREX.r2.2HG0177100 / G1,HORVU.MOREX.r2.2HG0177110 / G2,HORVU.MOREX.r2.2HG0177120 / G3),分别为含EH结构域蛋白1 (horvu.morex.r2.2hg0177170 / g4)、乙烯反应转录因子(Horvu.Morex.R2.2HG0177180 / G6)、fad结合小檗碱家族蛋白(HORVU.MOOREX.R2.2HG0177170 / G7)和胆碱转运蛋白相关家族蛋白(horvu.morex.r2.2hg0177310 / g15).在与光合作用或细胞器生物发生相关的基因簇也被鉴定在其中GPA1区域,包括4个具有高相似性的蓝铜基因(HORVU.MOOREX.R2.2HG0177210 / G7,horvu.morex.r2.2hg0177220 / g9,horvu.morex.r2.2hg0177230 / g10,HORVU.MOREX.r2.2HG0177250 / G12),一种DNA拓扑异构酶基因(horvu.morex.r2.2hg0177240 / g11),以及2个与替代氧化酶同源的推测PTOXs基因(HORVU.MOREX.r2.2HG0177260 / G13和HORVU.MOREX.r2.2HG0177270 / G14).
蓝色铜蛋白质用作电子转移反应中的电子乳房,如生物氮固定,呼吸和光合作用。结构分析表明推定的蓝铜蛋白,G7,G9,G10和G12GPA1该区域包含一个识别于光系统II和I之间的远程电子载体质体色素苷的结构域[28.].替代氧化酶参与调控细胞器中电子传递链的氧化还原状态[8,9,18.].特别是,推定的编码产品G14与IM (AT4G22260)具有较高的同源性拟南芥[8,9].所以,G14被命名为HVPTOX.从今以后。为G11在意义链和反义链上分别预测了两个不同的产物,一个PPR蛋白和一个DNA旋转酶(附加图。2).DNA腺酶基因的推定内含子含有预测PRR基因的逆转互补链中的编码外显子,反之亦然(附加图。2).鉴定了推定的DNA腺苷酶的EST匹配(FD525137),但我们没有发现预测PPR的ESTS来自可用数据库。DNA乙酶或拓扑异构酶已与叶绿体生物发生期间的DNA复制和转录的调节有关[29.].虽然缺乏EST比赛,预测的PPR蛋白对SVR7高度同源,其中一个抑制器拟南芥var2突变[19.].因此,我们选择该功能相关基因簇成员进行进一步分析。
选择GPA1候选人
该区域内的四个蓝色铜蛋白共用至少75%的序列标识和编码产品国和G12.仅以一种氨基酸(aa)取代而变化。我们推测这些蓝铜蛋白可能是冗余的,一个基因的突变可能不会导致明显的表型改变。此外,AOX编码由G13是不完整的,并从进一步的分析中被排除。利用Bowman、BW397、Lyallpur及其等基因突变体GSHO 519进行了序列多态性分析G11和G14(HVPTOX.).
尽管在鲍曼和莫雷克斯等位基因之间检测到一些snpG11,Bowman,BW397,GSHO 519和Lyallpur份额相同的基因组序列,包括编码区。这表明了G11可能不是候选人之一GPA1.
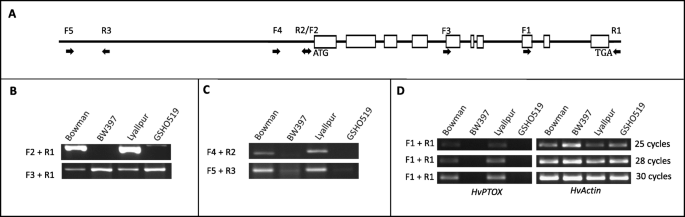
DK626738、DK619131、BF626913、RUS39D06w和HB15J15r的基因预测和EST匹配结果显示HVPTOX.含有10个编码外显子和9内含子(图。4a).在Bowman和Lyallpur中成功扩增出全长编码区,但在BW397和GSHO519突变体中未扩增出全长编码区(图)。4B,附加表2).我们在突变体中只得到了编码序列的3 '区(图1)。4B,附加表2).捕获全长HVPTOX., 我们进行了FPNI-PCR获取5 '区编码序列。产品的排序源自FPNI-PCR表示,在突变的等位基因中缺少第四个外显子的前三个和近一半。但是,近距离第四个外显子的序列HVPTOX.在BW397中不能与组装的参考基因组对齐,并且它与任何已知的蛋白质编码序列或转换元件不同源。
为了确定基因突变是由插入或缺失引起的,我们在潜在的启动子和远上游区域(起始密码子上游2.5 kB)设计了更多标记HVPTOX..我们的结果表明,这些标记在突变体中都缺失(图1)。4C)。根据缺失启动子,RT-PCR证实了这一点HVPTOX.在突变体中不表达(图。4d).与野生型25个循环表达丰度相比,在突变体中30个循环都无法检测到其表达(图)。4d)。定量实时PCR(QRT-PCR)也表明表达了GPA1在突变体中显着抑制(附加图。5).虽然删除的大小是未知的,HVPTOX.突变体的结构、表达和功能完全被破坏。因此,HVPTOX.基因(G4/horvu.morex.r2.2hg0177270)被选为强有力的候选人。的身份GPA1在同源或异源体系中仍需进一步验证。
讨论
植物叶绿体生物发生对植物的生物量和经济产量具有重要意义。斑纹突变体为理解功能叶绿体的发育提供了一个理想的模型。的等位突变体GPA.已经识别了,但他们的遗传基础差异仍然是未知的。在本研究中,我们表征了叶绿体超微结构gpa1.a突变并定位相应的位点。突变体白色条纹中缺乏叶绿素是由于叶绿体生物发生中断造成的。的GPA1基因在含有功能相关基因簇的410kb区域内界定。突变体中PTOX编码基因中的基因组缺失废除了其基因功能,表明它是一个有希望的候选者GPA1.
许多功能相关的基因在整个基因组中作为真核生物中的功能簇分布非修饰[30.].在植物中,已经确定了许多用于次生代谢的生物合成基因簇[31.].这些簇可能通过重复和新官能化从基因组中的其他地方募集基因,但不是来自原核生物的水平基因转移[32.].从进化的角度来看,功能相关基因的物理聚类可能会促进基因的协调表达,防止重组过程中共适应等位基因的破裂[32.,33.].中的集群成员GPA1区域可以针对光合作用或叶绿体发育的叶绿体。但是,它们的实际功能角色需要进一步调查。使用CRISPR技术来单独忽略聚类基因,可能会解决这个令人费解的问题。
虽然G11未必GPA1,有趣的是发现两种不同的基因来自相同的基因组片段。已经观察到真核型术术转录,并且可以将一个mRNA转化为细胞质中的几种单独的产品[34.,35.].然而,还没有关于反向互补链上存在两个独立基因的报道。prr编码基因缺乏EST匹配,提示它可能不是一个真正的基因,但这一结论需要通过cDNA末端的快速扩增(RACE)来证实。
PTOX蛋白编码G14与IN共享高度的高度拟南芥.彩色的突变即时通讯在拟南芥和同源鬼番茄中的突变体显示PTOX的损失导致叶绿体生物合成中的缺陷[9,36.].研究发现,PTOX作为末端氧化酶,在发育和成熟的类囊体中控制质体醌(PQ)池的氧化还原状态[37.,38.].PTOX参与将电子从塑料喹啉(PQH2)转移到分子氧,形成水和PQ [38.].在光合仪的氧化还原状态的调节中的作用使得PTOX对越来越多的生化途径来说至关重要,例如类胡萝卜素生物合成中的去饱和反应,氯仑倾斜,PSI循环电子流和光保护[37.,39.,40].
类胡萝卜素的生物合成受损即时通讯由于缺乏植物去饱和度(PDS)而突变体,中间植物累积在叶片的白色部分中[8,9].白色区域即时通讯由于缺乏光保护类胡萝卜素,可能会积累白光抗原子质粒[10].还证明了PQ池的氧化还原状态可以控制叶绿体生物发生作为逆行信号的有效引发剂[37.,41.].在这些场景下,预测的HVPTOX.(horvu.morex.r2.2hg0177270) 在里面GPA1该地区被指定为强有力的候选人。这一系列的GPA.近80年前均确定突变体,并良好的本地化GPA1在本研究中为功能验证提供了候选者,促进了这种长难以实现的基因的克隆。
结论
总而言之,我们已经确定了它们的特征并绘制了基因图谱gpa1.a大麦中引起杂色表型的突变。我们的结果表明,叶绿体生物发生在突变体的白色截面上有缺陷,而且GPA1突变对大麦的生长发育具有系统的影响。的GPA1基因在410kb区域内映射到染色体2h。另外,我们已经表明了GPA1在功能上与光合作用或叶绿体有关的基因簇中。进一步的研究表明,基因组缺失会破坏ptox编码基因的表达和功能,G14/horvu.morex.r2.2hg0177270.因此,本研究为克隆奠定了基础GPA1,这将提高我们对叶绿体生物发生的分子机制的理解。
方法
植物材料
F2偏离鲍曼(野生型)和BW397之间的交叉的分离人口(gpa1.a突变体)用于遗传绘图GPA1基因。的gpa1.aGSHO519携带Lyallpur的遗传背景。Bowman、BW397、GSHO519和Lyallpur的种子均来自美国农业部(USDA-ARS)国家植物种质系统(NPGS)。总共510个F2植物用于产生遗传图谱。与父母一起种植的所有植物在25°C的16小时光/ 8小时深色光纤下在温室中生长。在第1叶阶段进行表型,并在引导阶段重复。F的表型2重组分列的重组剂GPA1确认区域温度为30华氏度3.个人。
DNA提取
根据CTAB协议提取DNA [42.].在三叶阶段,我们从植物中收集了大约100毫克的叶片样本,并根据制造商的说明使用NanoDrop分光光度计(NanoDrop 8000, Thermo Fisher Scientific)进行定量。最终浓度调整到100 ng/uL用于PCR应用。
SNP基因分型和标记开发
48 F2首先用大麦50k iSelect SNP Array [43.].标记位置基于MINTX V1的大麦伪分子组件[44.].采用genome estudio (Illumina)的从头调用算法进行基因型调用。对多态snp进行聚类检测,并在必要时进行人工调整。利用连接的SNPs建立半热不对称逆转录聚合酶链反应(STARP)标记,对F2人口 [45.].根据制造商的说明,用Taq DNA聚合酶(New England Biolab)在10 μl的反应体积中进行PCR。引物元件可调节引物(豌豆引物)1和2的序列分别为5 ' -AGCTGGTT-SP9-GCAACAGGAACCAGCTATGAC-3 '和5 ' -ACTGCTCAAGAG-SP9-GACGCAAGTGAGCAGTATGAC-3 ' [45.].如前所述,热放大程序遵循触达协议[45.,46.].用Gelred™核酸染色(Milliporeigma)染色,用6%聚丙烯酰胺凝胶分析扩增子,其使用Typhoon TM FLA 9500可变模式激光扫描仪(GE Healthcare Life Sciences,Marlborough,MA)成像。本研究中使用的标记列于表中1.
物理图谱和基因预测
利用大麦cv Morex v2和Golden Promise v1的基因组序列进行标记定位和物理定位[27.,47.,48.].基因预测和注释分别与Fgenesh和PFAM 32.0的程序进行了[49.,50.].基因注释也用BLASTP计划确认。
基因表达分析
采用半定量反转录(RT)-PCR和实时定量PCR (qRT-PCR)进行基因表达分析。利用从孕穗期植株叶片中分离的RNA进行基因分析和cDNA测序。RNA提取使用NucleoSpin RNA Plant试剂盒(Macherey-Nagel, Düren, Germany)。利用M-MLV逆转录酶(Invitrogen)合成第一链cDNA。20μl的进行PCR扩增反应包含2μl cDNA(相当于50总RNA的ng),每个gene-specific底漆2μl(2.5μM), 10μl的水,0.5单元Taq DNA聚合酶(新英格兰生物学实验室),2μl核苷酸(2.5μM)和2μl 10 x标准聚合反应缓冲区(新英格兰生物学实验室)。肌动蛋白基因作为对照。PCR引物如下:HvActin、5 ' -GAGCACGGTATCGTAAGCAACTG-3 '和5 ' -CCTGTTCATAATCAAGGGCAACG-3 ';horvu.morex.r2.2hg0177270,f1:5'-ccagctccagaggtggctgt-3',r1:5'- cagcgctctagcacggaggt-3'。
使用7500个快速实时PCR系统(应用生物系统,纽约,美国,美国纽约州),用三种复制进行荧光QRT-PCR。在含有2μLcDNA的10μl反应体积的10μl反应体积中进行扩增(相当于50ng的总RNA),每个基因特异性引物(2.5μm)和5μlssbr选择主混合物(应用生物系统)。使用肌动蛋白基因作为实时分析的内部对照,并用引物5'-aactatgtcccaggtatcgc-3'和5'-gactcgtcgtactcatccttg-3'扩增。引物5'-gaaactaccagctccagaggg-3'和5'-gcgtttgacatgccttcatc-3'用于靶向GPA1基因表达。使用的扩增条件与先前描述的相同[51.].
叶绿素测量
叶绿素含量采用4个重复的分光光度法测定[52.].简单地说,收集野生型和突变株孕穗期的新鲜叶片组织0.2 g,在5ml 95%乙醇中黑暗浸泡48 h。3000rpm离心5分钟后,去除残留的植物碎片。叶绿素a和叶绿素b分别在663 nm和645 nm波长下用分光光度计(Beckman DU 7400)测定上清。
融合引物与嵌套整合PCR (FPNI-PCR)
FPNI-PCR进行染色体行走以识别未知基因组区域[53.].一级、二级、三级PCR使用的基因特异性引物分别为:GSP1, 5’-CTGCACTCAATAGGCAGGGTGT-3’;GSP2 5“-ACCGAGTCGCAACCAGCCTT-3”;和GSP3 5“-TTGCCACCCAACGCCTGACA-3”。根据Wang et al.(2011)设计了9个融合任意简并引物(FP1-9)和fp特异性引物(FSP1和FSP2)。第一轮PCR采用LA Taq (Takara Bio USA Inc., Mountain View, CA)。20 μl的反应包括10 μM FP引物和2 μM GSP1与所有其他浓度的试剂按照推荐的LA Taq协议。首轮PCR在FPNI-PCR过程包括高紧缩PCR循环(94°C 10年代,30年代62°C, 72°C 2 m,重复两次),紧随其后的是一个低紧缩PCR周期(15秒94°C, 1分钟25°C, 28°C增加0.2度/秒3分钟,和72°C 2分钟)。这种高严格度和低严格度的循环模式重复了六次。第一轮PCR通过两个高严格循环完成,94°C 10 s, 44°C 30 s, 72°C 2 min,最后72°C 5 min。PCR产物稀释至一半,作为下一轮PCR的模板。Phusion Hot Start Flex Polymerase (NEB, Ipswich, MA)用于第二轮和第三轮PCR,反应20 μl,反应中包含10 μM FSP引物,2 μM GSP引物和所有其他试剂,使用制造商的协议推荐浓度。第二轮PCR产物稀释1/40作为第三轮PCR的模板。在紫外线照射下,用1%琼脂糖凝胶溴化乙酯染色观察样品,用QIAquick gel Extraction Kit (Qiagen, Hilden, Germany)提取扩增条带并进行测序。
透射电子显微镜分析
从Bowman和BW397植株抽穗期采集的叶片样品用2.5%戊二醛固定在0.1 M磷酸钠缓冲液中,pH为7.35 (Tousimis Research Corporation, Rockville, MD),温度为4℃。样品预处理和切片制备遵循[54.].用铅柠檬酸铅染色两分钟,在JEOL JEM-100CX II电子显微镜(JEOL Inc.,Peabody,MA)上可视化铜网上的干燥部分。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。本文中的序列数据可以在数字对象标识符(DOI)中找到。https://doi.org/10.6084/m9.figshare.14153465.v1.
缩写
- GPA1:
-
爷爷1
- 即时通讯:
-
雇佣
- var2:
-
组合成2
- PTOX:
-
质吡啶末端氧化酶
- AOX:
-
替代氧化酶
- FtsH2:
-
丝状温度敏感H2
- Crr2-2:
-
Chlororespiratory减少2 - 2
- PGR5:
-
质子梯度调节5
- PPR:
-
戊庚二肽重复
- SVR:
-
variegation的抑制器
- FUG1:
-
傅Gaeri1.
- SCO1:
-
雪cotyledon 1.
- TEM:
-
透射电子显微镜法
- STARP:
-
半热不对称逆转录PCR
- FPNI-PCR:
-
融合引物和嵌套集成PCR
- FP:
-
融合任意退化底漆
- FSP:
-
FP-specific引物
- NPGS:
-
国家植物种质系统
参考
- 1.
Kretschmer M, Damoo D, Djamei A, Kronstad J.叶绿体与植物免疫:真菌效应物在哪里?病原体。2019;9(1):19。
- 2。
Serrano I,Audran C,RIVAS S.叶绿体在植物的先天免疫期间的工作。J Exp Bot。2016; 67(13):3845-54。
- 3.
Toufexi A,Duggan C,Pandey P,Savage Z,Segretin Me,Yuen LH,Gaboriau DCA,Leary Ay,Khandare V,Ward Ad等。叶绿体导航朝向病原体接口,以抵消爱尔兰马铃薯饥荒病原体的感染。生物XIV。2019; 10:1101。
- 4.
【关键词】质体逆行信号转导;植物生物学。2006;57:39 - 59。
- 5。
叶绿体和细胞核之间的信号传导:系统生物学方法能使复杂和高度调控的通路变得清晰吗?植物杂志。2010;152(2):453 - 9。
- 6。
李慧明,邱中川。蛋白质在叶绿体中的转运。植物生物学。2010;61:157-80。
- 7。
1 .于芳,付爱玲,徐勇,刘慧,刘x, Foudree A, Nambogga M, Rodermel S.叶绿体生物发生机制与突变体的形成。植物细胞环境。2007;30(3):350-65。
- 8。
Wu D, Wright DA, Wetzel C, Voytas DF, Rodermel S. TheIMMUTANSvariegation轨迹拟南芥定义在早期叶绿体生物发生过程中起作用的线粒体替代氧化酶同源物。植物细胞。1999;11(1):43-55。
- 9。
作者简介:Carol P, Stevenson D, Bisanz C, Breitenbach J, Sandmann G, Mache R, Coupland G, Kuntz m拟南芥基因IMMUTANS通过灭活与植物烯饱和相关的叶绿体末端氧化酶来引起杂色表型。植物细胞。1999;11(1):57 - 68。
- 10.
Fudree A,Putarjunan A,Kambakam S,Nolan T,FUSSELL J,Pogorelko G,Radermel S.差异中的差异机制为叶绿体生物发生提供了洞察力。前植物SCI。2012; 3:260。
- 11.
Suzuki CK, Rep M, van Dijl JM, Suda K, Grivell LA, Schatz G. atp依赖的蛋白酶也伴随蛋白生物发生。生物化学学报,1997;22(4):118-23。
- 12.
takechi k,丹麦妈妈,motoyoshi f,sakamoto w.该黄色的斑叶(VAR2)基因座编码FTSH的同源物,依赖于ATP依赖性蛋白酶拟南芥.植物生理学杂志。2000;41(12):1334-46。
- 13。
Chen M,Choi Y,Voytas Df,罗马尔S.突变拟南芥var2由于叶绿体FtsH蛋白酶缺失,导致叶片斑变。植物j . 2000; 22(4): 303 - 13所示。
- 14。
张丹,张林,藤本M, Tsutsumi N, Sodmergen SW。FtsH蛋白酶杂合物拟南芥:B型蛋白酶活性的可分配性进行适当的叶绿体发育。植物细胞。2010; 22(11):3710-25。
- 15.
KATO Y,Miura E,IDO K,IFUKU K,Sakamoto W.缺乏氯塑料Ftshs的杂色突变体在D1降解和积累反应性氧物质中有缺陷。植物理性。2009; 151(4):1790-801。
- 16。
王L,Kim C,Xu X,Piskurewicz U,Dogra V,Singh S,Mahler H,Apel K.单线酸氧和Executer1介导的信号传导在Grana边缘中引发,并取决于蛋白酶Ftsh2。Proc Natl Acad Sci U S A. 2016; 113(26):E3792-800。
- 17。
关键词:水热液,协同调控,复合形成,水热液黄色variegated1和黄色variegated2,参与照相系统II的修复周期的叶片FTSH金属蛋白酶拟南芥囊体膜。植物细胞。2003; 15(12):2843-55。
- 18。
Okegawa Y,Kobayashi Y,Shikanai T.替代电子传输途径中的生理环节,减少和氧化塑性醌拟南芥.工厂J.2010; 63(3):458-68。
- 19。
刘X,yu f,罗曼s.一个拟南芥戊庚二肽重复蛋白质,variegation7的抑制器7.,是ftsh介导的叶绿体生物发生所必需的。植物杂志。2010;154(4):1588 - 601。
- 20.
draka A, Franckowiak J, Lundqvist U, Bonar N, Alexander J, Houston K, Radovic S, Shahinnia F, Vendramin V, Morgante M, et al.;大麦形态与发育的遗传解剖。植物杂志。2011;155(2):617 - 27所示。
- 21.
Li M,Hensel G,Mascher M,Melzer M,Budhagatapalli N,Rutten T,Himmelbach A,Beier S,Korzun V,Kumlehn J等人。叶子差异与叶绿体域基因在阿尔多斯特里亚大麦中截断的CCT域基因引起的叶片杂色。植物细胞。2019; 31(7):1430-45。
- 22.
Ehrenberg L,Gustafsson A,Lundquist U.通过电离辐射和化学诱变诱导在大麦中诱导的活突变体。秘密人。1961; 47:243-82。
- 23.
Matchett Rw,Collock BM,Robertson DW。这 ”爷爷“基因:叶绿素突变大麦物种。j hered。1968年; 59:279-82。
- 24。
沉浸式Fr,亨德森山。大麦的联系研究。遗传学。1943; 28(5):419-40。
- 25。
Matchett Rw,Nass Hg,Robertson DW。大麦爷爷基因的继承与联系研究,大麦芽中华人民共和国遗传学杂志,1971;13:489-98。
- 26。
Muñoz-amatriaínM,Moscou MJ,Bhat Pr,Svensson JT,BartošJ,如此,ŠimkováH,endo Tr,Fenton Rd,Lonardi S等人。基于流量分选染色体和单核苷酸多态性标志物的大麦的改进的共识联系地图。植物基因组。2011; 4(3):238-49。
- 27。
[10] Zhang L, Zhang Q, Zhang Q, Li L, Bayer M, Bolser D, Taudien S等。大麦参考基因组序列的构建,大麦芽lSCI数据.2017; 4:170044。
- 28。
Hohner R, Pribil M, Herbstova M, Lopez LS, Kunz HH, Li M, Wood M, Svoboda V, Puthiyaveetil S, Leister D等。质体青素是植物光系统II和光系统I之间的长程电子载体。国家自然科学基金资助项目:国家自然科学基金资助项目;
- 29。
Pfalz J,Pfannschmidt T.早期叶绿体发育中的必需核蛋白。趋势植物SCI。2013; 18(4):186-94。
- 30.
Cera A,Holganza Mk,Hardan Aa,Gamarra I,Eldabagh Rs,Deschaine M,Elkamhawy S,Sisso Em,Foley JJT,Arnone JT。功能相关的基因聚类到基因组区域,在距离处坐标转录酿酒酵母酿酒酵母.msphere。2019; 4(2):E00063-19。
- 31.
Hen-Avivi S,Savin O,Racovita RC,Lee Ws,Adamski NM,Malitsky S,Almekias-Siegl E,Levy M,Vautrin S,Berges H等人。小麦中的代谢基因簇W1.和大麦Cer-cqu基因座决定-二酮生物合成和白霜。植物细胞。2016;28(6):1440 - 60。
- 32.
Nutzmann HW,Scazzocchio C,Osbourn A.真核生物中的代谢基因簇。Annu Rev Genet。2018; 52:159-83。
- 33.
Ben-Shahar Y, Nannapaneni K, Casavant TL, Scheetz TE, Welsh MJ。功能相关基因的真核操纵子样转录果蝇.国家自然科学基金资助项目:国家自然科学基金资助项目。
- 34.
真核生物中的Blumenthal t操纵子。功能基因组蛋白质组学。2004;3(3):199-211。
- 35.
Kominek J,Doing DT,Opulente Da,Shen XX,周X,Devirgilio J,Hulfachor Ab,Groenewald M,McGee Ma,Karlen SD等。真核采集细菌操纵子。细胞。2019; 176(6):1356-66 E1310。
- 36。
Josse Em,Simkin Aj,Gaffe J,Laboure Am,Kuntz M,Carol P.在染色体分化期间与类胡萝卜素的血液氧化酶相关联。植物理性。2000; 123(4):1427-36。
- 37。
Kambakam S,Bhattacharjee U,Petrich J,Rodermel S.Ptox在牙螺旋体中介导电子传输的新颖途径拟南芥.莫尔植物。2016; 9(9):1240-59。
- 38。
关键词:叶绿体,NAD(P) H脱氢酶,光系统,叶绿体拟南芥.J Biol Chem。2008; 283(50):34873-9。
- 39。
Peltier G, Cournac L.。植物生物学杂志。2002;523:523 - 50。
- 40.
Rumeau D,Peltier G,Cournac L.在光合作用和植物应激反应期间PSI周围的Chlororesprige和循环电子。植物细胞环境。2007; 30(9):1041-51。
- 41.
Pfannschmidt T, Brautigam K, Wagner R, Dietzel L, Schroter Y, Steiner S, Nykytenko A.通过氧化还原和能量状态对光合细胞基因表达的潜在调控:一种更好的理解方法。安机器人。2009;103(4):599 - 607。
- 42.
Murray Mg,Thompson WF。高分子量植物DNA的快速分离。核酸RES。1980; 8(19):4321-5。
- 43.
Bayer M, Rapazote-Flores P, Ganal M, Hedley PE, Macaulay M, Plieske J, Ramsay L, Russell J, Shaw PD, Thomas W, et al.;大麦50k iSelect SNP序列的开发与评价。植物科学与技术,2017;
- 44.
Mascher M,Gundlach H,Himmelbach A,Beier S,Twardziok所以,柳条T,Radchuk v,Dockter C,Hedley Pe,Russell J等。大麦基因组的染色体构象捕获序列。自然。2017; 544(7651):427-33。
- 45.
龙ym,潮文,ma gj,xu ss,qi ll。一种适应多个平台和吞吐量的创新的SNP基因分型方法。Al Appl Genet。2017; 130(3):597-607。
- 46.
关键词:野生二粒小麦,褐斑病,非特异性抗性,主显性基因中国生物医学工程学报,2010;
- 47.
Mascher M:Pseudomolules和Barley CV参考基因组序列组合的第二个版本的注释。morex [morex v2]。e !DAL -植物基因组学和表型学研究数据仓库(PGP), IPK Gatersleben, Seeland OT Gatersleben, Corrensstraße 3,06466,德国2019年。
- 48。
Schreiber M, Mascher M, Wright J, Padmarasu S, Himmelbach A, Heavens D, Milne L, Clavijo BJ, Stein N, Waugh R.大麦“转化参考”品种golden promise的基因组组装。G3(Bethesda).2020;10(6): 1823 - 7。
- 49。
Bateman A,Coin L,Durbin R,Finn Rd,Hollich V,Griffiths-Jones S,Khanna A,Marshall M,Moxon S,Sonnhammer El,等。PFAM蛋白质家族数据库。核酸RES。2004; 32(数据库问题):D138-41。
- 50.
Solovyev V,Salamov A.基因查找器计算机工具,用于分析人和模型生物基因组序列。Proc Int Conv Intel Syst Mol Biol。1997年; 5:294-302。
- 51.
关键词:水稻,叶片,色素沉着,遗传定位,物理定位Medicago truncatula.G3(Bethesda).2020;10(11):4159-65。
- 52.
阿诺迪。铜酶在分离的叶绿体中。多酚氧化酶Beta寻常魅力.植物杂志。1949;24(1):1 - 15。
- 53.
关键词:融合引物,巢式聚合酶链反应(FPNI-PCR),染色体快速行走或侧翼序列克隆生物科技BMC》。2011;11:109。
- 54.
Rajamohan A, Rinehart JP, Foster SP, Leopold RA。胚胎低温保存的渗透性障碍Pectinophora杀虫剂进行(鳞翅目:麦蛾科)。中国寄生虫学与寄生虫病杂志,2013;
致谢
论文作者感谢蒋晓红(Sherry)和麦迪逊·斯卡伯格的技术支持,感谢NDSU电子显微镜中心核心设施在TEM分析方面的帮助,感谢USDA-ARS NPGS提供鲍曼、BW397、Morex、Lyallpur和gsho519的种子。”
资金
本研究由美国农业部 - 农业研究服务(USDA-ARS)当前研究信息系统(CRIS)项目提供资金3060-21000-038-00D。该资助者在实验设计,数据分析或准备中没有作用。
作者信息
从属关系
贡献
SY设计了实验。SY和MO构建种群。MO和JF进行了标记检测。SY、MO、JF对数据进行分析。SY撰写了手稿的初稿,所有作者都对之前的版本进行了评论。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图1
Bowman与BW397表型比较。BW397突变体产生白色花药(A)、穗、芒和旗叶(B)。图2.基因预测G11的基因组序列。分别读取术语和反义链的PPR蛋白和DNA乙酶。外显子用矩形表示,直线用于内含子。E,外显子;我,内含子。基因结构被拉伸。图3.原凝胶图像裁剪为Fig。4c.样品排列顺序如下(从左到右):Bowman, BW397, Lyallpur, GSHO519。全长编码区(F2 + R1)如图所示。4b)和推定的启动子(F4 + R2,如图2所示。4c)在突变体中不能扩增,但用引物F3和R1成功获得3'的编码序列的一半(图。4B)所有基因型。Bowman基因与Lyallpur基因启动子(F4 + R2)之间存在长度多态性35 bp,经测序证实。起始密码子(F5和R3)上游2.5 kb的基因组区域,如图所示。4C)在突变体中也没有扩增。裁剪区域用白色虚线矩形表示。图4.图2的RT-PCR的原始凝胶图像。4d. RT-PCR分析25、28、30个PCR周期均未检测到表达HVPTOX.在突变体。Actin为内对照。样品按以下顺序排列(从左到右):Bowman,BW397,Lyallpur和Gsho519。裁剪区域用白色虚线矩形表示。图5.定量实时PCR(QRT-PCR)分析GPA1等位基因。
附加文件2:表1
SNP基因分型为31个F2s及其父母的父母系列,与大麦50K isElect SNP阵列。G-1至G-16是具有正常表型的F2,G-1至G-15是变形的F2s。称为SNP的基因型被转换为粉红色“A”,绿色“B”,黄色“H”和空白“ - ”的代码。WT Puent Bowman将粉红色的“A”基因型,“B”为突变体BW397,“H”为杂合,缺失数据为“ - ”。侧翼的SNP,JHI-HV50K-2016-139,629和JHI-HV50K-2016-142,540以黄色突出显示。表2。用于分析HVPTOX等位基因的引物。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
大麦杂色突变体的遗传分析,爷爷1.a..BMC植物BIOL.21日,134(2021)。https://doi.org/10.1186/s12870-021-02915-9
收到了:
接受:
发表:
关键字
- GPA1
- 叶绿体生物发生
- 基因映射
- 大麦