- 研究文章
- 开放获取
- 发布:
葡萄葡萄酒中BAM基因的基因组鉴定(vitis ViniferaL.)和异位表达vvbam1.调节可溶性糖水平提高番茄耐低温性
BMC植物生物学体积21, 文章编号:156.(2021.)
摘要
背景
低温(LT)是影响葡萄中生长和发展的主要限制因素之一。增加可溶性糖和清除活性氧(ROS)在葡萄抗胁迫下发挥关键作用。然而,涉及糖水平调节和抗氧化酶活性的β-淀粉酶(BAM)的机制尚不清楚。
结果
在本研究中,我们鉴定了6个BAM基因,并将其聚类为4组。多序列比对和基因结构分析表明,VvBAM6缺失Glu380残基,只包含一个外显子。转录丰度vvbam1.和vvbam3.随着温度降低而显着增加。在LT胁迫之后,vvbam1.在过表达番茄素线的叶子,叶柄,茎和根部高度表达。总淀粉酶和BAM活动增加了6.5-和在转基因植物6.01倍与那些在野生型番茄分别经受LT,植物(WT)相比较。转基因植物中的葡萄糖和蔗糖含量明显高于WT植物中的葡萄糖含量,而前者中的淀粉含量与后者在LT胁迫下的后者的淀粉含量下降1.5倍。转录组测序数据的分析显示,上调541个基因,并在转基因植物中下调663个基因。一种糖转运蛋白基因(SLSTP10),两个过氧化物酶(POD)相关基因(SlPER7和SlPER5)和一种过氧化酶(猫) - 相关基因(SlCAT1在LT胁迫下分别在转基因植物中升高8.6-,3.6-,3.0-和2.3倍。
结论
我们的结果表明VvBAM过表达通过调节淀粉水解来影响番茄植株的可溶性糖水平,从而促进活性氧清除并提高抗寒能力。
背景
植物作为固着生物,不断地暴露在各种环境压力下[1].非生物胁迫作为普遍的因素可以触发许多生理、生化和分子反应,导致植物的各种细胞过程[2,3.].冷胁迫包括冷(< 10°C)和冻结(< 0°C)温度,这是限制植物地理分布和生长的最关键的环境因素之一[4].低温(LT)可以降低生物合成活性和膜流动性,抑制生理和生化过程的正常功能,导致代谢功能障碍,并在某些情况下导致永久植物损坏或死亡[5,6].因此,提高抗寒植物是减少冷应激的不利影响,提高越冬能力,并与极端天气事件应对[的有效途径7].
活性氧(ROS)在植物受到不利的环境胁迫(如LT)后,会对细胞膜、蛋白质和核酸造成氧化损伤[8].在环境压力下,ROS稳态破裂并导致植物损伤。然而,植物已经进化了两种方法来应对过量的ROS:酶促和非酶促抗氧化系统[9].酶活性系统催化o的歧义2-进入h.2O2和过氧化氢酶减少H.2O2进一步进入H.2O, O2. 另一种非酶系统通过强还原剂清除活性氧,主要包括抗坏血酸(AsA)和谷胱甘肽(GSH)[10,11].AsA是植物在生物和非生物胁迫下增加最多的抗氧化物质。谷胱甘肽在植物的抗氧化过程中也起着重要的作用[12]并且其浓度已显示在植物中的生物和非生物胁迫下升高[13,14].
植物通过能量新陈代谢和转化来实现对不利环境的耐受性。淀粉作为主要的储能物质广泛存在于大多数植物中,以调节其生长和发展,并增加压力耐受性[15].贝塔淀粉酶(BAM)是一个典型的外水解,并且其主要功能是降解淀粉在植物[16,17].BAM属于葡萄糖水解酶14家族(GH-14)成员[18].在所有已知的BAM蛋白中发现了三个高度保守的序列区域。在N末端具有典型的糖苷水解酶结构域(PF01373),含有涉及催化机制的天冬氨酸[19].第二个域位于围绕谷氨酸的中心位置,该中心位于谷氨酸,其也参与催化机制[15].此外,β-淀粉酶 - 麦芽糖复合物的晶体结构表明,活性位点残留物Glu186和Glu380在Bam蛋白之间严格保守[20.].实验证据表明,β-淀粉酶是淀粉分解过程中麦芽糖的主要来源,产生麦芽糖[17].BAM的缺乏可能降低植物中淀粉的能力,特别是在黑暗中,表明淀粉水解在植物的适应中起重要作用,以适应不利的环境[21].淀粉降解依赖于BAM活性A. Thaliana.和其他生物[22].Kaphlan等人[23]报道,BAM1占叶肉细胞BAM总活性的90%以上A. Thaliana..李等人[24)表明,AtBMY7(At3g23920)在高温诱导下编码一种含有叶绿体过境肽的蛋白质A. Thaliana.. 这种蛋白质可以对热休克作出反应。Thalmann等人[25发现,通过协同作用,淀粉被迅速调动atmam1.和AtAMY3促进气孔打开。一般来说,AtBAM1在黑暗中催化淀粉降解。然而,AtBAM1也可以在植物受到胁迫的白天催化淀粉降解[25].
基因表达和蛋白质活性由光诱导[26],lt [27,干旱和盐[28,29和渗透压力[30.]. BAM转录本的表达和活性在温度胁迫期间被诱导,麦芽糖含量的增加与BAM转录本和活性相关[31,32].梦露等人。[22]报道BAM3在夜间和冷胁迫下参与叶肉细胞中叶片淀粉的降解。PtrBAM1 (α-和β-淀粉酶编码基因枳壳trifoliata)过表达增加了烟草叶片中BAM的活性,促进了麦芽糖和可溶性糖在冷胁迫下的积累[33]. 张等[34]发现LT可以诱导马铃薯块茎中StBAM7和StBAM9的高转录,而在其他组织中则没有。Prasch等人[29],表明AtBAM1调控保卫细胞中淀粉的降解,并影响气孔的开放A. Thaliana.经受干旱胁迫;然而,受损淀粉击穿bam1突变植株伴随着气孔开度减少。此外,bam1突变体在脯氨酸积累中受损,并且患有比WT植物更强的脂质过氧化[30.].
小道消息(vitis ViniferaL.)是一种广泛种植的果实作物,具有高经济价值。然而,其LT敏感性的生物学特性限制了培养和发展。山葡萄是一种极其耐寒的葡萄树种,可承受到40°C [35].因此,它用作分离靶基因以用于引入各种作物植物中的耐寒性的源。西红柿源于热带和亚热带地区。它们对LT敏感,因此它们用作研究与LT相关的功能基因的良好模型植物。在这项工作中,响应响应基因(vvbam1.)克隆并在番茄植株中过表达。vvbam1.番茄中过度表达提供了针对冷应激的明显耐受性。
结果
不同植物BAM蛋白的进化分析
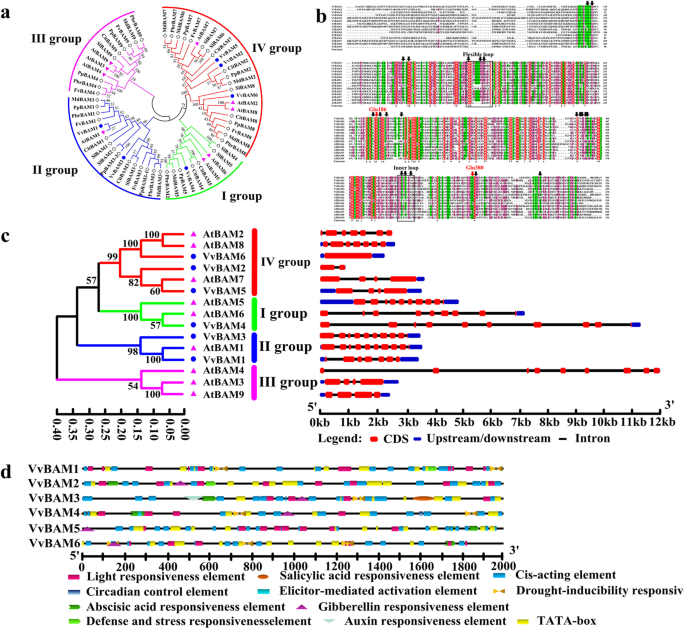
六个BAM基因(vvbam1.- - - - - -6从葡萄基因数据库中检索(表1).系统发生树构建以分析62 BAM氨基从葡萄,苹果,柑橘,梨,桃,草莓酸序列的进化关系,和番茄(图1A,补充表S2).通过参考BAM基因的演变将这些基因分成I,II,III和IV基团II,III和IV。A. Thaliana..vvbam4.属于第一组vvbam1.和vvbam3.被聚集到II组,vvbam2.,vvbam5., 和vvbam6.聚类到IV组,未发现葡萄BAM基因成员聚类到III组。利用15个基序模块对8个物种的BAM基因家族进行了图谱分析。葡萄BAM的6个基因成员有15个基序模块。S1).BAM基因家族分布在四种染色体上(表1).vvbam1.和vvbam4.分别位于第5和第12染色体;vvbam2.和vvbam5.在第15染色体上发现;vvbam3.和vvbam6.在第二染色体上检测到。氨基酸的数量范围为543(VVBAM3)至699(VVBAM5)。这些蛋白质的分子量为6.05(VVBAM3)和7.88(VVBAM5)Kd。预测的等电点(PI)为5.25-5.86(表1).葡萄树的糖苷水解酶的保守蛋白质序列与那些A. Thaliana.AtBAM酶(图。1b)。葡萄的多序列比对和A. Thaliana.BAM氨基酸序列显示,Glu186在两个物种中高度保守,而Glu380在VvBAM6序列中缺失。基因结构表明vvbam3.和VvBAM4分别含有10个外显子和9个内含子(图。1c)。vvbam2.,vvbam3., 和vvbam4.没有5 '非翻译区(UTR),但是vvbam1.,vvbam5., 和vvbam6.有5'和3'UTR。基因序列atmam4.是最长的,其次是的vvbam4..基因序列vvbam2.是最短的。这些基因的启动子序列由数量不等的光、防御和激素反应元件组成,如赤霉素、脱落酸、水杨酸和生长素(图。1d)。
表达概况VvBAM葡萄韧皮部不同生长时期的基因
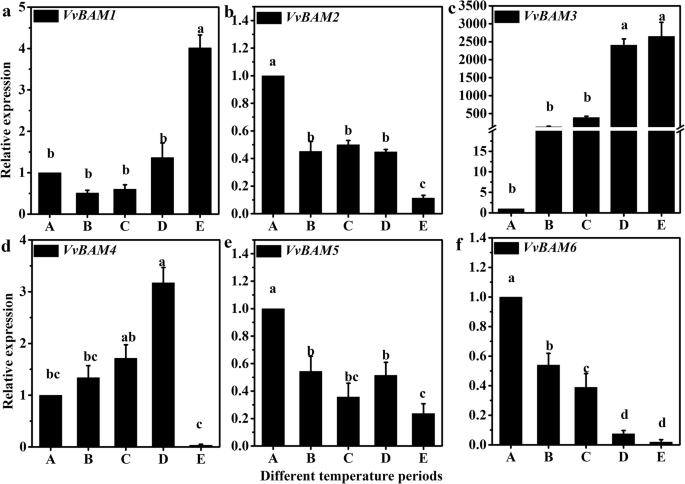
实时荧光定量聚合酶链反应(qRT-PCR)结果表明,6种基因型均具有特异性VvBAM在LT休眠期间基因具有不同的表达模式。相对表达vvbam1.随着温度降低而增加,特别是在E期内(图。2一种)。相对表达vvbam3.随着温度从A到E期的温度降低也显着增加(图。2c)。然而,vvbam2.,vvbam5., 和vvbam6.随着温度的降低,它们的表达显著下调(图。2b, e,和f)vvbam4.从A到D期增加,但在E期显著减少(图4)。2d).这些结果可以为确定VvBAM的功能提供坚实的基础.
的差异表达谱vvbam1.在LT的转基因番茄植物的不同组织中
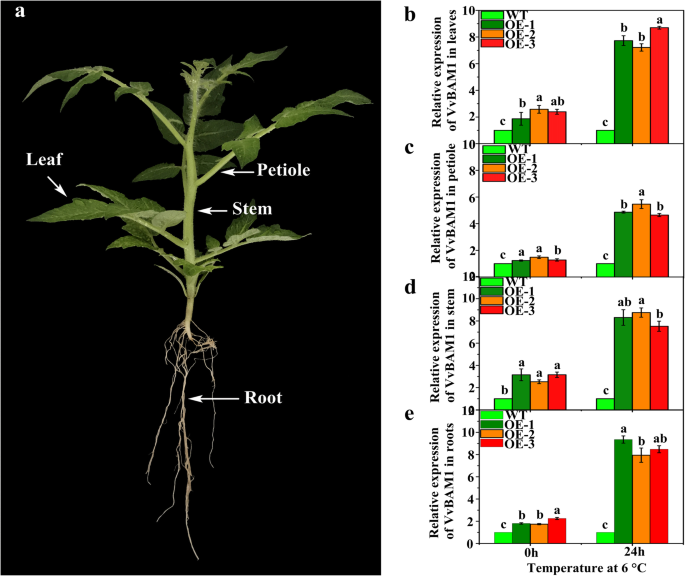
相对表达水平vvbam1.在不同组织器官中的WT和转基因植物中显着差异。在不压力条件下,表达vvbam1.在转基因植物中的叶片显着高于WT植物叶中的叶片(图。3.).在6°C下持续24小时,相对表达水平vvbam1.在转基因植物饲料中显着上调7.7-,7.2-和8.7倍,并且在0小时的WT植物叶中显着高(图。3.b)。表达水平vvbam1.转基因植物叶柄在无应力和应力条件下的WT植物叶柄中显着较高(图。3.c).的相对表达vvbam1.在转基因植物中,在没有应力和LT应力下的WT植物中的茎基本上高于WT植物茎(图。3.d).的表达趋势vvbam1.与叶、叶柄和茎的变化趋势一致。3.e)。
LT条件下转基因番茄植物的表型和染色分析
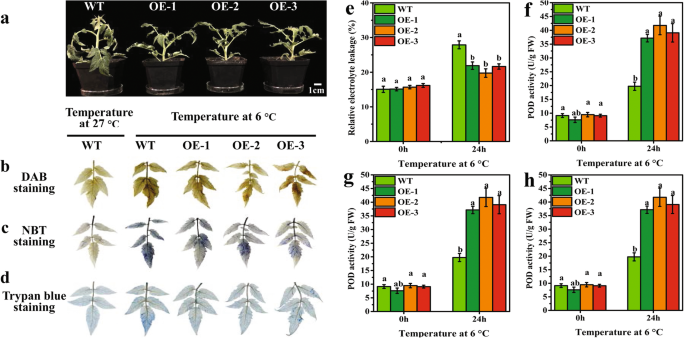
WT植物的高度和根长度显着高于转基因植物(补充图。S3.a、b和S4).在6℃下对WT和转基因植物进行梯度温度适应和应力72小时,以及相对电解质泄漏和vvbam1.选择表达水平来确定胁迫24 h的参数(添加Figs。S5,S6a,c)。结果表明,在LT胁迫下,转基因植物的叶片的衰弱程度小于LT胁迫24小时后的WT植物的程度(图。4一种)。DAB,NBT和台盼蓝染色进行检测H.2O2积累,O.2-在叶分别积累和细胞损伤的水平。H.2O227℃时积累不明显 WT番茄叶片中的摄氏度(图。4b)。After LT stress at 6 °C for 24 h, the leaves of three transgenic plants turned brown, but the color was slightly lighter than the WT leaves. The O2-结果表明,WT植株叶片在LT胁迫后染色面积明显,而转基因植株叶片在LT胁迫后染色面积不明显。4c)。台盼蓝染色显示,转基因番茄植物的染色面积比LT胁迫下的WT植物的染色面积轻,而在正常生长条件下的WT植物的染色面积比LT胁迫下方的染色面积轻(图。4d)。这些结果表明,转基因番茄植物叶片具有较低的ROS含量。
异位的影响vvbam1.番茄植物中抗氧化酶活性的表达LT胁迫下的抗氧化酶活性
WT和转基因番茄植株的叶片染色显示,H2O2(图。4b)和o2-(图。4c)中LT应力后不同。因此,相对电解质泄漏,POD,SOD和在WT和转基因植物的叶子CAT进行测定,以评价抗氧化酶活性。的相对电解质泄漏表明以下LT应力WT和转基因植物均高于正常生长条件下要高得多;然而,转基因植物在比WT(图的显着降低。4e)。通常,植物经受环境应激时的ROS积累,植物的抗氧化系统有助于抵消氧化应激产生的ROS [36].因此,测定了POD、SOD和CAT活性。结果表明,正常生长条件下,WT与转基因植株的POD活性无显著差异;而转基因植株在6℃低温胁迫24 h后,其含量分别增加了1.88-、2.11-和1.98倍(图2)。4f).正常生长条件下,WT和转基因植株的SOD活性差异不显著,但在LT胁迫24 h后,SOD活性显著升高。其在转基因植株中的活性显著高于在WT植株中的活性(图。4G)。猫活性的趋势与LT胁迫后的豆荚和SOD活性的趋势一致(图。4h) 。与野生型相比,低温胁迫后转基因植株的CAT活性显著增加约1.16倍。这些数据表明vvbam1.过表达可显著促进O2-和H.2O2通过抗氧化酶清除。
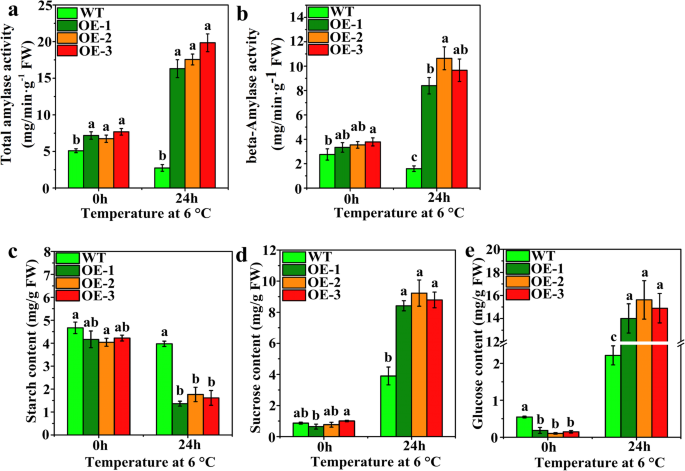
低温胁迫下转基因番茄淀粉酶活性和可溶性糖含量的差异
在正常和低温胁迫条件下,测定了WT和转基因植物中总淀粉酶和β-淀粉酶的活性(图。5a和b)。在正常条件下和LT胁迫后,转基因植株的总淀粉酶活性显著高于野生型植株(图。5一种)。另外,在LT胁迫之后抑制WT植物的总淀粉酶活性,但转基因植物的总淀粉酶活性显着升高(图。5a).在正常条件下,转基因植株的β-淀粉酶活性显著高于野生型植株(图2)。5b). LT胁迫24 h后,WT植株的β-淀粉酶活性降低,而转基因植株的β-淀粉酶活性显著升高。在正常和逆境条件下测定了野生型和转基因植株的淀粉、蔗糖和葡萄糖含量。5c -6e)。淀粉含量在正常条件下WT和转基因植物(OE-1和OE-3)没有显着差异(图。5c). LT胁迫24 h后,转基因植株和野生型植株的淀粉含量均有所下降,但转基因植株的淀粉含量降幅比野生型植株更显著。低温胁迫后,蔗糖含量显著增加(图2)。5d)。在正常条件下,其含量在WT和转基因植物之间没有显着差异,但在LT胁迫后,WT植物和三种转基因植物之间观察到相当大的差异。转基因植物的蔗糖含量高于WT植物的蔗糖含量。葡萄糖含量在LT应力后显着增加(图。5e)。在正常生长条件下,WT和转基因植物之间的葡萄糖含量显着不同。在LT胁迫24小时后,转基因植物的葡萄糖含量显着高于WT植物的葡萄糖含量,即增加6.7倍。这些结果表明,可溶性糖含量和淀粉酶活性的变化趋势一致。
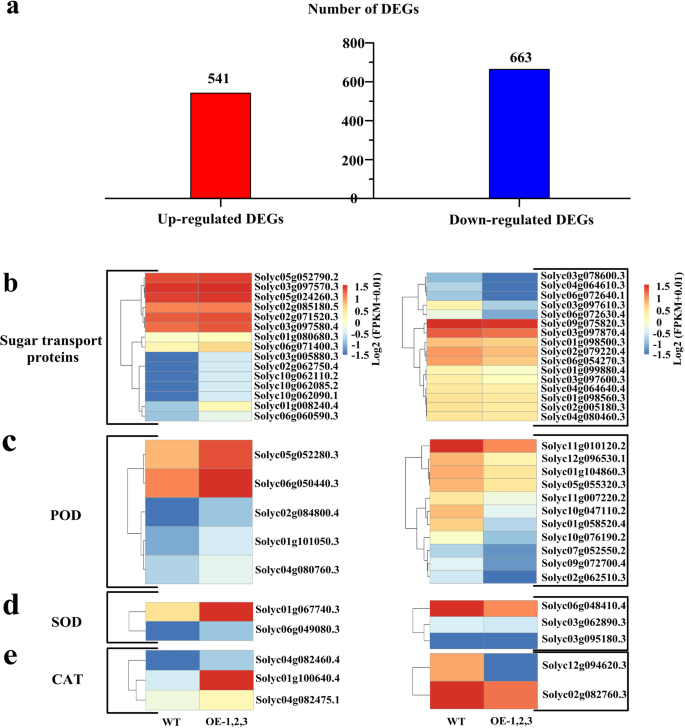
转基因番茄植物中糖转运蛋白和抗氧化酶基因差异表达的RNA测序谱分析
通过LT处理在WT和转基因植物中鉴定了总共1204℃(541个上调基因和663个下调基因)(图。6a).糖转运蛋白中有15个上调的DEGs和16个下调的DEGs(图2)。6b,补充表S4).两种糖转运蛋白基因SolyC06G071400.3(slsweet4.)和Solyc01g008240.4 (SLSTP10)在转基因植株中表达量分别上调2.9倍和18.6倍。Solyc06g0726304.1 (SlSWEET11)和solyc03g097610.3(SlSWEET10)在转基因植株中分别下调23.5倍和34.8倍。POD蛋白中5个表达上调,11个表达下调SlPER7)和Solyc01g101050.3(SlPER5)分别上调3.6倍和3.0倍;Solyc01g104860.3 (SlPER4)及Solyc11g010120.2 (SlPER1在LT胁迫后转基因植物中的这些基因中的2.1-和2.4倍下调(图。6c)。二(Solyc01G067740.3和Solyc06G049080.3)上调和三(SolyC03G062890.3,SolyC03G095180.3,SOLYC06G048410.3)在SOD中发现了下调的次数(图。6d)。该猫蛋白包括三个上调的次数和两个下调的次数,溶液01G100640.4(SlCAT1)上调2.3倍(图。6e)。这些结果表明,糖转运蛋白的相关基因,以及POD,SOD和CAT蛋白上调/下调响应LT应力转基因番茄植株。
讨论
进化BAM葡萄藤的基因
Bam蛋白调节淀粉降解以促进植物应激反应。岳等。[15]报道BAM基因属于多尾家族。例如,4,9,13和9BAM基因在大米,大麦,香蕉和A. Thaliana.分别为(23,37,38,39].在本研究中,6个基因编码BAM(vvbam1.- - - - - -6)从葡萄基因组数据库中获得。将这些Bam蛋白分为四个家族(图。1a).的系统发育树A. Thaliana.在桃、番茄、苹果、柑橘、草莓和梨中,BAM蛋白在高等植物中具有进化保守性。BAM属于GH-14蛋白,具有保守的核心糖苷水解酶结构域。通过x射线晶体学分析大豆GmBAM1和甘薯StBAM1,结果表明BAM具有底物结合口袋和活性位点[40,41.].底物结合伴随着一个内环和一个柔性外环的运动,催化是由一对保守的葡萄糖残基介导的[17].与九个atmam蛋白的多序列对齐A. Thaliana.揭示了VVBAM6肽缺乏GLU380氨基酸催化残基(图。1b),vvbam6.在不同温度周期下,葡萄植株的表达量呈向下调节的趋势(图2)。2F)。这一结果与卡普兰等人先前报道的意见是一致的。[21的表达趋势atmam7.在低温胁迫下vvbam6.和atmam7.聚集成系统发生中的IV族(图。1a和c)。基因结构表明vvbam2.,vvbam3., 和vvbam4.没有包含5′可能是因为葡萄基因组数据库的不完整性(图。1c) 。有趣的是,vvbam2.,vvbam5.,vvbam6., 和atmam7.在IV组中聚集,并且在LT应激后下调这些基因(图。1a和c)。这些基因在植物对LT胁迫的反应中可能具有类似的生化功能[21].转录起始位点上游2 k BP序列的所有情况VvBAM基因分析,确定lt相关元件。结果表明vvbam1.- - - - - -6含有光响应元件和启动子vvbam1.有两个干旱响应元件和一个防御和胁迫响应元件(图。1d)[34,42.].这些元素可能导致了对低温胁迫的VvBAM1反应。
vvbam1.过度表达通过促进ROS扫除来改善番茄植物的耐受性
非生物胁迫,例如干旱,盐度和温和,通常在植物光合组织中产生大量的ROS [8].ROS累积可以改变光合作用的机制,导致光抑制[43.].氧化应激过程中ROS的主要下游靶是核酸,蛋白质和脂质[44.].细胞膜被认为是主要的目标,其稳定性和完整性是在非生物胁迫条件下生长的植物的主要关注[45.];然而,大多数处于不利环境中的植物都容易发生细胞膜损伤[46.].植物已经进化出各种各样的机制,如清除ROS的抗氧化酶,以及一些还原物质解毒有害ROS [47.,48.].此外,糖可以作为渗透调节剂参与ROS清除。Shen等人。[49.]提出内源糖含量的增加不仅通过调节细胞渗透势来提高植物的耐冷性,而且还通过清除ROS等其他途径增强植物的耐冷性。BAM1蛋白通过硫氧还蛋白介导的还原被激活[50.],这一机制与通过电子载体铁氧还蛋白的光合电子传递链驱动基质氧化还原电位的变化有关[17,51.].因此,BAM1蛋白可以帮助清除叶绿体中多余的ROS。在本研究中,在LT胁迫下,转基因植株叶片上的DAB和NBT染色较WT植株叶片上的轻。结果表明,H2O2和o.2-转基因植株的积累水平低于野生型植株。这一现象有助于在低温胁迫下保护光合电子传递链[23].我们的结果还表明,异位表达VvBAM1显著提高了转基因植物的抗氧化酶(POD, SOD和CAT)活性(图2)。4f、 g和h),而ROS(h2O2和o.2-)含量和电解质泄漏在LT应力下减小(图。5B,C和D)。这些结果与Guy和Kaplan的结果一致[23].此外,在LT应力下的转基因番茄植物中升高了抗氧化酶的相关基因(图。6c、d、e)。这些结果表明,转基因番茄植株在LT胁迫下由于vvbam1调节抗氧化酶相关基因的表达而清除了ROS。
vvbam1.通过改变淀粉酶活性和调节糖水平提高LT耐受性
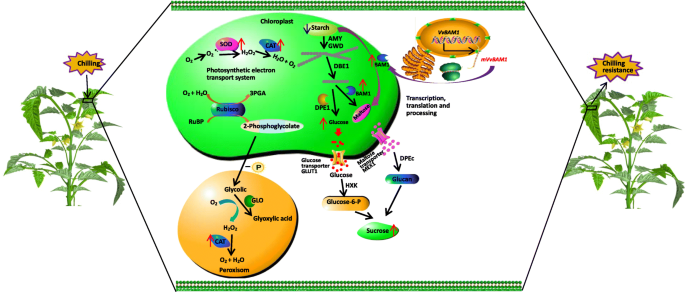
大多数植物在天然生长条件下遇到不同的生物和非生物重叠或连续的压力。然而,压力触发植物适应不合适的环境并重现[52.].碳水化合物新陈代谢在植物代谢中发挥着重要作用,为植物的生长和发展提供能量[53.].光合作用是将太阳辐射能中的无机碳转化为有机碳的基本生物过程[54.].因此,光合作用已成为保证植物在逆境环境中生存的主要能量来源。光合作用固定的碳有很大一部分以淀粉的形式储存在叶绿体中,然后在夜间被降解。BAMs参与分解叶淀粉[17].淀粉由Bams水解以形成可溶性糖,这是在高等植物的生命周期期间的关键Osmoreculation物质。LT可以诱导BAM转录和活性,并且该结果与可溶性糖含量的增加有关[23].另一个有助于提高低温胁迫耐受能力的方面是碳分配,这涉及糖代谢和能量生产[52.].在寒冷的压力下,冷却致玉米植物的叶子具有比冷冻敏感玉米植物的叶子更少的淀粉和更高的蔗糖 - 淀粉比[27].含有大量蔗糖在寒冷的胁迫下的耐冷耐热植物的叶子可以保持膜完整性[55.].我们的结果表明,在LT胁迫下,转基因番茄植物的叶片中含量大大降低了淀粉,葡萄糖和蔗糖含量增加,并且转基因植物略微枯萎(图。4A,E,5c, d, e)。这些结果表明vvbam1.过度表达可以增强转基因番茄植物的抗寒性。Storm等人。[56.表明BAM3酶活性在低温胁迫下降低A. Thaliana.BAM1酶活性基本不受影响。进一步的研究表明,BAM3在冷胁迫下由于过量的淀粉积累而受到翻译后修饰的抑制。彭等人[33]建议Ptrbam1.烟草过表达增加了冷应力下的BAM活性和可溶性糖积聚。在本作过程中,总淀粉酶和β-淀粉酶活性显着更高vvbam1.-过表达的转基因植株在LT胁迫后比野生型植株中表达的要多(图5a和b)。组织特异性表达显示vvbam1.转基因植株中的蛋白质含量明显高于野生型植株。因此,淀粉转化为可溶性糖,这不仅为组织提供能量,还参与LT胁迫下的渗透调节(图。3.) (33,57.].
糖跨膜转运在很大程度上依赖于糖转运蛋白,糖转运蛋白通过被动(但选择性)扩散或依赖能量的主动转运进行催化[25,58.].在叶片中,淀粉水解从葡聚糖 - 水直立通酶(GWD)的氨基甲素葡萄糖残留物的一小部分葡萄糖残留的磷酸化。17,59.].在LT胁迫下,vvbam1.在细胞核中迅速转录,从而导致BAM1蛋白的快速从头合成和淀粉酶活性的增加(图)。7).淀粉可以直接通过Bam直接降解或用α-淀粉酶(amy)和GWD协同产生麦芽糖。在塑性化酶1的酶促反应下产生直链淀粉;葡萄糖和麦芽糖通过葡萄糖转运蛋白1和麦芽糖出口1输送到细胞质中;部分转化的蔗糖用于渗透应激调节(图。7) [23,25,60.].转录组测序显示糖转运蛋白基因slsweet4.和SLSTP10在低温胁迫下,转基因番茄植株中表达量分别上调了2.9倍和18.6倍。6b).这一结果与Nørholm等人的结果一致[61.,认为AtSTP10可以增加胞质中糖的含量A. Thaliana..这些发现表明BAM1基因在调节淀粉降解和提高对低温胁迫的耐受性方面发挥了重要作用。
结论
总之,我们的结果提示异位过表达vvbam1.能促进淀粉水解,提高细胞质中蔗糖和葡萄糖含量,显著增强抗氧化酶对ROS的清除作用,降低活性氧对膜脂的过氧化作用,保护细胞膜的完整性。BAMs在植物应对非生物胁迫方面具有重要的研究意义,从而有助于进一步阐明淀粉酶在提高植物抗低温胁迫中的作用。
方法
植物材料及生长条件
在这个实验中,一岁的葡萄藤(山葡萄Rupr。var。对不同发展阶段的'Zuoshan 1')进行QRT-PCR分析以确定BAM基因家族的表达。葡萄园位于甘肃农业大学(103.69°E,36.09°N)。根据最低温度变化和植物休眠过程,我们设定了五个采样阶段,如下所示:生长期被定义为(日本月20日,每日极端温度为18°C至33°C);早期冷硬化时段定义为B(10月17日,5℃至17°C);中间冷硬化时段定义为C(10月28日,0°C至7°C);晚冷硬化时段定义为D(11月22日, - 5℃至1°C),深层休眠期被定义为E(1月12日, - 10°C至1°C)。然后,我们收集了葡萄树枝的韧皮孔,其中用液氮冷冻,并在-80℃下保留,用于RNA提取和BAM基因的分析。番茄种子(Solanum lycopersicum简历。“微汤姆”)从南京丰硕Horiculture有限公司,公司(南京,江苏,中国)购买并用于vvbam1.转换的实验。转T0将代移栽到营养土壤(蛭石与培养土壤比例为1:3)中生长,采集种子。将转基因番茄植株的种子收获,自然干燥,验证为转基因材料。将转基因阳性番茄植株用于后续的LT胁迫试验。将WT番茄种子播种在基本培养基中,T1生成转基因番茄植物在含潮霉素(50mg / L)的培养基中播种至进一步的筛选转基因植物。T.1收集潮霉素抗性的世代种子,生产T2生成转基因材料。进行了相同的方法以产生t3.生成转基因植物。wt和t3.在27℃下在黑暗中发芽的种子3d,然后在单个培养土盆中培养(蛭石和培养土的比例为1:3),在生长室中,条件设定如下:27°C / 20°C(16 h / 8h,光/暗)光强度为280μmol/ m2·秒−1,相对湿度为70-80%。六周大的WT和T3.将转基因植物在6℃下进行LT应力。通过逐渐降低温度获得最终应力温度,温度梯度设定为27℃至14℃,每1小时降低2℃,从14℃,每次降低1°C1小时(补充图。S5).收集叶片、叶柄、茎和根,分析转基因番茄植株在6℃下24 h的组织特异性表达和转录组测序。所有试验和3个生物重复均利用6周龄番茄植株的叶片。
VvBAM基因家族生物信息学分析
我们获得了9的加入号码拟南芥蒂利亚纳BAM基因参考Fulton等人的研究[17]并从数据下载他们的全长编码序列(CD)(https://www.arabidopsis.org/).然后,得到9个BAM基因序列A. Thaliana.与葡萄基因组数据库(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)并获得BAM基因家族的葡萄。苹果的Bam蛋白序列(M. Domestica.), 橙色的 (cit.sinensis.), 梨 (P. Bretschneideri.), 桃 (P. Persica)、草莓(f . vesca)和番茄(Solanum lycopersicum从植物血红素v12.1中检索(https://phytozome.jgi.doe.gov/pz/portal.html)并且用于在Clustalx v.2.0中生成多个序列对齐,默认设置。BAM蛋白的一个大型系统发育树拟南芥蒂利亚纳葡萄,苹果,柑橘,梨,桃子,草莓和番茄是使用Mega 6.0软件的最大可能性(ml)方法构建,默认设置,自序对准和基因结构(外显子和内含子)分析拟南芥蒂利亚纳利用DNAMAN 6.0软件和gdsv .2.0 (http://gsds.cbi.pku.edu.cn/)与参数的默认设置。独联体-作用元件(基因起始密码子前2 k bp)使用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/website.)用于预测并使用TBTools软件绘制。使用expasy预测葡萄BAM蛋白的分子量和等电点(PI)(http://web.expasy.org/protparam./)。
RNA分离和QRT-PCR分析
根据协议,使用OMEGA植物RNA试剂盒(OMEGA Norcorss,GA,USA)提取葡萄枝的总RNA。RNA样本(1 μg)用于使用PrimeScript合成的第一链cDNA™ IV第1链cDNA合成混合试剂盒(日本TaKaRa),符合制造商的说明。使用TB Green®预混料Ex Taq进行qPCR™ II(TaKaRa,日本)并根据制造商的说明。反应体积(20 μl)由1个 μl cDNA(100 纳克/微升),10 μl TB Green®预混剂Ex Taq™ 二、 二, μl基因特异性引物(1 正向和反向引物各μl),7 微升无核酸酶水。qPCR计划的初始步骤为1 95分钟 摄氏度,然后是40 在95时循环 摄氏10度 s、 五十五 摄氏度,持续30秒和72秒 摄氏20度 s使用Light Cycler®96实时PCR系统(瑞士罗氏)。补充表中列出了底漆S1用于QPCR。葡萄的参考基因是vvgapdh.(NCBI登录号NO。973647)和每个样品的数据与使用2的参考基因进行计算−ΔΔCT方法[62.].
基因克隆及质粒构建
的ORFvvbam1.(基因加入编号。XM_002285533,1734 BP)使用葡萄cDNA作为模板进行扩增。前底漆GacaccCatGGTAGCTATATGAGTATCACCATC;反向底漆gacacggtcacctcagtgcataagagcaacagcag。PCR扩增如下:在95℃下5分钟;在94℃下循环30秒,58℃,30s,72℃,90秒;最终延长在72°C 5分钟。通过1%琼脂糖凝胶电泳检测PCR产物,然后将用于DNA测序的PGEM-T易于载体(Promega,Madison,Wi,USA)相关(补充图。S2a).的编码序列vvbam1.被克隆到了NCO我和BSTE.二元载体PCAMBIA1301的II限制性位点,在花椰菜马赛克病毒的启动子后面35个年代(补充图。S3.公元前)。将重组质粒转化为根癌土壤杆菌菌株GV3101,并通过PCR和测序分析证实其存在。
转基因番茄的产生与鉴定
'Micro Tom'番茄植物通过农杆菌属- 根据Dan等人描述的方法所介绍的叶片变换。和hou等人。[63.,64.].简要介绍,7D番茄体外植物(来自种子萌发)生长在基础培养基上(1/2 ms + 20g / L蔗糖+ 6.5g / l琼脂,pH 5.8-6.0),收集植物子叶,并取出叶子提示和叶柄。将子叶切成垂直静脉的两种外植体,并在预培养基中展开它们(1/2 ms + 20g / L蔗糖+ 6.5g / l琼脂+ 1.0mg / l kinetin,pH 5.8-6.0)以生长2 d在气候室(28°C / 20℃,16h / 8h Photopheriod,Light / Dark)。一个殖民地农杆菌属GV3101和重组质粒在LB培养基中生长(含50μg/ml) 毫克/升利福平,50 庆大霉素mg/l和50 mg/l卡那霉素)在28℃过夜 °C摇动,直到培养密度达到OD6000.5-0.6。然后,液体介质农杆菌属以5000g离心以收集细菌。的农杆菌属用100mM丙酮酮酮悬浮,用100mM丙酮酮液染色6000.5-0.6。将预先培养的外植体转移到悬浮液中,并在室温下避逸5分钟。将外植体的印迹在灭菌的滤纸上干燥,以除去过量的细菌悬浮液,然后转移至预先培养的共培养,将板在28℃下保持暗。After 2 d, the explants were transferred to differentiation medium (MS + 20 g/l sucrose + 6.5 g/l agar + 2.0 mg/l zeatin + 30 mg/l hygromycin + 300 mg/l timetin). The explants were transferred to fresh differentiation medium every 15 d. When the explants started to differentiate, the differentiated buds were excised, and transferred to rooting medium (MS + 20 g/l sucrose + 6.5 g/l agar + 0.1 mg/l auxin + 15 mg/l hygromycin + 250 mg/l timentin). After rooting, the seedlings are transplanted into pots containing the substrate (ratio of vermiculite and culture soil is 1:3) (Fig.S2D-I)。使用CTAB(十六烷基三甲基铵)方法从叶中提取基因组DNA,并用VVBAM1的克隆引物鉴定转基因番茄植物(补充图。S2j).引物由Sangon Biotech (Shanghai, China)合成,PCR序列列于Supplementary TableS1.
LT中转基因番茄植物的生理化学分析
WT和T的叶3.在6℃下进行LT LT胁迫24小时的番茄植物与硝基唑鎓(NBT),3,3'-二氨基苯甲酸(DAB)染色,以及锥虫蓝,评价O的积累2-,及2O2,细胞损伤如Feng等[65.]和ma等人。[66.].Briefly, the treated leaves were immersed in 10 mM potassium phosphate buffer with 0.1% NBT (pH 7.8) and vacuum infiltrated for 5 min, and then the leaves were for 2 h at room temperature. After these steps, the leaves were boiled with NBT solution for 2 min. The tomato’s leaves were immersed in aqueous solution with 1 mg/ml DAB (pH 7.0), and then incubated for 8 h at room temperature in the dark, then boiling water bath for 5 min. The after staining leaves of tomato plants were decolorized with absolute ethanol for 2 h. The decolorizing solution (ethanol: lactic acid: glycerin, 3: 1: 1) was used to decolorize the leaves after dyeing with NBT and DAB until no longer contained chlorophyll. The tomato leaves from treatment were boiling trypan blue solution for 5 min, and then using the 2.5 g/ml chloral hydrate decolorizing for 2 h. Leaves of WT and T3.在6°C胁迫下,分别在0、3、6、12、24、48和72 h收获转基因植株,进行电解液泄漏检测。根据Ma等的方法测量电解质泄漏[66.].简而言之,WT和T在六周大时,有三片完全张开的叶子3.将转基因植物切成圆盘形状(直径1cm),并浸入30ml玻璃管中的15ml双蒸馏水中,摇动24小时。初始电导率(c1用型号DDS-307A器件(上海莱西利仪器)测量)。然后,煮沸带叶片形状的管,并确定导电性(C2).计算相对电解质泄漏量为C1到C.2.根据制造商的说明,使用商业化学品系测定套件(江苏州生物技术研究所)确定总淀粉酶和BAM活性,豆荚,SOD,猫,淀粉,葡萄糖和蔗糖含量。生物化学指示剂检测的叶片样品重量为0.2g。在所有实验中分析了三种独立的生物重复。
不同的组织表达水平vvbam1.在LT胁迫下的转基因植物中
该基因的组织特异性表达说明了潜在的植物关系,因为某种基因的表达及其在不同器官中的功能可以被观察到。因此,选取6周龄的WT和3株转基因植株的叶、叶柄、茎、根进行表达水平分析vvbam1.在正常生长和低温胁迫下(6°C)。采集叶片、叶柄、茎、根样品,液氮冷冻,−80℃保存。RNA提取,cDNA合成,如上所述。所有qRT-PCR引物均采用Primer3 Input (http://primer3.ut.ee/),并计算每个样本的内参基因相关数据SlActin(NCBI登录号NM_001330119)。
RNA-SEQ图书馆制备和测序
过度表达的影响vvbam1.在使用转录分布分析与LT胁迫相关的基因的表达。如上所述进行转基因番茄植物的RNA提取和cDNA合成。WT和T的转录组测序3.生物标记技术有限公司(北京,中国)委托研究了在6°C胁迫下24 h的番茄叶片。RNA质量和浓度分别通过纳米光度计(德国Implen)和Agilent 2100 BioAnalyzer(美国Agilent Technologies)琼脂糖凝胶电泳检测。用AMPure XP beads筛选了约250 ~ 300 bp的cDNA。PCR扩增产物用AMPure XP beads重新纯化,得到文库。使用Qubit 2.0荧光仪(Invitrogen公司,美国)进行初步定量。将文库稀释至1.5 ng/μl,使用Agilent 2100 BioAnalyzer检测文库的插入大小。然后进行Novaseq6000平台测序。所有实验均采用三个独立的生物学重复进行。通过假发现率(FDR) < 0.05和|Log鉴定差异表达基因(DEGs)2FC(折叠变化)| ≥ 2 as thresholds screening. After sequencing, a total of 38.17 Gb of clean reads by removing sequencing adapters and low-quality reads, more than 92% reads had a quality score of Q30 (sequencing error rate, 0.1%). The sequencing data results are listed in Table S3 (Supplementary TableS3.).
统计分析
呈现所有实验数据是指±标准偏差(SD)。通过单向ANOVA进行统计分析。通过Duncan的测试使用SPSS 22.0软件(SPSS Inc.,Chicago,USA)评估了重要不同,这些测试由小写表示(P< 0.05)。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在补充信息文件中。
RNA测序数据已沉积NCBI(https://submit.ncbi.nlm.nih.gov/subs/sra/)在Bioproject prjna703431下。
缩写
- BAM:
-
β-淀粉酶
- WT:
-
野生型植物
- 荚:
-
过氧化物酶
- 草皮:
-
超氧化物歧化酶
- 猫:
-
过氧化氢酶
- 轻拍:
-
3,3'-二氨基苯甲酸
- 电视台:
-
Nitroblue Tetrazolium.
- 度:
-
差异表达基因
- ROS:
-
反应性氧气
- 艾米:
-
α淀粉酶
- 七月。:
-
7月
- 10月。
-
十月
- 十一月:
-
11月
- 1月:
-
1月
- NCBI:
-
国家生物技术信息中心
- PCR:
-
聚合酶链反应
- QRT-PCR:
-
定量实时聚合酶链反应
- FDR:
-
假发现率
- 舰队指挥官:
-
折叠变化
- H:
-
小时
- CAMV35S:
-
Cobacco Cauliflower马赛克病毒
- GWD:
-
Glucan-water dikinase
参考
- 1.
杨X,徐H,Li D,Gao X,Li T,王R.褪黑素灌注对低温胁迫下番茄叶片光合产能的影响。Speckynthetica。2018; 56:884-92。
- 2.
王志强,王志强,王志强,等。植物抗热胁迫的分子机制和生理机制研究进展。中华医学杂志。2013;14:9643-84。
- 3.
李建军,李建军,李建军,等。植物对脱落酸和非生物胁迫的耐受性。植物学报2016;7:571。
- 4。
周明,沈超,吴磊,唐凯,林建军。植物低温胁迫下cbf依赖信号通路的研究。《生物技术》2011;31:186-92。
- 5。
徐伟,李瑞,张恩,马福,焦毅,王梓。基因转录组分析山葡萄,一种极其耐寒的中国野生vitis.物种,揭示了可能与冷压力有关的候选基因和事件。中国农业科学(英文版)。
- 6。
Barrero-Gil J,Huertas R,Rambla JL,Granell A,Salinas J.番茄植物在冷却适应过程中提高了对综合转录和代谢调整的降低的适应过程中的耐受性。植物细胞环境。2016; 39:2303-18。
- 7。
马Y,戴X,徐Y,罗W,郑X,曾D.冷1所赋予冷水稻的耐受性。细胞。2015; 160:1209至21年。
- 8.
植物活性氧(ROS)在胁迫反应中的调控:从AtRBOHD中学习。植物细胞代表2016;35:995-1007。
- 9.
任R,李Z,江X,刘Y。活性氧相关的程序性细胞死亡导致牡丹花粉低温保存后活力下降。植物细胞代表2020;39:941–52.
- 10.
Caverzan A,Passaia G,Rosa SB,Ribeiro CW,Lazzarotto F,Margis-Pinheiro M.植物反应对抗:抗坏血酸过氧化物酶在抗氧化剂保护中的作用。Genet mol Biol。2012; 35(4个):1011-9。
- 11.
Katharina K,Vaseghi MJ,Dreyer A,Dietz KJ。谷胱甘肽和抗坏血酸在调节逆行高光反应方面的意义拟南芥蒂利亚纳叶子。杂志。2018;162:262 - 73。
- 12.
Noctor G,Reichheld JP,Foyer Ch。ROS相关的氧化还原调节和植物信号传导。Semin Cell Dev Biol。2018; 80:3-12。
- 13.
程敏,高凯,常伟林,郭伟文,陈光华,林tp。谷胱甘肽的增加有助于拟南芥的耐受性和全球翻译变化。植物j . 2015; 83:926-39。
- 14.
Hasanuzzaman M,Nahar K,Anee Ti,富士塔M.植物谷胱甘肽:生物合成和在环境压力耐受性中的生理作用。physiolmol biol植物。2017; 23:249-68。
- 15.
Yue C,Cao H,Lin H,Hu J,Ye Y,LiJ.α-淀粉酶和β-淀粉酶基因的表达模式提供了茶叶响应依赖的分子机制的见解(山茶花Sinensis.)压力和采后加工治疗。Planta。2019; 250:281-98。
- 16。
Monroe JD,Breault JS,Pope Le,Torres Ce,Gebrejesus TB,Berndsen CE。拟南芥β-淀粉酶2是k+-需要的,具有s型动力学的催化四聚体。植物杂志。2017;175:1525-35。
- 17。
富尔顿特区、斯特勒M、梅特勒T、沃恩CK、李杰、弗朗西斯科P。β-淀粉酶4是淀粉分解所需的非催化蛋白质,在拟南芥叶绿体中作用于三种活性β-淀粉酶的上游。植物细胞。2008;20:1040–58.
- 18.
Lombard V,Ramulu Hg,Drula E,Coutinho PM,Henrissat B. 2013年碳水化合物活性酶数据库(聊天)。核酸Res。2014; 42:D490-5。
- 19.
鲁伊,夏基TD。麦芽淀粉酶在光合细胞胞浆麦芽糖代谢中的作用。车前草。2004;218:466–73.
- 20。
康YN,安达男,内海S,Glu186和Glu380的大豆β淀粉酶的催化反应B.三上的作用。J Mol Biol。2004; 339:1129-40。
- 21。
Kaplan F,Guy C.淀粉酶诱导和麦芽糖在温度休克期间的保护作用。裤子physiol。2004; 135:1674-84。
- 22。
β-淀粉酶1和β-淀粉酶3是拟南芥中具有可塑性的淀粉水解酶,可以适应不同的温度、pH和胁迫条件。植物杂志。2014;166:1748 - 63。
- 23。
卡普兰女,拟南芥β-amylase8防止盖C. RNA干扰麦芽糖积累时的PSII光化学效率冷休克和增加灵敏度冻结应力。植物杂志2005; 44:730-43。
- 24。
李杰,弗朗西斯科P,周伟,埃德纳C,斯特普M,格哈德R。拟南芥叶片中淀粉分解所需的无催化活性β-淀粉酶BAM4是一种淀粉结合蛋白。Arch Biochem Biophys。2009;489:92–8.
- 25。
Thalmann M,Pazmino D,Seung D,恐怖D,Nigro A,Meier T.通过脱落酸的叶淀粉降解的调节对于植物中的渗透胁迫耐受性是重要的。植物细胞。2016; 28:1860-78。
- 26。
一个新的推测β-淀粉酶基因和at - β-amy拟南芥蒂利亚纳是生理的监管。植物科学。2001;161:1019-24。
- 27.
Garzon CD,Lequart-Pillon M,Rautengarten C,等。两种玉米姐妹线中碳代谢的调节对比冷却耐受性。J Exp Bot。2019; 71:356-69。
- 28.
张刚,吴飞。干旱和盐胁迫下西藏野生大麦和栽培大麦籽粒超微结构、淀粉酶、蛋白质和氨基酸谱的差异。食品化学。2013;141:2743-50。
- 29.
β-淀粉酶1突变体的拟南芥植株表现出更好的抗旱性,这是由于保卫细胞中淀粉分解的减少。J Exp Bot. 2015; 66:6059-67。
- 30.
Zanella M,Borghi G,Piroone C,Thalmann M,Pazmino D,CostaA.β-淀粉酶1(BAM1)降解了干旱胁迫期间持续过量淀粉以维持脯氨酸生物合成。J Exp Bot。2016; 67:1819-26。
- 31。
岳超,曹辉,王玲,周莹,黄颖,郝霞。冷驯化对茶树糖代谢及糖相关基因表达的影响。中国农业科学(英文版)。
- 32。
钱W,小B,王磊,郝X,粤C,曹H. CsINV5,茶液泡转化酶基因提高了转基因拟南芥抗寒性。BMC植物BIOL。2018; 18:228。
- 33.
彭T,朱X,段,刘杰。Ptrbam1,β-淀粉酶编码基因枳壳trifoliata,是一个CBF调节成员,通过调节可溶性糖的水平,具有耐寒功能。植物学报。2014;37:2754-67。
- 34.
张华,侯军,刘军,谢超,宋斌。马铃薯冷藏和发芽过程中淀粉降解的淀粉酶分析。马铃薯> 2014;57:47-58。
- 35.
万永忠,Schwaninger HR,李丹,Simon CJ,王永军,何培生。中国野生葡萄种质资源的生态地理分布。葡萄。2008; 47:77 - 80。
- 36.
戴维斯乔丹。氧化环境和蛋白质损伤。生物物理学报。2005;1703:93-109。
- 37.
Koide T,Ohnishi Y,Horinouchi S.重组β-淀粉酶的表征水稻sativ.BIOSCI生物技术生物化学。2011; 75:793-6。
- 38.
张Q,Li C.拷贝数,基因组结构和α-淀粉酶基因的拷贝数,基因组结构和保守基序的比较。前植物SCI。2017; 8:1727。
- 39。
Jourda C,Cardi C,Gibert O,Giraldo Toro A,Ricci J,Mbéguié-Ambéguiéd,Yahiaoui N.谱系特异性进化历史和在熟面期间的主要淀粉代谢基因的调节。前植物SCI。2016; 7:1778。
- 40。
三上B,Degano男,Hehre EJ,Sacchettini JC。大豆β淀粉酶的晶体结构反应与β-麦芽糖和maltal:活性位点组分和催化其表观作用。生物化学。1994; 33:7779-87。
- 41。
郑志刚,严硕,张灿,申德德,徐淑仪。甘薯四聚体β-淀粉酶的结晶、分子置换溶液和提纯。蛋白质。1995;21:105-17。
- 42。
Li N,Wei S,Chen J,Yang F,Kong L,Chen C. Osasr2通过靶向GT-1顺式元素来调节防御相关基因OS2H16的表达。植物Biotechnol J. 2018; 16:771-83。
- 43。
Gururani男,卡塔斯Ĵ,陈LSP。非生物胁迫光抑制光合作用过程中的调控。莫尔植物。2015; 8:1304年至一三二○年。
- 44。
Ron M. ROS很好。植物学报。2017;22:11-9。
- 45。
Trentmann O,MühlhausT,吉玛d,索默楼Schroda男,与冷驯化至关重要的叶绿体包膜蛋白的Haferkamp一鉴定。植物理性。2020; 182:1239至1255年。
- 46。
Czarnockaa W,Stanislaw K.朋友或敌人?对环境应力的植物反应中的活性氧物种生产,清除和信号传导。自由Radic Biol Med。2018; 122:4-20。
- 47。
Das P,Nutan K,Singla-Pareek SL,Pareep A.植物中的氧化环境和氧化还原稳态:解剖主要细胞细胞器的显着贡献。前环境SCI。2015; 2:1-11。
- 48。
黄志军,仁敦豪,Thu NBA, Thao NP, Tran LP。非生物胁迫下植物转录因子及其在信号转导中的作用。咕咕叫基因组学。2017;18:483 - 97。
- 49。
沈斌,杨志强,王志强。通过将甘露醇生物合成靶向于叶绿体,提高转基因植物对氧化应激的抗性。植物杂志。1997;113:1177 - 83。
- 50
Laederach A, Dowd MK, Coutinho MC, Reilly PJ。麦芽糖、2-脱氧麦芽糖和麦芽糖自动对接到大豆β -淀粉酶活性位点。蛋白质。1999;37:166 - 75。
- 51
氧化还原法规:一个广阔的视野。《植物学报》2005;56:187-220。
- 52
朱茹非生物应激信号和植物反应。细胞。2016; 167:313-24。
- 53
剑兵Z,小燕Q,小燕H,盛轩C,Zhilan Y,光C,Guoping Z.根和叶片代谢物分析揭示了大麦低钾胁迫的适应性策略。BMC植物BIOL。2018; 18(1):187。
- 54。
Kasper H, Tage D, michael KS, Stiig M, Ronnie NG。北极峡湾(西格陵兰)的浮游植物生产力:估计碳固定和氧气生产的电子需求。《公共科学图书馆•综合》。2015;10 (7):e0133275。
- 55。
Tarkowski LP, Wim VDE。可溶性糖引发的耐寒性:一个多方面的对策。植物科学学报2015;6:203。
- 56。
风暴AR,科勒MR,Berndsen CE,梦露JD。谷胱甘肽抑制拟南芥β淀粉酶3的催化活性,但不是旁系同源物的β淀粉酶1.生物化学。2018; 57:711-21。
- 57.
李志刚,李志刚,李志刚。拟南芥糖耗散过程中基因同步上调的研究进展。植物学报2010;27:337-45。
- 58.
SJ斯托尔Woolston的CM,张Y,马丁SG。氧化还原环境,自由基,和氧化性DNA损伤。抗氧化氧化还原信号。2013; 18:2399-408。
- 59.
Kaplan F,Sung Dy,Guy C.β-淀粉酶的角色和淀粉粒度在温度胁迫期间。physiol植物。2006; 126:120-8。
- 60.
Eggert E,Obata T,Gerstenberger A,Gier K,Brandt T,Fernie A.蔗糖转运蛋白相互作用蛋白二硫化物异构酶影响氧化还原稳态,并将蔗糖分配与非生物胁迫耐受性联系起来。植物细胞环境。2016; 39:1366-80。
- 61.
Nørholm MHH, nouri - eldin HH, Brodersen P, Mundy J, Halkiera BA。拟南芥高亲和力己糖转运体STP13的表达与程序性细胞死亡相关。2月。2006;580:2381-7。
- 62.
利用实时定量技术分析相关基因表达数据——ΔΔCT方法。方法。2001;25:402-8。
- 63.
董杰,张颖,张勇,阿姆斯壮。微汤姆:用于功能基因组学的高通量模型转换系统。植物细胞代表2006;25:432-41。
- 64。
侯友,孟克,韩伊,班Qy,王b,苏杰克。柿子9-脂氧合酶基因DKLOX3在促进衰老和增强对非生物胁迫的耐受性中起阳性作用。前植物SCI。2015; 6:1073。
- 65。
冯HL,MA NN,Meng X,张S,王JR,柴S.一种新型番茄Myc型ICE1样转录因子,Slice1a,赋予转基因烟草中的冷,渗透和耐盐性。植物理性生物化学。2013; 73:309-20。
- 66。
马晓霞,陈超,杨敏,董晓霞,吕伟,孟Q.低温调节蛋白(SlCOR413IM1)对番茄抗寒性的影响。植物生理生化学报2018;124:29-39。
确认
我们感谢谢建明教授(中国甘肃农业大学)提供的根扫描仪,感谢魏霞霞、李玉梅教授为淀粉、葡萄糖和蔗糖分析提供的辅助。
资金
这项工作得到了甘肃农业大学纪律建设基金项目(GSau-XKJS-2018-226)和甘肃省科技重大项目(18ZD2NA006)。筹资组织为这项研究支付了实验费和出版费用,但在研究设计中没有发挥作用,也没有在收集分析和解释数据中,也没有在书面上写作。
作者信息
隶属关系
贡献
JM和BHC构思并设计了实验。GPL和GJN进行了实验,观察了植物的生长。GPL进行了qRT-PCR和部分数据分析。ZHM, QZ, YY参与了工厂材料的准备和部分数据分析。所有作者阅读并批准了手稿。
通讯作者
道德声明
伦理批准和同意参与
植物材料(山葡萄Rupr。var。本研究中使用的'Zuoshan 1')来自甘肃农业大学的葡萄园(兰州730070,中国; 103.69°E,36.09°N)。所有植物材料都是免费提供的。从南京丰朔豪华购买的微汤番茄种子,公司(江苏南京)。实验室实验是在逻辑立法和权限下进行的。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:补充表S1。
qRT-PCR的引物用于表达上的分析VvBAM基因。
补充文件2:补充表S2。
信息的信息BAM基因用于构建进化系统树图。1一种。
附加文件3:补充表S3。
基于从每个样品在24小时应力后的每个样品获得的RNA序列数据概述。
附加文件4:补充表S4。
热图中deg的标注信息。
附加文件5:补充图S1
图中BAM基因基序分析。1一种。
附加文件6:补充图。S2。
的vvbam1.克隆和番茄转化。一个电泳分析vvbam1.基因片段PCR扩增。红框表示放大vvbam1.产品。M代表DNA制造者阶梯(d5000bp)。b重组载体pCAMBIA1301-的电泳分析vvbam1.经双酶切证实甲我和BSTE II.E为酶解重组载体。M代表DNA制造者阶梯(DL 10kbp)。cvvbam1.已插入到甲我和BSTE.II PCAMBIA1301向量的网站。d- - - - - -我番茄外植体的生长与分化。j通过PCR单独鉴定所得的转基因植物。红色盒子表明转基因番茄植物的筛选结果。M代表DNA制造商梯(DL 2000 BP)。P代表积极控制。WT代表负面控制。OE-1 - OE-4支架四种转基因番茄植物。
附加文件7:补充图S3。
6周龄野生型和转基因番茄植株。一个6周龄野生型和转基因植物的表型。b6周龄野生型和转基因番茄植株的根系生长。
附加文件8:补充图S4
分析了六周龄WT和转基因番茄植物的植物高度。
附加文件9:补充图S5。
低温应力过程中温度的变化。变化趋势:从28°C每1h降低2°C至14°C,随后从14°C每1h降低1°C至6°C,确定并分析在6°C LT胁迫下72 h的最佳样品采集时间点。红色的部分是最终的采样时间间隔。
附加文件10:补充图S6。
电解液相对泄漏量的分析及计算公式vvbam1.在WT和转基因植物中的不同应力时间点下。一个不同胁迫时间点下番茄叶片的相对电解质渗漏。b相对表达水平vvbam1.番茄叶片在不同的胁迫时间点下。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
梁,G.,他,H.,Nai,G。et al。葡萄葡萄酒中BAM基因的基因组鉴定(vitis ViniferaL.)和异位表达vvbam1.调节可溶性糖水平提高番茄的耐低温性。BMC植物BIOL.21,156(2021)。https://doi.org/10.1186/s12870-021-02916-8
已收到:
接受:
发表:
关键字
- 小道消息
- VvBAM
- 低温
- 转录
- 中存在
- 番茄