摘要
背景
众所周知,大麦不易组织培养,这阻碍了基因转化及其生物技术应用。到目前为止,转化的理想外植体仍然局限于未成熟的胚胎;胚胎愈伤组织形成的机制尚不清楚。
结果
本研究旨在通过转录组测序揭示不成熟胚(IME)和成熟胚(ME)愈伤组织之间不同的转录调控途径。我们发现,胚胎在富含生长素的培养基中培养,在48小时内引起基因表达谱的戏剧性变化。总的来说,IME和ME系统中分别发现9330和11318个差异表达基因(DEGs)。发现有3880个DEGs对IME_0h/IME_48h有特异性,蛋白质磷酸化、转录调控和氧化还原过程是该组最常见的基因本体论类别。23国际宇航科学院, 十四东盟地区论坛, 八阿富汗二月, 三雅和四个销在愈伤组织形成过程中发现了基因的差异表达。愈伤组织诱导培养基(CIM)对愈伤组织生长的影响国际宇航科学院这表明生长素反应参与了愈伤组织形成过程中细胞重编程的调控。BBM.那LEC1,PLT2在IME系统中表达水平显著升高,但在ME系统中未被激活。本人在IME系统中比在ME系统中表现出更显著的增长趋势,表明这些胚胎、芽和根分生组织基因在决定能力获得方面起着至关重要的作用。此外,表观遗传调控因子,包括suvh3a.那SUVH2A,HDA19B / 703表明表观遗传重编程可能参与了该过程中基因表达的激活/抑制。此外,我们还检测了异位表达的影响HVBM和HvWUS在农杆菌属介导的大麦转换。表示的群中的转换效率PLTPPRO:HVBBM.+Axig1pro: HvWUS由于植株再生能力的增强,构建量比对照(空载体)增加了3倍。
结论
我们发现了一些可能导致两种外植体对愈伤组织诱导反应差异的调控因素,并为提高大麦转化效率提供了一个有前景的策略。
背景
基因转化已成为功能基因组研究的重要工具,是作物育种的一项重要技术。单子叶植物的转化通常依赖于离体组织培养。然而,许多作物品种难以再生,这是植物转化的主要瓶颈。因此,阐明植物再生的分子基础对植物生物技术的发展具有重要意义。
典型的农杆菌属-介导的转化通常始于在富含生长素的愈伤组织诱导培养基(CIM)上培养的外植体诱导多能细胞(称为“愈伤组织”)。最近的研究表明,cim诱导的愈伤组织形成是通过根分生组织相关途径进行的[1,显示了根分生组织调控基因的有组织的空间表达,如WUSCHEL-RELATED HOMEOBOX5 (WOX5)及短根(SHR.)[1那2].作为侧根发育,植物蛋白导致吲哚酸14(IAA14)的降解,并随后激活生长素响应因子7(ARF7)和ARF19 [3.];然后,AFR7和ARF19直接增强LATERAL ORGAN BOUNDARIES DOMAIN (LBD)蛋白的表达,如LBD16、LBD17、LBD18和LBD29 [4.那5.].反过来,LBD蛋白激活促进细胞增殖和改性细胞壁性质的套件表达[6.那7.那8.].此外,植物蛋白通过两种不同的途径促进细胞多能性获取,由WOX11和LBD16介导的一种,另一个涉及杯形子叶2(CUC2)和血清蛋白(PLTS)[9.那10].因为大多数研究人员只使用拟南芥对于这一过程,尚不清楚不同物种是否采用相同的愈伤组织起始机制。我们之前的研究表明,水稻根外植体诱导愈伤组织的策略不同拟南芥[11].然而,当胚胎被用作外植体时,是否涉及同样的途径仍是未知的。
大麦(大麦芽玉米(L.)是全球第四大谷物作物,被广泛种植作为动物饲料、酿造麦芽和葡萄酒。第一个成功的报告农杆菌属-介导的大麦转化利用未成熟胚胎作为外植体[12].虽然已经研究了用于大麦转化系统的替代目标组织,但未成熟胚胎仍然是实现高转化效率的最佳选择[13那14那15那16].此外,大麦的转化高度依赖于基因型。最敏感的基因型是春季品种金希望,迄今为止只有少数大麦品种成功转化[17].通过遗传作图研究了黄金承诺中潜在的可转化基因[18].黄金承诺中的三个转变-顺应性位点(TFA1那TFA2那TFA3)和突变体1460的一个位点(TRA1)被发现负责农杆菌属-介导的大麦转化[19那20.].然而,决定外植体选择和转化效率的关键因素仍然是未知的。
本研究的目的是通过转录组测序,为不成熟胚(IME)和成熟胚(ME)愈伤组织之间不同的转录调控途径提供新的认识。本文概述了生长素诱导大麦愈伤组织形成的早期分子机制,并提出了丰富外植体选择范围和提高转化效率的策略。
结果
大麦成熟胚和未成熟胚愈伤组织形态的研究
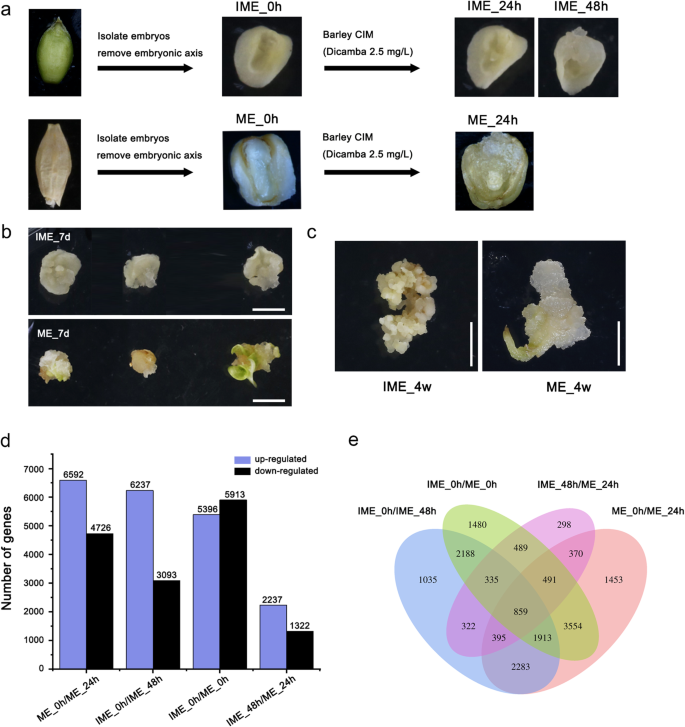
由于大麦愈伤组织的诱导和转化效率具有基因型依赖性,本研究选择具有较高愈伤组织形成能力的模型大麦品种Golden Promise,对其愈伤组织形成机制进行研究。以花后14天左右的未成熟胚和去除胚轴的成熟胚为外植体,在含有2.5 mg/L生长素(dicamba,一种合成生长素)的CIM上诱导愈伤组织。在CIM中培养24 h后,成熟的种子片上可以看到光滑的、水状的愈伤组织,并有一定程度的正常再生(可见枝条)。在ime诱导系统中,48h后从盾片周围区域出现黄色易碎愈伤组织(图)。1a).几乎所有的未成熟胚在培养7天后都产生了愈伤组织,并保持了较快的增殖速度(图2)。1b)。经过四周的文化,几乎所有未成熟的胚胎,但只有几个成熟的胚胎,已经开发了calli;与由未固化胚胎形成的致密和粒状愈伤组织相比,由成熟胚胎形成的少数愈伤组织是水的(图。1c)。
由未成熟(IME)和成熟(ME)胚胎形成的愈伤组织的特征。A:RNA-seq分析的样本采集示意图。将成熟种子表面绝育,未成熟种子(花后14天)去除胚轴,分离胚,在愈伤组织诱导培养基上培养。RNA-seq分别在3个时间点(未成熟胚愈伤组织IME_0h、IME_24h和IME_48h)和2个时间点(成熟胚愈伤组织ME_0h和ME_24h)采集。B:金promise大麦培养7 d后盾片诱导愈伤组织形成。酒吧= 500μm。C:金promise大麦黄芩诱导4周愈伤组织形成。酒吧= 500毫米。D:在胚源性愈伤组织形成和两种愈伤组织诱导系统之间,DEGs的数量增加或减少。E:Venn图显示两个样品之间的重叠和特定的egs
成熟和不成熟胚愈伤组织中表达的DEGs的整体分析
为了获得在CIM上愈伤组织形成过程中mRNA表达谱的概述,我们使用5个样品构建cDNA文库,每个样品有3个生物重复。IME_0h、IME_24h和IME_48h三种样品分别在不同时间点从ime愈伤组织中分离得到。另外两个样品分别在ME_0h和ME_24h从me衍生的愈伤组织中提取(图2)。1a).使用主流的Unique Molecular Identifier (UMI)标记技术进行转录组绝对定量测序;通过对每个序列进行UMI标记,消除了PCR扩增偏好对定量的干扰,真实反映了样品中转录本的表达丰度。获得了总计114 Gb的原始数据,其中包含7.59亿对端读取。在去除适配器序列和低质量的读取后,大约有7.4亿个干净的读取保留下来。超过99.92%和97.40%的clean reads的质量分数分别为Q20和Q30(附加文件1:表S1)。超过90.82%的配对端reads被定位到大麦参考基因组中,平均为69.15%的ungenes(见表)1).
为了比较不同阶段的基因表达谱,首先将读值归一化到FPKM值。然后对它们进行通常的相关系数(R2)和层次聚类分析。所有样品的3个生物重复的转录本丰度测定结果与系数(R2)大于0.87,表明测序数据具有良好的重复性(附加文件1:图S1)。进一步分析显示,125,095个转录本(74.98%)的长度在1000 - 5000 bp之间,8021个基因(55.21%)的长度在1000 - 5000 bp之间1:表S2)。
这一标准(|日志2Fold change|≥1 andP.值≤0.05)筛选差异表达基因(DEGs)(附加文件2).由于未成熟胚在CIM上48h后开始形成愈伤组织,而成熟胚在24h后开始形成愈伤组织,因此我们选择IME_0h、IME_48h、ME_0h和ME_24h进行进一步研究。通过两两比较,将本研究中确定的DEGs分为四组。DEGs数量最多的是ME_0h/IME_0h组,其中上调基因5396个,下调基因5913个。两种外植体在愈伤组织形成过程中都观察到显著的基因表达变化(图。1d).维恩图显示,4个对照组(IME_0h/48 h、ME_0h/24 h、IME_0h/ME_0h、IME_48h/ME_24h)均检测到859个DEGs。除了在两个比较组(IME_0h/48 h, ME_0h/24 h)中有5450个deg重叠外,在IME-和me -基础的诱导系统中分别有3880和5868个deg重叠。共1480个DEGs仅在诱导前成熟和不成熟胚胎的初始阶段(IME_0h/ME_0h)检测到(图)。1e)。
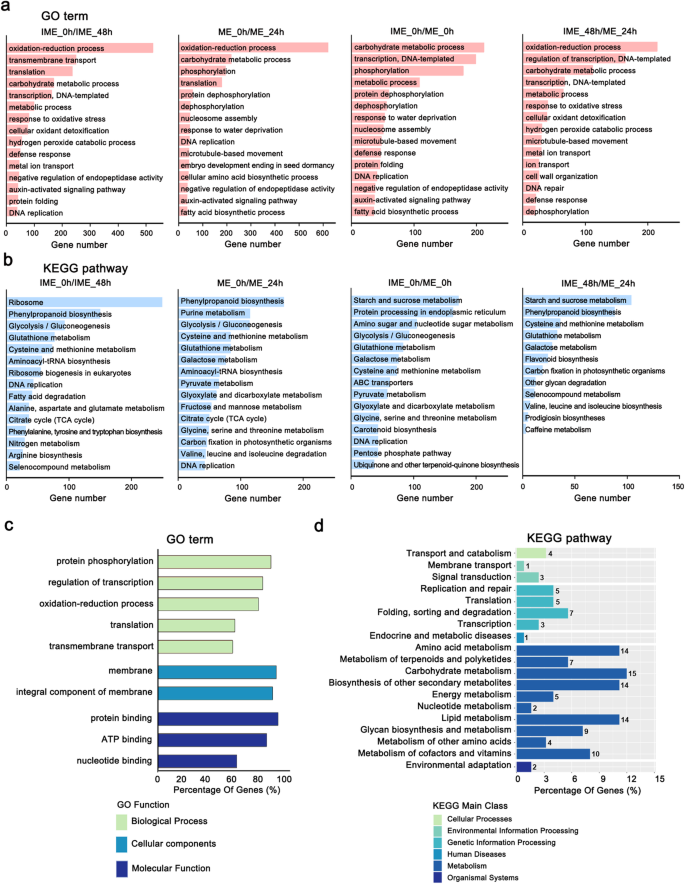
基因ontology (GO)分析显示,在IME_0h/IME_48 h、ME_0h/ME_24 h和IME_48h中,DEGs氧化还原过程是最常见的GO范畴,而IME_0h/ ME_0h中的DEGs主要参与碳水化合物代谢过程、转录和磷酸化等(图)。2a). KEGG分析显示,在IME_0h/IME_48、ME_0h/ME_24 h中富集了与苯丙酮类生物合成和糖酵解/糖异生相关的DEGs,在IME_0h/ ME_0h和IME_48h/ ME_24h中富集了淀粉和蔗糖代谢相关的DEGs(图)。2b)。
基因本体(GO)和DEGB分析不同群体中的差异表达基因。A:在IME_0h/IME_48h、ME_0h/IME_24h、IME_0h/ME_0h和IME_48h/ME_24h四种DEGs中筛选出15种最富集的氧化石墨烯生物过程。B:前15个最丰富的KEGG途径[67].P.值≤0.05,按DEGs数排序。C:IME-specific deg中富集程度最高的前10位氧化石墨烯(参考仅在对比IME_0h/IME_48h中发现的deg,但不包括在ME_0h/ME_24h中)。D:ime特异性DEGs中最丰富的19个KEGG通路类别
此外,我们还单独分析了ime特异性的deg,指的是仅在对比IME_0h/IME_48h中发现的deg,而不包括在ME_0h/ME_24h中。氧化石墨烯分析显示,蛋白磷酸化、转录调控、氧化还原过程、膜和蛋白质、ATP和核苷酸结合是IME系统中最常见的氧化石墨烯类别(图)。2c)。氨基酸代谢,碳水化合物代谢,脂质代谢和其他次级代谢物的生物合成是与IME特异性的含量相关的最富集的途径(图。2d)。
愈伤组织诱导中转录调控因子的差异表达
转录因子(TFs)通过调节细胞增殖和细胞命运重编程在胚性愈伤组织形成中发挥关键作用[21那22].植物转录因子数据库PlantTFDB (http://planttfdb.cbi.pku.edu.cn)在我们的数据集中用于blast测序和注释与愈伤组织发生相关的转录因子。
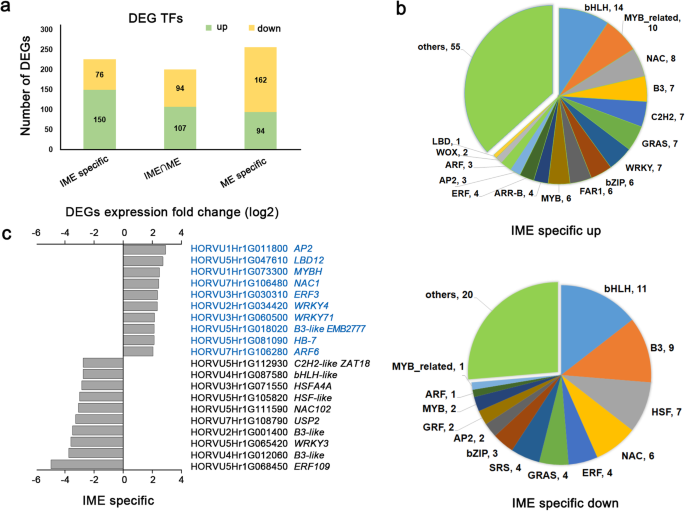
在两种愈伤组织诱导系统中,TFs的表达均发生了显著变化。在IME_0h/IME_48h组中鉴定出430个转录因子,在ME_0h/ME_24h组中鉴定出472个转录因子(附加文件2).其中,B3、bHLH、NAC、bZIP、myb相关的TFs进入IME_0h/IME_48h组前五名1:图S2a,附加文件2).此外,bHLH、NAC、ERF、bZIP和MYB家族成员在ME_0h/ME_24h组富集的差异表达tf中1:图S2b,附加文件2).在IME_0h/IME_48h组中HD-ZIP1(HORVU4Hr1G078410),PRE5(HORVU4Hr1G075340),LBD16.(Horvu0hr1g017670),沃什尔(本人,Horvu3HR1G085050),和ESE3(HORVU7Hr1G029870)升高,而ERF48(HORVU1Hr1G063100),像SRS(Horvu6hr1g084070),和C2H2样(HORVU5Hr1G112900)在愈伤组织诱导过程中降低1:图。S2C)。在ME_0H / ME_24H组中,转录水平LBD29(Horvu4HR1G080160),bHLH-like(HORVU3Hr1G030760),NAC071(HORVU1Hr1G049840)升高,而像SRS(HORVU6Hr1G084070),bZIP-like(HORVU4Hr1G021720),HSF-like(HORVU2Hr1G040680)在愈伤组织诱导过程中出现下降1:图S2d)。
由于我们对确定决定胚胎愈伤组织形成的TF感兴趣,我们进一步分析了仅在IME组中有差异调节的TF转录本。在ime诱导愈伤组织(IME-specific)过程中,共鉴定到226个TF基因,其中上调基因150个,下调基因76个,为DEGs。这些tf可能是造成两种外植体对愈伤组织诱导反应差异的原因之一。3.a).此外,bHLH、NAC、MYB、B3、HSF家族成员均在本组富集的差异转录因子中(图2)。3.b)。其中,显着表达TFS,折叠变化大于4.5(P.值< 0.05),如图所示。3.c.的转录水平AP2(HORVU1Hr1G011800),LBD12.(HORVU5Hr1G047610),MYBH(HORVU1Hr1G073300),母(HORVU7Hr1G106480),ERF3(HORVU3Hr1G030310)升高,而ERF109.(HORVU5Hr1G068450),B3-like(HORVU4Hr1G012060),WRKY3(orvu5hr1g065420)在愈伤组织诱导期间减少。
生长素信号在cim介导的愈伤组织形成中的作用
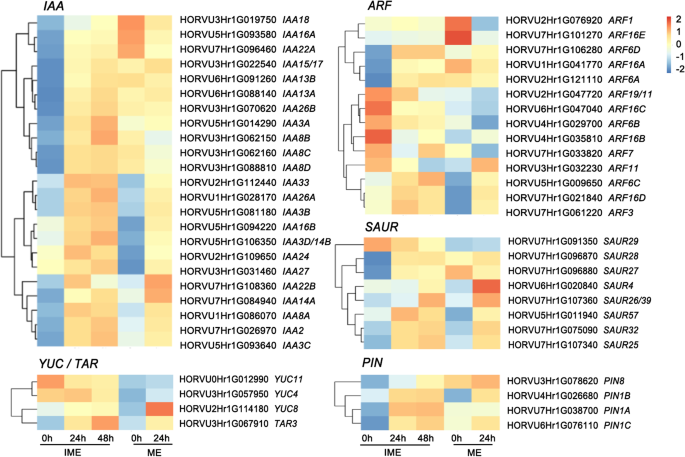
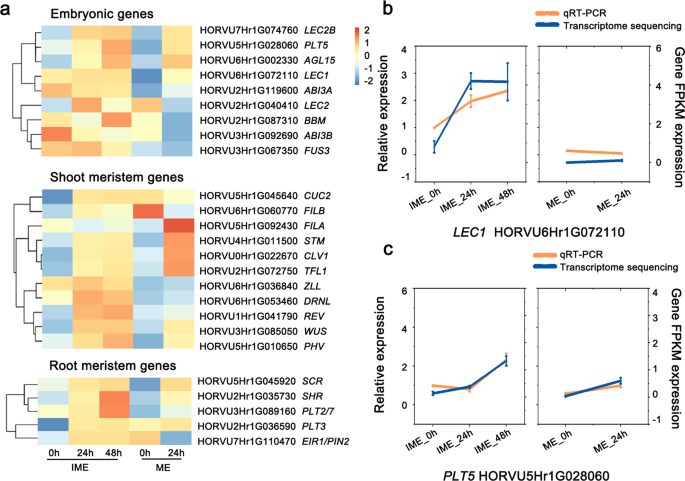
据报道,植物蛋白在组织培养中促进细胞增殖和重编程时发挥重要作用[23那24那25].我们检测了与生长素反应、生物合成和运输相关的基因转录谱。23国际宇航科学院, 十四东盟地区论坛, 八阿富汗二月,三YUCCA (雅)及四枚pin - formation (销)基因在愈伤组织形成过程中有差异表达(图。4.).CIM的影响国际宇航科学院IME系统中的基因比ME系统中的更广泛。22国际宇航科学院当IME作为外植体时,候选基因的表达量显著增加;十个国际宇航科学院在ME组中发现基因上调(超过3倍)。大多数分析的东盟地区论坛基因的表达模式在两组之间存在差异(图。4.).值得注意的是,候选基因ARF11(Horvu3HR1G032230)和ARF16B.(Horvu4HR1G035810)在两组之间表现出不同的模式,以及两个推定ARF6基因(HORVU2Hr1G121110和HORVU7Hr1G106280)在IME组上调,而在ME组保持不变。这些数据表明,生长素反应相关基因在生长素诱导的愈伤组织形成过程中协同调节细胞重编程。候选基因表达,包括ARF11,ARF16B.采用定量逆转录PCR (qRT-PCR)检测。结果显示在附加文件1:图S3。
愈伤组织诱导过程中生长素途径相关基因的表达。使用OmicStudio工具在https://www.omstudio.cn/tool.基于RNA-SEQ数据集(附加文件4.).热图下面的数字表示相对的表达强度,表达强度越高用红色表示。基因按生长素反应、生物合成和转运基因分组。注意,只显示了FPKM > 1基因
愈伤组织形成过程中胚、根和芽分生组织关键发育基因表达的变化
细胞被认为在分裂形成愈伤组织时去分化并获得能力[2那26].为了评价胚源愈伤组织的胚胎发生特性,分析了胚、根和芽分生组织的标记基因。在9个推测的胚胎基因中,FUSCA3 (FUS3,HORVU3Hr1G067350)和脱落酸不敏感3A (ABI3AIME系统中HORVU2Hr1G119600)的含量高于ME系统。值得注意的是,婴儿潮(BBM.HORVU3Hr1G089160)和LEC1(HORVU6Hr1G072110)在ime诱导的愈伤组织形成过程中表达量显著增加,但在ME系统中未被激活(图2)。5.a). qRT-PCR验证结果与RNA-Seq验证结果一致(图1)。5.b,无花果。5.c)。
愈伤组织诱导过程中胚和分生组织关键发育基因的表达变化。使用OmicStudio工具在https://www.omstudio.cn/tool.基于RNA-SEQ数据集(附加文件4.).A:基于RNA-SEQ数据集的胚胎,射击和根部分发基因的表达强度的聚类显示。B:转录水平LEC1和PLT5通过qRT-PCR和RNA-seq数据显示。数据显示的是三个生物重复的平均值±标准差
在11个上调的茎尖分生组织(SAM)基因中,有2个基因仅在IME系统中上调。此外,转录CUC2(orvu5hr1g045640)和FILB(HORVU6Hr1G060770)在IME系统愈伤组织形成过程中被迅速激活,而在ME系统中则受到抑制。值得注意的是,WUSCHEL (本人(HORVU3Hr1G085050)在IME系统中比在ME系统中表现出更显著的生长趋势。5个根尖分生组织(RAM)基因表达上调,其中4个基因在两组中重叠。PLT2(HORVU3Hr1G089160)在ime诱导的愈伤组织形成过程中表达显著增加,但在ME系统中未被激活。的增加SHR.(HORVU2Hr1G035730)和PLT3(HORVU2Hr1G036590)转录本在IME系统中比ME系统中要多;EIR1 / PIN2(HORVU7Hr1G110470)表现出相反的模式(图。5.一个)。
验证转录调控因子可能促进胚胎愈伤组织的形成和转化
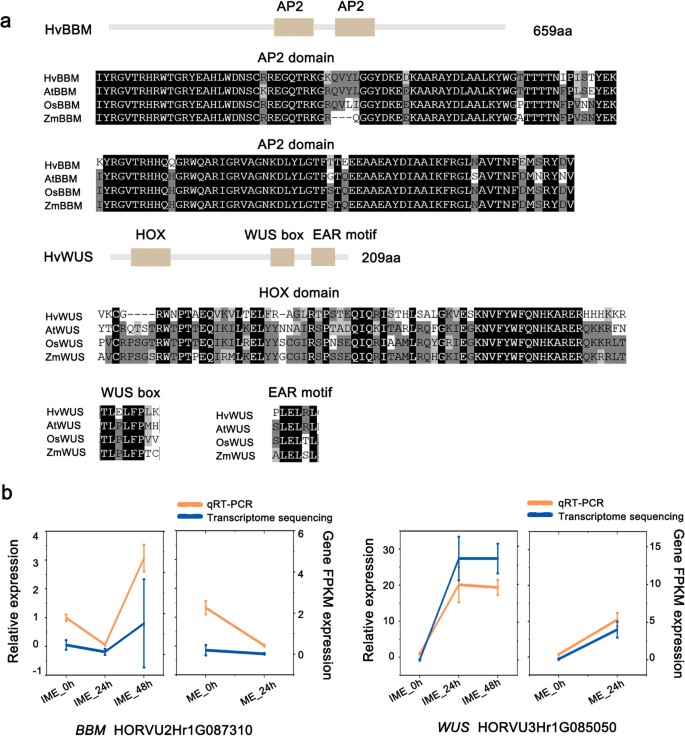
这项研究发现了一个BBM.基因和一个本人大麦的基因(附加档案1:图。S4)-HORVU2HR1G087310(称为BBM.)和HORVU3Hr1G085050(定名本人).这些基因在两个系统中表现出不同的表达模式(图。6.b);因此,我们在研究中对他们进行了进一步的调查。HvBBM包含两个AP2 dna结合域,与玉米、水稻和水稻中的基因氨基酸序列高度一致拟南芥(无花果。6.a).大麦WUS,与拟南芥干细胞调节器WUS [27那28],包含HOX结构域,WUS盒和耳动图案(图。6.a)系统发育树显示候选大麦BBM.与其他两个单子叶基因更接近,而候选大麦呢本人更接近双子体的WUS拟南芥(附加文件1:图。S4)。
为验证测序数据的可靠性,采用qRT-PCR检测愈伤组织形成早期的基因表达水平。的表达水平HVBM以未成熟胚为外植体时愈伤组织愈伤组织的数量逐渐增加,而以成熟胚为外植体时愈伤组织的数量则逐渐减少。6.这表明BBM.基因有助于外植体对CIM的差异反应。至于本人,在IME系统中观察到比在ME系统中更大的转录增加(图。6.b)。
我们还分析了候选基因LEC1.由LEC1编码的蛋白质含有一个CCAAT结合因子(CBF),氨基酸序列在大麦和其他物种中高度保守,例如玉米,水稻和拟南芥(附加文件1:图S5a)。转录水平LEC1通过qRT-PCR检测,结果与RNA-seq数据一致(图2)。5.b).系统发育树显示,候选大麦LEC1在单子叶中与其他两个同源基因更接近(附加文件)1:图S5b)。
异位表达HVBM和HvWUS提高遗传转化效率
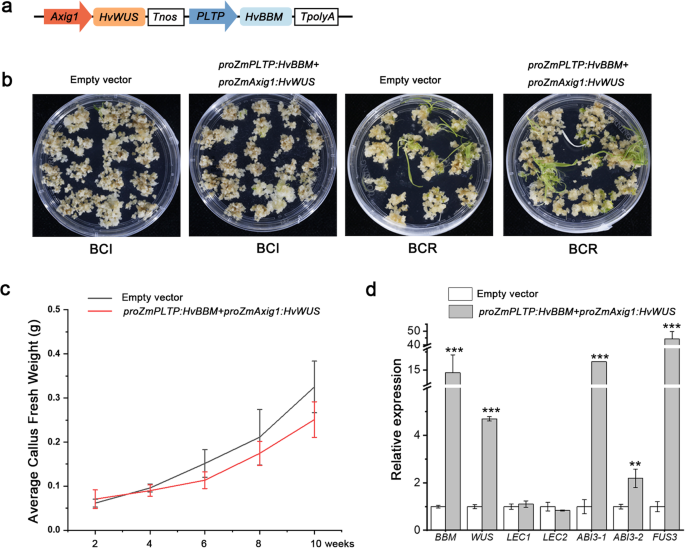
玉米过度表达(Zea Mays.)BBM.和玉米WUS2在许多以前不能转化的玉米自交系、未成熟的高粱胚、甘蔗愈伤组织和籼稻愈伤组织中,基因刺激了转化[29那30.].在本研究中BBM.和本人结果表明,IME和me衍生的愈伤组织诱导效果不同。6.b).进一步研究异位表达的影响BBM.和本人针对大麦愈伤组织的形成和转化效率,设计了2个结构体,每个结构体包含2个表达盒:玉米PLTP玉米促进剂BBM.(ZmBBM)或大麦BBM.(HVBM)与玉米相结合Axig1玉米促进剂本人(zmwus.)或大麦本人(HvWUS)(图。7.a).生成的向量表示为proZmAxig1: HvWUS + proZmPLTP: HvBBM.使用未成熟的胚胎作为外植体,农杆菌属-介导的转化。后农杆菌属接种,在含潮霉素的愈伤组织诱导培养基上选择愈伤组织,然后转移到植物再生的芽诱导培养基(SIM)(图。7.b).以愈伤组织鲜重测定愈伤组织增殖率,再生植株运输后未见明显表型变化proZmAxig1: HvWUS + proZmPLTP: HvBBM构造(图。7.c,额外的文件1:图S6)。
的影响BBM.和本人愈伤组织诱导培养基(CIM)的异位表达诱导愈伤组织的形成和转化效率。一种用于的结构的示意图表示农杆菌属介导的大麦转换。这proZmPLTP: HvBBM + proZmAxig1: HvWUS构建物包含两个片段:第一个片段包含玉米磷脂转移酶启动子(proZmPLTP)开车HVBM使用NOS终结者,第二个包括玉米Axig1启动子(proZmAxig1开车)HvWUSno终结者。B.后愈伤组织形成和植株再生表型农杆菌属接种。使用空向量的组被设置为控制。C对照和对照愈伤组织鲜重分析proZmPLTP: HvBBM + proZmAxig1: HvWUS变换群。误差条表示平均值的SE (N= 30)。实验分三个独立的重复进行。D.的影响BBM.和本人在基因上的异位表达LEC1-ABI3-FUS3-LEC2网络。所示数据为三个生物重复的平均值±标准差。P.< 0.05;***,P.< 0.01(学生的T.以及)。
转换的proZmAxig1: HvWUS+proZmPLTP: HvBBM构建以24.80%的频率产生的转基因植株。什么时候prozmaxig1:zmwus + prozmpltp:zmbbm结果表明,转基因植株的平均产量为4.00%,而空载体的平均产量为7.32%。其中,再生频率从7.32提高到24.8%HVBM和HvWUS转化效率可能取决于其对植株再生的促进作用2).
根据之前的研究,BBM.已知激活LEC1-ABI3-FUS3-LEC2网络以诱导体细胞胚胎发生[31].然后我们检测了这些基因下游的表达BBM..脱落酸不敏感3的转录水平(ABI3)及FUSCA3 (FUS3)在愈伤组织共表达中显著增加HVBM和HvWUS(无花果。7.d)。
调控DNA甲基化和组蛋白修饰的基因的转录变化
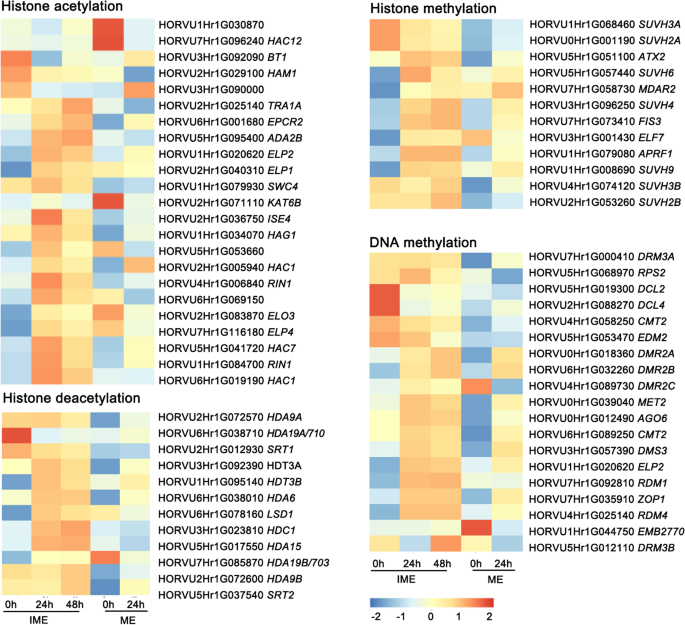
表观遗传重编程在愈伤组织诱导、体细胞胚发生和全能性获得中发挥重要作用[32].在假定的组蛋白甲基转移酶中,SUVH4(HORVU3Hr1G096250)在两个系统中均被激活,而HORVU1Hr1G008690 (SUVH9)只在IME系统中产生。suvh3a.(HORVU1Hr1G068460)和SUVH2A(Horvu0HR1G001190)候选基因在IME系统中下调,但在ME系统中仍然低水平(图。8.额外的文件1:图。S3)。
调节DNA甲基化基因的转录变化和组蛋白改性。使用OmicStudio工具在https://www.omstudio.cn/tool.基于RNA-SEQ数据集(附加文件4.).热图下面的数字表示相对的表达强度,表达强度越高用红色表示。注意,只显示了FPKM > 1基因
两个与组蛋白乙酰化相关的基因在两个系统中上调(RIN1那HAC7),ELP2(HORVU1Hr1G020620)在IME系统中特异性诱导。的表达HAC12(Horvu7HR1G096240)在ME系统中被抑制(图。8.).有两个基因参与组蛋白去乙酰化,HDA19/703(HORVU7Hr1G085870)和LSD1.(HORVU6Hr1G078160),在IME系统中上调,而在ME系统中保持抑制或不变。
作为表观遗传调控的重要组成部分,DNA甲基化相关基因在愈伤组织诱导过程中表现出显著变化[32].在两个系统中都发现了6个上调基因(DRM2A那DRM2B那MET2那前一个那CMT2.,DMS3.).ELP2(HORVU1Hr1G020620)仅在IME系统中被激活(图。8.).综上所述,这些数据表明,表观遗传重编程可能在生长素诱导的愈伤组织形成过程中调控基因表达方面发挥重要作用。
讨论
大麦是主要谷物中最难组织培养的作物之一。大麦转化常用未成熟胚作为外植体。然而,这些胚胎需要从正在发育的种子中单独分离出来,这需要大量的劳动力,而且受季节限制。相比之下,成熟胚易于获得,但利用成熟胚在组织培养中形成具有再生潜能的愈伤组织具有挑战性。在本研究中,我们探索了胚源性愈伤组织诱导过程中的全球转录变化,并确定了一些可能导致两种外植体对外源生长素反应差异的潜在因素。
生长素诱导大麦愈伤组织形成的全球转录变化
我们的RNA-seq数据显示,胚胎在富含生长素的培养基上孵育后,基因表达谱在48小时内发生了戏剧性的变化。在IME和ME系统中分别发现9330和11318个DEGs。大多数基因有显著的重叠,表明这些基因通常与不同系统的愈伤组织形成有关。近11.09%和12.84%的deg分别对IME_0h/IME_48h和ME_0h/ME_24h特异(图)。1e). IME_0h/ME_0h组中deg的数量最大(图2)。1d,无花果。2a),表明籽粒发育期间的碳水化合物代谢过程和基因转录决定了外植体的性质及其对愈伤组织对愈伤组织诱导培养基的反应。参与各种活性的基因,例如蛋白质磷酸化,转录调节和氧化还原过程,在基于IME的愈伤组织形成期间富集(图。2c).先前的一项研究表明,蛋白质酪氨酸磷酸化可能在植物激素刺激的细胞增殖中发挥重要的调节作用[33那34].此外,糖激活的TOR激酶被发现磷酸化并稳定E2Fa蛋白,而E2Fa蛋白在愈伤组织形成过程中转录激活s期基因[35].还已知E2FA的磷酸化来增强其转录活性[36].这些结果表明蛋白质磷酸化参与愈伤组织形成期间细胞增殖的调节。此外,我们表明,在大多数比较中,氧化还原过程显着富集。redox稳态被认为是维持新陈代谢,生长和干细胞维持和分化至关重要[37].据报道,硫氧还蛋白依赖的氧化还原修饰通过ROS稳态调节新生芽启动,这解释了植物再生的自然变异[38].因此,进一步探讨ROS稳态在愈伤组织形成和再生能力中的重要性将是一项有趣的研究。
生长素信号转导对cm诱导的大麦愈伤组织形成的影响
植物生长素是一种有效的愈伤组织诱导剂。本研究表明,成熟胚和未成熟胚形成愈伤组织的能力及其生长素信号通路不同。CIM的影响国际宇航科学院基因在IME系统中比在ME系统中更显著,表明未成熟胚胎对外源生长素的补充更敏感。总计23国际宇航科学院,14东盟地区论坛, 8阿富汗二月3雅和4.销在愈伤组织形成过程中发现了基因的差异表达(图。4.),说明生长素的反应和运输过程是生长素诱导愈伤组织形成过程中细胞重编程调控的必要过程。
研究拟南芥研究表明,在cam介导的愈伤组织形成过程中,生长素信号通过ARF转录因子,特别是ARF7和ARF19转导,激活LBD家族转录因子的表达[3.那4.那5.],从而诱导E2FA促进细胞周期再入[39].因此,我们比较了转录的小黑裙在我们的测序样本中的基因,显示出不同的组合LBD16B和LBD29A / B.在两个系统中上调(附加文件1:图S7)。因此,我们认为LBD蛋白作用于ARF因子的下游,通过细胞周期调节剂或细胞壁修饰来加强愈伤组织的形成[6.那7.那39].
胚胎基因在决定能力习得方面起着至关重要的作用
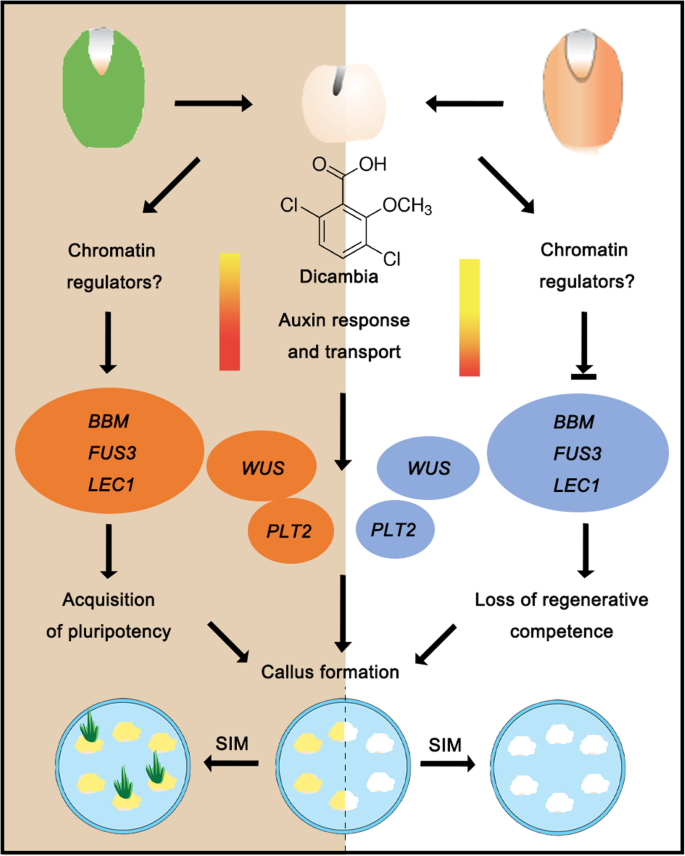
通过对胚和根、茎分生组织的关键发育基因的分析,确定了不同外植体及其衍生愈伤组织的分子特性。根分生组织调节基因,如PLT2和SHR.显示在IME系统中显著上调,支持在CIM上发育的愈伤组织具有类似根分生组织的组织学特征[1那10那40].
虽然两种类型的外植体在富含生长素的培养基上产生Calli,但只有未成熟的胚胎衍生的胚胎Calli获得SIM中的高再生电位[41].最近的研究表明,外植体的胚胎性质是体细胞重编程的先决条件[42].胚胎调节因子或分生组织调节因子的异位过表达诱导各种植物种的愈伤组织形成,说明未分化细胞命运的激活足以驱动无组织细胞增殖[27那29那43那44那45那46].我们的转录组测序数据显示,胚胎标记基因,如BBM.和LEC1,是由生长素快速诱导的,特别是在IME系统中FUS3和ABI3维持高水平转录(图5.a).这些基因在胚胎发生中发挥转录激活因子的作用。当这些转录因子中的任何一个异位表达拟南芥,所得植物在无植物激素培养基上产生胚胎愈伤组织[31那43那44那46那47那48].这些结果表明,参与胚胎发育的tf是细胞命运重编程所必需的,这是CIM中胚胎愈伤组织形成所必需的。茎分生组织基因大部分在IME系统中表现为强或弱的表达,其中只有3个在ME系统中被诱导(图)。5.),值得注意的是,本人在CIM上培养24 h后,候选基因被显著激活。此外,转录水平本人在输入法系统中比在ME系统中增加更多(图。5.a).归纳本人据报道,由生长素和细胞分裂素相互作用控制的SIM在愈伤组织诱导芽过程中参与最关键的事件[49那50].相比之下,auxin-induced本人胚胎调节因子的激活需要表达LEC1和LEC2在体细胞胚胎发生期间[51].LEC1和LEC2,加上BBM.和AGL15,形成高度相互关联的转录网络,促进表达yucs.那TAA1,IAA30调制植物蛋白生物合成和信令[21].因此,我们建议激活本人CIM培养过程中的表达可能通过多种途径赋予愈伤组织细胞多能性。
过度的BBM.和本人通过调节再生潜能提高转化效率
BBM.是在胚胎发生和种子发展期间优先表达的AP2 / ERF转录因子[45),而本人是一种含有同源结构域的转录因子,表达于芽分生组织的干细胞组织中心以及若干愈伤组织系中[27那28那52].以前的研究表明过度表达BBM.诱导胚愈伤组织拟南芥[45]和几种作物和树种[53,过度表达本人生成愈伤组织和体细胞胚胎拟南芥[54].这些结果表明了这些功能BBM.和本人在促进胚胎发生或胚性愈伤组织形成方面,双子叶植物可能是保守的,可用于提高愈伤组织的诱导效率。玉米BBM.和WUS2已成功地应用于玉米、高粱、甘蔗和籼稻大米(55].考虑到玉米结构表达引起的表型异常和不育等多效性效应BBM.和WUS2,愈伤组织表达启动子(Zm-PLTPpro)和生长素诱导启动子(Zm-Axig1pro)已被用来推动表达BBM.和WUS2,并通过体细胞胚胎获得转基因植物[29].我们用大麦替代玉米基因来测试这种方法BBM.和本人并产生健康和肥沃的转基因植物(附加文件1:图S6)。Co-expression大麦BBM.和本人大约三次改变转化效率(表2).在…的过程中农杆菌属在愈伤组织诱导能力中没有观察到愈合和随后的选择,在共表达时,在愈伤组织诱导能力中没有观察到显着的变化,并且在结合时,甚至更低的愈伤组织增殖能力PLTPPRO:HVBBM.和Axig1pro: HvWUS(无花果。7.c).然而,表达愈伤组织的植株再生能力显著提高PLTPPRO:HVBBM.+Axig1pro: HvWUS与用空向量的控制相比(图。7.b、d、表2).BBM.被证明是绑定的LAFL基因(LEC1 / L1L那ABI3那FUS3,LEC2)来调节它们的转录BBM.植物胚胎特性和全能性的其他主要调控因子上游[31].的影响BBM.和本人这可能与它们在基因中的调控作用有关,例如编码B3结构域蛋白ABSCISIC ACID-INSENSITIVE3 (ABI3)和FUSCA3 (FUS3)的基因(图3)。7.d),提示这些tf可能形成一个前馈循环,加强细胞命运转变。我们一起证明了大麦本人和BBM.基因可以通过提高大麦的再生潜力来刺激其转化。另一方面,某些转录因子(如WUS和BBM)的过表达已被报道可诱导体细胞胚胎发生拟南芥和玉米[31那42那45那54将BBM和WUS异位表达的影响与农杆菌属在今后的工作中,我们将进一步开展体细胞胚直接发生介导的大麦转化研究。
癌症诱导过程中转录组改变的表观遗传重新编程
越来越多的证据表明,愈伤组织形成过程中许多重编程基因的转录是受表观遗传调控的[56那57].表观遗传调节剂的遗传突变或化学扰动影响组织培养中愈伤组织的形成和芽再生[58].进化保守的蛋白质复合Polycomb抑制复合物2(PRC2)介导的组蛋白H3赖氨酸27三甲基化(H3K27ME3),以维持靶基因的抑制状态[56,包括编码胚胎调控因子的基因,例如LEC2和BBM.,防止胚胎发生和愈伤组织形成的异位发作[59那60].激活prc2抑制的重编程调节基因的机制是通过组蛋白去甲基化酶降低H3K27me3水平。两个候选基因HORVU3Hr1G096250和HORVU7Hr1G073410编码的蛋白质类似于拟南芥SuvH4和FIS3分别被发现在两个系统中被激活(图。8.),表明它们在愈伤组织诱导中起调节作用。此外,编码SUVH9同源物的HORVU1Hr1G008690在拟南芥,作为组蛋白甲基转移酶的SET结构域蛋白,仅在IME系统中显著上调(图2)。8.).我们专门检测组蛋白乙酰化相关基因的诱导ELP2(HORVU1Hr1G020620)的IME系统(图。8.),提高了组蛋白乙酰化帮助激活基因表达的可能性。此外,两个组蛋白去乙酰化酶基因,LSD1.(HORVU6Hr1G078160)和HDT3B(HORVU1Hr1G095140),在IME系统中特异性上调。这一发现与之前的一项研究一致,即水稻组蛋白去乙酰化酶OsHDA710通过在成熟水稻胚胎中通过组蛋白去乙酰化抑制抑制性OsARFs来调控愈伤组织的形成[61].
DNA甲基化是表观遗传调控的另一个重要组成部分,DNA甲基转移酶基因在愈伤组织诱导后表现出动态表达变化[32].其中两个,DRM2A(HORVU0Hr1G018360)和CMT2.(HORVU6Hr1G089250)在ME系统中被显著激活。相比之下,ELP2(HORVU1Hr1G020620)仅在IME系统中被激活(图。8.).除了DNA甲基化和组蛋白修饰之外,据报道,养蛋白还据报道,以促进植物细胞胚胎发生中的植物细胞包层能的获取[42].愈伤组织形成和芽再生过程中表观遗传调控与细胞重编程之间的分子联系有待进一步研究。
结论
通过对大麦胚性愈伤组织诱导过程中基因表达谱的详细分析,我们发现与生长素反应和转运相关的基因在IME系统中比在ME系统中更多。胚胎基因BBM.那LEC1,FUS3以及茎和根分生组织基因本人和PLT2显示两个系统之间的差异表达式模式,表明在确定获取能力时的关键作用。此外,表观遗传修饰可以参与调节不同外植体中基因的表达及其对愈伤组织诱导的反应(图。9.).HVBM和HvWUS可能是提高大麦转化效率的潜在目标。
方法
植物材料及组织培养
大麦(大麦芽l .简历。在浙江大学农业实验站自然条件下(11月- 5月)生长。授粉后14天的未成熟种子用75% (v/v)乙醇表面消毒1分钟,20% (v/v)次氯酸钠表面消毒20分钟,然后用无菌蒸馏水冲洗5次。成熟种子在50%硫酸中浸泡2小时,去除种皮,然后进行表面消毒。取去胚轴后,将IMEs和MEs置于愈伤组织诱导培养基中,盾片朝上[62],在24°C黑暗的生长室中诱导愈伤组织。将MEs和IMEs培养在3个生物重复中,每个重复由4个培养皿组成,每个培养皿含有30个胚胎。在CIM培养后0、24 h分别收获成熟胚,0、24、48 h分别收获未成熟胚。然后在液氮中快速冷冻,在−80°C保存,直到RNA提取。
RNA分离、文库构建和测序
以大麦未成熟胚和成熟胚的RNA为载体,构建cDNA文库。使用Illumina HiSeq 4000对端RNA-seq方法,对转录组进行测序,共产生7.56亿对端reads,产生114 Gb序列。在组装之前,低质量的reads(包含测序适配器的reads,包含测序引物的reads,以及q质量分数低于20的核苷酸)被去除,产生了6.17亿bp的清洁的配对端reads。原始序列数据已提交到NCBI Short Read数据库,登录号为GSE165487。
五个样本的原始序列数据与Ensembl(ftp://ftp.ensemblgenomes.org/pub/release-43/plants/fasta/hordeum_vulgare/dna/Hordeum_vulgare.IBS使用HISAT包的大麦参考基因组[63],它首先根据每一项解读的质量信息去除一部分解读,然后将解读映射到参考基因组。HISAT允许每次读取多次对齐(默认最多20次),当将读取映射到引用并建立潜在拼接连接数据库时,最多允许两次不匹配。通过将先前未映射的读数与假定连接的数据库进行比较,可以证实这一点。然后,使用umi工具去除序列相关偏差和放大噪声[64].
使用stringtie组装每个样本的映射读取[65].然后,使用Perl脚本合并来自样本的所有转录om以重建全面的转录组。在产生最终转录组后,使用弦代和编辑估计所有转录物的表达水平。STRINGTIE用于通过计算FPKM来预测mRNA表达水平。选择差异表达的mRNA和基因2Fold change|≥1,具有统计学意义P.< 0.05,使用R package edgeR [66].
实时的存在
使用Rnaiso Plus(Takara,大连,中国)提取大麦组织的总RNA,使用REVERTRA ACE QPCR RT试剂盒(中国上海TOYOBO,中国),使用1μgRNA进行1μg的RNA进行第一链cDNA合成。QRT-PCR在MasterCycler EP Realplex2系统(Eppendorf,汉堡,德国)使用Sybr Green Master套件(Roche,Basel,Switzerland)进行。扩增程序如下:10分钟95℃,然后在95℃,10s在60℃,20s处,在72℃下为10 s,持续40个循环,然后进行热变性步骤。使用ΔΔCT方法计算相对转录水平,使用ΔΔCT方法计算肌动蛋白基因作为参考。引物序列列于附加文件中1:表S4。
向量构造和农杆菌属介导的大麦转换
本研究中使用的质粒T-DNA表达盒的排列如图所示。7.一。prozmpltp:zmbbm + prozmaxig1:zmwus2构建物包含两个盒体:第一个盒体包含一个玉米磷脂转移酶启动子(prozmpltp.开车)ZmBBM使用NOS终结者,第二个包括玉米Axig1启动子(proZmAxig1开车)WUS2以Nos终止符[30.].为proZmPLTP: HvBBM + proZmAxig1: HvWUS2结构,使用的启动子与prozmpltp:zmbbm + prozmaxig1:zmwus2构建,用大麦中的同源基因替换ZmBBM和ZmWUS2.通过PCR扩增所有启动子和基因,使用输液试剂盒(Takara,大连,中国)组装PCR产物,然后将其克隆到pCAMBIA1305.本研究使用的引物列于附加文件中1:表S3。用于载体构建的克隆经测序验证。所描述的结构被电穿孔根癌土壤杆菌菌株EHA105。授粉后2-3周收获凯里波。在除去胚胎轴后,在大麦胚胎中获得不成熟的柔软菌,1.5-2毫米的尺寸,并用作外植体农杆菌属-中介转化遵循Harwood(2014)的程序[62].用湿霉素(50 mg L)诱导未成熟盾片的转基因愈伤组织−1)再生含培养基和耐潮霉素的植物。在幼苗阶段的再生植物在生长室中生长12-16周,具有16小时光/ 8 H夜循环,温度为23℃和70%湿度。随后,生长转基因植物直至在6-In的自然光下成熟。玻璃杯子里的锅[62].转化频率定义为产生抗湿霉素T的未成熟胚胎的数量0.植物。
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- 我:
-
不成熟的胚胎
- 我:
-
成熟胚
- 度:
-
差异表达基因
- CIM:
-
愈伤组织诱导培养基
- SIM卡:
-
射击诱导媒介
- WOX5:
-
WUSCHEL-RELATED HOMEOBOX5
- 月:
-
短的根
- 东盟地区论坛:
-
生长素响应因子
- LBD:
-
横向器官边界域
- CUC:
-
的杯状容器子叶
- plt:
-
过多的蛋白质
- ABI3:
-
脱落ACID-INSENSITIVE 3
- FUS3:
-
Fusca3.
- PRC2:
-
多梳性压抑情结2
- 山姆:
-
技条顶端分生组织
- 内存:
-
根顶端分生组织
- 分区:
-
黄色假期
- QRT-PCR:
-
定量逆转录PCR
- 去:
-
基因本体论
- UMI:
-
独特的分子标识符
- TFS:
-
转录因子
- BBM:
-
婴儿潮
- 本人:
-
WUSCHEL
- LEC1:
-
绿叶子叶1
- 国际宇航科学院:
-
吲哚乙酸
- Saur:
-
小生长素上升RNA
- 销:
-
PIN-FORMED
- 耶稣:
-
丝兰
参考文献
- 1.
6 .张志强,王志强,王志强,等。拟南芥根系再生的研究进展。Dev细胞。2010;18(3):463 - 71。https://doi.org/10.1016/j.devcel.2010.02.004.
- 2.
Efroni I, Mello A, Nawy T, Ip PL, Rahni R, DelRose N, Powers A, Satija R, Birnbaum KD。在激素相互作用的指导下,根的再生触发胚胎样序列。细胞。2016;165(7):1721 - 33所示。https://doi.org/10.1016/j.cell.2016.04.046.
- 3.
单根/IAA14的组织特异性表达改变拟南芥侧根发育。植物j . 2005; 44(3): 382 - 95。https://doi.org/10.1111/j.1365-313X.2005.02537.x.
- 4.
范明,徐超,徐凯,胡玉华。拟南芥再生过程中器官边界域转录因子的调控。细胞研究》2012;22(7):1169 - 80。https://doi.org/10.1038/cr.2012.63.
- 5.
ARF7和ARF19通过直接激活拟南芥的LBD/ASL基因来调控侧根的形成。植物细胞。2007;19(1):118 - 30。https://doi.org/10.1105/tpc.106.047761.
- 6.
LBD18作为一种转录激活剂,直接与EXPANSIN14启动子结合,促进拟南芥侧根的出现。植物j . 2013; 73(2): 212 - 24。https://doi.org/10.1111/tpj.12013.
- 7.
徐超,曹华,徐恩,张树华,胡勇。拟南芥LBD29靶基因的全基因组鉴定揭示了生长素诱导愈伤组织细胞重编程的分子机制。植物生理学报。2018;59(4):744-55。https://doi.org/10.1093/pcp/pcx168.
- 8.
徐春华,曹辉,张强,王辉,辛伟,徐恩,张胜,于瑞,于东,胡艳。生长素诱导的拟南芥愈伤组织的调控。Nat植物。2018;4(2):108 - 15。https://doi.org/10.1038/s41477-017-0095-4.
- 9.
杯状子叶基因促进愈伤组织不定芽的形成。植物生理学报。2003;44(2):113-21。https://doi.org/10.1093/pcp/pcg038.
- 10.
Kareem A,Durgaprasad K,Sugimoto K,Du Y,PulianMackal Aj,Triveri Zb,Abhayadev PV,Pinon V,Meyerowitz Em,Scheres B等人。两步机构的血清基因控制再生。Curr Biol。2015; 25(8):1017-30。https://doi.org/10.1016/j.cub.2015.02.022.
- 11.
郭芳,张华,刘伟,胡晓,韩宁,钱强,徐磊,边华。水稻和拟南芥根外植体愈伤组织的诱导策略。植物生理学杂志。2018;59(9):1782-9。https://doi.org/10.1093/pcp/pcy095.
- 12.
王敏,王志强,王文华,王文华,王文华。农杆菌介导的青稞转化。植物j . 1997; 11(6): 1369 - 76。https://doi.org/10.1046/j.1365-313X.1997.11061369.x.
- 13.
Holme IB, Brinch-Pedersen H, Lange M, Holm PB。根癌农杆菌侵染不同大麦品种胚珠的转化研究。植物学报2008;27(12):1833-40。https://doi.org/10.1007/s00299-008-0605-y.
- 14.
Shim YS, paul KP, Kasha KJ。离体大麦(Hordeum vulgare L.)小孢子的转化;预处理时间和温度与轰击结果的关系。52基因组。2009;(2):175 - 90。https://doi.org/10.1139/G08-113.
- 15.
Shim YS, paul KP, Kasha KJ。大麦(Hordeum vulgare L.)离体小孢子的转化:I.预处理和渗透处理对DNA合成时间的影响。52基因组。2009;(2):166 - 74。https://doi.org/10.1139/G08-112.
- 16.
陈志强,王志强,王志强,等。根癌农杆菌侵染大麦花粉的遗传转化研究。生物技术学报;2006;4(2):251-61。https://doi.org/10.1111/j.1467-7652.2005.00178.x.
- 17.
Lim WL, Collins HM, Singh RR, Kibble NAJ, Yap K, Taylor J, Fincher GB, Burton RA。无壳大麦转化和操纵谷物混合连锁β -葡聚糖的方法。acta botanica yunnanica(云南植物研究). 2018;60(5):382-96。https://doi.org/10.1111/jipb.12625.
- 18.
负责大麦农杆菌介导转化适应性的基因组区域。Sci众议员2016;6(1):37505。https://doi.org/10.1038/srep37505.
- 19.
Hisano H,Meints B,Moscou MJ,Cistue L,Echavarri B,Sato K,Hayes PM。基于TFA(转化扫算性)单倍型的转化高效薏米基因型和TFA基因座的较高分辨率映射。植物细胞批准。2017; 36(4):611-20。https://doi.org/10.1007/s00299-017-2107-2.
- 20.
Orman-Ligeza B, Harwood W, Hedley PE, Hinchcliffe A, Macaulay M, Uauy C, Trafford K. TRA1:调控农杆菌介导大麦转化的基因座。Front Plant Sci. 2020;11:355。https://doi.org/10.3389/fpls.2020.00355.
- 21.
田志刚,李志刚,李志刚,等。植物再生的分子机制研究进展。acta botanica yunnanica(云南植物研究). 2019;70(1):377-406。https://doi.org/10.1146/annurev-arplant-050718-100434..
- 22.
王志强,王志强,王志强,等。植物愈伤组织诱导及抑制机制的研究进展。植物细胞。2013;25(9):3159 - 73。https://doi.org/10.1105/tpc.113.116053.
- 23.
Skoog F,Miller Co。在体外培养的植物组织中生长和器官形成的化学调节。Symp Soc Exp Biol。1957; 11:118-30。
- 24.
疗养A.体细胞胚胎发生 - 植物细胞命运的应激引起的重塑。BBA-基因调节机械。2015; 1849(4):385-402。
- 25.
Valemkens D,Vanmontagu M,VanlijseBettens M. Agrobacterium-tumefaciens介导通过使用卡那霉素选择的Arabidopsis-thaliana根外植物的转化。P Natl Acad Sci USA。1988; 85(15):5536-40。https://doi.org/10.1073/pnas.85.15.5536.
- 26.
陈建平,陈志强,陈志强。拟南芥组培苗发育能力的研究进展。足底。2007;226(5):1183 - 94。https://doi.org/10.1007/s00425-007-0565-4.
- 27.
在拟南芥茎分生组织中,WUSCHEL在调控干细胞命运中的作用。细胞。1998;95(6):805 - 15所示。https://doi.org/10.1016/s0092 - 8674 (00) 81703 - 1.
- 28.
在拟南芥茎和花的分生组织完整中,WUSCHEL基因是必需的。发展。1996;122(1):87 - 96。
- 29.
王劳K,吴E, N, Hoerster G,黑斯廷斯C,曹MJ, Scelonge C, B Lenderts Chamberlin M, Cushatt J,王L,瑞安L,汗T, Chow-Yiu J,华W,余米,J,保Z, K,边缘Igo E, Rudrappa B, Shamseer点,布鲁斯·W·纽曼L,沈B,郑P, Bidney D, Falco C,注册J,赵ZY,徐D, T,琼斯Gordon-Kamm W.形态发生调节剂婴儿潮和Wuschel促进单子叶植物的转化。植物细胞。2016;28(9):1998 - 2015。https://doi.org/10.1105/TPC.16.00124.
- 30.
王宁,王宁,吴恩,吴恩华,王宁。玉米体细胞胚胎直接发生的快速基因型“独立”转化。中国生物医学工程学报。2018;54(3):240-52。https://doi.org/10.1007/S11627-018-905-2.
- 31.
Horstman A, Li M, Heidmann I, Weemen M, Chen B, Muino JM, Angenent GC, Boutilier K. BABY BOOM转录因子激活LEC1-ABI3-FUS3-LEC2网络诱导体细胞胚胎发生。植物杂志。2017;175(2):848 - 57。https://doi.org/10.1104/pp.17.00232.
- 32.
STROUD H,Ding B,Simon SA,Feng Sh,Bellizzi M,Pellegrini M,Wang GL,Meyers Bc,Jacobsen SE。从组织培养中再生的植物含有稳定的大米的外观蛋白酶体变化。Elife。2013; 2。https://doi.org/10.7554/eLife.00354.
- 33.
黄慧娟,林玉梅,黄丹丹,高桥,杉山山。植物激素诱导拟南芥下胚轴细胞增殖过程中酪氨酸蛋白的磷酸化。植物生理学报。2003;44(7):870 - 5。https://doi.org/10.1093/pcp/pcg082.
- 34.
Almeida Fa,Passamani LZ,Santa-Catarina C,Mooney BP,Thelen JJ,Silveira V.无标签的定量磷蛋白酶揭示了甘蔗中胚胎源性竞争力的信号传导动态。J蛋白质组。2020; 19(10):4145-57。https://doi.org/10.1021/acs.jproteome.0c00652.
- 35.
李K,徐PJ。拟南芥TOR信号是糖调控愈伤组织形成的关键。acta botanica yunnanica(云南植物研究). 2017;59(10):742-6。https://doi.org/10.1111/jipb.12560.
- 36.
熊颖,李玲,李丽丽,李丽丽,李春霞。葡萄糖- tor信号通路重组转录组并激活分生组织。大自然。2013;496(7444):181 - 6。https://doi.org/10.1038/nature12030.
- 37.
曾建军,董志,吴华,田志,赵志忠。氧化还原对植物干细胞命运的调控。EMBO j . 2017; 36(19): 2844 - 55。https://doi.org/10.15252/embj.201695955.
- 38.
张浩,张婷婷,刘浩,史勇,王明,别小明,李晓刚,张新新。硫氧还蛋白介导的ROS稳态解释了植物再生的自然变异。植物杂志。2018;176(3):2231 - 50。https://doi.org/10.1104/pp.17.00633.
- 39.
Berckmans B, Vassileva V, Schmid SP, Maes S, Parizot B, Naramoto S, Magyar Z, Alvim Kamei CL, Koncz C, Bogre L, et al.;侧边器官边界蛋白通过拟南芥E2Fa转录调控生长素依赖的细胞周期重新激活。植物细胞。2011;23(10):3671 - 83。https://doi.org/10.1105/tpc.111.088377.
- 40.
Bustillo-Avendano E,Ibanez S,Sanz O,Sousa Barros Ja,Gude I,Perianez-Rodriguez J,Micol JL,Del Pozo JC,Moreno-Risueno Ma,Perez-Perez JM。乙型根机组织期间激素控制,细胞重编程和图案化的调节。植物理性。2018; 176(2):1709-27。https://doi.org/10.1104/pp.17.00980.
- 41.
Ganeshan S, Baga M, Harvey BL, Rossnagel BG, Scoles GJ, Chibbar RN。大麦(Hordeum vulgare)成熟胚和叶基部/顶端分生组织产生多芽的研究。acta botanica sinica(云南植物学报)2003;37(1):57-64。https://doi.org/10.1023/A:1022631807797.
- 42.
王凤峰,尚国栋,吴丽丽,徐志刚,赵学勇,王建伟。植物体细胞胚胎发生的染色质可及性动态和转录调控网络结构。Dev细胞。2020;54(6):742 - 57。https://doi.org/10.1016/j.devcel.2020.07.003.
- 43.
Lotan T, Ohto M, Yee KM, West MA, Lo R, Kwong RW, Yamagishi K, Fischer RL, Goldberg RB, Harada JJ。拟南芥叶状子叶1在营养细胞中足以诱导胚胎发育。细胞。1998;93(7):1195 - 205。https://doi.org/10.1016/s0092 - 8674 (00) 81463 - 4.
- 44.
Stone SL, Kwong LW, Yee KM, Pelletier J, Lepiniec L, Fischer RL, Goldberg RB, Harada JJ。叶状子叶2编码一个诱导胚胎发育的B3结构域转录因子。中国科学(d辑:地球科学)2001;98(20):11806-11。https://doi.org/10.1073/pnas.201413498.
- 45.
Boutilier K, Offringa R, Sharma VK, Kieft H, Ouellet T, Zhang L, Hattori J, Liu CM, van Lammeren AA, Miki BL, et al.;婴儿潮的异位表达引发了从营养生长到胚胎生长的转变。植物细胞。2002;14(8):1737 - 49。https://doi.org/10.1105/tpc.001941.
- 46.
Braybrook SA, Stone SL, Park S, Bui AQ, Le BH, Fischer RL, Goldberg RB, Harada JJ。叶状子叶2直接调控的基因为胚胎成熟和体细胞胚胎发生的调控提供了新的认识。中国科学(d辑:地球科学)2006;103(9):3468-73。https://doi.org/10.1073/pnas.0511331103.
- 47.
Harding Ew,Tang W,Nichols Kw,Fernandez de,Perry Se。通过组成型抗静脉曲菌的15.植物理性的表达,增强了胚胎源性潜力的表达和维持。2003; 133(2):653-63。https://doi.org/10.1104/pp.103.023499.
- 48.
Stone SL, Braybrook SA, Paula SL, Kwong LW, Meuser J, Pelletier J, Hsieh TF, Fischer RL, Goldberg RB, Harada JJ。拟南芥叶子叶2诱导成熟性状和生长素活性:体细胞胚胎发生的意义。中国科学院院刊2008;105(8):3151-6。https://doi.org/10.1073/pnas.0712364105.
- 49.
在根分生组织中诱导茎干细胞活性和发育可塑性。基因Dev。2004;18(4):375 - 80。https://doi.org/10.1101/gad.291204.
- 50.
程志军,王林,孙伟,张颖,周超,苏永华,李伟,孙婷婷,赵学勇,李晓刚,程勇,赵颖,谢强,张新新。生长素和细胞分裂素对茎分生组织诱导的响应模式是由生长素响应因子3调控细胞分裂素生物合成的结果。植物杂志。2013;161(1):240 - 51。https://doi.org/10.1104/pp.112.203166.
- 51.
马玉峰,米otk A, Sutikovic Z, Ermakova O, Wenzl C, Medzihradszky A, Gaillochet C, Forner J, Utan G, Brackmann K,等。在拟南芥中,WUSCHEL作为生长素反应变阻器来维持顶端干细胞。Nat Commun。2019;10:1-11。
- 52.
Iwase A, Mitsuda N, Koyama T, Hiratsu K, Kojima M, Arai T, Inoue Y, Seki M, Sakakibara H, Sugimoto K, Ohme-Takagi M. AP2/ERF转录因子WIND1控制拟南芥细胞脱分化。咕咕叫医学杂志。2011;21(6):508 - 14所示。https://doi.org/10.1016/j.cub.2011.02.020.
- 53.
El Ouakfaoui S,Schnell J,Abdeen A,Colville A,Labbe H,Han S,Baum B,Laberge S,Miki B.通过AP2转录因子控制体细胞胚胎发生和胚胎发育。植物mol biol。2010; 74(4-5):313-26。https://doi.org/10.1007/S11103-010-9674-8.
- 54.
左JR,牛庆文,蔡恩华。在拟南芥中,WUSCHEL基因促进植物向胚胎的转变。植物j . 2002; 30(3): 349 - 59。https://doi.org/10.1046/j.1365-313X.2002.01289.x.
- 55.
王宁,王宁,吴恩,吴恩华,王宁。玉米体细胞胚胎直接发生的快速基因型“独立”转化。体外细胞DEV-PL。2018; 54(3):240-52。https://doi.org/10.1007/S11627-018-905-2.
- 56.
Ikeuchi M, Iwase A, Rymen B, Harashima H, Shibata M, Ohnuma M, Breuer C, Morao AK, de Lucas M, de Veylder L, et al.;PRC2抑制拟南芥成熟体细胞的去分化。自然植物。2015;1(7):1 - 7。
- 57.
王志强,王志强。生长素诱导的植物体细胞胚胎发生的表观遗传调控。中国生物医学工程学报。2020;21(4):457 - 462。
- 58.
李K,徐PJ。植物再生过程中的动态表观遗传变化。趋势植物SCI。2018; 23(3):235-47。https://doi.org/10.1016/j.tplants.2017.11.009.
- 59.
Bouyer D,Roudier F,Heese M,Andersen Ed,Gey D,Nowack Mk,Goodrich J,Renou JP,Griinu Pe,Colot V等.多梳抑制复合物2控制胚-苗阶段的转变。公共科学图书馆遗传学。2011;7(3)。
- 60.
Bratzel F, lorenz - torrejon G, Koch M, Del Pozo JC, Calonje M.在拟南芥中保持细胞身份需要PRC1环指同源物催化H2A单倍基化。咕咕叫医学杂志,2010;20(20):1853 - 9。https://doi.org/10.1016/j.cub.2010.09.046.
- 61.
张H,Guo F,齐P,黄Y,谢Y,Xu L,Han N,XU L,Bian H. OSHDA710介导的组蛋白脱乙酰化调节愈伤组织胚胎成熟胚胎的愈伤组织形成。植物细胞生理。2020; 61(9):1646-60。https://doi.org/10.1093/pcp/pcaa086.
- 62.
哈伍德佤邦。高通量农杆菌介导大麦转化的方案。方法:中华医学杂志。2014;1099:251-60https://doi.org/10.1007/978-1-62703-715-0_20.
- 63.
HISAT:低内存要求的快速拼接对准器。Nat方法。2015;12(4):357 - 60。https://doi.org/10.1038/nmeth.3317.
- 64.
史密斯T,Heger A,Sudbery I. UMI-Tools:在独特的分子标识符中建模测序误差以提高量化精度。Genome Res。2017; 27(3):491-9。https://doi.org/10.1101/gr.209601.116.
- 65.
Pertea M, Pertea GM, Antonescu CM, Chang TC, Mendell JT, Salzberg SL. StringTie能够从RNA-seq读取改进的转录组重建。生物科技Nat》。2015;33(3):290 - 5。https://doi.org/10.1038/nbt.3122.
- 66.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学,2010,26(1):139 - 40。https://doi.org/10.1093/bioinformatics/btp616.
- 67.
Kanehisa M, Goto S. KEGG:京都基因和基因组百科全书。核酸研究。2000;28(1):27-30。https://doi.org/10.1093/nar/28.1.27.
确认
不适用。
资金
基金资助:浙江省自然科学基金资助项目(批准号:)。LGN18C130001)和中国农业研究系统(CARS-05-05A)。
作者信息
从属关系
贡献
JQS和CLZ制备样本进行RNA测序并进行qRT-PCR。JQS、ZHZ和XPL进行转化和组织培养。JQS和CLZ对生物信息学分析做出了贡献。NH设计和协调工作,并使用JQS撰写稿件。HWB, JHW, MYZ参与了工作的设计和讨论,并协助起草了稿件。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
从五个库中读取的总数据的统计。样品:样品名称;Raw_reads:原始数据中读的总数;Raw_bases (G):离线原始数据总数据量;Valid_reads:移除连接后的有效读、低质量读等的数量;Dedup_reads: UMI重复数据删除后的读次数;Valid_Q20(%):有效读取的Q20值;Valid_Q30(%):有效读取的Q30值;Valid_GC (%): UMI重复数据删除后读的GC内容;Valid2raw(%):有效读取占原始读取的百分比; Dedup2Valid (%): the percentage of valid reads after deduplication of the reads in the genome.表S2。摘要的数据清洗和长度分配的标签。表S3。构建质粒的引物列表。红色标记的部分表示适配器序列。弗兰克-威廉姆斯:底漆。牧师:反向引物。表S4。qRT-PCR所使用的引物列表。F:底漆。接待员:反向引物。图S1。样本间的Pearson相关性。A:样品之间的相关热图。B:主成分分析的三维图。图S2。图S2一组愈伤组织诱导培养基(CIM)诱导的转录因子在未成熟和成熟胚愈伤组织形成中的表达。a - b:IME_0h/IME_48h和ME_0h/ME_24h的转录因子差异饼图。数字代表与特定TF家族相关的基因成员。C:IME_0h/IME_48h中表达差异最大的10个转录因子按变化倍数排序。蓝色标记的是转录因子上调,黑色标记的是转录因子下调。D:ME_0h/ME_24h差异表达量最高的10个转录因子。图S3。转录水平的ARF11那ARF16B.那SUVH2A和suvh3a.qRT-PCR和RNA-seq数据显示,在5个样本中。数据显示的是三个生物重复的平均值±标准差。图S4。系统发育树BBM.和本人大麦和其他物种的基因。采用Neighbor-Joining法构建mega4系统发育树。基因id是HVBM(HORVU2Hr1G087310.1),HvWUS(HORVU3Hr1G085050.1)大麦芽那ZmBBM(Zm00001d042492),zmwus.(ZM00001D026537)来自Zea Mays.那SbBBM(SORBI_3003G390600),SbWUS(SORBI_3006G254900)高粱二色的那OsBBM(LOC_Os01g67410.1),oswus.(LOC_Os04g56780.1)奥雅萨苜蓿那TaBBM(traescs3b02g427300.1),TaWUS(TraesCS2A02G491900.1)小麦那BdBBM(BRADI_2G57747V3),BdWUS(BRADI_5g25113v3)Brachypodium distachyon,AtBBM(AT5G17430.1),AtWUS(AT2G17950.1)拟南芥.图S5。候选基因表达分析LEC1愈伤组织形成过程中的基因。A:LEC1中的序列对准和域分析拟南芥、大米、玉米和大麦。B:大麦和其他物种LEC1的系统发育树。采用Neighbor-Joining法构建mega4系统发育树。基因id是HvLEC1(HORVU6Hr1G072110)大麦芽那AtLEC1(AT1G21970.1)来自拟南芥那BnLEC1(BnaA07g10770D)芸苔属植物显著那GmLEC1-A(GLYMA_07G268100),GmLEC1-B(GLYMA_17G005600)甘氨酸最大,和ZmLEC1(Zm00001d017898_T001)Zea Mays.,OsLEC1(LOC_Os02g49370.1)奥雅萨苜蓿.图S6。用空载体转化的愈伤组织再生植株的表型本人和BBM.基因。图S7。候选基因表达分析的小黑裙大麦愈伤组织形成的潜在相关基因。使用OmicStudio工具在https://www.omstudio.cn/tool.基于RNA-SEQ数据集(附加文件4.).热图下面的数字表示相对的表达强度,表达强度越高,用红色的颜色表示。
额外的文件2。
补充的DEG原料数据。
额外的文件3。
补充tf的原始数据。
额外的文件4。
补充原始数据的基因在热图。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
索娇,周超,曾志。et al。通过转录组分析鉴定促进大麦胚性愈伤组织形成的调控因子。BMC植物杂志21,145(2021)。https://doi.org/10.1186/s12870-021-02922-w
收到了:
公认:
发表:
关键字
- 大麦(大麦芽)
- 愈伤组织诱导
- 生长素响应
- 植物再生