摘要
背景
E2F/DP蛋白已被证明可调节与细胞周期控制和DNA修复有关的基因。然而,到目前为止,对毛竹E2F/DP家族潜在作用的研究还很有限。
结果
我们在毛竹基因组中发现了23个E2F/DPs,包括9个E2F基因、6个DP基因、8个DEL基因和1个E2F部分结构域基因。对同源基因对分化时间的估计表明,E2F/DP家族扩增主要是通过全基因组重复事件发生的。调控元件和共表达网络分析表明E2F/DP型调控细胞周期相关基因的表达。基于转录组数据和原位杂交的酵母双杂交试验和表达分析表明,PheE2F-PheDP复合物在冬笋生长中发挥了重要作用。qRT-PCR结果显示,PheE2F/DPs表现出不同的表达模式,对干旱和盐处理和日循环有不同的响应。
结论
我们的发现为毛竹E2F/DP家族提供了新的见解,并为进一步验证PheE2F/DPs的功能提供了部分实验证据。
背景
毛竹(植被类型)每年创造近50亿美元的经济价值。由于增长速度快,它是东亚用于商业目的的最重要的非木材产品[1,2]. 毛竹笋生长过程中,细胞分裂和细胞伸长同时产生高度增长。在冬季和生长早期,细胞分裂起关键作用,而在生长后期,细胞伸长占主导地位。
高等植物中的E2F/DP转录因子根据其保守结构域可分为E2F、DP和DEL(DP-E2F-like)三类[3.]. E2F组基因包含四个功能域,包括一个RBR结合域、一个“标记框”域、一个DNA结合域和一个亮氨酸拉链二聚化域,而DP组的成员缺少RBR结合域,一个与E2F相比的“标记框”域。DEL组基因被认为是非典型的E2F/DPs,以单体形式起作用,DEL基因只含有一个重复的DNA结合域[4].
E2F/DP家族有八个成员拟南芥.据报道,在细胞增殖过程中,典型的AtE2Fs发挥拮抗作用,因为E2Fc是负调控因子,而E2Fa和E2Fb是正调控因子[5,6,7]. E2Fa和E2Fb与DPa相互作用,通过其亮氨酸拉链二聚化结构域的组织激活细胞周期和细胞增殖相关基因的表达[8].
E2F成员可能在控制细胞命运决定中发挥不同的作用[3.]. 在mammals, the E2F signaling pathway is essential for cell growth and cell proliferation [9]. 小麦E2F的研究拟南芥研究表明,植物还具有E2F信号通路中的所有核心调节因子,如细胞周期蛋白依赖激酶抑制剂(CKIs)、视网膜母细胞瘤(RBs)、细胞周期蛋白和细胞周期蛋白依赖激酶(CDKs)。在植物中,E2F/DP与其靶基因中的E2FAT(TTTCCCGCC)基序结合,起到促进转录的作用[10].
先前的研究从第一个版本的毛竹基因组数据库中鉴定出12个PhE2F/DP转录因子[11].然而,由于在草图基因组序列的限制,相当数量PhE2F / DPs仍然缺少注释。此外,表达变化和潜在的作用PheE2F/DP型在竹笋生长过程中,对胁迫刺激和日周期的反应基因仍然缺失。在这项研究中,共有23个E2F/DPs是基于新版本的毛竹基因组注释项目(Moso-bamboo genome annotation project)鉴定出来的,该项目提供了染色体水平的从头基因组组装。23个基因的系统发育关系、基因结构和保守基序PheE2F/DP型基因分析。启动子分析表明独联体-作用元件,包括光响应和激素信号以及许多转录因子结合位点,存在于基因的启动子区域PheE2F公司基因。我们在毛竹基因组中研究了潜在的E2F/DP结合位点的基因启动子,发现了580个E2F/DP靶基因。在生物信息学预测的基础上,我们进一步研究了表达动力学PheE2F公司竹笋生长及对胁迫刺激和日循环的响应的基因。通过酵母双杂交和表达分析,研究了PheE2F/DPs在毛竹笋生长中的潜在作用。本研究为进一步验证E2F/DPs在毛竹中的功能提供了新的思路和一些有价值的信息。
结果
PheE2F/DP基因家族的鉴定与分类
在毛竹基因组中共鉴定出24个潜在的PheE2F/DP基因,包括一个PH02Gene25981。t1具有不完整的E2F域。寻找PH02Gene25981中是否存在不完整的E2F结构域。t1是由于在竹子基因组中错误的基因结构注释或PH02Gene25981引起的。T1只是一个假基因,我们使用了三种不同的方法来提供生物信息学和实验证据。首先,我们使用NCBI的CD-Search程序来识别整个过程中涉及的保守域PH02Gene25981.t1序列包括外显子、内含子、5′-UTRs和3′-UTRs,但未发现完整的E2F′-DD或DP结构域PH02Gene25981.t1顺序。其次,我们搜索了基因的表达信息和潜在的剪接变异体PH02Gene25981.t1在许多以前发表和未发表的转录组测序数据中,包括单分子测序数据[2,12]; 然而,没有发现有价值的信息。最后,我们为PH02Gene25981.t1 CDS和包含部分E2F结构域的外显子设计了不同的引物对。在不同的非生物胁迫下,从叶片、茎、根茎、竹笋、种子、根、花、幼苗等不同组织中分离到不同的RNA样品,作为克隆模板,但未获得CDS序列PH02Gene25981.t1从任何纸巾上。因此,我们推测PH02Gene25981。T1只是一个假基因。
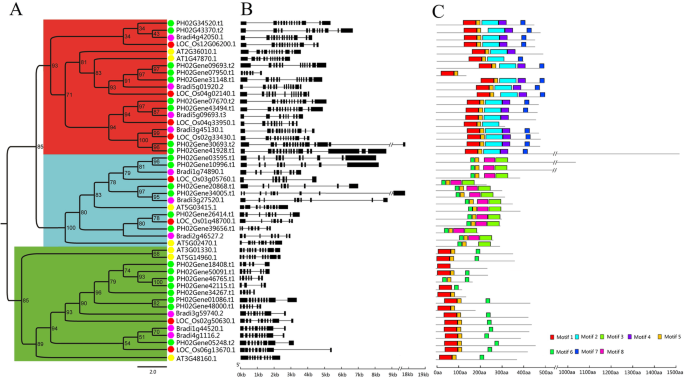
为确定毛竹与其他模式植物E2F/DP蛋白的进化关系,建立毛竹E2F/DP蛋白最大似然树,水稻,短柄草属和拟南芥构造。从毛竹中鉴定出23个PheE2F/DP基因,其蛋白可分为E2F、DP和DEL三个功能组[3.].其中9个蛋白被归为E2F组,6个归为DP组,8个归为DEL组。1a).对4种E2F/DPs的系统发育分析表明,PheE2F/DPs与OsE2F/DPs和BdE2F/DPs的序列相似性高于与AtE2F/DPs的序列相似性。例如,AT5G14960.1、AT3G01330.1和AT3G486160.1聚集在DEL组中,表明与短柄草属、大米和毛竹。
PheE2F/DP基因家族的特征分析
E2F基因结构分析/DP家族发现同一组中的基因具有相似的内含子长度和数目(图。1b). DP组内含子数为7 ~ 9个,DEL组内含子数为3 ~ 9个。E2F组的内含子平均数量远高于其他两组,内含子数量在5 ~ 16个之间。
E2F中发现了8个保存完好的主题/使用MEME在线程序的DPs(图。1c和附加文件1:图S1)。基序1和基序6分别代表E2F\ U TD结构域,基序2和基序3分别代表E2F\ U DD和DP结构域。基序2、4和7仅见于E2F组,而基序3和8仅见于DP组。大多数DEL成员与大多数E2F蛋白序列共享基序1和基序5。基序分析表明,同一组蛋白在上述保守域外具有多个相同的基序,表明同一组蛋白的功能保守。
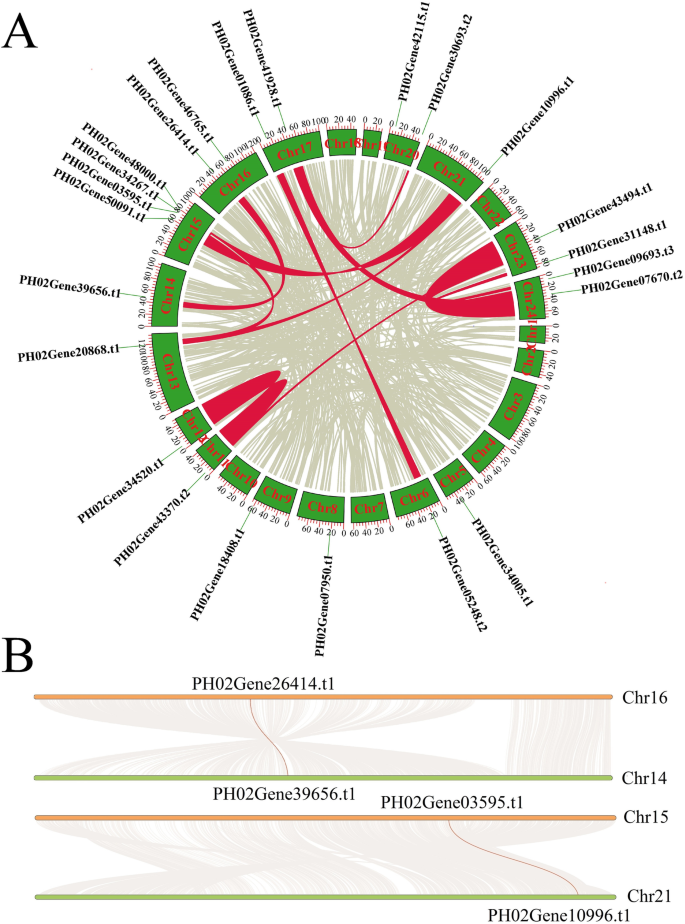
基因复制事件在产生新功能和基因扩增中起着关键作用。因此,我们分析了PheE2F/DPs的潜在复制事件。在毛竹E2F/DPs中未发现串联重复事件,但在毛竹基因组的同源区中有16个基因配对12个E2F/DP同源对(图。2a).例如,在16号染色体(chr)和14号染色体(chr)之间发现大量高度保守的共连块,其中含有Phe02Gene26414。t1和Phe02Gene39656。分别为t1(无花果。2b).在chr 15和21之间观察到类似的现象PHE02126414.t1型和PHE023656.t1型以及其他包含或不包含同源E2F/DP对的染色体对。此外,我们还计算了副同源对的发散时间(附加文件)1:表S1)。大多数PheE2F/DP基因对(8对中的7对)的差异约为6.5 ~ 13.5 mya,与毛竹全基因组重复事件(7 ~ 12 mya)相似[13],而且比O。莎蒂瓦,b . distachyon和答:芥。这些结果表明,全基因组复制事件在毛竹基因扩展中起着关键作用,包括E2F/DPs。
毛竹中PheE2F/DP的调控网络
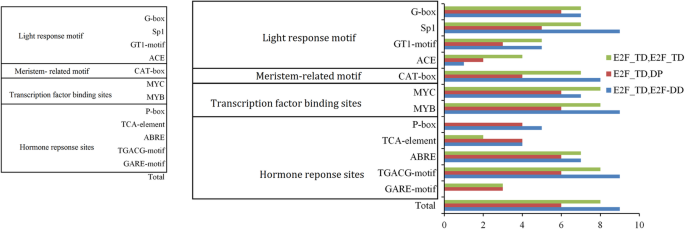
的独联体-元件位于启动子区域,对于基因表达在内外环境刺激下的空间、时间和组织特异性控制至关重要[14].因此,我们筛选独联体在所有的启动子区(2000-bp上游)的-元素PheE2F/DP型使用PlantCARE数据库的基因。大量的独联体-元件包括光响应位点、激素响应位点、转录因子结合位点和分生组织相关基序(图1)。3.). 全部23个PheE2F/DP型启动子包含至少一个光响应基序。MYB结合基序在所有23个启动子中都有发现PheE2F/DP型基因和大多数PheE2F/DP型启动子含有MYC结合元件。十三PheE2F/DP型促进剂含有对嗜酸甘油蛋白刺激的P盒或Gare图案。脱落酸反应性(ABRE)现场在PheE2F公司在21个启动子中均发现该元素。此外,对茉莉酸甲酯(MeJA)和水杨酸刺激反应敏感的TGACG基元和TCA元件也出现在大部分的水稻中PheE2F/DP型启动子区域。19个启动子包含CAT-box,一个分生组织表达相关的基因独联体-元素,表示PheE2Fs公司参与细胞分裂和增殖。此外,在比较两组之间的差异后,没有观察到显著性差异独联体表演元素。
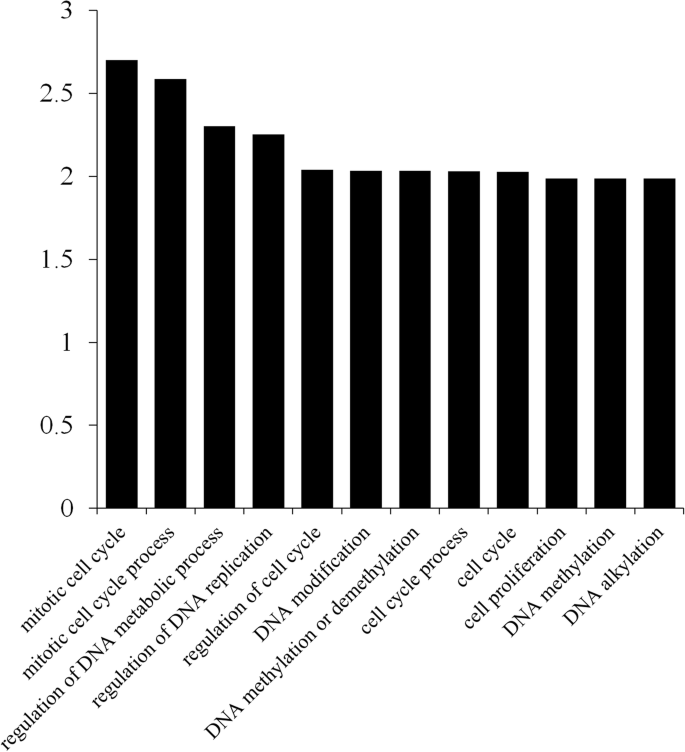
已有研究报道E2F/DP与靶基因的E2FAT(TTTCCCGCC)基序结合并调控其转录[10].因此,我们使用Plantcare筛选在Moso Bamboo Genomome中的51,074个蛋白质编码基因的启动子区域中的结合位点。最后,确定了含有其启动子区域E2F / DP结合位点的580个基因。为了探讨Phee2F / DP调节基因的潜在功能,我们进行了基因本体(GO)富集分析(图。4). 在生物过程中,基因丰度最高的群体包括有丝分裂细胞周期、有丝分裂细胞周期过程、DNA代谢过程调控、DNA复制调控和细胞周期调控。
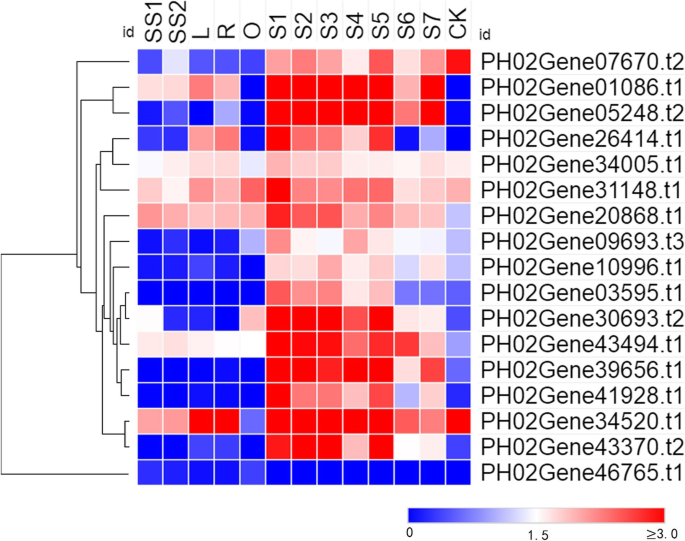
利用13个不同的茎秆组织样本的转录组数据,研究了其表达模式PheE2F / DPs。大多数E2F/DPs在冬笋(S1)和春笋中表现出较高的表达水平,尤其是在生长早期(S2-S5),与其他生长秆相比,如根茎(R)和幼苗茎(SS1和SS2)。在至少一个组织中表达的18个基因中,11个在冬笋(S1)中表现出最高的表达水平(图。5).PH02Gene34520.t1和PH0243370.t2在50cm高的竹笋(S2)中高表达PH0246765.t1表现出最高的积累水平在向外根茎(O)。ph02gene05248.t2和PH0210996.t1分别在S4(300cm高竹笋)和S5(600cm高竹笋)中高表达。表达分析结果显示PheE2F / DPs对竹笋的生长起着重要的作用,尤其是在冬季。
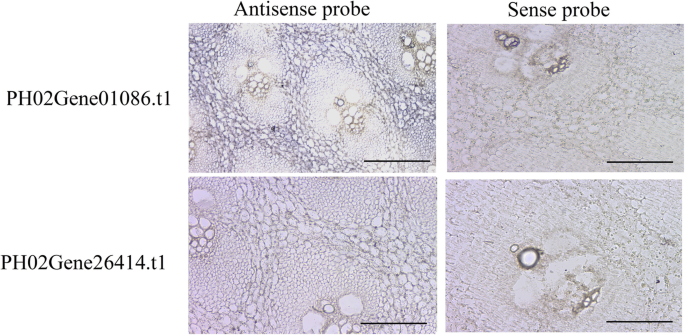
为了了解PheE2F/DPs在不同类型的茎秆生长中的调控网络,我们对来自13个不同茎秆组织样本的转录本的数量变化进行了调控测试。通过预测启动子区调控元件和PCC (R>0.90或R<-0.90)筛选得到的调控关系,共58个基因与至少一个PheE2F/DP基因存在强相关性(图1)。6). 在共表达网络中,连接次数最高的一级hub基因PH02Gene26414.t1正调控基因的表达PH0235099.t1(LSD1),PH02Gene44324.t1(ATXR3公司),电话:0209249.t1(跳)等。此外,PH02Gene05248。t2和PH02Gene01086。T1的连接次数位居第二和第三。3个枢纽基因在冬笋中均达到最高积累水平,且均受PH02Gene08546调控。PH02Gene20517 t1 (MYB)。t1 (MYB) and PH02Gene25898.t2 (MYB). In addition, all three genes regulated the expression of cell cycle-associated genes, includingPH02Gene32333.t1(CDKF公司),ph02gene29974.t1(MRB1),PH0236158.t1型(SPR2型),和PH0233706.t1(MCM2)以及与DNA复制相关的基因,包括PH02Gene32448.t3(波尔多3),PH0237503.t2(极2). 此外,许多参与RNA加工或环境胁迫反应的基因与许多E2F/DP成员具有高度的相关性。原位杂交结果显示hub基因的mRNAsph02gene01086.t1和PH0226414.t1在冬笋地上部组织中高表达,在维管束中低表达(图。7).
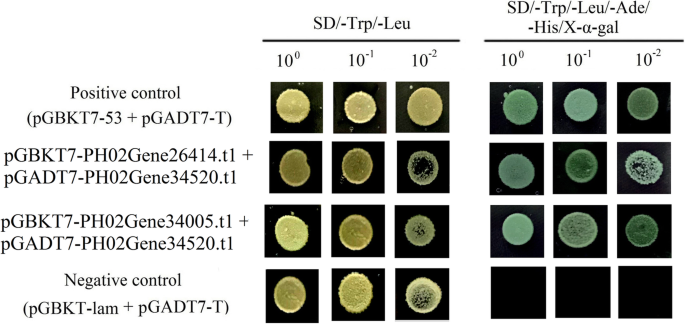
在拟南芥E2F可与DP相互作用,激活细胞周期和细胞增殖相关基因的表达[8].因此,酵母双杂化实验用于检查E2F-DP复合物是否也发生在摩尔竹中。三个枢纽基因,PH02Gene34520.t1(E2F公司),PH0226414.t1(DP),和PH02034005.t1(DP)对冬笋中积累量最高的品种进行了筛选和试验。pGBKT7-PH02Gene26414.t1的组合 + pGADT7-PH02Gene34520.t1和pGBKT7-PH02Gene34005.t1 + 将pGADT7-PH02Gene34520.t1共转化到酵母菌株AH109中。Y2H结果表明,阳性对照、阴性对照和两种转化子在SD上生长良好/−亮氨酸/−Trp介质(图。8).当转化子在SD/−Trp/−Leu/−Ade/−His/X-α-Gal培养基上生长5天后,阳性对照和实验组变蓝。阴性对照不能在含有X-α-Gal的营养选择培养基上生长。这些实验结果表明,在毛竹中,PheE2Fs可以与PheDPs相互作用。
表达模式PheE2F / DPs非生物胁迫处理与昼夜节律
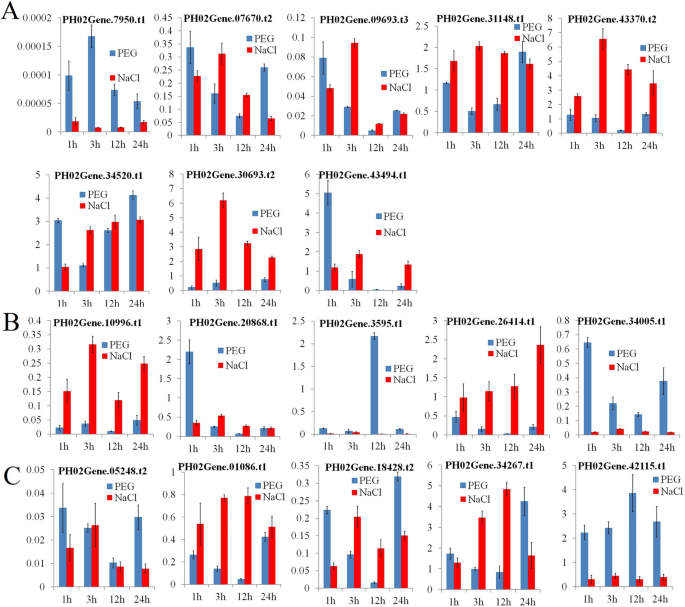
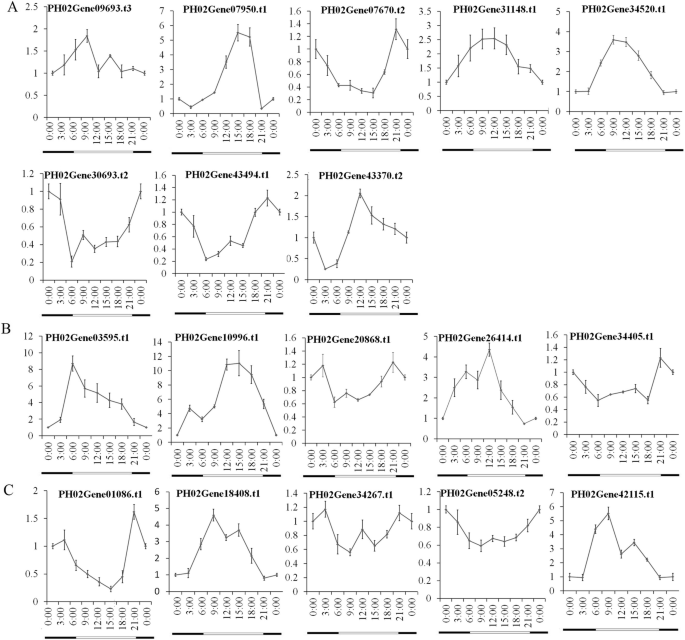
监管分析揭示了这一点PheE2F/DP型启动子包含各种类型的激素和光反应元素。激素响应元件,特别是与胁迫相关的激素如脱落酸、柠檬酸甲酯和水杨酸,表明这些基因可能受到非生物胁迫的诱导或抑制。要理解表达的变化PheE2F / DPs在非生物胁迫下,对毛竹幼苗进行了干旱(PEG)和盐分处理(Fig。9).干旱胁迫下,表达量PH02Gene07950.t1,PH02Gene07670.t2,PH02Gene09693.t3,PH0210996.t型1,PH0226414.t1,PH02034005.t1,ph02gene01086.t1,ph02gene05248.t2,和PH02Gene18408.t2被下调了,而PH02Gene34520.t1,PH02Gene34267.t1,和PH02Gene42115.t1表达上调。表达ph02gene03595.t.1,ph02gene20868.t1,和PH0243494.t1在12点达到顶峰 h、 1个 h、 和1 h、 分别。在盐胁迫下,PH0230693.t2,PH0231148.t1,PH02Gene34520.t1,PH02Gene43370.t2、PH02Gene34267.t1,PH0226414.t1,和PH0234267.t1表现出上调的表达趋势PheE2F / DPs表达量或表达下调趋势均无显著差异。
了解转录变化PheE2F / DPs在日周期中,我们研究了竹笋在4 24小时间隔 h周期(图。10).qRT-PCR分析结果显示大部分PheE2FDPs被昼夜循环调节。转录水平PH02Gene07950.t1,PH0231148.t3,PH02Gene03595.t1,和PH0226414.t115:00、09:00、06:00、12:00分别达到峰值。的转录水平PH02Gene34520.t1,PH02Gene18408.t2和PH02Gene42115.t1于4时至19时(白天)维持最高值。
讨论
毛竹E2F/DP基因家族特征
E2F/DP调控着细胞周期中多种生物过程所必需的基因的时空表达,其转录水平决定着细胞的增殖[7]. 在全基因组筛选中,毛竹中鉴定出23个E2F/DP基因,其保守结构域的数目远高于水稻(8),拟南芥(7),玉米(19) 小麦(18)和短柄草属(11) [15,16,17].毛竹的基因组大小(204mb)可与玉米(2300 Mb) [18],比小麦小得多(Triticeae) (17 Gb) [19],而且比短柄草属(300 Mb),拟南芥(164 Mb)水稻(441 Mb)[20.,21,22]. 而不是基因组大小,更高的PheE2F / DPs在毛梭的竹子表明了丰富PheE2F/DP型可能与基因组复制事件有关.前人的研究表明毛竹起源于四倍体,经历了从四倍体到二倍体的漫长进化过程,并携带了两个重复体,与二倍体相似水稻基因模型集[13,23]. 在E2F/DP家族中也观察到类似的现象。在毛竹基因组中鉴定出8对位于同线性区的PheE2F/DP同源基因对。此外,毛竹PheE2F/DP同源对的分化时间大多发生在7~12mya,与最近的全基因组复制时间一致。这些结果表明,全基因组复制事件是PheE2F/DP家族扩展的主要驱动力。
PheE2F/DP蛋白参与毛竹笋发育
近年来,一些研究表明PheE2F/DP参与了植物的许多重要生物学过程,如叶片生长[24,25,根生长[8,基因组完整性和生存能力的维持[26]环境应激反应[27].表达分析显示,超过一半的PheE2F / DPs,包括5个E2Fs公司还有四个每股股息在冬笋中表达量最高(图。5).启动子区结合位点的筛选表明,大量参与细胞周期的基因受到PheE2F/DP家族的调控,例如CDKF公司,MRB1,SPR2型和MCM2(图。6) [28],这些下游基因大多在冬季和生长期早期也表现出高表达水平。前期研究表明,竹笋夹层分生组织细胞在冬季和生长早期(S1-S5)持续旺盛生长和分裂,特别是在冬季,但后期竹笋夹层分生组织生长活性下降,细胞伸长取代了竹笋的持续生长[2]. 在拟南芥E2Fa和E2Fb与DPa相互作用调控下游基因表达[8]. 在this study, we used the Y2H assay to detect the interaction between E2Fs and DPs, and three hub genes which showed the highest accumulation levels in winter bamboo shoots were selected and further examined. The experiment results showed that the E2F-DP complex also occurs in Moso bamboo, which provides favorable evidence that the PheE2F-PheDP complex may play important roles in winter bamboo shoot growth. Thus, we concluded that the high abundance of E2F/DP genes during the winter and early growth period was essential for E2F-DP complex formation and that the E2F-DP complex vigorously promoted meristem cell growth by activating the expression of the cell cycle genes.
共表达网络分析表明PH022641.t1,ph02gene05248.t2和ph02gene01086.t1受PH02Gene08546调控。PH02Gene20517 t1 (MYB)。t1 (MYB) and PH02Gene25898.t2 (MYB). In addition, several MYB genes, such asPH0226882.t1和ph02gene09101.t1,压抑的表情E2F/DP型基因(图。6). 在烟草中,MybA1和myba2mrna在有丝分裂期波动并达到高峰,调节细胞周期基因的表达。在瞬时表达分析中,MybA1和MybA2激活了含有MSA的(M-特异性激活剂)启动子,而MybB抑制了这些启动子[29]. 在目前的研究中,所有23个启动子都含有MYB结合位点,并且大多数启动子都含有MYB结合位点E2F/DP型基因表现为正相关或负相关我的。因此,在多边投资委员会的控制下E2F/DP型基因在毛竹笋生长发育过程中对细胞周期基因的表达起着重要的调控作用。
PheE2F/DP蛋白参与胁迫和光反应
通过调控元件分析,发现PheE2F/DP启动子中存在大量的光响应位点。基于qRT-PCR的表达分析也证实了这一点PheE2F / DPs是光响应基因。基因的转录水平PH02Gene18408.t2和PH02Gene42115.t1毛竹笋在白天保持最大值,而PH0230693.t2和PH02Gene07670.t2在夜间高度表达(图。10).在拟南芥光改变了E2FC和E2FB的平衡,在细胞增殖的调节中起相反的作用。光照可提高E2FB蛋白的表达水平,进而诱导细胞周期基因的表达[30.]. 因此,我们推测PH0230693.t2和PH02Gene07670.t2,它们在夜间表现出较高的积累水平,可能是细胞周期和细胞增殖的负调控因子,夜间的高丰度可能抑制细胞周期基因的表达。白天,光线增加了植物的丰富度PH02Gene18408.t2和PH02Gene42115.t1并激活其表达,进一步促进光介导毛竹笋的生长发育。
识别监管要素PheE2F/DP型启动子表明,大部分成员含有脱落酸、MeJA和水杨酸调控元件,说明这些基因的表达可能受到某些环境线索的刺激。qRT-PCR分析也提供了证据PheE2F/DP型非生物胁迫诱导的基因(图。9).共表达网络分析表明,E2F/DPs调控了许多环境胁迫应答基因。PH02Gene44788.t1(AtRGGA),这与PH02Gene41928.t1(E2F/DP型)和PH02Gene26414。t1 (E2F/DP型),与应激反应有关。在拟南芥,AtRGGA是由盐和渗透胁迫引起的atrgga突变体对非生物胁迫表现出更高的敏感性[31]. 此外,PH02Gene25752.t1(ABA反应基因)和PH02Gene37465.t1(一种植物病毒应答基因)在网络中也受到E2F/DPs的调控[32]. 几种植物的高积累水平PheE2F / DPs在非生物胁迫下,植物对各种不利环境的抗性可能是必不可少的。
干旱和盐胁迫可能在转录水平上通过抑制盐胁迫来干扰细胞周期的调控E2F公司表达式。然而,大量新的证据表明,干旱和盐胁迫可以刺激细胞周期基因的表达。为Medicago truncatula e2fb.在高盐处理下,基因表达呈上调趋势[3.,27]. 此外,许多研究也揭示了细胞周期调控因子的积累水平与盐胁迫的关系。表达选用CDKC1,参与细胞增殖和分化,是NaCl处理通过ABA信号通路触发的[33]. 在拟南芥,CDC2aAt公司,一个细胞周期蛋白依赖激酶编码基因和两个有丝分裂细胞周期蛋白基因,即,Arath; CycB1; 1和Arath; CycA2; 1,在盐胁迫期间进行监测[34]. 在mammals, many E2F members act as key factors in the DNA damage-dependent expression regulation of cell cycle genes [35].许多PheE2F/DPs在非生物胁迫下表现出较高的积累水平,可能有利于竹子在恶劣环境下的生长。总的来说,PheE2F公司/每股股息参与了毛竹不同的生物过程。
结论
结果表明,毛竹基因组共鉴定出23个PheE2F/DPs基因,其中E2F基因9个,DP基因6个,DEL基因8个。的独联体-参与光周期反应、激素信号传导、分生组织生长以及许多MYB和MYC2结合位点的作用元件存在于细胞中PheE2F/DP型启动子。最近的全基因组复制在E2F/DP家族扩增中发挥了重要作用。转录组测序和原位杂交分析表明E2F/DPs系统在竹笋生长中起重要作用,尤其在冬季。qRT-PCR的表达谱表明E2F/DP型表达受到各种形式的非生物胁迫和日循环的刺激。这些结果为进一步深入了解毛竹E2F/DP基因家族奠定了基础,为进一步验证毛竹E2F/DP基因家族的功能奠定了基础。
方法
数据库搜索
的E2F/DP型序列拟南芥(拟南芥),水稻(大米),Broachypodium distachyon.(短柄草属)从拟南芥信息资源(Tair)下载[36],水稻基因组注释项目[37],和Broachypodium distachyon.基因组数据库[38], 分别。发表AtE2F/DP型和OsE2F/压差然后使用默认参数对当地竹子蛋白数据库进行BLASTP搜索查询。当e值≤−10时,认为序列与预测的E2F/DPs一致。最后,利用蛋白家族数据库(Pfam)对每个候选E2F/DP序列进行确认。
植物材料
龙里在广德县(E119°41′)采集了毛竹笋及其它竹秆样品;N30°89′),安徽省,2018年1月至8月(补充文件1:图S2)。这些茎秆样品的正式鉴定由Li等人完成[2]. 将竹材样品冷冻在液氮中,在室温下保存− 80 在提取RNA之前,°C。从广德县林业局获得了采集试验用竹笋和其他竹竿样品的许可。龙里在桂林大靖县(E110°179′)采集毛竹种子;2018年7-9月广西壮族自治区N25°049′)(补充资料)1:图S2)。必要的野外工作许可证是从桂林林业局获得的。这些种子的正式鉴定由Gao等人完成[39]. 此外,the sample collection work did not affect the ecology and did not involve protected species.
4:00~19:00在人工气候室中进行昼夜节律表达实验,龙立每3天采集一次竹材组织 从一个月龄的竹苗开始,在48小时的时间内。在每个时间点汇集5个表现出相似生长模式的个体,并对每个样本进行3次生物重复。
对于非生物胁迫处理,在长日照条件下(15℃)在人工气候室中生长竹子幼苗 光速/9 (黑暗中的h)。采用18%PEG6000培养基对两个月龄的苗木进行干旱胁迫试验。用含250%的培养基对两个月大的幼苗进行了盐胁迫试验 毫米氯化钠。龙里在1、3、12、24日采收 非生物胁迫处理后h。以自来水灌溉的幼苗为对照。植物样品在液氮中冷冻,并在低温下保存− 80 °C使用前。在每个时间点汇集5个表现出相似生长模式的个体,每个样本采用3个生物重复。凭证标本存放于北京国际竹藤中心植物标本室,目录号:ICBR-B-18101(竹笋)、ICBR-B-18201(根茎)、ICBR-B-18301(外根茎)、ICBR-B-18401(苗茎)、ICBR-B-18501(种子)、ICBR-B-18601(苗叶)。
基因结构、保守基序与调控元件分析
基因结构显示服务器程序(GSDS)基于带有默认参数的GFF注释文件研究E2F/DP的基因结构[40].使用MOTIF ELICITION计划(MEME)的多个EM来识别所识别的E2F / DP序列中的保守基序[41]. 模因是使用以下参数在本地运行的:重复次数-任意,最大模因数-8,最佳模因宽度限制在25到200个残基之间。
转录起始位点(mRNA起始位点)被指定为+ 1并通过从GigaDB下载的GFF文件获得,GigaDB是毛竹基因组注释项目的新版本[23].的启动子区中的调控元件PheE2F / DPs以及其他51050个毛竹基因(来自− 2000 bp至+ 1. bp)进行分析[14,42]. 基于BLASTX方法,利用TBtools对所有毛竹基因进行GO注释。BLASTX结果的e值截止值为1e−6用GO术语标注的相似度最小为55%。含E2F/DP结合位点基因的启动子通过TBtools进行基因本体(GO)富集分析[43].
共线性分析
研究含有E2F/DP型基因,同源性数据来自使用BLASTN进行的蛋白质-蛋白质比较,E值截止值为1e-6,其他参数为默认值或推荐值。利用MCScanX对BLASTP结果进行了分析,找出了它们之间的共线区域PheE2F/DP型基因以及其他贯穿整个基因组的共线性块。最小块大小为5,其他参数为默认值或建议值。利用TBtools软件提取共线性块,绘制PheE2F/DPs共线性图。
同源对发散时间的估计
使用DNA序列多态性软件(DNASP)计算旁阻胆对之间的KA(非纯类替代),KS(同义替代)和KA / KS比。公式T = ks /2λ用于估计复制事件的发散时间,发散率λ= 6.5×10−9单子叶和1.5 × 10−8在二榫薄膜[44].
多序列比对与系统树构建
ClustalW程序使用默认设置的全长E2F/DP氨基酸进行多序列比对。用于运行CLUSTALW程序的参数如下:氨基酸序列的评分矩阵:BLOSUM62,gap open:10,gap extension:0.2,迭代:none。利用IQ-tree软件建立了最大似然树模型,并采用JTT + 根据贝叶斯信息准则,R3是最优模型。采用bootstrap方法进行了1000个重复的系统发育测试。之后,将结果导入FigTreeV1.4.2软件进行处理。
RNA提取、逆转录和qRT-PCR分析
使用TRIzol试剂(Invitrogen,美国)从每个样品中分离总RNA。用2 根据制造商的说明,使用PrimeScriptTM RT试剂盒(日本TaKaRa)获得μg RNA。根据制造商的指示,使用SYBR绿色化学(德国曼海姆罗氏)在Light Cycler 480仪器(瑞士罗氏罗特勒兹罗氏)上进行qRT PCR实验。引物3在线程序用于基因特异性引物设计(附加文件)1:表S2)[45]. 每个实验采用三个生物重复和三个技术重复。TIP41被选为内部控制[46].使用2计算最终相对表达水平-△△Ct法。
转录组数据分析
转录组数据PheE2F / DPs(PRJNA354950, PRJNA604634, PRJNA706151) [2,12]. 这些转录组数据来自不同类型的生长秆,包括1.5厘米高的幼苗茎(SS1)、8厘米高的幼苗茎(SS2)、侧芽(L)、根茎(R)、外根茎(O)和不同生长阶段的竹笋(冬笋和50、100、300、600、900和1200厘米高的笋,命名为S1-S7,分别(附加文件1:图S2)。叶片展开后,将其秆标记为CK。4个生长茎秆(S1、O、SS1和R)在茎秆长度达到最终长度的十分之一时取样。表达丰度PheE2F / DPs以外显子模型每千碱基每百万次映射读取的片段数(FPKM)来衡量。热图是用R。
PheE2Fs调节网络
通过靶基因启动子的调控元件预测转录因子-靶基因(TF-TG)的相互作用。采用皮尔逊相关系数(PCC)法,通过R程序计算基因表达相关性。只有PCC值≥+ 0.90或<−0.90的转录因子(TF)和靶标关系被保留用于共表达网络的构建。最终使用Cytoscape 3.7.0软件对网络进行可视化。
原位杂交
竹笋组织在4%多聚甲醛中固定一天 °C,然后如前所述进行杂交[2].具体的探针ph02gene01086.t1和PH0226414.t1采用具有T7和SP6 RNA聚合酶结合位点的基因特异性引物进行PCR扩增。这些图片是使用奥林巴斯尼康E600相机拍摄的。
酵母双杂交测定
为了测试E2F能否与毛竹中的DP交互,我们采用了Matchmaker GAL4双混合系统(Clontech, Palo Alto, CA)。基于融合克隆方法(Clontech, Palo Alto, CA), PH02Gene26414全长。t1和PH02Gene34005。t1 cdna分别克隆到pGBKT7,全长PH02Gene34520。t1 cdna被克隆到pGADT7(附加文件1:表S3)。接下来,pGBKT7-PH02Gene26414.t1的组合 + pGADT7-PH02Gene34520.t1和pGBKT7-PH02Gene34005.t1 + 将pGADT7-PH02Gene34520.t1共转化到AH109酵母菌株中。转化酵母在SD上培养/−色氨酸/−4的Leu 然后转到SD/−色氨酸/−亮氨酸/−阿德/−His/X-α-Gal板5片 天。含pGBKT7-53的共转化子 + pGADT7-T和pGBKT7 Lam + 分别选取pGADT7-T作为阳性对照和阴性对照。
数据和材料的可用性
所有RNA序列原始数据可在NCBI获得,注册号为PRJNA354950(https://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA354950),PRJNA604634号(https://www.ncbi.nlm.nih.gov/bioproject/?term=prjna604634),PRJNA706151号(https://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA706151).
缩写
- 阿坝:
-
脱盐酸
- ABRE:
-
脱落酸反应性
- 疾病预防控制中心:
-
细胞分裂周期
- CDKC公司:
-
细胞周期蛋白依赖激酶C
- 克雷斯:
-
顺式调节元件
- DNnaSP公司:
-
DNA序列多态性
- FPKM:
-
每千碱基外显子模型的片段每百万次读取
- GSD编号:
-
基因结构显示服务器程序
- 走:
-
基因本体论
- 灵魂:
-
产生的替换
- ks:
-
同义替换
- 兆:
-
分子进化及遗传学分析
- 惩罚:
-
茉莉酸甲酯
- 模因:
-
多重em用于基序诱导
- 迈亚:
-
几百万年前
- NJ:
-
Neighbor-joining
- PCC公司:
-
皮尔逊相关系数
- 包含了:
-
蛋白质家族数据库
- 钉:
-
聚乙二醇
- 存在:
-
定量实时PCR
- 塔尔:
-
拟南芥信息资源
- TF-TG型:
-
转录因子靶基因
- 第二年:
-
酵母两个杂交
参考
- 1.
魏琦、郭力、焦聪、丁一林、高S、郭力、陈梅、胡平、夏思杰、任国德、费志杰。竹子快速生长期节间伸长发育动态的研究。树木生理学。2019;39(7):1201–14.https://doi.org/10.1093/treephys/tpz063.
- 2.
关键词:毛竹,茎生长,激素,信号转导,转录,解剖学植物生态学报;2018;https://doi.org/10.1111/pbi.12750.
- 3.
关键词:盐胁迫,E2F/DP基因,转录因子,表达分析Medicago truncatula.基因染色体组。2014;36(6):819 - 28。https://doi.org/10.1007/s13258-014-0218-5.
- 4.
Ramirez-Parra E, Lopez-Matas MA, Frundt C, Gutierrez C拟南芥细胞生长和分化。植物细胞。2004;16(9):2350–63.https://doi.org/10.1105/tpc.104.023978.
- 5.
del Pozo JC、Boniotti MB、Gutierrez C。拟南芥E2Fc在细胞分裂中起作用,在光照下被泛素-SCFAtSKP2途径降解。植物细胞。2002;14(12):3057–71.https://doi.org/10.1105/tpc.006791.
- 6.
del Pozo JC、Diaz Trivino S、Cisneros N、Gutierrez C。细胞分裂和内复制之间的平衡依赖于E2FC-DPB,即泛素-SCFSKP2A途径调控的转录因子拟南芥.植物细胞。2006;18(9):2224 - 35。https://doi.org/10.1105/tpc.105.039651.
- 7.
Magyar Z,Bogre L,Ito M。梦使植物细胞循环或静止。植物生物学。2016;34:100–6.https://doi.org/10.1016/j.pbi.2016.10.002.
- 8.
Sozzani R, Maggio C, Varotto S, Canova S, Bergonioux C, Albani D, Cella R.相互作用拟南芥激活因子E2Fb和E2Fa参与细胞周期的进程和发展。植物杂志。2006;140(4):1355 - 66。https://doi.org/10.1104/pp.106.077990.
- 9.
Polager S,Ginsberg D。E2F-在生与死的十字路口。细胞生物学趋势。2008;18(11):528–35.https://doi.org/10.1016/j.tcb.2008.08.003.
- 10.
拉米雷斯·帕拉E、弗林德C、古铁雷斯C。小鼠E2F调控基因的全基因组鉴定拟南芥. 植物J。2003;33(4):801–11.https://doi.org/10.1046/j.1365-313X.2003.01662.x.
- 11.
闫晓燕,蒋涛,王秀琴,邱胜华,刘炳柏。毛竹E2F/DP转录因子基因家族的鉴定及相关表达分析Mol Plant Breed. 2018; 16:6997-7003。
- 12.
王T,王H,蔡D,高YB,张HX,王YS,林CT,马利,顾LF。毛竹根茎相关的选择性剪接和选择性多聚腺苷酸化的综合分析(植被类型). 植物J。2017;91(4):684–99.https://doi.org/10.1111/tpj.13597.
- 13.
彭哲,陆毅,李立斌,赵Q,冯Q,高志敏,陆海云,胡特,姚恩,李凯,等.速生非用材林毛竹的基因组草案(毛竹). 纳特·吉内特。2013;45(4):456–61.https://doi.org/10.1038/ng.2569.
- 14.
Magali L, Patrice D, Gert T, Kathleen M, Yves M, Yves VP, Pierre R, Stephane R. PlantCARE:植物顺式调控元件数据库和启动子序列分析工具的门户。核酸杂志2002;30:25 - 7。
- 15
路易莎M,芭芭拉P,丽塔C,丽贝卡S,凯瑟琳B,里诺C,迭戈A。转录因子E2F家族拟南芥。植物视网膜母细胞瘤/E2F途径的新的和保守的成分。生物化学杂志。2002;277(12):9911–9.
- 16
库珀B、和记黄埔D、帕克S、吉米尔S、卢金布尔P、埃莱罗C、戈夫SA、格拉泽布鲁克J。水稻的鉴定(水稻)与细胞周期素介导的细胞周期调节有关的蛋白质。中国生物医学工程学报,2003;
- 17
金杰,田芙,杨德才,孟玉琴,孔丽,罗建春,高庚。PlantTFDB 4.0:植物中转录因子和调控相互作用的中心枢纽。核酸研究,2017年;45(D1):D1040–5。
- 18
关键词:植物基因组学,植物基因组学,植物基因组学核科学与技术2008;36:D959。
- 19.
国际小麦基因组测序联合会。六倍体面包小麦的染色体草图序列(小麦)基因组。科学2014;345:1251788,基于染色体的六倍体面包小麦(Triticum aestivum)基因组草图,6194,DOI:https://doi.org/10.1126/science.1251788.
- 20
Burr B.绘图和测序水稻基因组。植物细胞。2002; 14(3):521-3。https://doi.org/10.1105/tpc.140310.
- 21
国际短足类动物倡议。模式草基因组序列分析Broachypodium distachyon.:草基因组进化的洞见。大自然。2010;463(7282):763 - 8。https://doi.org/10.1038/nature08747.
- 22
Fileichkin sa,牧师高清,givan sa。替代拼接的基因组映射拟南芥.基因组研究》2010;20(1):45-58。https://doi.org/10.1101/gr.093302.109.
- 23
赵海华,高振华,王玲,王金玲,王sb,费波,陈超,石超,刘旭,张辉毛竹染色体水平参考基因组及选择性剪接图谱(植被类型). GigaScience公司。2018;7:1–12.
- 24
Bénédicte D、Elena RP、Qi X、Chua NH、Crisanto G。视网膜母细胞瘤/E2F通路在肿瘤发生中的细胞类型特异性作用拟南芥叶的发展。植物杂志。2005;140(1):67 - 80。
- 25
埃里卡·P、卡萨巴·P、比尼什·M、阿拉德·P、廷德·L。E2FB与视网膜母细胞瘤相关基因相互作用,在叶片发育过程中调节细胞增殖。植物生理学。2020;182(1):518–33.
- 26
Horvath BM、Kourova H、Nagy S、Nemeth E、Magyar Z、Papdi C、Ahmad Z、Sanchez Perez GF、Perili S、Blilou I。拟南芥视网膜母细胞瘤相关基因通过细胞周期调控以外的功能直接调节DNA损伤反应。EMBO J。2017;36(9):1261–78.https://doi.org/10.15252/embj.201694561.
- 27
李德、苏兹、董杰、王婷。豆科模式植物根的表达数据库Medicago Truncatula在盐胁迫下。BMC基因组学。2009;10(1):517.https://doi.org/10.1186/1471-2164-10-517.
- 28.
Klaas VK, Vlieghe K, Florqui LH, Gerrit TSB, Wilhelm G, Yves VP, Dirk I, Lieven DV。植物E2F潜在靶基因的全基因组鉴定。植物杂志。2005;139:316-28。
- 29.
Ito M, Araki S, Matsunaga S, Itoh T, Nishihama R, Machida Y, Doonan JH, Watanabe A.植物细胞周期中的G2/M期特异性转录是由c- myb样转录因子介导的。植物细胞。2001;13(8):1891 - 905。https://doi.org/10.1105/tpc.010102.
- 30
Enrique LJ, Edyta D, Zoltán M, Safina K, Saul H, Sarah M, James AHM, Gerrit TS, László B, Hugh PS.不同光启动基因的表达和细胞周期程序拟南芥.植物细胞。2008;20(4):947 - 68。
- 31
Alfredo A,Giorgia B,Roberta N,Vincenzo A,Paola P,Dhinoth KB,IDA R,Massimiliano S,Antonietta L,Antonello C,Stefania G.拟南芥ATRGGA RNA结合蛋白调节盐和干旱胁迫的耐受性。植物理性。2015; 168(1):292-306。
- 32.
AtYY1是一种具有双重功能的转录因子,是一种新型的转录负调控因子拟南芥ABA反应网络。摩尔。2016;9(5):650 - 1。https://doi.org/10.1016/j.molp.2016.02.010.
- 33.
黄耀文,蔡伟生,陈长青,林春旺,黄洪杰。盐胁迫下水稻c型周期蛋白依赖蛋白激酶基因Orysa的表达增加植物生理学杂志。2008;46(1):71-81。https://doi.org/10.1016/j.plaphy.2007.10.013.
- 34.
在盐胁迫下,细胞周期调控基因的表达和形态变化对盐胁迫的响应拟南芥.Planta。2000; 211:632-40。
- 35.
Mitxelena J, Apraiz A, Vallejo-Rodríguez J, García-Santisteban I, Fullaondo A, Alvarez-Fernández M, Malumbres M, Zubiaga AM。一个依赖e2f7的转录程序调节DNA损伤修复和基因组稳定性。核酸研究2018;9:9。
- 36.
Berardini TZ、Reiser L、Li D、Mezheritsky Y、Muller R、Strait E、Eva HL。这个拟南芥信息资源:制作和挖掘“金标准”注释参考植物基因组。《创世纪》。2015;53(8):474 - 85。https://doi.org/10.1002/dvg.22877.
- 37.
Yoshihiro k,Bastide M,汉密尔顿jp,Kanamori H,McCombie WR,欧阳S,Schwartz DC,Tanaka T,Wu J,Zhou S,Childs KL,Davidson RM,Lin H,Quesada-Ocampo L,Vaillancourt B,Sakai H,Sakai H,Lee Ss,Kim J,Numa H,Itoh T,Buell Cr,Matsumoto T.改进水稻使用下一代序列和光学图谱数据的日本裸鼠参考基因组。米饭。2013;6:4.
- 38.
Vogel JP、Garvin DF、Mockler TC、Schmutz J、Rokhsar D。模式草的基因组测序与分析Broachypodium distachyon..大自然。2010;463(7282):763 - 8。
- 39
高杰,张勇,齐飞,李世平,穆世,彭志。毛竹(Phyllostachys edulis)不同开花发育阶段花转录组序列测定及RNA-seq分析。公共科学图书馆一号。2013;9(6):e98910。
- 40
胡乙、金日平、郭艾、张赫、罗希杰、高庚。gsds2.0:一个升级的基因特征可视化服务器。生物信息学。2015;31(8):1296–7.https://doi.org/10.1093/bioinformatics/btu817.
- 41
作者简介:Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME SUITE:用于主题发现和搜索的工具。核酸研究2009;37: W202-W208, Web服务器,DOI:https://doi.org/10.1093/nar/gkp335.
- 42
姜奕、段奕杰、尹杰、叶SL、小朱、张福清、卢文X、范D、罗KM。全基因组鉴定和鉴定杨属WRKY转录因子家族及其在生物和非生物胁迫响应中的表达分析实验机器人。2014;65(22):6629-44。https://doi.org/10.1093/jxb/eru381.
- 43
马乔夫斯基EE,道斯S,米兹拉希V。结核工具-分枝杆菌研究的分子遗传学方法。国际生物化学细胞生物学杂志2005;37(1):0–68,54,DOI:https://doi.org/10.1016/j.biocel.2004.06.012.
- 44
曹杰,黄杰丽,杨玉萍,胡XY。杨树和葡萄寡肽转运蛋白基因家族分析。BMC基因组学。2011;12(1):465.https://doi.org/10.1186/1471-2164-12-465.
- 45
Koressaar T,Lepamets M,Kaplinski L,Raime K,Andreson R,REMM M. Primer3_Masker:用底漆设计软件集成模板序列的屏蔽。生物信息学。2018; 34(11):1937-8。https://doi.org/10.1093/bioinformatics/bty036.
- 46
范C、马J、郭Q、李X、王H、陆M。竹子荧光定量PCR参考基因的筛选(植被类型).《公共科学图书馆•综合》。2013;8 (2):e56573。https://doi.org/10.1371/journal.pone.0056573.
确认
不适用。
资金
本课题得到了国家重点研究开发项目(2018YFD0600101)的资助;陕西省省自然科学基金(批准号2019JQ-402),由陕西省科技厅资助;国际竹藤中心资助的国际竹藤研究中心基础研究基金(批准号1632018006);西北农林科技大学博士生科研基金资助项目(批准号:Z109021715),是西北农林科技大学资助的课题。每一个资助机构都是根据一份研究提案来发放资金的,资助者在研究设计、数据分析和手稿准备方面都没有发挥任何作用。
作者信息
从属关系
贡献
L.L.进行生物信息学分析、样本收集、实验并起草手稿。Q.S.和Z.L.帮助进行生物信息学分析和生理学实验。J.G.设计了实验并构思了项目,对研究进行了全面监督并修改了手稿。所有作者都已阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
竹笋许可和实验的其他秆样品收集是从京县林局获得的。从桂林林局获得实验的竹子种子收集许可。
同意出版
不适用。
相互竞争的利益
所有作者均声明没有利益冲突。
附加信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1
.PheE2F蛋白中不同基序的序列标识。图S2.用于毛竹组织的表达分析。表S1.估计发散期E2F/DP型四种物种的基因对。表S2.引物序列用于qRT-PCR。表S3. 用于基因克隆的引物序列
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用本文
李磊,史强,李卓。等。毛竹中PheE2F/DP基因家族的全基因组鉴定与功能分析BMC植物生物学21,158(2021)。https://doi.org/10.1186/s12870-021-02924-8
收到:
接受:
发表:
关键词
- E2F/DPs系统
- 毛竹
- 表达式
- 细胞周期
- 笋