摘要
背景
芝麻(胡麻属indicum)炭腐病,一种由真菌引起的破坏性疾病Macrophomina phaseolina(Tassi) Goid (MP)是芝麻产量和品质的一大威胁。然而,关于芝麻与MP之间基因对基因关系的信息尚不清楚,相互作用背后的分子机制也尚不清楚。本研究的目的是基于转录组学分析芝麻抗病(DR)和病感(DS)基因型抗MP的分子机制。这是首次用该方法报道芝麻与MP相互作用。
结果
通过比较转录组学研究发现了一组对MP有应答的核心基因,这些基因优先与核糖体相关过程、果实成熟和茉莉酸介导的信号通路调控等氧化石墨烯相关术语相关。DR的翻译机制和转录机制可以共同激活,从而更快地启动对MP的免疫。通过对两种基因型间差异表达的基因进行加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA),我们发现富含亮氨酸重复受体样激酶(LRR-RLK)蛋白可能在芝麻抗MP中起重要作用。值得注意的是,与DS相比,DR诱导了大多数关键基因,如模式识别受体(PRRs)和抗性基因,这表明DR启动了更强的模式触发免疫(PTI)和效应者触发免疫(ETI)。最后,研究表明JA/ET和SA信号通路都在芝麻抗MP中发挥重要作用。
结论
芝麻对MP的防御反应是一个复杂的生物过程,涉及许多植物激素和抗病相关基因,在我们的研究中,在转录水平上得到了说明。这些发现为进一步了解耐药和易感芝麻对MP的不同反应提供了更多的线索。
背景
植物已经进化出复杂的信号系统和分子机制,以应对不断变化的环境中各种生物和非生物胁迫[1].2006年,植物先天免疫的概念首次被提出。模式触发免疫(Pattern-triggered immunity, PTI)和效应者触发免疫(effect -triggered immune, ETI)是植物与病原相互作用长期共同进化过程中的两个重要机制[2].尽管PTI很弱,但它对植物来说是必不可少的,是抵御病原体的第一道防线。3.].PTI可由病原菌相关分子模式(pathogen-associated molecular patterns, PAMPs)触发,随后细胞壁增厚、细胞壁木质化、phytoalexin的产生和PR基因的诱导表达。然而,一些病原体可以通过向植物分泌效应物来抑制和突破PTI的防御。植物已经发展出一种侦察机制来感知和识别这些效应物,这导致了ETI。PTI和ETI都参与植物的早期防御反应。它们具有比较功能,防御信号转导的早期诱导和下游分子网络反应也可以在生理水平上观察到,如活性氧(ROS)的爆发,有丝分裂原活化蛋白激酶(MAPK)通路的激活和胼胝质的聚集[4].活性氧中间体的产生,特别是超氧阴离子自由基的爆发和过氧化氢的积累,被认为是植物对外部病原体的早期防御反应,是植物必要的自身免疫反应过程[5].ROS,包括O2−H2O2和何−,主要聚集在叶绿体和线粒体中,它们可以对脂质、蛋白质、核酸和光合作用装置造成氧化损伤。为了减少氧化危害,植物产生不同类型的抗氧化酶,如超氧化物酶歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)来清除ROS,增强抗病性。同时,H2O2通过POD同样可以产生有毒物质来抵御入侵的微生物,抑制病原体的增殖和扩散[6].ROS被认为是植物防御的重要信号成分[7,8].
碱性螺旋-环-螺旋(bHLH)蛋白属于TF超家族,广泛分布于真核生物中。bHLH超家族的成员通常包含两个高度保守且功能不同的结构域:与DNA结合的n端基本区域[9],主要识别E-box和G-box [10],以及c端HLH结构域,该结构域依赖疏水氨基酸相互作用形成两个HLH蛋白的同二倍体或异二倍体,并调节下游靶基因的表达[11,12].bHLHs经常与其他TF家族的成员合作,调节和诱导一系列次级代谢产物的生物合成,如萜类、生物碱、苯丙类和花青素等,它们在调节植物与环境之间的相互作用中起着重要的作用[13,14].目前,越来越多的研究表明bHLHs与各种植物的生物或非生物胁迫反应有关[15,16,17].
芝麻属于脚豆科,是最具优势和营养价值的油料作物之一,含油量为50-60%,蛋白质含量为20-30%。此外,它还富含不饱和脂肪(约85%)和天然抗氧化剂,如芝麻醇、生育酚和营养物质E [18,19].这些抗氧化剂具有显著的健康促进作用,如降低胆固醇和高血压,降低某些癌症的发病率,并对缺氧提供神经保护作用。随后,全球对芝麻的需求不断扩大。然而,在中国,芝麻易受多种病原体的侵害,这是导致芝麻产量低且不稳定的主要原因。此外,相对于其他作物,关于芝麻的基础研究还比较匮乏,这也是芝麻产量低的原因之一。研究芝麻的基础遗传学和分子生物学,对提高芝麻抗生物胁迫能力具有重要意义。
芝麻炭腐病一般发生在芝麻开花期末、成熟期前,在炎热干燥的天气或高环境胁迫下,病斑开始出现并从根或茎向外扩散。这是由种子和土壤传播的真菌MP引起的,它具有高度传染性,可以感染超过500种植物。木炭腐烂通常会使芝麻产量减少10-15%,严重情况下甚至超过80%。此外,它还会使芝麻含油量降低4.2-16.2%,从而同样影响芝麻的质量[20.].因此,揭示芝麻的抗性机理,筛选芝麻中的抗性基因,培育抗性品种,有助于减轻芝麻的产量损失。不幸的是,由于缺乏已知的分子机制和芝麻与MP相互作用中基因对基因关系的信息,芝麻的遗传改良进展缓慢。随着芝麻基因组的发表[21,22],关于芝麻的研究日益活跃。迄今为止,有关芝麻与MP相互作用的转录组的研究尚未发表。
因此,本研究通过比较分析芝麻抗性基因型DR和易感基因型DS接种MP后的转录组数据,初步探索芝麻抗MP的分子机制,为芝麻遗传改良提供基础理论研究。
结果
MP接种后DS和DR的根系表型
根据芝麻根感染表型的结果,我们发现MP接种后DR和DS之间存在差异(图2)。1).接种前,DS和DR的根无显著差异。接种后12 h, DS根部出现散发性黑点,而dr无明显症状。接种后24 h, DS根部黑点明显增多,部分根部坏死。而此时DR的根部刚刚出现黑点。随着时间的推移(36 HPI和48 HPI), DS中黑点逐渐向整个根扩散,坏死区域进一步扩大,而DR中黑点变化不明显,48 h内根内未见明显坏死。进一步说明DS对MP易感,DR对MP高度耐药。
Illumina测序和基因组比对
对接种后5个时间点(0 HPI、12 HPI、24 HPI、36 HPI和48 HPI)的植株及其生物重复进行测序,获得30个转录组。测序质量评价表明,所有样品的测序结果都很好,碱基分布平衡,平均Q值约为36。从30个文库中生成超过24亿个raw reads,去除适配器序列、低质量reads和rRNA序列后,获得约23.37亿个clean reads (clean ratio > 95.69%)用于后续分析。平均而言,95.89%的reads可以映射到芝麻的参考基因组,大部分(88.28%)可以映射到编码区(附加文件:表S1).
通过样本之间的Pearson相关系数检验样本之间的关系(图。2)和主成分分析(PCA)(附加文件:图S1).我们选择了在生物学重复(R2> 0.96)。此外,我们还可以看到两个样本DS 0 h-2和DR 48 h-3是基于PCA的严重异常值。因此,ds0 h-2和DR 48 h-3被排除在后续分析之外。PCA分析还显示,对照组(0 HPI)与处理组之间存在很大差异,这表明MP诱导芝麻转录组发生了许多不同的变化,可能存在一些抗性相关基因在芝麻与MP的相互作用中。
响应MP的核心基因集
为了了解两种基因型中芝麻与MP相互作用的整体转录组变化,将FPKM值大于0.1的基因视为表达基因。DS共检测到22,049、22,114、21,961、21,712和22,032个基因,DR在0 HPI、12 HPI、24 HPI、36 HPI和48 HPI分别检测到22,514、22,036、22,032、22,049和22,100个基因。在DS和DR的所有时间点也分别观察到23,042和23,217个基因的表达(附加文件:图S2A).有22,761个基因(96.9%)在DS和DR中同时表达,281个基因(1.2%)在DS中特异表达,456个基因(1.9%)在DR中特异表达(补充文件:图S2B)。
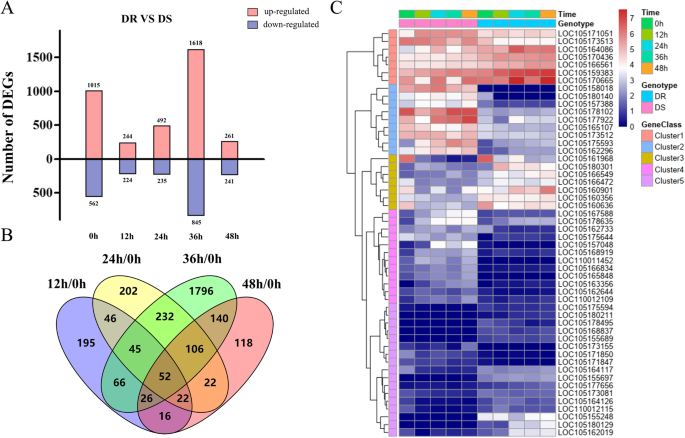
为了研究芝麻对MP反应的相关基因,在假发现率(FDR) < 0.01和|log2-fold change| > 1的标准下鉴定差异表达基因(DEGs)。如附加文件所示3.接种后4个时间点,A、3607、3876、3336、3359 DEGs显著上调,2839、3684、4329、2956 DEGs显著下调;DR、2304、2410、2485、2600 DEGs显著上调,2803、2703、3091、2394 DEGs显著下调。由此可见,在接种后48 h内,DR的总体DEGs (4994 ~ 5576 DEGs)明显少于DS (6315 ~ 7665 DEGs),且各时间点DR对胁迫反应的DEGs数量均显著少于DS。这表明MP对DR的伤害可能比DS小得多,这可能会在较小程度上改变转录组表达谱,使植物更容易应对胁迫。
进一步对DS和DR四个时间点上调和下调的DEGs进行重叠分析,发现DS和DR共上调基因分别为1977个和1320个,共下调基因为1791个和1357个。为了识别响应MP的核心基因集,我们比较了DS和DR之间的重叠DEGs,发现在两种基因型之间有867个上调的DEGs和721个下调的DEGs重叠(附加文件:图S3.B)。
通过分析上述核心基因组GO项的富集情况,研究基因对MP的潜在响应功能。867个上调的DEGs主要富集在核糖体相关的过程中,其次是硫胺焦磷酸结合、LSU-rRNA从三tristronic rRNA转录的成熟(SSU-rRNA, 5.8S rRNA, LSU-rRNA)、果实成熟、酰基甘油脂肪酶活性和对革兰氏阴性细菌的防御反应(图)。3.a).同样,721个下调的DEGs富集程度最高的主要术语是茉莉酸介导的信号通路调控、udp -半乳糖基转移酶活性、细胞-细胞信号传导、对冷冻的反应和二级细胞壁生物发生的调控(图2)。3.b)。
DEGs在DR中唯一上调
为了研究DR抗病性的功能特异性,我们研究了DR与DS中特异性上调的DEGs。在12 HPI时,核糖体的合成和组装、SSU-rRNA从三tricistronic rRNA转录本(SSU-rRNA, 5.8S rRNA, LSU-rRNA)的成熟和细胞质翻译过程中富集了733个DEGs(附加文件:图S4A),表明DR可能比DS反应更快,在应激初始阶段在转录和翻译水平上为抗性相关蛋白的翻译做准备。在24 HPI时,488个deg在氧化石墨烯方面富集,如配体门控离子通道活性、细胞对缺氧的反应、氧化还原酶活性、全身获得性抗性和防御反应的正调控(附加文件:图S4B),揭示了DR对感染应激做出了一系列反应,如过氧化物酶的产生和全身获得性抵抗过程和防御反应的激活,说明DR可以更快、更有效地安排防御系统来抵抗MP。当胁迫更严重时(36 HPI), DR中共有737个DEGs特异上调,主要富集在核糖体相关过程中,其次是韧皮部转运、核苷转运、核碱基转运、核碱基跨膜转运蛋白活性、细胞质翻译和过氧化氢分解代谢过程(附加文件:图S4C).在48 HPI时,GO富集表明750个DEGs参与核糖体相关途径、细胞质翻译、RNA结合、β -葡萄糖苷酶活性、配体门控离子通道活性和单萜类生物合成过程(附加文件:图S4D).这一结果表明DR不断转录、翻译和运输抗病相关蛋白和单萜烯等次生代谢产物以应对应激。总之,DR的快速应激反应和特定疾病相关通路的激活可能导致其高耐药性。
DS和DR之间的差异
通过比较DR和DS的DEGs,筛选出与芝麻抗病性相关性较高的基因。在正常生长条件下(0 HPI), DR和DS之间观察到1577个deg(图。4a). GO富集分析显示,这些基因富集于缩合蛋白复合体、有丝分裂染色体缩合、DNA引物酶活性、染色体缩合、参与DNA复制的DNA解卷、FMN还原酶活性和缺氧反应(补充文件:图S5).
然后,通过重叠分析,在4个时间点上,两种基因型间共有52个基因表达显著差异(图2)。4b).然后将其分为5个不同功能的聚类(图。4c).这52个基因在氧化石墨烯方面最为丰富,如对脱落酸的反应、细胞壁、激素介导的信号通路、对激素的反应、细胞-细胞连接、防御反应和信号转导(附加文件:图S6),其中大部分已知与植物胁迫有关。这进一步表明这些基因是引起DR比DS更高抗性的关键候选基因。其中,即使在正常情况下,两种基因型之间也有20个基因表达存在显著差异。
值得注意的是,两个基因型在36 HPI处发现的DEGs最多,两个基因型之间也最多。此外,DR VS DS中许多与生物胁迫相关的KEGG通路中的DEGs在36 HPI时显著富集,包括“植物激素信号转导”(35 DEGs)、“植物-病原体相互作用”(15 DEGs)、“油菜素类固醇生物合成”(2 DEGs)和“二萜生物合成”(12 DEGs)。但这些关键信号通路中的DEGs在其他时间点不明显,说明36hpi可能是芝麻抗病性的重要时段。
在36 HPI的关键通路中涉及DEGs
从KEGG途径来看,“植物-病原菌相互作用”和“植物激素信号转导”是植物抗性的关键途径。因此,在36 HPI的重要时刻分析了芝麻的两种主要途径。
根据KEGG通路赋值,鉴定“植物-病原体相互作用”通路相关基因。结果表明,在DR和DS中分别鉴定出48个和72个deg,且这些基因在两种基因型中均表达下调。DR中,PR1(发病相关蛋白1)、HSP90(热休克蛋白90 kDa beta)、MAP 2 K1(丝裂原活化蛋白激酶激酶1)和RPM1(抗病蛋白RPM1)表达增加,WRKY22、WRKY29、WRKY33、Rboh(呼吸爆发氧化酶)、FLS2 (LRR受体样丝氨酸/苏氨酸蛋白激酶FLS2)和CDPK(钙依赖性蛋白激酶)表达降低。DS中BAK1(油菜素类固醇不敏感1相关受体激酶1)、HSP90、map2 K1和Pti1 (pto相互作用蛋白1)基因表达上调,FLS2、MEKK1(丝裂原活化蛋白激酶激酶1)、NHO1(甘油激酶)、Rboh、RPS2(抗病蛋白RPS2)、WRKY22、WRKY29和WRKY33表达下调。此外,在“植物-病原体相互作用”途径中,HSP90等上调基因在DR中的参与程度高于DS。对于仅在DS中检测到的基因,BAK1和Pti1的表达增加,而MEKK1和NHO1的表达减少(附加文件:表S2).
同样,在“植物激素信号转导”途径中,DS(113)中涉及的DEGs数量多于DR(76)。这些基因大多参与生长素(AUX)、脱落酸(ABA)和乙烯(ET)的生物合成。此外,DS中特异性表达的CRE1(拟南芥组氨酸激酶2/3/4)、B-ARR(双组分响应调节因子ARR-B家族)、SnRK2(丝氨酸/苏氨酸蛋白激酶SRK2)、EIN2(乙烯不敏感蛋白2)、BZR1_2(油菜素类固醇耐药1/2)和BSK (br信号激酶)相关基因均下调,而BAK1和BKI1相关基因均上调(附加文件:表S .)2).
在“植物-病原体相互作用”途径中,与DS相比,DR中2个CDPKs、3个抗病蛋白RPM1、1个LRR受体样丝氨酸/苏氨酸蛋白激酶FLS2、2个编码钙结合蛋白的CML基因和1个Rboh基因的表达水平显著上调。这些基因可以通过识别Ca诱导植物的PTI2 +信号,然后激活超敏反应和细胞壁加强,以防止病原体的传播。WRKY22等其他基因表达水平显著上调,可通过产生下游防御基因诱导抗性。在“植物激素信号转导”途径中,共有35个基因存在差异表达,其中11个DEGs与生长素相关表达上调,包括2个生长素反应蛋白(IAA)、2个生长素内流载体(AUX1)、2个生长素反应蛋白(GH3)、1个生长素反应因子(ARF)和4个SAUR蛋白。其他表达上调的基因包括2个乙烯响应转录因子(ERF1)编码基因、2个SA生物合成相关转录因子TGA和1个调控蛋白NPR1、2个油菜素类固醇途径相关的细胞周期蛋白D3 (CYCD3)、1个赤霉素生物合成相关的DELLA蛋白和2个细胞分裂素合成途径相关的双组分响应调控基因(表1)1).
两个芝麻基因型间轮毂基因的WGCNA分析
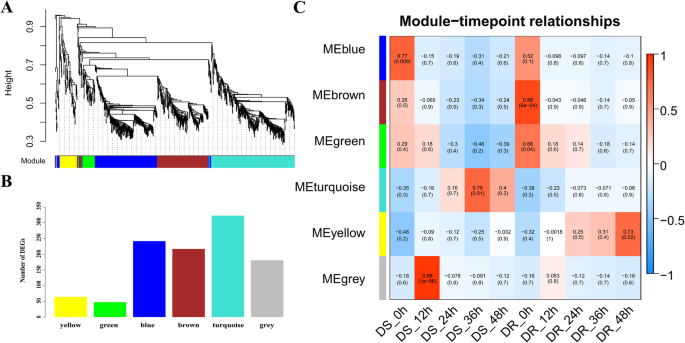
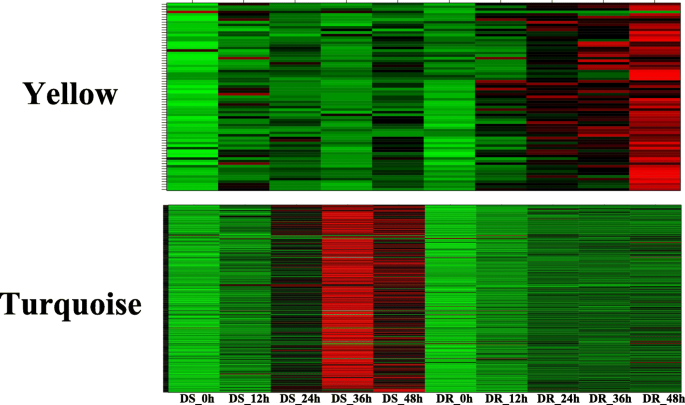
采用加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA)对接种后DR与DS差异表达的所有基因(平均FPKM、>、0.1)进行分析。1076个基因被分为蓝色、棕色、绿色、绿松石、黄色和灰色6个共表达模块,分别包含242、217、48、323、65和181个基因(图。5a, b).检测模块与耐、敏感基因型接种后时间点的相关性表明,6个模块对MP胁迫的响应不同。在这些模块中,绿松石模块的基因与DR-36HPI呈负相关,而DS-36HPI呈正相关。同样,黄色模块中的基因与DR-36HPI呈正相关,而与DS-36HPI呈负相关(图2)。5c)。
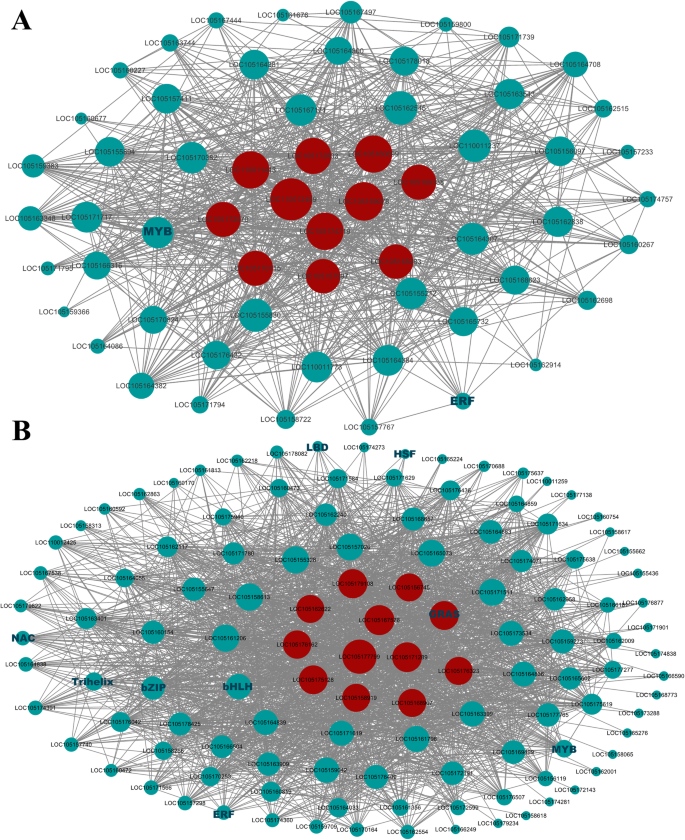
这两个模块的基因表达谱如图所示。6.因此,我们选择了绿松石色和黄色模块进行基因共表达网络分析,以揭示芝麻与MP互作过程中的中枢基因。在基因共表达网络中,许多基因只与有限数量的其他基因相互作用,而较少的基因集(枢纽基因)与许多其他基因相互作用,毫无疑问,枢纽基因在网络中起着核心作用。为了了解模块内基因之间的关系,我们使用Cytoscape软件构建了黄色模块和蓝绿色模块的基因网络(权重为> 0.3和前2000条边)。tf以深绿色字体表示,节点圈大小与其相互作用的基因数量呈正相关。节点大小最大的基因表示枢纽基因,以红色节点表示(图2)。7).
在黄色模块中,我们观察到几个枢纽基因,包括LOC105160699 (LRR受体样丝氨酸/苏氨酸蛋白激酶),LOC105172070(可能的LRR受体样丝氨酸/苏氨酸蛋白激酶),LOC110012469(可能的LRR受体样丝氨酸/苏氨酸蛋白激酶),LOC105170715(水通道蛋白PIP2-7), LOC105157597(可能的2-羟戊二酸依赖双加氧酶),LOC105172803(聚半乳糖醛酸酶),LOC105169338(组蛋白H3.2), LOC105168283 (2-phytyl-1,4-萘醌甲基转移酶),LOC105169078(蛋白解毒43),LOC110011443 (NA)和LOC105174719 (NA)。同样,在绿松石模块中检测到的中心基因为LOC105161270 (GRAS)、LOC105177799(过氧化物酶73前体)、LOC105158919(漆酶-15样)、LOC105179108(漆酶-14样)、LOC105175128 (g型凝集素s受体样丝氨酸/苏氨酸蛋白激酶)、LOC105156745 (E3泛素-蛋白连接酶rha2b样)、LOC105171289 (ATP硫酰化酶1)、LOC105168907(亚油酸9s -脂氧合酶5)、LOC105167576 (VQ基序含蛋白22)、LOC105162622(油酸样蛋白)、loc105166162 (NA)、LOC105176323 (NA)。此外,还检测到黄色模块中的LOC105174354 (MYB)和绿松石模块中的LOC105173824 (bHLH)和LOC105161270 (GRAS)等关键转录因子,这些转录因子可能在防御中发挥重要的调控作用。这些结果表明,编码LRR-RLK和漆酶的基因可能在芝麻对MP的防御中起主要作用。同时,芝麻中过氧化物酶的活性可能与芝麻的抗性有关。值得注意的是,LOC105161270 (GRAS)不仅是绿松石模块中的枢纽基因,而且是与植物抗病性密切相关的TF,表明它可能是抗MP的关键调控基因。
tf参与芝麻防御
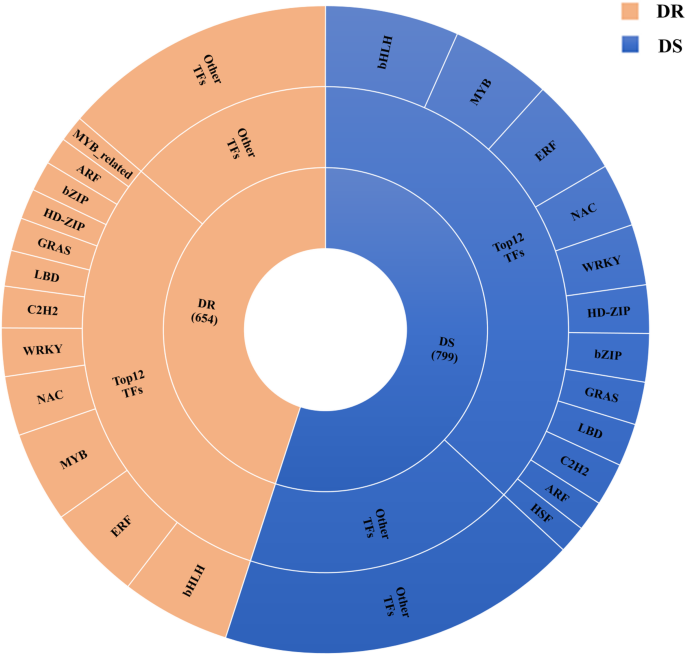
为了研究芝麻与MP相互作用中的主要转录因子,我们研究了所有参与转录调控的基因的表达。在芝麻的DEGs中共鉴定出3904个tf,可分为49个基因家族。总的来说,转录因子的数量随着胁迫的严重程度而增加(附加文件:表S3.).在DR中,bHLH基因家族是最丰富、最活跃的TF家族,显著高于其他TF家族,其次是ERF、MYB、NAC、WRKY、C2H2、LBD、GRAS、HD-ZIP、bZIP、ARF、myb_相关等转录因子家族。此外,许多deg都是TF家族的成员bHLH, MYB, ERF, NAC, WRKY, HD-ZIP, bZIP, GRAS, LBD, C2H2DS的ARF、HSF(图;8).本研究发现,在芝麻与MP相互作用中,bHLH转录因子家族是含量最高的转录因子,表明bHLH蛋白可能在芝麻抗炭腐中发挥重要作用。
实时定量PCR
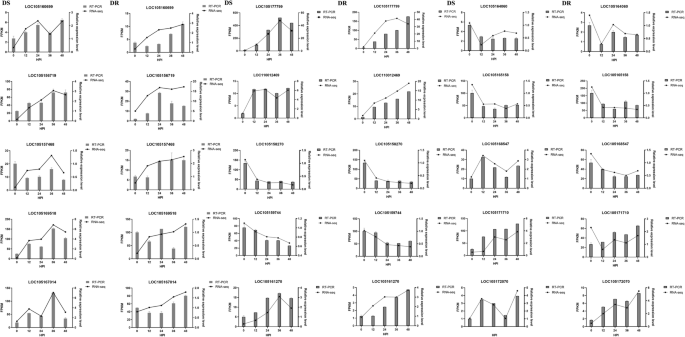
选择了两种基因型中对MP有反应的15个基因来确认RNA-seq结果,包括8个耐MP基因和7个植物激素信号通路基因(附加文件:表S4).结果表明,real-time quantitative PCR和RNA-seq与整体表达趋势一致(图2)。9),表明本研究中使用的RNA-seq具有较高的可靠性。
讨论
比较转录组分析
植物通常受到各种生物和非生物胁迫,特别是病原体胁迫,严重影响植物的生长发育。在我们的研究中,MP感染逐渐改变了芝麻转录组的表达,并在36 HPI时表现出最多的DEGs,这意味着这是芝麻抵抗病原体入侵的关键时期。此外,我们发现无论接种后的哪个时间点,DS都比DR具有更多的DEGs和tf,这表明在转录水平上,易感基因型更容易受到MP的干扰,这可能是由于DS缺乏适应MP胁迫的相应机制。DR和DS在病原体感染过程中做出的不同决策可能会导致其耐药性的差异。
根据四个时间点的GO富集分析,在DR中特别收集到了大量参与核糖体相关过程的DEGs,而在DS中没有发现这些DEGs,核糖体是在细胞水平上合成蛋白质的“工厂”,各种机制已经进化到可以在植物的转录和翻译水平上快速检测和反应环境变化[23,24].DR中更多的DEGs参与核糖体相关通路,表明DR可能对MP胁迫有快速而强烈的反应,翻译机制与转录机制协同激活,这与Supriyo Chowdhury描述的结果一致[25].
在MP胁迫下,两个基因型中均有部分DEGs持续表达,是介导芝麻抗MP的核心基因。研究发现,这些基因中有很多是pod,接种后表达量显著增加。大量研究表明,较高的抗氧化酶活性有助于提高植物的抗病性[26,27].POD通过解毒H .2O2它在抗病过程中起着重要的作用。当受到外界病原体的胁迫时,POD活性的增强可以增加酚氧化物的含量,引发超敏反应,进而抑制病原体的增殖和扩散[28].
在这个核心基因集中有许多蛋白激酶基因和致病相关基因。人们认识到,大量的受体蛋白激酶和病原相关蛋白可以赋予植物对病原体的抗性[29].PmDTM基因编码小麦类受体丝氨酸/苏氨酸蛋白激酶,可提高小麦的抗病性小麦黑麦[30.].类似地,CsWAKL08基因编码的壁相关受体样激酶被发现调节抵抗柑橘黄单胞菌亚种。citri通过ROS控制和JA信号传导机制,这进一步强调了该激酶家族在植物抗病中的重要性[31].ScPR10是从甘蔗中鉴定出来的一个与致病相关的基因,对植物的抗性具有正向调控作用Sporisorium scitamineum、高粱花叶病毒、水杨酸和茉莉酸甲酯胁迫[32].在这个核心基因集中发现的另一个重要基因家族是细胞色素P450,它是植物基因组中最大的基因家族之一。在小麦中,细胞色素P450基因TaCYP72A被证实具有对脱氧雪腐镰刀醇的抗性,该基因介导了小麦对脱氧雪腐镰刀醇的早期抗性f . graminearum[33].同样,桂林王等人发现GbCYP86A1-1基因在海岛棉对抵抗起着积极的作用大丽轮枝菌属并启动抗病的下游免疫途径。例如,GbCYP86A1-1转基因拟南芥显著增加了编码蛋白激酶、tf和PRs的基因表达,从而提高了其抗性[34].此外,少数编码漆酶的基因也反映在该基因集中。Yan Zhang等报道了含有漆酶保守结构域的GhLAC15基因增强了抗性黄萎病dahliae通过木质化的增加和阿拉伯糖和木糖的积累[35],表明漆酶可能与植物对病原体的抗性有显著关系。
同时比较了DR和DS在胁迫下的基因表达情况,筛选出了52个差异连续表达的基因,表明它们可能为DR提供了更高的抗炭腐能力。因此,未来的研究将重点关注这些涉及芝麻抗病性的基因及其生物学功能。
PTI和ETI有助于芝麻对MP的抗性
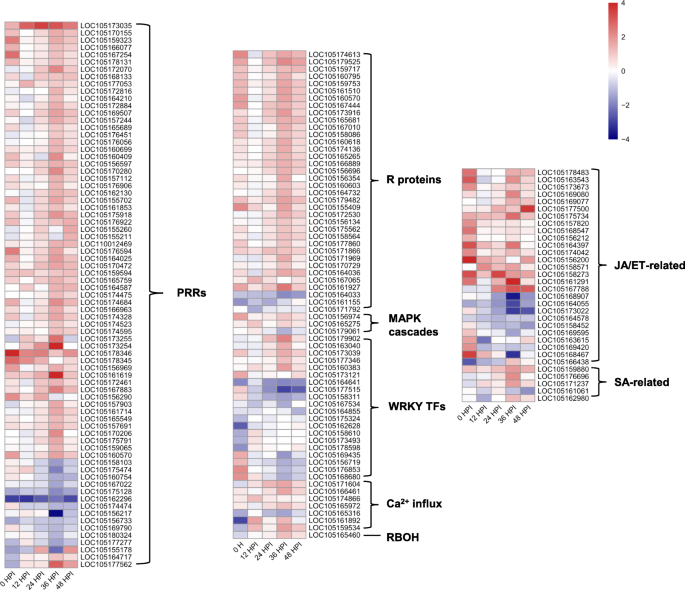
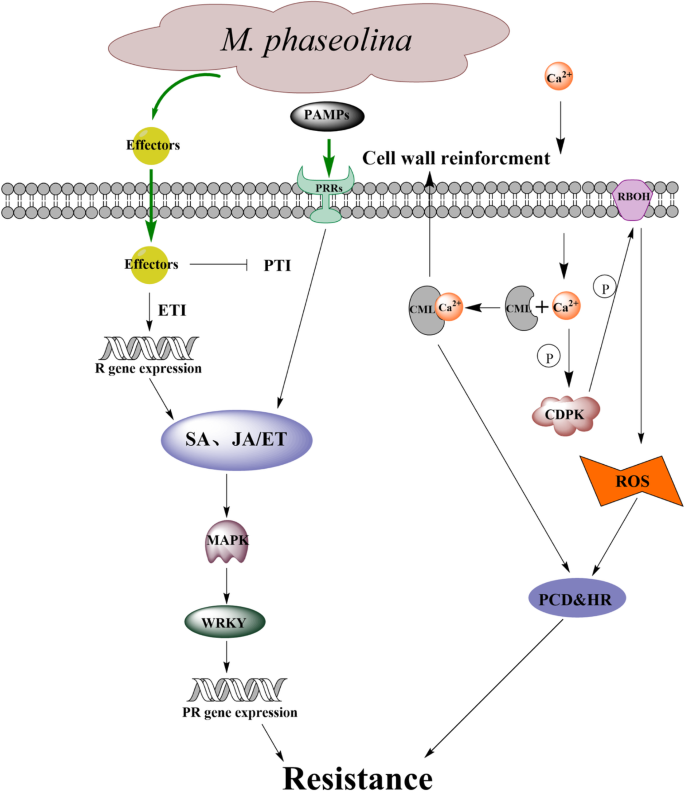
为了解芝麻对MP的免疫应答机制,通过文献、nr和KEGG标注筛选出174个与PTI和ETI相关的deg进行讨论。这些基因可能参与了芝麻抗MP的过程。其中包括75个模式识别受体(PRRs)基因,36个抗性(R)基因,1个呼吸爆发氧化酶同源物(RBOH), 7个Ca2 +内流相关蛋白,3个MAPK级联,20个WRKY和32个激素代谢相关基因(图。10,附加文件:表S5).
PRRs对病原体的感知和识别
植物的防御始于PRR对病原体PAMP的检测,然后PRRs动态地与不同的共受体、调节受体激酶和受体样细胞质激酶(RLCK)结合,启动免疫信号转导,PTI启动[2,36].植物PRRs包括受体样激酶(RLK)和受体样蛋白(RLP) [37,38].两种基因型间有73个差异表达的PRRs涉及芝麻耐MP。在两种基因型中都诱导了PRRs,其中12个在DS中诱导,60个在DR中诱导。10,附加文件:表S5).先前的研究表明,PTI中的一些关键PRRs,如油菜素类固醇不敏感1相关激酶1 (BAK1) [39], fls2 [40]和几丁质激发子受体激酶[41],在植物抵抗病原体方面起着重要作用。值得注意的是,一个CERK和两个FLS2基因在两种基因型中表现不同。此外,WGCNA还表明,LRR-RLKs在芝麻抗MP中发挥了重要作用。由此可见,DR比DS更能快速、积极地识别PAMPs,诱导PTI的能力更强,这可能是两者耐药性差异的主要原因。
MAPK级联,WRKY tf, Ca2 +涌入和RBOH
prr衍生的信号通过进一步的磷酸化级联,包括MAPK级联和钙依赖性蛋白激酶(CDPKs)传递到下游靶点,如RBOH [42].同样,在芝麻抗MP的过程中,有3个MAPKs差异表达,其中DR诱导了2个(图2)。10,附加文件:表S5).由MAPK级联激活的WRKY tf在植物防御反应中发挥着复杂的作用,其作用是积极的[43,44]和负的[45,46监管机构。在本研究中,两种基因型中有20个wrky存在差异表达,其中6个在DR中诱导,10个在DS中诱导(图2)。10,附加文件:表S5).WRKY转录因子在病原体防御中的作用是积极的还是消极的,尚不清楚,有待进一步研究。
此外,与DS相比,DR接种后3种钙调素样蛋白(calmodulin-like, CML)和3种CDPKs显著上调。10,附加文件:表S5).当PRRs识别病原体的PAMPs时,Ca2 +在细胞质中可以观察到浓度。Ca2 +可与CML结合诱导下游细胞壁增强和超敏反应,也可激活CDPK磷酸化和转导RBOH蛋白等免疫信号,对下游病原体进行防御[47].它表明Ca2 +是芝麻抗MP的重要第二信使。在dr中诱导了一个芝麻基因(LOC105165460),推测其功能为RBOH,这与小麦、棉花和黄瓜枯萎病真菌病原的观察结果一致[48],说明接种后DR中可能存在较高水平的ROS,抑制MP的感染和定殖。
R蛋白
细胞内受体R蛋白(Intracellular receptor R protein)是R基因编码植物免疫的重要组成部分,它可以检测并结合病原体效应物并触发ETI,这在以往的研究中得到了有力的证据。例如,R基因Pm60介导小麦对白粉病的抗性[49],两个R基因RGA4和RGA5在功能上相互作用,介导水稻抗性Magnaporthe oryzae[50].在本研究中,共有36个R基因在耐药和敏感基因型之间存在差异表达,其中33个R基因是由DR诱导的(图2)。10,附加文件:表S5),几乎所有R基因在36 HPI位点均有差异表达,进一步说明36 HPI位点为关键时期。此外,R基因的上调表达可能代表了ETI的激活,表明DR比DS诱导了更强的ETI反应,增强了其对MP的抗性。
JA/ET和SA信号通路在芝麻免疫中的作用
植物激素在植物抵抗病原体方面起着重要作用。据认为,植物对生物营养性病原体的抗性主要由SA信号通路控制,而对坏死性病原体的抗性则由JA/ET信号通路介导[51].研究发现,半生物营养型病原菌MP在与芝麻相互作用过程中,有一个明显的生物营养期(约36 h)和向坏死营养的过渡期,而后进入坏死营养阶段。芝麻对MP的抗性主要是由JA/ET信号通路的激活引起的[25].同样,JA处理或强JA信号通路在草莓果实中可以增强其抗性葡萄孢菌说明JA参与了葡萄的抗病葡萄孢菌[52].为了研究JA/ET信号通路在本研究中的潜在作用,我们检测了JA/ET信号通路中涉及的关键deg的表达模式,发现DR中有17个deg被诱导,DS中有5个deg被诱导。例如,与DS相比,JA合成酶基因(1个AOS, 1个LOX和4个OPR)在DR中上调。此外,DR中诱导了4个JAZ蛋白,1个防御素和2个MYC2 tf(图。10,附加文件:表S5).许多文献表明JA信号通路可以直接通过JAZ蛋白调控MYC2的转录因子,进而诱导下游基因[53].综上所述,JA信号通路可能在芝麻免疫中发挥重要作用。与DS相比,有4个DEGs上调ET生物合成和信号转导通路,4个DEGs下调ET生物合成和信号转导通路。10,附加文件:表S5),表明ET可能不是直接调控对MP的抗性,而是在JA/ET信号通路中起动态调控作用。
NPR1蛋白是SA介导的防御反应诱导的主调控蛋白,位于SA信号转导的下游和PR基因表达的上游。NPR1是系统获得性抗性(systemic acquired resistance, SAR)途径中的正向调控基因,可调控PR蛋白在SAR中的表达,例如转基因BjNPR1的芥菜就表现出较强的抗性链格孢属brassicae而且白粉菌属cruciferarum,激活了SAR,表明BjNPR1参与了对真菌病原体的抗性[54].在我们的研究中,在DR中检测到编码1个NPR1和2个TGA tf的3个上调基因(图。10,附加文件:表S5).研究表明,TGA与NPR1复合物可增强TGA与PR1基因启动子的结合,并积极诱导PR1的表达[55].此外,还检测到编码NIM1-INTERACTING2 (NIMIN2)的下调基因(图2)。10,附加文件:表S5).已知NIMIN2可与NPR1相互作用,作为NPR1的负调控因子,抑制NPR1调控基因的抑制[56].这表明SA可能在芝麻抗MP中起着至关重要的作用。它表明T.long gibrachiatumH9可以激活黄瓜JA/ET和SA信号通路,进而增强黄瓜的抗病能力葡萄孢菌[57].基于我们的研究结果,芝麻和MP之间相互作用的示意图如图所示。11.
防务相关的助教
据报道,许多tf,如bHLH [58,59], myb [60,61], erf [62,63,64], nac [65,66]及WRKY [43,67,68],与植物对病原体的各种抗性机制有关。在我们的研究中,bHLH转录因子家族是芝麻与MP相互作用中最丰富的转录因子。众所周知,bHLH家族的许多成员与植物的非生物抗逆性有关,如耐旱性[69],耐寒性[70]和耐盐性[71].然而,它们在植物生物胁迫中的作用却很少被描述。群成等近期揭示了bHLH转录因子GmPIB1在大豆疫霉根腐病中的作用,发现GmPIB1可以直接结合关键酶GmSPOD1的启动子,后者编码ROS并抑制其表达,减少ROS的产生,增强大豆对疫霉的抗性[58].Yan S等人发现转基因bHLH转录因子CsIVP-RNAi的黄瓜植株对霜霉病具有更高的抗性,并能积累更高水平的SA。CsIVP可与SA信号通路中的负调控因子CsNIMIN1发生物理相互作用,因此CsIVP是SA介导的黄瓜霜霉病抗性的重要调控因子[59].在这里,目前的研究也得到了类似的结果:bHLH转录因子可能在芝麻抗性中发挥重要作用(图。7).
结论
综上所述,通过比较转录组分析,获得了芝麻抗MP的一组核心基因,包括蛋白激酶、疾病相关蛋白、细胞色素P450和PODs等与抗病密切相关的基因。然后在MP压下筛选出DR和DS连续表达且存在差异的52个基因,这些基因富集了GO对脱落酸反应、细胞壁、激素介导的信号通路、激素反应、细胞-细胞连接、防御反应和信号转导等GO术语。其次,初步探讨了芝麻对MP的免疫应答机制。与DS相比,DR对MP感染反应更快,翻译机制和转录机制被协同激活。DR在转录水平上不太可能受到MP的干扰。此外,174个涉及PTI和ETI的基因在耐药和易感基因型中表现出不同的表达模式,包括识别病原体的PRRs和R基因,磷酸化和激活下游信号的钙离子内流过程相关基因和MAPK级联相关基因,下游基因如RBOHs和激素代谢和转导相关基因(JA/ET和SA)。值得注意的是,大部分PRRs、钙离子内流相关基因和R基因在DR中被诱导,表明DR中触发了更强的PTI和ETI。最后,我们发现JA/ET和SA信号转导通路在芝麻抗MP中都很重要。这是首次利用转录组学方法报道芝麻与MP相互作用的机制,对芝麻耐药基因抗MP感染的分子机制有了更深入的了解。
方法
材料及应力处理
两种抗性水平比较的芝麻易感基因型(冀9014)和抗病基因型(政治13号)[72,73]为广泛种植品种,均由河南省农业科学院芝麻研究中心提供。Macrophomina phaseolina(MP)是河南省农业科学院植物保护研究所生物防治研究室分离保存的炭疽病菌。
MP混合基质的制备:在- 20°C、25%甘油中储存的MP菌株在PDA固体培养基上活化。活化后,MP在PDA固体培养基中培养,30°C培养箱中培养4天。将充满MP的PDA培养基用消过毒的牙签分成约0.5 cm的小片,然后接种到消过毒的200 mL液态PD培养基中(每瓶接种半盘PDA)。在30°C、200 r/min的条件下摇匀培养5天。用粉碎机将充满菌丝体的培养基打碎,得到菌丝体悬浮液。然后将每100 mL菌丝体悬液与100 mL消毒水和200 g消毒基质(营养土:蛭石= 3:1)混合。
芝麻幼苗在基质(土壤:营养土:蛭石= 3:1:1)生长碗中培养,分2对真叶期疏育,每盆留3株。在人工气候箱中培养,光照16 h(30°C),黑暗8 h(28°C)。将DS和DR从生长碗中移植到基质中,3对真叶上有菌丝体。在MP处理期间(12 h、24 h、36 h、48 h)和处理前(0 h),收集DS和DR的根组织作为样本(3个生物重复)提取RNA。
mRNA文库构建和测序
用TransZol Up Plus RNA试剂盒(Cat# ER501-01, Trans)提取的总RNA经安捷伦生物分析仪2100(安捷伦科技,加州圣克拉拉,美国)电泳鉴定,并用RNA Clean XP试剂盒(Cat A63987, Beckman Coulter, Inc.)纯化。Kraemer Boulevard Brea, CA, USA)和RNase-Free DNase Set (Cat#79254, QIAGEN, GmBH, Germany)。用NanoDrop nt -2000分光光度计和Agilent Bioanalyzer 2100 (Agilent Technologies, Santa Clara, CA, US)检查总RNA的质量,检查后的高质量RNA随后可以测序。根据实验操作说明,将纯化的总RNA经过mRNA分离、片段化、第一链cDNA合成、第二链cDNA合成、末端修复、A的3’-末端添加、连接连接、富集等步骤,完成cDNA文库的构建。建立库后,使用Qubit®2.0荧光仪检测浓度,使用Agilent 4200检测库的大小。
测序:按照cBot用户指南所示的相应流程,在配有Illumina测序仪的cBot上完成聚类生成和第一方向测序引物杂交,并进行配对端测序。测序过程和实时数据分析由Illumina公司提供的数据采集软件控制。
转录组的组装
下游分析前,去除质量低、引物序列和末端质量低的不合格reads。Seqtk包用于过滤原始读取以获得干净的读取,以便读取可以用于后续的数据分析。过滤后,用HISAT2(版本:2.0.4)将干净的reads映射到芝麻基因组[74].映射生成的数据是一个BAM文件。
芝麻参考基因组为S_indicum_v1.0 [22],可从以下网址下载:ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/000/512/975/GCF_000512975.1_S_indicum_v1.0/GCF_000512975.1_S_indicum_v1.0_genomic.fna.gz.
deg分析
通过将reads转化为FPKM(外显子模型的每千碱基片段/每百万映射reads)来标准化基因表达,计算每个样本的基因表达水平[75].我们首先用Stringtie(版本:1.3.0)计算Hisat2比对后每个基因的片段数[76,77],然后用M值修剪平均值(TMM)方法进行归一化[78],最后用perl脚本计算每个基因的FPKM值。
利用edgeR包分析样品间的差异基因[79],以及p-value经多重假设检验校正。通过控制错误发现率(False Discovery Rate, FDR)确定p值的阈值,修正后的p值为q-value [80,81].根据参数:log检测不同表达基因(DEG)2|折叠变化| > =1,q-value <= 0.05。
功能注释和tf预测
将deg与NCBI非冗余(NR)数据库进行比较,并通过KAAS将其功能注释到GO和KEGG数据库中。
为了鉴定芝麻DEGs中的转录因子,在线网站plantTFDB [82) (http://planttfdb.cbi.pku.edu.cn/index.php?sp=Sin)。
加权基因共表达网络分析
加权基因共表达网络分析(Weighted gene co-expression network analysis, WGCNA)是一种描述不同样本间基因相关性模式的系统生物学方法。它可用于识别具有高度协同变化的基因集,分析基因集之间的相互联系以及基因集与表型之间的相关性。WGCNA软件包版本:1.69 [83]构建本研究的基因共表达网络。去除劣势样本(meanFPKM < 0.1)后,利用log2变换后的FPKM矩阵,在mergeCutHeight为0.8,minModuleSize为30的条件下,构建无标度共表达网络。为了找出具有生物学意义的模块,计算模块特征基因与样本或样本性状之间的相关系数。Cytoscape软件版本3.6.1 [84]以权重> 0.3为截断点(从WGCNA中获得)对每个模块进行可视化。
中存在
采用新加坡生产的CFX 384™实时系统和2× ChamQ Universal SYBR qPCR Master Mix (Vazyme,南京,中国)定量检测DS和DR中15个基因的相对表达量——ΔΔCt方法。每个样品3个重复。qPCR引物由生工生物设计合成,详见附加文件:表S4.15个基因的相对表达量归一化至SiUBQ5基因的相对表达量[85].
统计分析
本研究所有数据均为3个生物重复的平均值。FPKM值用于描述基因表达丰度。
数据和材料的可用性
数据可在NCBI SRA登录:PRJNA706471。
缩写
- 议员:
-
Macrophomina phaseolina
- 博士:
-
抗病
- DS:
-
Disease-susceptible
- TF:
-
转录因子
- PTI:
-
Pattern-triggered免疫力
- 指数:
-
Effector-triggered免疫力
- PAMP时:
-
病原体相关分子模式
- ROS:
-
活性氧
- MAPK:
-
丝裂原活化蛋白激酶
- SOD:
-
Superoxidase歧化酶
- 猫:
-
过氧化氢酶
- 圆荚体:
-
过氧化物酶
- bHLH:
-
基本helix-loop-helix
- 现病史:
-
小时post-inoculation
- 主成分分析:
-
主成分分析
- 度:
-
差异表达基因
- 罗斯福:
-
错误发现率
- PR1:
-
发病相关蛋白1
- 一半:
-
热休克蛋白90 kDa β
- 图2 k1:
-
丝裂原活化蛋白激酶1
- RPM1:
-
抗病蛋白RPM1
- RBOH:
-
呼吸突发性氧化酶
- FLS2:
-
FLAGELLIN-SENSING 2
- CDPK:
-
钙依赖性蛋白激酶
- BAK1:
-
油菜素类固醇不敏感1相关受体激酶1
- Pti1:
-
光子相互作用蛋白1
- MEKK1:
-
丝裂原活化蛋白激酶1
- NHO1:
-
甘油激酶
- RPS2:
-
抗病蛋白RPS2
- 辅助:
-
生长素
- 阿坝:
-
脱落酸
- 是:
-
茉莉酸
- 山:
-
水杨酸
- 等:
-
乙烯
- CRE1:
-
拟南芥组氨酸激酶2/3/4
- B-ARR:
-
双组分响应调节器ARR-B家族
- SnRK2:
-
丝氨酸/苏氨酸蛋白激酶SRK2
- EIN2:
-
乙烯不敏感蛋白2
- BZR1_2:
-
油菜素类固醇耐药1/2
- BSK:
-
BR-signalling激酶
- CML:
-
Calmodulin-like
- GH3:
-
糖苷水解酶
- 东盟地区论坛:
-
生长素反应因子
- ERF1:
-
乙烯响应转录因子1
- CYCD3:
-
细胞周期素D3
- 人力资源:
-
过敏的反应
- JAZ:
-
茉莉酸ZIM结构域含蛋白
- WGCNA:
-
加权基因共表达网络分析
- PRR:
-
模式识别受体
- RLCK:
-
受体样细胞质激酶
- RLK:
-
受体激酶
- RLP:
-
受体蛋白
- CERK:
-
几丁质激发子受体激酶
- 特别行政区:
-
全身获得性耐药性
- NIMIN2:
-
NIM1-INTERACTING2
- 纤毛运动:
-
程序性细胞死亡
- FPKM:
-
每千碱基的外显子模型的片段数
参考文献
- 1.
李志强,李志强,李志强,等。植物细胞壁介导的免疫反应:细胞壁变化引发植物抗病反应。植物学报,2018;29(4):344 - 344。https://doi.org/10.1111/tpj.13807.
- 2.
琼斯JD, Dangl JL。植物免疫系统。大自然。2006;444(7117):323 - 9。https://doi.org/10.1038/nature05286.
- 3.
番茄富含亮氨酸重复受体样激酶SlSERK3A和SlSERK3B在细菌和线虫先天免疫中具有重叠功能。PLoS One. 2014;9(3):e93302。https://doi.org/10.1371/journal.pone.0093302.
- 4.
Nicaise V, Roux M, Zipfel C. pamp触发的抗细菌免疫的最新进展:模式识别受体监视和提高警报。植物科学进展。2009;30(4):344 - 344。https://doi.org/10.1104/pp.109.139709.
- 5.
金世德,黄伯奎。辣椒苯丙氨酸解氨酶基因PAL1在水杨酸依赖信号通路中对微生物病原体防御反应的重要作用。中国科学(d辑),2014;26(3):344 - 344。https://doi.org/10.1093/jxb/eru109.
- 6.
张世生,胡林,刘志林,等。植物抗病相关酶的研究进展[J]。安徽农业科学通报,2006;13:48-9。
- 7.
Van Breusegem F, Dat JF。植物细胞死亡中的活性氧。植物科学进展。2006;32(2):366 - 366。https://doi.org/10.1104/pp.106.078295.
- 8.
杨晓明,李志强,李志强,等。植物对非生物胁迫的响应及其与氧化还原信号的关系。植物细胞环境学报。2012;35(2):259-70。https://doi.org/10.1111/j.1365-3040.2011.02336.x.
- 9.
王志强,王志强,王志强,等。异源螺旋-环-螺旋蛋白之间的相互作用产生了特异性结合到共同DNA序列的复合物。细胞。58 1989;(3):537 - 44。https://doi.org/10.1016/0092 - 8674 (89) 90434 - 0.
- 10.
基本螺旋-环-螺旋蛋白概述。中国生物医学工程学报。2004;5(6):226。https://doi.org/10.1186/gb-2004-5-6-226.
- 11.
Nesi N, Debeaujon I, Jond C, Pelletier G, Caboche M, Lepiniec L. TT8基因编码DFR和BAN基因表达所需的基本螺旋-环-螺旋结构域蛋白拟南芥长角果.《植物科学》2000;12(10):1863-78。https://doi.org/10.1105/tpc.12.10.1863.
- 12.
Martínez-García JF, Huq E, Quail PH.光信号直接靶向启动子元素结合转录因子。科学。2000;288(5467):859 - 63。https://doi.org/10.1126/science.288.5467.859.
- 13.
陈玲,胡斌,秦勇,胡刚,赵娟。MYB转录因子负调控花青素生物合成的研究进展。植物物理与生物化学。2019;136:178-87。https://doi.org/10.1016/j.plaphy.2019.01.024.
- 14.
周敏,王志军,王志军,等。茉莉酸转录因子在植物次生代谢中的调控作用。生物技术,2016;34(4):441-9。https://doi.org/10.1016/j.biotechadv.2016.02.004.
- 15.
Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)作为脱落酸信号的转录激活因子。植物学报。2003;15(1):63-78。https://doi.org/10.1105/tpc.006130.
- 16.
Chinnusamy V, Ohta M, Kanrar S, Lee BH, Hong X, Agarwal M, Zhu JK。ICE1:拟南芥低温诱导转录组和抗冻性的调节因子。基因开发,2003;17(8):1043-54。https://doi.org/10.1101/gad.1077503.
- 17.
Kavas M, balo土耳其卢MC, Atabay ES, Ziplar UT, daggan HY, Ünver T.普通豆bHLH转录因子对过量盐浓度响应的全基因组特征和表达分析。中国生物医学工程学报。2016;29(1):129-43。https://doi.org/10.1007/s00438-015-1095-6.
- 18.
Makinde FM, Akinoso R.生芝麻、烤芝麻和发酵芝麻面粉营养品质的比较(芝麻。)尼日利亚生长的种子。食品科学学报,2014;13(3):309-19。https://doi.org/10.17306/J.AFS.2014.3.9.
- 19.
Nagendra Prasad M, Sanjay K, Prasad D, Vijay N, Kothari R, Nanjunda SS.芝麻营养和营养特性的研究进展。中国食品科学,2012;2(2):1-6。
- 20.
王玲,张勇,朱旭,朱旭,李东,张旭,高勇,肖刚,魏旭,张旭。芝麻ssr遗传图谱的构建及抗炭腐相关数量性状位点的鉴定。科学通报2017;7(1):8349。https://doi.org/10.1038/s41598-017-08858-2.
- 21.
张红,苗红,王玲,曲玲,刘红,王强,岳明。重要油籽作物基因组测序芝麻.中国生物医学工程学报。2013;14(1):401。https://doi.org/10.1186/gb-2013-14-1-401.
- 22.
王玲,于珊珊,佟超,赵艳,刘艳,宋超,张颖,张鑫,王艳,华伟,李东,李冬,李峰,余娟,徐超,韩霞,黄松,泰松,王洁,徐霞,李艳,刘松,Varshney RK,王娟,张旭。高油料作物芝麻基因组测序为油料生物合成提供了新的研究方向。中国生物医学工程学报。2014;15(2):R39。https://doi.org/10.1186/gb-2014-15-2-r39.
- 23.
Dossa K,李东,王玲,郑霞,刘安,余娟,魏霞,周瑞,Fonceka D, Diouf D,廖波,Cissé N,张旭。两种不同基因型芝麻对干旱胁迫的转录组、生化和生理解剖学研究科学通报2017;7(1):8755。https://doi.org/10.1038/s41598-017-09397-6.
- 24.
雷玲,石娟,陈娟,张敏,孙松,谢松,李霞,曾波,彭林,豪阿,赵华,宋伟,范智,赖军。干旱胁迫下玉米幼苗核糖体动态平移景观分析。中国植物学报,2015;36(6):344 - 344。https://doi.org/10.1111/tpj.13073.
- 25.
乔杜里,巴苏,Kundu。病原菌的生物营养-坏死开关在不同阶段引起抗性和敏感芝麻的不同反应,涉及多个信号通路。科学通报2017;7(1):17251。https://doi.org/10.1038/s41598-017-17248-7.
- 26.
Narayan OP, Verma N, Singh AK, Oelmüller R, Kumar M, Prasad D, Kapoor R, Dua M, Johri AK。在鹰嘴豆中定植抗氧化酶Piriformospora籼参与病原体的防御葡萄孢菌.科学通报2017;7(1):13553。https://doi.org/10.1038/s41598-017-12944-w.
- 27.
吴伟,万霞,沙福,法哈德斯,黄娟。不同施肥和密度下抗氧化酶在油菜鞘枯病侵袭适应性响应中的作用。科学通报2014;2014:502134。
- 28.
王爱林,邓文强,朱海峰,等。黄瓜侵染后酶活性的变化Pseudoperon ospora[J] .长江蔬菜,2008;10:52-4。
- 29.
万杰,张晓春,Neece D, Ramonell KM, Clough S, Kim SY, Stacey MG, Stacey G.一种LysM受体样激酶在拟南芥几丁质信号传递和真菌抗性中起关键作用。植物学报。2008;20(2):471-81。https://doi.org/10.1105/tpc.107.056754.
- 30.
鲁楠,陆敏,刘鹏,徐红,邱霞,胡松,吴勇,白松,吴娟,薛松。中国长种大头麦PmDTM广谱抗白粉病基因的精细定位及其与Pm24的关系。植物科学通报2020;40(6):1709-14。https://doi.org/10.1094/PDIS-11-19-2431-RE.
- 31.
李强,胡安,齐娟,窦伟,秦霞,邹霞,徐玲,陈松,何艳。CsWAKL08是一种病原菌诱导的甜橙壁相关受体激酶,通过ROS控制和JA信号通路对柑桔细菌性溃疡病产生抗性。Hortic res 2020;7(1):42。https://doi.org/10.1038/s41438-020-0263-y.
- 32.
彭强,苏勇,凌红,Ahmad W,高松,郭杰,Que Y,徐磊。甘蔗发病相关蛋白ScPR10在胁迫下的防御反应中起积极作用Sporisorium scitamineum,SrMV, SA和MeJA应力。植物细胞学报,2017;36(9):1427-40。https://doi.org/10.1007/s00299-017-2166-4.
- 33.
Gunupuru LR, **am C, Malla KB, Kahla A, Perochon A, Jia J, Thapa G, Doohan FM。小麦细胞色素P450增强了对脱氧雪腐镰刀醇的抗性和产量。PLoS One. 2018;13(10):e0204992。https://doi.org/10.1371/journal.pone.0204992.
- 34.
王刚,徐娟,李玲,郭震,司强,朱刚,王霞,郭伟。巴贝登棉GbCYP86A1-1正向调节防御黄萎病dahliae通过细胞壁修饰和免疫途径的激活。植物科学进展,2020;18(1):222-38。https://doi.org/10.1111/pbi.13190.
- 35.
张艳,吴玲,王霞,陈斌,赵娟,崔娟,李忠,杨娟,吴玲,吴娟,张刚,马忠。棉花漆酶基因GhLAC15通过增加植物细胞壁的防御木质素和木质素成分来增强植物对黄萎病的抗性。植物病理学杂志,2019;20(3):309-22。https://doi.org/10.1111/mpp.12755.
- 36.
曹霞。模式识别受体信号在健康与疾病中的自我调节和交叉调节。免疫学杂志,2016;16(1):35-50。https://doi.org/10.1038/nri.2015.8.
- 37.
Couto D, Niebergall R, Liang X, Bücherl CA, Sklenar J, Macho AP, Ntoukakis V, Derbyshire P, Altenbach D, Maclean D, Robatzek S, Uhrig J, Menke F, Zhou JM, Zipfel C.拟南芥蛋白磷酸酶PP2C38负向调控中枢免疫激酶BIK1。PLoS Pathog. 2016;12(8):e1005811。https://doi.org/10.1371/journal.ppat.1005811.
- 38.
李志强,李志强,李志强,等。植物模式识别受体在广谱抗病中的功能、发现和开发。植物科学进展。2017;36(1):357 - 357。https://doi.org/10.1146/annurev-phyto-080614-120106.
- 39.
张斌,邵玲,王娟,张艳,郭霞,彭燕,曹颖,赖志。BAK1磷酸化ATG18a抑制植物自噬,降低植物对坏死性病原体的抗性。自噬。2020;26:1-18。
- 40.
张旭,Valdés-López O, Arellano C, Stacey G, balut - kurti P.玉米的遗传解剖MAMP响应。应用物理学报,2017;30(6):1155-68。https://doi.org/10.1007/s00122-017-2876-6.
- 41.
Petutschnig EK, Jones AM, Serazetdinova L, Lipka U, Lipka V.溶素motif受体样激酶(LysM-RLK) CERK1是一种主要的几丁质结合蛋白拟南芥并且受到几丁质诱导的磷酸化作用。中国生物医学工程学报,2010;29(4):457 - 457。https://doi.org/10.1074/jbc.M110.116657.
- 42.
刘志刚,刘志刚,刘志刚。植物-微生物相互作用中模式识别受体的研究进展。植物学报,2018;29(4):344 - 344。https://doi.org/10.1111/tpj.13808.
- 43.
高玉峰,刘建科,杨富民,张广元,王东,张林,欧一斌,姚亚。WRKY转录因子WRKY8促进植物对病原菌感染的抗性,并介导植物对干旱和盐胁迫的耐受茄属植物lycopersicum.中国生物医学工程学报。2020;38(1):344 - 344。https://doi.org/10.1111/ppl.12978.
- 44.
Ramos RN, Martin GB, Pombo MA, Rosli HG. WRKY22和WRKY25转录因子是防御反应的正向调节因子烟草benthamiana.植物分子生物学杂志,2011;26(1):344 - 344。https://doi.org/10.1007/s11103-020-01069-w.
- 45.
彭勇,Bartley LE,陈x, Dardick C,陈m,阮r, Canlas PE, Ronald PC。OsWRKY62是基础和xa21介导的防御的负调控因子米白单胞菌。oryzae在大米。植物学报,2008;1(3):446-58。https://doi.org/10.1093/mp/ssn024.
- 46.
Ifnan Khan M,张勇,刘志,胡娟,刘超,杨s, Hussain A, Furqan Ashraf M, Noman A,沈玲,夏霞,杨峰,管东,何山。辣椒中的CaWRKY40b作为负调控因子响应Ralstonia solanacearum通过直接调节包括CaWRKY40在内的防御基因。国际分子化学杂志,2018;19(5):1403。https://doi.org/10.3390/ijms19051403.
- 47.
王志强,王志强,王志强,等。钙依赖性蛋白激酶对植物免疫信号通路的调控。分子植物-微生物相互作用。2019;32(1):6-19。https://doi.org/10.1094/MPMI-09-18-0267-FI.
- 48.
杜志刚,李志刚,李志刚,等。棉花根系和下胚轴组织基因表达谱的变化镰孢枯萎菌.Mol植物-微生物相互作用。2004;17(6):654-67。https://doi.org/10.1094/MPMI.2004.17.6.654.
- 49.
邹松,王辉,李勇,孔智,唐东。NB-LRR基因Pm60与小麦抗白粉病有关。植物学报,2018;18(1):298-309。https://doi.org/10.1111/nph.14964.
- 50.
Césari S, Kanzaki H, Fujiwara T, Bernoux M, Chalvon V, Kawano Y, Shimamoto K, Dodds P, Terauchi R, Kroj T. NB-LRR蛋白RGA4和RGA5在功能和物理上相互作用,赋予抗病性。Embo j . 2014;33(17): 1941-59。https://doi.org/10.15252/embj.201487923.
- 51.
对生物营养性和坏死性病原体防御机制的比较。植物科学进展。2005;43(1):205-27。https://doi.org/10.1146/annurev.phyto.43.040204.135923.
- 52.
贾华,张超,peraiz T,赵鹏,刘震,王波,王超,张玲,方杰,钱杰。茉莉酸参与葡萄果实成熟和抗性葡萄孢菌.中国生物医学工程学报。2016;16(1):79-94。https://doi.org/10.1007/s10142-015-0468-6.
- 53.
Dombrecht B, Xue GP, Sprague SJ, Kirkegaard JA, Ross JJ, Reid JB, Fitt GP, Sewelam N, Schenk PM, Manners JM, Kazan k。植物学报。2007;19(7):2225-45。https://doi.org/10.1105/tpc.106.048017.
- 54.
Ali S, Mir ZA, Tyagi A, Mehari H, Meena RP, Bhat JA, Yadav P, Papalou P, Rawat S, Grover A芸苔属植物juncea对真菌病原体具有广谱抗性。植物科学,2017;8:1693。https://doi.org/10.3389/fpls.2017.01693.
- 55.
Johnson C, Boden E, Arias J.水杨酸和NPR1诱导反式激活TGA因子招募到防御基因启动子。植物学报。2003;15(8):1846-58。https://doi.org/10.1105/tpc.012211.
- 56.
丁艳,孙涛,奥凯,彭艳,张艳,李霞,张艳。水杨酸受体NPR1和NPR3/NPR4在植物免疫转录调控中的相反作用。中国生物医学工程学报。2018;173(6):1454-67 e15。
- 57.
袁敏,黄艳,葛伟,贾震,宋松,张玲,黄艳。茉莉酸、乙烯和水杨酸信号通路对诱导的系统性抗性的影响木霉属longibrachiatum黄瓜中的H9。BMC基因组学。2019;20(1):144。https://doi.org/10.1186/s12864-019-5513-8.
- 58.
程强,董玲,高婷,刘婷,李楠,王玲,常鑫,吴娟,徐萍,张松。bHLH转录因子GmPIB1促进了对bHLH的抗性疫霉突变在大豆.应用物理学报,2018;69(10):2527-41。https://doi.org/10.1093/jxb/ery103.
- 59.
闫松,宁科,王震,刘霞,钟勇,丁磊,紫红,程震,李霞,单红,吕强,罗磊,刘荣,闫磊,周震,Lucas WJ,张旭。CsIVP在黄瓜脉管发育及霜霉病抗性中的作用。公共科学图书馆。2020;18(3):e3000671。https://doi.org/10.1371/journal.pbio.3000671.
- 60.
张玉玲,张春林,王桂兰,王玉玉,齐超,赵强,游彩霞,李云云,郝玉杰。R2R3 MYB转录因子MdMYB30通过调节角质层蜡生物合成来调节植物对病原体的抗性。BMC植物生物学,2019;19(1):362。https://doi.org/10.1186/s12870-019-1918-4.
- 61.
崔娟,姜宁,周霞,侯霞,杨刚,孟J,栾勇5种对水分亏缺和盐胁迫具有耐受性。足底。2018;248(6):1487 - 503。https://doi.org/10.1007/s00425-018-2987-6.
- 62.
Tezuka D, Kawamata A, Kato H, Saburi W, Mori H, Imai R.水稻乙烯反应因子OsERF83正向调控抗病性Magnaporthe oryzae.植物物理学报。2019;135:263-71。https://doi.org/10.1016/j.plaphy.2018.12.017.
- 63.
刘健,王勇,赵刚,赵健,杜辉,何霞,张慧海岛棉ERF转录因子,GbERFb,调节宿主反应和抗性黄萎病dahliae在烟草。中国生物工程学报,2017;23(1):125-34。https://doi.org/10.1007/s12298-016-0402-y.
- 64.
孙旭,于刚,李娟,刘娟,王霞,朱刚,张霞,潘慧滨藜属canescens,正调节渗透和疾病抗性拟南芥.植物科学通报2018;https://doi.org/10.1016/j.plantsci.2018.05.004.
- 65.
刘强,闫松,黄伟,杨娟,董娟,张松,赵娟,杨涛,毛霞,朱霞,刘波。NAC转录因子ONAC066通过抑制ABA信号通路正向调控水稻抗病性。中国生物医学工程学报,2018;29(4):379 - 379。https://doi.org/10.1007/s11103-018-0768-z.
- 66.
王斌,魏军,宋娜,王宁,赵军,康哲。小麦NAC转录因子TaNAC30对小麦抗条锈病抗性的负调控作用。中国生物医学工程学报,2018;26(5):432-43。https://doi.org/10.1111/jipb.12627.
- 67.
段勇,姜勇,叶松,Karim A,凌震,何勇,杨松,罗坤。水杨酸诱导的杨树WRKY转录因子PtrWRKY73参与杨树抗病拟南芥.植物细胞学报2015;34(5):831-41。https://doi.org/10.1007/s00299-015-1745-5.
- 68.
邹玲,杨峰,马勇,吴强,易凯,张东。转录因子WRKY30介导拟南芥对黄瓜花叶病毒的抗性。生物化学学报。2019;517(1):118-24。https://doi.org/10.1016/j.bbrc.2019.07.030.
- 69.
刘伟,泰辉,李生,高伟,赵敏,谢超,李文祥。bHLH122在拟南芥抗旱性和渗透胁迫抗性以及ABA分解代谢抑制中起重要作用。植物学报。2014;201(4):1192-204。https://doi.org/10.1111/nph.12607.
- 70.
徐伟,张楠,焦勇,李锐,肖东,王忠。拟南芥bHLH转录因子正向调节cbf通路并增强其对冷胁迫的耐受性。Mol Biol杂志2014;41(8):5329-42。https://doi.org/10.1007/s11033-014-3404-2.
- 71.
周娟,李峰,王金林,马勇,崇坤,徐亚友。野生水稻的基本螺旋-环-螺旋转录因子(OrbHLH2)提高了拟南芥对盐胁迫和渗透胁迫的耐受性。中国植物学报,2009;26(3):344 - 344。https://doi.org/10.1016/j.jplph.2009.02.007.
- 72.
引用本文赵红,苗红梅,高海涛,倪玉霞,魏力斌,刘海宇。芝麻种质资源抗枯萎病的鉴定与评价Macrophomina phaseolina[J] .河南农业科学,2012;41(11):82-7。
- 73.
陈YH。芝麻品种茎腐病抗性鉴定及SiPYL4和SiTLP基因功能分析[D]:郑州大学;2019.
- 74.
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。https://doi.org/10.1038/nmeth.3317.
- 75.
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.用RNA-Seq绘制和量化哺乳动物转录组。光子学报。2008;5(7):621-8。https://doi.org/10.1038/nmeth.1226.
- 76.
Pertea M, Pertea GM, Antonescu CM, Chang TC, Mendell JT, Salzberg SL. StringTie能够改善RNA-seq reads的转录组重建。中国生物工程学报。2015;33(3):290-5。https://doi.org/10.1038/nbt.3122.
- 77.
裴德华,李志强,李志强,等。应用HISAT、StringTie和Ballgown进行RNA-seq实验的转录水平分析。自然科学进展。2016;11(9):1650-67。https://doi.org/10.1038/nprot.2016.095.
- 78.
Robinson MD, Oshlack A. RNA-seq数据差异表达分析的标度归一化方法。中国生物医学工程学报。2010;11(3):R25。https://doi.org/10.1186/gb-2010-11-3-r25.
- 79.
Robinson MD, McCarthy DJ, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的生物导体包。生物信息学,2010,26(1):139 - 40。https://doi.org/10.1093/bioinformatics/btp616.
- 80.
Benjamini Y, Hochberg Y.控制错误发现率:一种实用而强大的多重测试方法。张晓明,王晓明,王晓明,等。
- 81.
张志刚,张志刚。依赖条件下多重测试错误发现率的控制。安统计2001;29:1165-88。
- 82.
金J,田F,杨,孟YQ,香港L,罗J,高g . PlantTFDB 4.0:对中央在植物转录因子和监管中心交互。核酸研究,2017;45(D1): D1040-5。https://doi.org/10.1093/nar/gkw982.
- 83.
朗菲尔德P,霍瓦特S. WGCNA:加权相关网络分析的R包。生物信息学。2008;9(1):559。https://doi.org/10.1186/1471-2105-9-559.
- 84.
Su G, Morris JH, Demchak B, Bader GD。生物网络探索与Cytoscape 3。《生物信息学》,2014;47:8.13.1-24。
- 85.
刘明明,刘海宇,田明明。芝麻侵染菌内参基因的筛选Macrophomina phaseolina[J] .作物学报,2012;38(03):471-8。https://doi.org/10.3724/SP.J.1006.2012.00471.
确认
感谢河南省农业科学院芝麻研究中心提供的芝麻品种。我们也感谢李春提供的技术援助。
资金
本工作得到中国农业科研系统专项资金(car -14)和河南省科技重大专项资金(201300110600)的支持。资助机构在研究的设计和数据的收集、分析和解释中没有任何作用,在撰写手稿时应该声明。
作者信息
从属关系
贡献
HL、BT、YN、XL、HZ协助进行实验。YC和MJ准备了植物材料。ML协助实验,WY负责实验、数据分析和稿件撰写。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1
.基因组作图和基因作图区域。
附加文件2:表S2
.在DS和DR中,DEGs涉及36 HPI的两条重要途径。
附加文件3:表S3
.DR和DS的总体tf。
附加文件4:表S4
.qPCR引物对序列。
附加文件5:表S5
.DEGs参与了芝麻抗MP的PTI和ETI。
附加文件6:图S1
.30个样本的PCA。
附加文件7:图S2 .
.DS和DR中基因表达(FPKM> 0.1)的概述。
附加文件8:图S3
.DS和DR中的DEGs。
附加文件9:图S4
.前30个GO术语富集了DR中上调的DEGs功能类别,分别为12 HPI (A)、24 HPI (B)、36 HPI (C)、48 HPI (D)。
附加文件10:图S5
.接种前(0 h),前30个GO术语丰富了DR和DS之间DEGs的功能类别。
附加文件11:图S6
.前30个GO术语丰富了DR和DS之间52个常见deg的功能类别。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
燕,W.,倪,Y.,刘,X。et al。芝麻抗性的机理Macrophomina phaseolina通过比较抗性和易感芝麻基因型的转录组发现。BMC植物生物学21日,159(2021)。https://doi.org/10.1186/s12870-021-02927-5
收到了:
接受:
发表:
关键字
- Macrophomina phaseolina
- 胡麻属indicum
- 转录组
- 抗病性
- 分子机制