抽象的
背景
乙酰菌酮(3,5-二甲氧基-4-羟基乙酮,AS)是在自由形式的植物中很少发现的纤维素型酚类化合物。迄今已逐步抑制增长假单胞菌过氧化氢和过氧化物酶(AS混合物)存在下的细菌。
结果
我们检测到升高的自由水平尼科尼亚塔哈瓦姆和N. Benthamiana.通过注射细菌Elicitor FLG22或致病性 - 突变体诱导模式触发的免疫(PTI)后植物假单胞菌含油pv。两61HRCC.- 细菌;但在PTI发作时与兼容或不相容的病原体的接种后没有。在这项研究中,我们证明了作为混合物的抗菌效果是一般的,因为几种革兰氏阴性植物致病细菌的生长是特征性地抑制的。随着混合物的抑制作用是迅速的,所示的发光强度的直接下降p .两pv。番茄DC3000 lx菌株加入AS混合后。用荧光报告染料法研究了抑菌作用的机理。SYTOX Green实验支持了其他人先前的发现,即AS混合物不会导致膜渗透。此外,我们观察到作用方式可以是细菌细胞膜的去极化,这在电压敏感染料DIBAC的实验中得到了证实4(3)。
结论
在烟草叶片的植物PTI反应期间升高自由乙酰血红素酮(N. Tabacum.和N. Benthamiana.).与过氧化氢和过氧化物酶(作为混合物)结合时,混合物的组分协同作用,以迅速抑制细菌代谢和迅速增殖在各种植物病原体中。这种效果与去极化而不是透化细菌细胞膜有关。与体内模型的混合物类似,在侵入植物细胞的侵袭细菌附着的部位和乙酰菌酮的存在可能在PTI期间抑制细菌增殖中存在重要作用。
背景
与哺乳动物的先天免疫应答类似,植物也具有称为模式触发的免疫(PTI)的诱导型电阻系统。这种形式的植物抗性重新创新具有哺乳动物的诸如Toll样受体(TLR)等结构的模式识别受体(PRR)。类似于先天免疫应答的PTI可以通过微生物相关分子模式(MAMPS)触发。这些包括来自细菌鞭毛蛋白(FLG22)的保守肽,伸长因子Tu(EF-TU),肽聚糖(PGN),脂多糖(LPSS),XA21介导的水稻抗免疫活化剂(AX21)(综述:[1,2])。PTI也可以诱导在Planta.非病原体:腐生植物、共生植物(例如:荧光假单胞菌)或致病性突变体(如。假单胞菌含油pv。两61HRCC.-) (3.,4,5].PTI对广泛的微生物有效,能够抑制机会主义病原体。其早期的信号传导事件包括快速钙流入,激活促乳丝糖苷活化蛋白激酶(MAPK)磷酸化级联,然后导致反应性氧物质(ROS),核糖沉积和防御基因表达,可能介导微生物生长的抑制[6].Disease-inducing,毒性p .两pv。Tabaci.在烟草植物中能够阻断用于信号转导和转录调节相关蛋白的特定基因的混乱诱导的表达水平改变[7].
在我们以前的工作期间,我们识别出超过400个表达的序列标签(EST),代表在PTI期间激活的176个单独基因尼科尼亚塔哈瓦姆.苯丙醇丙烷合成相关基因高度代表并覆盖了苯丙醇丙烷途径目前已知网络的主要部分[8].我们的假设是苯丙基丙酮途径的元素可能在PTI对细菌对细菌的抑制作用中起重要作用,即通过导致细胞壁设防或通过具有直接抗微生物作用的酚类化合物,或者通过作为信号剂,影响细菌的毒力因子。木质素单体和相关化合物合成的褐化和诱导长期与植物防御有关[9,10.],最近患有FLG22诱导的免疫力拟南芥[11.].近年来,木质素沉积已被证实能在空间上限制病原菌,并限制其在体内的运动拟南芥[12.].
贝克及其同事[13.检测到乙酰苯胺酮(AS)和其他一些酚类的积累N. Tabacum.细胞培养物,当用悬浮液处理时p .两pv。两菌株B7(非HR诱导)。后来他们也表明了这一点P.荧光,一种非致病性物种引起的质质体液中AS升高N. Tabacum.[14.].在这项研究中,我们描述了检测和识别N. Benthamiana.和N. Tabacum.leaves using high-performance liquid chromatography-diode array detection-mass spectrometry (HPLC-DAD-MS), moreover, we show the MAMP (i.e. flg22) associated accumulation of this phenolic compound, and suggest that it is a marker of PTI in tobacco plants.
我们寻求两者在PTI期间积累的化合物烟草模型物种,因为N. Tabacum.是一种学习细菌相互作用的古典模型植物Solanaceae.家族,平行数据来自N. Benthamiana.也许以后也会被证明是有用的,因为瞬时沉默和过表达的研究更容易在后者中进行。我们研究了AS的出现是否是PTI的特异性表现N. Benthamiana.以及它是否与PTI的发病时间相关,使用HPLC-DAD-MS。根据AS作为漆酶活性增强剂的报道[15.],当与辣根过氧化物酶和过氧化氢结合时具有抗菌活性[16.],我们测试了多种植物致病菌,以检测其抗菌活性。我们也使用了发光p .两pv。番茄DC3000菌监测对细菌代谢活性的影响。最后,为了了解AS的作用模式,我们使用荧光染料测量受影响细菌的膜透性和膜去极化。
结果
鉴定乙酰菌酮,代谢物与PTI发作相关
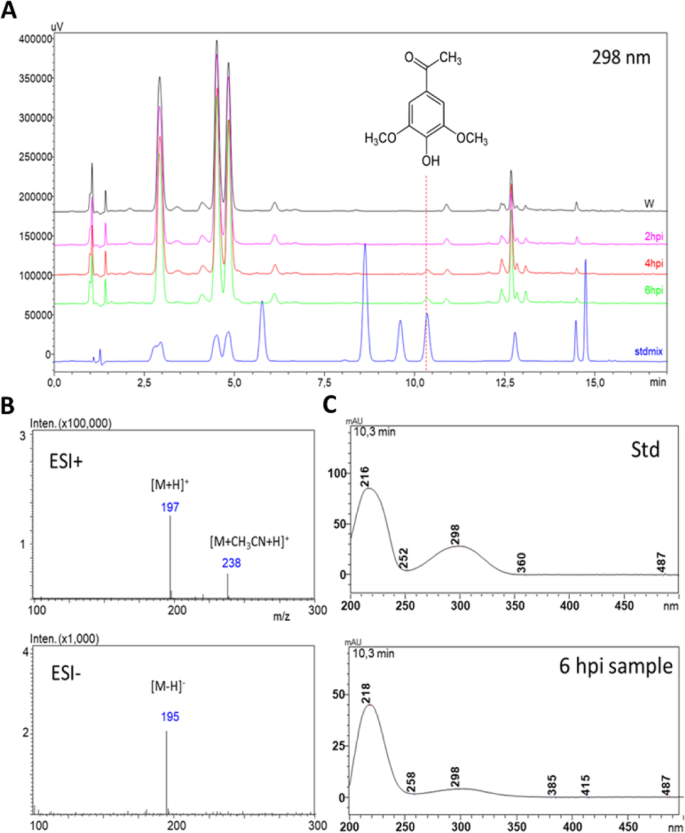
我们的第一个目标是检测和识别酚代谢物,特别是更多(或更少)在N. Benthamiana.与PTI发作结合的叶子。N. Benthamiana.树叶上浸透着假单胞菌含油PV..Syringae HRCC.- (P. s。Syringae HRCC.- )悬浮液或FLG22肽诱导PTI,以及水作为对照。两种PTI诱导剂都是在接种后6小时内引起可靠的HR抑制的浓度(50μm的FLG22,P. s。Syringae HRCC.- 109CFU/ml),基于Nguyen等人和Chakravarthy等人的研究[17.,18.].HR的抑制,有时被称为“HR测试”,是有效PTI发病的指标,与能够在挑战性接种后阻止细菌增殖的局部耐药性的发病密切相关[3.,8,17.].叶样品被培养6小时,通过HPLC-DAD-MS分析提取物,得到与相关的酚类化合物相关。提取N. Benthamiana.根据文献中的建议,用90%甲醇进行叶片进行叶片[19.].
我们在PTI诱导中检测了几种推定的酚类化合物(具有特征紫外光谱)N. Benthamiana.叶子(数据未显示)。别人的作品[13.,20.进行;进行N. Tabacum.帮助鉴定了其中一些化合物。在这份手稿中,我们着重于一个特定的化合物(m / z.197 [M + H]+),选择性地发生在pti诱导的(接种后6小时,现病史)N. Benthamiana.叶子(图。1a),经质谱分析鉴定为乙酰丁香酮(3,5-二甲氧基-4-羟基苯乙酮)。1b)和UV(图。1c)光谱和保留时间(图。1A)分析标准。将标准化合物添加到植物提取物中,可使假定的AS峰明显升高。
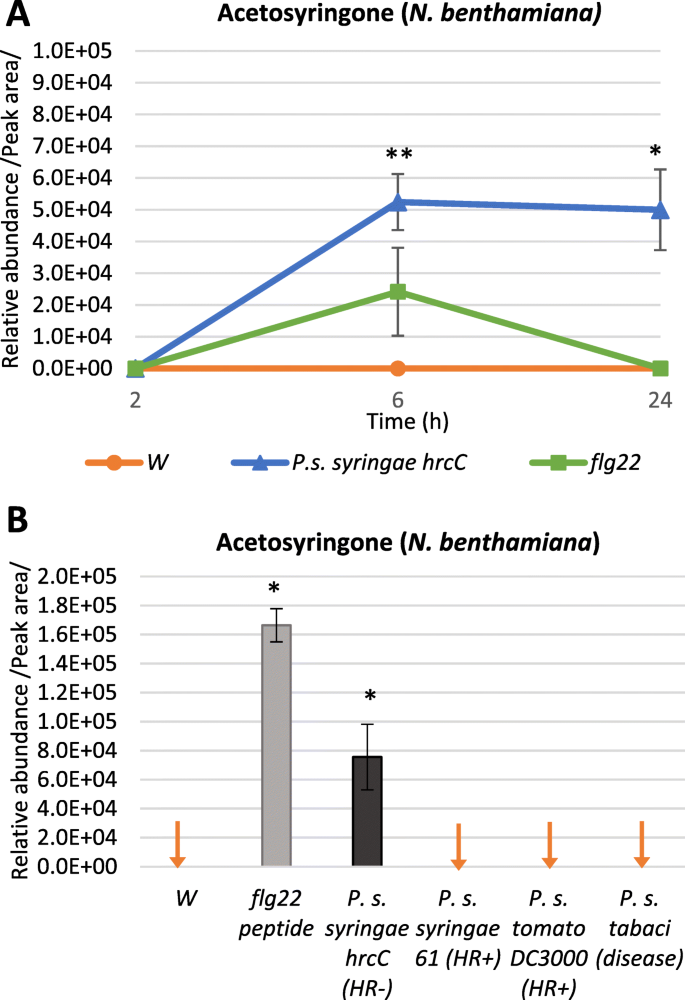
我们发现阿斯伯格综合症特别有趣,因为除此之外P. s。Syringae HRCC.- 治疗,它也强烈诱导在肽处理的FLG22N. Benthamiana.叶子,但在6hPI的水处理对照中尚未检测到(图。2一种)。与两者叶片中的PTI密切相关的丰富N. Benthamiana.(无花果。2A)和烟草(n .烟草附加文件1).第一次被隔离N. Tabacum.叶渗出液和根培养基,其中被确定为特定的渗出液,而不是被动地从受损的植物细胞中渗出[21.].Baker等人。报告烟草细胞培养培养基中的积累[13.]并且在妊娠液中[14.]用不同的细菌治疗后。
酚代谢物水平的变化
为了了解AS水平的升高是否发生在不同的植物-细菌相互作用中,我们分析了来自6个hpi样本N. Benthamiana.用相容细菌的悬浮液注射的叶子:假单胞菌含油pv。Tabaci.,两个不相容的细菌:p .两PV..番茄DC3000和p .两PV..两61,PTI诱导细菌:p .两PV..Syringae HRCC.- (10.9CFU/ml), pti诱导MAMP: flg22肽。对水处理的对照也进行了分析。有趣的是,AS显示出一种独特的模式:它只在flg22和p .两PV..两hrcC) - - -处理样品-两种PTI诱导样品;但在使用浓度下的其他样品中却不存在(低于检测限)(图。2b).时间过程实验均支持AS在有效PTI形成过程中逐渐积累N. Benthamiana.(无花果。2a)和N. Tabacum.(附加文件1).应注意,在接种接种时抑制HR抑制和相容细菌的增殖似乎存在共同的共同;在诱导PTI后,通常也在5-6小时内变得有效[22.].
乙酰苯甲酸酮酮与过氧化氢和过氧化物酶对植物病原菌的抗菌作用
有报道称AS或相关苯乙酮具有抗真菌或抗菌作用。罗瑞莫和佩里[23.[报告分离来自两个主要抗真菌活性成分的Plagiochila下方(新西兰苔类)。经鉴定为2-羟基-4,6-二甲氧基苯乙酮和2-羟基-3,4,6-三甲氧基苯乙酮。粗提物相对较高的活性是由于植物中这些化合物的含量较高(两者均为6-7 mg/g的干燥植物)。根据Mock等人的研究,过氧化氢通过过氧化物酶对AS进行体外氧化,可以创建一个长时间的氧化环境,类似于接种不相容细菌的烟草悬浮细胞中的氧化爆发。[16.].
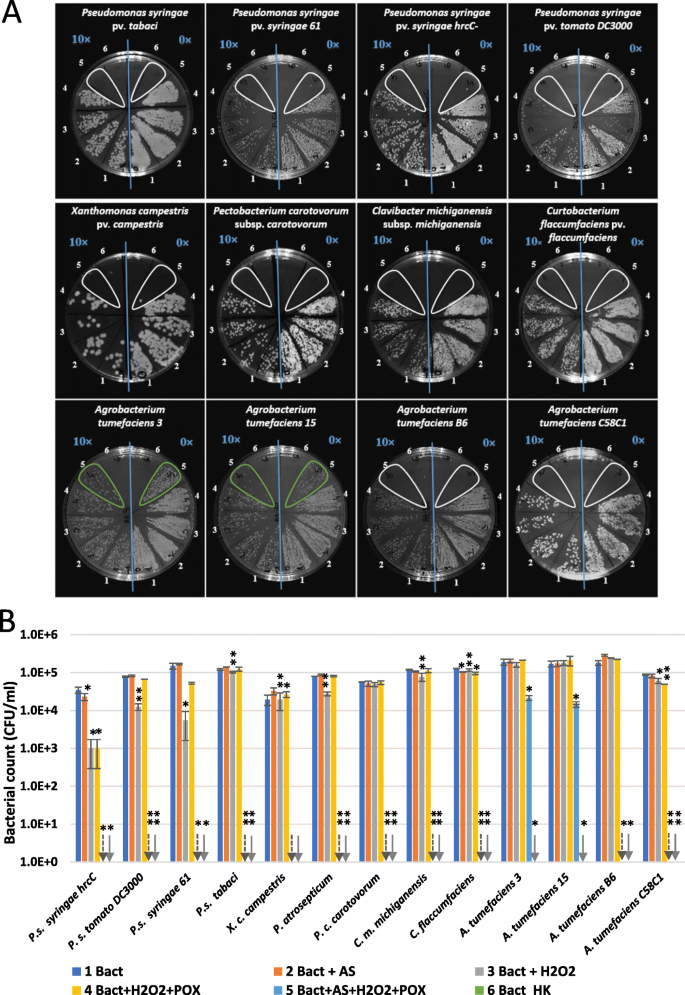
基于后者,我们在体外氧化方面测试了对应于对应于不同植物(烟草)相互作用的细菌菌株的抗微生物菌株(图。3.A-B)。P. s。pv。番茄DC3000和P. s。pv。两61和PTI诱导细菌P. s。pv。Syringae HRCC.- 测试和其他植物病原细菌,包括野生型瘤瘤农杆菌肿瘤术菌株(来自樱桃,酸樱桃和大丽花)[24.裁员的实验室菌株(A. Tumefaciens.C58C1)[25.].V骚扰基因农杆菌被AS激活,它们被认为是PTI标记基因的弱诱导剂(Szatmári et al. 2006)。我们将50 μM AS和50 μM H组合在一起2O2含有10个磷酸盐缓冲液中的0.72u / ml过氧化物酶,含有10个5CFU/ml不同细菌悬液。共孵育3 h后,进行连续稀释。没有生长假单胞菌,Xanthomonas.,胶杆,Clavibacter要么铜段在完全反应混合物中孵育3小时后检测到菌株。相反,农杆菌在两个被检测的菌株中,生长被保留下来。当省略不同成分的混合物时,有的假单胞菌菌株仍然抑制在各种程度上。例如CFU计数P. s。pv。Syringae HRCC.- 用H处理时,通过一个数量级降低2O2和过氧化物酶。然而,当混合物用作时完成时,根本没有检测到生长。单独对任何菌株无效,因此乙酰苯胺酮与过氧化物酶活性的组合是必需的。烟草过氧化物酶活性的活化在Planta.在PTI期间,在PTI期间的时间间隔已经显示出早先[3.].
乙酰氧化酮对不同植物致病细菌氧化形式的抗菌作用。细菌(10.5 CFU/ml) were added to reaction mixtures containing 50 μM AS, 50 μM H2O2,和0.72u / ml辣根过氧化物酶,省略了各种对照混合物,从中省略了一种或两种组分。在CFU测定的共育3小时后镀连续稀释液。一个镀膜B琼脂平板上镀层的连续稀释液的典型代表性实例。每块板的右半部分:无稀释(0×),每个板的左侧:10×稀释(用蓝色刻字表示)。适用于细菌悬浮液的治疗组合的编号:1。未治疗的对照;2.作为;3. H.2O2;4.2O2+痘;5. + h2O2+痘;6.香港。b图显示了结果的量化。误差条表示标准差。星号根据学生的T检验,与相应的水处理对照有显着差异(*p< 0.1;Arunachal Pradesh,p< 0.05)。向下箭头表示零值。缩写:Bact:细菌,As:acetosyringone,香港:热杀害,痘:辣根过氧化物酶
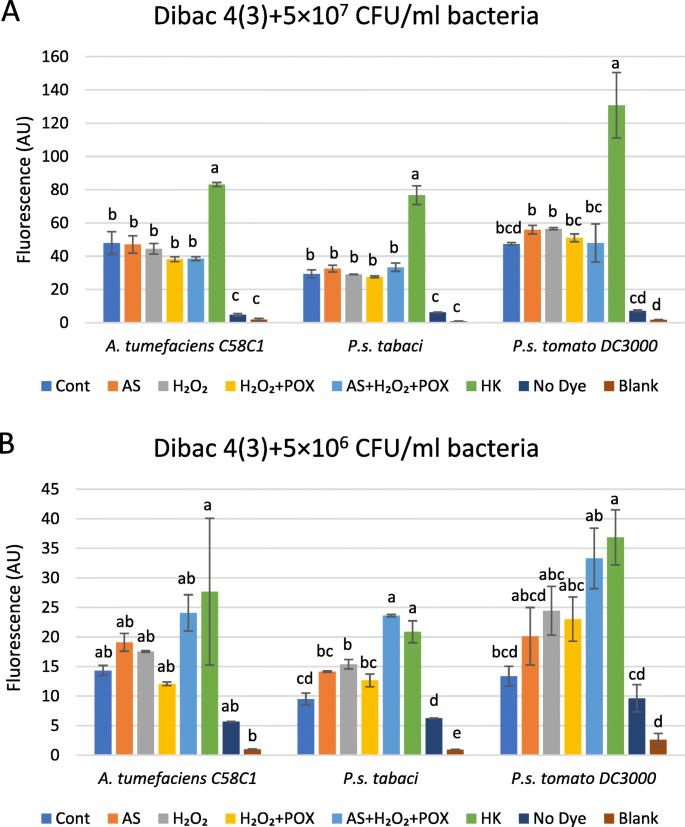
当相同的浓度为h时2O2和过氧化物酶与较高浓度的细菌合并,混合物在CFU还原中无效。在5×107 CFU/ml假单胞菌含油pv。Tabaci.和农杆菌肿瘤术C58C1显然不受影响,并且在5×106 CFU/ml they only showed a 5–6-fold reduction in CFU counts (Additional file2).根据细菌浓度似乎似乎对抗氧化效果的细菌浓度似乎是强烈的因素。
我们对混合成分后AS混合物发生的变化感到好奇。我们发现,只有在完整的AS混合物中,AS的数量随时间而减少,但在含有AS+POX或AS+H的部分混合物中没有2O2(附加文件3.一种)。新化合物仅在后面的180分钟期间出现(附加文件3.b)。
The LC–mass spectrometry analysis of the full AS mix reaction yielded m/z peaks corresponding to AS itself (m/z = 197, [M + H]+; (m/z = 195, [M-H]-); putative compounds syringaldehyde (m/z = 183, [M + H]+; (m/z = 181, [M-H]-) and 2,6-DMQB (2,6-dimethoxy-p-benzoquinone, m/z = 169, [M + H]+) and several other peaks corresponding to unknown compounds (Additional file3.b)。新形成的化合物的推定鉴定基于来自文献的数据[26.,27.].
过氧化氢酶和漆酶等氧化酶的催化循环通常涉及到酚类底物在酶催化过程中被氧化产生自由基时释放质子和电子后的中间苯氧基。苯氧自由基可参与自由基的重组、交叉偶联和自偶联,从而导致歧化、二聚、聚合或其他底物的氧化[26.,28.].预期所产生的化合物就是这种反应的产物。
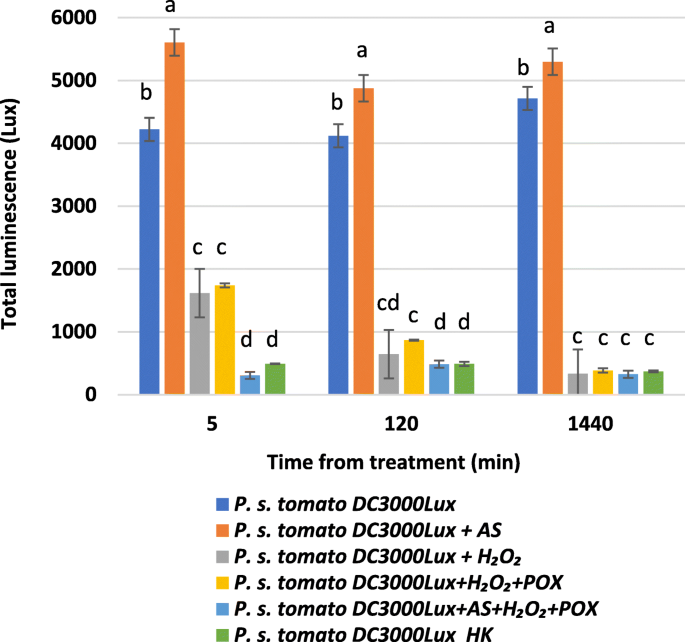
我们使用了发光p .两pv。番茄DC3000株染色体上标记有卢克达甲基因集群[29.]监测由氧化引起的细菌细胞活力的变化。可行的P. s。pv。番茄DC3000 Lucs细菌积极发出恒定的发光水平。我们计划在与氧化为氧化时监测发光的时间依赖性降低。我们发现,在给予AS + H后,我的发光水平几乎立即掉到了已经在第一次测量(5分钟)的热杀死细菌的背景水平2O2+ POX鸡尾酒(图。4).这种响应明显快于H引起的效果2O2单独或h.2O2与过氧化物酶相结合。单用AS不能降低生物发光。事实上,与未经处理的细菌相比,它似乎显著增加了生物发光,这一现象需要进一步的研究来找到解释。总之,这些结果表明,添加AS + H后,细菌的代谢活动立即停止2O2+ POX鸡尾酒。因此,不仅混合物更有效地抑制细菌增殖比H更有效2O2单独+过氧化物酶,但至少在细菌上表现得更快,至少就代谢活性而言。
用选择性染料增强荧光检测乙酰丁香酮混合处理的细菌细胞的活力和膜去极化
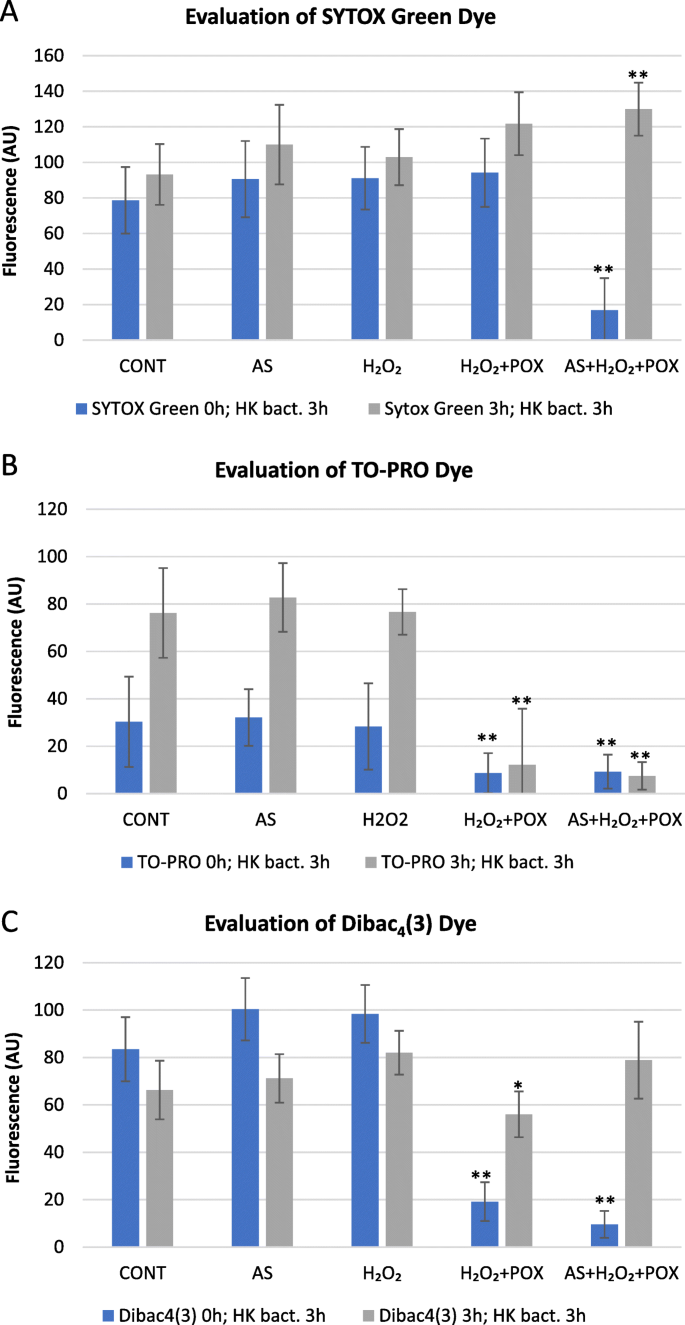
我们测试了几种荧光染料,以检测AS混合物处理后细菌的活力(图)。5A-C)。Sytox Green和TO-Pro-3碘化物测定通常用于评估细菌细胞膜完整性,而Dibac4(3)已知能够报告较慢的速度膜去极化。 With DIBAC4(3)和TO-PRO-3碘化物我们发现H2O2+ POX和AS + H2O2+ POX混合物导致添加染料的漂白(图。5b, c),通过添加热杀菌(HK BACT)进行检测,因此无法有效检测染色。乙酰丁香酮(和其他酚类化合物)的脱色增强作用是已知的,它可以通过侵略性氧化来促进染料的脱色。与其他测试分子相比,AS似乎是一种优越的漂白介质[15.].因为+ h中的氧化还原潜力2O2+ POx混合物在2-3小时后返回到几乎基础水平[16.],在将反应混合物加入孔后,我们加入3小时后加入荧光染料。这允许检测Sytox Green和Dibac4(3)香港Bact + H中的荧光2O2+ POX和HK BACT + AS + H.2O2+ Pox混合物也是如此(图。5A,C),而在PRO-3碘化物的情况下,漂白仍然发生并且仍然没有可检测荧光。这种现象可能意味着在3小时内仍然存在显着的氧化能力在H中2O2+ POX和AS + H2O2+能够漂白为-PRO-3的POx混合物(图。5b),但不是Sytox Green和Dibac4(3)(图。5a,c)。在3小时孵化期间,迄今为止似乎似乎经历了对照井的显着衰落。因此,我们得出结论,Dibac4(3)是一种合适的染料,用于通过AS + H处理细胞后的细菌细胞膜去极化2O2+ POx混合物,给出在加入原始反应混合物后仅添加染料3小时。
不同荧光染料的适用性评价在混合体系中检测膜渗透性和膜去氧的膜渗透。测试不同的荧光染料以测量膜渗透性:Sytox Green(一个),to-pro(b);和膜去偏振:DIBAC4(3)(c).在含50μm的反应混合物中指示剂染料的荧光染料,50μmH2O2测量省略了0.72U / mL POX,以及省略了一种或两种组分的各种对照混合物。在制备混合物后立即(0h)或3小时加入荧光染料,以查看是否发生漂白。香港p .两pv。Tabaci.混合液配制3 h后加入悬浮液至5 × 106 CFU/ml final density. Fluorescence was measured 4 h after preparation of the mixtures. Error bars indicate standard deviations. Asterisks indicate significant difference from corresponding controls according to student’s T-test (*p< 0.1;Arunachal Pradesh,p< 0.05)。缩写:续:未经治疗的细菌,AS:acetosyringone,香港:热杀死,痘:辣根过氧化物酶,Au:任意单位
DIBAC4(3)是一种电压敏感的荧光染料,可用于监测膜电位的耗散,而不仅仅是像碘化丙啶(PI)或SYTOX绿色染料那样一般地增加膜透性[30.].后者染料只能在膜完整性受到损害时渗透细菌细胞并染色核核。然而,细胞的死亡也可能因透射跨膜电位而导致,这可以通过电压敏感的荧光染料(如Dibac)来检测4(3)。该染料报告了长期去极化但不测量即时变化[31.].
细菌膜的去极化有助于氧化乙酰苯胺酮对细菌的抑制作用
我们比较了DIBAC的高度4(3)对照中的荧光值和作为三种细胞浓度的三种物种的混合处理细菌悬浮液。将细菌孵育在混合物中3小时,然后达希克4(3),共孵育1 h后记录荧光(图3)。6A-B)。作为混合物在使用的两种细菌浓度下影响荧光。在5×107 CFU/ml there was none or just a small elevation in fluorescence as compared to the untreated control in any of the bacteria (Fig.6a).相比之下,在5 × 106 CFU/ml the fluorescence of the AS mix-treated bacteria was closer to the values of the heat killed controls (Fig.6b)。这与先前的发现相关,即在菌落形成单元的下降所涉及的情况下,较高浓度的细菌对混合的影响相同(第2.3节)。读取低于5×10的荧光6 CFU/ml bacterial density was not sensitive enough, therefore, we used microscopy to detect fluorescent cells in more diluted suspensions.
细菌膜去氧对氧化处理后的细菌密度的依赖性。悬架5×107(一个)和(b)5×106 CFU/ml ofp .两pv。Tabaci,P. inringaepv。番茄DC3000或A. Tumefaciens.将细菌加入含有50μm的反应混合物中,50μmH2O2, 0.72 U/ml POX,以及各种对照混合物,其中省略了一种或两种组分。用电压敏感DIBAC检测细菌膜极性4(3)治疗细菌后添加3小时。误差条表示标准差。酒吧上方的不同字母表示不同水平的DIBAC4(3) Tukey’s Test指定的荧光(p< 0.05)。缩写:续:不治疗的对照细菌,如:乙酰菌酮,香港:热杀死,痘:辣根过氧化物酶,空白:缓冲
相应的文献表明DIBAC4(3)在许多情况下与细菌细胞死亡有关,但到目前为止并不是所有情况,因为膜去极化并不一定意味着膜的充分渗透[30.].因此,在混合的情况下解决这个问题,我们发现有必要通过检测较大分子的膜渗透性,例如Sytox Green(图。7).
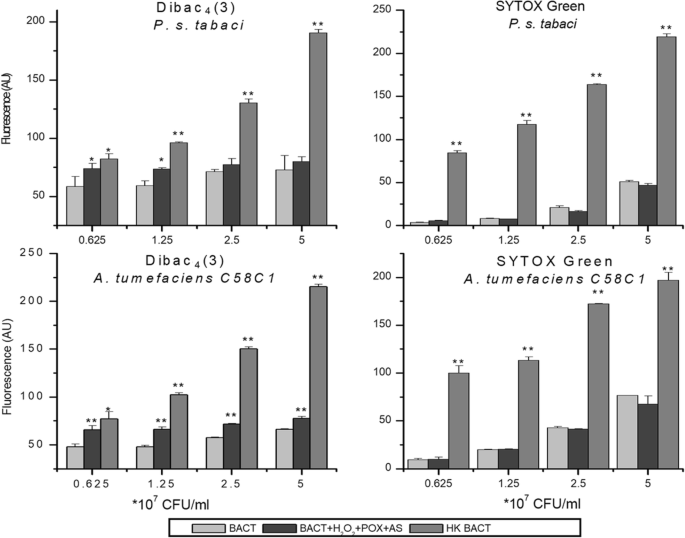
膜去极化和渗透性测试氧化后的细菌浓度为氧化术后。从5×10的稀释系列细菌7到0.625×107 CFU/ml ofp .两pv。Tabaci.和A. Tumefaciens.将C58C1细菌加入到含50μm,50μmH的反应混合物中2O2,和0.72 u / ml pox。未经治疗的细菌用作阴性,并作为阳性对照热杀死细菌。用电压敏感DIBAC检测细菌膜极性4(3)细菌处理3 h后,用SYTOX Green染色法染色,细胞膜通透性。误差条表示标准差。根据学生t检验(*),用星号表示与相应对照有显著性差异p< 0.1;Arunachal Pradesh,p< 0.05)。缩写:Bact:细菌,AS:Acetosyringone,HK:热杀死,痘:辣根过氧化物酶,AU:任意单位
为了测试,如果将混合物加入到植物病原体的细菌中,如果将细胞膜去氧的水平与细胞膜渗透率相关或发散,则将其与混合物相同的是,将混合物应用于具有增加密度的细菌悬浮液。一种假单胞菌和一个农杆菌随机选取菌株作为代表性菌株。热杀死的细菌被用作膜去极化(DIBAC)的阳性对照4(3))和膜渗透性(Sytox Green)。在细菌密度下(0.625×1071.25×107 CFU/ml), significant difference was detected between DIBAC4(3)未处理和AS混合处理细菌的荧光。在两种细菌中,这种差异随着细菌密度的增加而减小,而在两种细菌中,这种差异变得微不足道假单胞菌含油pv。Tabaci..这些数据表明,使用未知机制,细菌抵消了膜去偏振。与dibac相反4(3),用作混合物处理时,术毒素绿色荧光不会增加。这是所有密度的细菌都是如此。因此,我们得出结论,当细菌密度相对较低时,混合可能会诱导细菌膜的去极化,与乙酰苯乙烯酮混合物的组分的浓度相比。另一方面,没有发生细菌膜的透化性。
细胞活力的显微镜评价
荧光显微镜用于增强荧光测量,以可视化细菌细胞膜在低CFU时的去极化,并将其与可检测到的膜渗透程度进行比较。Postnikova等人对后者进行了研究[32.)p .两pv。两使用Live /Dead®Baclight荧光染色,其利用碘化丙锭(PI)来检测膜渗透性。作者发现通过氧化为细菌膜没有透化性。
在这里,我们使用与2.5节中的相同的染料。,因为两种染料都已显示为适合于细菌的显微镜检查。电压敏感染料DIBAC4(3)众所周知,不抑制细菌生长和增殖,因此甚至已经用于时间流逝显微镜[30.].Sytox Green广泛应用于细菌的活力染色。我们将每种染料用DAPI用作备受级别,以设想显微镜视野中的所有细菌。如前所述,作为混合物的抑制作用与细菌计数成反比,因此我们在这里使用了低(105CFU /毫升)的密度p .两pv。Tabaci.细菌,类似于CFU还原实验(附加文件2).将细胞作为3小时的对照温育或缓冲液作为控制,然后加入染料,然后再加入以防止氧化漂白(图。8).DIBAC4(3)在未处理的对照样品中不存在荧光,但在混合处理的样品和热杀灭样品中,它非常强烈强烈(图。8一种)。这意味着当细胞在混合物中孵育细胞时,细菌膜被去极化。相比之下,Sytox Green,透明膜的染料留下了作为混合物培养的细菌未持久,这意味着膜对较大分子没有渗透(图。8b)。显微镜实验结果支持通过荧光测量获得的结果。与过氧化氢和辣根过氧化物酶组合一起服用,导致膜去极化,但膜渗透性可忽略不计的膜渗透性,基于具有特定荧光染料的染色。
调查的在Planta.混合兼容的影响p .两pv。Tabaci.
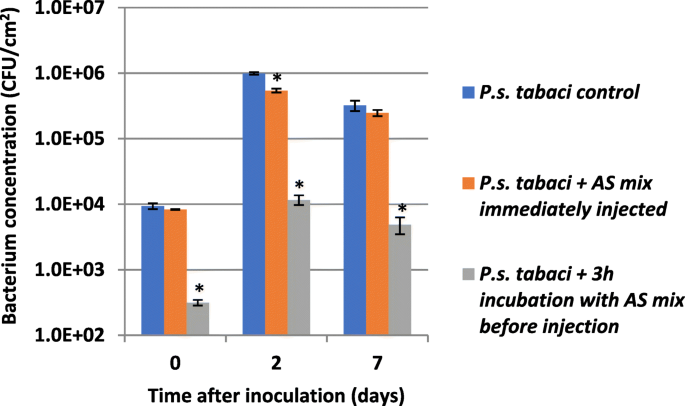
我们在体内实验中进行,看看外部管理作为混合的外部管理提高了烟草植物承受兼容攻击的能力p .两pv。Tabaci..将细菌悬浮在0.01M磷酸钾缓冲液(pH6)至10中6CFU /毫升。作为混合物组分(如,过氧化氢,辣根过氧化物酶)加入到体外使用的最终浓度(在2.4节中)。然后将制备的细菌混合物注射到烟草的中间区域,立即或在3小时后孵育,看看反应混合物是否能够抑制细胞内空间中的细菌细胞。通过在砂浆中研磨叶片从叶组织中与叶组织重新分离细菌,并通过稀释电镀计算菌落形成单元(图。9).
我们的结果表明,虽然适用于混合有效降低了菌落形成单位数p .两pv。Tabaci.CCA细菌。在孵育3小时内2级数量级,当将混合物立即注射到叶子中时,不会观察到菌落数的减少。p .两pv。Tabaci.无论预治疗的类型如何,细菌以相似的速度增殖。在每种情况下,在前两天中,细菌计数增加了约1.5-2的数量级,然后在第七天略有下降。与未处理的细菌和立即注射的细菌相比,体外预处理的细菌不能达到相对较高的表观增殖速率。从植物中恢复的菌落形成单位的比例接种在第3天结束时从30〜65倍增加到30至65倍。这告诉我们,如果部分细菌在VBNC状态下,它们显然无法在植物组织内恢复正常状态,在应用的情况下。
讨论
我们的结果表明,作为特异性出现的烟草代谢物N. Tabacum.和N. Benthamiana.PTI诱导后,hr阴性突变体均未诱导p .两pv。两hrcC) - - -当PTI开始对细菌繁殖开始有效时,细菌或FLG22 Elicitor肽在时间点(5-6 HPI),在氧化环境中导致体外的某些植物病原细菌的快速灭活。
在我们的研究中,AS仅在pti诱导的(flg22和P.Syringae HRCC.-)样品在6 hpi。这是特别有趣的,因为它被发现能迅速抑制几种植物病原假单胞菌细菌种类,当结合双氧水和辣根过氧化物酶在体外。这些结果更加有趣,因为过度表达C4H(肉桂酸4-羟化酶)已被证明增加了诱导烟草细胞悬浮培养中as的积累[33.].而且,OMT(O甲基转移酶,如甲基丙酯处理的烟草细胞悬浮培养物中发现的那样合成[34.].在C4H和OMT过度表达植物中将有值得分析乙酰苯乙烯酮水平的这些变化。
我们证明了AS混合物的抗菌效果与细菌密度成反比。此外,一些农杆菌分离株比测试的剩余植物病原细菌更耐混合。对这些现象的直接说明可以是细菌所拥有的抗氧化能力,例如细菌。组成型和诱导型过氧化酶酶活性。徐和潘[35.]表明了一个农杆菌在与野生型相比,过氧化氢酶活性缺乏过氧化氢酶活性的菌株的菌株高度衰减。因此,过氧化氢酶被认为是一种毒力因子农杆菌而且,我们的结果可能提供一种可能的抗氧化酶确认是一种毒力因子,但需要进一步研究。农杆菌已知具有过氧化物和磷酸盐限制诱导的过敏酶基因(Kata),其也显示出通过负反馈回路调节[36.,37.].复杂的监管机制可能最终导致更高的阻力农杆菌氧化应激。假单胞菌还已知物种和其他植物病原体具有运作过氧化氢酶和Oxyr(过氧化氢传感转录活化剂)[38.], 而且,假单胞菌含油显示过渡酶对于植物发病机制是必要的[39.].
我们调查了使用荧光染料作为混合物作为膜渗透和膜去极化的报道的两种可能的抗菌机制。我们发现与过氧化氢和辣根过氧化物酶组合导致膜去极化,但膜渗透可忽略不计。我们的结果与贝克和同事的结果一致[14.谁已经在流式细胞术实验中显示,PI无法渗透假单胞菌含油pv。两用AS混合物处理后的细菌细胞。他们还表明,这些细菌细胞在持续的细胞呼吸支持下达到了活的但不可培养的(VBNC)状态。我们目前的数据表明,这种感知的VBNC状态是在细菌细胞膜显著去极化后达到的。Mariano等人[40[调查分泌的毒素(SSP6)时,制成类似的观察结果Serratia marcescens.,这能够导致Dibac检测到的靶细胞的去极化4(3),对于较大的染料分子如PI,不增加膜的通透性,类似于本研究中的SYTOX Green。在另一项研究中,Spindler等人[41.报道了一种抗微生物机制,其中膜去极化和透化性不相关。肽抗生素Bac8C几乎立即但可逆膜的革兰氏阴性细菌去极化大肠杆菌在IC50浓度下,膜通透性无增加。在较高的浓度下,细菌膜仍在5分钟内发生去极化,在这种情况下,膜渗透也随之发生,但仅在30分钟内。我们的研究结果表明,膜去极化和膜渗透可能同时存在于抗菌药物的活性机制中,或者这两种作用可能像目前氧化as一样被解耦。
未受损增殖的AS混合处理,并立即注入相容细菌在Planta.这表明,在植物细胞间隙中可能存在一种或多种因子,要么快速清除过氧化氢,要么代谢或结合游离AS。提供浓度为50 μM的H2O2在混合中可能会在体内证明不足。在抗性相互作用中,植物可能在细菌侵袭的位置产生显着更高的量。在防御反应期间,ROS生产特别受到广泛调查([42.])。与病原体攻击相关的呼吸爆发被认为具有信号传递的作用,此外,ROS可能还有助于在不同的病原体系统中发挥直接的抗菌作用[43,44].氧化爆裂拟南芥由质外体过氧化物酶产生的酶也被证明是抗性的重要组成部分[45].在真菌感染期间,最近鉴定了在真菌感染期间活跃的电池壁过氧化物和血浆膜局部氧化酶的活性氧物质(ROS)和血浆膜局部化NADPH氧化酶[46] 在拟南芥.
我们的小组报道了在早期PTI中PTI期间过氧化物酶基因和过氧化物酶活性的诱导[3.,8];以及邻近PTI诱导的附件部位的电池壁中的过氧化氢的局部生产hrpL突变体假单胞菌phaseolicola在N. Tabacum.使用电子显微镜[22.].H2O2在用不同的细菌感染后,还在各种植物的叶子中报道了在植物细胞壁和细菌周围的细菌附着部位的过氧化物酶。合突变病原体[47,48].这些微观现象具有同时积累的表明,可以在本地给予条件的抗菌混合物,因为我们所示,可以对广泛的细菌病原体有效。然而,目前尚未清楚的植物角色,因此将需要进一步调查。基于上述引用的文献一种可能性是在细胞壁过氧化物酶或NADPH氧化酶附近形成局部的高抗微生物活性点,当浓度在细胞间隙中也升高时是最可能的。
结论
在这项工作中,我们设法揭示了一种模式触发免疫的指示代谢物烟草植物。通过体外模拟pti诱导细菌入侵植物细胞间隙的氧化环境,我们证明了乙酰丁香酮与过氧化氢和过氧化物酶联合抑制几种不同植物病原菌生长的能力。我们还表明,细菌的代谢抑制几乎是即时的,而且,抗菌效果不是基于膜渗透,而是基于细菌的膜去极化。
根据我们的结果,我们提出除了一些直接抑制细菌生长的酚酸外,似乎酚类化合物(例如乙酰菌酮)和氧化突发(由过氧化氢和过氧化物酶产生)的相互作用可能增强抗菌活性。然而,调查体内角色的作用及其与植物复合ROS生产系统的其他组成部分的相互关系将需要更复杂的方法。
我们的结果为植物中发现的抗微生物活动类型添加了一个新方面。源自植物的代谢产物的直接抗菌活性已被广泛研究(审查[49])。植物中ROS的抗微生物活性已长期研究[50,51].由二次代谢物和过氧化氢反应产生的增强的抗菌活性,导致强抗微生物活性是一种值得广泛的调查的相对新的区域。在这种情况下,特定诱导后产生的植物代谢物如PTI elictors,可能是具有间接抗微生物活性的丰富化合物来源。
方法
植物材料
烟草植物(尼科尼亚塔哈瓦姆简历。萨姆森和尼古利亚娜·宾夕法尼亚州)在温室土壤中种植(一般盆栽混合泥炭、粘土和牛肥(Florimo®általános virágföld) pH 6.4+/−0.5,Matécsa Ltd., Kecel,匈牙利,完成5 V/V%珍珠岩(Florimo®Kertészeti Perlit, 2-6 mm, Matécsa Ltd., Kecel,匈牙利)。试验前2天和试验期间,将2 ~ 2.5月龄的烟草植株置于光照/暗期为16/8 h、温度为23℃的生长室内。使用25号针头的皮下注射器,用细菌悬浮液或flg22肽溶液浸润中间的2-3片叶子。在适当的时间点,立即用液氮冷冻叶片样品,在−70℃保存至加工。水渗透相邻的叶片旁边的处理(在情况下N. Benthamiana.)或在同一片叶子上完全分开的脉间区域(如N. Tabacum.)被用作对照。每次实验都是以至少两种植物进行并行作为生物复制。使用不同植物世代的实验还重复了至少两次以确认检测到的趋势。
细菌和化学处理
所有细菌菌株(表1)在王中培养基中在28℃下培养[55].每个细菌菌株的来源和参考发布包括在表中1.细菌的过夜培养物悬浮在蒸馏水中,并在560nm处调整到OD 1.0或OD 0.21(109或10.8CFU /毫升)。从这个原种中把细菌稀释到所需的密度。实验前常规用平板稀释法验证细菌密度。简而言之,10 μl由10倍稀释后的105开始实验前先培养液为CFU/ml, 48 h后计数菌落。将flg22肽(Genescript,美国)在无菌双蒸馏水中溶解到1 mM的固定溶液中。再用无菌双蒸馏水稀释至50 μM渗入N. Benthamiana.植物。
高效液相色谱 - 二极管阵列检测质谱(HPLC-DAD-MS)
制备样品时,用研钵和杵在液氮下研磨100mg叶片样品。加入500 μl 90%甲醇后加热至70°C 15 min。然后用超声波均质器(4710系列,Cole Parmer Instrument Co., IL, USA)对样品进行两次55%超声45秒。然后在13000 rpm下离心10分钟。上清液通过0.22 μm孔径的亲水聚四氟乙烯注射器过滤器(Gen-lab Ltd.,匈牙利)过滤,并用于后续分析。
含有0.02mg / ml新胆酸,粘密酸,绿原酸,乙酰霉酮,水杨酸,肉桂酸,香豆酸和咖啡酸(每种来自Sigma St Louis,Mo,Mo,USA)的标准标准标准物并行延伸。在HPLC流动阶段使用梯度级乙腈(Fisher Scientific,Pa,USA),甲酸(98-100%,成绩,布达佩尔,匈牙利)和纯水(净化设备:Merck Millipore Direct-Q 3紫外线系统).
HPLC-DAD-MS用于鉴定和定量酚类化合物。在配备有二进制梯度溶剂泵,真空脱气剂,恒温式自动进样器,柱烤箱,光电二极管检测器和单Quadrupole质量分析仪的LC-MS-2020系统(Shimadzu,京都,日本)进行分析。电喷雾电离(ESI)界面。使用0.8ml / min流动相流速和10μl,在45℃下在35℃下在35℃下进行35℃(150mm×3mm,Maisch,Ammerbuch,德国Maisch,Ammerbuch博士)注射体积。用0.1%甲酸(A)和0.1%甲酸(B)的乙腈水溶液(A)和乙腈水溶液(B)如下:0-10分钟,5-15%B;10-17分钟,15-65%b;17.1-19.5分钟,100%B和19.51-22分钟,5%B. ESI在以下条件下工作:DESOLVATION LINE(DL)温度,250°C;热块温度,400°C;干燥N.2气流,15升/分;雾化器N.2气流,1.5升/分钟。在M / Z 130-700的范围内的正质量扫描光谱记录在正极和负电离模式中,并且还进行了选择 - 离子监测(SIM)获取,检测在预研究期间样品中发现的酚类的基峰。使用程序Labsolutions 5.42V(Shimadzu)获取和处理数据。
体外药敏试验
植物疗法细菌的易感性(表1)通过通过Mock等人出版的方法通过连续稀释液和电镀测试。(2015)。简而言之,乙酰菌酮(作为; Sigma St Louis,Mo,USA)溶解在乙醇中以获得50mM的储备溶液,然后在10mM磷酸钾缓冲液(PPB)中稀释至50μm的终浓度(ppb),pH 6.如单独使用,或与50μmH组合使用2O2(从30% H2O2, Sigma,圣路易斯,MO,美国)和辣根过氧化物酶(POX)。这种乙酰丁香酮与过氧化氢和辣根过氧化物酶结合的混合物称为乙酰丁香酮混合物(as混合物)。VI型辣根过氧化物酶(P8375-2KU, Sigma)库存(720 U/ml)在100 mM PPB, pH 6。在pH为6的10mm PPB溶液中,其最终浓度为0.72 U/ml。
按照第5.2节的方法培养了细菌。,然后稀释至105 CFU/ml in 10 mM PPB, pH 6. The following treatment combinations were applied to the bacterial suspensions: 1. non-treated control; 2. AS; 3. H2O2;4.2O2+痘;5. + h2O2+痘;6.在70℃下热杀死(HK)10分钟。将细菌在上述治疗组合中在Thermoshaker(Stat Fax2200,Avarention Technoly,USA)以27 + 0.1°C的27 + 0.1℃下孵育180分钟,连续摇动(200rpm),然后稀释10次。将10μL原始和稀释的混合物涂布在王的B琼脂平板上,并在2天后计算菌落。一次对每种细菌菌株的治疗一次进行重复,并在不同的日子中重复至少两次。
通过质谱法监测乙酰苯乙烯酮反应混合物的变化
如第5.4节中所述制备测试溶液,但在0.01M乙酸铵缓冲液pH6中。与H组合2O2通过使用LC-MS 2020系统(无柱)通过流喷射分析分析或作为混合物进行分析。用2%甲醇(梯度等级,摩尔化学品,Budapest,匈牙利)用水(用Merck Millipore Direct-Q 3紫外线系统纯化)用作流动相,流速,立即注射10μL,制备混合物后30,60,120和180分钟。在此期间将混合物保持在25℃。ESI-MS设置与第5.3节中给出的相同,但在M / Z 150-800的范围内记录了全质量扫描光谱的正质量扫描光谱。
膜去极化和渗透性测定
对于膜去极化和渗透性测定,将细菌密度调节至给定值5×106和5×107CFU /毫升。试验溶液和混合物的制备如5.4节所述。处理组合体积为200 μl,在96孔微量滴定板上进行重复试验。混合物在热摇瓶(Stat Fax®2200,Awareness Technology, Florida, USA)中孵育180分钟,温度为27 +−0.1°C, 200转/分连续摇晃。加入荧光指示染料,共孵育60 min。
荧光染料dibac4(3)(Biotium Inc.,Ca,USA)储备溶液溶解在DMSO中1mg / ml。在实验混合物中进一步稀释1:1000。
Sytox®Green和To-Pro®-3荧光染料来自SelectFX核标记试剂盒(Invitrogen,CA,USA)。Sytox®Greg(DMSO中60μg/ ml)和TO-Pro®-3(DMSO中210μg/ ml)批量如制造商推荐的稀释1:300。
然后通过GFP频道中的IBright™FL1000成像系统(Thermo Fisher Scientific Inc. Ma,USA)记录荧光。使用NIH Imagej进行量化[56]软件Readplate2.1插件。
荧光显微镜
对于荧光显微镜,将细菌密度调节至105CFU /毫升。试验溶液和混合物的制备如5.4节所述。治疗组合量为1毫升。将混合物在Thermoshaker(Stat Fax2200,Avarention Technoly,Florida,USA)中温育180分钟,在27 + 0.1°C,连续摇动。加入荧光指示染料,共孵育60 min。然后将细菌细胞以8000rpm离心1分钟。然后弃去990μl上清液,将细菌细胞重新悬浮在剩余的10μL中,并立即染色荧光显微镜检查。
荧光染料DIBAC4(3)和Sytox Green以与5.6节中所述相同的浓度使用。DAPI来自SelectFX核标记试剂盒(DMSO中的60μg/ ml; Invitrogen,Ca,USA),并按制造商推荐使用1:300稀释。
使用Zeiss Axioskop 2加荧光显微镜(Carl Zeiss Microscopy GmbH)收集荧光显微图像。Sytox Green和Dibac4(3)使用由450-490 nm激发过滤器,495nm二向色镜和500-550nm屏障过滤器组成的过滤器组中检测到Epfloorfercence模式中检测到(绿色荧光)。使用由365nm激发过滤器,395nm二向色镜和420-470nm屏障过滤器组成的荧光过滤器组检测DAPI(蓝色)荧光。使用NIH ImageJ软件生成覆盖图像[56].使用NIH Imagej的整个图像和控制器应用亮度和对比度调整。保持亮度和对比度,使得每个捕获的功能在每个图像中都清晰可见。
在体内(在Planta.)细菌增殖试验
烟草植物如2.1中所述成长。密度假单胞菌含油pv。Tabaci.细菌调整为106CFU /毫升。如第5.4节所述,在0.01M PPB PH 6中制备测试溶液和混合物。治疗方法如下:1。细菌(控制);2。细菌+ 50 μm AS + 50 μm H2O2+ 0.72 U/ml POX;立即混合物注入;3.细菌+ 50 μm AS + 50 μm H2O2+ 0.72 U/ml POX;在27°C震动3小时后注入混合物。采用装有25号针头的皮下注射器,用细菌悬浮液渗入烟草中间的三片叶片,详情见[57].在800μl10mMmgcl中均化来自每次时间点的三片叶片的八件11毫米的圆盘2在砂浆中。通过KING的B琼脂板上的板数技术计算可活细胞的数量。实验进行了两次,结果是相似的。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从合理的请求上从相应的作者获得。
缩写
- PTI:
-
模式触发的免疫力
- 作为:
-
acetosyringone
- 和混合一样:
-
乙酰苯胺酮,过氧化氢和辣根过氧化物酶的混合物
- POX:
-
辣根过氧化物酶
- PRRs:
-
植物抗性新兵模式识别受体
- 通常:
-
toll样受体
- mamp:
-
微生物相关分子模式
- ef-tu:
-
伸长因子TU.
- PGN:
-
肽聚糖
- LPSS:
-
脂多糖
- 地图:
-
丝裂原活化蛋白激酶
- ROS:
-
反应性氧气
- ests:
-
表达序列标签
- HPLC-DAD-MS:
-
高效液相色谱 - 二极管阵列检测质谱法
- PPB:
-
磷酸钾缓冲
- 香港:
-
heat-killed
- 香港BACT:
-
热杀死细菌
- P. s。桑雷克:
-
假单胞菌含油pv。两
- p . s .烟:
-
假单胞菌含油pv。Tabaci.
- P. s。番茄:
-
假单胞菌含油pv。番茄
- X. c。Campestris:
-
Xanthomonas Campestris.pv。Campestris.
- 个人电脑。Carotovorum:
-
Pectobacterium carotovorum亚普。Carotovorum.
- c . m . michiganensis:
-
Clavibacter Michiganensis.亚普。michiganensis
- 人力资源:
-
过敏的反应
- HPI:
-
小时后接种
- ESI:
-
电喷雾电离
- PI:
-
碘化丙烯酸铅
- VBNC:
-
可行的但non-culturable
参考
- 1。
T. Boller, G. Felix, A renaissance of rlicitors:感知微生物相关分子模式和危险信号的模式识别受体,Annu Rev Plant Biol 60(2009) 379-406。https://doi.org/https://doi.org/10.1146/annurev.arplant.57.032905.1053461。
- 2。
7 . M.A. Newman, T. Sundelin, J.T. Nielsen, G. Erbs, MAMP (microassociated molecular pattern)触发植物免疫,植物科学学报4(2013)139。https://doi.org/https://doi.org/10.3389/fpls.2013.00139.
- 3.
黄志强,黄志强,黄志强,黄志强,黄志强,二氨基联苯胺和二氯荧光素对烟草基础抗性的早期检测,植物病理学杂志(2005)596-607。https://doi.org/https://doi.org/10.1111/j.1439-0434.2005.01026.x10,10。
- 4.
A. Szatmari,P.G.OTT,G.J.Varga,E.Besenyei,A.Czelleng,Z.Klement,Z.Bozsó,通过烟草中新分离的代表基因的表达模式表达基底抗性(BR),植物细胞批评。25(2006)。https://doi.org/https://doi.org/10.1007/s00299-005-0110-5.
- 5.
A.R.拉莫斯,J.E. Morello,S. Ravindran,W.L.邓,H.C.黄,A. Collmer,识别假单胞菌含油pv。两61 III型分泌系统HRP蛋白可以行进III型途径,并有助于效应蛋白的易位转移到植物细胞中,J.Bacteriol。189(2007)5773-5778。https://doi.org/https://doi.org/10.1128/JB.00435-07.
- 6.
(1)植物免疫的翻译后调控,植物生物学与分子生物学杂志,2017,34(4):514 - 514。https://doi.org/https://doi.org/10.1016/j.pbi.2017.05.004.
- 7.
z Bozso P.G.奥特,e . Kaman-Toth G.F. Bognar, m . Pogany。Szatmári,重叠但反应特异性的转录组改变特征烟草的性质-假单胞菌含油相互作用,前植物SCI 7(2016)251. https://doi.org/https://doi.org/10.3389/fpls.2016.00251.
- 8。
一种。szatmári,á。Zvara,Á.m.Móricz,E.Besenyei,E.Szabó,P.G。OTT,L.G.Puskás,Z.Bozsó,模式触发烟草免疫(PTI):活化基因的分离表明苯丙醇型途径在抑制细菌病原体中的作用,PLO一体化,PLO为9(2014)E102869。https://doi.org/https://doi.org/10.1371/journal.pone.0102869,8。
- 9。
陈志强,陈志强,陈志强,木质素化对植物抗病性的影响,植物营养与肥料学报(1980)。https://doi.org/https://doi.org/10.1146/annurev.py.18.090180.0013551。
- 10。
R.A.Dixon,C.J. Lamb,S. Masoud,V.J.H.Sewalt,N.L.Paiva,代谢工程:通过苯丙醇生物合成和防御反应的遗传操纵作物改善前景 - 综述,基因。179(1996)61-71。https://doi.org/https://doi.org/10.1016/S0378-1119(96)00327-7,1。
- 11.
W.R.Chozem,A. Memon,F.S.李,J.K.翁,N.K.粘土,SG2型R2R3-MYB转录因子MYB15控制拟南芥的防御诱导和基础免疫力,植物细胞29(2017)1907-1926。https://doi.org/https://doi.org/10.1105/tpc.16.00954,8。
- 12.
M. Lee,H.S.吉蒙,S.H.金,J.H.Chung,D. Roppolo,H. Lee,H.J.Cho,Y. Tobimatsu,J.Ralph,O.K.基于木质素的屏障限制了基于木质素的屏障对感染部位的病原体,并赋予植物的抗性,J.38(2019)。https://doi.org/https://doi.org/10.15252/emb.2019101948.
- 13。
C.J.Baker,B.D.惠特克,D.P.罗伯茨,N.M. Mock,C.P.米饭,K.L.DEAHL,A.A.Aver'Yanov,植物细菌相互作用期间氧化还原细胞外酚醛酚诱导,Physiolmol植物疗法66(2005)90-98。https://doi.org/https://doi.org/10.1016/j.pmpp2005.05.0023。
- 14。
关键词:细菌,烟草,质外体,酚类物质,抗性https://doi.org/https://doi.org/10.3389/fpls.2015.00649.
- 15.
S. Camarero,D. Ibarra,M.J.Martínez,Á.T.Martínez,木质素衍生的化合物,作为有效的漆胶囊介质,用于脱色不同类型的核批量染料,Appl Environ Microbiol 71(2005)1775-1784。https://doi.org/https://doi.org/10.1128/AEM.71.4.1775-1784.2005,4。
- 16.
N.M. Mock, C.J. Baker, a . a . averyanov, a . a . averyanov,一种可活但不可培养(VBNC)状态的诱导假单胞菌含油在暴露于吻合酚醛酚,乙酰苯甲酸乙酮的氧化时的病毒毒素,对乙酰苯胺酮植物植物疗法89(2015)16-24。https://doi.org/https://doi.org/10.1016/j.pmpp.2014.11.006.
- 17.
H.P. Nguyen, S. Chakravarthy, A.C. Velásquez, H.L. McLane, L. Zeng, H. Nakayashiki, D.H. Park, A. Collmer, G.B. Martin,番茄和本氏烟草pamp触发免疫的方法,Mol Plant-Microbe Interact 23(2010) 991-999。https://doi.org/https://doi.org/10.1094/MPMI-23-8-0991,8。
- 18.
S. Chakravarthy,A.C.Velásquez,S.K.ekengren,A. Collmer,G.B.马丁,鉴定尼古利亚娜·宾夕法尼亚州参与病原菌相关的分子模式触发的免疫,Mol植物微生物相互作用23(2010)715-726。https://doi.org/https://doi.org/10.1094/mpmi-23-6-0715,6。
- 19。
K. Cho,Y. Kim,S.J.Wi,J.B.Seo,J. Kwon,J.H.chung,k.y.公园,M.H.NAM,与兼容病原体接种烟草中的非靶制代谢物分析(尼科尼亚塔哈瓦姆L. cv。威斯康星州38)使用UPLC-Q-TOF / MS,J.Agric。食品化学。60(2012)11015-11028。https://doi.org/https://doi.org/10.1021/jf303702j.
- 20。
M.I.Mhlongo,P.A.Steenkamp,L.A.Piarter,N.E.Madala,I.A.Dubery,改变的代谢物状态的分析尼科尼亚塔哈瓦姆植物营养与肥料学报,2016,35(6):727 - 733。https://doi.org/https://doi.org/10.3389/fpls.2016.01527.
- 21。
S.E. Stachel, E. Messens, M. Van Montagu, P. Zambryski,受伤植物细胞产生的激活T-DNA转移的信号分子的鉴定农杆菌肿瘤术《自然》318(1985)624-629。https://doi.org/https://doi.org/10.1038/318624A0, 6047年。
- 22。
张志强,张志强,张志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强,黄志强。https://doi.org/https://doi.org/10.1002/ps.694,4。
- 23。
S.D.Lorimer,N.B.佩里,来自新西兰肝脏的抗真菌羟基 - 苯乙酮,Plagiochila下方, Planta Med 60(1994) 386-387。https://doi.org/https://doi.org/10.1055/s-2006-95951104。
- 24。
S.Süle,生物型农杆菌肿瘤术在匈牙利,J Applbacteriol 44(1978)207-213。https://doi.org/https://doi.org/10.1111/j.1365-2672.1978.tb00792.x.2。
- 25。
C. Koncz, J. Schell, TL-DNA基因5的启动子控制一种新类型的嵌合基因的组织特异性表达农杆菌二元载体,MGG Mol Gen Genet 204(1986)383-396。https://doi.org/https://doi.org/10.1007/BF003310143。
- 26。
“紫丁香酸甲酯:一种有效的细菌漆酶和真菌漆酶的酚类介质,生物资源技术124(2012)371-378。”https://doi.org/https://doi.org/10.1016/j.biortech.2012.08.023.
- 27。
A. Martorana, L. Sorace, H. Boer, R. Vazquez-Duhalt, R. Basosi, M.C. Baratto,漆酶生物催化反应中酚类天然介质的光谱表征,J Mol Catal B酶97(2013)203-208。https://doi.org/https://doi.org/10.1016/j.molcatb.2013.08.013.
- 28。
C. Jacyn Baker,D.P.罗伯茨,N.M. Mock,B.D.惠特克,K.L.DEAHL,A.A.Aver'yanov,妊娠氧化还原代谢:协同酚醛氧化和新型氧化爆发,Physiolmol植物疗法67(2006)296-303。https://doi.org/https://doi.org/10.1016/j.pmpp2006.04.005,6。
- 29.
范建军,C. Crooks, C. Lamb,高通量荧光定量荧光法测定植物生长假单胞菌含油染色体标记为Photorhabdus luminescensluxcabe, Plant J 53(2007) 393-399。https://doi.org/https://doi.org/10.1111/j.1365-313x.2007.03303.x2。
- 30.
J.D. te Winkel, d.a Gray, K.H. Seistrup, L.W. Hamoen, H. Strahl,使用电压敏感染料分析抗菌剂触发的膜去极化,Front Cell Dev Biol 4(2016) 29。https://doi.org/https://doi.org/10.3389/fcell.2016.00029.
- 31。
Alakomi HL, Mättö J, Virkajärvi I, Saarela M.微板规模荧光染色法在评估益生菌制剂活力中的应用。微生物学杂志。2005;62(1):25-35。https://doi.org/10.1016/j.mimet.2005.01.005.
- 32。
O.A.Postnikova,J. Shao,N.M. Mock,C.J.Baker,L.G。Nemchinov,可行但不可培养的(VBNC)细胞中的基因表达分析假单胞菌含油pv。两, 正面。微生物。6(2015)1419. https://doi.org/https://doi.org/10.3389/fmicb.2015.01419.
- 33。
J.W.Blount,S. Masoud,L.W.Sumner,D. Huhman,R.A.迪克松,肉桂酸酯4-羟基化酶的过表达导致乙酰苯甲酸乙酮的积累增加,在引发的烟草细胞悬浮培养物中,Planta。214(2002)902-910。https://doi.org/https://doi.org/10.1007/S00425-001-0701-5.,6。
- 34。
王志强,王志强,王志强,等。茉莉酸甲酯处理烟草细胞悬浮培养中合成乙酰丁香酮的o -甲基转移酶的检测。植物化学。2014;99:52-60。https://doi.org/10.1016/j.phytochem.2013.12.013.
- 35。
X.Q.徐,S.Q.平底锅,A.农杆菌过氧化氢酶是肿瘤发生的毒力因子,mol microbiol 35(2000)407-414。https://doi.org/https://doi.org/10.1046/j.1365-2958.2000.01709.x2。
- 36。
K.Nakjarung,S. Mongkolsuk,P. Vattanaviboon,Oxyr来自农杆菌肿瘤术:评价其在过氧化氢酶和过氧化物反应调控中的作用,生物化学学报,2003,41-47。https://doi.org/https://doi.org/10.1016/s0006-291x.(03)00535-7,1。
- 37。
Z.-C.袁,罗齐赫,下午芬兰,磷酸盐限制诱导过氧化氢酶表达Sinorhizobium meliloti.,假单胞菌铜绿假单胞菌和土壤杆菌, Mol Microbiol 58(2005) 877-894。https://doi.org/https://doi.org/10.1111/j.1365-2958.2005.04874.x3。
- 38。
Ishiga Y,ichinose Y.假单胞菌含油pv。番茄奥克斯在番茄中的毒力是毒力所必需的拟南芥.摩尔。植物微生物相互作用。2016; 29:119-31https://doi.org/10.1094/mpmi-09-15-0204-r..
- 39.
M. Guo, A. Block, C.D. Bryan, D.F. Becker, J.R. Alfano,假单胞菌含油植物发病机制,J菌194(2012)5054-5064统称,统称过敏酶。https://doi.org/https://doi.org/10.1128/jb.00999-12, 18岁。
- 40。
G. Mariano,K. Trunk,D.J.威廉姆斯,L. Monlezun,H. Strahl,S.J.皮特,S.J.Coulthurst,一家新的VI分泌系统递送的效应蛋白蛋白质显示离子选择性孔隙形成活性蛋白。(2019)676247. https://doi.org/https://doi.org/10.1101/676247.
- 41。
E.C. Spindler, J.D.F. Hale, T.H. Giddings, R.E.W. Hancock, R.T. Gill,解译合成抗菌肽bac8c的作用模式,Antimicrob Agents Chemother 55(2011) 1706-1716。https://doi.org/https://doi.org/10.1128/aac.01053-10,4。
- 42。
d . Camejo,。Guzmán-Cedeño, A. Moreno,植物与病原体相互作用中的活性氧,植物生理学与生物化学103(2016)10-23。https://doi.org/https://doi.org/10.1016/j.plaphy.2016.02.035.
- 43。
C. Lamb,R.A.迪克松,氧化爆裂不含抗病抗性,annu转速植物理性植物Mol Biol 48(1997)251-275。https://doi.org/https://doi.org/10.1146/annurev.arplant.48.1.2511。
- 44。
J.A.Hernández, G. Gullner, M.J. Clemente-Moreno, A. Künstler, C. Juhász, P. Díaz-Vivancos, L. Király, Oxidative stress and antioxidative responses in plant–virus interactions, Physiol Mol Plant Pathol 94 (2016) 134–148. https://doi.org/https://doi.org/10.1016/j.pmpp.2015.09.001.
- 45。
L. V. Bindschedler, J. Dewdney, K.A. Blee, J.M. Stone, T. Asai, J. Plotnikov, C. Denoux, T. Hayes, C. Gerrish, D.R. Davies, F.M. Ausubel, G.P. Bolwell,过氧化物酶依赖的质外体氧化爆发拟南芥病原体抗性所需,工厂J 47(2006)851-863。https://doi.org/https://doi.org/10.1111/j.1365-313X.2006.02837.x,6。
- 46。
E.Kámán-Tóth,蒂克,G.Gullner,Z.Bozsó,L.Pogány,M.Pogány,细胞壁过氧化物酶和NADPH氧化酶衍生的反应性氧的贡献alertaria brassicicola.诱导氧化爆发拟南芥, Mol Plant Pathol 20(2019) 485-499。https://doi.org/https://doi.org/10.1111/mpp.12769,4。
- 47。
Bestwick CS,Brown IR,Mansfield JW。过氧化物酶活性的局部变化伴随过氧化氢在生菜中的非质硬过敏反应的发育过程中。植物理性。1998年; 118(3):1067-78。https://doi.org/10.1104/pp.118.3.1067.
- 48。
K. Mitchell,I. Brown,P.Nnox,J. Mansfield,基于细胞壁的防御在非致病性HRP突变细菌的早期限制中的作用拟南芥,植物化学。112(2015)139-150。https://doi.org/https://doi.org/10.1016/j.phytochem.2014.07.015.
- 49。
P. Bednarek,P.Schulze-Lefert,植物次级代谢物在Host-Pathogen接口中的作用,In:Annu。植物Rev.在线,John Wiley&Sons,Ltd,奇切斯特,英国,2018年:PP。220-260。https://doi.org/https://doi.org/10.1002/9781119312994.apr0368.
- 50.
B. Barna, J. Fodor, B. d . Harrach, M. Pogány, Z. Király,活性氧在植物对坏死营养和生物营养病原体的抗性和敏感性中的Janus face,植物生理与化学59(2012)37-43。https://doi.org/https://doi.org/10.1016/j.plaphy.2012.01.014.
- 51.
S. Lehmann,M. Serrano,F. L'Haridon,S.E.TJamos,J.P. Metroaux,活性氧物种和植物抗真菌病原体,植物化学。112(2015)54-62。https://doi.org/https://doi.org/10.1016/j.phytochem.2014.08.027.
- 52.
H.C.黄,R. Schuurink,T.P.丹尼,小米。阿特金森,C.J.Baker,I. Yucel,S.W.Hutcheson,A. Collmer,分子克隆假单胞菌含油pv。两基因簇使荧光假单胞菌以诱导烟草植株的超敏反应,中国烟草杂志,17(1988)4748-4756。https://doi.org/https://doi.org/10.1128/jb.170.10.4748-4756.1988.
- 53.
Cuppels da。TN5插入突变的生成与表征假单胞菌含油pv。番茄.达成。环绕。Microbiol。1986;51。
- 54.
(1)植物保护性状的正向遗传筛选鞘粉菌株Fr1Pseudomonas syringae dc3000,appl。环绕。微生物。78(2012)5529-5535。https://doi.org/https://doi.org/10.1128/aem.00639-12.
- 55。
E.O.国王,M.K.沃德,D.E.Raney,两种简单的媒体,用于碧粘素和荧光素,J Lab Clin Med 44(1954)301-307。https://doi.org/https://doi.org/10.5555/乌瑞:pii:002221435490222x.2。
- 56。
C.A.施耐德,W.S.Rasband,K.W.Eliceiri,NIH图像到ImageJ:25年的图像分析,NAT方法9(2012)671-675。https://doi.org/https://doi.org/10.1038/nmeth.20897。
- 57。
Klement Z.通常使用病理生理方法。在:klement z,k。rk,sands d,编辑器。植物细菌学的方法。布达佩斯:Akadémiai新闻;1990. p。96-121。
致谢
作者感谢Sándor Süle博士好心的礼物A. Tumefaciens.菌株。
植物材料授权陈述
本研究中的研究方案符合相关的机构,国家和国际指导方针和立法。
本研究中使用的烟草植物的种植获得了研究所的合法许可。
资金
这项工作得到了NKFI / OTKA Grant PD 109050的支持。
作者信息
隶属关系
贡献
Ás和ZB设计并构思了这项研究。ás,ámm和zb执行了实验。ámm,áa和jkn贡献了材料/分析工具。ás,ámm和zb进行了数据分析;ás和zb监督了研究工作;ás,zb,ámm解释了数据并修改了稿件;是,JKN,MP和ÁA修改了稿件。所有作者均认批准了提交的稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1。
相对累积N. Tabacum.叶子。回应治疗假单胞菌含油pv。Syringae HRCC.- 2,4和6 HPI的细菌。值是三个生物重复的平均值。所有值均向非处理的对照水平归一化。误差条表示标准差。星号根据学生的T检验,与相应的水处理对照有显着差异(*p< 0.1;Arunachal Pradesh,p< 0.05)。W:处理的水控制;P.S.两HRCC.(HR-):p .两pv。两hrcC) - - -(HR -突变)。
额外的文件2。
氧化形式的不同植物致病细菌的抗菌效应。5×106或5×107 CFU/ml bacteria were added to reaction mixtures containing 50 μM acetosyringone, 50 μM H2O2和0.72 U / mL辣根过氧化物酶,并省略了对照组的控制混合物。在共育3小时后接种连续稀释液,用于CFU测定。A-D)图示了结果的量化。误差条表示标准差。缩写:Bact:细菌,AS:acetosyringone,香港:热杀害,痘:辣根过氧化物酶。
额外的文件3。
lc -质谱分析AS MIX反应的时间过程实验。在含50 μM乙酰丁香酮、50 μM H的反应混合物中AS与新化合物的相对数量2O2, 0.72 U/ml辣根过氧化物酶2O2或省略辣根过氧化物酶。使用HPLC-MS跟踪反应混合物通过180分钟跟踪。化合物用它们的m / z值表示。缩写:如:乙酰血清酮,痘:辣根过氧化物酶
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
szatmári,á。,móricz,ám.,schwarczinger,我。等等。一种触发的免疫相关酚丙酮酮,可以快速抑制各种植物病原细菌。BMC植物杂志21,153(2021)。https://doi.org/10.1186/s12870-021-02928-4
已收到:
接受:
发表:
关键词
- Pattern-triggered免疫力
- 假单胞菌含油
- acetosyringone
- 埃尔科特
- 氧化爆发
- 抗菌