摘要
背景
作为BR信号传导的关键调控因子,BES1家族基因调控着数千个参与各种发育过程的靶基因。到目前为止,的函数BES1对番茄家族了解甚少,值得对该家族进行全面的基因组和表达分析。
结果
在这里,九SlBES1根据保守基序、基因结构和系统发育分析,将番茄家族成员划分为5个类群。番茄间的同质性;拟南芥辣椒和大米的进一步分析,以获得进化特征的见解。几个独联体-与激素、胁迫和植物发育相关的元素在启动子区域显示SlBES1家族的基因。亚细胞定位显示,7个成员位于细胞核和细胞质中,这意味着这7个蛋白存在去磷酸化和磷酸化形式,此外,其中5个具有转录激活活性,其余2个具有转录抑制活性。然而,另外两个成员既不定位于细胞核,也不具有活化活性。除此之外,SlBES1.8其他成员在所有器官中普遍表达。此外,SlBES1基因对9种主要植物激素的响应表现出变异表达。值得注意的是,SlBES1基因在应激反应中表现出明显的下调趋势。
结论
在本研究中,我们系统地分析了SlBES1家族,结合蛋白功能特征和表达模式的分析,我们的结果为功能研究奠定了基础SlBES1家庭。
背景
植物的生长发育是由植物激素的整合持续调控的。同时,它们的产量和品质经常受到包括生物和非生物胁迫在内的各种环境刺激的影响。为了适应不利的环境,许多基因,特别是那些转录因子(TFs)倾向于整合多种激素信号来对抗环境刺激,维持正常的生长发育[qh]1,2]。
众所周知,植物激素包括但不限于生长素、细胞分裂素(CK)、赤霉素(GA)、脱落酸(ABA)、乙烯(ET)、油菜素内酯(BR)、水杨酸(SA)、茉莉酸(JA)和独角麦内酯。其中,自发现于芸苔属植物显著在花粉中,BR因其对细胞伸长和分裂的影响而被认为是一种植物生长促进激素[3.,4]。随后的研究表明,BRs在植物的发育和生理过程中发挥着多功能作用,包括种子萌发、植物结构、维管分化、气孔形成、开花、雄性育性、衰老和抗逆性[qh]5,6,7]。同时,在过去的几十年里,人们通过遗传学、分子学和蛋白质组学的方法对BR信号转导途径进行了广泛的探索,为我们提供了BR功能的分子机制的全局视图。简单地说,细胞外富含亮氨酸的重复受体激酶(LRR-RK) brassinosteroids - insensitive 1 (BRI1)可以识别并结合BR,导致BR信号的启动[8,9]。该通路中的一系列激酶和磷酸酶被相继触发以完成其功能,导致bri1 - em - suppressor 1 (BES1)和BRASSINAZOLE-RESISTANT 1 (BZR1)两个同源转录因子的去磷酸化和激活[10,11,12,13],进而通过与E-box (CANNTG)或BR-response element (BRRE, CGTGT/CG)结合来调控数千个靶基因[14,15]。
BES1和BZR1在BR信号通路中的作用首先被两个显性突变所揭示。bes1-D和bzr1-D,表现出组成型BR反应表型,包括抑制bri1矮化表型,对油菜素唑(BRZ)不敏感,茎长,衰老加速,br诱导基因表达上调[12,13]。此后,BES1/BZR1在整合多种激素信号调控植物生长发育中的重要功能被广泛探索。例如,BES1/BZR1可以直接调控纤维素合酶基因(中国极限运动协会) [16],微管不稳定蛋白(MDP40) [17],atb1相互作用因子2(AIF2) [18],叶片倾角增大1(ILI1),多效唑耐药(PRE1),il1结合bHLH(IBH1) [19]或与MYB结构域蛋白30 (AtMYB30)相互作用[20.],髓母细胞病家族转录因子样2 (mybl2) [21和异三聚体g蛋白β亚基(AGB1) [22来控制植物细胞伸长。类似地,BES1/BZR1也可以通过直接调控相关关键基因的表达或与相关蛋白相互作用,影响植物的免疫、胁迫反应、花器官发育和静止中心细胞的分裂分化[j]。7]。通过染色质免疫沉淀微阵列(ChIP-chip)研究,已经鉴定出大量BES1和BZR1的推测靶基因,分别达到1609和3410。其中受BRs调控的基因众多,而参与植物激素、胁迫信号等其他信号传导的靶基因也不少[23,24],这意味着BES1和BZR1不仅是BR信号的主要调控因子,而且在其他调控网络中也发挥着关键作用。
有四个BES1同源染色体在答:芥,名叫BEH1-4.然而,很少有研究单独关注这四个基因,可能是因为它们在BR信号传导中的功能冗余[15]。在拟南芥的个体单突变体BES1,BZR1它们的四个同源物没有显示出任何生长缺陷。此外,两倍、三倍和四倍突变体的不同组合未观察到明显的表型。而5倍突变体(Bes1 bzr1 beh1 beh3 beh4)和六倍突变体(Bes1 bzr1 beh1 beh2 beh3 beh4) [25]。同时,Chen等人的另一项研究也证明了类似的结果。[26],表明的高度功能冗余BES1基因。剩下的两个BES1成员BAM7和BAM8(也相应地命名为BMY4和BMY2)是β-淀粉酶蛋白,但包含在BES1在n端存在bes1型结构域。有趣的是,这两种β-淀粉酶被报道为TF,并通过介导BR信号传导来控制茎的生长发育拟南芥[27]。
总之BES1家族基因通过调控BR信号和其他信号通路,在植物生长发育过程中起着关键的调节作用。然而,对BES1基因家族的研究主要基于拟南芥因此,从其他植物物种,特别是农作物中获得新的见解是至关重要的。作为最重要的园艺作物之一,番茄(茄属植物lycopersicum)是研究植物生长发育特别是肉质果实发育成熟的典型模式[28]。在我们的研究中,一个全面的全基因组分析SlBES1包括基因家族的染色体分布、bes1型结构域内的保守氨基酸残基、系统发育关系、同源性分析、基因结构、保守基序和潜力独联体元素。我们进一步探讨了它们的亚细胞定位和转录激活活性。的时空表达模式SlBES1基因家族也进行了调查。更重要的是,我们详细分析了SlBES1九种主要植物激素和不同胁迫的基因家族。我们的研究结果为其功能和机制分析提供了有价值的信息BES1番茄的家族基因。此外,本研究可为植物激素信号转导及抗逆性研究奠定基础。
结果
鉴定和表征SlBES1基因家族
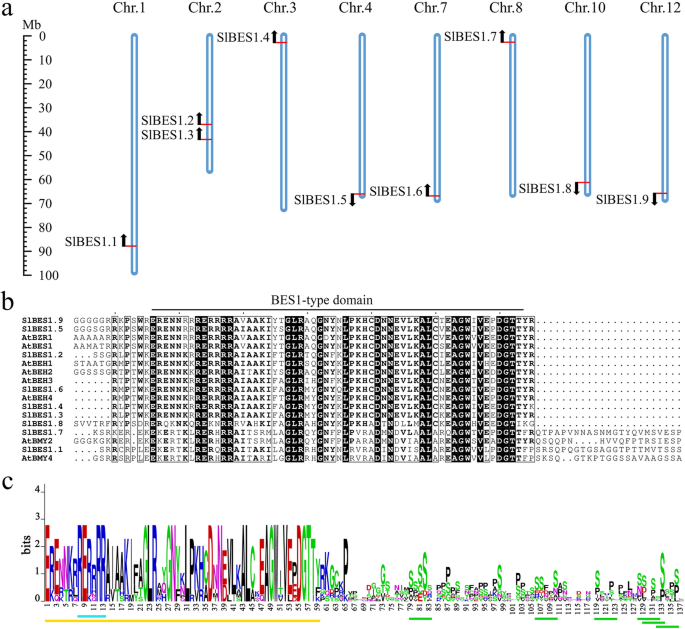
识别BES1在茄科基因组数据库(Solanaceae Genomics Database)中,收集到的保守的bes1型结构域序列作为BLASTP查询。总共9推测SlBES1使用默认参数获得候选项。同时利用Phytozome数据库进行检索SlBES1吉恩家族,也是一样SlBES1获得了候选人。然后通过CD-Search和SMART确认了保守的bes1型结构域的存在。这些9SlBES1基因后来被命名为SlBES1.1来SlBES1.9根据其基因组位点(表1)1).特别是两名委员(SlBES1.1和SlBES1.7)标记为β-淀粉酶,其余标记为tf。注释的七SlBES1TFs外显子数相对较少,范围为2 ~ 3个,蛋白质长度短,范围为180 ~ 333个氨基酸(AA),预测分子量较轻,范围为20,389 ~ 35,772.85 kDa。而这两种带注释的β-淀粉酶外显子数较多,蛋白长度较长,分子量较大(表2)1).的其他详细属性SlBES1理论等电点(pI)和bes1型结构域位置等基因也在表中提供1.
染色体分布及保守氨基酸残基分析SlBES1基因
SlBES1基因家族随机分布在8条染色体上SlBES1除chr外位于一条独立染色体上的基因。包含2的2SlBES1的基因,SlBES1.2和SlBES1.3.值得注意的是,大多数SlBES1位于染色体远端的基因,其中3个正向分布,其余6个反向分布(图2)。1一个)。
番茄bes1型结构域长度为86 ~ 135个氨基酸。从全长序列比对来看,比较保守的序列只出现在bes1型结构域的n端(图2)。1b).我们进一步分析了该结构域中氨基酸残基的保守性,类似于答:芥,o .漂白亚麻纤维卷和g .分子[29], n端bes1型结构域的氨基酸残基在大多数位点保持保守,这被认为是DNA结合所必需的。值得注意的是,在氨基酸8至13之间的精氨酸偏倚区也被观察到SlBES1家庭。bes1型结构域的c端序列保守性较低,相比之下,它含有许多富含丝氨酸的磷酸化位点,这暗示了SlBES1蛋白的潜在调控中心(图2)。1c) (30.]。
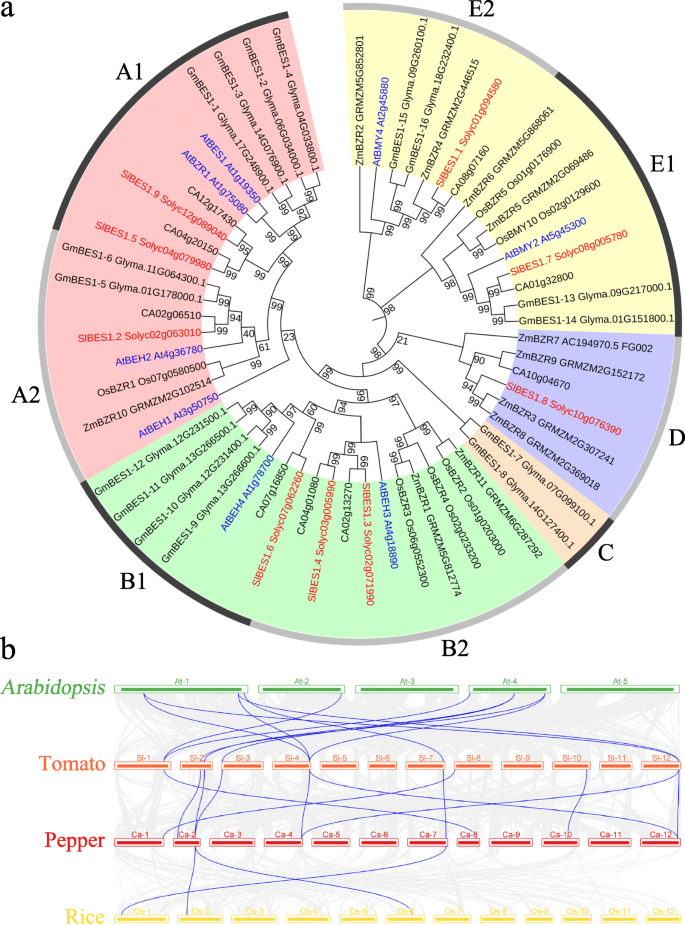
植物的系统发育与共系分析SlBES1基因
了解…的系统发育关系SlBES1家族基因,共59个BES1基因美国lycopersicum(9),答:芥(8),c .建立(9),g·马克斯(16),o .漂白亚麻纤维卷(6)和z梅斯(11),使用MEGA X以默认参数构建Neighbor-Joining系统发育树。与Liu等人的研究结果一致[29], Li等。[31], Song等。[32,我们将这59个分类BES1根据bootstrap值和系统发育拓扑结构,将基因分为五组,命名为A至E。2a). a、B和E组占大多数BES1基因和基因又分别分为2个亚群。子组A1包含关键成员BES1和BZR1的同系物SlBES1.5和SlBES1.9分别在番茄。根据Liu等人的分析[29],相应的E组比其他组更古老,这一组确实有BES1这里分析了所有六个物种的基因。此外,E组基因氨基酸长度较长,并被选择性地注释为β-淀粉酶。D组则少得多BES1来自三个物种的基因,包括一个番茄BES1的基因,SlBES1.8C组有两个BES1基因g·马克斯的扩展和发散BES1进化中的基因家族。
进一步了解的系统发育机制SlBES1对番茄、辣椒和辣椒三个品种进行了比较综合图拟南芥)和一个单子叶(水稻)(图。2b).结果表明,番茄BES1在另一种辣椒中发现了同源物茄科物种,其次是拟南芥而单子叶水稻的同源物最少。更重要的是,所有SlBES1在辣椒染色体上可发现同染色体基因(9个),其中大部分为同染色体基因SlBES1同源基因(7)在拟南芥而在水稻染色体上只有两个。综上所述,同型基因对SlBES1双子叶比单子叶多。同时,随着茄科辣椒是番茄的亲缘植物,与番茄具有较好的合成性拟南芥和米饭。这些结果表明BES1家族在植物进化中可能起着重要的作用。
的基因结构和氨基酸保守基序SlBES1基因
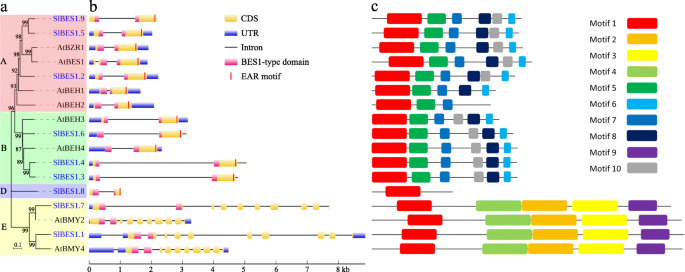
随着基因的进化,基因的调控区和/或编码区在基因复制的基础上发生分化。因此,氨基酸改变的取代和/或改变可能发生,基因的功能可能改变以适应不同的生长条件[33]。利用来自。的BES1蛋白序列构建了一个更简单的邻居连接系统发育树美国lycopersicum和答:芥充分分析基因结构和保守基序(图2)。3.一个)。
的结构BES1聚集在同一枝上的基因非常接近,包括外显子和内含子的数量和位置。例如,被注释的β-淀粉酶基因所含的外显子(10 ~ 11个)比那些通常只有2 ~ 3个外显子的被注释的TFs要多得多,而这三个番茄的第3个外显子也是如此BES1基因(SlBES1.3,SlBES1.4和SlBES1.6)只有4个核苷酸。此外,番茄的大部分内含子BES1基因似乎比它们长拟南芥同源物,这与番茄拥有更大基因组的事实一致。此外,番茄的bes1型结构域BES1基因均位于外显子1和外显子2之间SlBES1.1.值得注意的是,LxLxL型乙烯响应元件结合因子相关的两亲性抑制(EAR)基序,之前被报道为负转录调控基序[34],在c端观察到BES1标记为tf的基因,这意味着这些基因具有潜在的转录抑制功能BES1而那些带注释的β-淀粉酶基因不含这种特殊基序(图2)。3.b)。
含有高度一致的氨基酸序列的蛋白质,特别是在功能域,往往具有相似的生物学功能,因此番茄和番茄的10个保守基序拟南芥利用MEME套件对BES1蛋白进行了研究(图5)1).如图所示。3.c, motif 1是所有BES1蛋白中最保守的motif,它与BES1型结构域重叠。这些基序的排列组合与其系统发育关系密切相关。例如,A组和B组具有相同的基序(基序1、5、6、7、8和10),而基序8和10的顺序相反,其余的基序(基序1、2、3、4和9)被包含在e组中,特别是D组只包含基序1,这表明该组基因可能存在功能缺失或功能分化。
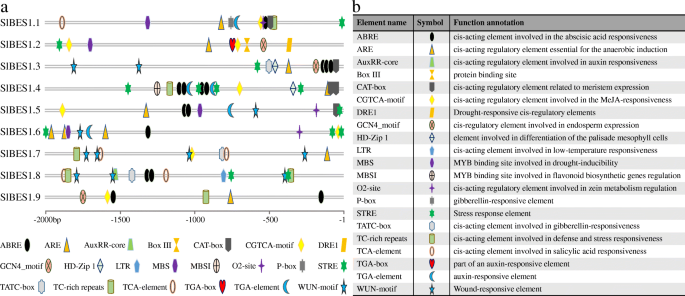
潜在的独联体有效的SlBES1基因启动子
发掘潜力独联体-elements, 2 kb的上游序列SlBES1将基因提交到PlantCARE数据库。的种类和位置独联体-元素被标记为不同的图标(图2)。4a),其势函数标注在图中。4b.所有这些独联体-检测到的元件主要分为植物激素响应元件、植物发育相关元件和胁迫响应元件三大类。在这些独联体-元素、ABRE和STRE显著,分别参与脱落酸和胁迫响应,说明SlBES1基因可能被非生物胁迫诱导或抑制,从而参与植物的抗逆性。此外,每一个SlBES1基因具有不同的种类和数量独联体-元素,我们可以假设,在不同的生长状态和环境条件下,SlBES1基因可以独立或协同发挥作用,以保证植物的正常生长发育。
SlBES1蛋白的亚细胞定位
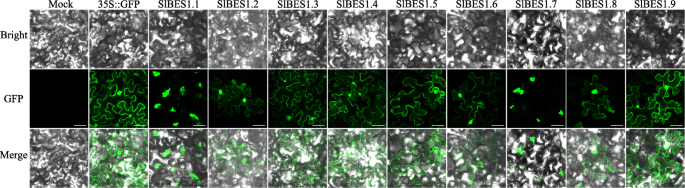
亚细胞定位暗示了蛋白质的工作位置,在基因功能研究中是不可忽视的。为了检测SlBES1蛋白的亚细胞定位,利用绿色荧光蛋白(GFP)与SlBES1蛋白融合,在烟草(烟草benthamiana)叶。如图所示。5其中,7个BES1蛋白SlBES1.2、SlBES1.3、SlBES1.4、SlBES1.5、SlBES1.6、SlBES1.8和SlBES1.9定位于细胞核和细胞质。这一结果与磷酸化的BES1主要分布在细胞质中,而去磷酸化的BES1在细胞核中积累的事实基本一致[15]。对于这两个被注释的β-淀粉酶蛋白SlBES1.1和SlBES1.7,绿色荧光色素呈现非核形状,因此我们进一步用DAPI标记烟叶细胞的细胞核,绿色荧光色素确实没有与细胞核重叠(图5)2).我们还检测了叶绿素自荧光来分析这两种蛋白是否定位于叶绿体,而这两种荧光色素在大小和位置上都有明显的区别,表明它们属于非叶绿体定位(图5)2).综上所述,考虑到绿色荧光色素比细胞核大,我们假设这两个被注释的β-淀粉酶基因位于内质网。
SlBES1蛋白的转激活活性分析
和大多数人一样SlBES1因此,我们利用酵母gal4应答报告系统检测SlBES1蛋白的反活化活性(图2)。6a).将pGBKT7-SlBES1融合质粒在酵母中转化3天后,所有酵母转化子在SD/−Trp培养基上生长良好,只有含有pGBKT7-SlBES1.3、pGBKT7-SlBES1.4、pGBKT7-SlBES1.5、pGBKT7-SlBES1.6、pGBKT7-SlBES1.9的5个酵母转化子和阳性酵母转化子分别水解X-α-Gal并显示蓝色色素,并通过Aureobasidin a (AbA)筛选存活。表明这5种slbes1具有交互活性,而SlBES1.1、SlBES1.2、SlBES1.7和SlBES1.8 4种slbes1不具有交互活性。根据上述SlBES1.1和SlBES1.7的非核亚细胞定位,我们假设这两个SlBES1蛋白不是tf(图2)。5),根据这一假设,SlBES1.1和SlBES1.7确实不具有交互激活活性(图2)。6a).然而,考虑到这7个SlBES1 TFs的c端存在EAR基序(图2)。3.b)出乎意料的是,其中5个被发现具有交互激活活性(在Discussion中进一步讨论)。其余的两个SlBES1蛋白,SlBES1.2和SlBES1.8,显示没有反激活活性,进一步确定它们是否作为转录抑制物通过双荧光素酶测定(图2)。6b).将这两个基因的全长编码序列与GAL4 DNA结合域作为效应体融合。强转录激活因子VP16 [35],作为阳性对照。效应因子和报告因子在烟叶中共表达后,测定其LUC和REN值。正如预期的那样,pBD- slbes1.2和pBD- slbes1.8的相对LUC/REN比率远低于单独的pBD。相反,VP16转录激活因子显著增加了LUC报告基因的表达。结合酵母的转激活活性分析,我们证实了SlBES1.2和SlBES1.8是转录抑制因子。
的组织特异性和时空表达谱SlBES1基因
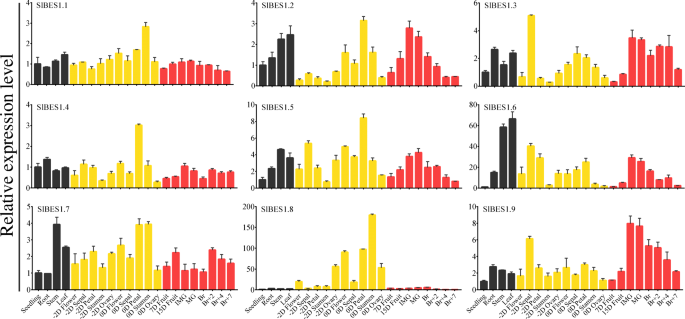
发育特异性和组织特异性表达模式可以帮助我们预测基因的潜在功能,从而预测基因的时空表达SlBES1采用实时荧光定量聚合酶链反应(qRT-PCR)检测基因。选取22个番茄组织模板进行表达谱检测,包括萌发后12天的幼苗,萌发后30天的根、茎、叶,开花和开花前2天的花和花器官(萼片、花瓣、雄蕊和子房),以及不同发育阶段的果实(开花后7天和15天、未成熟绿、成熟绿、破茧、破茧后2天、破茧后4天和7天)。一般来说,大多数SlBES1基因在所有器官中普遍表达,除了SlBES1.8这主要在花器官中表达,表明其潜在的重要功能SlBES1.8在果实凝固期间。值得注意的是,SlBES1.1和SlBES1.4在相对稳定的表达模式下,仅在花蕊和花瓣中分别观察到相对较高的表达,表明SlBES1.1和SlBES1.4可能对番茄植株发育起根本作用。更重要的是,的表达式SlBES1.2,SlBES1.5,SlBES1.6和SlBES1.9随着果实的发育逐渐增加,在IMG和MG期达到最高水平,然后随着果实的成熟逐渐下降(图2)。7).有趣的是,这四种基因的进化关系比其他基因更为密切SlBES1成员(无花果。3.A),这意味着这四个潜在的功能冗余或协同效应SlBES1基因对番茄果实发育的影响
的表达谱SlBES1对植物激素反应的基因
近一个世纪以来,植物激素在植物生长发育中起着至关重要的调节作用,已被广泛研究。了解一个基因对植物激素的响应性,特别是对这些TFs的响应性,可以为我们研究基因功能提供线索。本研究主要研究了吲哚-3-乙酸(IAA)、6-苄基氨基嘌呤(6-BA)、赤霉素A3 (GA)等9种植物激素及其类似物3.12 DPG时,分别用脱落酸(ABA)、乙烯利、外延油菜素内酯(EBL)、水杨酸(SA)、茉莉酸甲酯(MeJA)和独角麦内酯(GR24)处理番茄幼苗。
首先,植物激素处理的有效效果通过之前报道的对植物激素有响应的内参基因得到了验证(图5)3.).ARF5[36],TAS14[37],E4[38],PR1[39],WRKY37[40),D27[41分别用IAA、ABA、Ethephon、SA、MeJA和GR24诱导CLAU[42],GA20ox1[43),CPD[44]可被6-BA、GA抑制3.和EBL。意料之中的是,这些基因在相应激素治疗下的表达与之前发表的报告基本一致,例如,TAS14和PR1ABA和SA均可诱导数倍以上,表明植物激素的处理效果显著。
的响应性SlBES1通过qRT-PCR研究这些激素的基因(图2)。8).表达水平的折叠变化大于2倍p值< 0.05 (FC > 2,p< 0.05)认为对植物激素有反应。根据这个,响应性SlBES1表5总结了这9种植物激素的基因1反应性被标记为“Y”。总的来说,SlBES1基因至少能对一种植物激素产生应答,但对不同植物激素的应答是有区别的。例如,SlBES1.6在对8种植物激素有反应的同时SlBES1.9只能响应一个,即GR24。另一方面,GR24会影响最大的SlBES1吉恩,多达8个人,说明SlBES1基因可能与独角麦内酯信号传导有潜在联系。而乙烯利仅影响SlBES1.2.除此之外,SlBES1基因对一些植物激素的反应显示出相同的趋势,在这种情况下,SlBES1这些基因一般由IAA诱导,GR24抑制。相反,SlBES1基因也可能受到一些植物激素的影响,其趋势与之相反,如ABA诱导的SlBES1.6和SlBES1.8而压抑SlBES1.3和SlBES1.5.的变分表达式SlBES1不同植物激素处理下的基因暗示该基因家族以复杂的方式参与多种激素信号。因此,该基因家族在植物激素串扰中的详细作用值得研究,并可能为我们在该领域提供新的见解。
SlBES1基因在激素处理下的表达谱。九种主要植物激素或其类似物,包括IAA, GA3.选择6-BA、ABA、Ethephon、EBL、SA、MeJA和GR24处理12 DPG的番茄幼苗,分析其响应性SlBES1基因分别为生长素、赤霉素、细胞分裂素、脱落酸、乙烯、油菜素内酯、水杨酸、茉莉酸和独角麦内酯。以不添加任何植物激素的MS/2液体培养基处理的幼苗为对照。的关系表达式SlBES1处理1 h、2 h、4 h、8 h和16 h后,用qRT-PCR检测基因。将数据转换为日志2FC(折叠变化)和可视化的热图。每个时间点的值代表三个生物重复的平均值。红色和蓝色分别表示对照中表达水平的增加和减少。*指与…有显著差异p与相应的模拟对照组比较< 0.05
的表达谱SlBES1基因对压力的反应
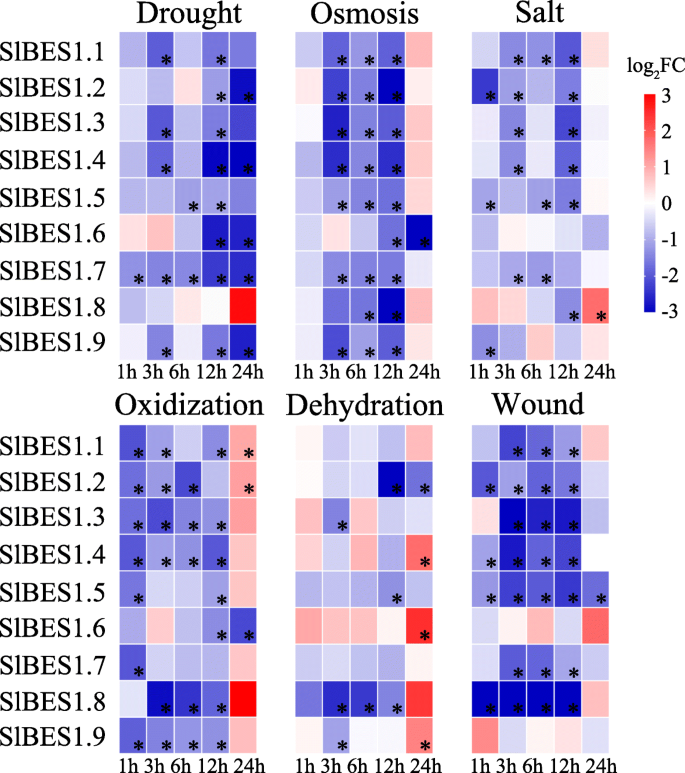
进一步探索潜在的响应性SlBES1我们分析了它们在干旱、渗透、盐、氧化、脱水和伤口胁迫下的表达谱(图2)。9).表5总结了对这些压力的反应2标记为“Y”。总的来说,SlBES1基因家族受多种胁迫的影响,在这6种胁迫下均表现出下调的趋势。这表明SlBES1基因家族在番茄抗逆性中可能起负向作用。具体来说,四名成员(SlBES1.2,SlBES1.3,SlBES1.4,SlBES1.5)对这里分析的所有治疗都有高反应。此外,至少有四种治疗方法可以抑制或诱导其他五种成员。值得注意的是,最强烈的响应SlBES1创面处理后进行家族基因检测。而在盐胁迫下,反应性相对较弱。的广泛参与SlBES1对这些压力作出反应的基因暗示了它们潜在的重要功能。
讨论
BES1转录因子在植物中广泛存在。自从它在拟南芥的全基因组鉴定BES1基因家族已经在许多物种中进行了研究,包括芸苔属植物拉伯[45],芸苔属植物显著[32],芥蓝。学报[46],玉米[47],豆科[31],Gossypium[29],大豆[48),马吕斯有明显[49],但很少有报道关注该基因家族在番茄中的功能(茄属植物lycopersicum).在我们的研究中,有9个BES1在番茄中鉴定的基因(表2)1),其中7个成员通过结合亚细胞定位和转激活活性的调查被确认为tf,而另外两个成员不是(图2)。5,6).根据保守氨基酸残基分析,SlBES1蛋白在其bes1型结构域中具有相同的保守n端和富含丝氨酸的c端(可能分别负责DNA结合和磷酸化)拟南芥(无花果。1c).除此之外,还有西红柿BES1家族与他们有着非常相似的基因结构拟南芥在CDS区,外显子、bes1型结构域和EAR-motif在数量、位置和长度上高度一致(图2)。3.b).此外,BES1蛋白的保守模因基序与其系统发育关系也表现出相应的排列和组合(图2)。3.c).这些结果暗示了BES1基因家族在番茄和番茄中可能具有保守和冗余的功能拟南芥.的确,AtBES1 / AtBZR1和AtBEHs在一定程度上表现出功能冗余,高序突变体导致雄性不育表型拟南芥而单、双、三、四倍突变体则不表现出这种表型[25,26]。在这些结果的指导下,我们可以假设SlBES1基因也可能影响同样的生物过程。
据报道,在BR缺失的情况下,核心负调控因子brassinosteroids - insensitive 2 (BIN2)会使BES1蛋白发生磷酸化,磷酸化后的BES1主要分布在细胞质中。在BR存在的情况下,BIN2活性被抑制,同时磷酸化的BES1被蛋白磷酸酶2A (PP2A)去磷酸化,随后从细胞质转移到细胞核[15,50,51]。与此相对应,AtBES1的亚细胞定位显示在细胞核和细胞质中都存在[13,52]。同样,在我们的研究中,7个番茄BES1成员同时表现出核和细胞质定位(图2)。5),这反过来表明番茄BES1蛋白也保持磷酸化的调节。更重要的是,另外两个特殊的BES1蛋白BMY2和BMY4被报道位于细胞核中,并作为TFs功能拟南芥[27]。与此结果不同的是,它们的番茄同源物SlBES1.7和SlBES1.1没有定位到细胞核(图2)。5,年代2),这意味着这两个基因可能发生功能分化。9个中的4个拟南芥位于叶绿体中的β-淀粉酶[53],我们考察了SlBES1.1和SlBES1.7是否与它们具有相同的定位。然而,SlBES1.1-GFP和SlBES1.7-GFP荧光都没有与叶绿素自荧光重叠(图5)2),表明SlBES1.1和SlBES1.7的非叶绿体定位。根据荧光色素的大小,我们推测这两个基因可能定位于内质网。SlBES1.1和SlBES1.7的亚细胞定位有待进一步的实验验证。
EAR基序是植物中一个活性抑制基序。EAR基序蛋白可以作为转录因子,通过组蛋白修饰直接抑制下游基因的转录,也可以作为转录调节剂,通过与转录激活因子结合来调节转录激活因子的活性,从而降低靶基因的表达水平[34,54]。通过对基因结构和氨基酸序列的分析,我们发现这些基因中都存在EAR基序BES1标记为tf的基因(图2)3.B),这表明这些基因可能具有转录抑制功能。然而,其中有五名成员(SlBES1.3,SlBES1.4,SlBES1.5,SlBES1.6和SlBES1.9)在酵母中显示出转录激活活性,只有两个成员(SlBES1.2和SlBES1.8)作为转录抑制因子(图2)。6).事实上,据报道AtBZR1尽管其c端存在EAR基序,但在BR稳态和信号传导中发挥双重作用。在这种情况下,AtBZR1不仅可以抑制BR生物合成基因,还可以通过直接结合下游BR应答基因的启动子激活下游BR应答基因[14]。在Jia等人最近发表的一份报告中。[55], SlBZR1(在我们的研究中也命名为SlBES1.9)作为转录抑制因子,这与我们的结果相反。在调查中,拟南芥以叶片原生质体为材料,评价了SlBZR1的转激活能力。在VP16不存在的情况下,SlBZR1对报告基因的表达无显著影响,而在VP16存在的情况下,SlBZR1显著降低了VP16的转录激活活性。考虑到酵母和拟南芥在叶片原生质体中,我们可以假设几种不同的蛋白可能通过直接相互作用或竞争的方式影响SlBZR1的反活化活性,从而产生相反的反活化能力。同样,AtBES1在其c端也具有EAR基序,并同时作为激活因子和抑制因子[7,15]。例如,这种现象在转录因子中很普遍,拟南芥阴阳1号(AtYY1)同时含有激活和抑制结构域,其n端51-193位残基具有较强的抑制活性,而其c端256-387位残基具有4倍以上的激活活性,导致其全长AtYY1具有较弱的转录抑制活性[56]。因此,我们可以假设SlBES1在酵母中表现出转录激活活性的基因也可能含有除抑制性EAR基序外的激活结构域,这使得它们在特定情况下可以激活或抑制下游基因。
一个番茄BES1的基因,SlBES1.8,在nj树中按D分组(图2)。2)中没有封闭的同源物拟南芥.此外,它具有更简单的基因结构,这里只分析了一个保守基序(图2)。3.),暗示了这种基因的特殊性。亚细胞定位显示SlBES1.8定位于细胞核和细胞质(图2)。5),结合酵母分析和双荧光素酶实验得出的转录抑制活性(图2)。6),我们可以将其视为转录抑制因子。发育特异性和组织特异性表达模式显示出特异性的相对高表达水平SlBES1.8在花器官中(图。7),这为……提供了可能性SlBES1.8可能有助于番茄的结实和早期发育。与这个假设相一致,SlBES1.8均可被生长素和赤霉素诱导(图2)。8),两种重要的植物激素,在调节坐果和发育。更重要的是,生长素和赤霉素反应灵敏独联体-元件、AuxRR-core和TATC-box也在SlBES1.8(无花果。4).综上所述,我们可以推测SlBES1.8可能对番茄果实的坐果和发育有重要作用,这在其他基因的功能中未见报道BES1成员。
在所有植物激素处理中,变化最明显的是SlBES1暴露于GR24时发生表达,其中SlBES1在治疗早期,基因被显著抑制(图2)。8).据报道,MORE AXILLARY GROWTH LOCUS 2 (MAX2)是一种关键的独角胞内酯(SL)信号成分,它可以与BES1及其同系物相互作用并调节AtBES1的降解,该过程依赖于26S蛋白酶体并由GR24促进[57]。此外,一种假定的SLs受体AtD14也可以增强AtBES1的降解[57]。鉴于。的表达水平下降SlBES1基因(图。8),我们可以假设SlBES1蛋白在番茄中也受到同样的降解调控。然而,除此之外,转录水平SlBES1激素处理(如乙烯利)对基因的影响不大,尽管在某些时间点出现了变音符表达变化(图2)。8).BES1和BZR1以去磷酸化的形式发挥作用,激素处理可能不会影响它们的mRNA水平,但会改变它们的磷酸化状态。的确,表达水平AtBES1不受EBL处理的影响,而以去磷酸化的形式稳定下来[13]。在本研究中,EBL治疗也未改变SlBES1基因在早期治疗阶段,而一些成员,如SlBES1.6和SlBES1.2,处理8 h后诱导或抑制(图2)。8).与EBL治疗相似,AtBES1和AtBZR1也不受GA的影响3.治疗拟南芥而去磷酸化的AtBZR1在GA后出现了积累3.应用程序(58]。在我们的调查中,大多数SlBES1家族基因对赤霉素无应答性3.治疗,除了轻微的诱导SlBES1.6和SlBES1.8以及对SlBES1.1在一些时间点观测到的数据(图2)。8表51).AtBZR1可以与酵母双杂交得到的所有DELLA蛋白相互作用。此外,AtBZR1与DELLA家族转录调控因子ga1-3阻遏物(REPRESSOR of ga1-3, RGA)的物理蛋白-蛋白相互作用通过共定位、bic和co-IP进一步验证。此外,AtBZR1和RGA似乎相互拮抗转录活性[58]。总的来说,GA3.的功能受到影响BES1主要不是在转录水平,而是通过调节BES1-DELLA相互作用在翻译水平。因此,对于BES1家族介导的植物激素串扰的研究,进一步的研究不仅应着眼于转录调控,还应研究BES1家族的蛋白-蛋白相互作用和磷酸化状态。
从应激处理中的表达模式,我们可以知道大多数SlBES1当暴露于压力时,基因被抑制,因此可能以消极的方式对这些压力作出反应。9).许多研究已经证明了这一假设,例如AtBZR1可以直接抑制JUNGBRUNNEN1(JUB1),一种过氧化氢诱导的NAC转录因子,其功能是促进对各种非生物胁迫的耐受性[59,60]。此外,已有研究证实BR信号通路通过调控BR通路负调控因子BES1与RESPONSIVE TO DESICCATION 26 (RD26)之间的互抑机制来抑制干旱反应。此外,RD26可受干旱诱导,促进干旱调控基因的表达,从而提高植物的抗旱性。而BES1可以抑制RD26等干旱相关基因的表达,导致干旱响应的抑制[61]。因此,我们推测,击倒SlBES1基因家族可以提高番茄的抗逆性,从而提高产量。
总的来说,这项研究提供了有价值的信息SlBES1家族,包括基因组特征,蛋白质功能特征和在不同组织中的表达模式,以及对植物激素和胁迫的响应。该结果为细胞功能研究提供了重要线索SlBES1基因和对番茄激素信号串扰和抗逆性的认识。
结论
在这项研究中,有9个BES1在番茄中进行了基因鉴定。随后对该家族进行了系统的基因组特征分析,包括染色体定位、bes1型结构域内的保守氨基酸残基、进化关系、基因结构、保守基序和基因序列独联体元素。的亚细胞定位和转激活活性SlBES1进一步研究基因。的表达谱SlBES1不同组织中的基因在番茄坐果和发育中显示出潜在的重要作用。此外,基因的表达模式暗示了关键的调控作用SlBES1对植物激素和压力作出反应的基因。因此,我们的研究结果为功能研究奠定了基础SlBES1家庭。
方法
植物材料和生长条件
番茄(茄属植物lycopersicum简历。从法国图卢兹大学INRA果实基因组学与生物技术实验室获得的番茄矮秆品种Micro-Tom,在MS/2培养基上发芽12天后移栽到温室土壤上。适宜生长条件为明暗循环16/8 h,昼夜温度25/20℃,相对湿度60%。烟草植物(烟草benthamianaL.)在相同生长条件下直接种植在土壤上。所有植株每周用营养液灌溉一次。从番茄幼苗(12 DPG)、1月龄番茄(30 DPG)和其他相应发育阶段的番茄组织中收集发育和组织特异性表达分析样本。收集了至少8株独立健康植株的幼苗、根、茎和叶。采集了至少20株独立健康植株的花期花、花前2天花及相应的花器官。每个阶段的水果样本至少从10个单独的水果中采集。所有样品立即冷冻,研磨后彻底混合。每个组织组包含三个独立的生物样本,每个样本在qRT-PCR中进行四次技术重复。
的识别BES1番茄基因
识别BES1番茄的基因家族AtBES1首先从拟南芥信息资源(TAIR)数据库(https://www.arabidopsis.org/).的氨基酸序列全长AtBES1在NCBI中通过CD-search检索bes1型域(https://www.ncbi.nlm.nih.gov/cdd/?term=).bes1型结构域氨基酸序列在茄科基因组数据库(http://solgenomics.net/, Tomato Genome proteins, ITAG release 4.0), e值为10−10.此外,Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Slycopersicum)也用于搜索BES1番茄的基因家族。通过CD-search和SMART (http://smart.embl-heidelberg.de/).总的来说,包含bes1类型域的候选域被视为BES1番茄的基因。BES1拟南芥基因家族(答:芥)、胡椒(c .建立)、大豆(g·马克斯)、米饭(o .漂白亚麻纤维卷)和玉米(z梅斯),收集自TAIR,茄科基因组数据库,大豆Wm82.a2。v1 (https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Gmax)、水稻基因组注释计划数据库(http://rice.plantbiology.msu.edu/index.shtml),玉米数据库(http://www.gramene.org/分别)。
番茄的生物信息学分析SlBES1基因
的基因组位点SlBES1基因收集自茄科基因组数据库。的分子量(MW)和等电点(pI)SlBES1用ExPASy Server (https://web.expasy.org/protparam/).ClustalX2.1软件[62]对9个SlBES1蛋白和8个AtBES1蛋白的全长序列进行多序列比对。利用ESPript 3.0 (http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)输出图片。用于保守氨基酸残基分析SlBES1通过CD-search确认每个SlBES1蛋白的bes1型结构域,随后通过WebLogo (http://weblogo.berkeley.edu/).更重要的是,为了分析进化关系,从番茄中提取的BES1蛋白的全长,拟南芥利用MEGA X中的MUSCLE程序对辣椒、大豆、水稻和玉米进行了比对[j]。63],默认设置。然后根据比对结果构建邻居连接树,并利用交互式生命树(iTOLv5)在线工具(https://itol.embl.de/)最终被用来打磨nj树。TBtools [64用One Step MCScanX进行番茄间的基因合成分析,拟南芥并通过多重合成图进一步将结果可视化。的结构BES1通过基因结构显示服务器(GSDS 2.0) (http://gsds.cbi.pku.edu.cn/),并通过MEME Suite (http://meme-suite.org/tools/meme).为了探索独联体的启动子区的-元素SlBES1基因,2 kb序列在上游SlBES1使用编码序列提交到PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
SlBES1蛋白的亚细胞定位
为确定亚细胞定位,选取不含终止密码子的编码序列全长SlBES1将基因融合到pCXDG-GFP载体中。随后将融合质粒转化为根癌土壤杆菌(GV3101)。以1月龄烟草叶片瞬时表达融合SlBES1-GFP蛋白。感染3天后,用激光扫描共聚焦显微镜(德国徕卡TCS SP8)观察绿色荧光。
酵母的反活化活性分析
的开放阅读帧(orf)SlBES1将基因扩增并连接到pGBKT7-GAL4BD质粒中。融合的GAL4BD-SlBES1构建物进一步转化为Y2H金酵母细胞。采用SD/−Trp培养基培养酵母转化子。转化子α-半乳糖苷酶活性通过X-α-gal和AUR1-C由Aureobasidin A (AbA, Clontech, USA)筛选。
Dual-luciferase化验
的orfSlBES1.2和SlBES1.8扩增并连接到pEAQ-GAL4BD质粒作为效应物。选择VP16构建pEAQ-GAL4BD作为阳性对照。将含有GAL4结合元件(5 × GAL4)与CaMV35S最小TATA区融合驱动萤火虫荧光素酶(LUC)表达的双报告载体pGreenII 0800-LUC作为报告载体。以CaMV35S驱动的肾荧光素酶(renilla luciferase, REN)为内参。
效应器和报告因子转化为根癌土壤杆菌(GV3101)分别侵染1月龄烟叶,并按效应器:报告者比例= 9:1。用双荧光素酶报告基因检测系统(Promega, USA)检测LUC和REN在共感染3天后的活性。每种组合至少进行6次生物重复。最后,计算LUC/REN比值,评估SlBES1蛋白的转录激活活性。
激素和应激疗法
激素处理时,番茄幼苗首先在MS/2固体培养基上发芽生长。发芽12天后,将番茄幼苗浸泡在含有20 μM IAA、10 μM 6-BA、20 μM GA的MS/2液体培养基中3.分别为100 μM ABA, 20 μM Ethephon, 0.5 μM EBL, 20 μM SA, 50 μM MeJA和5 μM GR24, 25°C暗室孵育。分别处理1 h、2 h、4 h、8 h、16 h后采集样品。在每个时间点将幼苗浸泡在不加激素的MS/2培养基中作为对照。每个样品采集3株幼苗,每个时间点每个处理采集3株幼苗。
对1月龄番茄植株进行胁迫处理。将番茄植株浸泡在含20% (m/v) PEG6000、100 mM甘露醇、150 μM甲基紫素(MV)和200 mM NaCl的溶液中,在标准条件下培养,进行干旱、渗透、氧化和盐胁迫处理。在脱水胁迫处理中,番茄植株除去土壤,用水清洗,然后放在滤纸上,在室温下自然干燥。在损伤应激处理中,用镊子刺穿相同位置的番茄叶片。以浇水充足的番茄植株作为对照。分别在处理1 h、3 h、6 h、12 h、24 h后采集样品。采集3株单株相同位置的叶片为1个样品,每个处理在每个时间点采集3个样品。
RNA分离、cDNA合成及实时荧光定量PCR分析
按照说明书,用RNAprep Pure Plant Kit (Tiangen Biotech, China)提取总RNA。琼脂糖凝胶电泳检测总RNA的完整性,NanoDrop 1000 (Thermo, USA)检测总RNA的浓度。第一链cDNA采用PrimeScript™RT reagent Kit和gDNA Eraser (Perfect Real Time) (Takara, Japan)合成,每40 μL反应总RNA 2 μg。cDNA产物在使用前用去离子水稀释至5倍。结核病绿色®预混料Ex Taq™II (Tli RNaseH Plus) (Takara, Japan)在CFX96 Touch™Real-Time PCR检测系统(BIO-RAD, USA)上进行qRT-PCR。每个反应中使用2微升稀释的cDNA,其他反应组分和条件按照制造商的说明进行。相对表达式由2——ΔΔCt方法,并由TBtools可视化为热图。
数据和材料的可用性
番茄的序列信息和拟南芥BES1从茄科基因组学网络(SGN, SL4.0,https://solgenomics.net/)和拟南芥信息资源(https://www.arabidopsis.org/分别)。辣椒、大豆、水稻和玉米中BES1蛋白的氨基酸序列从大豆基因组数据库(Wm82.a2.v1,http://phytozome.jgi.doe.gov/pz/portal.html)、水稻基因组注释计划数据库(http://rice.plantbiology.msu.edu/index.shtml),玉米数据库(http://www.gramene.org/分别)。独联体-元素从PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).的BES1家族表达数据由qRT-PCR生成,需要时可从相应作者处获取。支持结果的所有其他数据都包含在文章及其附加文件中。
缩写
- AA:
-
氨基酸
- 阿坝:
-
Aureobasidin一
- BES1:
-
BRI1-EMS-SUPPRESSOR 1
- BZR1:
-
BRASSINAZOLE-RESISTANT 1
- cd:
-
编码序列
- ChIP-chip:
-
染色质immunoprecipitation-microarray
- 耳朵:
-
乙烯响应元件结合因子相关的两亲性抑制
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 兆瓦:
-
分子量
- 子:
-
开放式阅读框
- pI:
-
理论等电点
- 存在:
-
定量实时聚合酶链反应
- TFs:
-
转录因子
- UTR:
-
翻译区
参考文献
- 1.
刘建军,刘建军,刘建军,等。NINJA将协同抑制因子TOPLESS连接到茉莉酸信号。自然。2010;464(7289):788 - 91。https://doi.org/10.1038/nature08854.
- 2.
顾玉英,辛达华,张美,林惠敏。植物激素信号在生物和非生物胁迫反应之间的串串。中华医学杂志,2018;19(10):3206。https://doi.org/10.3390/ijms19103206.
- 3.
Mitchell JW, Mandava N, Worley JF, Plimmer JR, Smith MV。油菜素——从油菜花粉中提取的植物激素的新家族。大自然。1970;225(5237):1065 - 6。https://doi.org/10.1038/2251065a0.
- 4.
Grove MD, Spencer GF, Rohwedder WK, Mandava N, Worley JF, Warthen JD等。油菜素内酯:一种从甘蓝型油菜花粉中提取的促进植物生长的类固醇。大自然。1979;281(5728):216 - 7。https://doi.org/10.1038/281216a0.
- 5.
王志强,白美梅,吴娥,朱建勇。油菜素内酯信号网络及其光形态发生调控。科学通报,2012,36(1):701-24。https://doi.org/10.1146/annurev-genet-102209-163450.
- 6.
Planas-Riverola A, Gupta A, Betegón-Putze I, Bosch N, Ibañes M, Caño-Delgado AI。油菜素内酯信号在植物发育和逆境适应中的作用。发展。2019;146 (5):dev151894。https://doi.org/10.1242/dev.151894.
- 7.
李启峰,卢杰,于建伟,张春青,何建新,刘qq。油菜素内酯调控的转录因子BZR1/BES1在多信号调控的植物生长中起协调作用。生物化学与基因调控机制学报,2018;1861(6):561-71。https://doi.org/10.1016/j.bbagrm.2018.04.003.
- 8.
李军,李军。富亮氨酸重复受体激酶参与油菜素内酯信号转导的初步研究。细胞。1997;90(5):929 - 38。https://doi.org/10.1016/s0092 - 8674 (00) 80357 - 8.
- 9.
王振宇,Seto H, Fujioka S, Yoshida S, Chory J.植物甾体激素质膜受体BRI1的表达及其调控作用。大自然。2001;410(6826):380 - 3。https://doi.org/10.1038/35066597.
- 10.
金涛,关森,王志强。CDG1激酶介导BRI1受体激酶到BSU1磷酸酶和gsk3样激酶BIN2的油菜素内酯信号转导。生物质化学工程,2011;43(4):561-71。https://doi.org/10.1016/j.molcel.2011.05.037.
- 11.
何建新,Gendron JM,杨勇,李军,王志勇。gsk3样激酶BIN2磷酸化并破坏拟南芥油菜素内酯信号通路的正调节因子BZR1。科学通报,2002;39(5):385 - 391。https://doi.org/10.1073/pnas.152342599.
- 12.
王志勇,Nakano T, Gendron J,何军,陈敏,Vafeados D,等。核定位BZR1介导油菜素内酯诱导的生长和反馈抑制油菜素内酯的生物合成。生态学报,2002;2(4):505-13。https://doi.org/10.1016/s1534 - 5807 (02) 00153 - 3.
- 13.
尹勇,王志强,Mora-Garcia S,李俊,吉田S, Asami T,等。BES1在油菜素内酯的作用下在细胞核内积累,调节基因表达,促进茎伸长。细胞。2002;109(2):181 - 91。https://doi.org/10.1016/s0092 - 8674 (02) 00721 - 3.
- 14.
何建新,Gendron JM,孙勇,Gampala SS, Gendron N,孙长青,等。BZR1是一种转录抑制因子,在油菜素内酯稳态和生长反应中具有双重作用。科学。2005;307(5715):1634 - 8。https://doi.org/10.1126/science.1107580.
- 15.
尹颖,Vafeados D, Tao Y, Yoshida S, Asami T, Chory J.一类新的转录因子介导拟南芥油菜素类固醇调控基因的表达。细胞。2005;120(2):249 - 59。https://doi.org/10.1016/j.cell.2004.11.044.
- 16.
谢丽,杨超,王鑫。油菜素内酯通过调控拟南芥CESA基因的表达来调控纤维素的生物合成。[J] .生物力学学报,2011;32(3):491 - 491。https://doi.org/10.1093/jxb/err164.
- 17.
王欣,张军,袁敏,Ehrhardt DW,王铮,毛涛。拟南芥微管不稳定蛋白40参与油菜素内酯调控下胚轴伸长。植物学报,2012,24(10):4012-25。https://doi.org/10.1105/tpc.112.103838.
- 18.
金燕,宋建辉,朴秀,郑玉玉,金世华。油菜素内酯诱导的转录抑制和去磷酸化依赖蛋白降解负调控bin2相互作用的AIF2 (BR信号负调控因子)bHLH转录因子。植物生理学报,2017;58(2):227-39。https://doi.org/10.1093/pcp/pcw223.
- 19.
张丽丽,白梅,吴杰,朱建勇,王辉,张志,等。拮抗HLH/bHLH转录因子介导油菜素内酯调控水稻和拟南芥细胞伸长和植株发育。植物学报,2009;21(12):3767-80。https://doi.org/10.1105/tpc.109.070441.
- 20.
李磊,于鑫,Thompson A,郭明,Yoshida S, Asami T,等。拟南芥MYB30是BES1的直接靶点,并与BES1协同调控油菜素内酯诱导的基因表达。植物科学学报,2009;35(2):379 - 379。https://doi.org/10.1111/j.1365-313X.2008.03778.x.
- 21.
叶慧,李丽,郭华,尹颖。MYBL2是gsk3样激酶BIN2的底物,在拟南芥油菜素内酯信号通路中作为BES1的协同抑制因子。中国科学:自然科学版,2012;109(49):20142-7。https://doi.org/10.1073/pnas.1205232109.
- 22.
张涛,徐鹏,王伟,王松,Caruana JC,杨海奎,等。拟南芥g蛋白β亚基AGB1与BES1相互作用,调节油菜素内酯信号传导和细胞伸长。植物科学,2017;8:2225。
- 23.
孙勇,范学勇,曹德明,唐伟,何坤,朱建勇,等。拟南芥油菜素内酯信号转导与转录网络在植物生长调控中的整合。开发单元,2010;19(5):765-77。https://doi.org/10.1016/j.devcel.2010.10.010.
- 24.
于鑫,李磊,Zola J, Aluru M,叶华,Foudree A,等。拟南芥BESI靶基因全基因组鉴定揭示了油菜素内酯转录网络。植物学报,2011;36(4):634 - 646。https://doi.org/10.1111/j.1365-313X.2010.04449.x.
- 25.
陈伟,吕明,王毅,王帕,崔毅,李敏,等。BES1通过ems1 - tpd1 - serk1 /2介导的信号通路激活,控制拟南芥绒毡层的发育。中国生物医学工程学报,2019;10(1):464。https://doi.org/10.1038/s41467-019-12118-4.
- 26.
陈丽丽,高志,赵志,刘霞,李勇,张勇,等。BZR1家族转录因子在BR信号传导中具有冗余和不可或缺的功能,但在调节拟南芥花药发育中表现出不依赖于bri1的功能。植物学报,2019;12(10):1408-15。https://doi.org/10.1016/j.molp.2019.06.006.
- 27.
李建军,刘建军,刘建军,等。β-淀粉酶样蛋白在拟南芥植株生长发育中的转录调控作用。植物学报,2011;23(4):1391-403。https://doi.org/10.1105/tpc.110.081950.
- 28.
乔凡诺尼J,阮春,Ampofo B,钟生,费铮。果实成熟的表观基因组和转录动力学。植物学报,2017;38(1):61-84。https://doi.org/10.1146/annurev-arplant-042916-040906.
- 29.
刘忠,钱国光,陆磊,秦伟,刘军,李军,等。棉花BES1基因的全基因组分析揭示了其在油菜素内酯信号传导中的进化保守作用。中国科学:生命科学,2018;61(12):1566-82。https://doi.org/10.1007/s11427-018-9412-x.
- 30.
李江南KH。GSK3/ shaggy样激酶调控油菜素内酯信号传导科学。2002;295(5558):1299 - 301。https://doi.org/10.1126/science.1065769.
- 31.
李Y,他L,李江,陈J,刘c基因组鉴定、描述和表达分析豆科BZR转录因子的基因家族。植物科学,2018;9:1332。https://doi.org/10.3389/fpls.2018.01332.
- 32.
宋翔,马翔,李超,胡健,杨强,王涛,等。甘蓝型油菜BES1基因家族的综合分析及其在代表性种中的进化模式研究。生物医学工程学报,2018;19(1):346。https://doi.org/10.1186/s12864-018-4744-4.
- 33.
徐刚,郭超,单华,孔华。外显子-内含子结构中重复基因的分化。中国科学:自然科学版,2012;39(4):1183 - 1183。https://doi.org/10.1073/pnas.1109047109.
- 34.
Ohta M, Matsui K, Hiratsu K, Shinshi H, Ohme-Takagi M. II类ERF转录抑制子的抑制域共享活性抑制的基本基序。植物学报。2001;13(8):1959-68。https://doi.org/10.1105/TPC.010127.
- 35.
Sadowski I, Ma J, Triezenberg S, Ptashne M. GAL4-VP16是一种异常有效的转录激活因子。大自然。1988;335(6190):563 - 4。https://doi.org/10.1038/335563a0.
- 36.
Zouine M,付勇,Chateigner-Boutin AL, Mila I, Frasse P,王辉,等。番茄ARF基因家族的特征揭示了包括选择性剪接在内的多层次转录后调控。科学通报,2014;9(1):884 - 883。https://doi.org/10.1371/journal.pone.0084203.
- 37.
Pye MF, Dye SM, Resende RS, MacDonald JD, Bostock RM。盐胁迫对番茄疫霉根冠腐病易感性的影响。植物科学,2018;(9):525。https://doi.org/10.3389/fpls.2018.00525.
- 38.
徐瑞,Goldman S, Coupe S, Deikman J.乙烯调控番茄果实成熟过程中E4转录的两个协同顺式元件。植物学报,1996;31(6):1117 - 1227。https://doi.org/10.1007/BF00040829.
- 39.
李涛,黄勇,徐志生,王峰,熊爱士。水杨酸诱导抗感番茄品种对番茄黄曲叶病毒的差异抗性。植物学报,2019;19(1):173。https://doi.org/10.1186/s12870-019-1784-0.
- 40.
王铮,刘磊,苏辉,郭磊,张军,李勇,等。番茄茉莉酸和铝串扰:茉莉酸/铝调控根生长过程中WRKYs和ALMTs的鉴定和表达分析植物生理学报,2014;44(4):444 - 444。https://doi.org/10.1016/j.plaphy.2020.06.026.
- 41.
刘建军,刘建军,刘建军,刘建军。Sl-IAA27调控番茄(品种:MicroTom)独角麦内酯生物合成和菌根形成。植物化学学报,2017;13(3):1124-32。https://doi.org/10.1111/nph.14246.
- 42.
Bar M, israel A, Levy M, Ben Gera H, Jiménez-Gómez JM, Kouril S,等。CLAUSA是一种MYB转录因子,通过减弱细胞分裂素信号传导促进叶片分化。植物学报,2016;28(7):1602-15。https://doi.org/10.1105/tpc.16.00211.
- 43.
李建军,李建军,李建军,等。通过表征新的番茄原核突变体揭示della独立的赤霉素反应。植物学报,2015;27(6):1579-94。https://doi.org/10.1105/tpc.114.132795.
- 44.
尹毅,秦凯,宋霞,张强,周毅,夏霞,等。BZR1转录因子通过FERONIA受体样激酶介导的活性氧信号调控番茄耐热性。植物生理学报,2018;59(11):2239-54。
- 45.
Saha G, Park JI, Jung HJ, Ahmed NU, Kayum MA, Kang JG,等。油菜BZR转录因子家族分子特征及非生物胁迫诱导的表达谱分析。植物生理学报,2015;42(2):92 - 104。https://doi.org/10.1016/j.plaphy.2015.04.013.
- 46.
吴鹏,宋翔,王忠,段伟,胡锐,王伟,等。白菜BES1转录因子家族的全基因组分析。学报)。植物学报,2016,31(3):291-301。https://doi.org/10.1007/s10725-016-0166-y.
- 47.
李建军,张建军,张建军,等。玉米BZR转录因子家族的克隆及其对逆境胁迫的响应[j] .华北农学报,2018,34(3):422 - 422。https://doi.org/10.1007/s10725-017-0350-8.
- 48.
李强,郭磊,王辉,张勇,樊超,沈勇。大豆BES1基因家族的全基因组分析及综合表征。Heliyon。2019;5 (6):e01868。https://doi.org/10.1016/j.heliyon.2019.e01868.
- 49.
曹旭,Khaliq A,陆生,谢敏,马忠,毛健,等。苹果(Malus domestica) BES1基因家族的全基因组鉴定与特征分析。植物生物学(Stuttg)2020; 22(4): 723 - 33所示。https://doi.org/10.1111/plb.13109.
- 50.
金涛,关森,孙勇,邓铮,唐伟,尚建新,等。从细胞表面受体激酶到核转录因子的油菜素内酯信号转导。中华生物医学杂志,2009;11(10):1254-60。https://doi.org/10.1038/ncb1970.
- 51.
唐W,杨元M,王R, Y,王C, Oses-Prieto JA等。PP2A通过去磷酸化BZR1激活油菜素类固醇应答基因表达和植物生长。中华生物医学杂志,2011;13(2):124-31。https://doi.org/10.1038/ncb2151.
- 52.
蒋军,张超,王晓安。新发现的转录因子BES1促进拟南芥油菜素内酯信号传导和发育的亚型。植物学报,2015;27(2):361-74。https://doi.org/10.1105/tpc.114.133678.
- 53.
富尔顿DC, Stettler M, Mettler T, Vaughan CK,李俊,Francisco P,等。β - amylase4是淀粉分解所需的非催化蛋白,作用于拟南芥叶绿体中三种活性β -淀粉酶的上游。植物学报,2008;20(4):1040-58。https://doi.org/10.1105/tpc.107.056507.
- 54.
杨健,刘勇,闫华,田涛,游强,张磊,等。PlantEAR:植物EAR基序蛋白功能分析平台。前瞻,2018;9:590。https://doi.org/10.3389/fgene.2018.00590.
- 55.
贾超,赵生,鲍涛,赵鹏,彭坤,郭强,等。番茄BZR/BES转录因子SlBZR1正调控番茄和拟南芥BR信号通路和盐胁迫耐性。植物科学。2021;302:110719。https://doi.org/10.1016/j.plantsci.2020.110719.
- 56.
李涛,吴晓霞,李慧,宋建辉,刘建勇。拟南芥ABA响应网络的一个新的负调控因子AtYY1的双功能转录因子。植物学报,2016;9(5):650-61。https://doi.org/10.1016/j.molp.2016.02.010.
- 57.
王艳,孙松,朱伟,贾凯,杨红,王旭。独角麦内酯/ max2诱导的油菜素内酯转录效应物BES1降解调控茎枝分枝。生态学报,2013;27(6):681-8。https://doi.org/10.1016/j.devcel.2013.11.010.
- 58.
李启峰,王超,姜磊,李生,孙世生,何建新。BZR1和DELLAs之间的相互作用介导拟南芥油菜素内酯和赤霉素之间的直接信号串扰。科学通报,2012;35(5):662 - 667。
- 59.
吴a, Allu AD, Garapati P, Siddiqui H, Dortay H, Zanor MI,等。JUNGBRUNNEN1是一种对活性氧物种敏感的NAC转录因子,可调节拟南芥的寿命。植物学报,2012;24(2):482-506。https://doi.org/10.1105/tpc.111.090894.
- 60.
Shahnejat-Bushehri S, Tarkowska D, Sakuraba Y, Balazadeh S.拟南芥NAC转录因子JUB1调控GA/BR代谢和信号转导。植物学报,2016;2(3):16013。https://doi.org/10.1038/nplants.2016.13.
- 61.
叶慧,刘生,唐斌,陈健,谢志,Nolan TM,等。RD26介导干旱和油菜素内酯信号通路之间的串扰。生态学报,2017;8(1):14573。https://doi.org/10.1038/ncomms14573.
- 62.
Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H,等。群集W和群集X 2.0版。生物信息学。2007;23(21):2947 - 8。https://doi.org/10.1093/bioinformatics/btm404.
- 63.
库马尔S, Stecher G, Li M, Knyaz C . Tamura K. MEGA X:基于计算平台的分子进化遗传学分析。生物医学进展,2018;35(6):1547-9。https://doi.org/10.1093/molbev/msy096.
- 64.
陈超,陈宏,张毅,Thomas HR, Frank MH,何毅,等。TBtools:为大生物数据交互式分析开发的综合工具包。植物学报,2020;13(8):1194-202。https://doi.org/10.1016/j.molp.2020.06.009.
致谢
感谢重庆大学分析测试中心提供激光扫描共聚焦显微镜分析。
资金
国家重点研发计划项目(2016YFD0400101)和国家自然科学基金项目(31772370,31972470,32002100)资助。资助机构在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有发挥任何作用。
作者信息
从属关系
贡献
Z. L.和Y. L.设计了这项研究;D. S.、W. X.、L. W.和W. L.进行实验并进行生物信息学分析;D. S.写了手稿,Y. L.和Y. S.修改了论文。所有的作者都读过并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
植物材料(茄属植物lycopersicum简历。本文中使用的Micro-Tom)来自法国图卢兹大学INRA水果基因组学与生物技术实验室。所有植物材料都是免费提供的,并按照国际准则进行维护。本文不包含任何人类或动物的研究,也不涉及任何濒危或受保护的物种。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:图S1。
这10个保守基序在模因分析中的详细序列标识。图S2。亚细胞定位分析SlBES1.1和SlBES1.7.图S3。内参基因在相应激素处理下的相对表达量。表S1.的响应性摘要SlBES1家庭荷尔蒙治疗。表S2。的响应性摘要SlBES1家庭压力治疗。表S3.本研究使用的引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
苏,D,向,W,文,L。et al。全基因组鉴定、鉴定及表达分析BES1番茄的基因家族。BMC Plant Biol21,161(2021)。https://doi.org/10.1186/s12870-021-02933-7
收到了:
接受:
发表:
关键字
- BES1基因家族
- 全基因组分析
- 亚细胞定位
- Transactivation活动
- 表达式模式
- 番茄(茄属植物lycopersicum)