摘要
背景
蛋白酶抑制剂是广泛分布于植物界的防御蛋白。它们通过降低昆虫肠道中消化酶的活性,降低营养物质的可利用性,从而损害攻击性食草动物的生长发育。一类具有良好特性的蛋白酶抑制剂是Kunitz型胰蛋白酶抑制剂(KTIs),已在多种植物中被描述,包括Populus SPP..像白杨树这样的长寿木质多年生植物遇到了巨大的异层异常,但几乎没有研究树木防御的特殊性。因此,我们旨在调查KTIS在黑色杨树中的诱导(P黑鬼)三种不同的食草动物啃食的树叶,舞毒蛾和莫加多伦西亚毛毛虫,和Phratora Vulgatissima甲虫。
结果
我们识别并生成17个全长cDNA序列ktis.并分析了8个上调量最高的黑杨叶片的表达模式克蒂通过QRT-PCR。我们发现甲虫引发了更高的转录诱导克蒂与毛毛虫相比,两种毛毛虫的诱导性相似克蒂表达水平。此外,克蒂大多数基因的表达与草食动物受损叶片的胰蛋白酶抑制活性密切相关,但与受损程度即叶片面积损失无关。
结论
我们的结论是,黑杨中KTIs的诱导是以一种基于阈值的方式控制在转录水平上的,并且强烈地受草食动物的物种特性的影响。然而,这些模式潜在的分子机制和生态后果仍有待研究。
背景
在过去的数百万年里,植物发展了许多策略来保护自己免受食草动物的伤害。除了间接防御(包括招募植食动物的天敌),植物可以通过产生机械屏障、化学毒素和威慑物,或使用干扰植食动物的酶机制的生化防御来直接伤害攻击者。在化学防御中,大多数关注的是低分子量代谢产物,但也存在一些防御蛋白,如蛋白酶抑制剂(pi),可以降低食性食草动物对植物组织的消化率。通过抑制食草动物中肠的蛋白质水解酶,pi减少了蛋白质的消化,从而降低了食草动物生长和发育所需的游离氨基酸的可用性[15.]. 植物中发现的抑制剂种类繁多,目前已有99个不同的抑制剂家族[32.]。这些PI家族以及家庭内的不同成员,对食草肠道中发现的四种蛋白酶,即丝氨酸,半胱氨酸 - ,天冬氨酸 - 和金属蛋白酶的活动有所不同。在食草昆虫中,最丰富的蛋白质降解酶是丝氨酸蛋白酶[15.]。因此,丝氨酸PIS广泛分布在植物王国中并不令人惊讶20.那21.]。最佳表征类别的丝氨酸型胰蛋白酶胰蛋白酶抑制剂(KTIS; ktis;也是Kunitz型蛋白酶抑制剂,KPI),其中一些也能够抑制半胱氨酸蛋白酶[2那6.]. kti是相对较小的蛋白质,质量为20到25 kDa公司[39.],具有β-三叶结构,由一个β-桶和几个环组成,其中一个环与目标蛋白酶的活性位点结合[42]. KTIs的生物活性已通过肠道提取物的体外试验得到证实[16.那29.],以及监测食用富含kti食物的食草动物的适合度[2那6.那22.那25.那26.那30.]。自大豆中KTI的首次描述以来[19.那24.,大多数后续研究也集中在豆科植物的KTIs [16.那17.那22.那30.那36.那43]。然而,在过去的几年里,树木中的KTIs得到了更多的关注。在属的种杨树,已经确定了几个KTIS [7.那27.那29.那37.那39.]有的被机械损伤或昆虫取食诱导[27.那27.那29.那39.]. 例如,森林帐篷毛虫(一种多面手食草动物)的摄食量增加了克蒂杂交杨树叶片转录本的局部和系统丰度[28.]。事实上,在机械伤害时,编码用于KTI的基因属于全身杨树中的最高调节的内容[9.]. 在Philippe等人的一项研究中[39.结果表明,通过伤口触发的转录感应在kTI之间变化并以时间依赖性方式变化。到目前为止,大多数研究使用森林天幕毛虫是一般人类鳞翅目的物种,调查杨树中的食草动物触发的KTI反应[27.那28.那39.]。据我们所知,杨树KTI诱导其他植食性物种的特异性尚未被研究。
对不同食草动物的反应的特异性对于像树的大型长寿的木质多年生植物尤为重要,这在寿命中遇到了大量的食草动物。例如,众所周知,植物对叶片咀嚼草食动物的反应不同,而不是在富含磷脂素-SAP上喂养的草食虫[13.那23.]。在同一喂养公会内也可以观察到抗草食性防御的特异性,并且甚至根据昆虫的发育阶段,甚至在相同的物种内。例如,早期Instar Generalist Caterpillars在黑色杨树叶中诱导更强烈的防御反应,而不是同一物种的晚龄毛细胞[31.]. 潜在的机制可以解释为HAMPs或DAMPS(草食动物或损害相关的分子模式,分别)植物受到攻击时感知[13.]。这些受草本病变的物理属性的影响,例如叶面积去除或组织损伤的时机,也是由化学提示,例如食草动物的唾液化合物[33.]. 所有这些特征都可能是草食性物种特有的,并可能使植物能够区分攻击者,并对特定的草食性动物建立充分有效的防御。在黑杨树上,这种食草动物特有的反应可以显示为信号分子[14.],以及化学防御特征,如挥发性排放[14.那31.那47]。在Fabisch等人最近的一项研究中[14.]甲虫取食比毛虫取食黑杨叶片对胰蛋白酶的诱导作用更强。然而,到目前为止,我们还不知道是哪些特定的基因导致了观察到的PI活性的差异,以及在甲虫和毛虫喂养的叶片中PI编码基因的转录是否存在差异。
在这项研究中,我们测试了不同食草症种类诱导的假设克蒂基因以物种特异性方式。我们确定了17.克蒂从黑杨的一个转录组中提取基因,并产生最上调的全长cDNA序列。这些基因的表达模式克蒂通过三种不同的昆虫物种在草本血症时由QRT-PCR测定的基因(图。1)显示出物种间的显著差异。
方法
植物和昆虫
Populus nigra.L.(杨柳科)树是从德国耶拿附近一个普通花园的树木上剪下来的。这些树最初来自于一个单一的雌性基因型P黑鬼人口(基于形态学特征的Sybille Uncicker确定的物种)位于德国的Küstrin-Kietz(52°34'1“N,14°38'3”E)。由于本研究的扦插从共同庭院中的树木中取出,因此没有允许收集植物材料的许可;凭证标本将在德国耶拿统治者队的春季2021中存放。在2升盆中盆栽,在温室中生长(18/20°C,夜间/日,相对湿度60%,用9-14小时光周期的自然光,为12小时补充光)并转移到气候室(18/20°C,夜间/天;相对湿度60%; PhotoPeriod 16 H)试验开始前2天。树木长4个月至约0.5米(转录组样本)或者长到1.6米高 m(约6 个月)并修剪回0.8 米4 治疗前周(基因表达样本).
舞毒蛾L.(Erebidae,Lepidoptera)毛虫是具有宽主体范围,优选落叶树的通用饲养者。L. DISPAR.从美国农业部(USDA,Buzzards Bay,Ma,USA)的鸡蛋上孵化了毛虫,并在气候室(14/10h,Light / Dark,20-23°C,相对湿度60%)直到它们达到第三瞬间,该阶段用于实验。该物种在MPI-CE中连续饲养。
莫加多伦西亚Blachier(Erebidae,Lepidoptera)毛毛虫也是偏好的木质植物和灌木的一般主义者. A.莫加多伦斯毛细胞从私人饲养员提供的鸡蛋中孵化(www.entomologenportal.de.)并饲养在黑色杨树叶子上,直到它们到达第三个瞬间,该阶段用于实验。个人被饲养,直到成年阶段确认物种身份。
Phratora VulgatissimaL.(Chrysomelidae,Coleoptera)甲虫是专家,喂养在Salicaceae内的窄系列中。甲虫(甲基甲基甲基尔甲基甲群; MPI-CE中可用的酒精中的个体饲养在黑杨树上的实验室中。
实验设计与取样
来自两个不同实验的植物材料被用来分析转录组(参见转录组样本)或kunitz型胰蛋白酶抑制剂(KTIs;看到基因表达样本).
转录组样本
一个叶池(来自一棵年轻的黑杨树茎的8片叶子)(n = 4) 被纱布包裹,然后感染了L. DISPAR.毛毛虫(每棵树4个人),成人P.Vulgatissima.甲虫(每棵树6只),或未经处理(控制)。由于实验昆虫的可得性存在时间差异,甲虫处理比毛虫处理提前两周进行;两种治疗都有各自的对照组(n= 4),与草食处理植物同时处理和取样,但未暴露于草食动物。2 d后,处理后的叶片在液氮中快速冷冻,保存在−80℃。
基因表达样本
通过QRT-PCR,来自Fabisch等人所述的实验的基因表达分析。[14.使用了,描述了这些方法的进一步细节。简而言之,黑杨树的叶池(5叶)(n= 10,但随机选择6进行基因表达分析)用PET袋(Bratschlauch, Toppits, Minden, Germany)包装后感染L. DISPAR.毛虫(每棵树10个)答:mogadorensis(每棵树10个),P.Vulgatissima.甲虫(每棵树50只),或未经处理(控制)。1 d后减少毛虫数量,防止叶片过度脱落。总摄食期为2 d后,拍摄叶片照片,评估损害程度,随后将其速冻在液氮中,并在−80℃保存。通过重建图片中原始的叶子面积,并计算代表总的和去除的叶子面积的像素数,将损害量化为叶子面积损失(Photoshop, Version 15.0.0, Adobe Systems Incorporated, San Francisco, USA)。像素被转换为面积(厘米2)使用照片中的参考字段。
RNA分离和cDNA合成
冷冻叶片在液氮中研磨,使用Invitrap旋转植物迷你试剂盒(Stratec Biomedical Ag,Birkenfeld,德国)分离RNA,包括DNase消化。用Nanodrop 2000C分光光度计(Peqlab Biotechnologie GmbH,Erlangen,德国)测量RNA浓度。对于转录组样品,用RNA 6000纳米试剂盒在生物分析仪(Agilent,Santa Clara,Ca,USA)上进行额外的质量检查。使用上标-III逆转录酶和寡替偶-DT-DT引物(Thermo Fisher Scientific,Waltham,Ma,USA)从RNA合成cDNA。
转录组分析
在Hisequck-Genome-Center(Köln,德国Köln,illumina,San Diego,CA,USA)的Max Planck-Genome-Center(Köln,San Diego,CA)进行测序,每个样品读取9个MIO。详细资料有关质量控制措施的信息,DE Novo转录组的组装和注释可以在Eberl等人中找到。[12.,但最相关的信息将在这里总结。该注释使用了BLAST、基因本体论(GO)和InterPro术语(InterProScan、EBI)。基于对NCBI nr数据库中已知KTI的BLAST命中阳性、与丝氨酸蛋白酶抑制剂相关的GO条件和/或对Pfam结构域PF00197 (Kunitz STI蛋白酶抑制剂)的命中,识别出潜在KTI蛋白的Contigs编码。或InterPro域IPR011065 (Kunitz抑制剂STI-like超家族)和IPR002160 (Kunitz豆科蛋白酶抑制剂I3)。为了确定进一步的KTI候选者,该P黑鬼转录组在内部数据库中上传,用于来自NCBI的杨树KTI序列的爆炸分析(www.ncbi.nlm.nih.gov/)和植物血统(https://phytozome.jgi.doe.gov/pz/portal.html). 使用CLC Genomics Workbench v9.1进行数字基因表达分析以生成BAM(映射)文件,然后使用QSeq软件(美国威斯康星州麦迪逊市DNAStar公司)估计表达水平。log2(RPKM)值(标准化映射读取值;用生物复制样品的几何平均数(s)计算折叠变化值。差异表达的基因通过Student t检验(如Qseq中所述)进行鉴定,并使用Benjamini–Hochberg程序对多重检验进行校正,以检查错误发现率(FDR)。修正FDR后p-Value小于0.05,基因被认为是显着差异的表达。
除了克蒂本文所述的转录组中的基因序列,另一个实验克蒂基因(Pnkti B1)从相同的额外叶片转录组中鉴定出来P黑鬼基因型和可比性L. DISPAR.草食病治疗(未发表)。此外,编码kti的另一个序列(pnkti A4或者在转录组中未存在的SQ33325-2)在从CDNA(见下文)的扩增期间鉴定出最初设计的引物Pnkti A13(SQ33325)。
PI基因的克隆和测序
根据制造商手册(New England Biolabs GmbH, Frankfurt/Main, Germany),在HF-buffer中使用Phusion高保真聚合酶,从食草动物诱导的样本的混合cDNA中扩增全长开放阅读框(ORF)。引物的设计依据是转录组中已知的ORF,或根据NCBI数据库中检索到的同源基因的ORF (https://www.ncbi.nlm.nih.gov/).将PCR产物克隆到PCR4-钝的顶部载体(Thermo Fisher)中,并使用Sanger协议和用ABI棱镜 - 基因分析仪3130XL(应用生物系统)进行完全测序。
序列比对与系统发育分析
同系物P黑鬼KTI使用NCBI数据库的爆炸搜索识别序列(https://blast.ncbi.nlm.nih.gov/Blast.cgi)和P. Trichocarpa.基因组v3.0(https:////phytozome.jgi.doe.gov/).比对和相似性计算是用genious软件(Biomatters, Auckland, New Zealand)完成的。
利用MEGA6中的肌肉算法构建了杨树KTI蛋白的氨基酸序列[46]。使用邻接方法和基于JTT矩阵的方法使用Mega6完成树重建。消除了少于80%的站点覆盖的所有位置。
qRT-PCR分析基因表达
cDNA(用水稀释1:3)基因表达样本用于定量实时PCR(qRT PCR),在CFX-Connect实时PCR检测系统(Bio-Rad Laboratories,Hercules,CA,USA)上的Brilliant III超快SYBR反应混合物(Agilent)中进行,采用40个2步循环(95 摄氏度,30秒 + 60 °C,30s)和从53到95的熔化曲线 摄氏度。引物序列见表S2. PCR产物通过上述克隆和测序进行验证。基因表达用CFX Manager 3.1(Bio-Rad)和Δc计算问方法并考虑底漆效率。值被标准化为肌动蛋白作为参考基因[41.]相对于对照样品表达。
胰蛋白酶抑制活性测定
为了将基因表达与蛋白酶抑制剂活性联系起来,进行了胰蛋白酶抑制活性测定,如Fabisch等[14.]。在短的情况下,用400μL缓冲液(25mM Hepes-KOH,pH 7.2,3.2,3%PVPP,2%PVP,1mM EDTA)萃取10mg冷冻干燥的叶片材料,并在比色中测试胰蛋白酶抑制活性的提取物(N-乙酰-D1-苯丙氨酸β-萘基酯的切割)凝胶扩散测定。
统计分析
检查所有数据是否检查统计假设,即差异的同质性和正态分布。所有的基因表达数据克蒂基因必须是日志10.-转换以满足参数测试的统计假设。对于基因表达数据,采用单因素方差分析(MANOVA)和Tukey事后检验相结合的方法。所有统计分析均采用spss17.0(SPSS,芝加哥,伊利诺伊州,美国)进行。
结果
草食动物诱导的kunitz型胰蛋白酶抑制剂的鉴定
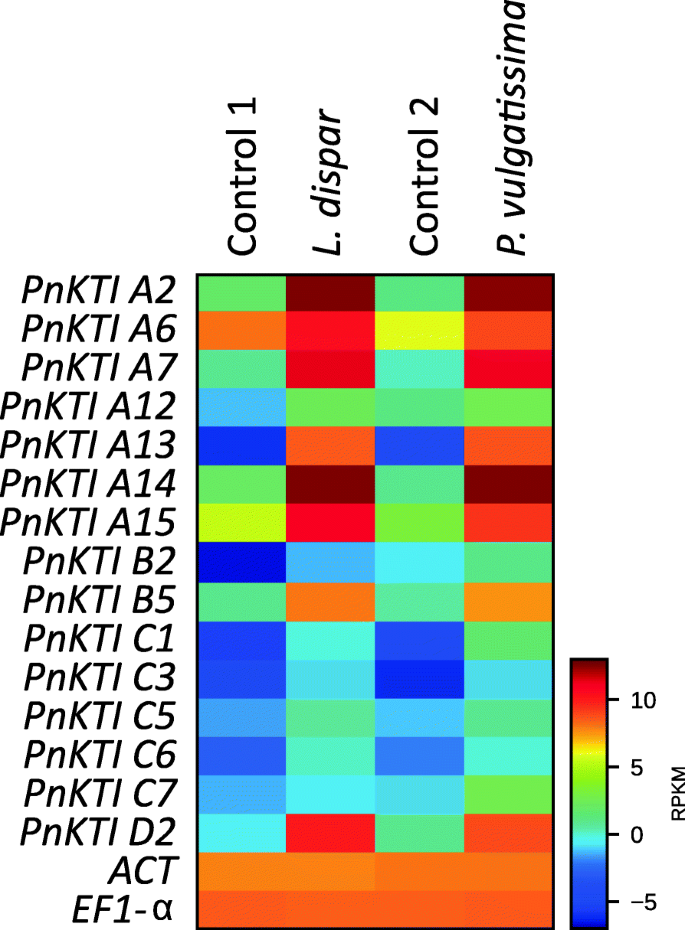
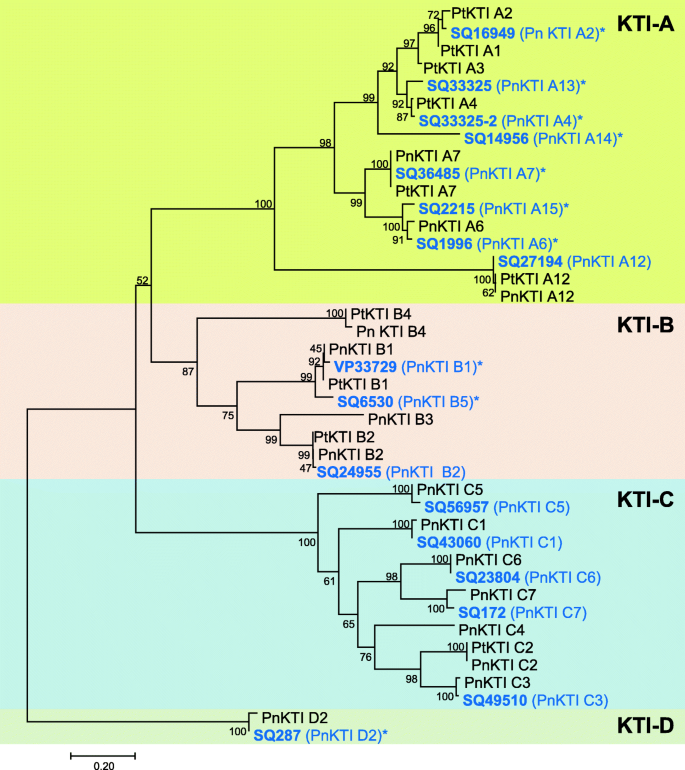
两种不同昆虫取食和不取食黑杨树叶的转录组,舞毒蛾(鳞翅目)和Phratora Vulgatissima(鞘翅目),用于识别植食动物诱导的kunitz型胰蛋白酶抑制剂(KTIs)的编码基因。在所有转录组序列中,45个序列被鉴定为蛋白酶抑制剂基因(pi),其中30个在毛虫和甲虫两种食草动物上均表达上调,7个在不同的食草动物上表达不同的调控模式,8个在食草动物上表达下调(表S3.).在45个PI基因中,15个属于克蒂S,并在草食病上进行了上调(图。2).这15岁克蒂序列,加上两种另外识别克蒂将基因与先前描述的杨树进行比较克蒂(表年代4.),并根据Ma等人的命名法命名[27.]。
基于氨基酸对准的系统发育分析显示KTIS簇中的4个亚壳(图。3.). 17kti大部分属于A和C亚家族,而只有一种蛋白质属于D亚家族。有趣的是,与其他三个亚家族的成员相比,C亚家族的所有成员都表现出低表达,并且在食草时仅略微上调(图。2). 因此,在进一步的分析中没有考虑C亚科的KTI。从剩下的克蒂选择在食草动物诱导样品中表达水平最高的基因进行cDNA测序,得到10个完整的开放阅读框PnKTI基因(图。3.).
kti基因表达的草食物特异性诱导
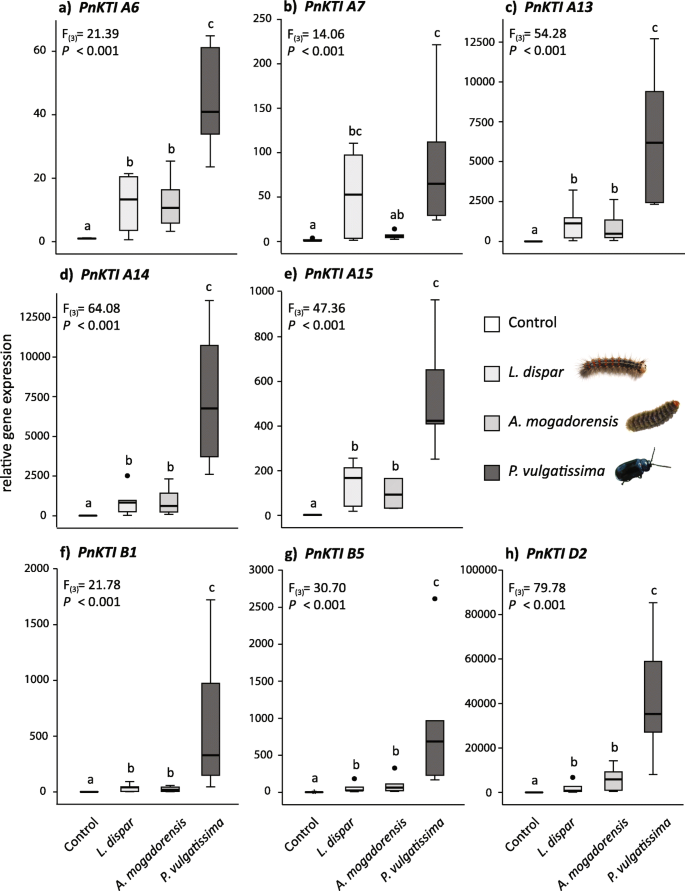
目的:研究肿瘤的特异性克蒂基因表达,我们使用了三种不同的草食性物种,其具有相似的(L. DISPAR,AMATA MOGADORENSIS)或不同的(P.Vulgatissima.)黑杨树叶的损伤模式(图。1)但都会引起相似的叶面积损失(表S)1). 在以前的研究中,我们发现三种不同的食草动物,特别是通过不同的植物,都能诱导黑杨叶片中总胰蛋白酶抑制剂的活性P.Vulgatissima.[14.]. 为了在转录水平上研究这一现象,研究了9个候选基因的相对表达PnKTI通过QRT-PCR分析S,使用来自此前一项研究的随机选择的样品进行分析。
而PnKTI A2不能在qPCR反应中扩增,因此被排除在进一步分析之外,其余8个都是PnKTI通过所有测试的昆虫,基因显示出在草食性上的显着上调(图。4.). 以损伤严重程度为协变量的多变量分析显示,草食处理对损伤的影响最大PnKTI基因表达(F(24) = 7.230;P. < 0.001).
未损坏叶片中的组成型表达水平不同PnKTIA亚家族成员的表达水平一般高于B和D亚家族成员(表S5.).然而,在草食病上,该基因表明其诱导性更明显差异(图。4.).毛毛虫草本植物L. DISPAR.和答:mogadorensis导致所有的上调克蒂基因大约10 (Pnkti A6)至2000倍(pnkti d2)与本构层次相比。全部克蒂这两种鳞翅目食草动物的基因诱导水平相近。甲虫食草性的P.Vulgatissima,然而,引起了更强的诱导克蒂基因表达比毛虫食草性强。在甲虫受损叶片中的表达量增加了4万倍(pnkti d2)与未损坏的控制相比。然而,不同的基因之间的诱导水平有很大的差异,从大约40 (Pnkti A6)和几百(Pnkti A15那B1那B5.)至几千倍(Pnkti A13那A14那D2). 有趣的是,pnkti d2,一个具有最低组成性表达水平的基因,显示了迄今为止对毛虫和甲虫的相对诱导最强(图。4.h) 是的。
仅考虑草食动物处理(不包括未损坏的对照组),我们发现伤害严重程度(%叶面积损失)对大多数情况下的表达水平没有实质性影响PnKTIs。只有两个基因,Pnkti A7和Pnkti B1,其表达显著受此因素影响(ANCOVA;Pnkti A7: F(1)= 9.348,P. = 0.009;Pnkti B1: F(1) = 5.012;P. = 0.042). Accordingly, the expression of thePnKTI除了案例外也没有与伤害严重程度相关联Pnkti A7,这与叶面积损失显示出积极关系(Spearman的等级相关性:ρ= 0.556,P. = 0.017). The total trypsin-inhibiting activity (Table S1[14.];), 另一方面,与所有PnKTI正相关(表1).
讨论
本文介绍了kunitz型胰蛋白酶抑制剂(KTIs)的序列分析和表达模式。Populus nigra.),包括十个全长cDNA序列,其中六个尚未描述过P黑鬼.这些Pnktis中的八个在叶片中的草食性物种特异性诱导模式的背景下研究了甲虫食草剂的表明比相同幅度的毛虫草本相似的更强烈的转录响应。
黑杨个体KTI基因表达水平及诱导性研究
蛋白酶抑制剂(PI)的转录和活性的上调在黑杨中也有报道[27.那38.]。然而,在不同的研究中,构成性表达水平和诱导幅度是不同的。在我们的研究中,c -亚家族成员在食草动物中普遍表现出低表达水平,很少或没有上调(图。2).相比之下,马等人。[27.]观察到这个亚科的大多数基因有较强的食草动物诱导作用。这说明克蒂转录取决于比草食动物喂养或单独伤害更多的因素。植物的某些特征,如年龄,基因型[44或以前经历过的损伤可能会起到一定作用,但实验条件,如非生物条件、时机[27.那39.或者伤害严重程度可能会影响表达水平。然而,不同的研究中也存在一致的模式。在我们的研究中,pnkti d2是D亚家族的唯一成员,表现出最高的诱导性,即在取食时的相对变化(图。4.).相同的基因是最上调的克蒂另一种黑杨树的草食性和机械性伤害研究[27.]。同样,高食草食虫诱导的表达水平Pnkti A14在我们的实验(图。2;表的年代5.)与杂交杨树(P. Trichocarpa.xdeltoides.)草食病和机械伤害后[39.]. 然而,在未受损的对照组中,该基因也显示出相对较高的转录物丰度,假设在组成性防御或初级代谢中也起作用。相反地,pnkti d2,在我们和类似的研究中显示出在未损坏的组织中的最小表达水平[27.],似乎只在诱导的抗草食性防御中起作用。
大部分的基因表达没有相关性PnKTI基因和损伤的严重程度,这表明基于阈值的PnKTI转录而不是持续控制,在这种情况下,更多的损伤会导致更高的死亡率克蒂成绩单水平。此外,我们还发现,杨树叶片中胰蛋白酶抑制活性与所有基因的转录水平都有很强的正相关关系PnKTI基因。这表明P黑鬼KTI活性主要受转录水平控制,因此是由从头生物合成控制的。胁迫诱导的pi从头生物合成的重要性已在水稻中得到证实[40]。
PnKTI诱导中的食草动物特异性
当我们分析转录时克蒂在不同昆虫食草食虫中损坏的叶子中,甲虫引起了所有测试的更强大的诱导克蒂(图)4.). 类似的观察来自松树[35.]还有马利筋[1那48),与毛虫食草动物相比,甲虫食草动物诱导了更强的防御反应(分别是树脂和萜烯或乳胶)。虽然在杨树中没有发现,但在其他系统中对pi的诱导有物种特异性的报道。在大豆中,被粘虫幼虫侵染增加了pi的活性,而蓟马侵染没有增加[43]。de Oliveira等。[11.]甚至观察到番茄PIs对同一属食草动物伤害的不同反应。他们表明,PI活性是由蜘蛛螨诱导的荨麻疹叶螨,但被t . evansi[11.]。有趣的是,鳞翅目和鞘翅目食草动物对番茄的取食危害与我们对黑杨木的研究结果相反。这里,烟草角虫对基因表达和胰蛋白酶抑制活性的诱导作用强于科罗拉多马铃薯甲虫[10.]。
差异PnKTI甲虫之间的表达式(Phratora Vulgatissima)还有卡特彼勒(舞毒蛾和莫加多伦西亚)的食草性可能是基于这些昆虫造成的不同损害模式,尽管这三种昆虫都是咀嚼树叶,并清除了相同的总叶子面积。当毛毛虫清除大块的树叶时,甲虫会在树叶上造成微小但大量的损伤(图。1). 黑杨的另一个重要的抗草食性防御特性是挥发物的释放[31.]。其他因素,如损害的持续时间或植物上沉积的化合物也可能是重要的。当用机械毛虫对利马豆进行人工损伤时,损伤持续时间和损伤区域的变化会影响挥发物的排放[34.]。此外,唾液中的物种特异性化合物可以触发不同的防御反应或在此报告的响应的幅度。在另一种杨树物种中证明了昆虫衍生的诱导对PI诱导的重要性,其中来自森林帐篷毛毛虫的机械伤害和同时施用口腔分泌物抑制了PIS的诱导[39.]. 本研究中使用的昆虫的口腔分泌物也可能表现出抑制作用,可能对PI诱导有不同的效果。无论是食草动物宿主范围,比较通才等L. DISPAR.和答:mogadorensis与专家如P.Vulgatissima.,在pi的归纳中起什么作用,尚不清楚。专家通常对宿主的特定化学防御具有较高的耐受性,例如黑杨树中的水杨素[3.]。因此,对专业食草动物的防御等防御的增加可能是一种更有效的方法来防御这些昆虫。需要使用更多草食物的研究或更彼此密切相关并引起类似的饲养模式的一般研究,以确定食草动物宿主范围是否影响PI诱导。
是否草食动物特异性诱导模式PnKTIS有生态相关性是另一个开放的问题。在这种情况下发挥重要作用的一个因素是“效果特异性”[20.]. PIs对不同的食草动物具有不同的防御效果,这可以从五种不同的食草动物在添加PI的日粮中的表现看出[8.]. 同样,棉铃虫对不同种类的蛋白酶抑制剂表现出不同的偏好和表现[25.]。这可以通过PIS一方面在其抑制不同蛋白酶的能力中变化的事实中解释,即胰蛋白酶,胰凝乳蛋白酶和弹性蛋白酶[29.另一方面,昆虫在其肠道蛋白酶活动中变化[8.那20.]。另外,肠道pH值基本上不同于鳞翅目和鞘翅目之间的[20.]也影响PIs的抑制活性[49]。因此,研究黑杨树个体KTIs对不同食虫动物的作用是很有意义的,例如利用转基因树或膳食中补充重组KTIs。对食草动物的“反应特异性”被认为比对所有食草动物的类似反应更具成本效益[20.]. 记住,健身成本与PIs的生物合成有关[18.,植物可能旨在诱导一个食草动物最敏感的pi子集。在这种情况下,PI活性不能独立于其他植物防御化合物进行评价。在烟草中,pi与化学防御化合物尼古丁具有协同作用,当食草动物不得不通过增加摄食活动来弥补营养不足时,尼古丁的毒性会更大[45]。黑杨杨含有叫做枸霉素的有毒防御化合物,这些化合物已被证明对食草性能和生存产生负面影响[4.那5.]。因此,今后的研究应进一步探讨水杨类化合物和pi这两种直接防御的主要成分之间可能的协同效应。
结论
我们的主要结论是黑杨叶片中的PI诱导取决于饲养食草动物的身份,甲虫诱导比毛虫更强的反应。此外,PI活性在转录水平和最有可能以阈值的方式调节。然而,所观察到的模式的大多数分子机制以及它们的生态后果仍然待阐明。
数据和材料的可用性
短读数据已在EBI短读取档案(SRA)中存放,具有以下样本登录号:ERS5844847-ers5844862。还可以使用以下URL直接访问完整的研究:http://www.ebi.ac.uk/ena/data/view/prjeb43369..
缩写
- 凯蒂:
-
Kunitz型胰蛋白酶抑制剂
- 存在:
-
实时定量PCR
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- PI:
-
蛋白酶抑制剂
- 汉普斯:
-
食草动物相关的分子模式
- 阻尼:
-
有关分子模式
- ORF:
-
开放阅读框
- 聚合酶链反应:
-
聚合酶链反应
- 曼诺娃:
-
多元方差分析
参考文献
- 1。
Agrawal AA,Hastings AP,Patrick ET,Knight AC.五种密切相关的乳草中食草动物诱导的激素信号和防御特性的特异性(蛔虫属.). 化学经济杂志。2014;40(7):717–29.https://doi.org/10.1007/s10886-014-0449-6.
- 2。
Arnaiz A、Talavera Mateo L、Gonzalez Melendi P、Martinez M、Diaz I、Santamaria M。拟南芥库尼茨胰蛋白酶抑制剂对蜘蛛螨的防御。植物科学与技术,2018;https://doi.org/10.3389/fpls.2018.00986.
- 3.
Boeckler Ga,Gershenzon J,Unsicker SB。Salicaceae的酚糖苷及其作为抗病性防御的作用。植物化学。2011; 72(13):1497-509。https://doi.org/10.1016/j.phytochem.2011.01.038.
- 4.
Boeckler Ga,Paetz C,Feibicke P,Gershenzon J,Unsicker SB。通用食草动物的杨树水杨酸的新陈代谢舞毒蛾(鳞翅目)。昆虫生物化学分子生物学。2016;78:39–49.https://doi.org/10.1016/j.ibmb.2016.08.001.
- 5.
Boeckler GA,Towns M,Unsicker SB,Mellway RD,Yip L,Hilke I等。杨树中缩合单宁途径的转基因上调导致两树食性鳞翅目植物叶片适口性的显著变化。化学经济杂志。2014;40(2):150–8.https://doi.org/10.1007/s10886-014-0383-7.
- 6.
Botelho-Júnior S, Machado OL, Fernandes KV, Lemos FJ, Perdizio VA, Oliveira AE等。非基因组模型物种的防御反应:茉莉酸甲酯暴露揭示了西番莲叶片组装功能多样化的库尼茨型胰蛋白酶抑制剂的能力,并招募其中两种来对抗木瓜蛋白酶。足底。2014;240(2):345 - 56。https://doi.org/10.1007/s00425-014-2085-3.
- 7.
Bradshaw HD,Hollick JB,Parsons TJ,Clarke HR,Gordon MP。杨树树中的系统伤口响应基因编码类似于红薯孢子和豆科植物胰蛋白酶抑制剂的蛋白质。植物mol biol。1990; 14(1):51-9。https://doi.org/10.1007/BF00015654..
- 8.
百老汇RM。昆虫对植物蛋白酶抑制剂有抗药性吗?昆虫生理学杂志,1995;41(2):107-16。https://doi.org/10.1016/0022-1910电话:(94)00101-L.
- 9.
Christopher ME,Miranda M,Major IT,Constabel CP.杂交杨树系统创伤诱导防御的基因表达谱。足底。2004;219(6):936–47.https://doi.org/10.1007/s00425-004-1297-3.
- 10。
Chung Sh,Felton GW。“番茄对专业鳞翅目植物和鞘翅目物种的抗性抗性的特异性。”J Chem Ecol。2011; 37(4):378-86。
- 11.
通过诱导和抑制植食性动物的表现和植物在连续攻击后的防御。昆虫科学。2019;26(1):108 - 18。https://doi.org/10.1111/1744-7917.12499.
- 12.
Eberl F,Perreca E,Vogel H,Wright LP,Hammerbacher A,VEIT D等人。黑杨树木的锈病感染减少光合作用,但不影响异戊二烯生物合成或排放。前植物SCI。2018; 9:1733。https://doi.org/10.3389/fpls.2018.01733.
- 13。
梅尔道,霍威。植物激素在昆虫特异性植物反应中的作用。植物生态学报,2012;https://doi.org/10.1016/j.tplants.2012.01.003.
- 14。
Fabisch T、Gershenzon J、Unsicker SB。木本植物黑杨草食性防御反应的特异性(Populus nigra.).J Chem Ecol。2019; 45(2):162-77。https://doi.org/10.1007/s10886-019-01050-y.
- 15
关键词:植物防御,昆虫,草食动物abstract:中国生物医学工程学报,2013;https://doi.org/10.3390/ijms140510242.
- 16
Garcia Va,Freire MDGM,Novello JC,Marangoni S,Macedo MLR。胰蛋白酶抑制剂Poecilanthe parviflora种子:对害虫蛋白酶的纯化,表征和活性。蛋白质J. 2004; 23(5):343-50。https://doi.org/10.1023/b :jopc.0000032654.67733.d5..
- 17
门卫室AM,博尔特D。豇豆胰蛋白酶抑制剂抗代谢作用的研究(Vigna Unguiculata.)和其他豆科植物对布鲁氏菌甲虫发育的影响callosobruchus maculatus.. 食品农业科学杂志。1983;34(4):345–50.https://doi.org/10.1002/JSFA.2740340405..
- 18
格拉威GA,扎瓦拉JA,凯斯勒A,范达姆NM,鲍德温IT。我国胰蛋白酶抑制剂生产的生态成本与效益尼古利亚娜attenuata..生态。2003; 84(1):79-90。https://doi.org/10.1890/0012-9658(2003)084[0079:ECABCW]2.0.CO;2..
- 19.
未加热豆粕提取物中的蛋白水解抑制物质。中国生物医学工程学报。https://doi.org/10.1016/s0021-9258(18)71934-0.
- 20.
Haq SK, Atif SM, Khan RH。抗虫、害虫和病原体的蛋白蛋白酶抑制剂基因:自然和工程植物保护。生物化学与生物物理学报,2004;https://doi.org/10.1016/j.abb2004.07.022.
- 21。
海茨T、杰弗里P、弗里蒂格B、罗格朗M。PR-6家族:植物-微生物和植物-昆虫相互作用中的蛋白酶抑制剂。地址:Datta SK,S。穆图克里希南S(编辑);植物致病相关蛋白。博卡拉顿:华润出版社;1999年。131–55.
- 22。
贾马尔F、潘迪PK、辛格D、艾哈迈德W。库尼茨型丝氨酸蛋白酶抑制剂紫矿种子及其对西瓜发育生理的影响Helicoverpa armigera.流程生物化学。2015; 50(2):311-6。https://doi.org/10.1016/j.procbio.2014.12.003.
- 23。
卡班,鲍德温。对草食动物的诱导反应:芝加哥大学出版社;2007
- 24。
库尼茨M。大豆胰蛋白酶抑制剂的结晶。科学。1945;101(2635):668–9.https://doi.org/10.1126/science.101.2635.668.
- 25。
Kuwar SS, Pauchet Y, Heckel DG。类特异性蛋白酶抑制剂、合成蛋白酶抑制剂和天然蛋白酶抑制剂对棉铃虫生活史性状的影响Helicoverpa armigera.拱形昆虫生物学理发学。2020; 103:E21647。
- 26。
Lee Si,Lee S-H,Koo Jc,Chun Hj,Lim Co,Mun Jh等人。大豆Kunitz胰蛋白酶抑制剂(SKTI)赋予棕色Planthopper的抗性(摘要研究选择性转基因水稻中的Stål)。摩尔品种。1999;5(1):1–9.https://doi.org/10.1023/A:1009660712382.
- 27
马勇、赵Q、陆明志、王杰。胰腺癌Kunitz型胰蛋白酶抑制剂基因家族拟南芥和杨树trichocarpa以及其对伤害和食草动物的表达反应Populus nigra..树遗传学基因组织。2011; 7(2):431-41。https://doi.org/10.1007/s11295-010-0345-3.
- 28
主要IT,Constabel CP。杨树防治对食草病的分子分析:伤口和昆虫引发诱导基因表达的比较。新植物。2006; 172(4):617-35。https://doi.org/10.1111/j.1469-8137.2006.01877.x.
- 29
杨树中Kunitz胰蛋白酶抑制剂家族的功能分析揭示了其对草食动物防御的生化多样性和多样性。植物杂志。2008;146(3):888 - 903。https://doi.org/10.1104/pp.107.106229.
- 30.
Marchetti S、Delledonne M、Fogher C、Chiaba C、Chiesa F、Savazzini F等。大豆Kunitz、C-II和PI-IV抑制剂基因赋予烟草和马铃薯转基因植物不同水平的抗虫性。理论应用基因。2000;101(4):519–26.https://doi.org/10.1007/s001220051511.
- 31.
acta botanica botanica(云南植物研究中心),云南植物研究中心,云南植物研究中心(云南植物研究中心),KöllnerPopulus nigra.)而年龄和身份的影响影响个体挥发物的价值作为提示草食性天敌。BMC植物生物学。2014;14(1):304.https://doi.org/10.1186/s12870-014-0304-5.
- 32.
MEROPS数据库,Rawlings, Barrett AJ, Thomas PD, Huang X, Bateman A, et al。2017年的MEROPS蛋白水解酶、底物和抑制剂数据库,以及与PANTHER数据库中的肽酶的比较。核酸2017;46:D624-32https://www.ebi.ac.uk/merops/.
- 33.
Mithöfer植物相关分子模式的识别。植物杂志。2008;146(3):825 - 31所示。https://doi.org/10.1104/pp.107.113118.
- 34。
MithöferA,Wanner G,Boland W.喂养的影响斜纹夜蛾在利马豆叶上。2像昆虫取食一样的连续机械伤害足以引起与食草有关的挥发性物质的排放。植物杂志。2005;137(3):1160 - 8。https://doi.org/10.1104/pp.104.054460.
- 35。
Moreira X、Lundborg L、Zas R、Carrillo Gavilán A、Borg Karlson A-K、Sampedro L。松树上两种食草昆虫对化学防御的诱导能力与目标植物组织、特定的食草动物和防御特性有关。植物化学。2013;94:113–22.https://doi.org/10.1016/j.phytochem.2013.05.008.
- 36。
Negreiros Anm,Carvalho MM,Xavier Filho J,Blanco-Labra A,Shewry Pr,Richardson M.来自种子的主要Kunitz胰蛋白酶抑制剂的完整氨基酸序列Prosopsis juliflora.植物化学。1991; 30(9):2829-33。https://doi.org/10.1016/S0031-9422(00)98207-4.
- 37。
Neiman M,Olson MS,Tiffin P.杨树蛋白酶抑制剂的选择性历史:多态性升高,净化选择和近期复制的阳性选择驱动分歧。新植物。2009; 183(3):740-50。https://doi.org/10.1111/j.1469-8137.2009.02936.x..
- 38。
一种具有凝集素样结构域的伦巴第杨树受体样蛋白激酶的研究中国生物医学工程学报,2002;https://doi.org/10.1007/s00438-002-0683-4.
- 39
杨树库尼茨型蛋白酶抑制剂家族的基因组分析、全长cDNA克隆、转录组和蛋白分析。新植醇。2009;184(4):865 - 84。https://doi.org/10.1111/j.1469-8137.2009.03028.x.
- 40。
Rakwal R、Agrawal GK、Jwa N-S。水稻的特性(水稻l .)Bowman-Birk蛋白酶抑制剂:严格光调控诱导反应切,茉莉酸,乙烯和蛋白磷酸酶2A抑制剂。基因。2001;263(2):189 - 98。https://doi.org/10.1016/S0378-1119(00)00573-4.
- 41。
拉米雷斯·卡瓦加,莫尔斯·阿姆,戴维斯·吉咪。杨树细胞分裂素反应调节基因家族的转录谱表明其在植物发育中具有不同的作用。新植物醇。2008;177(1):77–89.https://doi.org/10.1111/j.1469-8137.2007.02240.x.
- 42。
Renko M,SabotičJ,TurkD.β-三叶草抑制剂 - 从Kunitz的工作向前。Biol Chem。2012; 393(10):1043-54。https://doi.org/10.1515/hsz-2012-0159.
- 43.
Romero B,Dillon FM,Zavala Ja。不同的大豆品种以食草质的方式差异差异,降低食草动物性能。节肢动物植物互动。2020; 14(1):89-99。https://doi.org/10.1007/s11829-019-09730-y.
- 44.
Rubert-Nason KF,Couture JJ,Major It,Constabel CP,Lindrooth RL。基因型,环境和吉普赛蛾草食物对颤抖的白杨中局部和全身化学防御的影响(美洲山杨). 化学经济杂志。2015;41(7):651–61.https://doi.org/10.1007/S10600-Z..
- 45.
Steppuhn A,鲍德温。本地植物的抗性管理:尼古丁阻止食草动物补偿植物蛋白酶抑制剂。Ecol Lett公司。2007;10(6):499–511.https://doi.org/10.1111/j.1461-0248.2007.01045.x.
- 46。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析6.0版。中国生物医学工程学报。2013;30(12):2725-9。https://doi.org/10.1093/molbev/mst197.
- 47。
Unsicker SB, Gershenzon J, Köllner TG。甲虫取食对黑杨树叶片挥发性物质排放的影响与毛虫取食不同。植物信号处理技术。2015;10(3):e987522。https://doi.org/10.4161/15592324.2014.987522.
- 48。
Van Zandt Pa,Agrawal AA。诱导植物对普通乳草的专家食草动物的特异性Asclepias Syriaca.Oikos。2004;104(2):401 - 9。https://doi.org/10.1111/j.0030-1299.2004.12964.x.
- 49。
沃尔夫森JL,Murdock LL。昆虫中消化蛋白酶活性的多样性。J Chem Ecol。1990; 16(4):1089-102。https://doi.org/10.1007/BF01021013.
致谢
感谢Almuth Hammerbacher和Chhana Ullah在转录组实验中的帮助,感谢Bettina Raguschke在质粒测序中的帮助,感谢Beate Rothe在样本分析中的帮助。
资金
这项研究由马克斯·普朗克学会资助。Thomas Fabisch是由Gerhard and Ellen Zeidler Stiftung资助的。资助机构为研究项目提供了资金支持,但不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。由Projekt DEAL支持和组织的开放获取资金。
作者信息
从属关系
贡献
FE,TF,JG,TGK,SBU构思了该项目;TF进行了生物实验和叶样品收集;Fe分析了基因表达;KL和Fe克隆并测序所有候选基因;TGK创造了系统发育树;HV组装并分析转录组;fe写了稿件;所有作者审查和评论了稿件。作者阅读并批准了最终手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充资料
附加文件1:表S1
.在杨树中喂养三种草本病毒和胰蛋白酶抑制活性的伤害。表S2.用于克隆和qRT-PCR的引物序列。表S3.Contigs的差异表达作为蛋白酶抑制剂在黑色杨叶片转录组中的蛋白酶抑制剂。表S4.本研究及其他研究中KTI同源物的命名。表S5. 个体qRT-PCR分析的定量周期克蒂基因。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Eberl,F.,Fabisch,T.,Luck,K。等。杨树蛋白酶抑制剂表达以食草质特异性方式不同。BMC植物生物学21,170 (2021). https://doi.org/10.1186/s12870-021-02936-4
收到了:
公认:
发表:
关键词
- Kunitz-type胰蛋白酶抑制剂;食草动物特异性;木本植物;树的防御
- 鳞翅目
- 鞘翅目
- salicaceae.
- 诱导防御
- 蛋白酶抑制剂