抽象的
背景
Shedding过早甜樱桃(李属鸟结核l)果实具有显着影响的生产,这反过来又对经济效益产生了相应的影响。
结果
为了更好地了解甜樱桃果实脱落的分子机制,从授粉树上观察到花粉活力和结构。随后,研究了脱落果实的形态特征,滴灌癌的植物激素滴度,胚胎癌的转录组以及HD-ZIP基因家族进行了研究。这些发现表明,在结构中,产生重度果实脱落的花粉畸形,其活力低于平均水平。苦味的果实和叉状物的特征在于红颜色,中间胚胎胚胎中止,其高度归因于低花粉活力和畸形。转录组分析显示6462显着表达,其中2456个基因上调,4006个下调在脓肿癌中。在这些基因中,蟾蜍蛋白生物合成和信号转导基因(α-TRP.那AUX1, 1-氨基环丙烷-1-羧酸氧化酶基因(华)对乙烯合成的影响,在脱落果柄中上调。关于细胞壁重塑相关基因(厘米/秒那朋友那PG实验那xth.),在癌脱落中调高,反映了调节脱落过程的关键作用。转录组分析结果显着符合先前记录的蛋白质组分析的分析。与保留果实的那些相比,嗜鼻癌中的植物蛋白含量显着低,这可能会增加脱落区的乙烯敏感性,相反,散发性酸癌的积极酸(ABA)积累大大较高。此外,(TZ + IAA + GA3)/ ABA的比例在脓肿癌中也明显降低。此外,HD-ZIP基因家族分析表明Pavhb16.和Pavhb18.在嗜睡器官中令人上调。
结论
我们的发现结合了形态学、细胞学和转录调控来揭示甜樱桃果实脱落的分子机制。为进一步研究植物器官脱落提供了新的视角。
背景
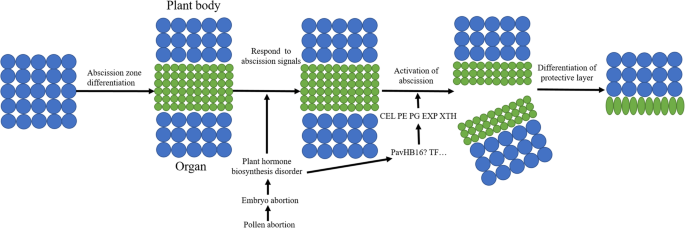
脱落是一种高度编程的机制,其中植物去除衰老,受伤,感染或可分配的器官,例如叶子,花瓣,萼片和水果[1].该过程涉及细胞分离,该细胞分离发生在叶柄和花梗中的专用细胞中,其被称为脱落区(AZ)[2].AZ由几层小细胞组成,这些小细胞与周围细胞不同,以及最初为器官分离开发的这些细胞[3.].早期的研究表明,一些疯子箱基因一直与AZ的分化有关,包括joint那MACROCAYLYX,高级副总裁[4.那5.]. 在AZ分化完成后,AZ细胞倾向于对脱落信号作出反应[2].在现场条件下,AZ将器官牢固地将器官连接到植物身体[6.].一旦AZ接受脱落信号,例如生长,环境应力,衰老和不规则施肥,将激活脱落过程[7.].
生理,遗传,分子和生化方法的进步显着增强了过去几十年中对脱落的理解[8.那9.].特别是,对模型植物的深入研究如拟南芥而番茄可以更容易理解植物器官脱落的机制[10那11].众多研究表明,植物激素在植物器官的脱落中发挥着至关重要的作用[12那13].在植物中发生的植物激素在正常情况下处于平衡状态。然而,一些内部或外部原因破坏了均衡,例如干旱,碳水化合物的饥饿,害虫,疾病和异常受精,并且这种发生已成为植物器官脱落的信号[7.].在这些植物激素中,乙烯(Eth)和脱落酸(ABA)在脱落中发挥积极作用[14].相比之下,生长素(IAA),细胞蛋白(CTK)嗜酸甘油蛋白(GA)和多胺(PAS)在脱落过程中发挥负面作用[7.].通常,乙烯和生长素之间的平衡在脱落过程中起着至关重要的作用[1].此外,缺乏碳水化合物也可以有助于植物官的脱落[7.那15].因此,合成这些植物激素和信号转导途径的基因也在植物器官脱落机制中发挥着关键作用[16那17].
植物的细胞壁由纤维素、半纤维素、果胶、木质素和结构蛋白组成[18]. 诱导后,这些细胞分泌细胞壁修饰酶和水解酶,使细胞壁疏松并降解相邻细胞之间的中间板层[2].研究表明,一些细胞壁水解酶和辅助蛋白可以损害植物细胞壁的结构,最终导致植物器官的脱落[19那20.那21.].这些水解酶包括纤维素酶(CEL),多肢乳糖酶(PGS),果胶甲基酯酶(PEMS)和果胶酶(PL)。此外,一些研究表明,水解对于由其他酶(Exps)等其他酶协调的细胞膨胀,以及木糖葡聚糖内凝血糖基酶/水解酶(xths)[21.]. 在细胞壁降解和植物器官脱落后,形成一个保护层可以减少水分流失,并形成一个物理屏障,防止病原菌的机会性攻击[22.].为了支持在AZ中形成保护层的解剖发现,已经有研究表明,AZ中与胁迫相关的过氧化物酶活性增加,这被认为在AZ的木质素化过程中发挥了作用[23.].
在多年的研究基础上,建立了植物器官脱落的调控模型[24.].脱落是一个有组织、有规律的发育过程,包括四个可识别的步骤:(1)AZ的分化;(2)获取响应脱落信号的能力;(3)植物器官脱落的激活;(4)脱落后保护层的分化。第一步,joint与MADS-BOX基因互动MACROCALYX调节花梗脱落带的发育[5.].这LeACO在下一步将增强乙烯的生物合成,这可能是刺激脱落区域的信号[16那25.].第三步,当植物器官感知脱落信号时,部分基因在AZ中特异表达,激活器官的脱落。例如,ATDOF4.7可以通过直接与启动子联系起来作为阳性调节剂ADPG2[10].另一个,呢LcHB2可以通过直接激活作为果实脱落的正稳压器lccel2.和LCCEL8.在荔枝中,纤维素酶活性增加。结果,减少了纤维素含量,并且通过脱落区中的细胞壁的劣化和细胞分离的劣化来最终诱导果实脱落[26.].在最后一步,保护层的分化涉及程序性细胞死亡(PCD),这涉及到核酸酶和活性氧(ROS)的诱导[27.].
甜樱桃(李属鸟结核L.)是含有各种糖(葡萄糖,果糖,蔗糖和山梨糖醇),膳食纤维和褪黑激素的最普遍的水果之一28.],它也富含褪黑激素和膳食纤维,简单的糖,甜樱桃还含有各种维生素,矿物主要是钾,酚类化合物(黄酮类化合物和花青素)。此外,吃甜樱桃可以降低癌症和关节疼痛的风险,以及预防神经变性疾病[29.].由于甜樱桃的生产营养价值,在中国、美国、日本、智利等国家被广泛种植。然而,果实脱落严重影响了产量和经济效益。因此,努力揭示甜樱桃果实脱落的分子机制,有助于尝试培育高产品种。
在本研究中,分析了花粉活力,转录组,植物激素含量和甜樱桃中的HD-ZIP基因家族。(1)本研究发现,“溪流”的花粉活力较低,花粉电子显微镜的结构变形;(2)植物激素信号的转导与细胞壁修饰连接的植物壁修饰中的基因显着上调;(3)Pavhb16,细胞壁重塑蛋白,以及植物激素生物合成和信号转导在转录组和蛋白质组之间进行调节。(4)Pavhb16.和Pavhb18.在脓肿器官(花,果实,叉霉,叶子和叶柄)上调节。这些结果有助于我们了解甜樱桃果实脱落的转录监管机制。
结果
主要授粉树的花粉活力
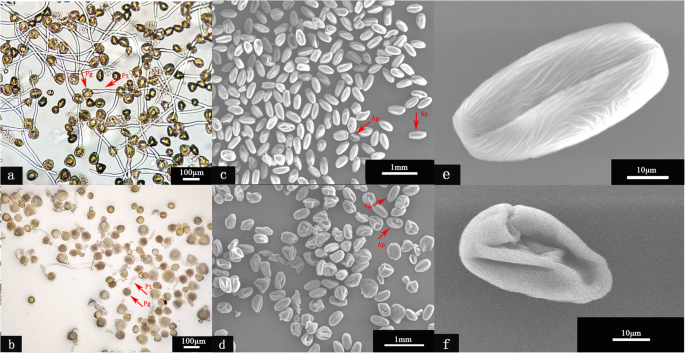
结果表明,“Qianyynt 1”的花粉萌发率占66.3%(图。1a),虽然'Brooks'的花粉仅占13.5%(图。1b).根据花粉的形态特征,可分为正常花粉(图。1e)和畸形花粉(图。1f) 是的。据统计,“千营一号”畸形率为13.33%(图1)。1c),而在“布鲁克斯”中占88.81%(图。1d)(附加文件1:表S1)。这些结果表明花粉活性可能与花粉形态有很大的相关性。换句话说,花粉活力越高,花粉畸形率越低。而这种“布鲁克斯授粉树的较低的花粉活力会导致胚胎流产,这是甜樱桃果实脱落的理由。
脱落果实的形态和解剖结构
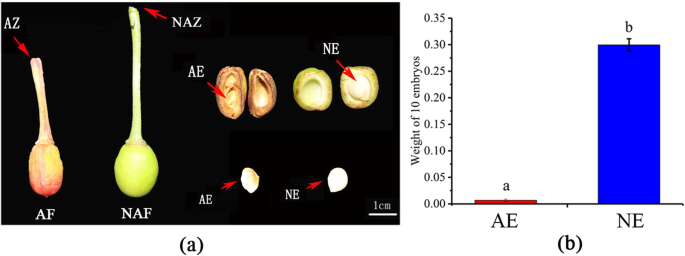
脱落果实和叉霉的形态结构是红色的,胚胎基于结果形态特性观察结果干燥。相比之下,水果和叉霉的保留是绿色的,胚胎饱和(图。2一种)。另外,十个脓肿胚胎(0.0068g)的重量显着低于非脓肿胚胎(0.3000g)(图。2b)。这些结果表明,脱落果实的胚胎中止,这可以引发激素不平衡并导致水果过早脱落。这些发现表明,甜樱桃果实和胚胎流产之间存在出色的相关性。
脓肿与非脓肿患者之间的内源激素分析
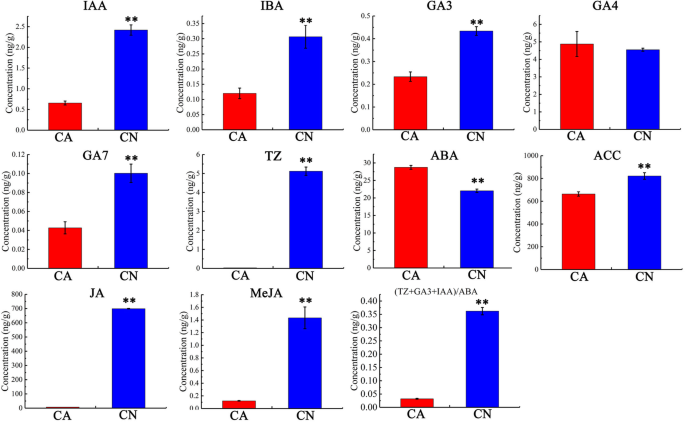
为进一步研究甜樱桃果实生理脱落的激素调控,内源生长素(IAA)和吲哚-3-乙酸(IBA),赤霉素(GA3、GA4、GA7),细胞分裂素(GA3、GA4、GA7)在生理脱落前的果实发育阶段,对脱落果柄与非脱落果柄之间的反式玉米素(TZ)、脱落酸(ABA)、1-氨基环丙烷-1-羧酸(ACC)、茉莉酸(JA)和茉莉酸甲酯(MeJA)进行了分析。生长素(IAA, IBA)在脱落果柄中的分布较非脱落果柄低。在3种气体中,GA4在离体果柄和非离体果柄中含量相近,而GA3和GA7在离体果柄中含量显著降低。细胞分裂素(TZ)水平在脱落果柄中明显降低。而脱落酸水平在离体果柄中显著升高。在脱落果柄中,1-氨基环丙烷-1-羧酸(ACC)、茉莉酸(JA)和茉莉酸甲酯(MeJA)水平显著下降。为全面观察植物激素平衡,计算(TZ + IAA + GA3) / ABA的比值,结果表明,抽离果柄中(TZ + IAA + GA3) / ABA的比值显著低于非抽离果柄(图4)。3.额外的文件2:表S1)。这些发现表明,减少的养肝蛋白可以增加乙烯脱落区反应的敏感性,并且ABA的增加的含量也将加快甜樱桃果实的脱落。然而,在疾病的癌中,GA3和CTK的含量与抑制甜樱桃果实脱落有关。对于甜樱桃果实的推测可能是所有这些荷尔蒙的变化,尽管主要原因可能是养羊酸下降。
转录组分析和鉴定差异表达基因(DEGS)
使用RNA-SEQ分析噬毒乳癌和非脓肿疱疹的转录om,以获得用于甜樱桃果实脱落的详细和有效的转录组数据。在RNA-SEQ分析之前,构建了六个cDNA文库并使用Illumina Hiseq 4000平台读取的成对末端序列。通过基因表达综合(GEO)(接入号:PRJNA636209),已经在NCBI序列读取归档(SRA)中沉积了原始数据。产生了30.7亿令吉的总和,每个样品都提供了5133万的平均产量。从每个文库中获得50.54百万个清洁读数的平均读取比率,在去除适配器序列,含N型读数和低质量后,具有98.48%的足够读数。(附加文件3.:表S3)。参考基因组完全匹配每个库的平均映射比率为89.87%,约为45.41亿次清洁读数。确定每三个样品之间的所有基因表达水平的Pearson相关系数,研究样品之间的基因表达相关性。(附加文件4.:图S1)。
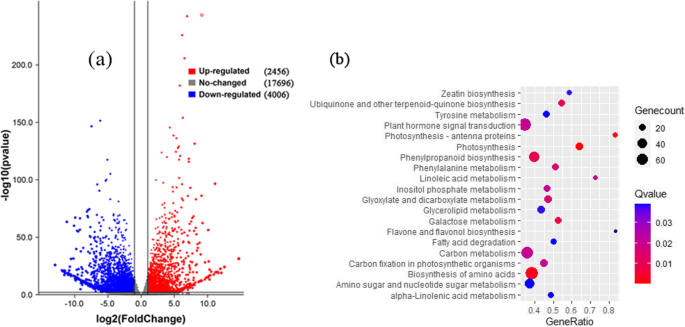
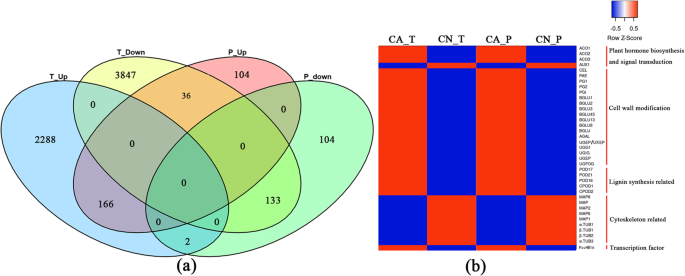
所有样品都映射了总共43,673个基因。分析脓肿和非脓肿癌基因表达水平,并认识到6462个差异表达基因(DEGS)。(附加文件5.:表S4)。其中,脱落果柄上调2456个,下调4006个。(无花果。4.a).下调的DEGs数量高于上调的DEGs数量;值得指出的是,一些与植物细胞壁重塑相关的基因已被显著上调。这可能是调节甜樱桃果实脱落最直接的因素。
患者脱落期间的富集分析
进行KEGG通路分析;根据富集结果,非果柄离体的前20条途径如图所示。4.b和附加文件6.:表S5。在这些途径中,涉及植物激素信号转导和半乳糖代谢,可能调控甜樱桃果实的脱落。此外,生长素和乙烯合成的相关途径也得到了丰富6.:表S5)。另外,还增加了与细胞壁改性相关的一些途径。这些结果表明,植物激素生物合成和信号转导,以及细胞壁改性在水果脱落调节中起着至关重要的作用。这些发现与先前的途径研究一致[30.那31.].此外,氨基酸的生物合成、碳代谢、苯丙素的生物合成等途径也被发现是富集的。
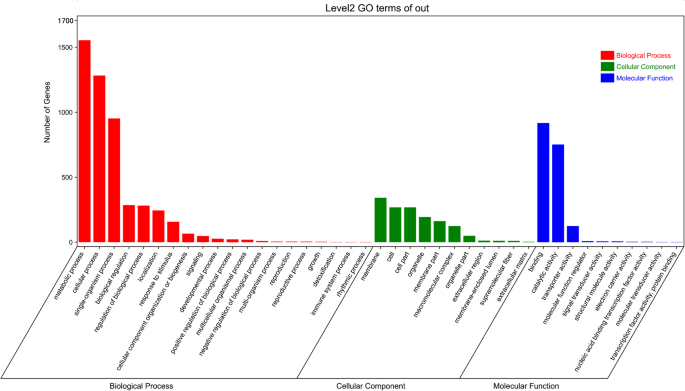
基因本体论(GO)分类结果表明,脱落果柄与非脱落果柄之间的基因差异有2596个,可分为3个品种:生物过程(BP)、细胞成分(CC)和分子功能(MF)7.:表S6)。在BP类别中,代谢过程和蜂窝过程是最丰富的术语。对于CC品种,膜,细胞和细胞部件是主要术语。MF的前三个术语是结合,催化活性和转运蛋白活性(图。5.).
植物激素生物合成和信号转导
Kegg浓缩分析显示“植物激素信号转导”是一个重要的途径。在植物素信号转导途径中,显着下调的基因包括养羊蛋白流入载体(AUX1),助长/吲哚-3-乙酸(AUX / IAA),毒素响应因子(ARF),以及小型胃苷(Saur). 在the cytokinin signal transduction pathway, the cytokinin receptor CRE1 was down-regulated. However, in the ABA signal transduction pathway, the PP2C and SnRK2 were up-regulated in abscising carpopodium. Simultaneously, in the ethylene signal transduction pathway, the ethylene insensitive 3 (EIN3) and ethylene response factor (ERF) were up-regulated which may improve the fruitlet abscission. Also, some essential genes are differentially expressed in the plant hormone synthesis pathways. These genes include the tryptophan synthase alpha chain (α-Trp), which is related to auxin biosynthesis. Additionally, the 1-aminocyclopropane-1-carboxylate synthase and 1-aminocyclopropane-1-carboxylate oxidase (ACO) were up-regulated in abscising carpopodium.
细胞壁重塑相关基因
细胞壁倒回是细胞对调节脱落的方法之一。我们的RNA-SEQ分析噬菌体和非脓肿的分析显示细胞壁重塑基因表达的双向变化。这种现象不仅可以与持续的脱落过程相关联,而且还与未删除的器官的逐步发展(附加文件8.:表S7)。在这些细胞壁重塑相关的次数中,存在4个纤维素酶(CELS),7个多肢乳糖酶(PGS),5个果胶酶(PE),7个过氧化物酶(PODS),2β-半乳糖苷酶(BGALS),5个eAllacins(Exps),和上调5 Xyloglucan内甘油糖苷基酶/水解酶(xth),其可以调节细胞壁重塑。这些结果表明,细胞壁重塑相关基因在果实脱落期间发挥着至关重要的作用。无论这些细胞壁改造酶基因的差异表达,细胞壁都被重新渗透,导致细胞壁或中隙的降解,这导致细胞分离和果实脱落。
转录因子
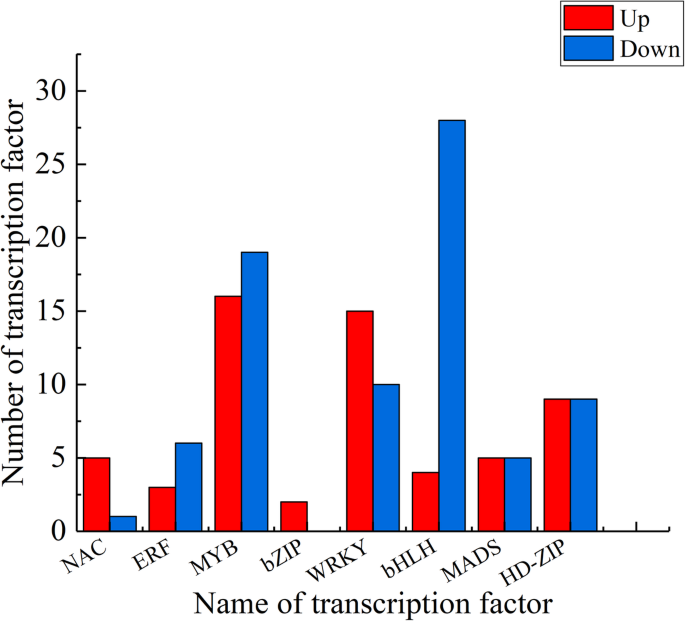
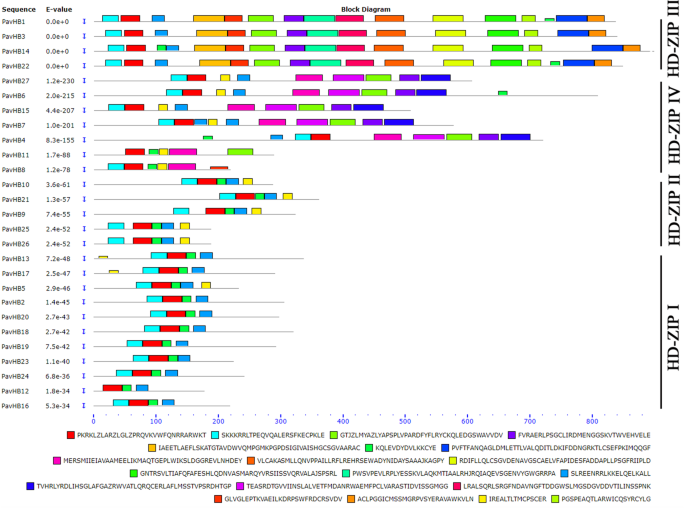
转录调控在导致植物器官脱落的一系列复杂事件中起着关键作用。因此,转录因子在这一过程中也扮演着重要的角色。根据我们的数据,有8种类型的转录因子值得关注,即NAC、ERF、MYB、bZIP、WRKY、bHLH、MADS、HD-ZIP,它们可能调控甜樱桃果实的脱落。在这些转录因子中,差异表达最多的是MYB,其次是WRKY和HD-ZIP。6.).值得注意的是,这三种基因家族的基因可能会调节植物器官脱落的脱落。此外,通过影响与酶基因相关的植物激素生物合成基因和细胞壁改性,已显示HD-ZIP系列在荔枝中诱导脱落。
叉谈叉状体转录组和蛋白质组之间的串扰
该研究进行了联合蛋白质组学和转录组学评估,以更明确地发现甜樱桃果实脱落的主要基因。该研究进行了联合蛋白质组学和转录组学评估,以更明确地发现甜樱桃果实脱落的主要基因。差分累积的蛋白质(隔离)具有1.5倍和差异表达的基因,具有2倍的基因用于合作调查。在转录水平和蛋白质水平之间存在337个基因/蛋白质常见的差异表达。在这些基因中,有166个基因频繁上调和133个基因常见的下调(图。7.a) 是的。在植物激素的生物合成和信号转导途径中,有3个与乙烯生物合成有关的基因1-氨基环丙烷-1-羧酸氧化酶(ACO)在脱落的果皮中被鉴定为上调基因;一个生长素外排载体(AUX1)基因表达下调,可能参与生长素的转运。更重要的是,与植物细胞壁重塑相关的酶,如纤维素、果胶乙酰酯酶和多聚半乳糖醛酸酶被上调。同样,与植物细胞壁木质素生物合成相关的过氧化物酶也被上调。然而,一些与细胞壁合成相关的微管蛋白,包括微管蛋白α链(α-TUB)、微管蛋白β链(β-TUB)和微管相关蛋白(MAPs)呈下降趋势。令人兴奋的是,同源框亮氨酸拉链转录因子(Pavhb16.)在转录和蛋白质水平上上调(图。7.b)。
通过定量实时PCR验证差异表达基因
为了确认从转录组数据获得的基因表达的结果,选择QRT-PCR的15次有关植物器官脱落。这些可参与植物激素生物合成,植物激素信号转导,植物细胞壁改造,可调节甜樱桃果实的脱落。如图所示,15°的基于转录组数据和QRT-PCR结果具有非常相似的表达模式,这表明转录组分析的可信度(附加文件9.:表S8,图。8.).
HD-ZIP基因家族的鉴定与表达谱分析
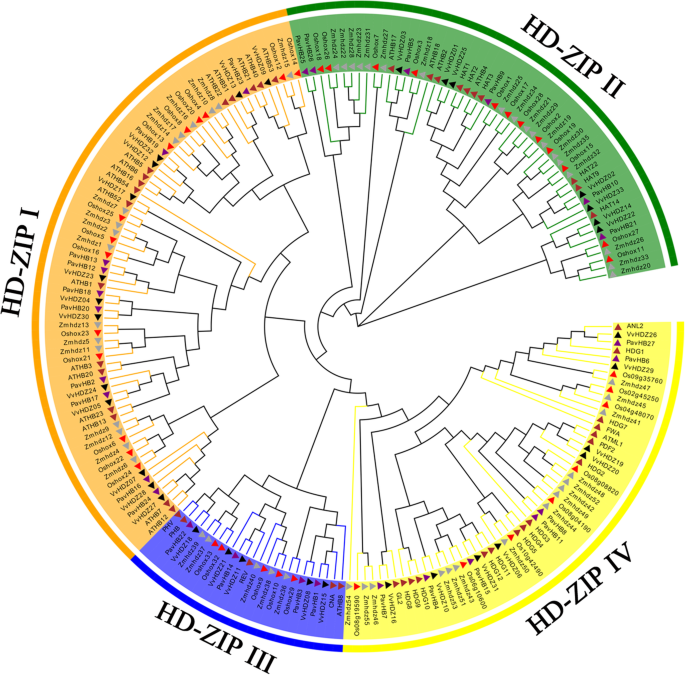
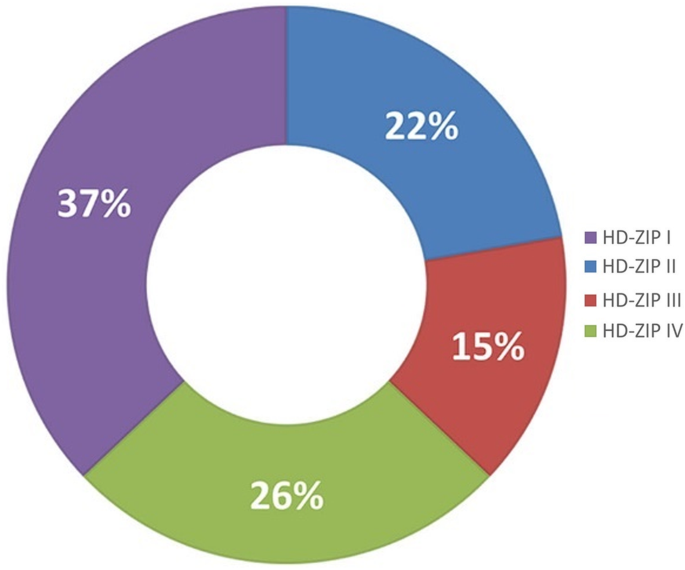
根据以前的研究[26.那32.[HD-ZIP基因家族在植物器官的脱落中起着有影响力的作用。为了探讨高清ZIP与甜樱桃果实脱落的关系,本研究确定了甜樱桃的HD-Zip基因家族。系统发育树在甜樱桃,拟南芥,玉米,葡萄树和水稻中用HD-Zip TFS构建(图。9.).在甜樱桃中计算每个亚族HD-ZIP的比例(图。10).结果表明,甜樱桃HD-Zip TFs被分成四组(I、II、III和IV)。在这个sub-family, HD-Zip我(十个成员),占37%,是最大的一类PavHB TFs,其次是HD-Zip IV和HD-Zip II, 26%(7名成员)和22%(6)成员,分别;最小的是HD-Zip III(4个成员),仅占15%。根据基因结构分析,HD-Zip III和HD-Zip IV比其他两组有更多的基序,HD-Zip III的大部分蛋白质有15或16个基序。此外,相同的亚科具有相似的母题(图。11).在这些高清ZIP中,这很明显Pavhb16.,其在转录组和蛋白质组中上调,属于HD-Zip I子组。
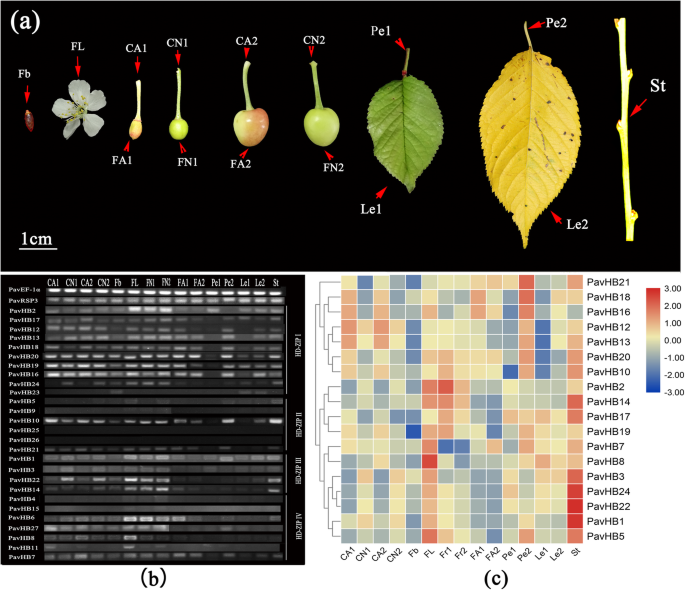
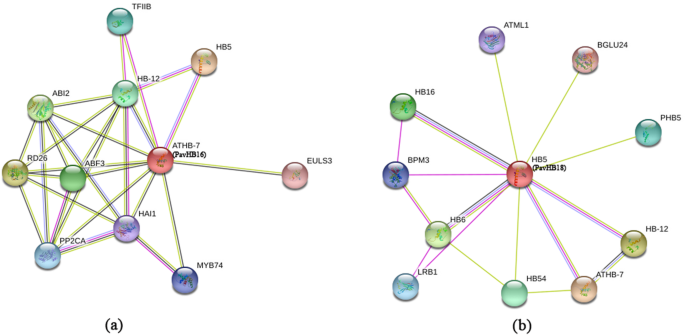
根据HD-ZIP基因家族的生物信息学分析,已经发现了Pavhb16.属于HD-zip i子组,它有四个图案。为了了解调节植物器官脱落的更多基因,在不同的组织中分析了HD-ZIP基因族的表达模式(图。12一种)。该半定量和QRT-PCR数据显示Pavhb16.和Pavhb18.在鲜花中显着上调,脓肿(两种不同的发育阶段),旧叶柄和旧叶子(图。12b) 是的。此外,qRT PCR结果也证明了这一点(图。12C)。这些结果表明Pavhb16.和Pavhb18.可能有助于甜樱桃的植物器官脱落。另外,蛋白质 - 蛋白质相互作用网络结果表明Pavhb16.与脱离酸响应基因相互作用(图。13a),和Pavhb18.与β -葡萄糖苷酶相互作用24(图。13b)。这些结果表明该基因,Pavhb16.和Pavhb18.在甜樱桃器官脱落中起关键作用。
基因表达水平在不同组织中。一种甜樱桃的不同组织;B.不同组织中HD-ZIP基因家族的半定量分析(原始凝胶图像在附加文件中显示)10:图S2);C代表HD-ZIP基因家族表达模式的热图.FB:花蕾;FL:花;CA1:在第一阶段中萎靡的叉霉;CN1:第一阶段的非脱落套件;FA1:第一阶段中散发出果实;FN1:第一阶段的非脓肿生品;CA2:第二阶段的嗜睡症;CN2:第二阶段的非脱落颅内皮;FA2:第二阶段中散发出果实;FN2:第二阶段的非脓肿成果; Pe1: Young leaf petiole; Pe2: Old leaf petiole; Le1: Young leaf; Le2: Old leaf; St: Stem
讨论
在本研究中,我们组合形态,转录组,蛋白质组,植物激素和高清ZIP基因家族分析,揭示甜樱桃果实脱落的分子机制。我们的研究表明,甜樱桃果实的脱落可能与植物激素生物合成和信号转导,细胞壁重塑,细胞骨架和转录因子相关。有趣的是,我们发现了一种可能与甜樱桃花,叶子和果实有关的转录因素。这些结果与先前研究的结果类似[16那26.那30.那33.].从分子水平上了解植物器官的脱落对疏花疏果和机械采摘具有重要意义。
花粉败育导致果实脱落
健康的胚胎发育,使果实激素处于相对稳定的状态,从而促进果实的进一步生长。相反,胚败育往往会导致小果脱落[34.].然而,胚胎的自然发育在很大程度上依赖于成功受精[35.].失败的施肥会导致胚胎流产,这将引发激素不平衡和果实脱落。许多研究发现,内源激素的调节与植物的胚胎发育密切相关[36.].在本研究中,甜樱桃‘Santina’是一个自交不亲和品种。因此,其传粉树“布鲁克斯”的花粉活力在胚胎发育中起着至关重要的作用。结果表明,布鲁克斯的花粉发芽率仅为15.56%。
花粉形态显示大部分花粉发生了变形。这一趋势表明,授粉树花粉不规则可能会影响甜樱桃胚的败育。先前的研究表明,过早的果实掉落是由几个因素造成的,包括缺乏授粉或胚胎退化[37.]. 因此,对于自交不亲和果树,授粉树花粉的正常发育对提高结实率起着重要作用。
植物激素涉及甜樱桃的果实脱落
植物激素的调节效果在整个植物器官脱落过程中对整个植物器官脱落过程具有重要意义,因为它们介导植物器官应对压力[7.].植物激素可能发挥促进或抑制脱落信号的作用,这取决于不同的组织、浓度、内稳态和受体的亲和性、运输或它们之间的相互作用,而且反应是复杂的[38.].几种植物激素,包括乙烯(Eth),脱落酸(ABA),茉莉酸(Ja)和茉莉酸甲酯(Meja),作为脱落加速信号[7.那39.],而生长素、赤霉素(GA)、细胞分裂素(CTK)和多胺被认为是脱落抑制剂[7.那40].由于植物激素参与整个植物发育周期,控制脱落的几个基因也构成生物合成植物激素和信号转导途径的一部分,或影响其代谢[12那41.].虽然许多植物激素的作用仍然不清楚,但已被证明促进毒素/亚乙基平衡和ABA触及脱落[42.].目前,胚癌中的养肝浓度显着低于保留颅骨。
此外,脱落酸的增加可能也参与了果柄脱落的调控。然而,ACC浓度的降低并不反映乙烯浓度的降低。虽然脱落的果柄中ACC浓度较低,但如果1-氨基环丙烷-1-羧酸氧化酶(ACO)含量增加,则会导致乙烯浓度的增加[16].因此,ACO在乙烯生物合成中起着至关重要的作用,转录组结果显示ACO被上调。另外,减少植化素含量可以将脱落区的敏感性增加到乙烯[43.].因此,一旦脱落区生长素含量降低,脱落区对乙烯的敏感性就会提高,即使是少量的乙烯也会引发脱落[44.].因此,脱落区中的植物素含量在调节脱落方面发挥着至关重要的作用。
转录因子调控甜樱桃小果脱落
多种基因调节植物器官的脱落,转录因子也发挥着关键作用[18那25.那27.]. 在番茄花器官的脱落过程中joint,这是疯箱基因家族在脱落区的分化中发挥着重要作用[45.].另外,在荔枝果实脱落过程中,当果实开始脱落或由环切加落叶(GPD)或乙烯(ETH)处理诱导脱落时,LCHB2 / 3.被诱导,然后通过直接结合促进剂加速乙烯和脱离酸的生物合成LcACO2/3那LcACS1/4/7,lcnced3.基因[42.].在目前的研究中,MADS家族的一些转录因子也被显著上调,这可能也在脱落带的分化中发挥了必要的作用。其中最值得注意的是同源盒家族的基因Pavhb16.和Pavhb18.,属于HD-ZIP I子家族,与HD-ZIP关系密切LcHB2在荔枝中[42.].此外,根据序列比对分析,甜樱桃基因的启动子蜜蜂甜樱桃的基因和启动子lccel2.荔枝具有相同的序列(AAATTAAA),可以与之结合使用LcHB2(附加文件11).因此,可以推测HD-ZIP基因家族的基因在甜樱桃的脱落调控中发挥着广泛的作用。
细胞壁改造意识到甜樱桃的果实脱落
细胞壁的重塑伴随着植物器官的脱落,因此与细胞壁重塑有关的基因在促进植物器官的脱落方面尤为重要。发现纤维素酶,果胶酶,多肢乳糖酶,扩张素,木糖葡聚糖中鳞糖苷酶/水解酶和过氧化物酶的基因在柑橘,荔枝和西红柿的脱落循环期间被显着上调[2那45.那46.].另外,在荔枝中,它被证明了lccel2.和LCCEL8.可以通过LcHB2,从而促进荔枝脱落[47.].我们的研究结果发现,与细胞壁重塑有关的几个基因在即将脱落的嗜睡中显着上调。解释为什么这些细胞壁改性酶基因可以与植物器官的脱落有关的是它们编码的每种蛋白质具有枢轴功能。纤维素酶的主要功能是水解纤维素,其是主要的细胞壁成分[48.];果胶酶和多肢乳糖酸酶均参与果胶的水解[49.];木葡聚糖内转糖基化酶/水解酶主要水解细胞壁中的半纤维素,扩张蛋白在果实的成熟和软化过程中起着致命的作用[21.];此外,过氧化物酶在木质素合成中起着关键作用;在对植物器官脱落的研究中,虽然没有发现木质素积累与植物器官脱落的关系,但发现木质素是在其他植物的脱落带产生的[21.].这表明过氧化物酶在促进木质素合成中起重要作用。因此,上调过氧化物酶基因表达可以在植物器官脱落中发挥积极作用。近年来的研究发现,脱落果柄中纤维素酶、果胶酶、聚半乳糖醛酸酶、扩张蛋白、木葡聚糖内转糖化酶/水解酶、过氧化物酶等基因均显著上调。此外,以往的蛋白质组学研究也显示了同样的结果[50.].这些结果表明,细胞壁的重塑可能促进甜樱桃果实脱落。
细胞骨架调节甜樱桃的果实脱落
细胞骨架是细胞的基本组分,在整个细胞开发过程中起着至关重要的作用。此外,果胶转运及其改性蛋白主要通过肌动蛋白细胞骨架进行。因此,肌动蛋白丝组织缺陷会影响细胞粘附的缺陷是不成熟的。肌动蛋白相关的蛋白2/3复合物(ARP2 / 3)高度保守,并且是调节肌动蛋白丝的分支和成核的素数[51.].另外,微管骨架是构成细胞的基本骨架[52.].并且已经研究过,植物器官脱落也与微管的排列有关[44.].在该研究中,一些细胞骨架相关基因,包括α-桶,地图被下调,这可能是调节甜樱桃果实脱落的原因之一。结果意味着阻碍了植物细胞的形成,这反过来导致编程的细胞死亡和植物器官的脱落。此外,本研究组早期的蛋白质组学也表明,在胞衣骨架和甜樱桃果的脱落之间存在密切关系[50.].
结论
植物器官的脱落是由一系列因素引起的。甜樱桃将在过期期间脱落,必须在开发阶段区分脱落区。然而,由于授粉树的畸形花粉,花粉管萌发受到限制,并且无法完成正常的授粉和施肥,从而导致胚胎的流产。胚胎流产引起植物激素的不平衡,例如升高的乙烯生产和减少的养肝生产。降低的植物蛋白含量将使脱落区的敏感性提高到乙烯,从而激活与植物器官脱落的转录因子的表达。转录因子被翻译成蛋白质,然后与基因的启动子结合,这可以降解细胞壁。之后,细胞壁劣化 - 相关基因,例如厘米/秒和第页已启动,从而增加这些细胞壁降解酶的含量。在适当的pH和温度下,这些酶活性升高,因此降解了中间薄片和细胞壁,这使得甜樱桃果下降。值得注意的是,HD-ZIP基因家族的转录因子可能在调节植物器官的脱落方面发挥不可或缺的作用。在未来,Pavhb16.那Pavhb18.等转录因子进行详细研究,进一步揭示甜樱桃果实脱落的分子调控机制(图1)。14).
方法
植物材料
以贵州威宁甜樱桃树(E:104.12, N: 27.25)为主要材料。选择3株生长势相近的乔木,在开花20天后分别取脱落果柄和非脱落果柄。这些果柄被快速冷冻在液氮中,然后带回实验室在−80°C的冰箱中储存。“布鲁克斯”,被用作“桑蒂纳”的传粉树,因为后者的特点是自交不亲和。在中国贵州省威宁县(E:104.12, N: 27.25)也有种植,用花粉检测花粉活力和形态特征。以贵州省秀文县(E: 106.61, N: 26.85)种植的3株黔英1号乔木(E: 106.61, N: 26.85)为材料,以黔英1号的花粉为对照,检测其活力和形态性状。为了进行组织特异性表达模式分析,我们使用了各种甜樱桃“Santina”组织。每棵树被认为是每个样本的生物复制,进行3次重复。
花粉萌发比和形态特征的测定
体外花粉萌发是根据先前公布的方法进行的,轻微改性[53.[是否通过体外培养来确定花粉萌发率。介质式是:MS培养基+ 10%蔗糖+ 0.5%琼脂糖+ 0.1g / L的硼酸。简而言之,在玻璃滑块上落下凹槽中的介质,在凝固后,花粉洒在介质上,用解剖针头置于培养皿中并覆盖,并置于25℃的培养箱。四个小时后,显微镜观察后测定花粉萌发率。花粉管长度大于花粉粒径,否则被记录为发芽,否则记录为没有发芽。此外,以及每个样品的三个生物学重复和每次重复被随机选择3个视野,并且计算每场的花粉数量。使用该公式计算花粉萌发百分比:
每个品种在气球期后期进行3次重复,选出约150朵花,放入纸袋中。(其中一次复制包括三棵甜樱桃树的50朵花)。将花药置于牛皮纸中,室温干燥至花粉爆裂,并撒粉。用解剖针将花粉置于置于显微镜台上的双面透明胶带上。花粉样品在BAL-TEC scd005溅射镀膜机上被0.02 μm金合金包裹,并在15 kV下用JEM-2100 (UHR)进行监测。根据花粉形态特征,可分为两种类型。即正常花粉椭圆形饱满,畸形花粉不规则,干枯。每个样本随机选取3个生物重复,每个生物重复选取3个视场,统计每个视场的花粉数。花粉百分比按公式计算:畸形花粉(%)=\(\ frac {\ mathrm {merformed} \ mathrm {pollen}} {\ mathrm {pollen}} {\ mathrm {total} \ mathrm {number} \ \ mathrm {} \ \ mathrm {deparged} \ mathrm {pollen}} \ times100 \%\).
形态学特性的比较和胚胎重量的测定
根据果实的形态特征,分别描述了脱落和非脱落果实的形态特征。另外,取10个脱落的和10个非脱落的小果,然后解剖小果,用电子微天平测量其胚胎重量,每样重复5次(共50个胚胎)。显著性由学生t检验决定(P. < 0.05) with SPSS 21.
激素水平的提取和测定
采用高效液相色谱-串联质谱法(HPLC-MS/MS)分别测定抽离和非抽离果柄3个生物重复中IAA、IBA、GA3、GA4、GA7、ABA、ACC、JA和MeJA的含量。本研究中激素的提取和含量测定方法采用了之前发表的文献[54.].最后,显著性由学生的t检验(P. < 0.05).
总RNA提取、Illumina文库构建及测序
使用RNA制备纯化多糖多酚植物总RNA提取试剂盒(天根,北京,中国)提取总RNA并去除DNA。进行3个生物重复。使用Nanodrop 2000微型分光光度计(Thermo Fisher Scientific, Waltham, MA, USA)和琼脂糖凝胶电泳测量RNA质量和浓度。使用安捷伦2100生物分析仪(安捷伦科技)评估RNA的完整性。用带有Oligo (dT)的磁珠富集mRNA,并在片段缓冲液中分裂成短片段(~ 200 nt)。用随机六聚体引物进行逆转录,合成第二链cDNA。在末端修复后,5 '尾被磷酸化,3 '尾被加入腺嘌呤。测序接头连接到双链DNA片段。PCR扩增片段,构建cDNA文库。利用Illumina集群站和Illumina HiSeq 4000测序平台对文库进行测序。
RNA-SEQ数据的生物信息学分析
从每个cDNA文库中获得原始reads。为了获得干净的reads,使用SOAPunke和trimmomatic软件去除适配器序列、低质量reads和未知碱基大于5%的reads。甜樱桃基因组(Prunus_avium_v1.0.a1)来自蔷薇科基因组数据库(GDR) (https://www.rosaceae.org/species/prunus_avium/genome_v1.0.a1.)作为参考资料和文本注释。将基因表达水平归一化计算为FPKM (Fragments Per Kb Per Million reads)。差异表达基因(DEGs)通过DEseq2 R包进行鉴定,命令可以在附加文件中找到12. 结果p值采用Benjamini和Hochberg的方法来控制假发现率(FDR)。用ap值DEseq2发现< 0.05。记录日志2(折叠变化)> 1和p值< 0.05为显著差异表达。基因本体论(GO)和京都基因基因组百科全书(KEGG)富集分析https://www.omicshare.com/tools/),这是一种生物信息学平台。本研究组早期公布的蛋白质组学数据用于分析与转录组的相关性[50.].采用1.5倍的差异积累蛋白(DAPs)和2倍的差异表达基因进行协同研究。
各种植物组织(包括脓肿和非脓肿型颅内)下的样品的表达水平通过QRT-PCR使用Poftup Sybr Green Master Mix(Thermofisher,重庆,中国)以10μl,含有5μLSYBR的QRT-PCR验证了QRT-PCR绿色主混合物,100ng cDNA模板,以及每种正向和反向引物的0.5μm。QRT-PCR扩增如下进行:95℃,30秒,其次为40个95℃的循环,5s和60℃。这路面F-1α和PavRSP3号用作内部控制,并在附加文件中列出了引物序列13:表S9。相对基因表达水平用2——ΔCt方法 [55.[CFX连接实时PCR检测系统(Bio-Rad Laboratories,CA,USA)。所有其他验证都在三个重复中进行,两种重复,都是生物和技术。
HD-ZIP基因家族生物信息学及表达水平分析
HD-ZIP域(蛋白家族ID: PF00046)的隐马尔可夫模型(HMM)从Pfam (http://pfam.xfam.org/),并用作查询以搜索以前的装配甜樱桃基因组数据库(https://www.rosaceae.org/species/prunus_avium/genome_v1.0.a1.)使用HMMER 3.0软件(http://hmmer.org/).并将得到的序列上传到SMART和pam网站进行保守域分析。同时包含同源框结构域(HD, PF00046)和同源框相关亮氨酸拉链结构域(HALZ, PF02183)的蛋白被归类为候选蛋白。利用MEGA (version 7.0)软件,采用邻域连接法构建系统发育树。使用MEME (version 4.12.0)分析Motif位置(http://meme-suite.org/tools/meme.).采用半定量和定量Real-time PCR (qRT-PCR)方法分析表达水平路面F-1α和PavRSP3号用作内部控制,并在附加文件中列出了底漆序列14: S10表。功能相互作用的网络Pavhb16.和Pavhb18.被集成到字符串(版本11.0)中。
数据和材料的可用性
分离果柄和非分离果柄转录组的原始序列reads保存在NCBI sequence Read Archive (SRA)中,登录号为PRJNA636209。
缩写
- 阿坝:
-
脱盐酸
- ACC:
-
1-氨基环丙烷-1-羧酸盐
- ACO:
-
1-氨基环丙烷-1-羧酸氧化酶
- AE:
-
露出水果胚胎
- 房颤:
-
被切除的水果
- 东盟地区论坛:
-
生长素反应因子
- 辅助/IAA:
-
生长素/ Indole-3-Acetic
- AUX1:
-
助流素流出载体
- AZ:
-
果皮脱落带
- CA:
-
脓肿car
- CN:
-
在第一阶段的非脱落套件
- CTK公司:
-
细胞分裂素
- DAF):
-
几天后开花
- 例如:
-
内葡聚糖酶
- EIN3:
-
乙烯不敏感3.
- ERF公司:
-
乙烯反应因子
- 实验:
-
膨胀蛋白
- F A:
-
在第一阶段中散发出果实
- FB:
-
花蕾
- fl:
-
花
- FN:
-
在第一阶段不脱落的果实
- FPKM:
-
每百万千克碎片读
- GA:
-
吉布林素
- HPLC-MS /女士:
-
高效液相色谱-串联质谱分析
- IBA:
-
Indole-3-butyric酸
- 是:
-
茉莉酸
- Kegg:
-
京都基因和基因组百科全书
- Meja:
-
茉莉酸甲酯
- NAF:
-
non
- 纳兹:
-
非脓肿肉毒状脱落区
- NE:
-
Non-abscising胚胎
- IAA:
-
吲哚-3-乙酸
- NPR5:
-
PR5的非态度
- 朋友:
-
果胶乙酰酯酶
- PAO:
-
聚胺氧化酶
- PEM公司:
-
果胶甲基酯酶
- PG:
-
polygalacturonase.
- PL:
-
果胶酸裂解酶
- 荚:
-
过氧化物酶
- 阿富汗二月:
-
小植物素升压RNA
- 圣:
-
干
- TZ:
-
Trans-Zeatin.
- xth:
-
木瓜葡聚糖内甘油糖苷酶/水解酶
- α-TRP:
-
色氨酸合成酶α链
- β-gal:
-
β-半乳糖苷酶
- β-glc1:
-
β-葡聚糖酶
参考
- 1.
高燕,刘勇,梁勇,陆军,蒋超,费忠,等。蔷薇RhERF1和RhERF4通过影响果胶降解介导乙烯和生长素调控的花瓣脱落。工厂j . 2019, 99(6): 1159 - 71。https://doi.org/10.1111/tpj.14412..
- 2。
Sundaresan S,Philosoph-Hadas S,Riov J,Belausov E,Kochanek B,Tucker ML,等。脱落花和花器官与脱落区细胞中的细胞溶胶的碱化密切相关。J Exp Bot。2015; 66(5):1355-68。https://doi.org/10.1093/jxb/eru483.
- 3.
Roberts Ja,Elliott Ka,Gonzalez-Carranza Zh。脱落,裂开和其他细胞分离过程。Annu Rev植物Biol。2002; 53(1):131-58。https://doi.org/10.1146/annurev.arplant.53.092701.180236.
- 4.
Roberts Jeremy A,Whitelaw Catherine A,Gonzalez-Carranza Zh。细胞分离过程在植物中,机制和操纵。Ann Bot。2000; 86(2):223-35。https://doi.org/10.1006/anbo.2000.1203.
- 5。
刘D,王D,秦Z,张D,Yin L,Wu L等。Sepallata Mads-Box蛋白SLMBP21形成蛋白质复合物,与番茄花脱落区的转录激活剂作为转录激活剂。工厂J. 2014; 77:284-96。
- 6。
NAKANO T,FUJISAWA M,Shima Y,ITO Y. AP2 / ERF转录因子SLERF52在番茄中的花梗脱落。J Exp Bot。2014; 65:3111-9。
- 7。
Savicki M,AïtBarkae,ClémentC,Vaillant-Gaveau N,Jacquard C.在生殖器官脱落期间环境压力和植物代谢之间的串扰。J Exp Bot。2015; 66(7):1707-19。https://doi.org/10.1093/jxb/eru533.
- 8。
四种分离度:花器官脱落的调节。植物信号行为。2014;9:1-9。
- 9。
Tucker Ml,Kim J.脱落研究:我们所知道的以及我们仍然需要学习的内容。Stewart Postharvest Rev. 2015; 11:1-7。
- 10.
魏平,谭芳,高新青,张新青,王国青,徐华,等.拟南芥DOF家族转录因子AtDOF4.7的过表达诱导拟南芥花器官脱落缺陷。植物生理学。2010;153(3):1031–45.https://doi.org/10.1104/pp.110.153247.
- 11.
林ZX,方QM,XU T,JUN LX,LAI LT。乙烯诱导的番茄花修脚脱落的蛋白质组学分析。J蛋白质组。2015; 121:67-87。https://doi.org/10.1016/j.jprot.2015.03.023.
- 12.
柿子早期生理性果实脱落过程中的激素交互作用(Diospyros Kaki.(注)“凯旋”和“新蜀”品种。Sci Hortic(阿姆斯特丹)。2019;243:575–82.https://doi.org/10.1016/j.scienta.2018.08.044.
- 13。
关键词:干旱,黄羽扇豆,花脱落,分子生物学2019.
- 14。
孙达生,马超,蒋传志,里奥夫J,穆伽西曼伽拉姆等。番茄杂交种富脯氨酸蛋白调控脱落带对乙烯信号的响应能力。Hortic杂志2018;5(1):28。https://doi.org/10.1038/s41438-018-0033-2.
- 15.
梁Y,江C,刘y,高y,鲁杰林素调节蔗糖运输,抑制玫瑰(Rosa Hybrida)的瓣膜脱落;2020。
- 16。
Chersicola M, Kladnik A, Žnidarič MT, Mrak T, Gruden K, Dermastia M. 1-氨基环丙烷-1-羧酸氧化酶的诱导和脱落相关过程对乙烯的差异敏感。植物科学与技术,2017;
- 17。
葛T,黄X,潘X,张J,谢R。柑橘果实脱落相关多聚半乳糖醛酸酶基因的全基因组鉴定与表达分析。3生物技术。2019;9:1–12.https://doi.org/10.1007/S13205-019-1782-9..
- 18。
陈建平,陈建平。植物离体区转录调控的研究进展。植物。2019;8:10-4。
- 19。
Ogawa M,Kay P,Wilson S,Swain SM。Arabidopsis Dehiscence区聚乳糖酰胺酶1(ADPG1),ADPG2和Quartet2是在拟南芥中生殖发育期间细胞分离所需的多肢蛋白酶。植物细胞。2009; 21(1):216-33。https://doi.org/10.1105/tpc.108.063768.
- 20
莫林He,Lamotte Ce,Gochnauer C,McNamer A.果胶酯酶与叶和花脱落1相关的进一步对比研究。植物理性。1972; 50:655-9。
- 21
番茄果实发育过程中XTH、扩张蛋白和次生壁相关CesA在花和果实脱落区的分布(茄属植物lycopersicum).植物科学与技术,2015;
- 22
脱落带的发展。斯图尔特2009年收获布道;5:5。
- 23
YOON J,CHO LH,ANTT HW,KOH HJ,G.Nnox蛋白OSH15通过压制木质素生物合成基因诱导谷物破碎。植物理性。2017; 174(1):312-25。https://doi.org/10.1104/pp.17.00298.
- 24
Kim J,Yang J,Yang R,Sicher RC,Chang C。大豆叶片脱落的转录组分析确定了器官极性和细胞命运的转录调节因子。前植物科学。2016;7(90):125.
- 25
Chersicola M,Kladnik A,Tušekžnidaričm,Lers A,Dermastia M.番茄叶片叶猴脱落区中的1-氨基环丙烷-1-羧酸氧化酶诱导的图案与核糖核酸酶-1x编码lexx基因的表达无关。植物BIOL。2018; 20(4):722-8。https://doi.org/10.1111/plb.12730.
- 26
李超,赵敏,马鑫,文忠,应鹏,彭明,等。HD-zip转录因子LcHB2通过激活两个纤维素酶基因来调控荔枝果实的脱落。实验机器人。2019;70(19):519 - 203。https://doi.org/10.1093/JXB/ERZ276.
- 27。
bardror T, Dermastia M, Kladnik A, Žnidarič MT, Novak MP, Meir S,等。番茄在脱落过程中发生不对称的程序性细胞死亡。植物细胞。2011;23(11):4146 - 63。https://doi.org/10.1105/TPC.111.092494.
- 28。
关键词:荔枝,聚半乳糖醛酸酶,E支,脱落Sci Hortic(阿姆斯特丹)。2013; 150:244-50。https://doi.org/10.1016/j.scienta.2012.10.029.
- 29。
González-Gómezd,lozano m,fernández-leónmf,ayuso mc,Bernalte Mj,Rodríguezab。褪黑素和血清素中的八甜樱桃栽培品种(Prunus Avium L.)检测和定量。EUR FOITE RECONGOL。2009; 229(2):223-9。https://doi.org/10.1007/S00217-009-1042-Z..
- 30.
TalónM,Tadeo Fr。在亚乙烯促进的柑橘植物脱落期间脱落区细胞中的细胞壁重塑。前植物SCI。2017; 8:126。https://doi.org/10.3389/fpls.2017.00126.
- 31。
Santiago J, Brandt B, Wildhagen M, Hohmann U, Hothorn LA, Butenko MA等。介导花器官脱落的多肽激素信号复合体的机制洞察。Elife。2016;5:1-19。
- 32.
Dwivedi KK,Roche DJ,Clemente Te,Ge Z,Carman JG。OCL3启动子来自高粱双色将基因表达引导到花器器官基部的脱落和营养转移区;2014. p。489-98。
- 33.
易莉,明伟杜,小玉田,徐东永LZ。棉花脱落叶片脱落区微耳骨细胞骨架的变化研究。J Shihezi Univ。2016; 34:1-7。
- 34.
乙烯对芒果果实脱落的影响2003.p。0316。
- 35.
李丹,薛鑫,王勇,赵安,任宏,隋聪,等。枣胚发育与败育的观察。西北农业学报,2016,25:1379 - 85。
- 36.
Tokuji Y,Kuriyama K.嗜酸甘油蛋白和细胞素蛋白在胡萝卜(Daucus Carota)中形成胚性细胞团块中的参与。J植物理性。2003; 160(2):133-41。https://doi.org/10.1078/0176-1617-00892.
- 37。
Singh Z.胚胎流产与果实尺寸,质量和芒果皮屑的营养素浓度相关;2005. p。4167。
- 38。
Estornell LH,AgustíJ,Merelo P,TalónM,Tadeo Fr。阐明器官脱落的机制。植物SCI。2013; 199-200:48-60。https://doi.org/10.1016/j.plantsci.2012.10.008.
- 39。
赵W,Baldwin EA,Bai J,Plotto A,Irey M.甜橙洞中烧结区脱落区的转录om对黄龙豆腐相关果实脱落的比较分析。Hortic Res。2019; 6(1):71。https://doi.org/10.1038/s41438-019-0152-4.
- 40。
泰勒杰,怀特劳加州。信号在缺席。新植物醇。2001;151(2):323–39.https://doi.org/10.1046/j.0028-646x.2001.00194.x.
- 41。
Teh HF,Neoh BK,Wong YC,Bin KQ,Eng T,OOI K等。荷兰酮,多胺和细胞壁代谢在油棕榈果汁中的开发和成熟过程中;2014年。
- 42。
李C,Ma X,Huang X,Wang H,Wu H,Zhao M等。HD-ZIP I转录因子LCHB2和LCHB3在荔枝中促进与乙烯和ABA的生物合成相关的基因的转录,促进果实脱落。树生理。2019; 39(12):2071。
- 43
刘丹,李军,李臻,裴毅(氢对乙烯诱导的番茄叶柄脱落的抑制作用)茄属植物lycopersicuml。)。Hortic Res。2020:1-11。https://doi.org/10.1038/s41438-019-0237-0.
- 44
Xuan L,Li J,Wang X,王C.硫化氢与其他信号分子之间的串扰调节植物生长和发育。int j mol sci。2020; 21:1-21。
- 45
Nakano T,Kimbara J,Fujisawa M,Kitagawa M,Ihashi N,Maeda H等.番茄果实脱落区发育的转录调控中大花萼和无接缝的相互作用。植物生理学。2012;158(1):439–50.https://doi.org/10.1104/pp.111.183731.
- 46
李聪、王勇、应平、马伟、李杰。荔枝果实脱落相关基因的全基因组数字转录分析。前植物科学。2015;6:502.
- 47
Li C,Zhao M,Ma X,Wen Z,Ying P,Peng M.通过激活两个纤维素酶基因来调节荔枝果实脱落的HD-Zip转录因子。J Exp Bot。2019; 70:5189-203。
- 48
Kemmerer EC。纤维素酶与大豆脱叶,花,花和荚脱落区相关的纤维素酶的对比研究。植物理性。1994年; 104(2):557-62。https://doi.org/10.1104/pp.104.2.557.
- 49
罗伯茨·贾,冈萨雷斯卡拉南萨Zh。脱落中的果胶酶功能。Stewart Postharvest Rev. 2009; 5:1-4。
- 50。
邱志林,文智,杨坤,田涛,乔刚,洪勇,等。比较蛋白质组学分析阐明了甜樱桃果实脱落的机理。(4)。https://doi.org/10.3390/ijms21041200.
- 51。
Daher FB,Braybrook SA。如何放手:果胶和植物细胞粘附。前植物SCI。2015; 6:1-8。
- 52。
BARR FA,GRGENERG U. cytokinesis:放置并制作最后的切割。细胞。2007; 131(5):847-60。https://doi.org/10.1016/j.cell.2007.11.011.
- 53。
郭kb,qiao g,秋zl,温z,杨h,wen xp。甜樱桃的水果滴和其内部原因在不充分的冷却区。Russ J植物理体。2020; 67(1):94-102。https://doi.org/10.1134/S1021443720010070.
- 54。
张D,张米,周y,王Y,沉别,陈H,等。大米G蛋白γ亚基DEP1 / QPE9-1通过增加水稻颗粒中的毒素和细胞素素含量来呈正调节籽粒灌装过程。米。2019; 12(1):91。https://doi.org/10.1186/s12284-019-0344-4.
- 55。
Schmittgen TD,Livak KJ。用比较CT法分析实时PCR数据。NAT PROTOC。2008; 3(6):1101-8。https://doi.org/10.1038/nprot2008.73.
致谢
不适用。
资金
这project was supported by grants from Core Program of Guizhou Province, P. R. China (2016–2520), Core Program of Education Department of Guizhou Province (KY2021–038), the Innovation Talent Program of Guizhou Province, P. R. China (2016–4010), as well as the Graduate Student Research Foundation of Guizhou Province (Qianjiaohe YJSCXJH [2019]027). These funding bodies had no role in the design of the study and collection, analysis, and interpretation of data or in writing the manuscript.
作者信息
从属关系
贡献
XPW设计了这项研究。ZLQ利用ZW、QDH、GQ、KY和HY进行实验,收集实验数据并撰写实验稿。XPW审阅了手稿。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
这些实验没有使用转基因技术,也没有涉及受保护的物种。本研究使用的桑蒂娜取自贵州大学示范基地威宁地区的一个果园。它不需要特定的许可。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
甜樱桃花粉的发芽率和畸形率。
附加文件2:表S2。
脓肿患者植物激素的含量和非脓肿颅内菌之间的含量。
附加文件3:表S3。
脱落果柄和非脱落果柄读数汇总。
附加文件4:图S1。
样本之间的皮尔逊相关性。
附加文件5:表S4。
脱落果皮与非脱落果皮基因的差异表达。
附加文件6:表S5。
富含DEG的KEGG路径。
附加文件7:表S6。
去分类的DEGS。
附加文件8:表S7。
植物细胞壁重塑相关基因表达水平。
附加文件9:表S8。
通过QRT-PCR验证RNA-SEQ结果。
附加文件10。
内基因和HD-ZIP基因家族的原始凝胶图像。
额外的文件11。
的顺序蜜蜂启动子。
附加文件12。
DESeq 2r包识别的差异表达基因的命令。
附加文件13:表S9。
通过QRT-PCR分析在颅骨分析转录组数据核化的引物。
附加文件14:表S10。
27个HD-ZIP基因的引物序列列表用于表达水平分析。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
邱,Z.,Wen,Z.,Hou,Q.et al。转录组,植物激素和HD-ZIP基因家族分析之间的串扰照亮了甜樱桃的果实脱落的分子机制(李属鸟结核五十) 是的。BMC植物BIOL.21,173 (2021). https://doi.org/10.1186/s12870-021-02940-8
收到了:
公认:
发表:
关键字
- 甜樱桃
- 脱落
- 植物激素
- 转录组
- HD-ZIP