抽象的
背景
为了破译根系和微生物相互作用,植物生长期内的根源和微生物群落的继承模型中的次生代谢物积累要求进行深入调查。然而,到目前为止,在内生真菌和丛枝菌根真菌(AMF)中没有综合研究,具有药用甘草植物的根源以及内生真菌和AMF对甘草植物根系中的次生代谢产物积累的影响。
结果
在目前的研究中,研究了1-3岁的根和微生物之间的相互作用,药用甘草植物的根和疏流物土壤。使用高效液相色谱法(HPLC)测定甘草根系中的次级代谢物含量。利用高通量测序技术破译根和土壤中的内生细胞和AMF的组成和多样性。在植物的增长期间,与AMF相比,时间和物种显着影响内生真菌的多样性和丰富性,例如Ascomcota,底育霉菌,镰刀那枝孢属那萨拉克莱西姆.生长期也影响了AMF的多样性,表现为相对丰度的显著增加血管球和相对丰富的显着降低Diversispora.它表明内生真菌和AMF社区之间的不同连续模式。同时,基于距离的冗余分析和壁炉型试验揭示了根的水含量和次级代谢物(甘草酸,液体素和总异味),其赋予了内生真菌和AMF多样性。此外,植物生长显着改变了土壤的物理化学性质,影响了内生真菌和AMF社区的分布。
结论
本研究表明内生真菌群落和AMF群落的演替模式不同。在植物生长期间,根内3种次生代谢产物的含量每年都在增加,这导致了内生真菌和AMF群落组成和分布的总体差异。内生真菌群落对次生代谢产物的敏感性高于AMF群落。目前的研究为根际微生物和根分泌物之间的相互作用提供了新的见解。
背景
药用甘草属多年生豆科草本植物,生长在干旱、半干旱地区[1].中文药典中提到的三种土着甘草植物是glycyrrhiza uralensis那glycyrrhiza inflata,和甘草glabra[2].次生代谢物glycyrrhiza.如多糖、三萜皂苷、黄酮类化合物等glycyrrhiza.根,有深远的药用价值[3.那4.].甘草酸是三萜皂苷的最丰富的组分[5.]和有价值的药理学活性化合物,其具有抗炎[6.]抗病毒和免疫调节性能[5.那7.那8.].Lialiritin是具有抗氧化剂,抗细菌和抗炎特性的黄酮类化合物的关键组分[9.那10.].
甘草已越来越多地被用作医药、食品和化妆品的健康添加剂、调味剂,在全球范围内非常受欢迎[11.].由于人类活动,野生甘草等自然资源正在迅速枯竭。因此,栽培甘草是甘草根活性物质的主要来源[12.那13.].根际及其周围环境中的植物和微生物相互作用在许多生态过程中起着至关重要的作用,例如营养循环和碳螯合过程[14.].内生菌,特别是内生真菌,无症状地定殖健康植物的不同组织,如茎、叶和根[15.].它在宿主工厂的发展和生理学中起着至关重要的作用。除了提供营养和水,内心体也会影响宿主的生理过程;例如,Endophytes增加应力耐受性和根系生长[16.].内生真菌与宿主工厂的互动相互作用是进化过程的一部分[17.].此外,它显着影响二次代谢产物生产和积累。因此,Endophytes显着影响药用植物的质量和数量和药物成分的含量[17.那18.].据我们所知,目前还没有关于内生真菌与药用甘草植物根的联系以及内生真菌对甘草植物根次生代谢产物积累的影响的全面研究。
丛枝菌根真菌(AMF)是一个主要的根系合酶,被归类为称为龟猴菌的单一系统[19.].AMF显示与超过80%的陆生植物的共生关系,并从宿主植物中获得碳[20.那21.],while increases the nutrient (nitrogen and phosphorus) absorption by the host plant (nitrogen and phosphorus), thus, affects the secondary metabolism of host plants, and enhances the host plant’s tolerance to pathogens, which is directly or indirectly related to plant’s defense system [22.那23.].共生影响植物到植物的相互作用和植物群落的结构对较大的规模。因此,它影响农业生产以及农业生态系统的保护和恢复。
微生物群落的时间动态,包括与根相关的微生物群,受到许多因素的影响,如土壤的pH值、氮和磷含量[24.].在此背景下,为了解土壤特性的改变对次生代谢产物的影响,本研究以甘草为材料,在其生长期间进行了研究。因此,阐明土壤变量参与甘草植物根次生代谢产物积累和相关微生物多样性的调控机制,对于优化甘草植物栽培中植物-土壤互作至关重要。
高通量测序(HTS)技术有助于在各种生态系统中快速准确地鉴定微生物,包括细菌,真菌和AMF,与传统的文化依赖技术相反[25.那26.].因此,它拓宽了微生物多样性在生态系统中的应用和认识。本研究通过采集1 ~ 3年生甘草根际土壤和根样,对土壤理化因子进行评价,探讨次生代谢产物对药用植物微生物多样性的影响。利用热模拟技术对甘草根内生真菌和AMF群落的多样性和结构进行了研究。我们假设根中次生代谢产物水平随时间的增加而增加,并调节甘草根内生真菌和AMF群落的组成。本研究旨在:(1)阐明3种甘草属植物次生代谢产物浓度的变化及其与土壤特性的相关性;(2)探讨与甘草根相关的内生真菌和AMF群落的演替、组成和多样性;3)揭示了生长期1-3年次生代谢产物与微生物群落之间的相互作用。
结果
甘草根系中次生代谢物分析
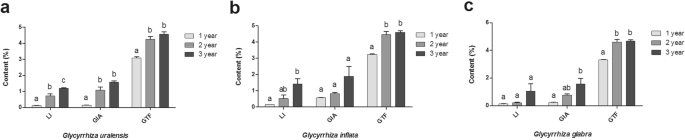
方差分析表明,次生代谢物的分泌量随植物生长期的不同有显著差异。如图所示。1,Liethiritin(Li)含量G. Uralensis.生长期限大幅增加(P. < 0.05), besides, glycyrrhizic acid (GIA) and total flavonoids (GTF) content increased significantly during 2nd and 3rd year as compared to 1st year (P. < 0.05) of the growth period.G. inflata.根系第3年的LI含量显著高于第1年(P. < 0.05) of the growth period, besides, GTF content increased significantly during 2nd and 3rd year as compared to 1st year (P. < 0.05) of the growth period. AlthoughG. inflata.根的GIA内容随时间而增加,没有显着差异(P. > 0.05) were observed. During the three years of the growth period, the LI content increased in theG. Glabra.根系,但3年生长期内LI含量差异不显著(P. > 0.05). GIA content was significantly higher in 3rd year than 1st year (P.< 0.05), GTF含量在第2、3年显著升高(P. < 0.05) than the 1st year of the growth period. In conclusion, the content of secondary metabolites in the three licorice species’ roots increased significantly during the growth period but to a different extent.
次级代谢产物含量在三种牌照的根源中随着生长期而变化。描述:条形图(标准错误)具有不同小写字母表示显着差异(P. < 0.05) was assessed by one-way analysis of variance followed by Bonferroni’s statistic test for multiple comparisons. The same letter indicates no significant difference (P. > 0.05). Abbreviations: GIA, GTF and LI mean glycyrrhizic acid, liquiritin and total flavonoid, respectively
此外,方差分析显示,随着甘草植株的生长期,其理化性质发生了显著的变化(表1)1)(P.< 0.05)。全钾(STK)含量在第3年显著低于第2年(P.< 0.05)。总盐(TS)和硝态氮(SNN)含量在第2年和第3年显著低于第1年(P. < 0.05), conversely, ammonium nitrogen (SAN) content increased significantly in the 2nd and 3rd year than the 1st year (P. < 0.05) of the growth period. Pearson correlation analysis showed that secondary metabolites (GIA, GTF, and LI) were significantly and positively correlated to SAN (r > 0;P.< 0.05),与TS呈显著负相关(r < 0;P. < 0.05) (Table2),这与分析次级代谢物和土壤因子之间逐步多线性回归模型的分析(图S1)。
内生真菌和AMF社区之间的分布差异
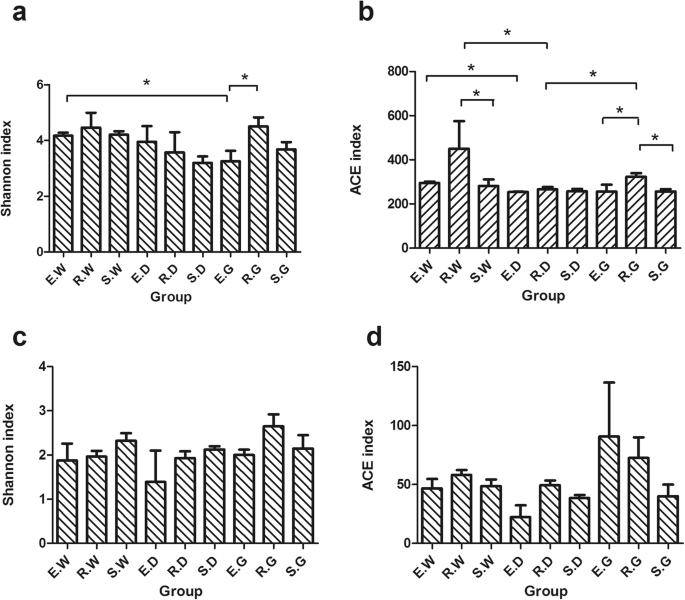
根据Wilcoxon Rank-Sum测试,不同组之间内生真菌社区的α分集索引显着不同(图。2).具体而言,r.g的香农指数。样品显着高于例如G样品,并且E.W样品的Shannon指数显着高于大于大规模样品(P. < 0.05) (Fig.2A).rg样品的ACE指数显著高于eg和s g样品,e W样品的ACE指数显著高于e D样品。R. G和R. W样品的ACE指数显著高于R. D样品,R. W样品的ACE指数显著高于S. W样品(P. < 0.05) (Fig.2B.).3种甘草AMF群落的alpha多样性指数基本一致(图2)。2C,D).结果表明,与AMF社区相比,增长年和物种显着影响了内生真菌群落的多样性和丰富性。
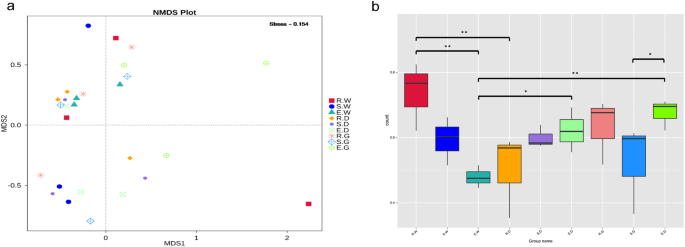
非度量多维尺度分析(NMDS)表明,各样品中内生真菌相互分离。结果表明,生长期和种类显著影响内生真菌群落组成(图。3A).NMDS分析的应力为0.154,表明统计方法的准确性(图。3A).NMDS分析验证了β多样性指数的结果。由于基于加法的无核苷酸的Wilcox Rank-Sum试验组合物的内生真菌社区在R.W和E.W样品之间显着不同(P. < 0.01), E. G and S. G samples (P.< 0.05)、r.w和r.d样品(P. < 0.01), E. D and E. W samples (P. < 0.05), and E. G and E. W samples (P.< 0.01)(图3B.).
基于加权unifrac距离的内生真菌群落的β多样性分析。描述: (一种)非度量多维尺度(Non-Metric Multi-Dimensional Scaling, NMDS)分析,图中的每个点代表一个样本,来自同一组的样本用相同的颜色表示。应力值较低(< 0.2),表明NMDS能准确反映试样之间的差异程度。(B.)对β多样性差异的意义测试,其中*代表着显着差异(P.< 0.05),采用Wilcoxon秩和检验进行分析。纵坐标是多样性;横坐标是具有图中所描述的相同含义的组名。2
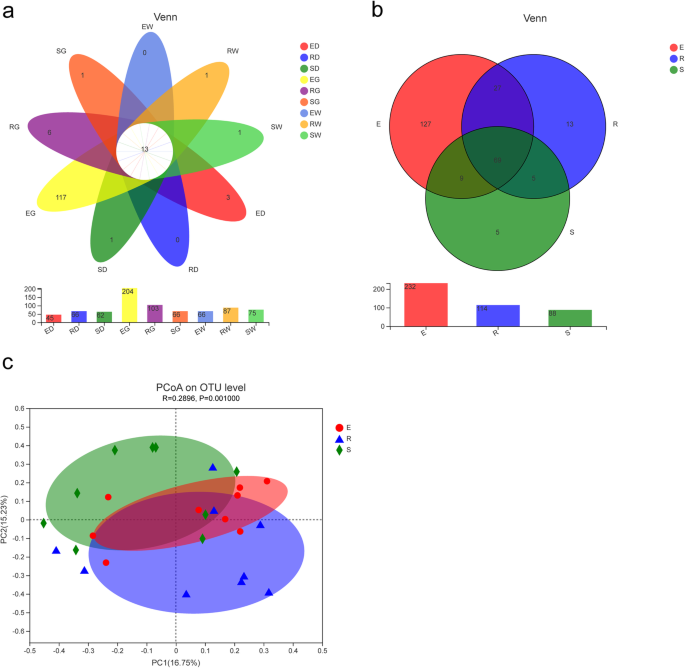
如在花瓣图中所示,每个样本的AMF群落中存在13个常见OTU(图。4).流离症层土壤中的AMF OTU数明显减少了生长期,最高数量的独特OTU在第1年(127)中发生,第三年(5)中最低(图)(图。4 b)生长期。此外,根据基于Bray-Curtis距离算法的主要坐标分析(PCOA),甘草物种不会显着影响AMF物种的组成;然而,生长期显着改变了AMF物种组成(R = 0.2896,P. = 0.001) (Fig.4摄氏度).
AMF社区的分布差异。描述:花瓣图(一种)和venn图(B.),基于操作分类单元(OTU), OTU表示对给定组的公共或唯一OTU。组名具有如图所示的相同含义。2.基于第1、2、3年加权单压裂距离的主坐标分析(PCoA)图(C),图中的每个点代表一个样本,来自同一组的样本用相同的颜色表示
内生真菌和AMF社区组成的差异
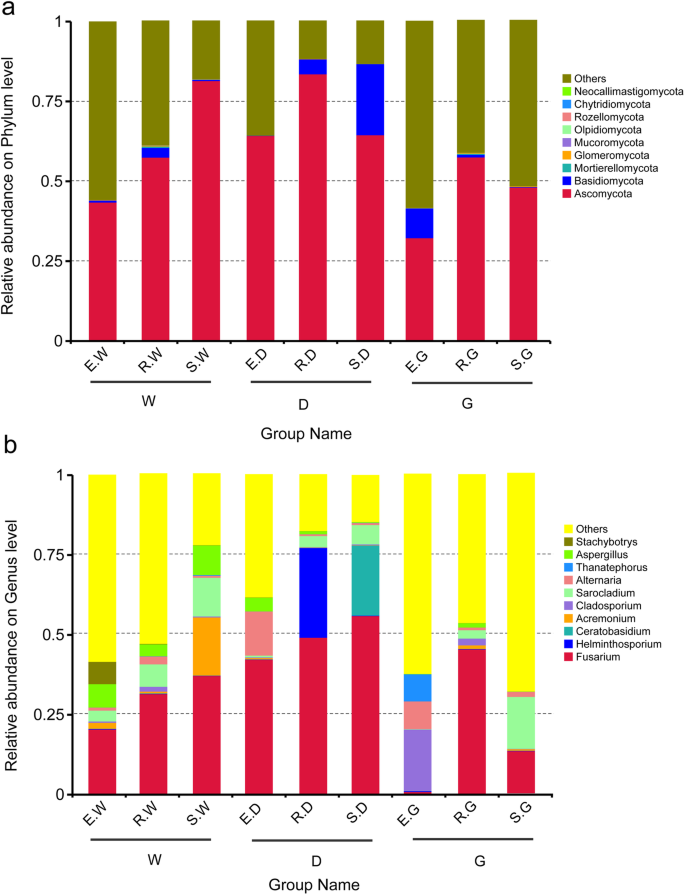
子囊菌门比其他真菌门丰富。它占43.608,57.392,81.344,64.176,83.474,64.392,32.231,57.237,和47.782%的物种总数大肠W, r·W s W e . D r . D, D, e . G r G,分别和s G样本(无花果。5).随着增长期的增加,ascomycota的相对丰度G. Uralensis.根部有显着增加。此外,底霉素是R. D(4.689%),S.D(22.261%)的主要场,例如(9.331%)样品。生长期显着增加了碱化的相对丰度G. inflata.根中,担子菌门的相对丰度显著降低G. Glabra.根(图。5).
Phylum前10位内心真菌的相对丰度的直方图(一种)分类水平和Genera(B.)分类水平。描述: (一种) 和 (B.)纵横统一是物种的相对丰富,其他意味着少或未注释;横坐标是具有图中所描述的相同含义的组名。2
这镰刀属于所有样品中的其他属性比其他属性更丰富。个体组的范围为56.12%(S.D)至0.666%(例如)(图。5 b).相对丰富的镰刀在生长期内,属的属性显着增加G. Uralensis.和G. inflata.根。同时,随着增长期的增加,相对丰富萨拉克莱西姆在三种药材中甘草品种也有所增加。然而,克拉孢菌素相对丰富G. Glabra.随生育期的延长而显著降低(图。5 b).
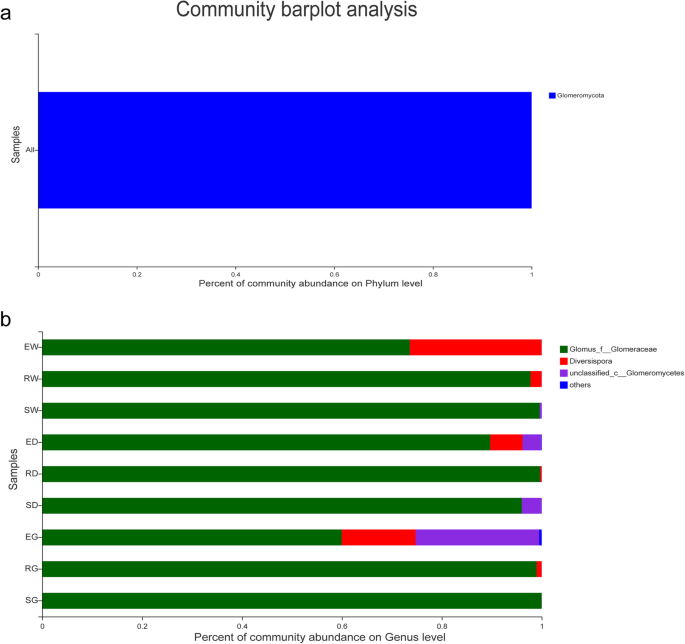
AMF社区的OTU被分类为三个不同的属。血管球属是所有样品中的显性属。它占73.595,97.771,99.594,89.690,99.685,96.015,59.967,98.015,59.967,98.980和E.W,R.W,S.W,S.W,E. D,R. D,S的物种总数的99.998%。D,E.G,R.G和S.G分别。Diversispora属是E. W(26.394%),E.G(14.792%)和E. D(6.479%)样品中最常见的属(图3.479%)(图。6 b).相对丰富的血管球随着增长期的增加,显着增加;但是,相对丰富的相对丰富Diversispora显着减少(图。6 b).
相对丰度的前10名骨折菌根真菌菌的直方图(一种)和genera(B.).描述:横坐标是物种的相对丰富;其他人意味着少或未注释;纵坐标是具有相同含义的组名,如图2所示。2
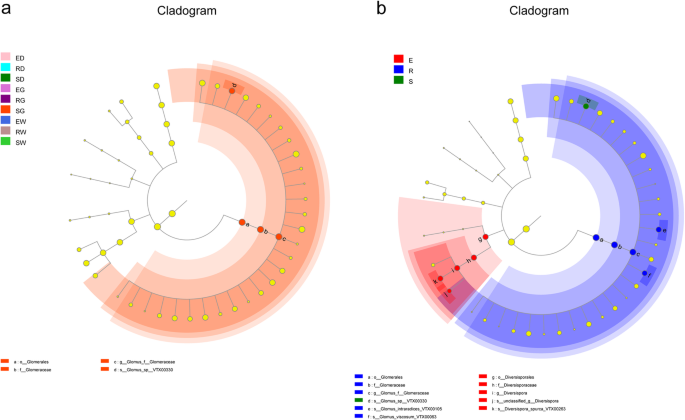
lefse(LDA效应大小)分析用于辨别土壤AMF社区相对丰富的统计学意义,并验证在其增长期间的土壤AMF社区的相关性。在每组中,只有S.G样品显示出三种生物标志物的显着富集:gl那肾小球理由, 和血管球(无花果。7一个).在生长期方面,共使用11种生物标记物来区分AMF群落的显著差异。根据本分析的结果,丰度在第3年观察到显著差异(1个分类单元:Glomus-sp.-VTX00330),第1年(5个分类群:多普利亚群,多样日俄勒斯,Diversispora那DiversiSpora-Spurca-VTX00263和未分类_Diversispora)和第2年(5个分类群:肾小球,肾小球,Glomeraceae,Glomus Intraradices-VTX00105那Glomus-viscosum-VTX00063)(图。7 b).
线性判别分析效应尺寸(lefse)AMF群落组合物差异分析作为生长期的函数。描述:在划分图中,从内部辐射到外部的圆形表示从物种的门外的分类水平。不同的分类水平的每个小圆数代表着相应组显着富集的微生物组,并且显着影响了基团之间的差异,并且小圆的直径与物种的相对丰度成比例。浅黄色小圆圈代表没有显着差异的微生物组。具有与图2中所述的相同含义的组名称。2
根系次生代谢产物与土壤理化性质及微生物群落的关系
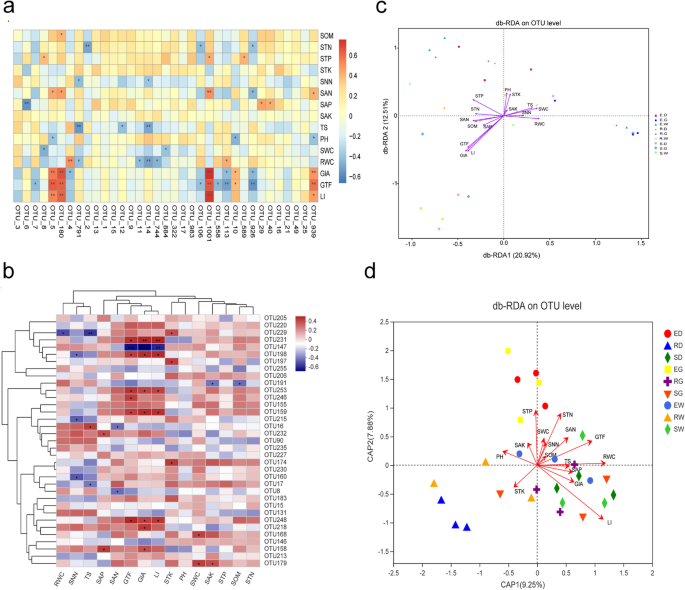
使用Spearman热图描绘了内生真菌群落,次生代谢物和土壤理化性质的前35 oTus之间的相关性(图。8).GIA,GTF和LI含量显着且与OTU-5,OTU-180,OTU-1001和OTU-939有否定相关(P. < 0.05), in line with the SAN content in the soil (Fig.8).OTU-180和OTU-1001属于属镰刀子囊菌类门。Otu-5属于属萨拉克莱西姆子囊菌类门。在AMF群落中排名前35位的otu中,GTF、GIA和LI含量与OTU-248、OTU-159、OTU-253、OTU-198和OTU-231呈极显著正相关(R > 0,P. < 0.05), which belonged to genus血管球,但与OTU-147呈负相关(R <0,P. < 0.05), which belonged to genusDiversispora(无花果。8 b).
次生代谢物与土壤理化性质与微生物群落的关系。描述:前20个OTU,次级代谢物和土壤性质之间的SPEARMAN相关分析的热图(一种)对应于内科真菌群落和(C)分别对应于AMF社区。标记*是重要的测试P. < 0.05. Db-RDA analysis based on OTU levels that mainly used to reflect the relationship between microorganisms and environmental factors. Endophytic fungal community and AMF community corresponding to (B.)(D.), 分别
基于Bray-Curtis距离的基于距离的冗余分析(db-RDA)表明,GIA (R.2 = 0.434,P. < 0.01), GTF (R.2 = 0.363,P.< 0.01), LI (R.2 = 0.417,P. < 0.01) were crucial environmental driving factors, which influenced the distribution of endophytic fungal communities, resulting in 33.43% of the overall variability in the composition of endophytic fungal communities (Fig.8 c).在AMF社区,LI (R.2= 0.477;P.< 0.01), RWC (R.2 = 0.300;P.< 0.05)是影响AMF群落分布的关键环境驱动因子。8 d).它表明,内生真菌社区对次级代谢物比AMF社区更敏感。此外,根据壁炉式测试,GIA,GTF和Li是与内生真菌社区相关性最高的环境因素(R = 0.273,P. = 0.014) (Table3.).环境因素,即RWC,GIA,GTF和LI与AMF社区高度相关(R = 0.358,P.= 0.003)。
讨论
在这项研究中,三个中次级代谢物,即GIA,LI和GTF的水平glycyrrhiza.物种根源随着生长期显着增加(图。1),符合Yang等人的研究。[27.].在医疗甘草植物中,生理活性化合物,生理活性的最终产物[28.],在生长期期间保持浓度,保护来自邻近植物,病原体和改变环境条件的植物[29.].脱椎间微生物会影响甘草根系中次生代谢物的产生。在本研究中,脱钻土壤中存在多种枝枝菌根真菌物种(图。6.),包括血管球.在Chen等人的一项研究中。[13.],Glomus Mossee接种改善了根结构,光合效率和黄酮类积累G. Uralensis..Xie et al. [1结果表明,AMF的共生活性增加了水稻对磷的吸收和甘草酸和甘草苷的积累G. Uralensis.植物。此外,甘草酸,液体素和黄酮类化合物显着且与属呈正相关血管球(无花果。8 b).因此,目前的研究表明,AMF殖民化有效地增加了三种药用甘草物种的根源中次生代谢物的生产和积累。
根据目前的研究结果,药用甘草根中的GIA,GTF和LI的含量显着且与TS含量呈负相关(表2和图。土壤的S1)。它增加了植物中的渗透性和离子胁迫,是药用甘草植物生长和干旱和半干旱地区生长和发育的主要非生物限制因素[30.].它可以归因于更高浓度的盐(主要是Na+)在土壤中,通过植物减少水和营养素的摄取和光合率[31.].它限制了植物生长和发育所需的养分含量[32.].有趣的是,在药用甘草的增长期间,土壤的TS含量显着降低(表1).表明干旱地区的甘草植物可以有效地减轻了干旱和半干旱地区的土壤盐含量的非生物应激,并在根中产生生物活性化合物。王[33.]和Zahra [34.等等。证明了适当的盐胁迫增加了甘草通过在生物合成途径中的基因或蛋白质的过表达来增加有效成分,即三萜类化合物,黄酮类化合物和甘草蛋白和甘草蛋白的积累。
根据以前的研究,由于植物的营养吸收,在常年生长和植物的发展期间,土壤中的营养水平降低[35.那36.].本研究表明,植物生长显著降低了土壤中TS、SNN、速效钾(SAK)和STK含量(见表2)1).相反,第2年土壤全氮(STN)、全磷(STP)、STK、有机质(SOM)、SAN和SAK含量略高于第1年和第3年。这可能与药用植物根系次生代谢产物的产生、凋落叶和气候条件(包括降雨方式和温度)的改变有关。
首先,落叶将营养成分的运输与植被到土壤的生态系统。根据之前的研究,某些溶解的有机化合物,例如酚类化合物和萜类化合物,通过叶片浸出的叶子凋落量增加了土壤的微生物活性和土壤营养素的矿化,包括有机氮和有机磷,通过酶的代谢[37.那38.].因此,凋落物的质量和数量会影响营养循环,保留和营养侵蚀的土壤中的微生物呼吸率[39.].其次,气候条件,特别是降雨,增加了有机物质的溶解,包括蛋白质,酚和碳水化合物,以及来自植物叶垃圾的无机营养素[40].在本研究中,营养水平的变化(SOM,STN,STP,STK,SAN和SAK)符合在实验生长期三年的降雨中。在第2年(65毫米)的降雨量高于1年(46.9毫米)和第3年(23.2毫米)的降雨量,并平行于SOM,STN,STP,Stk,SAN和SAK的水平。结果表明,年降雨量的差异可能会改变土壤的生态环境。因此,它表明气候条件可能会在不久的将来积极影响药用牌的生长,发展和有效成分。
此外,二年内的内生真菌的丰富性略高于第一至第3年(图。2).我们推测较高的降雨量增加了土壤中有机物质的溶解,微生物营养素和能量的主要来源,导致土壤肥力增加和微生物激活增加[41.].
显性微生物群落在土壤养分循环和次级代谢物生产中发挥着至关重要的作用[42.].本研究以药用甘草根际和根际土壤为研究对象,通过高温透射电镜(HTS)分析了药用甘草根际和根际土壤内生真菌和AMF群落的组成和多样性,并阐明了次生代谢产物对真菌群落组成的影响。根据本研究的结果,在甘草生长期间,内生真菌和AMF群落的组成和多样性发生了变化(图2)。4.).这些发现与Zhang等人的研究一致。43.[这表明水稻植物根微生物中的微生物迁移与生长期和发育阶段相关。内生真菌群落的多样性受生长期和物种的影响(图。3.),而AMF群落受生长期的影响更大。结果表明,土壤和植物互作对内生真菌和根际AMF群落的影响存在差异,表现为3种甘草植物生长期间根内生真菌群落的时间演替和根次生代谢产物的同步变化。内生真菌作为微生物群存在于宿主植物的根中。根系分泌物的质量组成取决于植物种类、植物发育阶段和其他环境因素[44.].它直接影响内生真菌的组成。植物和微生物之间的相互作用是高度动态的,并且通过基于共施加压力的环境因素的确定性选择来驱动[45.那46.].多项研究表明,植物通过特定的根分泌物影响微生物群落。在周等人的一项研究中[47.[香豆酸是否施用于黄瓜幼苗,以增加丰度和改变细菌和真菌社区的组合物。Carvalhais等人。[48.表明激活诱导的植物系统抗性,例如茉莉酸防御途径的诱导,显著改变了根际微生物群落。
此外,外源物质在很长一段时间内施加影响AMF群落组成甘道里希齐根茎土壤。土壤作为脱钻amf群落的自然栖息地。如前所述,土壤中改变的营养含量引发了AMF的菌丝密度和孢子密度的转变,以便资源分配到土壤内部环境的主动和静态结构[49.].之前的研究表明,土壤营养含量连续增加,例如P,增加了AMF孢子的密度[50.].Min Sheng等[51.结果表明,磷肥长期施用可间接增加土壤表层AMF孢子和菌丝密度。此外,在其他研究中,土壤中的有机物是微生物的主要基质和能量来源[52].某些AMF品种作为生物营养物,可直接消耗来自不同资源的简单有机物以生长繁殖[53].
随着植物生长,为特定微生物组合物选择的甘草植物,包括内生真菌(Ascomycota,盆霉大肠,菌根和肾小球霉菌)(图。5.和AMF(血管球那Diversispora) (图。6.).由于其适应性,子囊菌门在各种生态系统中丰富,包括陆地和沿海海洋生境[54].它可能会干扰土壤的食物链。此外,多项研究[55那56表示Ascomycota在土壤中增加营养和Somdecthith中起着至关重要的作用。此外,它是一个主导的门,主要参与根系分泌和宿主植物中的索华降解。多项研究[57那58]的研究表明,球状菌门与80%以上的陆生植物(如丛枝菌根)的根具有特殊的互惠共生关系。它的菌丝连接植物的根部和土壤养分储备[49.],提高多种营养物质的溶解度和有效性,改善土壤结构,并为植物吸收微量营养物质提供保护屏障[59那60].它增加了甘草植物根部的营养吸收,促进了甘草植物的生长。此外,肾小球菌对环境紊乱和压力更具抵抗力,从而在实现生态功能方面发挥着至关重要的作用[61].在本研究中,上述真菌均存在于所有样品中。因此,我们推测这些真菌与甘草植物的生长密切相关。深入分析这些真菌与甘草的相互作用,可能为甘草栽培提供重要数据。
根际物理化学和生物成分之间的复杂相互作用及其周围环境(土壤和气候)导致高度结构的微生物社区[62那63].根据目前的研究,次生代谢产物(GIA、GTF和LI)是影响三种药用甘草AMF和内生真菌群落组成和分布的关键驱动因子。8.和表3.),符合Li等人的研究。[64].由植物根系分泌的植物化学物质介导多种相互作用,例如植物微生物,植物植物和植物真菌相互作用。血清研究[65表明根分泌物中的次生代谢物是高度依赖微生物定殖的碳底物。它在植物和微生物的相互作用中起着至关重要的作用。众所周知,黄酮类化合物刺激或抑制根瘤菌瘤基因表达,并以化学方式吸引根[66].黄酮类化合物还可以作为信号传导组分,并建立丛枝菌根共生,刺激菌根孢子萌发和菌丝菌分支,并在植物之间介导事件[67].然而,渗出液-菌根-真菌之间的信号转导机制需要深入分析。本研究为阐明根系分泌物在促进这些有益的多方相互作用中的作用提供了参考数据。
结论
本研究研究了不同时间点甘草根相关内生真菌和AMF群落的时间演替,以及根内土壤特征和次生代谢产物的变化。与AMF相比,内生真菌群落的多样性和丰富度受生长期和物种的显著影响。然而,内生植物和AMF的群落组成受生长期的影响。在植物生长期间,根系中3种次生代谢产物含量逐年增加,土壤理化性质发生改变,导致内生真菌和AMF群落组成和分布总体上存在差异。本研究结果表明,内生真菌群落对次生代谢产物的敏感性高于AMF群落。为了确定这些真菌在次生代谢物积累中的作用,需要进行深入的分析。目前的研究为根际微生物和根分泌物之间的相互作用提供了新的见解。
方法
土壤和根抽样
分别于2017年8月、2018年8月和2019年8月在新疆省雁栖南部(86°17′e, 42°11′N)甘草种植基地进行了田间试验。研究区海拔1073.3 m,属温带大陆性荒漠气候,土壤为沙质。研究期间(2017、2018和2019年)年平均气温分别为10.06°C、8.92°C和9.98°C。2017年、2018年和2019年的年平均降雨量分别为46.9毫米、65毫米和23.2毫米。实验所用甘草种子购自新疆北菱甘草科技有限公司,种子用薄土层覆盖,用塑料包裹。种子发芽后将塑料薄膜去除。将甘草幼苗从苗圃移栽到田间,在生长期的萌芽期、中期和成熟期浇水。
分别于2017年8月、2018年8月和2019年8月对三种甘草(G. inflata.那g .解和G. Glabra.),并实行交错取样以保持样品的均匀性。本研究在9个(3种× 3重复)样地(4 m × 4 m)采集样本。每个地点采集3个同质复合样本,每个样本由5个生长良好的甘草植物的根组成。每个样地按“Z”型随机选取生长良好的甘草植株5株,挖出完整的植株根系。为了分离附着在根上的松散松散土壤和根际土壤样品(0-40 cm深度),在不破坏根结构的情况下,多次摇动根。将5个土样混合得到均匀的复合土,再将复合土分为2个子样;一个储存在液氮中用于DNA提取,另一个用于理化性质分析。用无菌剪刀剪断根部(0-40 cm)。每根样品平均分为两部分,其中一部分用于测定次生代谢物的含量。另一根被放入无菌塑料袋中,立即放在冰箱中送往实验室,对根表面进行消毒和消毒,如前所述[68然后储存在液氮中,直到提取DNA。共获得54个实验样品,其中土壤样品27个,根系样品27个(3年× 3种× 3个重复),待进一步处理。
甘草植物根系中物理化学特征及次生代谢物的测定
在实验室中自然风干的根茎土壤样品以获得恒定重量,使其在确定土壤的物理化学性质之前可以通过2mm筛。通过使用pH计和土壤悬浮液(1:5水和土壤比例)通过常规方法测定土壤pH。通过重量分析测量土壤水分含量(SWC)。根据以前的方法[68]用腐铜1035个自动氮分析仪进行高氯酸(硫酸消化方法)来确定土壤中STN的浓度;使用钼锑抗比色法测定土壤中的STP和Agilent Cary60紫外分光光度计测定;使用酸溶液和原子吸收光谱法测定土壤中的STK;SOM由外部加热方法确定;使用原子吸收光谱法测定TS。使用0.01M氯化钙萃取方法测定土壤中氮气(SAN)和SNN的浓度,如先前通过BaO等人所述描述。[69].有效磷(SAP)通过碳酸氢钠萃取(钼锑抗比色法)测定,如Bao等人先前所述[69].使用醋酸铵提取方法和原子吸收光谱仪估计SAK。
甘草样品在实验室烘箱(60℃/72 h)中干燥至恒重,然后通过60目筛,用杵和臼将样品磨成粉末[1].在室温下,使用超声浴(250W,40kHz)和71%色谱甲醇来提取0.2g甘草根粉样品。将所得溶液以12,000rpm离心10分钟,使用0.22μm孔径膜(Agilent,USA)过滤上清液。如前所述[68[甘草根系中的两个代表性的次级代谢物,即Li和Gia在Agilent Zorbax SB-C18柱上(150mm×4.6mm)上的高效液相色谱法测定。GIA和LI数据的细节在图4中示出。S2和图3。S3分别。使用紫外分光光度计(334nm)测定GTF的含量,并使用来自Solarbio的Glycyrrhiza标准(Cas#551-15-5)作为参考。
DNA提取
按照制造商的说明,使用FastDNA®Spin Kit for soil (MP Biomedicals, USA)和DNA Quick Plant System Kit (Tiangen, China)从0.5 g土壤和根样品中分离总DNA。使用NanoDrop2000 (Thermo Fisher Scientific, USA)测定DNA浓度和纯度,并使用1%琼脂糖凝胶电泳目测分离DNA的DNA完整性(图S4)。以无菌水为模板,将总DNA稀释至1 ng/μL。
PCR扩增根样本
利用特异性引物对根标本进行PCR扩增。利用特异性引物1737F (5 ' -GGAAGTAAAAGTCGTAACAAGG-3 ')和2043R (5 ' -GCTGCGTTCTTCATCGATGC-3 ')扩增ITS1-5F区ITS基因[70].另外,为了确保效率和准确性,使用Phusion®高保真PCR主混合物(新英格兰Biolabs)进行PCR扩增,并在以下内容下在热循环液PCR系统(ABIGeneamp®9700,ABI,USA)中进行反应热循环程序:95°C / 3分钟(初始变性),然后是32个95℃/ 30 s,52℃/ 30 s,72℃/ 30 s,最后在72°C / 5分钟(最终延期)。
PCR扩增土壤样品
使用巢式PCR和特异性引物扩增AMV4-5NF_amdgr区域的AMF基因。使用特异性AMF引物进行第一轮PCR扩增:AML1F(5'-ATCAACTTCGATGGTAGGATAGA-3')和AML2R(5'-GaaccCaaacactTGGTTC-3'),具有以下热循环程序:95℃/ 3分钟(初始变性),然后进行32个循环的95℃/ 30秒,55℃/ 30秒,72℃/ 45 s,最后在72℃/ 10分钟(最终延伸)。在第二轮PCR扩增步骤中,使用来自第一轮的PCR产物用作模板使用特异性引物:AMV4-5NF(5'-A形CCTAGTTGAATTTCG-3')和AMDGR(5'-CCCAACTATCCTATATCAT-3')的条形码.通过以下条件进行嵌套的PCR扩增:95℃/ 3分钟(初始变性),然后进行30°C / 30 s,55°C / 30 s,72°C / 45 s,最后一个循环72°C / 10分钟(最终延伸)。PCR扩增的一系列PCR扩增都是三份进行的,并且每次反应含有20μl反应混合物,其中4μL5XFastPFU缓冲液,2μL2.5mM DNTPS,0.4μL正向/反向引物(10μm),0.4μLFastPFU聚合酶,0.2μlBSA,1μL模板DNA和12μLDDH2添加o以使体积增加到20μl。
PCR产物纯化和Illumina Hiseq测序
将PCR产物与相等体积的1x加载缓冲液混合,并使用2%琼脂糖凝胶电泳检测。使用Axyprep DNA凝胶提取试剂盒(Axygen Biosciences,Axygen,USA)进行切割并纯化靶带并使用量子™荧光计(Promega,USA),根据厂商的标准量化。根据制造商的指示,使用NextFlex Rapid DNA-SEQ试剂盒(Bioo Scientific,USA)构建cDNA文库。使用Qubit®2.0荧光计(Thermo Sciencific)和安捷伦生物分析仪2100系统评估图书馆的质量。该CDNA库由北京指南针生物科技有限公司(中国北京,中国)对Illumina Hiseq2500平台进行测序。
生物信息学分析和统计分析
使用cutadapt软件分配了从排序的配对读取的读取分配给各个样本[71,基于它们的特殊性。条形码和引物序列从这些读取被截断。Flash软件版本1.2.7 [72]对每个样本剩余的配对端reads进行剪切和拼接,组装这些reads得到原始标签。在特定的过滤条件下对原始数据进行过滤,得到高质量的干净数据[73那74].另外,为了分离嵌合序列并消除非微生物读取,例如,叶绿体和线粒体读取,将读取与联合数据库进行比较(https://unite.ut.ee/)[75]使用Uchime [76].因此,生成干净的读取。UPARSE软件版本7.0.1001 (http://drive5.com/uparse/)[77用于将序列聚集成相同的运作分类单位(OTUS),其相似度≥97%,选择具有最高频率的代表性序列进行进一步注释。Unite数据库用于为每个代表性序列执行注释信息。肌肉软件版本3.8.31(http://www.drive5.com/muscle/)[78]进行多序列比对,分析不同OTUs间的系统发育关系以及不同类群优势菌群物种间的差异。使用含有最少序列的样本对OTUs丰度进行归一化处理。基于归一化数据分析了α和β多样性。
在本研究中,使用Qiime 1.7.0计算样本的α分集指数,包括Chao1,Ace,Shannon,SIMPSON和商品覆盖,并使用R软件2.15.3表示。每组的平均值用于构建种类的种类末端图和属的相对丰度。R软件2.15.3采用基于加权Unifrac,物种与非生物因子,DB-RDA,NMDS,Mantel测试和Venn图之间的加权Unifrac,Spearman相关性进行PCoA,Wilcoxon Rank-Sum测试。使用lefse软件进行线性判别分析(LDA),LDA与LDA得分4的默认滤波器值一起使用,以评估统计组之间的差异。使用SPSS版本19.0(IBM Inc.,Armonk,USA)进行差异(ANOVA)和Spearman相关性分析的统计分析,其中显着水平设定为0.05。针对土壤次生代谢物和物理化学性质进行了Pearson相关性分析。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- HPLC:
-
高效液相色谱
- AMF:
-
丛枝菌根真菌
- HTS:
-
高吞吐量排序
- 李:
-
Liquiritin
- GTF:
-
总黄酮
- GIA:
-
甘草酸
- nmd:
-
非公制多维缩放
- PCoA:
-
主坐标分析
- LDA:
-
线性判别分析
- DB-RDA:
-
基于距离的冗余分析
- 辣子鸡:
-
运营分类单位
- SWC:
-
土壤水分含量
- STP:
-
总磷
- 耶鲁大学管理学院:
-
有机物
- STN:
-
总氮
- Stk:
-
总钾
- TS:
-
总盐
- SNN:
-
硝态氮
- 圣:
-
氮氮
- 树液:
-
可用的磷
- SAK:
-
可用的钾
参考
- 1。
谢W,Hao Z,Yu M,Wu Z,Zhao A,Li J等。通过丛枝菌根共生改善磷营养作为促进甘草蛋白糖尿病患者的关键因素促进甘草蛋白和液体素积累。植物土壤。2019; 439(1-2):243-57。https://doi.org/10.1007/s11104-018-3861-9.
- 2。
Rizzato G,Scalabrin E,Radaelli M,Capodaglio G,Piccolo O.对甘草新代谢的新探索。食品化学。2017; 221:959-68。https://doi.org/10.1016/j.foodchem.2016.11.068.
- 3.
王L,Yang R,Yuan B,刘Y,刘C.甘草的抗病毒和抗菌活性,是一种广泛使用的中草药。Acta Pharm Sin B. 2015; 5(4):310-5。https://doi.org/10.1016/j.ap.ap.2015.05.005.
- 4.
牛金玉,张玲,程旭,李凯,周刚。甘草抗癌作用的研究进展。Curr Bioact Comp. 2009; 5:1-9。
- 5。
李平L,Cui-Ai R,Hong-yan Z.Glycyrrhizin免疫调节作用的研究进展。中国实验传统医学公式杂志。2010;272-276。
- 6.
Schr Felbauer B, Raffetseder J, Hauner M, Wolkerstorfer A, Ernst W, Szolar OHJ。甘草中的主要活性化合物甘草酸通过干扰膜受体信号减弱促炎反应。生化杂志。2009;421: 473 - 482。
- 7.
Crance JM,Scaramozzino N,Jouan A,Garin D.干扰素,利巴韦林,6-氮酮和甘草蛋白:抗病毒化合物对致病性的黄病毒有效。antivir res。2003; 58(1):73-9。https://doi.org/10.1016/s0166-3542(02)00185-7.
- 8.
Baba M,Shigeta S.甘草蛋白抗病毒活性在体外甘草蛋白酶 - 带状疱疹病毒。antivir res。1987; 7(2):99-107。https://doi.org/10.1016/0166-3542(87)90025-8.
- 9.
Martins N,Barros L,DeneñasM,Santos-Buelga C,Ferreira ICFR。甘草化合物酚类化合物的表征和甘草毒素Glabra L.根茎和根的抗氧化特性。rsc adv。2015; 5(34):26991-7。https://doi.org/10.1039/C5RA03963K..
- 10。
Astolak H,Czyzowska A,Kregiel D.从食用植物对软饮料腐败的抗菌和抗菌和抗菌活性通过Asaia SPP腐败。J Food Prot。2016; 80:25-34。
- 11.
任军,王志刚。甘草的药理作用研究。中华中医药杂志。1988;8(4):307-9。
- 12.
王继,高W,张立,黄L.组织培养物理苏尔斯岛苏尔森菌的建立及质量评价。Appl Biochem Biotechnol。2013; 169(2):588-94。https://doi.org/10.1007/S12010-012-0012-2..
- 13。
美兰,陈,广,杨,叶,盛,企鹅,李,弘妍,邱。Glomus Mosseae接种改善了营养应激下甘草的根系结构,光合效率和黄酮类化合物积累。植物科学的边疆。2017年;8:931。
- 14。
Singh Bk,Millard P,Whiteley As,Murrell JC。解开根际 - 微生物相互作用:机会和局限性。趋势微生物。2004; 12(8):386-93。https://doi.org/10.1016/j.tim.2004.06.008.
- 15.
S. H. Faeth。真菌Endophytes:常见的宿主植物共生,但罕见的共生主义者。综合和比较生物学。2002;42:360-368。
- 16.
万吉Za,ashraf n,mohiuddin t,利亚兹-ul-hassan s.植物 - 内心共生,生态学视角。苹果microbiol biotechnol。2015; 99(7):2955-65。https://doi.org/10.1007/S00253-015-6487-3..
- 17.
徐海亮,王志强,陈志强,陈志强,陈志强。植物内生真菌与药用植物的亲缘关系研究进展。MICROBIOL前面。2016;2016:7(−):-。
- 18.
Firákovás,turdíkovám,múkovám。通过与植物相关的微生物产生的生物活性次生代谢物。生物炎。2007;62:251-257。
- 19.
斯图尔梅尔股。属于肾小球学症状的丛林菌根真菌的分类和系统学史。mycorrhiza。2012; 22(4):247-58。https://doi.org/10.1007/S00572-012-0432-4.
- 20.
Kivlin SN, Hawkes CV, Treseder KK。丛枝菌根真菌的全球多样性与分布。土壤生物化学。2015;43:2294-303。
- 21.
Davison J, Moora M, Öpik M, Adholeya A, Ainsaar L, Bâ A, Burla S, Diedhiou AG, Hiiesalu I, Jairus T et al.;真菌共生体。对丛枝菌根真菌多样性的全球评估显示,其地方性很低。科学(纽约,纽约)。2015;349: 970 - 973。
- 22.
史密斯SE,读DJ。菌根共生。q Rev Biol。2008; 3:273-81。
- 23.
植物和丛枝菌根中的萜类化合物增强对草食昆虫的防御。安机器人。2017;119:791 - 801。
- 24.
Edwards J,Johnson C,Santos-MedellínC,Lurie E,Sundaresan V.结构,变异和大米根系微生物的组装。继续Natl Acad Ences。2015; 112。
- 25.
Hill Je,Seipp Rp,Betts M,Hawkins L,Hemmingsen SM。通过高通量测序对复杂的微生物群落进行广泛分析。申请环境微生物。2002; 68(6):3055-66。https://doi.org/10.1128/AEM.68.6.3055-3066.2002.
- 26。
Antje R,Martha Z,Andreas S,Mandy S,Rafael S,Alexander G,等。高通量磷料测序对嗜热沼气系统中微生物生物膜的表征。有限元微生物ECOL。2012; 79:785-99。
- 27。
Liu Y,Li Y,Luo W,Liu S,Wei G.土壤钾与不同年龄泡沫的根次级代谢物和根系核心细菌相关。植物土壤。2020:1-19。
- 28。
李艳,吴辉。药用植物生长发育与有效成分动态积累相关性的研究进展。植物学报。2018;3:293-304。
- 29。
王志刚,方志刚。次生代谢产物的自然功能。生物化学工程,2000;69:1-39。https://doi.org/10.1007/3-540-44964-7_1.
- 30。
魏立龙,张旭,徐胜。盐度是影响超干旱环境下荒漠植物叶片养分吸收的主要生态因子吗?2020;
- 31。
王志强,王志强,王志强,等。植物次生代谢产物的动态变化及其影响因素。药用植物学报。2015;2(4):105-13。https://doi.org/10.1016/j.jarmap.2015.09.002.
- 32。
詹姆斯JJ,理查兹RLTH。盐碱荒漠群落中多种资源限制了植物的生长和功能。J生态。2005;93(1):113 - 26所示。https://doi.org/10.1111/j.0022-0477.2004.00948.x..
- 33。
关键词:甘草,盐胁迫,活性成分,蛋白质组学,蛋白质组学中国农业科学。2020;68(5):1480-93。https://doi.org/10.1021/acs.jafc.9b04887..
- 34。
Zahra, Shirazi, Ali, Aalami, Masoud, Tohidfar, Mehdi M. Sohani。盐胁迫下伊朗甘草三萜基因表达及植物化学成分含量。原生质。2019;256: 827 - 837。
- 35。
杨志康,杨志康,甘特,等。杨树成熟期根系微生物组真菌和细菌群落结构的多因素分析《公共科学图书馆•综合》。2013;8 (10):e76382。https://doi.org/10.1371/journal.pone.0076382.
- 36。
Lin, Chen, Philip, Ci, Brookes, Jianming, Xu, Jiabao, Zhang, Congzhi。多年生黑麦草根相关细菌微生物群的结构和功能分化。土壤生物化学。2016;98: 1 - 10。
- 37。
Uselman Sm,Qualls Rg,Lilienfein J.溶于有机C,N和P的质量由不同类型和种类的垃圾产生:根凋落物与叶子垃圾。土壤Biol Biochem。2012; 54:57-67。https://doi.org/10.1016/j.seilbio.2012.03.021.
- 38。
Kuzyakov Y,Friedel JK,Stahr K.审查灌注效应的机制和量化。土壤Biol Biochem。2000; 32(11-12):1485-98。https://doi.org/10.1016/s0038-0717(00)00084-5.
- 39。
joly fox。从kiikkil fromin n?o,H?Ttenschwiler S.叶砂窝渗滤液的多样性,从温带林树木及其对土壤微生物活动的后果。生物地球化学。2016; 129(3):373-88。https://doi.org/10.1007/s10533-016-0239-z.
- 40。
Eva C,Josep P,情人节DW。植物渗滤液从四种北部石碑渗透物质对土壤矿化,白色云杉(Picea glauca)萌发和幼苗生长。Ann Bot。2005; 95:1247-52。
- 41。
AI C,梁G,Sun J,Wang X,他P,周W等人。无根际微生物组对32年长期无机和有机施肥土壤植物衍生碳的依赖。土壤Biol Biochem。2015; 80:70-8。https://doi.org/10.1016/j.soilbio.2014.09.028.
- 42.
焦子,徐义,张俊,郝x,鲁y,遮阳A.农业土壤中的核心微生物群及其营养循环的潜在关联。MSYSTEMS。2019; 4(2)。https://doi.org/10.1128/msystems.00313-18.
- 43.
静林,张,永新。稻米的根微生物率与田地和发展阶段的居民时间相关。掌管中国生活。2018;61:613-621。
- 44.
黄XF,Chaparro JM,REDRDON KF,张R,沉Q,VIVANCO JM。根际相互作用:根出渗出物,微生物和微生物社区。Botany-botanique。2014; 92:281-9。
- 45.
林旭,林志刚,林志刚。地下微生物群落的随机和确定性装配过程。ISME j . 2012; 6(9): 1653 - 64。https://doi.org/10.1038/ismej.201222.
- 46.
Duffy B,Keel C,Defago G.病原体信号在疾病保护中的多重药植物微生物相互作用中的潜在作用。申请环境微生物。2004; 70(3):1836-42。https://doi.org/10.1128/AEM.70.3.1836-1842.2004.
- 47.
兴昌周FW。人工施用的香草改变黄瓜根际土壤微生物社区(Cucumis sativusL.)。加拿大土壤杂志。2013;93:13-21。
- 48.
Carvalhais LC,Dennis PG,Badri DV,Tyson GW,Vivanco JM,Schenk PM。茉莉酸植物防御途径的激活改变了根际细菌群落的组成。Plos一个。2013; 8(2):E56457。https://doi.org/10.1371/journal.pone.0056457..
- 49.
Alguacil MdM, Roldán A, Salinas-García JR, Querejeta JI。免耕对水稻的磷状况、同位素组成和产量均有影响phoudolusulus vulgaris.在雨水喂养的农业系统中。“粮食与农业”杂志。2011;91:268-272。
- 50.
陈志强,王志强,陈志强,等。菌根对森林碳氮循环的影响。应用生态学报,2014,29(4):591 - 598。土壤植物。2010;327(2):519。https://doi.org/10.1007/S11104-009-0157-0..
- 51.
盛M,拉兰德,哈姆尔C,ZIADI N.长期耕作和矿物磷肥对加拿大东部潮湿大陆区丛枝菌根真菌的影响。植物土壤。2013; 369(1-2):599-613。https://doi.org/10.1007/s11104-013-1585-4.
- 52.
Pietramellara G,Ascher J,Ceccherini Mt,哥伦亚G.土壤作为生物系统。Ann microbiol。2002; 52:65-71。
- 53.
Govindarajulu M, Pfeffer PE, Jin H, Abubaker J, Douds DD, Allen JW,等。丛枝菌根共生中的氮转移。大自然。2005;435(7043):819 - 23所示。https://doi.org/10.1038/nature03610..
- 54。
皮卡德克。沿海海洋栖息地港口新型早期散发真菌多样性。真菌ECOL。2017; 25:1-13。https://doi.org/10.1016/j.funeco.2016.10.006.
- 55。
VoíkováJ,Baldrian P. Duggal群体在分解叶垃圾中经历了快速的连续变化。ISME杂志。2013;7:477-486。
- 56。
Haichar Fe,Marol B,Rangel-Castro Ji,Prosser B,Heulin A.植物宿主栖息地和根除渗透土壤细菌群落结构。ISME J. 2008; 2(12):1221-30。https://doi.org/10.1038/ismej.2008.80.
- 57。
Smith SE, David RF。菌根共生(第三版)。土壤学报2008;73:694。
- 58。
Haug I,Lempe J,Homeier J,Wei M,Setaro S,Oberwinkler F等人。Graffenrieda emarginata(Melastomataceae)与肾小球菌形成菌根和Hymenoscyphus Ericae Agagegate的成员在新山雨林的有机土壤中。可以j bot。2004; 82(3):340-56。https://doi.org/10.1139/B03-153.
- 59。
Berruti A,Lumini E,Balestrini R,Bianciotto V.丛枝菌根真菌作为天然生物元经济体:让我们从过去的成功中受益。前微生物。2016; 6。https://doi.org/10.3389/fmicb.2015.01559.
- 60。
土壤微生物与植物施肥。生物技术学报。2011;92(5):875-85。https://doi.org/10.1007/S00253-011-3521-Y..
- 61。
Daniell TJ,丈夫R,Fitter啊,年轻的JPW。丛枝菌根真菌殖民殖民作物的分子多样性。有限元微生物ECOL。2001; 36(2-3):203-9。https://doi.org/10.1111/j.1574-6941.2001.tb00841.x.
- 62。
Narula n,Kothe E,Behl Rk。根部渗出在植物微生物相互作用中的作用。J Appl Botany食物Qual。2008; 82:122-30。
- 63。
拜斯惠普,布勒克林CD, Vivanco JM。根分泌物调节根际植物-微生物的相互作用:施普林格。柏林海德堡。2008;14。
- 64。
李家,江XM,尹海,尹迪,刘Q.三种Picea asperata种植园的根渗出物和土壤微生物。英勇盛太薛宝。2014; 25(2):325-32。
- 65。
Redmond JW, Batley M, Djordjevic MA, Innes RW, Kuempel PL, Rolfe BG。黄酮诱导根瘤菌结瘤基因的表达。大自然。1986;323(6089):632 - 5。https://doi.org/10.1038/323632A0.
- 66.
Shaw Lj,Morris P,Hooker Je。根际微生物植物黄酮信号的感知和修饰。环境微生物。2010; 8:1867-80。
- 67.
黄酮类化合物在根-根际信号转导中的作用:促进植物-微生物相互作用的机遇与挑战。中国生物医学工程学报。2012;63(9):3429-44。https://doi.org/10.1093/jxb/err430.
- 68.
Dang H,张T,Li G,MU Y,LV X,Wang Z等人。根联的内生细菌群落组成和三种药用甘蔗的结构及其变化与日益增长的一年。BMC Microbiol。2020; 20(1):291。https://doi.org/10.1186/s12866-020-01977-3.
- 69.
BAO,S. D.土壤农业化学分析。(中国农业出版社)。2008;22-196。
- 70。
大卫,浆果,卡里姆本马赫德,迈克尔,瓦格纳,亚历山大,洛伊。用于多重扩增溶解偏置的条形型引物偏置扩增。应用和环境微生物学。2011;78:612。
- 71。
Martin M. Cutadapt从高通量测序读取中移除适配器序列。Embnet j . 2011; 17(1)。https://doi.org/10.14806/ej.17.1.200.
- 72。
Magoč T, Salzberg SL. FLASH:短读的快速长度调整以改善基因组组装。生物信息学。2011;27:2957 - 63。
- 73.
Caporaso JG,Kuczynski J. Qiime允许分析高吞吐量社区测序数据。NAT方法。2010; 7(5):335-6。https://doi.org/10.1038/nmeth.f.303.
- 74.
Bokulich NA, Subramanian S, Faith JJ, Gevers D, Gordon JI, Knight R, et al.;质量过滤极大地提高了Illumina amplicon测序的多样性估计。Nat方法。2013;10(1):57-9。https://doi.org/10.1038/nmeth.2276.
- 75.
Alawneh L,Debbabi M,Hassaine F,Jarraya Y,Shahi P,Andrei。朝着统一的范例验证和验证系统工程设计模型。在:资源科技软件工程国际会议的诉讼程序。2006年。
- 76.
Edgar Rc,Haas Bj,Clemente JC,Quince。Uchime提高了嵌合检测的敏感性和速度。生物信息学。2011; 27:2194-200。
- 77.
埃德加钢筋混凝土。UPARSE:从微生物扩增子读取的高度精确的OTU序列。Nat方法。2013;10(10):996 - 8。https://doi.org/10.1038/nmeth.2604.
- 78.
罗伯特C.埃德加。肌肉:高精度和高吞吐量的多个序列对齐。核酸研究。2004年。
致谢
在这项研究中,我们要感谢L. Z教授的指导,所有作者都为他们的共同努力。我们还要感谢许多未被列为共同作者的研究生以及参与耕地的工作人员以及土壤样本的收集。
资金
本研究得到了中国国家自然科学基金的财务支持(41561010和31560177)。所有资金机构只提供财政支持,并没有参与实验,抽样和手稿写作任务的设计。
作者信息
从属关系
贡献
L.Z.和H.D.设计了实验。H. D执行了方法,数据分析,调查,并是写作稿件的主要贡献者。T.Z.,Z.W.,G. Li。,W.Z.和X. LV。收集样品并修改了手稿。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
伦理批准和同意参与
植物材料(G. inflata.那g .解和G. Glabra.)在实验中使用来自兴江蜂箱甘草技术有限公司(中国新疆)。所有植物材料(不濒危物种)免费提供,并遵守当地的机构指南和立法。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Dang,H.,张,T.,王,Z.等等。与植物生长相关的内生真菌和丛枝菌根真菌的演替及其与植物根系次生代谢产物的相关性。BMC植物BIOL.21,165(2021)。https://doi.org/10.1186/s12870-021-02942-6
已收到:
公认:
发表:
关键词
- 丛枝菌根真菌
- 内生真菌
- 高吞吐量排序
- 药用甘草
- 植物生长
- 次生代谢物