摘要
背景
授粉可以通过保护种子来促进雌菠菜萼片的发育,从而提高植物的适合度。这种反应需要授粉信号,从而导致萼片细胞内的重塑,以保持和发育,但这种反应的调节机制仍不清楚。为了研究授粉诱导的花萼早期代谢变化,我们采用高通量RNA-seq方法。
结果
菠菜品种“匝数9”用于差异表达的基因分析,然后进行养蛋白模拟和养肝抑制剂治疗的实验。首先,首先将鉴于授粉后不同时间点(12h,48h和96h)差异表达的候选转录物,并检测到TRP依赖性生长素生物合成和毒素调制和转导过程的显着差异。此外,在授粉后,几种养羊素调节途径,即细胞分裂,细胞膨胀和生物发生,从授粉以萼片中的早期发育症状激活。为了进一步证实,在萼片发育中的作用,分别将具有不同浓度梯度的毒素模拟(2,4-D; IAA)和毒素传输抑制剂(NPA)分别喷洒到菠菜未加压和授粉的花朵中。NPA治疗导致促进型转运减弱,导致授粉后浓度为0.1和1mm的萼片发育。2,4-D和IAA治疗未加长的花朵,导致浓度较低但浓度较高的萼片发育。
结论
我们假设萼片保留和发育可能与养肝稳态有关,通过调节相关途径来调节萼片大小。这些调查结果提出了对菠菜授粉后这种不寻常的萼片生长现象的理解。
背景
授粉在导致萼片和花瓣脱落的基因表达模式中脱落全球变化[1].然而,在少数科植物中,萼片的长期存在,其实际功能是输入和输出花粉,这表明它们在授粉后能够适应与授粉无关的新功能。例如,在Helleborus foetidus和巴黎重楼,绿色的宿存萼片为发育中的种子和果实提供同化物质[2,3.].菊科、唇形科、Dilleniaceae和锦葵科的各种植物授粉后也有萼片生长,参与果实发育[4].然而,很大程度上扩展了萼片空泡角度通过向寄生虫对封闭在这些萼片内封闭的水果的毛细胞来增强植物健康5].保持鉴于侦察员持久性后授粉职能,值得探讨其保留和授粉后生长背后的监管机制。
植物激素稳态涉及花式器官脱落的发作。在乙烯敏感的花朵中,衰老的第一个可见迹象伴随着亚乙基生产的瞬态和突然升起[6].虽然乙烯触发器脱落,但植物蛋白似乎降低了脱落细胞对乙烯的敏感性,从而防止脱落[7,8].发现植物蛋白的外源性应用延迟或预防苹果中的花脱落[9],樱桃,调语[10.], 棉布 [11.]和杰拉尔顿蜡花[12].在克里姆蒙霍桑德兰省,花的脱落部分受到花药的调控,这是由于花药持续产生生长素[13].由于卵巢中的低内源性生长素生物合成而发生未受精的花朵,并且通过外源IAA治疗延迟或预防[14].随着对生长素生物合成、运输和代谢研究的不断深入,人们认为浓度梯度是植物器官发生和模式形成的驱动力,生长素是一种植物形态形成因子[15].然而,生长素对萼片发育和保留控制的影响尚不清楚。
菠菜(Spinacia oleracea)是一种蔬菜植物,原产于中亚和西亚,属于苋科。菠菜有三种生殖系统:i)雌雄异株,ii)雌雄同体,iii)雌雄同体。雌雄异株菠菜(XX)花有4-5个柱头和大的萼片,这些萼片持续存在并包住种子,而雌雄异株菠菜(XY)花有4个雄蕊。雄花的小萼片在开花后几乎不可见。雌雄异株和雌雄同株是常见的,而雌雄同株是罕见的。我们对几个中国菠菜品种进行了检验,但没有一个品种表现出雌雄同体的特征。雌雄同体植物的花药脱落后,花柱和花丝很难区分,只有一个或几个雌雄同体的花。雌雄同株(雌花和雄花在同一株上)植物授粉后,雌花萼片与雌花萼片生长一致。利用雌雄异株雌植物作为实验系统来研究这一现象是合理的。有趣的是,雌花宿存的绿色萼片有助于植物的种子保护(图)S1A, B).授粉和受精触发绿色萼片随着种子的发育而扩张,但尚不清楚是什么代谢变化导致了萼片大小的显著增加。
本研究旨在思考基因调节的早期变化,以改变授粉后修饰菠菜萼片大小,以确定异常萼片保留和发育的监管代谢变化。本研究的数据将为菠菜的分子资源提供有价值的补充。本研究还将指导未来选择候选基因,以延迟花衰老或通过在其他植物物种中延长萼片寿命来促进水果集。
结果
花粉管生长和第一个采样阶段
通过对菠菜雌花花粉管生长特征及其视觉发育症状的表征,确定了构建第一阶段RNA-seq文库的最佳时间点。目的是寻找授粉后萼片内早期授粉诱导发育变化的代谢途径。由于授粉后萼片随着种子的发育而生长,因此需要恰好在受精前的时间点(萼片发育的第一阶段)。对授粉后0、10、12、14 h不同时间的花粉管生长进行测定。观察到花粉管在12hap后,在14hap之前,在胚珠末端达到相对稳定的非线性生长(图S1C).因此,12 HAP被认为是图书馆建设的第一个时间点。
转录组组件和差异表达基因分析
为揭示授粉后萼片发育过程中基因表达的变化,以康乃尔-9未授粉(UNP)和授粉(12、48和96 HAP)花萼为材料,构建了3个生物重复的非链特异性cDNA文库。从12个文库中共获得了148,241,329条长度为150 bp的末端clean reads。每个文库从未授粉的花萼中产生了12 - 1410万的净读取,从授粉的花萼中产生了9 - 1480万的净读取。清洁reads被绘制到菠菜draft基因组上[16].每个阶段的样本作图率都在91%以上(表1)S1).通过连续比较系统进行差异表达分析,以确定授粉后每个阶段的差异表达基因。在未加长的(UNP)和12个Hap之间,总共2825个基因在未加长的(UNP)和12hap之间表达,1443个上调和1382个下调基因,在12hap和48个Hap之间减少至1782,具有715个上调和1067个下调基因,并且在48和96hap之间进行了1061,696次上调和366个下调基因。在所有设计的比较中的DEGS概要在图2中报告。1a.图中层级热图显示了不同处理间的差异。1c。
KEGG和GO富集分析
为了进一步证实功能诠释,我们对每个选定的时间点进行差异表达基因进行了KEGG浓缩分析(图S2).The results suggested that the ‘plant phytohormone signal transduction’ was the significantly enriched pathway in all comparisons, while the other pathways such as ‘Tryptophan metabolism’, ‘DNA replication’, ‘Glycin, serine, threonine metabolism’, and ‘Valine, leucine and isoleucine degradation’ pathways were overrepresented at UNP vs 12 HAP. Pathways related to ‘glycan degradation’, ‘carbon metabolism’ at 12 vs 48HAP and ‘Phenylpropanoid biosynthesis’, ‘Flavone and flavonol biosynthesis pathways’ and ‘alpha-Linolenic acid metabolism’ were enriched at 48 vs 96HAP. Additionally, ‘secondary metabolites biosynthesis pathway’ was of significant enrichment at 12 vs 48HAP and 48 vs 96HAP.
为了确定在每个选定的时间点上调和下调的GO,对所有成对比较的差异表达基因进行GO富集分析(图1)S3).在从UNP到12hap的转变过程中,“细胞壁组织”、“细胞壁修饰”、“甲基化”、“细胞生长”、“发育生长参与形态”、“DNA复制”均上调。而“器官氮化物分解代谢过程”、“氧化还原过程”、“脂质分解代谢过程”则被下调。在12HAP到48HAP的过渡阶段,“碳水化合物代谢过程”、“光合作用、暗反应”、“戊糖-磷酸还原循环”、“多糖代谢(葡聚糖)”、“光系统I的电子传递”显著上调。下调的氧化石墨烯主要为“几丁质代谢过程”、“氨基糖代谢过程”、“葡萄糖胺分解代谢过程”。在48HAP到96HAP的过渡阶段,“细胞壁代谢和生物合成过程”、“木聚糖生物合成过程”、“肽酶和水解酶活性的负调节因子”显著上调。“微管运动”、“细胞分裂”、“有丝分裂细胞周期”、“胞质分裂”在GO下调组中富集(图)S3).
授粉后色氨酸依赖的生长素生物合成途径
在高等植物中,由色氨酸(Trp)通过吲哚-3-丙酮酸(IPA)途径生物合成生长素[17].It’s a two-step process that involves the amino group removal from Trp forming indole-3-pyruvate (IPA), catalyzed by TRYPTOPHAN AMINOTRANSFERASE OF ARABIDOPSIS (TAA) family and then IPA decarboxylation by YUC flavin mono-oxygenase enzymes (YUC), forming IAA. In this study, 1 TAA (Spo25321)及两个香港中文大学(SPO11200,SPO24134),与12HAP相比,UNP转录本表达上调(图。2a、 表S2).
Phytohormone信号转导洞察力揭示了养肝信号通路中的富集
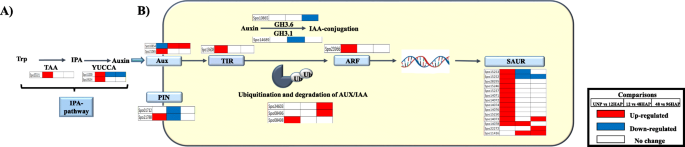
Kegg浓缩分析显示授粉后植物激素信号转导的调控。深入了解该途径,揭示了养蛋白传输和信号通路中清楚地定义的富集(图。2B,表格S2).在其弱酸性自然的酸性性质和细胞间运动是通过养蛋白流量的渗透性的渗透性的植物蛋白(AUXIN SUX1(AUX / LAX)和砧蛋白流出载体销形成(引脚)蛋白来实现的其他植物激素中是独一无二的。发现三个Aux1转录物表达式在UNP与UNP VS 12HAP的两个转录物授粉后累积,并且在12 Vs 48和48 Vs 96hap中。除此之外,授粉后12 vs 48小时下调的2个引脚转录物表明进一步养蛋白积累。两个AUX / IAA(植物素响应因子阻遏物)基因显示出UNP与12HAP的表达模式的非显着变化,促进了12个HAP的ARF(毒素响应因子)的转录。ARF介导的早期小型小型中小型中调节的RNA基因(14 saur)在授粉后差异调节,在UNP vs 12hap上的12个Saur基因上调,然而,在12 vs 48hap和48 Vs 96hap中仅升高了几个基因。减少一些GRETCHEN HAGEN 3(GH3)转录物的表达,例如GH 3.1和GH3.6所涉及的植物蛋白缀合,表明在稍后的时间点也存在一些活跃的助长累积。表达数据表明,在12 HAP诱导显着的养蛋白信号,以在稍后的时间点调节生长响应。
授粉后细胞的扩张和分裂发生改变
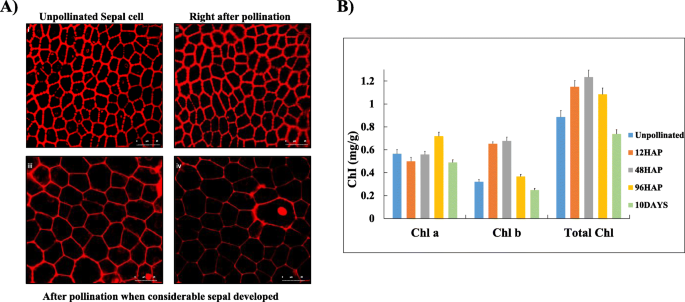
通过对生长素信号转导通路的观察,可以清楚地看到授粉后含有大量的DEG。生长素是植物生长发育的重要调控因子。这些过程的许多方面涉及多种生长素施加控制细胞壁扩张和细胞分裂。此外,授粉后,随着萼片的生长,细胞的大小显著增加(图。6A).这导致我们提出了一个问题(1)细胞扩张,修饰和分裂基因表达增加授粉后。为了解决这个问题,我们研究了参与这些途径的基因的表达模式。细胞扩张需要细胞壁松动,这主要是由内转糖基化酶/水解酶(XTHs)和扩张蛋白(EXP)调控。16个扩张蛋白家族成员在授粉萼片中有差异表达。除1个基因在授粉后48 h与96HAP时表达上调外,其余基因在授粉后12 h时表达上调。16个扩张蛋白基因中有8个基因通过12 ~ 48HAP和48 ~ 96HAP的转变而下调。共有8个基因被注释为XTHs在授粉后差异表达,这些基因在48和96HAP时表达上调,4个基因在UNP和12HAP时表达上调。此外,还观察到几个基因的调节涉及细胞壁修饰和同型半乳糖酸破坏。授粉后有23个果胶酯酶基因受到调控。其中17个基因在UNP与12HAP时表达上调,6个基因在12与48HAP时表达上调。 Downregulation of 9 and 11 genes was observed at 12 vs 48 and 48 vs 96 h after pollination, respectively. This may indicate that the pectin polymers are broken down rapidly for recycling after pollination. Enrichment of most of the cell wall loosening and pectinesterases may suggest that cell enlargement signals start rapidly right after pollination at 12H and continue at later time points (Table1).
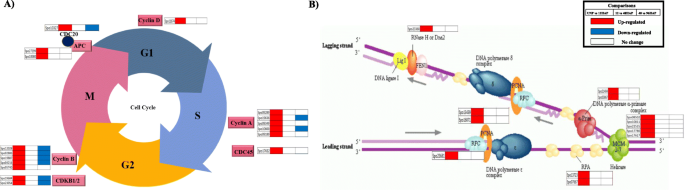
然后我们调查涉及细胞分裂的关键基因,包括事件序列[18]. 主动复制(S期)的启动需要蛋白质的组装,包括复制因子RFA、微染色体维持蛋白复合体(MCM)、DNA聚合酶、增殖细胞核抗原(PCNA)和其他因子。五个MCM基因(MCM 2,3,4,6,7),两个DNA聚合酶α-primase复合物基因(Pri1和POLA2),两个PCNA基因和三个复制因子(RPA1,RPA2和RFC3)在UNP和12HAP中被发现上调,而在12HAP到48hap和48hap到96hap的转变中没有观察到调控(图。3.B,表格S2).细胞周期蛋白(cyclin)、Cdks和APC/C参与了授粉后细胞周期的相变。11个被注释为细胞周期蛋白的基因,是触发G1到S和G2到M转变的关键细胞周期调节因子[19授粉后差异表达。五个基因向细胞周期蛋白-a,5个基因的同源性显示出高同源性,并且在UNP vs 12hap上上调了1种带细胞周期蛋白的基因。其中,将2个细胞周期蛋白A和4细胞周期蛋白B基因通过48HAP下调至96小时的转变。发现这些基因中的任何一个都没有在12小时Vs 48Hap中调节。通过与称为细胞周期蛋白依赖性激酶(CDK)的酶家庭合作来调节细胞周期事件。仅在UNP VS 12HAP上仅在48 Vs 96hap下调,仅在UNP VS 12HAP上上调两种CDKB基因(CDKB1和2)。促进复合物(APC / C),另一个细胞周期调节剂导致蛋白质降解,其持有乳腺染色体并使它们在后脱发期间移动到细胞的相对杆。它们还会导致M细胞周期性降解,使新子细胞通过将细胞推出有丝分裂来进入G1。在UNP vs 12Hap上升高到APC8和10同源的APC基因,并未通过12HAP调节至48HAP和48HAP至96HAP转变(图。3.一种)。复制机械基因和细胞周期调节剂基因的富集表明授粉后萼片器官的细胞数开始增加。
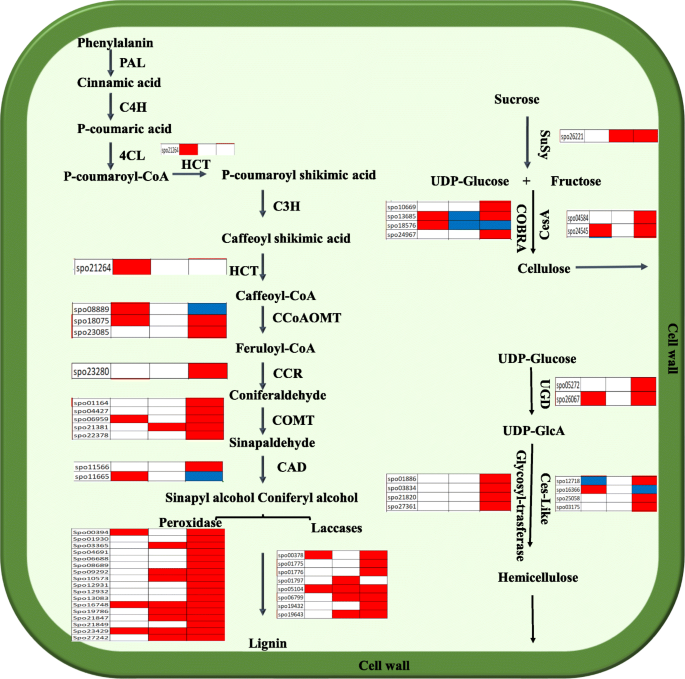
传粉后细胞壁代谢改变
生长素在细胞壁多糖合成中可能直接或间接的作用,以及氧化石墨烯富集分析中细胞壁相关基因的过度表达,促使我们对这些基因进行详细研究(图1)。4、表S2).细胞壁由纤维素、半纤维素、果胶和木质素等组成,它们相互交联、相互作用,形成复杂而坚硬的网络。纤维素是植物细胞壁中含量最丰富的生物高聚物,由纤维素合酶(CS)催化的udp -葡萄糖组成。两个中国极限运动协会同源的基因拟南芥CESA48,SCWS中CESA复合物的必要组分,发现在48 VS 96HAP上上调。眼镜蛇基因编码gpi锚定蛋白参与结晶纤维素组装细胞壁形成。三个眼镜蛇基因主要以48 vs 96hap表示,具有与类似的表达模式相似中国极限运动协会基因表明它们可以合作涉及纤维素组装和细胞壁的合成。半纤维素是第二重要的细胞壁组分,被纤维素合酶样基因和糖基转移酶(GT)催化。四CSL授粉后基因表达差异显著。其中,3个基因在UNP对12HAP和48个对96HAP上调。此外,五名成员GT基因在48和96HAP时优先表达。木质素由无定形聚合物单木醇组成,通过苯丙素途径生物合成。共12个参与木质素生物合成途径的基因在授粉后显著表达。如预期的那样,几个木质素生物合成转录本包括一个hydroxycinnamoyltransferase (HCT),三caffeoyl辅酶a 3-O-methyltransferase(CCoAOMT),两个肉桂醇脱氢酶(计算机辅助设计),一个肉桂 - CoA还原酶(CCR.), 5catechol-O-methyltransferase(COMT)授粉后差异表达。最后,单脂醇被过氧化物酶和漆酶聚合,然后运输到细胞壁。八个漆粉(Lac.)和17个过氧化物酶基因在用大多数基因在48 Vs 9 6HAP中显着上调。在许多酶中,糖基水解酶(GHS)与细胞壁多糖的降解和重塑相关。发现含有九个GHS基因在授粉后受到调节。其中,将8个基因在48 vs 96hap,3处以12 vs 48hap上进行3个基因,并且在12 vs 48hap下。这些基因的表达模式与授粉后96小时的大量跛足和细胞壁生物合成基因一致。
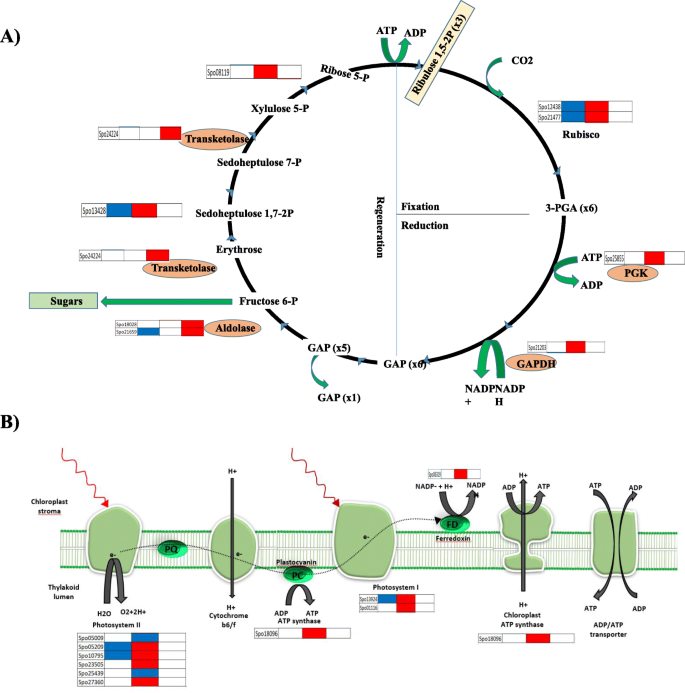
授粉后花萼的光合作用和叶绿素含量发生变化
细胞壁代谢调查清楚地表明,很大一部分DEGs属于纤维素、半纤维素、单酚聚合、细胞壁松动和授粉后降解。葡萄糖是细胞壁的主要组成部分,也是蔗糖生物合成途径的中间体。这促使我们研究卡尔文循环基因的表达模式(图。5a、 表S2).我们发现,在卡尔文循环的所有三个阶段(固定、还原和再生)中,12 - 48HAP转化过程中基因表达模式发生了动态变化。两个参与碳固定的rubisco小亚基基因,一个磷酸甘油酸激酶和一个甘油醛磷酸脱氢酶(GAPDH)在光合碳还原中起重要作用,通过12HAP到48HAP的转变被上调。然而,参与1,5-二磷酸核酮糖再生的三个基因(醛糖酶和转酮糖)在48和96HAP时被发现上调。由于萼片增强了授粉后的卡尔文循环,可以认为光合作用的光依赖反应也同时增强,提供代谢能(图1)。5b).光收集中心蛋白(光系统II的4个基因和光系统I的2个基因)以及其他光合作用成分如电子转运体铁氧还蛋白和atp合酶的上调表明光合作用机制在12和48HAP时可能显著减弱。接下来,我们研究了授粉后萼片光合产物是否转化为己糖。蔗糖合酶(SuSy)可逆将蔗糖转化为udp -葡萄糖,udp -葡萄糖是纤维素生物合成的底物,也是半纤维素和果胶所需的其他核苷酸-糖前体。在这项研究中,只有一个Susy在12 vs 48和48 vs 96HAP时表达上调。由于叶绿素被广泛认为是植物叶片光合能力的直接调节因子(Singsaas et al., 2004),我们测量了授粉后各时间点的萼片叶绿素含量(图1)。6b)。结果表明,当萼片生长刚刚开始时,总叶绿素含量增加12,48 hap,然后在96小时的略微下降,但仍然超过未透明的样品。在足够唾液中授粉10天授粉后观察到这些内容物的显着降低,以表明光合活性在授粉后促进授粉,以提供生长前体,并且当发生显着的生长时最终滴下。
通过qRT-PCR对RNA-seq数据进行验证
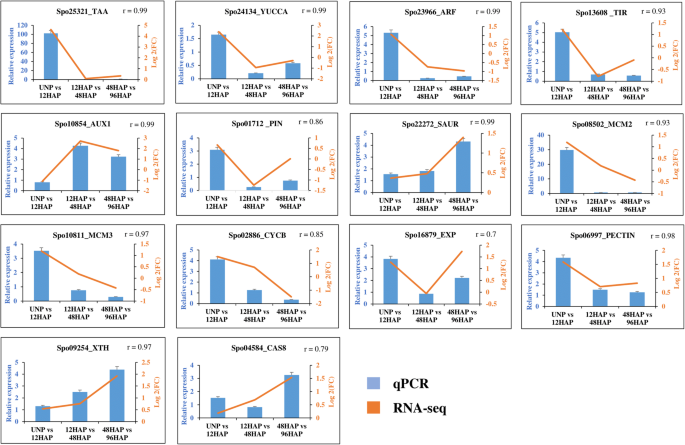
为验证RNA-seq数据鉴定的基因表达模式,随机选取14个基因进行qRT-PCR检测。生长素生物合成基因中的两个(SPO25321,SPO24134)、生长素信号转导途径中的三个基因(SPO01712,SPO23966,SPO13608),三个细胞周期基因(SPO08502,SPO10811,SPO02886)的特征是12HAP的表达高于UNP。定量PCR分析证实了细胞壁生物发生基因的转录本丰度差异(SPO09254,SPO04584.)和saur(SPO22272)在48 vs 96hap,远高于12 vs 48 hap和UNP与12hap。两种细胞膨胀基因(SPO16879,SPO06997.)和AUX1(SPO10854.)基因在RNA-seq和qPCR中也表现出相似的表达模式。所有所选基因的表达模式均与RNA-seq数据一致。7).
生长素作为一种信号,触发自发的菠菜萼片发育
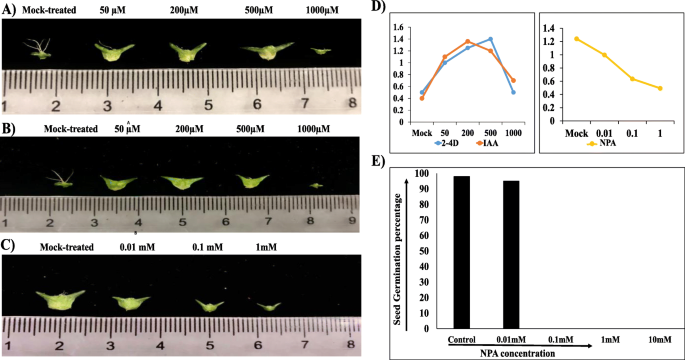
RNA-seq分析表明,传粉后启动的萼片发育可能是由细胞扩张、细胞分裂和细胞壁重塑所驱动。鉴于生长素信号在授粉后发育的萼片中是活跃的,并且这种激素在细胞生长和扩张中起作用,我们测试了外源应用生长素是否提供了驱动萼片发育的信号。我们用合成的2,4-D和天然IAA生长素类似物在50,200,500,1000uM浓度下处理未授粉的菠菜花,并在10天后研究了萼片的自主发育(图。8一种)。我们测量了15-20个萼片的大小,以估计平均增长。在50,200和500um,未加长的花萼萼片几乎同样发展,它们的生长与授粉花萼的生长相当,但在1000例枯萎的枯萎病,并且在天然毒素模拟中的略微增加,它们根本没有生长,这表明菠菜花的整形素(萼片)中的植物素荷尔蒙积累将触发萼片脱落反应。为了进一步证实蟾蜍蛋白的效果,我们将菠菜花与NPA以0.01,0.1,1mm浓度为0.01,0.1,1mM浓度,并在10天后研究了自主萼片发育(图。8b).在0.01 mM时,正常情况下,萼片发育较正常情况下略小,但在0.1 mM和1mm时,萼片发育差异显著;在0.1 mM时,萼片略小,但小于0.01 mM,在1mm时,萼片完全没有发育。我们还观察了NPA处理后授粉花的种子大小在成熟时的差异。当NPA浓度为0.01 mM时,正常种子发育为模拟种子,而当NPA浓度为0.1 mM和1 mM时,小种子发育为败育种子。我们进一步分别检查了不同NPA处理下种子的发芽率(图1)。8C)。观察到每种治疗的一种种子进行萌发,并计算萌发百分比。在模拟治疗的中,发芽率约为97%。在0.01mm中,随着它们的萼片大小也相似,观察到相同的萌发百分比,因为它们的萼片大小也相似,而在0.1和1mM NPA治疗中,没有种子萌发,并且与它们的萼片大小一致,这也没有开发。这可能表明通过互动途径的植物素运输可能在授粉后在菠菜中汲取胚胎和萼片发育,因为萼片随着被包裹的显影种子而生长。每个处理中的萼片尺寸的定量数据如图4所示。8d。
讨论
菠菜雌花独有的粉授粉后的萼片保留和发育可通过授粉信号确定,并且其调节仍然不清楚。在该研究中,用连续比较系统的3种不同时间点(UNP与12HAP; 12 Vs 48Hap; 48 Vs 96HAP)在3种不同时间点之间的表达模式表明授粉后的萼片发育可能与三种生物过程有关,包括(i)对植物激素(II)细胞分裂和膨胀(III)细胞壁生物发生的反应。Degs的Kegg浓缩分析表明,植物植物激素信号转导途径在每个时间点授粉后具有重要意义。特别是,在信号传输过程中的生长素相关的DEG,表明植物素对萼片生长和发育的调节产生了更大的影响。在授粉后,伴随植物素流入载体AUX1基因,随着血清的增加的转录物水平 - 植物蛋白响应基因。参与植化素缀合的基因的下调将在萼片细胞中刺激更活跃的植物蛋白含量。通过在授粉花萼中的毒素流动的弱化削弱了外源性NPA申请进一步证实了未显示出0.1和1mm的任何发育变化,这表明生长素累积与萼片发育相关,并且毒素流动的弱化破坏了发展。
授粉是在柱头表面感知的,花粉与柱头的相互作用或花粉传播物质启动了发育事件。生长素被认为是通过花粉传播的生长素或其他因子直接传递到柱头的主要授粉信号[20.].在烟草花柱中,发现生长素合成与花粉管生长有很强的相关性[21,22].尼奇(23]发现,在花粉萌发后13.5和20.5 h,色氨酸-生长素前体接触培养基上的生长素浓度增加。这表明花粉管具有一种酶系统,可以将色氨酸转化为生长素。研究还发现,静止的花粉和未授粉的卵巢中有一种色氨酸- iaa酶,授粉后玉米的活性增强[24]. 后来在高等植物中,Trp依赖的TAA–YUC介导的生长素生物合成被发现是生长素库的主要贡献者[25].本研究发现2 YUC和1 TAA均上调,表明色氨酸依赖性生长素的生物合成为菠菜萼片保留提供了授粉信号。此外,生长素类似物对未授粉花萼的处理表明,生长素对授粉后萼片的保留和生长具有足够的作用,但其发育效应是浓度依赖性的。结果表明,在50、200和500 uM 2、4 D和IAA处理下,未授粉的花萼发育与授粉的花萼发育相同,但1000 uM浓度对花萼发育的影响不同。8A, b)表明生长素的过度积累可能会触发有规律的授粉调节的花被衰老反应。然而,研究表明,喷洒生长素并不总是成功的[26,27].在某些浓度下,植物素可以增强而不是减少脱落,但众所周知,过量的养肝蛋白刺激乙烯生产[28].在兰花花中,通过授粉在柱塞中迅速诱导毒素调节的ACC合酶,导致乙烯生产爆发,导致花脱落[29].本研究未发现与乙烯相关的基因受到调控,提示花粉中生长素的合成可能不是乙烯合成的唯一主要花粉信号,而是引起菠菜萼片发育的信号。也有可能花粉中含有其他的生长素形式,如生长素缀合物,或其他因子,它们可能协同参与生长素引起常规授粉调节的菠菜花被脱落反应。
植物素通过调节细胞扩张,分裂和重塑来控制所有植物发展方面。快速细胞膨胀需要通过改变细胞壁网络内的分子相互作用和壁张力的松弛来实现的壁松动。几个提出的模型表明,松开细胞壁引起的交联,切割或减弱的非共价键,便于沿着纤维素支架的半纤维素聚合物滑动。已鉴定为主要细胞壁宽松剂的膨胀菌素(EXP),木糖葡聚糖内翻糖基酶/水解酶(XtH)和果胶甲基酯酶(PME)[30.,31,32在本研究中发现授粉后立即上调。根中生长素诱导了若干EXP和PME家族成员的活性[33].Saurs在细胞扩张中的积极作用已揭示来自拟南芥的几项研究[34,35,36].越来越多的证据也表明生长素可以直接影响细胞周期相变的关键调控因子(细胞周期蛋白和细胞周期蛋白依赖激酶)来控制细胞增殖[37].全球文本分析显示CYCB1和苏铁潜在的毒素诱导。发现基因蛋白基因在启动子区中具有疾病响应元件(辅助);然而,尚未调查此类元素的功能相关性[38,39].在我们的研究中,各种细胞周期蛋白A,B与参与DNA复制等螺旋酶,DNA聚合酶,在细胞周期的S阶段的复制因子一起的各种细胞周期蛋白A,B也是上调的,表明授粉后的养蛋白基因表达积累可能会引发与细胞周期相关的萼片中的基因用于细胞增殖。
除了细胞壁膨胀和细胞增殖之外,还长期提出了激素信号传导和细胞壁生物合成之间的关联。细胞壁生物发生也在开发过程中建立细胞尺寸并部分调节的植物膜来发挥关键作用。因此,可以通过增加的光合酸盐产生,细胞壁聚合物或其他代谢途径来提供细胞壁生物发生中的葡萄糖前体。40].研究表明,通过增加番茄植物的叶片和水果中的叶绿素含量来调节光合速率和糖积累的疾病响应因子(ARFS)过表达和糖积累[41].授粉后蔗糖合成的关键基因rubisco-subunit、PGK、GAPDH、FBP、醛缩酶和三聚糖等基因均上调。传粉后细胞壁代谢的调节和细胞生长的增加也被证明与细胞壁分解代谢和合成代谢相关的基因的高表达。纤维素合酶表达上调,眼镜蛇授粉后萼片,甘黄油转移酶和木质素生物合成基因的杀授授粉为未来菠菜繁殖的工作基础。除了细胞壁生物合成的生长之外,通过通过糖苷水解酶破裂现有的细胞壁聚合物的再循环可以保护用于细胞壁重建的前体(葡萄糖)。原代墙架构的几种变化与养肝剂有关,包括细胞壁酸化[42],从头合成多糖,并修饰特定的细胞壁聚合物[43].维管生长素转运体突变体通过影响茎中的木纤维而显示出细胞壁厚度的减少,可以通过外源性生长素的应用来挽救[44].突变体的CCR1和C4H.,随着木质素积累的降低,许多养肝响应基因被下调[45].蒂尔·A·雷曼[46]的研究表明,细胞壁生物合成的中断扰乱了生长素的运输,影响了各向同性生长的各向异性,从而全面影响了根系的形态。
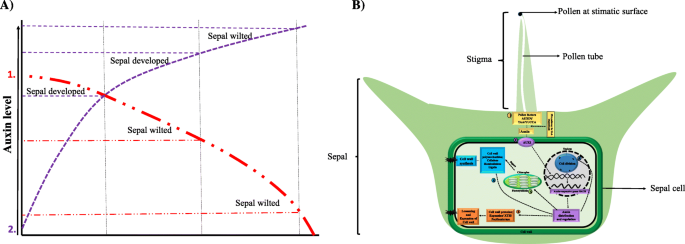
总之,RNA-SEQ数据分析,2,4-D,IAA和NPA治疗表明,植物素在授粉后在菠菜萼片发育中发挥着重要作用。结果表明,萼片发育需要适当的植物素浓度和生长素稳态(图。9a).我们的假设模型概述了本研究的所有发现,并强调了色氨酸依赖的生长素生物合成和生长素信号转导对细胞分裂、扩张和细胞壁生物发生的影响,以改变授粉后菠菜雌花的萼片大小(图)。9b).然而,花萼组织非常小,这使得在授粉前解剖和收集足够的样本来测定内源生长素含量非常困难。本研究为进一步深入研究授粉后萼片保持和发育的分子机制奠定了基础。
A.生长素模型显示了生长素浓度对菠菜萼片发育的影响。生长素运输抑制剂(NPA)处理授粉花(红色虚线)导致生长素极性流减弱,可能导致生长素浓度下降到导致萼片枯萎的水平。在一定浓度下,生长素类似物(2,4d, IAA)对未授粉的花(紫色虚线)施用后,生长素浓度增加导致未授粉花的萼片发育,进一步增加导致萼片枯萎,说明生长素水平对萼片发育至关重要。B菠菜中萼片尺寸调节的植物素调节性代谢变化。它表明TRP依赖性生长素生物合成和生长素信号传导途径对细胞分裂,膨胀和细胞壁生物发生的影响,以改变授粉后菠菜雌花中的萼片大小。 授粉导致花粉因子活化,产生生长素和2。
授粉导致花粉因子活化,产生生长素和2。 激活生长素信号通路3。
激活生长素信号通路3。 养肝调节基因负责细胞壁松动/膨胀4。
养肝调节基因负责细胞壁松动/膨胀4。 而细胞分裂途径为萼片细胞增殖发育5-6。生长素还
而细胞分裂途径为萼片细胞增殖发育5-6。生长素还 间接地(通过光合作用)或
间接地(通过光合作用)或 直接调控细胞壁合成途径促进生物量积累促进萼片发育
直接调控细胞壁合成途径促进生物量积累促进萼片发育
方法
植物材料
从USDA获得菠菜品种Cornel-9种子。用10%次氯酸盐溶液处理种子,在20℃下温育18小时,并在滤纸上在培养皿中转移。2周后,两片叶子阶段的幼苗被转移到16厘米的盆中,并迁移到福建农业和林业大学福州海霞科技学院(STIES),福州,中国温度设定为23°C,湿度65%,和16小时光周期。在开花的开始时,分别覆盖了女性和雄性植物以防止随机授粉。
花粉管生长测量
鲜花成熟后,女性花却授粉。在授粉(HAP)后的0,10,12,14小时,浸没在1:9的乙酸和100%乙醇中浸没在0,1:9的比例中,以固定2小时的样品,然后在1米NaOH中浸没6小时室内温度。最后,用50mM PBS溶液洗涤花,并用0.1%苯胺蓝染色30分钟。鲜花在载玻片上固定并在倒置的ePiforence Leica DM IRB显微镜(Wetzlar,德国)下观察,配备了Q成像Retiga 2000冷却数码相机(Burnaby,BC,Canada)。
分期选择、RNA分离、文库制备和高通量测序
为了探讨授粉后授粉后的基因,花卉授粉。选择授粉花的三个阶段(图。1b)。未加压(控制;约0.4厘米的萼片大小)和三个阶段的授粉花(第1阶段:受精前,当花粉管达到胚珠时,萼片大小为约0.4cm),48小时(第2℃)阶段;萼片开始发育的早期发育症状;萼片尺寸约为0.55厘米)和96小时(第3阶段;可见萼片发育;萼片大小约0.75厘米)(图。1b)在茎中部采集萼片,根据10 ~ 15个萼片的平均大小估算萼片大小。每个时间点采集3个生物重复,每重复5 ~ 20朵花。显微镜下解剖分离花萼组织,无菌dH冲洗2O清除任何花粉残留物。qagen, RNeasy Plant Mini Kit (QIAGEN,http://www.qiagen.com/)提取总RNA,按照说明书使用Ultra RNA Library Prep Kit (NEB, #E7770L)构建RNA-seq文库。使用Illumina Hiseq™2500系统对索引库进行高通量测序,获得150 nt的对端reads。
差异表达基因分析,代谢途径和基因本体富集分析
测序后,通过FASTQC应用检查了原始读取的质量(适配器序列,低质量读取和其他污染物)https://www.bioinformatics.babraham.ac.uk/projects/fastqc/. 适配器序列被trimmoatic(版本0.4.4)删除。在那之后,清晰的读数被映射到菠菜基因组(http://www.spinachbase.org/)和读取计数生成与STAR aligner [47].装配每个转录本的映射读取,并使用StringTie计算FPKM值。对于差异基因表达分析,读计数数据归一化,并使用参数为log2FC > 1或<−1的bioconductor (R)包中的DESeq2计算差异表达基因(DEGs)P-value threshold to 0.05,并启用独立过滤。差异表达基因在连续比较系统中进行研究(以每个连续阶段为参考点)。KEGG通路和基因本体富集分析采用在线工具“Omicshare”(https://www.omicshare.com/).
基因表达定量RT-PCR分析
1 μg总RNA的第一链cDNA由PrimeScript™RT Reagent Kit与gDNA Eraser合成。将cDNA合成反应稀释至终体积80 μl。定量RT-PCR使用TB Green™Premix Ex Taq™II试剂盒(TaKaRa),在CFX- 96井实时系统(BioRad,美国)中进行。终反应体积为20 μl;1 μl cDNA, 1 μM每个引物和10μLTBGreen TM PCR主混合物。扩增程序为95°C 3分钟;根据用户手册指示,在95℃下为10 s和50°C的40°C和50°C的循环分离阶段。每个样品重复三次。基因的相对表达通过参考基因归一化GAPDH在每个样本中[48].数据的正常化由2完成 -△△本研究中使用的CT方法引物在表中提供S3.
测量萼片叶绿素含量和萼片尺寸
清洗萼片以去除其他污染物,并将具有15-20个花萼的3个复制品(at、UNP、12、48、96HAP)浸入无水乙醇溶液中溶解色素。在不同波长下(470、649和665)溶液的吸光度值之后 分光光度计(L3,INESA,China)测定。最后根据上述公式计算叶绿素a、叶绿素b和总叶绿素含量[49],即。叶绿素a = (13.95A665–6.88A649)*0.001*1/g二。叶绿素b = (24.96A649–7.32A665)*0.001*1/g iii.总叶绿素 = 叶绿素a + 叶绿素b。
为了测量细胞大小,将雌花的萼片分3个阶段(未授粉阶段、未授粉阶段、未授粉阶段)分离。就在授粉之后,iii。当相当大的萼片发展)和处理与碘化丙啶Ready Flow™试剂按照用户手册的指示。图像由共聚焦激光扫描显微镜拍摄。
菠菜花植物素模拟和养蛋白转运抑制剂的外源性应用
菠菜植物在如前所述的相同条件下生长。使用的所有化学物质都是订购的https://dotscientific.com..在雌性花序成熟后,将未加长的花朵浸入合成的助体素类似物(2,4-二氯苯酸乙酸; 2,4-D)和天然助体素类似物(吲哚-3-乙酸; IAA),浓度为50μm,200 μM, 500 μM, and 1000 μM respectively. For efficient adsorption, flowers were dipped into the solutions for about 1 min. To counter confirm the effect of these hormones, auxin transport inhibitor (N-1-Naphthylphthalamic acid; NPA) sprayed to pollinated flowers at 12 HAP. The concentrations of NPA were set to 0.0 l mM, 0.1 mM, and 1 mM respectively. To enhance the application efficiency of these hormones and their transport inhibitors, another application was done after 2 days. For each treatment, four biological replications were used. Samples were harvested and observed after 10 days.
数据和材料的可用性
目前研究期间使用的数据集在NCBI上公开提供(http://www.ncbi.nlm.nih.gov/bioproject/716151),注册编号为(BioProject: PRJNA716151, SRA: SUB9312724)。
参考
- 1。
琼斯ml。撒氏授粉加速的花冠衰老需要乙烯信号传导。植物SCI。2008; 175(1-2):190-6。https://doi.org/10.1016/j.plantsci.2008.03.011.
- 2.
埃雷拉厘米。花后花被功能:宿存萼片对鸡眼草种子发育的贡献。我是J Bot。2005;92(9):1486–91.https://doi.org/10.3732/ajb.92.9.1486.
- 3.
余凯,范强,王勇,魏娟,马强,余东,等。重楼叶萼片的功能:光合产物分配与分配给果实和根茎。植物生理学杂志。2013;40(4):393-9。https://doi.org/10.1071/fp12257.
- 4.
热带花卉多样性与进化生物学。剑桥:剑桥大学出版社;1995.
- 5.
Sisterson MS,Gould Fl。Physalis Angulata的充气Calyx:来自寄生寄生的寄生,为Heliothis Sublexa。生态。1999年; 80(3):1071-5。https://doi.org/10.1890/0012 - 9658 (1999) 080 (1071: TICOPA) 2.0.CO; 2.
- 6.
关键词:乙烯,植物,生长发育,衰老,植物abstract:植物生态学报,2017;
- 7。
Basu MM,González-carranza Zh,Azam-Ali S,Tang S,Shahid AA,Roberts Ja。在拟南芥花的脱落区细胞中的操纵揭示了吲哚酸信号传导是器官脱落的先决条件。植物理性。2013; 162(1):96-106。https://doi.org/10.1104/pp.113.216234.
- 8。
Kühnn,abello c,godoy f,delrot s,arce-johnson p.葡萄树丛中的差异行为:依赖于植物素转运的乙烯相关基因表达减少与第一开发浆果的低脱落相关。Plos一个。2014; 9(11):E111258。https://doi.org/10.1371/journal.pone.0111258.
- 9。
生长调节剂的农业应用及其生理基础。植物生理学杂志。1952;3(1):87-108。https://doi.org/10.1146/annurev.pp.03.060152.000511.
- 10。
《脱落生理学》。植物生理学杂志。1955;6(1):211-38。https://doi.org/10.1146/annurev.pp.06.060155.001235.
- 11.
李玉玲。棉花花和果实脱落的研究。医学杂志。1977;19(2):81 - 7。https://doi.org/10.1007/BF02926740.
- 12.
Joyce D.治疗,以防止Geraldton蜡的花脱落。Hortscience。1992年; 27(11):1243。
- 13.
Koevenig J,Sillix D. IAA的运动在蜘蛛花(克里姆蒙群岛)雄蕊长丝中的部分。我是J机器人。1973; 60(3):231-5。https://doi.org/10.1002/j.1537-2197.1973.tb10221.x.
- 14.
Yager RE, Muir RM。蛋氨酸和吲哚乙酸在烟草脱落控制中的相互作用。生物医学杂志1958;99(2):321-3。https://doi.org/10.3181/00379727-99-24337.
- 15.
赵艳生物合成及其在植物开发中的作用。Annu Rev植物Biol。2010; 61(1):49-64。https://doi.org/10.1146/annurev-arplant-042809-112308..
- 16.
徐超,焦超,孙浩,蔡旭,王旭,葛超,等。120份菠菜种质的基因组草图和转录组多样性。Nat Commun。2017;8(1):1 - 10。
- 17.
植物生长素生物合成途径的研究。机器人学报。2012;63(8):2853-72。https://doi.org/10.1093/jxb/sers091.
- 18。
关键词:植物生长发育,细胞周期,细胞周期2006;40(1): 77-105。https://doi.org/10.1146/annurev.genet.40.110405.090431.
- 19。
Blagosklonny MV,Pardee Ab。细胞周期的限制点。细胞周期。2002; 1:102-9。https://doi.org/10.4161/cc.1.2.108.
- 20.
李建平,张建平。矮牵牛花(Petunia hybrida)亲和和不亲和授粉后花粉-雌蕊系统的激素状况。植物学报,2003;https://doi.org/10.1007/S00497-003-01891..
- 21.
隆德公顷。烟草花柱和子房的生长激素与果实发育有关。中国生物医学工程学报,2006;https://doi.org/10.1002/J.1537-2197.1956.TB10534.x..
- 22。
缪尔RM。烟草生长激素与果实坐果和发育的关系。作者简介:张建平,男,博士研究生。https://doi.org/10.1002/j.1537-2197.1942.tb10272.x.
- 23。
NITSCH J.植物激素在水果开发中的作用。博士论文。加州理工学院;1951年。https://doi.org/10.7907/G2GR-7342.
- 24.
Stehsel mli。玉米籽粒在发育过程中色氨酸,蟾蜍素和烟酸之间的相互关系。II。玉米籽粒中蟾蜍络合物的性质研究。本文加利福尼亚州的大学;1950年。
- 25.
关键词:生物化学,生物力学,生物力学,生物力学拟南芥中生长素合成的主要途径。自然科学学报,2011;108(45):18512-7。https://doi.org/10.1073/pnas.1108434108.
- 26.
Wagstaff C,Yang TJ,Stead Ad,Buchanan-Wollaston V,Roberts Ja。山地拟南芥分子和山叶叶片的分子与结构特征及转录谱比较。工厂J. 2009; 57(4):690-705。https://doi.org/10.1111/j.1365-313X.2008.03722.x.
- 27.
奥尼尔SD。花发育的传粉调控。植物生物学杂志,1997;48(1):547 - 547。https://doi.org/10.1146/annurev.arplant.48.1.547.
- 28.
植物生长素诱导的乙烯引起脱落酸的生物合成和生长抑制。植物杂志。2000;124(3):1437 - 48。https://doi.org/10.1104/pp.124.3.1437.
- 29.
Burg SP,Dijkman MJ。乙烯和养羊酸参与花粉诱导瓦达兰花花褪色。植物理性。1967年; 42(11):1648-50。https://doi.org/10.1104/pp.42.11.1648.
- 30.
科斯格罗夫DJ。膨胀蛋白使植物细胞壁松动。自然。2000;407(6802):321–6.https://doi.org/10.1038/35030000.
- 31。
Micheli F.果胶甲基酯酶:细胞壁酶,具有植物生理学的重要作用。趋势植物SCI。2001; 6(9):414-9。https://doi.org/10.1016/s1360 - 1385 (01) 02045 - 3.
- 32.
木糖葡聚糖内转糖基化和内水解酶的XTH家族:当前的展望和一个新的统一命名。植物生理学杂志。2002;43(12):1421-35。https://doi.org/10.1093/pcp/pcf171.
- 33.
Laskowski M、Biller S、Stanley K、Kajstura T、Prusty R。生长素处理拟南芥根系的表达谱:侧根发生的分子分析。植物细胞生理学。2006;47(6):788–92.https://doi.org/10.1093/pcp/pcj043.
- 34。
生长素和赤霉素敏感的拟南芥小生长素UP RNA36在光照下调节下胚轴伸长。植物细胞代表2013;32(6):759–69.https://doi.org/10.1007/S00299-013-1406-5..
- 35。
孔勇,朱勇,高超,佘伟,林伟,陈勇,等。拟南芥中SMALL AUXIN UP RNA41的组织特异性表达差异调控细胞扩张和根分生组织模式。植物生理学杂志。2013;54(4):609-21。https://doi.org/10.1093/pcp/pct028.
- 36.
Spartz Ak,Lee Sh,Wenger JP,Gonzalez N,Itoh H,Inzéd等。小植物中的Saur19亚家族,促进RNA基因促进细胞膨胀。植物J. 2012; 70(6):978-90。https://doi.org/10.1111/j.1365-313X.2012.04946.x.
- 37.
Dudit D,Ábraháme,miskolczi p,ayaydin f,Bilgin m,Horváthgv。细胞周期控制作为钙,激素和发育信号的靶标:磷酸化在视网膜间血栓瘤的途径中的作用。Ann Bot。2011; 107(7):1193-202。https://doi.org/10.1093/aob/mcr038.
- 38.
Hartig K,植物细胞周期中的植物蛋白,细胞质素和糖之间的Beck E.串扰。植物BIOL。2006; 8(03):389-96。https://doi.org/10.1055/s-2006-923797.
- 39.
Roudier F,Fedorova e,lebris m,leecomte p,györgyeyj,vaubert d等。MedicaCo物种A2系型Cyclin是助规调节的,并参与Meristem形成,但可分配用于结核相关的发育计划。植物理性。2003; 131(3):1091-103。https://doi.org/10.1104/pp.102.011122.
- 40。
奥乔亚·比利亚雷亚尔M、艾斯普鲁·埃尔南德斯E、巴尔加斯·阿里斯普鲁一世、马丁内斯·泰莱斯MÁ。植物细胞壁聚合物及其衍生物的功能、结构和生物活性。聚合。2012;4:63–86.
- 41。
袁勇,徐鑫,龚卓,唐勇,吴敏,闫芳,等。生长素响应因子6A调控番茄的光合作用、糖积累和果实发育。Hortic杂志2019;6(1):1 - 16。
- 42。
雷尔·德尔,克莱兰·雷尔。生长素诱导细胞伸长的酸生长理论是有生命力的。植物生理学。1992;99(4):1271–4.https://doi.org/10.1104/pp.99.4.1271.
- 43。
Kutschera U, Briggs WR。生长素诱导的豌豆节间细胞壁合成的快速刺激。国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.84.9.2747.
- 44.
Ranocha P, Dima O, Nagy R, Felten J, Corratgé-Faillie C, Novák O等。拟南芥WAT1是植物生长素稳态所需的液泡型植物生长素转运促进剂。Nat Commun。2013;4(1):1 - 9。
- 45.
Vanholme R,Storme V,Vanholme B,Sundin L,Christensen JH,Goeminne G,等。拟南芥Lignin生物合成扰动的响应的系统生物学观点。植物细胞。2012; 24(9):3506-29。https://doi.org/10.1105/TPC.112.102574.
- 46。
Lehman Ta,Sanguinet Ka。拟南芥纤维素合成酶突变体径向溶胀的植物蛋白和细胞壁串扰。植物细胞生理。2019; 60(7):1487-503。https://doi.org/10.1093/pcp/pcz055.
- 47。
Dobin A,Davis Ca,Schlesinger F,Drenkow J,Zaleski C,JHA S等人。星:超快通用RNA-SEQ对齐器。生物信息学。2013; 29(1):15-21。https://doi.org/10.1093/bioinformatics/bts635.
- 48.
Chen K,Fessehaie A,arora R.参考基因的选择在种子引发过程中促进基因表达和Zea Mays和Spinacia Oleracea的QPCR萌发。植物mol biol报告。2012; 30(2):478-87。https://doi.org/10.1007/S11105-011-0354-011-0354- 011-0354-.
- 49.
阿诺迪。铜酶在分离的叶绿体中。β寻常的多酚氧化酶。植物理性。1949; 24(1):1。
致谢
不适用。
资金
福建省自然科学基金资助:马晓凯(项目编号:2018 J01606)。
作者信息
从属关系
贡献
m.f.r.m.和M.X构思了这个项目并设计了实验。m.f.m.x和zp进行了实验,M.Z和M.F.对实验数据进行了分析。M.F.写了手稿。R.M.和M.X修改了手稿。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
不同样本的统计摘要。表S2。差异表达基因的LOG2FC涉及不同途径。表S3。在QRT-PCR中使用的序列。图S1。A)菠菜性别类型B)萼片保护种子表型C)‘cornell -9’菠菜雌花授粉后12 h花粉管生长特征图S2。KO浓缩分析在成对分析中,括号中的值()显示了每个KO项的Q值。图S3。两两分析中上调和下调的DEGs的GO富集分析,括号()中的值表示GO各项的q值。
权利和权限
开放获取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
马鑫,周平。et al。生长素调控菠菜授粉后萼片保持和发育的代谢变化。BMC植物杂志21日,166(2021)。https://doi.org/10.1186/s12870-021-02944-4
收到了:
接受:
出版:
关键字
- 授粉
- 萼片发展
- 生长素生物合成
- 菠菜