- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
用丛枝菌根真菌接种大豆植物的生理生化反应gydF4y2BaBradyrhizobium.gydF4y2Ba在干旱胁迫下gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba, 文章编号:gydF4y2Ba195gydF4y2Ba(gydF4y2Ba2021.gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
本研究旨在研究丛枝菌根真菌(AMF)生物肥料潜力的影响gydF4y2BaBridyrhizobium japonicumgydF4y2Ba(gydF4y2BaB. japonicum.gydF4y2Ba)对干旱胁迫大豆(Giza 111)荚果早期(播种后50 d, R3)和种子发育期(播种后90 d, R5)产量和生长的影响。gydF4y2Ba
结果gydF4y2Ba
在R3和R5期,未受水分胁迫的植株生物量、叶片叶绿素含量、结瘤率和籽粒产量均高于受水分胁迫的植株。在根际水平,AMF和gydF4y2BaB. japonicum.gydF4y2Ba在水分充足和干旱胁迫条件下,处理提高了细菌数量和酶(脱氢酶和磷酸酶)活性。不考虑干旱的影响,AMF和gydF4y2BaB. japonicum.gydF4y2Ba与未处理相比,在干旱(限制灌溉)和充足水分条件下,处理均能提高大豆的生长和产量。目前的研究表明,AMF和gydF4y2BaB. japonicum.gydF4y2Ba干旱胁迫下,种子中过氧化氢酶(CAT)和过氧化物酶(POD)含量增加,丙二醛(MDA)和脯氨酸含量下降。的相对表达gydF4y2Ba猫gydF4y2Ba和gydF4y2Ba圆荚体gydF4y2Ba通过在干旱胁迫条件下施用生物元化器治疗来上调基因。有趣地在涉及脯氨酸代谢的基因的相对表达的情况下观察到逆向趋势gydF4y2BaP5CS.gydF4y2Ba,gydF4y2BaP5CR.gydF4y2Ba,gydF4y2BaPDH、gydF4y2Ba和gydF4y2BaP5CDHgydF4y2Ba在相同的条件下。本研究表明,生物元化器减少了干旱胁迫对细胞发育的抑制作用,并导致DNA积累和细胞分裂循环的时间较短。参与次生新陈代谢和表达水平的酶活性的显着变化gydF4y2BaGmSPS1gydF4y2Ba,gydF4y2BaGmSuSy,gydF4y2Ba和gydF4y2BaGMC-INV.gydF4y2Ba在用生物元化器处理并在R3和R5阶段暴露于干旱胁迫的植物中。这些次生新陈代谢活性的变化及其由生物元经济体引起的转录水平可能有助于提高大豆对干旱胁迫的耐受性。gydF4y2Ba
结论gydF4y2Ba
本研究的结果表明,生物元ilizers对大豆植物的应用是一种有希望的方法,可缓解对大豆植物生长性能的干旱胁迫影响。生物元体的综合应用可能有助于获得农业生态系统的改善,以对气候变化的不利影响,并有助于改善干旱胁迫下的土壤肥力和植物生长。gydF4y2Ba
背景gydF4y2Ba
水资源日益短缺是全球粮食生产面临的巨大挑战,特别是在干旱和半干旱地区[gydF4y2Ba1gydF4y2Ba].埃及是最近是水资源赤字约束的国家之一,最近由于种群的快速增加而与尼罗河水的固定份额(每年555亿立方米)相结合。因此,开发与现代农业实践融合的新技术很大,可以作为埃及可持续农业的替代战略。大豆(gydF4y2Ba甘氨酸最大gydF4y2BaL.)是一个重要的豆科作物,并考虑世界上最有价值的油籽作物,含有约18-22%的无胆固醇油,其中85%不饱和脂肪酸和40-42%蛋白[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].最近的研究报告称,大豆生产需要足够的供水以实现高收益率[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].然而,植物只能在一定限度(阈值水平)内忍受水分胁迫,超过这个限度,产量就会严重下降[gydF4y2Ba6gydF4y2Ba].以大豆为例,据报道,在40%田间容量时,植株经历严重的干旱胁迫[gydF4y2Ba7gydF4y2Ba].它的存在是由于土壤在一定时间内水分不足,因此植物可利用的水分有限[gydF4y2Ba8gydF4y2Ba].先前的研究表明,与水分充足的条件相比,水分不足会使大豆产量减少40% [gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].因此,所有植物生理过程,如细胞趋势,光合过程,细胞,组织和器官的生长受干旱胁迫的影响[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
因此,干旱胁迫可以显着降低大豆叶中叶绿素A,B和总叶绿素的含量[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba],可以在植株中积累较高的脯氨酸含量[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].此外,大豆中的POD、CAT等抗氧化酶在非生物胁迫下被高度激活[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba],特别是在水分压力下[gydF4y2Ba21gydF4y2Ba],适应,控制和清除干旱胁迫诱导的自由基,伴随MDA的较高积累[gydF4y2Ba14gydF4y2Ba].前一项研究表明,干旱条件下大豆的生物质产量下降[gydF4y2Ba22gydF4y2Ba],并且水缺损的负面影响根据大豆暴露于干旱胁迫的生长阶段而变化。gydF4y2Ba
在这种背景下gydF4y2Ba,gydF4y2Ba将大豆植物暴露于营养期间短时间内的中等干旱增加,增加了植物在后期发育阶段的干旱过程中的适应[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].类似的报道表明,当植物在植物阶段期间仅在短时间内暴露于中度土壤水分缺陷时,大豆产量并未受到不利影响[gydF4y2Ba25gydF4y2Ba].在另一项研究中,在开花之前经历干旱的大豆植物产生的种子产量高于开花后的植物,因为在早期生长阶段暴露于干旱的植物之前已经在开花之前为适应性反应建立了更大的根系系统[gydF4y2Ba26gydF4y2Ba].因此,在开花和荚填充阶段期间,大豆植物对干旱胁迫非常敏感[gydF4y2Ba4gydF4y2Ba].然而,Pod扩大和种子填充阶段的水缺损对最终产量和产量组分具有显着的负面影响[gydF4y2Ba27gydF4y2Ba].因此,制定切实可行的策略以减少水分亏缺对大豆生产的不利影响是一个迫切需要解决的问题。gydF4y2Ba
植物生长促进微生物,如gydF4y2BaB. japonicum.gydF4y2BaAMF是最有前途的策略之一,通过生物固氮和磷在土壤和根际的溶解过程,提高植物对养分的有效性,以促进植物生长[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].这些微生物还可以通过调节1-氨基环丙烷-1-羧酸盐脱氨酶表达,并诱导植物激素信号来缓解应力效应。gydF4y2Ba30.gydF4y2Ba].DUC等人。[gydF4y2Ba31gydF4y2Ba]表示AMF接种,特别是gydF4y2BaSeptoglomus crountictumgydF4y2Ba缓解干旱和热应激对番茄植物的不利影响。此外,AMF通过改善矿物质营养和水采集,可以通过改善矿物质营养和水采集来增强植物耐受性,从而提高作物产量[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba],也会影响充足水分和受干旱胁迫的寄主植物的水分平衡[gydF4y2Ba34gydF4y2Ba].AMF可以干扰气孔导度从而提高对干旱胁迫的耐受性[gydF4y2Ba35gydF4y2Ba]但是通过刺激更高的酶促和非酶促抗氧化活性降低氧化损伤[gydF4y2Ba36gydF4y2Ba].此外,据报道,AMF调节水上蛋白基因表达模式[gydF4y2Ba37gydF4y2Ba]并改变叶组织中的脯氨酸含量[gydF4y2Ba38gydF4y2Ba众所周知,豆科植物可以建立与根茎的特异性共生关系,如gydF4y2Ba根序gydF4y2Ba,gydF4y2BaBradyrhizobium.gydF4y2Ba,gydF4y2BaSinorhizobium.gydF4y2Ba,gydF4y2BaAzorhizobiumgydF4y2Ba,gydF4y2Ba中丘gydF4y2Ba,gydF4y2Baallorhizobium.gydF4y2Ba[gydF4y2Ba39gydF4y2Ba].这些根瘤菌在农业中发挥着重要作用,因为它们具有生物固氮的能力,从而减少了对化学氮肥的需求[gydF4y2Ba40gydF4y2Ba].然而,与宿主植物,细菌种类和仿生土壤变量有关的几个因素,特别是干旱,可以限制氮固定对植物生长性能的贡献[gydF4y2Ba41.gydF4y2Ba].最近的一项研究表明,接种土壤gydF4y2Ba根序gydF4y2Ba菌株增加染色,氮素同化和豆类产量[gydF4y2Ba42.gydF4y2Ba].而且,gydF4y2BaBridyrhizobium japonicumgydF4y2Ba有效地改善了大豆的生长、结瘤、固氮、氮、磷、钾(NPK)的获取和种子产量[gydF4y2Ba43.gydF4y2Ba].gydF4y2Ba
本研究的假设是gydF4y2BaB. japonicum.gydF4y2BaAMF可提高大豆植株对矿质养分的有效性,缓解水分亏缺对大豆生长的影响。因此,从生产性状、光合作用、代谢产物等方面全面分析大豆植株抗旱的主要生理生化和分子机制,以阐明大豆植株抗旱适应的潜在机制。此外,还对抗氧化酶和脯氨酸代谢及其相关基因进行了研究,以进一步阐明AMF和根瘤菌在干旱胁迫下促进大豆生长的潜在能力。因此,本研究旨在了解、评价和最大限度地利用微生物接种技术,为其作为缺水地区高产抗旱大豆栽培的替代施肥技术提供理论和实践依据。gydF4y2Ba
方法gydF4y2Ba
实验网站gydF4y2Ba
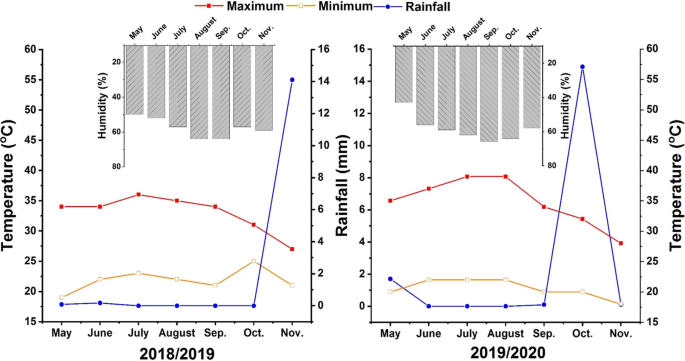
埃及曼苏拉大学农业农场进行了现场实验2年,埃及农业农场(27.00gydF4y2Ba°gydF4y2Ba从5月到11月,N,30.00°E)。数字gydF4y2Ba1gydF4y2Ba在两个季节介绍研究区域的气象数据。土壤纹理是粘土壤土,表gydF4y2Ba1gydF4y2Ba表明了试验土壤的一些理化和生物学特性。gydF4y2Ba
农艺实践gydF4y2Ba
苗床采用圆盘犁和平垄作。地块大小为3米× 3.5米,有4条2.5米长的脊。大豆品种种子。吉萨111是从埃及Kafr El-Sheikh的Sakha农业研究站采购的。种子先用次氯酸钠消毒,然后用消毒水冲洗,再用微生物接种剂浸泡后播种。菌根接种:在每座山接种苏丹草陷土5 g和病根0.5 g,播种前接种于土壤表层以下5 cm处。之后,在间隔25厘米的垄肩上人工播种(每山3粒),垄距为70厘米。gydF4y2Ba
3周后,将植株减薄,以保持每山两株。肥料用量分别为180、361、120 kg hm - 2gydF4y2Ba−1gydF4y2Ba使用尿素(46%N),磷(46%N),磷酸钙(N),磷(P)和钾(K)(15.5%P.gydF4y2Ba2gydF4y2BaOgydF4y2Ba5gydF4y2Ba)和硫酸钾(48%K.gydF4y2Ba2gydF4y2Bao)分别作为来源。gydF4y2Ba
该治疗在带有四个重复的条形图设计中,其中施肥的不同处理(无施肥,100%NPK,50%NPK,gydF4y2BaB. japonicum.gydF4y2Ba + 50% NPK, Mycorrhiza + 50% NPK,B. japonicum.gydF4y2Ba + Mycorrhiza + 50% NPK) were serving as the vertical plots. While the irrigation treatments (withholding irrigation at R3 and withholding irrigation at R5) were serving as horizontal plots.
灌溉根据埃及大豆产量的优化建议(550毫米/总增长期)进行,并根据埃及Mansoura地区大豆种植制度的当地农民灌溉实践。该灌溉管理如下:首先在播种15天后,首先用10%的总水要求灌溉图。下列灌溉事件以25%(营养生长)为15天的间隔施用,25%(开花R1至早期POD R3)和35%(POD开发到POD填充R4-R6)的阶段的总需求生长,而在成熟期间土壤自然干燥(5%)。为了诱导干旱胁迫,在早期豆荚的阶段(从播种,R3)和种子发育(从播种,R5),在两个赛季,灌溉,灌溉持续2周。灌溉水从附近的池塘泵送,并通过管道引起地图,并通过水表测量淡水的量。通过使用校准的pH计,在1:5土壤和水提取物中测量土壤pH。用手控制杂草,并且STOMP(BASF)500(4升/公顷)也用作除草剂以控制杂草。所有上述农艺实践都是针对所有治疗均匀进行的。gydF4y2Ba
Bradyrhizobium剂制备gydF4y2Ba
B. japonicum.gydF4y2BaUSDA-110是从埃及Kafr El-Sheikh Kafr El-Sheikh的细菌学实验室获得的。然后,在酵母提取物甘露醇(YEM)中,对吲哚乙酸(IAA)产生进行测试的菌株[gydF4y2Ba44.gydF4y2Ba,根据Ahmad等人的方法添加0.1%的l -色氨酸[gydF4y2Ba45.gydF4y2Ba]及在Pikovaskya液体介质中溶解磷酸盐[gydF4y2Ba46.gydF4y2Ba],并补充磷酸三钙[gydF4y2Ba47.gydF4y2Ba].剂制备,gydF4y2BaB. japonicum.gydF4y2BaUSDA-110在30°C下在YEM培养基上生长5天,直至达到培养密度(1.3×10gydF4y2Ba9gydF4y2Bacfu /毫升)。将大豆种子接种gydF4y2BaB. japonicum.gydF4y2Ba根据Gao等人的研究[gydF4y2Ba29gydF4y2Ba].简而言之,将种子浸泡在含有阿拉伯胶(16%)的微生物孕育剂中,作为粘合剂30分钟,在空气中留干,然后移植种子。通过第二次灌溉,每株植物也将另外的培养物(10mL)加入。非细菌处理接收相等量的高压灭菌的接种以提供相同的营养素。gydF4y2Ba
菌根接种物准备gydF4y2Ba
AMF的孢子gydF4y2BaGlomus Clarum.gydF4y2Ba,gydF4y2BaGlomus Mosseae,gydF4y2Ba和gydF4y2BaGigaspora Margarita.gydF4y2Ba是由埃及曼苏拉大学理学院植物系培育而成,在gydF4y2Ba高粱苏丹斯gydF4y2Ba坚持。根作为寄主植物传播。五克被捕获的土壤含有约50孢子ggydF4y2Ba−1gydF4y2Ba土壤和0.5克受感染的苏丹草根(70%的定植指数)根据Asrar等人的研究接种菌根治疗。[gydF4y2Ba48.gydF4y2Ba].gydF4y2Ba
染色,估计菌根定殖和微生物计数的测定gydF4y2Ba
在种植120天后,用0.05%台盼蓝染色大豆植物的新鲜根[gydF4y2Ba49.gydF4y2Ba].定殖水平由Trouvelot等人的方法估计[gydF4y2Ba50.gydF4y2Ba],使用Mycocalc软件(湖北武汉)。通过剧烈摇动将土壤与根部分离,然后将土壤通过2mm的滤网,得到散装级分。剩余的细根(<2mm)和土壤在塑料容器中轻轻摇动1分钟,将土壤聚集体(0.5-5mm)与根圈分开,产生根际馏分[gydF4y2Ba51.gydF4y2Ba].在大豆植株种植120 d后的根际,在营养琼脂培养基(oxoid, UK)和Pikovskaya培养基上计数细菌总数和溶磷细菌[gydF4y2Ba46.gydF4y2Ba[Gao等人的方法。[gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
形态生理,旋转和谷物产量gydF4y2Ba
随机,每块块的四株植物于9月15日选择,用于测量根长,植物干重,分支/植物数量,以及叶绿素含量。根据我们之前的研究,在使用Spad-502(Minolta Co. Ltd.)的Spad-502(Minolta Co. Ltd.)在最年轻的完全扩展叶的中点确定叶绿素含量[gydF4y2Ba29gydF4y2Ba].虽然计算每种植物根部的结节数,并且它们的平均值表示为每种植物的结节数。在成熟阶段(11月1日)结束时,收获了植物,测定了每张幼群的籽粒产量。gydF4y2Ba
酶提取和生化分析gydF4y2Ba
根据张等人,在根际测定脱氢酶和酸性磷酸酶的活性。[gydF4y2Ba52.gydF4y2Ba根据Sheteiwy等人的方法测定了新鲜种子中CAT、POD等抗氧化酶的含量[gydF4y2Ba21gydF4y2Ba[简要地,在冰冷的条件下,将种子样品(各自0.5g)在8ml 50mM磷酸钾缓冲液(pH7.8)中均化。然后,在4℃下以10000×g离心20分钟的匀浆,并根据Salah等人的方法使用上清液进行豆荚和猫的测定。[gydF4y2Ba53.gydF4y2Ba].蔗糖合酶(SuSy)、蔗糖磷酸合酶(SPS)、酸性转化酶(AI)活性测定方法参照Jiang等[gydF4y2Ba54.gydF4y2Ba].脯氨酸的测定方法参照Sheteiwy等[gydF4y2Ba21gydF4y2Ba].根据周和谷杉的方法,将脂质过氧化测量为MDA含量[gydF4y2Ba55.gydF4y2Ba].gydF4y2Ba
流式细胞仪分析和转录水平分析gydF4y2Ba
根据HU等人的方法,从种子中进行核隔离。[gydF4y2Ba56.gydF4y2Ba].根据我们之前的研究,我们分析了新鲜种子中抗氧化剂、脯氨酸和次生代谢的转录水平[gydF4y2Ba13gydF4y2Ba].简而言之,使用杵和砂浆在液氮中彻底研磨冷冻的种子(每次100mg)。此后,从种子中分离总RNA,通过Nanodrop 2000 / 2000c(Thermo Scientific,USA)测定RNA的浓度。分光光度计也通过分量光度计检查RNA纯度,该方法在定量实时PCR之前的260/280nm比。使用Sybr Premix前Taq(Takara,Japan)进行定量实时RT-PCR。本研究中使用的PCR程序与Sheteiwy等人最近使用的相同。[gydF4y2Ba13gydF4y2Ba].所有基因的前向(F)和反向(R)引物的序列(5'-3')呈现在补充表S中gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
用双向ANOVA评估治疗的差异,考虑干旱应激和生物元分ilimers作为固定因子。目前的结果是三个重复±标准偏差(SD)的方法。通过使用IBM-SPSS统计包的差异分析数据(IBM-SPS,19,USA)来分析数据。通过在研究因素的水平之间的0.05级的0.05级的0.05级的显着性中应用Duncan的多个范围试验来进行比较。星号表示显着差异:*gydF4y2BaP
结果gydF4y2Ba
植物生长促进性状gydF4y2BaB. japonicum.gydF4y2BaUSDA-110.gydF4y2Ba
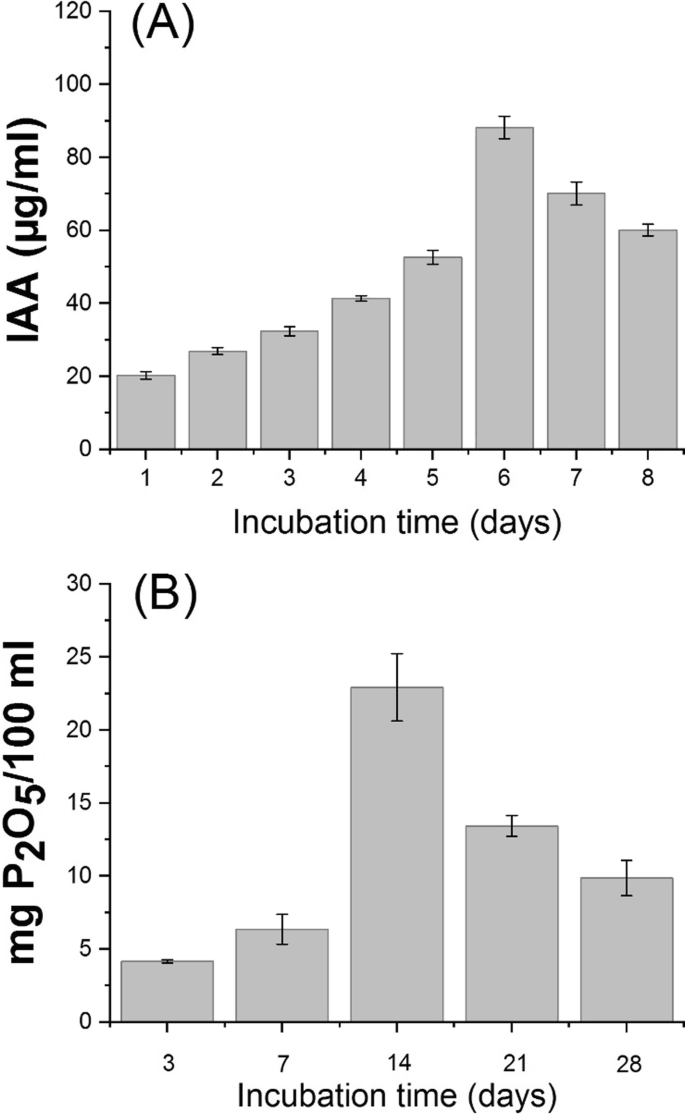
结果在图2中呈现。gydF4y2Ba2gydF4y2Ba表明细菌菌株的能力(gydF4y2BaB. japonicum.gydF4y2Ba(USDA-110)产生IAA并有效溶解磷酸盐。从培养第1天开始,IAA逐渐升高,在第6天达到最大值(88.20 μg/ml),然后IAA产量逐渐下降(图2)。gydF4y2Ba2gydF4y2Ba一种)。因此,在孵育14天后,最大可溶性磷释放为22.92mg p / 100ml培养,然后随着培养期的前进而降低(图。gydF4y2Ba2gydF4y2Bab)。gydF4y2Ba
生物元化器对干旱胁迫下植物生物质和叶绿素含量的影响gydF4y2Ba
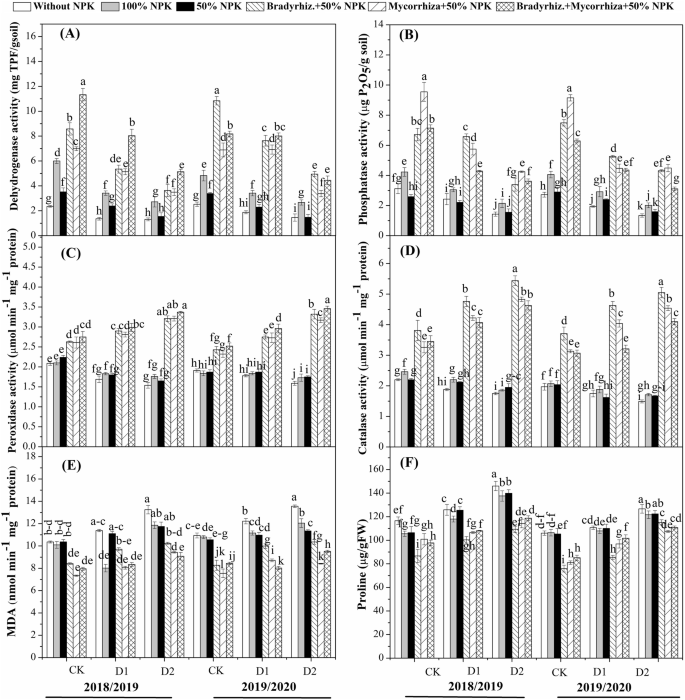
表中提出了关于受生物元体施用的施用施用的态化生理性状的平均数据gydF4y2Ba2gydF4y2Ba.在正常灌溉下生长的大豆幼苗具有最高的根长度和植物干重,与在R3的预备水下的植物中生长的植物在r3和r5阶段在两种生长季节。与R3阶段的预灌溉灌溉灌溉的植物中,观察到根长度和干重的最低值,与R5阶段的预制灌溉和生长季节的完整灌溉(表gydF4y2Ba2gydF4y2Ba).无论干旱胁迫影响,AMF和gydF4y2BaBradyrhizobium.gydF4y2Ba与未处理的植物相比,治疗改善了植物的根长和干重。在植物中观察到根长和干重的最低值,没有生物元化器治疗并在生长季节的R3下暴露于水缺水。随着应用而改善了根长gydF4y2BaBradyrhizobium.gydF4y2Ba35.7,12.1和29.5%;随着42.0,20.7和36.8%的施用,其组合在38.9,16.46,33.0%,与对照,100%NPK和50%NPK相比,它们的组合分别为38.9,16.46%,而且它们的组合分别为38.9,16.46,33.0%。植物干重随着应用而改善gydF4y2BaBradyrhizobium.gydF4y2Ba59.3,13.5和34.8%;随着对照,100%NPK和50%NPK(表格)相比,在63.2,21.8和41.0%的情况下,其组合均为63.2,21.8和41.0%,其组合在增长季节中,分别与对照,100%NPK和50%NPK(表gydF4y2Ba2gydF4y2Ba).在R3和R5两个生长季,不灌水的植株叶绿素含量均低于灌水较好的植株。叶绿素含量随施用而提高gydF4y2BaBradyrhizobium.gydF4y2Ba54.3,27.1和35.4%;随着对照,100%NPK和50%NPK(表格)相比,随着对照,100%NPK和50%NPK的比较(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
结果表明gydF4y2BaBradyrhizobium.gydF4y2Ba在两个生长季节,AMF及其组合均提高了干旱胁迫和良好灌溉植物的单株分枝数gydF4y2Ba3.gydF4y2Ba).在R3和R 5的预扣灌溉均导致每株植物的植物良好植物的植物每种植物的分支数量减少。随着应用的应用,每个植物的分支数量得到改善gydF4y2BaBradyrhizobium.gydF4y2Ba52.1,15.3和35.8%;随着对照,100%NPK和50%NPK的比较,随着46.6,5.7和28.5%的施加46.6,.7和28.5%,其组合在48.7,9.3,31.3%中,繁殖季节均为48.7,9.3,31.3%。这些结果表明,与未处理的植物相比,生物元化器通过改善植物的培训和氮固定能力通过调节和氮固定能力来减少干旱胁迫的有害影响gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
生物元化器对干旱胁迫下瘤瘤瘤瘤产量的影响gydF4y2Ba
表中提出了关于结节数和谷物产量的平均数据gydF4y2Ba3.gydF4y2Ba.结果表明,用gydF4y2BaBradyrhizobium.gydF4y2Ba与未接种的植物相比,AMF及其组合显著增加了根瘤数量(表1)gydF4y2Ba3.gydF4y2Ba).另外,在干旱胁迫下,在植物暴露于R3和R5阶段的干旱胁迫时,促进胁迫下的染色胁迫下降,并且在R3阶段暴露于干旱胁迫的植物中突出这种减少(桌子gydF4y2Ba3.gydF4y2Ba).同样,与完全灌溉相比,在两个生长季的R3和R5阶段停止灌溉对粮食产量也有负面影响。可以说,随着应用,粮食产量得到了提高gydF4y2BaBradyrhizobium.gydF4y2Ba分别为57.0、5.9和25.9%;随着对照,100%NPK和50%NPK(表gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
生物元化器对干旱胁迫下土壤酶的影响gydF4y2Ba
结果表明,随着生长季节的完整灌溉(图。gydF4y2Ba3.gydF4y2BaA和B)。然而,与生物晶片的接种器在无论是生长季节的对照植物相比,根际土壤中具有改善的根际土壤的脱氢酶和磷酸酶活性。观察到最高的脱氢酶活性在繁殖季节中的组合处理,而在R3阶段预制灌溉外,观察到磷酸酶活性的最高值,除了普照阶段,较高gydF4y2BaBradyrhizobium.gydF4y2Ba- 两种生长季节的植物(图。gydF4y2Ba3.gydF4y2Ba).随着应用而改善了脱氢酶活性gydF4y2BaBradyrhizobium.gydF4y2Ba73.4,43.7和64.4%;随着对照,100%NPK和50%NPK的比较,AMF在76.1,49.3,67.9%的组合中施加66.4,29.7和55.5%,其组合分别为增长季节。用磷酸酶活性随着应用而得到改善gydF4y2BaBradyrhizobium.gydF4y2Ba分别为57.0、5.9和25.9%;与对照、100% NPK和50% NPK相比,在两个生长季施用AMF分别增加61.5、45.3和60.8%及其组合分别增加65.5、51.0、64.9%(图2)。gydF4y2Ba3.gydF4y2Ba).这些发现证明,与这种微生物接种导致无根际土壤中的微生物量和酶活性增加,完整的灌溉以及干旱胁迫。gydF4y2Ba
生物元化器对干旱胁迫下抗氧化酶,脯氨酸,次生代谢和MDA的影响gydF4y2Ba
结果表明gydF4y2BaBradyrhizobium.gydF4y2Ba和AMF及其组合导致植物种子中的最高豆荚和猫活动暴露于r3和r5阶段在繁殖季节的灌溉(图。gydF4y2Ba3.gydF4y2Ba).在两个季节的脯氨酸和MDA的情况下观察到逆转趋势。可以概括,随着应用的应用,POD活性得到改善gydF4y2BaBradyrhizobium.gydF4y2Ba38.6,35.5和35.1%;随着37.1,33.9和33.5%的施用,其组合在41.3,38.3,38.0%的情况下,与对照,100%NPK和50%NPK相比,两种生长季节都分别在生长季节中(图。gydF4y2Ba3.gydF4y2Bac).同时,CAT活性随施胶量的增加而提高gydF4y2BaBradyrhizobium.gydF4y2Ba58.8,54.5和56.8%;随着45.0,49.2和51.7%的施用,其组合在50.9,45.8,48.5%中,与对照,100%NPK和50%NPK相比,它们的增长季节在50.9,45.8,48.5%中(图。gydF4y2Ba3.gydF4y2Bad)。相反,MDA活动的应用下降gydF4y2BaBradyrhizobium.gydF4y2Ba到20.5,1.9和13.8%;通过31.0,22.7和25.1%的AMF施用,它们的组合在35.8,28.14,20.14%,30.4%,分别与对照,100%NPK和50%NPK相比(图。gydF4y2Ba3.gydF4y2Bae)。同样,脯氨酸活性也通过施用减少gydF4y2BaBradyrhizobium.gydF4y2Ba21.9,17.8和19.3%;通过施加17.1,12.9和14.5%,它们的组合在15.0,15.0,15.0,分别与对照,100%NPK和50%NPK相比分别的增长季节增加了15.0,15.0,12.3%(图。gydF4y2Ba3.gydF4y2Baf).因此,目前的研究表明,生物肥料的应用可能具有增加抗氧化系统的潜力,以减少干旱胁迫条件下脂质过氧化诱导的氧化损伤。gydF4y2Ba
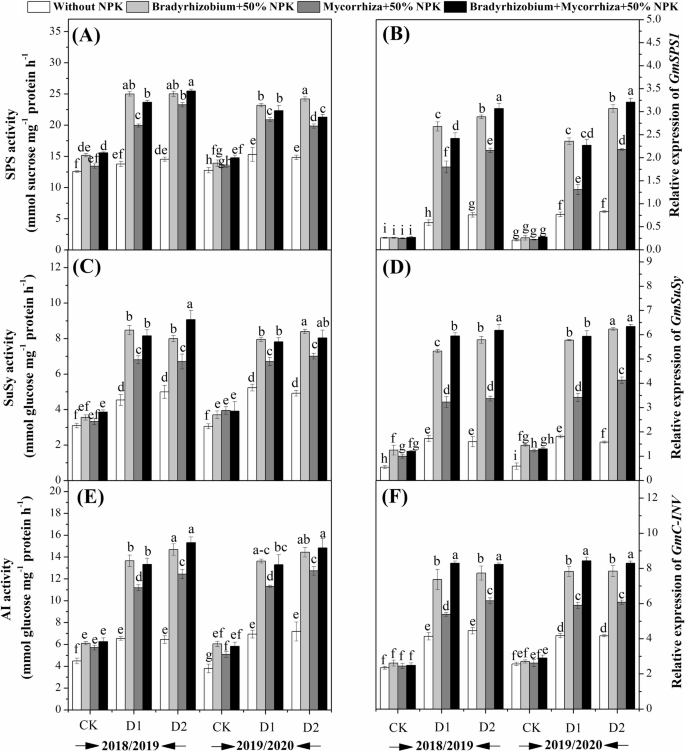
通过接种改善了SPS,SUSY和AI的活动gydF4y2BaBradyrhizobium.gydF4y2Ba菌根及其组合(无花果。gydF4y2Ba4gydF4y2Ba)与未经秘密的植物相比,这在暴露于r3和R5的植物中的植物中发表于植物。SPS的活动(图。gydF4y2Ba4gydF4y2Baa)和susy(图。gydF4y2Ba4gydF4y2Bac) 2018年R5干旱胁迫下联合施用生物肥料的植株,其产量显著提高,而联合施用生物肥料的植株,其产量显著提高gydF4y2BaBradyrhizobium.gydF4y2Ba2019年生长季节(图。gydF4y2Ba4gydF4y2Baa).而在R5干旱胁迫下处理的植物中,AI的活性较高gydF4y2BaBradyrhizobium.gydF4y2Ba单独处理和联合处理之间无显著差异(图2)。gydF4y2Ba4gydF4y2Bae)。gydF4y2Ba
生物肥料对SPS活性的影响gydF4y2Ba一个gydF4y2Ba),Susy(gydF4y2BacgydF4y2Ba),ai(gydF4y2BaegydF4y2Ba);相对表达水平gydF4y2BaGmSPS1gydF4y2Ba(gydF4y2BabgydF4y2Ba);gydF4y2BaGmSuSygydF4y2Ba(gydF4y2BadgydF4y2Ba) 和gydF4y2BaGMC-INV.gydF4y2Ba(gydF4y2BafgydF4y2Ba“干旱胁迫条件下的大豆。意味着共享相同的字母,对于一年中的参数,没有显着差异gydF4y2Baα=gydF4y2Ba学生 - 纽曼 - Keul测试后0.05gydF4y2Ba.gydF4y2BaCK(完整灌溉);D1(R3阶段的扣除灌溉)和D2(R5阶段扣缴灌溉)gydF4y2Ba
生物肥对干旱胁迫下次生代谢、抗氧化酶和脯氨酸转录水平的影响gydF4y2Ba
相对表达gydF4y2BaGmSPS1gydF4y2Ba在干旱胁迫下,生物肥料处理在两个生长季均上调(图2)。gydF4y2Ba4gydF4y2Bab)。gydF4y2BaGmSPS1gydF4y2Ba在用组合治疗处理的植物中仅明显上调并在R5阶段暴露于干旱。同样,gydF4y2BaGmSuSygydF4y2Ba在暴露于R3和R5阶段的干旱胁迫下的植物中显着上调表达并用gydF4y2BaBradyrhizobium.gydF4y2Ba和组合治疗(图。gydF4y2Ba4gydF4y2Bad)。虽然表达水平gydF4y2BaGMC-INV.gydF4y2Ba在暴露于R3和R5的植物中的植物中的植物显着改善,并在生长季节的组合治疗(图。gydF4y2Ba4gydF4y2BaF)。受施用生物肥料和干旱胁迫条件影响,参与抗氧化酶活性和脯氨酸代谢的基因的相对表达量的平均值如图所示。gydF4y2Ba5gydF4y2Ba.结果表明gydF4y2Ba猫gydF4y2Ba和gydF4y2Ba圆荚体gydF4y2Ba与对照相比,在两个生长季节,施用生物肥料和干旱胁迫的影响下,种子中的表达水平均上调。gydF4y2Ba5gydF4y2Baa和b).的更高表达gydF4y2Ba猫gydF4y2Ba在R5阶段,AMF和gydF4y2BaBradyrhizobium.gydF4y2Ba(图。gydF4y2Ba5gydF4y2Baa),虽然gydF4y2Ba圆荚体gydF4y2Ba结果表明,经AMF和AMF处理的植株在R3期表达量较高gydF4y2BaBradyrhizobium.gydF4y2Ba在两季(图。gydF4y2Ba5gydF4y2Bab)与其各自的对照相比。可以得出结论,适用gydF4y2BaBradyrhizobium.gydF4y2Ba,AMF及其组合改善了表达水平gydF4y2Ba猫gydF4y2Ba分别为76.6,72.6和67.6%,gydF4y2Ba圆荚体gydF4y2Ba与对照相比,在两个生长季节中分别提高了78.1、74.7和73.6%。相反,参与脯氨酸代谢的基因,如gydF4y2BaP5CS.gydF4y2Ba,gydF4y2BaP5CR.gydF4y2Ba,gydF4y2BaPDH、gydF4y2Ba和gydF4y2BaP5CDHgydF4y2Ba通过施用生物元透析剂处理被抑制(图。gydF4y2Ba5gydF4y2BaC-F)。可以得出结论,适用gydF4y2BaBradyrhizobium.gydF4y2Ba, AMF及其组合降低了gydF4y2BaP5CS.gydF4y2Ba64.9,55.6和54.9%,gydF4y2BaP5CR.gydF4y2Ba分别为0.53、46.9和42.4%,gydF4y2BaPDH.gydF4y2Ba58.9,53.5和55.3%,和gydF4y2BaP5CDHgydF4y2Ba与两种生长季节的各自对照相比,分别为41.2,33.0和30.2%。gydF4y2Ba
生物肥料对小麦相对表达水平的影响gydF4y2Ba猫gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba);gydF4y2Ba圆荚体gydF4y2Ba(gydF4y2BabgydF4y2Ba);gydF4y2BaP5CS.gydF4y2Ba(gydF4y2BacgydF4y2Ba);gydF4y2BaP5CR.gydF4y2Ba(gydF4y2BadgydF4y2Ba);gydF4y2BaPDH.gydF4y2Ba(gydF4y2BaegydF4y2Ba) 和gydF4y2BaP5CDHgydF4y2Ba(gydF4y2BafgydF4y2Ba“干旱胁迫条件下的大豆。意味着共享相同的字母,对于一年中的参数,没有显着差异gydF4y2Baα=gydF4y2Ba学生 - 纽曼 - Keul测试后0.05。CK(完整灌溉);D1(R3阶段的扣除灌溉)和D2(R5阶段扣缴灌溉)gydF4y2Ba
生物元化器对干旱胁迫下细菌数量和菌根定殖的影响gydF4y2Ba
在干旱胁迫和不干旱胁迫下,化学和生物肥料对大豆根际分离细菌数量的影响见表gydF4y2Ba4gydF4y2Ba.无论干旱的效果如何,从用生物元经氧化剂处理的植物的根际分离的总细菌计数和磷酸盐溶解的细菌高于化肥处理植物的根际(表gydF4y2Ba4gydF4y2Ba).然而,在两个生长季节,干燥的土壤和重新灌溉会导致细菌数量的增加。与未受干旱胁迫的植物相比,免灌R3期和R5期的根际细菌数量(总数和p增溶剂)最高,其次为免灌。gydF4y2Ba
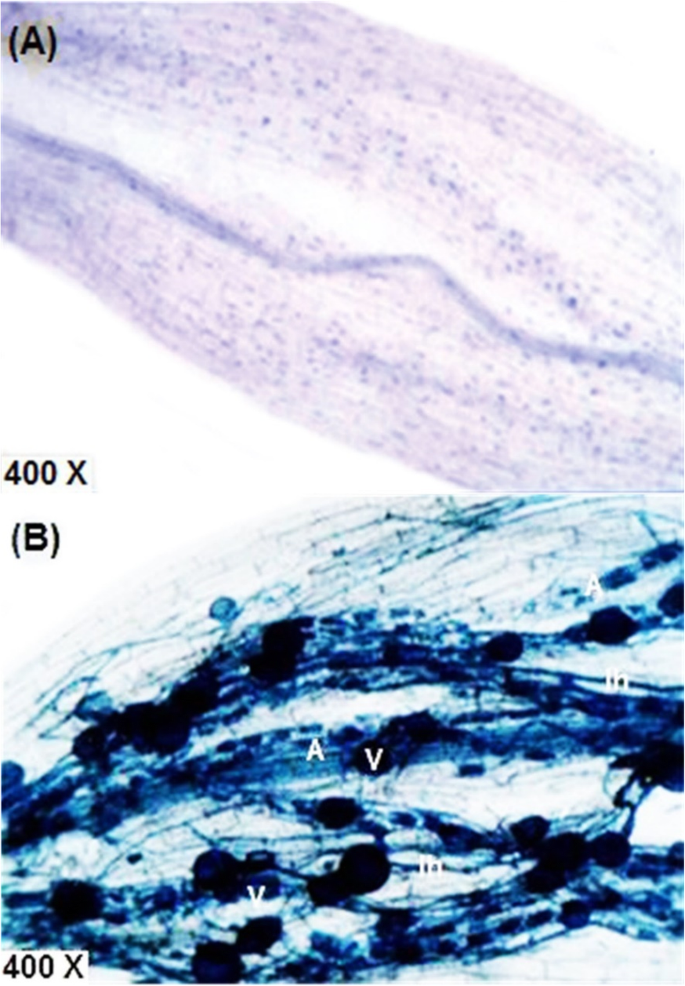
通过使用菌根殖民化的频率如肌肉烧结频率,菌根殖民和丛频的强度受到不同治疗的显着影响,监测植物生长过程中的植物生长期gydF4y2Ba4gydF4y2Ba).Arbsucularycorrohiza真菌的根部定植因菌根和/或与......gydF4y2BaBradyrhizobium.gydF4y2Ba(混合物+ 50%NPK)在生长季节。此外,观察到,响应于干旱胁迫的水平,大豆根部的菌根殖民化的所有估计变量在大豆根中降低。然而,在R5阶段暴露于抑制灌溉的植物的菌根定植高于暴露于R3阶段的预灌溉(表gydF4y2Ba4gydF4y2Ba).在台台虫蓝染的大豆植株的根中观察到不同的结构,如丛枝、囊泡和内部菌丝(图。gydF4y2Ba6gydF4y2Ba).未接种菌根的大豆植株根部未见AM真菌定殖。gydF4y2Ba
生物元化器对干旱处理核DNA含量的影响gydF4y2Ba
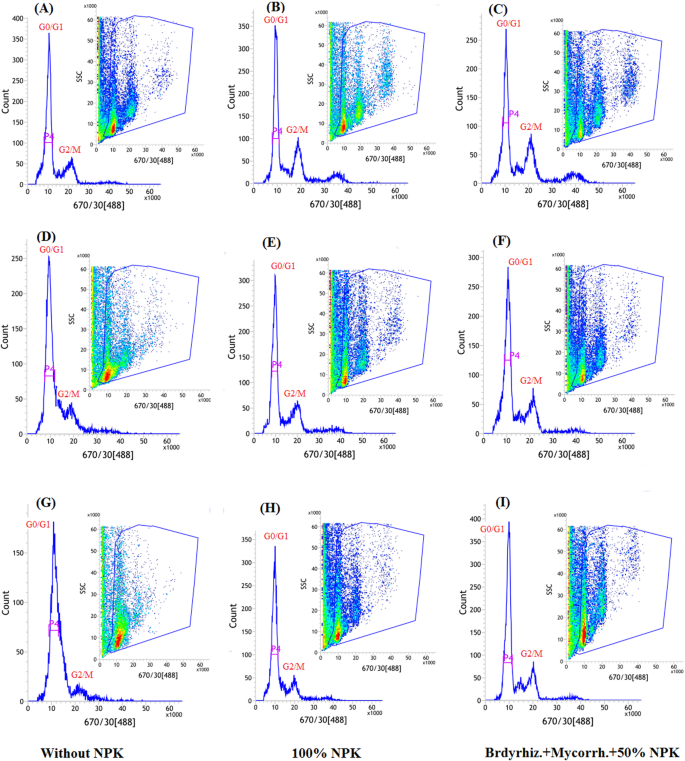
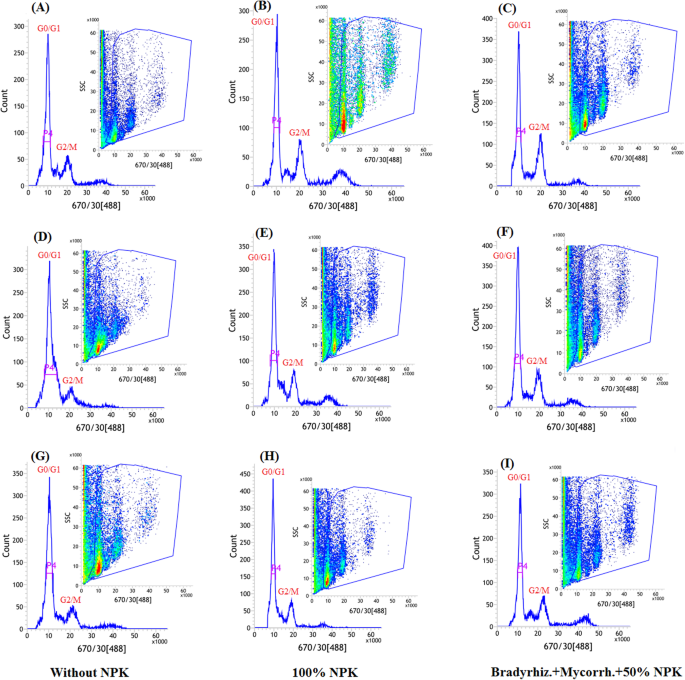
为了探讨生物元透析器相互作用是否可以在干旱胁迫下维持大豆细胞周期进展,使用流式细胞术技术分析核DNA含量(图。gydF4y2Ba7gydF4y2Ba和gydF4y2Ba8gydF4y2Ba).在R3和R5阶段暴露于预扣灌溉的植物,与无资料植物相比,其细胞进展的变化显示(图。gydF4y2Ba7gydF4y2Bad - i和无花果。gydF4y2Ba8gydF4y2Bad - i)。各处理间G0/G1期细胞进展无明显变化。另一方面,R5期受限制灌溉的植株在G2/M期细胞受到阻滞,这在未施用生物肥料的植株中表现得更为明显(图5)。gydF4y2Ba7gydF4y2Ba和gydF4y2Ba8gydF4y2Ba(g-i))。gydF4y2Ba
讨论gydF4y2Ba
最近,生物元经济体生产gydF4y2BaBridyrhizobium japonicumgydF4y2Ba和/或AMF已被证明在水分亏缺条件下的田间试验对大豆生长和产量有显著的效益[gydF4y2Ba57.gydF4y2Ba].然而,大多数研究主要集中在评估大豆产量的数量和质量。在本研究中,不仅已经研究了产量,而且还对土壤,不同生理,生物化学和分子方面的细菌分布和酶活性以及大豆植物的细胞开发,以获得更好的理解改善大豆适应和对干旱胁迫条件的耐受的响应机制。gydF4y2Ba
能力gydF4y2BaB. japonicum.gydF4y2Ba在本研究中也测试了USDA-110来溶解磷酸盐并产生吲哚乙酸。结果表明gydF4y2BaB. japonicum.gydF4y2BaUSDA-110在孵育14天后达到最大活性,随后随孵育期的提前而下降(图2)。gydF4y2Ba2gydF4y2Ba).磷含量随着孵育期的提前而下降,这可能是由于对磷的利用导致磷释放水平的波动,而可溶磷在培养基中的有效性也可能对磷的进一步溶解有抑制作用[gydF4y2Ba29gydF4y2Ba].排泄有毒产品也可能负责P增溶的这种下降。而且,gydF4y2BaB. japonicum.gydF4y2BaUSDA-110可以有效地生产IAA(图。gydF4y2Ba2gydF4y2Ba),另外;gydF4y2BaB. japonicum.gydF4y2BaUSDA-110被证明有效地在大豆植物根部的结节。植物生长促进的所有这些特征可能有助于改善大豆植物的生长。gydF4y2Ba
施用生物肥料的植物根际土壤细菌总数和溶磷细菌数量均高于施用化肥的植物。在本研究中,所有品种均施不同剂量的化肥。细菌数量的增加可能是由于经过生物肥料处理的植物根际养分活力的增加,这些植物为土壤微生物分解有机物提供了所需的能量。菌根化也可减少根分泌物的释放。也观察到干旱胁迫在R3和R5阶段导致细菌数量的增加,这可能是由于土壤干燥,宽再湿润,可以改变有机物的组成及其粒子,使其更容易受到微生物的活动(gydF4y2Ba58.gydF4y2Ba].另外,微生物不一定在干旱胁迫下死亡,但可以通过重新润湿后通过微生物进入休眠阶段以迅速降解的有机材料。同样,Meisner等人。[gydF4y2Ba58.gydF4y2Ba]和lovieno和baath [gydF4y2Ba59.gydF4y2Ba]发现,在滞后期后,重新润湿干燥土壤刺激细菌生长和呼吸。Bloem等人也观察到类似的发现。[gydF4y2Ba60.gydF4y2Ba],表明土壤重新灌溉后的呼吸,N矿化和细菌生长速率的增加。gydF4y2Ba
在这项研究中,单独或结合地接种菌根菌gydF4y2BaBradyrhizobium.gydF4y2Ba提高了大豆植株根组织中菌根定殖水平。在菌根处理中,这种高定殖导致了根系的增加(见表)gydF4y2Ba2gydF4y2Ba),有助于大豆吸收更多的营养和水分。然而,在干旱条件下,菌根定殖水平有所下降,但所使用的菌根物种仍有定植大豆根系的能力(表2)gydF4y2Ba4gydF4y2Ba).类似地,Juge等人[gydF4y2Ba61.gydF4y2Ba据报道,联合治疗gydF4y2BaBradyrhizobium.gydF4y2BaAMF增强了根系的菌根作用。此外,Pavithra和Yapa [gydF4y2Ba62.gydF4y2Ba]观察到干旱胁迫下大豆根系菌根定植量下降,Asrar等[gydF4y2Ba48.gydF4y2Ba]发现受胁迫条件影响的根组织中,菌根殖民化(M)和枝射频率(A)的两种强度显着降低了20%,然而,菌根仍然可以殖民殖民根系。这一发现表明,使用的菌根物种具有在干旱胁迫下进行殖民殖民源性的大豆根,通过改善通过其菌丝的磷营养和吸水性来改变特异性根长,根系结构和增强植物生长。gydF4y2Ba
大豆根际的高微生物活性激活土壤酶主要在浇水和干旱胁迫处理下的生物元ilizers的根际磷酸酶和脱氢酶(图。gydF4y2Ba3.gydF4y2BaA和B)。脱氢酶活性存在于活细胞中,并且基本上依赖于土壤微生物群落的代谢状态,可以被认为是土壤微生物活性的直接测量。然而,土壤磷酸酶在有机P的矿化中是必不可少的[gydF4y2Ba29gydF4y2Ba].高脱氢酶和磷酸酶在有机质分解中具有重要作用和土壤中营养物的易位[gydF4y2Ba63.gydF4y2Ba],这可能是由于细菌和AMF改善土壤理化性质,特别是土壤结构,提高土壤微生物活性的机制。这些结果与Gao等人得到的结果一致[gydF4y2Ba29gydF4y2Ba]和el-sawah等。[gydF4y2Ba64.gydF4y2Ba谁观察到具有含有PGPR和/或AFM的生物元素和/或AFM的生物元素和脱氢酶的活性增加,所述PGPR和/或AFM与根际的细菌计数相关。gydF4y2Ba
在本研究中,大豆的形态生理学和产率受R3和R5阶段的扣乳影响,然而,在生长季节的生物元化器治疗中得到了大豆生长。这可能是由于能力gydF4y2BaBradyrhizobium.gydF4y2Ba固定氮,溶解磷酸盐,产生IAA(图。gydF4y2Ba2gydF4y2Ba),可以与植物生长的改善相结合,此外,AM共生通过增加植物组织中特别的营养物质的浓度来增加植物生长速率。此外,生物氮固定的增加和来自土壤的硝酸盐摄取的相对减少,更集中酸化,这可能有助于从土壤中培养磷酸盐。Jayne和Quigley [gydF4y2Ba65.gydF4y2Ba]报道了菌根在水分亏缺条件下促进植物生长,这可能与AMF在干旱胁迫下提高植物磷营养含量、水分获取和细胞信号传导的能力有关[gydF4y2Ba66.gydF4y2Ba].在本研究中,在两个生长季中,R3期停止灌溉的植株与R5期和对照相比,籽粒产量显著降低。然而,接种gydF4y2BaBradyrhizobium.gydF4y2Ba结果表明:干旱胁迫下,玉米籽粒产量显著增加;之前,Soe等人[gydF4y2Ba67.gydF4y2Ba]报道了联合使用gydF4y2BaB. japonicum.gydF4y2Ba与对照相比,对大豆籽粒产量有显著影响。这些结果与最近的研究结果一致,报道说使用生物肥料产生的效果gydF4y2BaBradyrhizobium.gydF4y2Ba显著提高大豆和绿豆籽粒产量[gydF4y2Ba43.gydF4y2Ba].gydF4y2Ba
目前的研究结果表明,用gydF4y2BaB. japonicum.gydF4y2Ba单独或与AMF结合的大豆瘤瘤的显着增加(表gydF4y2Ba3.gydF4y2Ba).几项研究报告了积极的效果gydF4y2BaB. japonicum.gydF4y2Ba和AMF对大豆结瘤的影响。在这方面,Hao等人[gydF4y2Ba68.gydF4y2Ba据报道,AM真菌接种改善了菌根植物 - 根瘤菌共生,这对促进干旱胁迫期间的植物生长更有效。此外,AMF还可以降低结节中发生的氧化应激[gydF4y2Ba69.gydF4y2Ba],提高结节的碳代谢[gydF4y2Ba70gydF4y2Ba],这可能会增加结节的有效性来固定大气氮。SOE和YAMAKAWA [gydF4y2Ba71.gydF4y2Ba]发现同系有联系gydF4y2BaB.袁明gydF4y2BaP4显着改善了细结的大豆数量。我们的结果表明gydF4y2BaB. japonicum.gydF4y2Ba单独处理的结节数高于单独处理或混合处理。一些研究也报道了类似的发现,用生物肥料单独接种被证明比联合接种更有效,这可能在很大程度上取决于联合接种的微生物类型。因此,Juge等人[gydF4y2Ba61.gydF4y2Ba发现了三重治疗gydF4y2Ba(gydF4y2Ba慢生根瘤菌×偶氮螺旋藻×gydF4y2BaAMF)及双重处理(gydF4y2BaBradyrhizobium×gydF4y2BaAMF)的结节比gydF4y2BaBradyrhizobium.gydF4y2Ba独自的gydF4y2Ba.gydF4y2Ba有趣的是(gydF4y2Ba72.gydF4y2Ba据报道,组合使用BradyRhizobial菌株和gydF4y2BaS. Griseoflavus.gydF4y2Ba与单独治疗相比,P4增加了结节。此外,Htwe等人[gydF4y2Ba43.gydF4y2Ba]报道了一种生物肥料混合物含有gydF4y2BaB. japonicum.gydF4y2Ba,gydF4y2Bab . elkaniigydF4y2Ba和gydF4y2BaS. Griseoflavus.gydF4y2Ba提高大豆根瘤数量和根瘤干重。本研究表明,R3期不灌水对结瘤的抑制程度较高,这可能与干旱胁迫抑制了碳同化和氮代谢有关。此前,Miao等人[gydF4y2Ba73.gydF4y2Ba[]报道了相似的结果,即花期水分胁迫比结荚期和灌浆期降低了单株结核数。gydF4y2Ba
在本研究中,干旱胁迫和生物肥料处理均表现出添加性的上调gydF4y2Ba猫gydF4y2Ba和gydF4y2Ba圆荚体gydF4y2Ba活性及其相关基因的表达,表明胁迫条件下植物细胞中能够清除不同ROS的相应酶的活性在转录后被激活。Mittler也观察到了类似的结果[gydF4y2Ba74.gydF4y2Ba他说,抗氧化剂水平的增加在降低ROS活性方面具有关键作用,因此植物能够在逆境环境下维持其生理功能。之前,Salah等人[gydF4y2Ba53.gydF4y2Ba[报道,豆荚可以用作抵抗水稻植物中氧化应激的内在防御工具,也可以用作潜在的生物标志物来评估应力的强度[gydF4y2Ba75.gydF4y2Ba].有趣的是,先前的研究报告说,猫的活性与土壤有机物和土壤微生物数量的含量有关[gydF4y2Ba76.gydF4y2Ba].因此,在大豆植株上接种生物肥可能激活了抗氧化酶,这些酶有助于清除干旱胁迫下脂质过氧化引起的氧化应激。gydF4y2Ba
本研究中的脯氨酸含量在干旱胁迫下的植物中增加(图。gydF4y2Ba3.gydF4y2BaF)。几项研究观察了不同的非生物胁迫下脯氨酸的积累。因此,金和泰[gydF4y2Ba77.gydF4y2Ba]的脯氨酸含量显著增加,说明脯氨酸具有提高水稻在冷胁迫下的适应能力的作用。本研究报道脯氨酸代谢相关基因在干旱胁迫下上调。gydF4y2Ba5gydF4y2BaC-F),其与脯氨酸含量一致(图。gydF4y2Ba3.gydF4y2Baf).我们的研究结果与先前的研究报告一致,即脯氨酸含量在渗透胁迫下由于基因编码上调而提高gydF4y2BaP5CS.gydF4y2Ba[gydF4y2Ba78.gydF4y2Ba].此外,Dobra等。[gydF4y2Ba79.gydF4y2Ba]观察到上调gydF4y2BaP5CS.gydF4y2Ba烟草植物叶片中的基因表达暴露于干旱胁迫6天。有趣的是,Hien等人。[gydF4y2Ba80gydF4y2Ba表示P5CS活性对于具有不同无非胁迫耐受性水平的植物中的差异脯氨酸积累不负责任。其他几项研究还表明,在不同的非生物胁迫下,P5Cr的脯氨酸积累和P5Cr的转录水平不会受到影响[gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba].有证据表明,盐度胁迫导致gydF4y2BaP5CR.gydF4y2Ba不同的植物种类,如大豆,小麦,gydF4y2Ba拟南芥gydF4y2Ba和豌豆[gydF4y2Ba83gydF4y2Ba].目前的研究表明,参与脯氨酸代谢的基因是控制脯氨酸水平并保持干旱胁迫下脯氨酸降解水平的主要关键。此证据符合以前的一项研究,其中报告了gydF4y2BaP5CDHgydF4y2Ba和gydF4y2BaPDH.gydF4y2Ba基因是维持细胞ROS平衡所需的脯氨酸氧化的主要调节剂[gydF4y2Ba84gydF4y2Ba]并且还必须在非生物胁迫下控制脯氨酸水平[gydF4y2Ba82gydF4y2Ba].gydF4y2Ba
目前的发现表明,在不同的生物元经氧化物处理下观察到R3和R5阶段的大豆根部细胞进展的变化(图。gydF4y2Ba7gydF4y2Ba和gydF4y2Ba8gydF4y2Ba).这些研究结果表明,生物元化器治疗减少了干旱对细胞进展的抑制作用,并导致细胞积聚和循环分裂的时间较短。在干旱造型的植物中减少细胞产生可能是由于较少数量的分割电池,例如分配尺寸减少[gydF4y2Ba85gydF4y2Ba,gydF4y2Ba86gydF4y2Ba].也是sheteiwy等。[gydF4y2Ba13gydF4y2Ba研究表明,在盐胁迫和渗透胁迫及其组合作用下,核积累受到抑制,尤其是G0/G1期。先前的一项研究表明,细胞周期活动参与了转录因子介导的应激反应[gydF4y2Ba87gydF4y2Ba].目前的研究探讨了生物元经氧化物处理植物中细胞周期的变化可能是由于细胞对应力条件的反馈并增加植物适应性胁迫。细胞周期的反馈可以通过一些细胞周期基因的表达的正和阴性调节来控制,这导致对非生物应激响应的细胞周期进展的扰动[gydF4y2Ba85gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
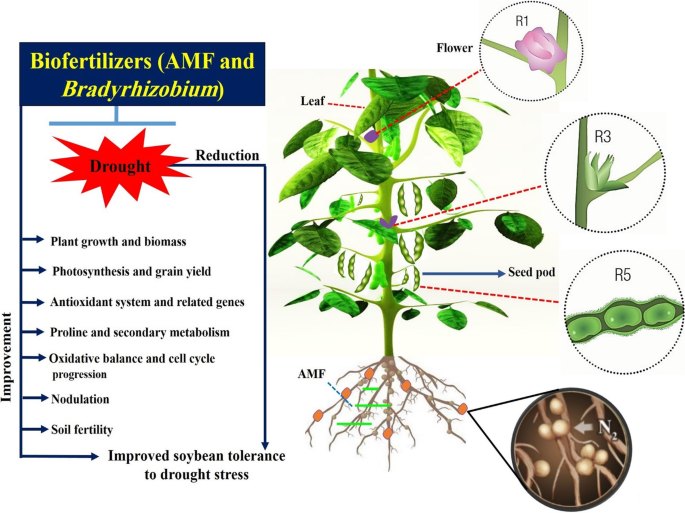
总之,与暴露于R3和R5阶段的干旱胁迫的植物相比,植物生物质,叶绿素含量,酚类碱,叶绿素含量,旋转和籽粒产量的显着增加。接种amf和gydF4y2BaBradyrhizobium.gydF4y2Ba在干旱胁迫条件下改善大豆生长和产量。在用生物元化器处理的植物的根际土壤中,土壤酶的细菌计数,土壤核化水平和活性也增加,这对于在水缺陷条件下提高大豆生长和产量具有重要作用。生物元化器改善了大豆及其相关基因的抗氧化系统,这有助于降低干旱胁迫诱导的氧化损伤。此外,植物中脯氨酸和上调其相关代谢基因的累积可能是影响在干旱胁迫下影响大豆的适应性反应的重要作用。此外,接种生物元素的植物积累了次级代谢的次级新陈代谢的较高活性,这与干旱胁迫下的表达模式一致。生物元化器治疗减少了干旱胁迫对细胞进展的抑制作用,导致DNA积累和循环分裂的时间较短。本研究得出结论,生物元素与大豆植物相关联的应用可作为减轻对大豆生长绩效的有前途和替代技术,以通过将其介绍进入农业系统来提高农业系统来获得更大的可持续性土壤肥力,植物生长在干旱胁迫下。该方法提供详细视图(图。gydF4y2Ba9gydF4y2Bainculast对土壤生态系统功能的影响。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究中产生或分析的所有数据均包含在本文中。gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
Neupane J,Guo W. Precision水管理的农艺基础和策略:综述。农艺学。2019; 9(2):87。gydF4y2Bahttps://doi.org/10.3390/agronomy9020087gydF4y2Ba.gydF4y2Ba
- 2.gydF4y2Ba
匿名的。年度报告国际热带农业研究所。尼日利亚伊巴丹;2000. p。1-2。gydF4y2Ba
- 3.gydF4y2Ba
大豆,美国大豆协会。gydF4y2Bahttp://soystats.com/gydF4y2Ba2015(访问2017年3月)。gydF4y2Ba
- 4.gydF4y2Ba
黄志强,王志强,王志强,等。大豆品种抗旱性与抗旱性的关系。杂志。2019;166(1):88 - 104。gydF4y2Bahttps://doi.org/10.1111/ppl.12864gydF4y2Ba.gydF4y2Ba
- 5。gydF4y2Ba
Sheteiwy Ms,Shao H,Qi W,Daly P,Sharma A,Shaghaleh H等人。茉莉酸的种子灌注和叶面应用增强大豆盐度胁迫耐受性(gydF4y2Ba甘氨酸最大gydF4y2Ba,L.)幼苗。J SCI食品和农业。2020; 2020:1-15。gydF4y2Ba
- 6。gydF4y2Ba
Wakchaure G,Minhas P,Meena Kk,Singh NP,Hegade PM,Sorty Am。受缺陷灌溉制度的影响,洋葱产量,水生产率和洋葱的水生产率和质量,以及植物生物调节剂的外源性应用的洋葱(葱属CEPA L.)。农业水管理。2018; 199:1-10。gydF4y2Bahttps://doi.org/10.1016/j.agwat.2017.11.026gydF4y2Ba.gydF4y2Ba
- 7。gydF4y2Ba
李胜,谢勇,刘刚,王军,林华,辛勇,等。不同侵蚀土壤水分胁迫下大豆水分利用效率研究水。2020;12(2):373。gydF4y2Bahttps://doi.org/10.3390/w12020373gydF4y2Ba.gydF4y2Ba
- 8.gydF4y2Ba
戴人在全球变暖下干旱:审查。电线上升Chg。2012; 2:45-65。gydF4y2Ba
- 9.gydF4y2Ba
Manavalan LP,Guttikonda SK,Tran LP,Nguyen HT。在大豆中改善抗旱性的生理和分子方法。植物细胞生理。2009; 50(7):1260-76。gydF4y2Bahttps://doi.org/10.1093/pcp/pcp082gydF4y2Ba.gydF4y2Ba
- 10.gydF4y2Ba
Purcell L. Specht J.改善干旱胁迫的生理性状。在:Boerma H,Specht,编辑。大豆:改进,生产和用途。麦迪逊:美国农艺学会;2004. p。569-620。gydF4y2Ba
- 11.gydF4y2Ba
Thao np,tran ls。耐旱大豆基因工程的潜力。关键的Rev Biotech。2012; 32(4):349-62。gydF4y2Bahttps://doi.org/10.3109 / 07388551.2011.643463gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
主要作物的灌溉,在:灌溉用水的有效利用,第2版;新德里Kalyani酒吧;1995.229 - 59页。gydF4y2Ba
- 13.gydF4y2Ba
Sheteiwy Ms,Shao H,齐W,Hamoud Ya,Shaghaleh H,Khan Nu,等。通过调节水稻中的细胞和分子信号,通过调节细胞和分子信号来缓解盐度,渗透胁迫和它们的组合诱导的GABA减轻氧化损伤。int j mol sci。2019; 20(22):5709。gydF4y2Bahttps://doi.org/10.3390/ijms20225709.gydF4y2Ba.gydF4y2Ba
- 14.gydF4y2Ba
吴锐,杨军,王磊,高秀娟。不同抗旱性亚麻幼苗对干旱胁迫的生理响应。《阿格利司Boreali-Sinica。2019; 34:145-53。gydF4y2Ba
- 15.gydF4y2Ba
Hussain S,Pang T,Iqbal N,Shafiq I,Skalicky M,Brestic M等。不同大豆基因型在间作中的适应策略与可塑性。Func植物Biol。2020:1-20。gydF4y2Ba
- 16。gydF4y2Ba
Turkan I,Bor M,O¨zdemirf,koca h差异对脂质过氧化和抗氧化剂在耐旱性p acutifolius灰色和干旱敏感性p寻呼L经过聚乙二醇介导的水胁迫植物SCI 2005;168:223-231。gydF4y2Ba
- 17。gydF4y2Ba
Sheteiwy Ms,A J,Yin M,Jia X,Guan Y,He F等人。冷等离子体处理和外源水杨酸引发增强了盐度耐受性gydF4y2Ba奥雅萨苜蓿gydF4y2Ba幼苗。原生质。2018A:1-21。gydF4y2Ba
- 18.gydF4y2Ba
Sheteiwy Ms,Fu Y,Hu Q,Nawaz A,Guan Y,Zhan L等。纳米ZnO应力下含有聚乙二醇的种子喷射诱导水稻抗氧化防御和代谢性能。环境科学污染粉丝。2016; 23(19):19989-20002。gydF4y2Bahttps://doi.org/10.1007/s11356-016-7170-7gydF4y2Ba.gydF4y2Ba
- 19.gydF4y2Ba
Sheetiwy Ms,Shen H,Xu J,Guan Y,Song W,Hu J.种子多胺多胺代谢由籽氨基和5-氨基乙酸进行耐寒水稻的耐受性改善(gydF4y2Ba奥雅萨苜蓿gydF4y2BaL.)幼苗。Environ Exp Bot。2017A; 137:58-72。gydF4y2Ba
- 20.gydF4y2Ba
董强,安军,宋伟,关勇,何飞,等。腐殖酸对ZnO纳米粒子诱导的生理和分子变化的调控gydF4y2Ba奥雅萨苜蓿gydF4y2Ba幼苗。植物生长调节。2017B:1-15。gydF4y2Ba
- 21.gydF4y2Ba
赵玉玲,龚德华,高艳,潘瑞,胡建军,关玉华。茉莉酸甲酯对水稻种子渗透胁迫的调控作用。Environ Exp Bot. 2018b; 153:236-48。gydF4y2Ba
- 22。gydF4y2Ba
Thu NBA, Nguyen QT, huang XLT, Thao NP, Tran LP。越南大豆品种抗旱性评价为大豆生产和基因工程提供了潜在资源。Biomed Res Int. 2014;gydF4y2Bahttps://doi.org/10.1155/2014/809736gydF4y2Ba.gydF4y2Ba
- 23。gydF4y2Ba
黄志强,王志强,王志强,等。干旱胁迫对大豆生长发育的影响。作物科学。2000;40(3):716 - 22所示。gydF4y2Bahttps://doi.org/10.2135/cropsci2000.403716x.gydF4y2Ba.gydF4y2Ba
- 24。gydF4y2Ba
Kron AP, Souza总经理,Ribeiro RV。不同发育阶段的水分亏缺可以提高甘氨酸max的抗旱性。Bragantia。2008;67(1):43-9。gydF4y2Bahttps://doi.org/10.1590/S0006-87052008000100005gydF4y2Ba.gydF4y2Ba
- 25。gydF4y2Ba
Lich MA, Wright D, Lenssen AW。大豆对干旱的反应,农业。爱荷华州立大学推广与推广,艾姆斯,IA(美国)(2013)。gydF4y2Ba
- 26。gydF4y2Ba
Hirasawa T,Tanaka K,Miyamoto D,Taili M,Ishihara K.在籽粒灌装过程中干旱条件下大豆植物干物质生产和生态学特性的影响。jp j croc sci。1994年; 63(4):721-30。gydF4y2Bahttps://doi.org/10.1626/jcs.63.721gydF4y2Ba.gydF4y2Ba
- 27。gydF4y2Ba
Andrade FH,AguirrezábalLan,Rizzalli Rh,Crecimiento Endimiento Comparados。在:andrade fh,萨德拉斯vo(eds。)基地Para el Manejo delMaíz,el Girasol Y La Soja。Inta Balcarce,Facultad de Ciencias Agrarias,Buenos Aires,阿根廷P.450(2002)。gydF4y2Ba
- 28。gydF4y2Ba
Tarnabi ZM,Iranbakhsh A,Mehregan I,AhmAdvand R.丛枝菌根真菌(AMF)对小麦细胞壁和膜元素基因表达的影响(gydF4y2BaTriticum Aestivum.gydF4y2Ba在水分亏缺条件下,利用转录组分析。植物学报2019;1 - 20。gydF4y2Ba
- 29。gydF4y2Ba
高C,El-Sawah Am,Ali DFI,Alhaj Hamoud Y,Shaghaleh H,Sheteiwy Ms。生物和有机肥的整合提高了杂交玉米的植物生长,籽粒产量,质量和代谢(gydF4y2Ba玉米gydF4y2Bal .)。农学。2020;10:319。gydF4y2Bahttps://doi.org/10.3390/agronomy10030319gydF4y2Ba.gydF4y2Ba
- 30。gydF4y2Ba
Souza R,Ambrosini A,Passaglia LMP。植物生长促进细菌作为农业土壤中的孕育剂。Genet mol Biol。2015; 38(4):401-19。gydF4y2Bahttps://doi.org/10.1590/S1415-475738420150053gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
丛枝菌根真菌缓解干旱和高温联合胁迫对番茄植株的负面影响。植物生理学。2018;132:297-307。gydF4y2Bahttps://doi.org/10.1016/j.plaphy.2018.09.011gydF4y2Ba.gydF4y2Ba
- 32.gydF4y2Ba
利用丛枝菌根真菌提高蔬菜产量和品质的研究进展。Sci长的矮。2015;187:131-41。gydF4y2Bahttps://doi.org/10.1016/j.scienta.2015.03.002gydF4y2Ba.gydF4y2Ba
- 33.gydF4y2Ba
邵海波。叶绿素a荧光测定菌根化和非菌根化甘氨酸max Linn的抗旱性。acta Microbiol Res. 2011; 5:4197-206。gydF4y2Ba
- 34.gydF4y2Ba
奥格RM。水分关系、干旱和泡-丛枝菌根共生。菌根。2001;11:3-42。gydF4y2Ba
- 35.gydF4y2Ba
Augé RM, Toler HD, Saxton AM。丛枝菌根共生在干旱条件下比充足水分条件下更能改变寄主植物的气孔导度:金属分析。菌根。2015;25:13-24。gydF4y2Bahttps://doi.org/10.1007/S00572-014-0585-4gydF4y2Ba.gydF4y2Ba
- 36.gydF4y2Ba
Pedranzani H, Rodríguez-Rivera M, Gutiérrez M, Porcel R, house B, Ruiz-Lozano JM。丛枝菌根共生调节水稻的生理和生产性能gydF4y2BaDigitaria Eriantha.gydF4y2Ba通过调节抗氧化剂和茉满半酸盐水平,对非生物胁迫进行非生物胁迫的植物。mycorrhiza。2016; 26(2):141-52。gydF4y2Bahttps://doi.org/10.1007/s00572-015-0653-4gydF4y2Ba.gydF4y2Ba
- 37.gydF4y2Ba
Quiroga G,Erice G,Aroca R,Chaumont F,Ruiz-Lozano JM。干旱敏感玉米品种中丛枝菌根共生的增强的干旱胁迫耐受性与宿主植物盆蛋白的更广泛和微小的调节相关,而不是耐旱栽培品种。前植物SCI。2017; 8:1056。gydF4y2Bahttps://doi.org/10.3389/fpls.2017.01056gydF4y2Ba.gydF4y2Ba
- 38.gydF4y2Ba
Chitarra W,Pagliarani C,Maserti B,Lumini E,Siciliano I,Cascone P等人。丛枝菌根共生对水分压力番茄耐受影响的洞察。植物理性。2016; 171:1009-23。gydF4y2Bahttps://doi.org/10.1104/pp.16.00307gydF4y2Ba.gydF4y2Ba
- 39。gydF4y2Ba
Sawada H, Kuykendall LD, Young JM。豆科细菌固氮共生系统学观念的转变。应用微生物学报2003;49:155-79。gydF4y2Bahttps://doi.org/10.2323/jgam.49.155gydF4y2Ba.gydF4y2Ba
- 40.gydF4y2Ba
王志强,王志强,王志强。豆科植物结瘤的遗传学和功能基因组学。植物学报。2006;9:110-21。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2006.01.005gydF4y2Ba.gydF4y2Ba
- 41.gydF4y2Ba
Hungria M,Vargas Mat。影响热带地区种植的豆类N2固定的环境因素,并强调巴西。现场裁剪。2000; 65:151-64。gydF4y2Bahttps://doi.org/10.1016/s0378-4290(99)00084-2gydF4y2Ba.gydF4y2Ba
- 42.gydF4y2Ba
Tena W,Wolde-Meskel E,Walley F.原生和异国情调的根瘤菌菌株的共生效率促使扁豆(gydF4y2Ba镜头culinarisgydF4y2BaMedik。)在埃塞俄比亚南部的土壤中。农艺学。2016; 6:1-11。gydF4y2Ba
- 43.gydF4y2Ba
HTWE AZ,Moh Sm,Moe K,Yamakawa T. Biofertiliser生产,用于农艺应用和对大豆的共生效果评估。农艺学。2019; 9(4):162。gydF4y2Bahttps://doi.org/10.3390/agronomy9040162gydF4y2Ba.gydF4y2Ba
- 44.gydF4y2Ba
文森特JM。根瘤细菌的实际研究手册。IBP手册第15号。黑色的科学。普尔。牛津和爱丁堡,1970年;。gydF4y2Ba
- 45.gydF4y2Ba
在色氨酸存在和不存在的情况下,由固氮菌和荧光假单胞菌的本地分离物产生吲哚乙酸。中国生物医学杂志2005;29:29-34。gydF4y2Ba
- 46。gydF4y2Ba
Pikovskaya ri。与一些微生物物种的重要活动相关的土壤中磷的调动。Mikrobiologiya。1948; 17:362-70。gydF4y2Ba
- 47。gydF4y2Ba
Hemalatha N,Raja N,Jayachitra A,Rajalakshmi A,valarmathi N.磷酸盐溶解细菌的分离和表征及其对辣椒H.1型Chiol Jiol Pharm Res的影响。2013; 4:159-67。gydF4y2Ba
- 48。gydF4y2Ba
Asrar A,Abdel-Fattah Gm,Elhindi Km。提高Snapdragon的生长,花卉产量和水合关系(gydF4y2BaAntirehinum Majus.gydF4y2BaL.)植物在使用丛枝菌根真菌的灌注和水胁迫条件下生长。Speckynthetica。2012; 50:305-16。gydF4y2Bahttps://doi.org/10.1007/S11099-012-0024-8gydF4y2Ba.gydF4y2Ba
- 49。gydF4y2Ba
Phillips JM, Hayman DS。改进的程序清除根和染色寄生和泡状丛枝菌根真菌快速评估感染。acta physica sinica(物理学报),2017;gydF4y2Bahttps://doi.org/10.1016/s0007-1536 (70)80110-3gydF4y2Ba.gydF4y2Ba
- 50。gydF4y2Ba
Trouvelot A,Kough JL,Gianinazzi-Pearson V. Mesuredu Taux de Mycorhization VA D'联合国Systèmeadriculaire recherche de方法d'估计Ayant Une签名Fonctionnelle。在:Gianinazzi-Pearson v,Gianinazzi S,编辑。菌根的生理和综合方面。巴黎:在inra出版物;1986. p。217-21。gydF4y2Ba
- 51。gydF4y2Ba
Gobran GR,CLEGG S.矿物土根系中营养可用性的概念模型。可以j土壤sci。1996年; 76(2):125-31。gydF4y2Bahttps://doi.org/10.4141/cjss96-019gydF4y2Ba.gydF4y2Ba
- 52。gydF4y2Ba
张X,李福,刘T,徐C,Duan D,Peng C等人。重金属污染土壤酶活性,蛋白质表达,微生物生物量和群落结构的变化。ISRN土壤科学。2013:1-12。gydF4y2Ba
- 53。gydF4y2Ba
胡强,李建平,李建军,等。聚乙二醇对水稻种子启动生理和分子机制的调控(gydF4y2Ba奥雅萨苜蓿gydF4y2Ba在纳米氧化锌应力作用下。Sci众议员2015;5:14278。gydF4y2Ba
- 54。gydF4y2Ba
姜建峰,陆玉峰,李建刚,李林,何鑫,邵海林,等。冷等离子体种子处理对番茄抗病性的影响gydF4y2BaRalstonia solanacearum.gydF4y2Ba(细菌枯萎者)。Plos一个。2014; 9:1-6。gydF4y2Ba
- 55.gydF4y2Ba
周WJ,Leul M. Uniconazole诱导强奸植物的耐受性与激素水平,酶活性和脂质过氧化的变化相关。植物生长调节。1999年; 27(2):99-104。gydF4y2Bahttps://doi.org/10.1023/A:1006165603300gydF4y2Ba.gydF4y2Ba
- 56.gydF4y2Ba
胡y,张l,zhao l,李家,他,周k等。Trichostatin A选择性地抑制玉米ZMDREB1基因的冷诱导的转录。Plos一个。2011; 6(7):E22132。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0022132gydF4y2Ba.gydF4y2Ba
- 57.gydF4y2Ba
干旱胁迫下根瘤菌和丛枝菌根真菌对大豆种子产量、大小分布和脂肪酸的影响Microbiol杂志2021;242:126640。gydF4y2Bahttps://doi.org/10.1016/j.micres.2020.126640gydF4y2Ba.gydF4y2Ba
- 58.gydF4y2Ba
IOVIENO P,BAATH E.干燥和重入措施对土壤细菌生长率的影响。有限元微生物ECOL。2008; 265:400-7。gydF4y2Ba
- 59.gydF4y2Ba
Meisner A,Rousk J,Baath E.长期干旱将细菌生长反应变为重新润湿。土壤Biol Biochem。2015; 88:314-22。gydF4y2Bahttps://doi.org/10.1016/j.seilbio.2015.06.002gydF4y2Ba.gydF4y2Ba
- 60.gydF4y2Ba
陈志强,王志强,王志强,等。土壤微生物数量与活性的关系。土壤生物学报1992;24:655-65。gydF4y2Ba
- 61.gydF4y2Ba
法官C, Prévosta D, Bertranda A, Bipfubusaa M, Chalifourb FP。大豆对慢生根瘤菌、偶氮螺旋菌和丛枝菌根的生长和生化反应。应用生态学报。2012;31(4):457 - 462。gydF4y2Bahttps://doi.org/10.1016/j.apsoil.2012.05.006gydF4y2Ba.gydF4y2Ba
- 62.gydF4y2Ba
Pavithra D,Yapa N.丛枝菌根真菌接种增强了植物的干旱胁迫耐受性。地下水verv。2018; 7:490-4。gydF4y2Bahttps://doi.org/10.1016/j.gsd.2018.03.005gydF4y2Ba.gydF4y2Ba
- 63.gydF4y2Ba
Sinha RK,Valani D,Chauhan K,Agarwal S.通过蚯蚓造成的蚯蚓博物艺生物技术踏上可持续农业的第二种绿色革命:恢复查尔斯达尔文爵士的梦想。JAgric Technol维持开发。2010; 2:113-28。gydF4y2Ba
- 64.gydF4y2Ba
El-Sawaham,El-Keblawy A,Ali DFI,Ibrahim HM,El-Sheikh Ma,Sharma A等。丛枝菌根真菌和植物生长促进无根毒细菌增强土壤重点酶,植物生长,种子产量和瓜尔的定性属性。农业。2021; 11(3):194。gydF4y2Bahttps://doi.org/10.3390/agriculture11030194gydF4y2Ba.gydF4y2Ba
- 65.gydF4y2Ba
Jayne B,Quigley M.丛枝菌根对水缺陷植物生长和生殖反应的影响:荟萃分析。mycorrhiza。2014; 24:109-19。gydF4y2Bahttps://doi.org/10.1007/S00572-013-0515-X.gydF4y2Ba.gydF4y2Ba
- 66.gydF4y2Ba
李t,胡yj,hao zp,李h,王ys,陈bd。来自丛枝菌根真菌GloMus Morraycus的两个功能性水上蛋白基因的第一克隆与表征。新植物。2013; 197:617-30。gydF4y2Bahttps://doi.org/10.1111/nph.12011gydF4y2Ba.gydF4y2Ba
- 67.gydF4y2Ba
Soe公里,敏党卫军,赢得MM,昂山素季(Aung TT,圣乐,敏党卫军。缅甸Co-inoculation Bradyrhizobium yuanmingense MAS34和链霉菌属griseoflavus P4菌剂来改善植物生长,种子产量的大豆品种和土壤肥力的改善。Myanmar agricultural Res J. 2018; 4:154-64。gydF4y2Ba
- 68.gydF4y2Ba
Hao Z,谢W,江X,吴Z,张X,陈B.丛枝菌根真菌在干旱胁迫下提高了rozobium-glycyrrhiza幼苗共生。农艺学。2019; 9(10):572。gydF4y2Bahttps://doi.org/10.3390/agronomy9100572gydF4y2Ba.gydF4y2Ba
- 69.gydF4y2Ba
Buecking H,kafle A.丛枝菌根真菌在植物的氮气吸收中的作用:当前的知识和研究差距。农艺学。2015; 5(4):587-612。gydF4y2Bahttps://doi.org/10.3390/agronomy5040587gydF4y2Ba.gydF4y2Ba
- 70。gydF4y2Ba
Goicoechea N,Merino S,Sanchez-Diaz M.丛枝菌根真菌(AMF)的贡献给落叶灌木症患者呈下水缺陷的落叶灌木症状的适应。physiol植物。2004; 122(4):453-64。gydF4y2Bahttps://doi.org/10.1111/j.1399-3054.2004.00421.xgydF4y2Ba.gydF4y2Ba
- 71。gydF4y2Ba
从缅甸大豆中分离的缅甸缓生根瘤菌及其与灰黄链霉菌P4共接种固氮效果的评价。土壤通报。2013;59(3):361-70。gydF4y2Bahttps://doi.org/10.1080/00380768.2013.794437gydF4y2Ba.gydF4y2Ba
- 72。gydF4y2Ba
关键词:大豆,内生放线菌,日本慢生根瘤菌,生长,结瘤,固氮,种子重土壤通报。2012;58(3):319-25。gydF4y2Bahttps://doi.org/10.1080 / 00380768.2012.682044gydF4y2Ba.gydF4y2Ba
- 73。gydF4y2Ba
苗松,史华,金军,刘杰,刘昕,王刚。短期旱涝对盆栽大豆结瘤及关键结瘤期产量的影响。农业环境学报。2012;10:819-24。gydF4y2Ba
- 74。gydF4y2Ba
Mittler R.氧化应激,抗氧化剂和应力耐受性。趋势植物SCI。2002; 7(9):405-10。gydF4y2Bahttps://doi.org/10.1016/s1360-1385(02)02312-9gydF4y2Ba.gydF4y2Ba
- 75。gydF4y2Ba
Shah K,Kumar Rg,Verma S,Dubey Rs。镉对生长稻幼苗抗氧化酶的脂质过氧化,超氧化物阴离子产生及活性的影响。植物SCI。2001; 161(6):1135-44。gydF4y2Bahttps://doi.org/10.1016/s0168-9452(01)00517-9gydF4y2Ba.gydF4y2Ba
- 76。gydF4y2Ba
接种丛枝菌根真菌可改变番茄根际细菌群落结构,但菌根分泌物对土壤富集或接种丛枝菌根真菌对番茄根际细菌群落结构影响不大gydF4y2BaPhytophthora Nicotianae.gydF4y2Ba.土壤Biol Biochem。2010; 42(3):473-83。gydF4y2Bahttps://doi.org/10.1016/j.seilbio.2009.11.034gydF4y2Ba.gydF4y2Ba
- 77。gydF4y2Ba
基斯,太极。水稻品种幼苗耐寒性评价:视觉评级的比较和生理变化的定量指标。Euphytica。2011; 178(3):437-47。gydF4y2Bahttps://doi.org/10.1007/s10681-010-0343-4gydF4y2Ba.gydF4y2Ba
- 78。gydF4y2Ba
Choudhary Nl,Sairam Rk。Tyagi A,水稻干旱过程中δ1-吡咯啉-5-羧酸酯合成酶基因的表达(gydF4y2Ba奥雅萨苜蓿gydF4y2Bal .)。印度j生物志法生物麦子。2005; 42(6):366-70。gydF4y2Ba
- 79.gydF4y2Ba
Dobra J,VankováR,Havlovám,Burman Aj,Libus J,Štorchováh。烟草叶和根在干旱胁迫过程中表达脯氨酸代谢相关基因和随后的恢复。J植物理性。2011; 168(13):1588-97。gydF4y2Bahttps://doi.org/10.1016/j.jplph.2011.02.009gydF4y2Ba.gydF4y2Ba
- 80.gydF4y2Ba
Hien Dt,Jacobs M,Angenon G,Hermans C,THU TT,SON LV等。脯氨酸积聚和吡咯啉-5-羧酸盐合成酶基因特性在盐度和干旱耐受性的三种水稻品种中。植物SCI。2003; 165(5):1059-68。gydF4y2Bahttps://doi.org/10.1016/s0168-9452(03)00301-7gydF4y2Ba.gydF4y2Ba
- 81.gydF4y2Ba
Willett CS,Burton Rs。脯氨酸生物合成基因及其在Euryhaline Copepod中盐度胁迫下的调节gydF4y2BaTigriopus californicusgydF4y2Ba.Comp Biochem Physiol Part B. 2002; 132(4):739-50。gydF4y2Bahttps://doi.org/10.1016/s1096 - 4959 (02) 00091 - xgydF4y2Ba.gydF4y2Ba
- 82.gydF4y2Ba
等。通过同时调控植物中脯氨酸的生物合成和降解来提高游离脯氨酸和富含脯氨酸的蛋白质水平。植物科学。2011;181(2):140 - 50。gydF4y2Bahttps://doi.org/10.1016/j.plantsci.2011.04.013gydF4y2Ba.gydF4y2Ba
- 83.gydF4y2Ba
MA L,周E,GAO L,Mao X,周R,佳J.普通小麦P5Cr基因的分离,表达分析和染色体位置(gydF4y2BaTriticum Aestivum.gydF4y2Bal .)。acta botanica sinica(云南植物学报),2012;gydF4y2Bahttps://doi.org/10.1016/j.sajb.2008.05.003gydF4y2Ba.gydF4y2Ba
- 84.gydF4y2Ba
Szabados L,SavouréA.脯氨酸:多功能氨基酸。趋势植物SCI。2009; 15:89-97。gydF4y2Ba
- 85.gydF4y2Ba
赵立,王p,侯h,张h,王y,yan s等人。对非生物胁迫反应的细胞周期基因的转录调节与玉米中组蛋白修饰的动态变化相关。Plos一个。2014; 9(8):E106070。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0106070gydF4y2Ba.gydF4y2Ba
- 86.gydF4y2Ba
West G,Inze D,Beemster GT。拟南芥原药对盐胁迫的响应中的细胞周期调制。植物理性。2004; 135(2):1050-8。gydF4y2Bahttps://doi.org/10.1104/pp.104.040022gydF4y2Ba.gydF4y2Ba
- 87.gydF4y2Ba
Santilli G,Schwab R,Watson R,Ebert C,Aronow Bj,Sala A.温度依赖性修饰和B-MYB的激活:对细胞生存的影响。J Biol Chem。2005; 280(16):15628-34。gydF4y2Bahttps://doi.org/10.1074/jbc.M411747200gydF4y2Ba.gydF4y2Ba
致谢gydF4y2Ba
中国博士后科学基金[2019M6617770]和《极端气候条件下作物遗传资源表型研究》基金(VEGA 1/0589/19)。gydF4y2Ba
实验研究中gydF4y2Ba
作者证实,所有的实验方法都符合相关机构、国家和国际指南和立法。我们还指定获得了与种子集合相关的所有权限或许可。gydF4y2Ba
资金gydF4y2Ba
作者非常感谢111个项目(BP0719040);中国博士后科学基金基金[2019 M617770]与气候基础条件的作物遗传资源表型(Vega 1/0589/19)。gydF4y2Ba
这项工作也得到了捷克共和国教育、青年和体育部的资助(S grant of MSMT CR)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
MSS、AME-S和DFIA发起、设计、实施和监控实验。AME-S和DFIA制备生物肥料并进行微生物学测定。AME-S进行了诱捕培养技术,并估计了菌根的定殖。MSS, YAH和HS进行酶提取和生化分析。MSS进行实时荧光定量PCR和流式细胞术分析。MS进行了统计分析。MSS和AME-S撰写了手稿的初稿。YX, ZU, MB, MF, AS和HA对手稿进行了修改。所有的作者都通过了手稿的定稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
QRT-PCR中寡核苷酸引物的序列分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
熊永强,李国强,李国强,熊永强。gydF4y2Baet al。gydF4y2Ba用丛枝菌根真菌接种大豆植物的生理生化反应gydF4y2BaBradyrhizobium.gydF4y2Ba在干旱压力下。gydF4y2BaBMC植物BIOL.gydF4y2Ba21,gydF4y2Ba195(2021)。https://doi.org/10.1186/s12870-021-02949-z.gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02949-z.gydF4y2Ba
关键字gydF4y2Ba
- AMFgydF4y2Ba
- 次生新陈代谢gydF4y2Ba
- 脯氨酸代谢gydF4y2Ba
- 土壤酶gydF4y2Ba
- 大豆产量gydF4y2Ba
- 流式细胞仪gydF4y2Ba