摘要
背景
在收获前,螺栓技术是指农业和园艺作物的早期开花的生产。实际上,螺栓是由各种环境因素和内源性遗传成分的协调效果引起的事件,这导致菠菜等蔬菜作物的质量和生产力大大降低。然而,关于菠菜中螺栓机构中涉及的信号传导途径和分子函数知之甚少。关于从植物生长转变为菠菜生殖阶段的遗传信息将代表调节螺栓连接时间和改善抗性品种以最大限度地减少性能损失的优势。
结果
为了研究控制菠菜抽薹的关键基因及其遗传网络,我们在营养和生殖阶段对早抽薹登录Kashan和晚抽薹登录Viroflay进行了RNA-seq分析,发现在不同的比较中差异表达基因(DEGs)在195到1230之间。这些基因主要与春化、光周期/昼夜时钟、赤霉素、自主和衰老信号通路相关。基因本体论分析揭示了碳水化合物代谢相关术语,并详细分析了果糖- 1,6 -二磷酸醛缩酶、海藻糖-6-磷酸合酶1、促花因子1、早花、GIGANTEA、MADS-box和MADS-box蛋白揭示了它们在抽薹起始或延迟中的潜在作用。
结论
这项研究是第一个报告确定螺栓在菠菜和flowering-related基因转录组测序的基础上,提供洞察锚杆支护控制,可以用于分子育种计划和进一步研究基因的调控机制与锚杆支护在其他蔬菜作物。
背景
菠菜 (菠菜oleraceaL.)来自Amaranthaceae家族是一年一度的,脱衣性和耐寒性的植物植物,具有多种营养素和健康促进化合物,如纤维,维生素,铁和抗氧化剂活动[1,2].这种植物在世界范围内种植,正在成为最重要的经济蔬菜作物之一,估计年产量约2600万吨[3.].事实上,菠菜的经济价值受到产量性能的显着影响,受环境因素大大影响,包括光,温度,水,湿度和营养[4,5].抽薹或早花是多种环境因素和内源遗传成分协同作用的关键事件[6,7]被称为最重要的因素之一,可能导致质量,生产率和菠菜作物的严重经济损失大,特别是在春季[8,9,10.].根据抽薹时间,菠菜品种可分为三类:中抽薹品种,抽薹时间在60 ~ 70 d;晚抽薹品种,抽薹时间在60 ~ 70 d。抽薹发生在70 d后。晚抽薹菠菜品种由于对光周期不敏感,在生长季节可以多次刈割,提高总产量[9].因此,利用晚抽薹品种和调控抽薹时间是限制抽薹对菠菜产量影响的最有效方法。此外,研究开花相关基因的信号通路和分子功能,可以为研究人员调控抽薹提供依据。
近年来,许多研究揭示了模式植物开花相关的信号通路和调控网络[11.,12.,13.,14.,15.,但很少有研究关注菠菜。拟南芥的研究[15.],萝卜[16.], 萝卜 [17.]和生菜[18.]已经发现了光周期、衰老、春化、内源激素(特别是赤霉素)和信号级联对抽薹的影响。这些信号调节最重要的开花整合因子,包括CO1过表达抑制因子(SUPPRESSOR OF OVEREXPRESSION OF CO1, SOC1)、开花位点T (FT)和叶(LFY),它们决定最终开花时间。光周期通路中的关键基因是CONSTANS (CO),它是一种转录因子,能积极激活FT [19.,20.].在葡萄酒途径中,开花基因座C(FLC)被称为通过抑制SOC1,FT和LFY基因抑制开花的关键基因[21.,22.].SQUAMOSA启动子结合样蛋白1 (SPL1)、SPL2、SPL3、SPL9、SPL13和SPL15是与衰老途径相关的最相关的候选基因[23.].基于生理和遗传研究,胃蛋白酶含量的降低通过限制节间伸长来影响花卉形成。LFY是吉布林素途径中的主要靶基因之一[24.].
通过使用下一代测序(NGS)技术在过去几年中,大多数信息已被发现。如今,RNA-SEQ结合数字基因表达(DGE)分析是在许多植物物种中的某些条件下全球发现功能基因和表达分析的强大策略。例如,RNA-SEQ已被应用于检测与开花过程相关的基因拟南芥[25.],Raphanus Sativus[16.],Eichhornia香[26.], 和Lagerstroemia籼[27.], 和摘要以[18.].
以前的研究报告了不同的基因,途径,机制,网络在不同植物物种在不同情况下在不同植物物种中变化的复杂作用[15.,16.,17.,18.].尽管菠菜参考基因组已被测序[28.利用NGS技术和生物信息学方法,并进行转录组研究,目前对菠菜营养生长到生殖阶段开花抽薹机制的基因和遗传网络了解甚少。因此,我们通过转录组和qPCR分析揭示了与菠菜抽薹相关的关键基因。为此,选取两种抗抽薹能力不同的菠菜品种Kashan(早抽薹加入)和Viroflay(晚抽薹加入)作为材料,进行高通量RNA测序(RNA-seq),分析两个营养至生殖阶段的整体转录水平变化。本研究结果将有助于我们识别调控菠菜抽薹的基因和分子机制,有助于我们更好地理解菠菜抽薹的机制,并可为其他蔬菜作物抽薹相关遗传机制调控的分子育种和进一步研究提供参考。
结果
测序数据分析
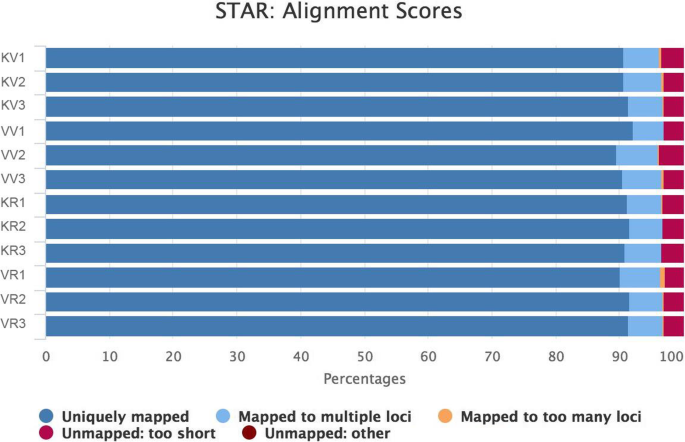
以Kashan和Viroflay两种植物营养和生殖阶段的叶片为材料,构建了12个cDNA文库,共获得55906.4万条原始reads。每个样本的平均产量为4658.8万份。在这些reads中,在去除低质量的reads和适配器序列后,每个库平均保留了43269万个干净的reads, Q30比超过92.86%S1).在质量检查之后,使用明星单独映射到每个样品的97.80-98.30%的高质量测序读数(图。1, 桌子S2).
差异基因表达分析
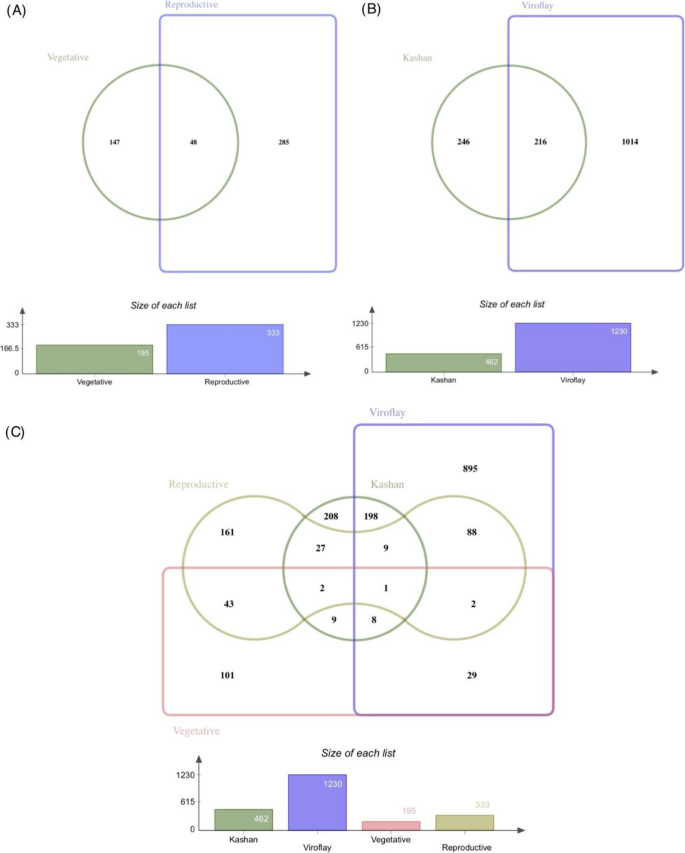
为了发现早期和后期螺栓连接的遗传差异,从两个阶段和附加的成对比较鉴定了DEGS(图。2).每次加入中的发育阶段比较揭示了在喀山和毒物鼠中有效的462和1230个基因(图。2b)分别具有强的DEG信号,用于生殖阶段中的上调基因。每个阶段的加入比较表明,生殖阶段(333个基因)的DEG的数量显着大于营养期(195基因)(图。2a).有趣的是,在营养阶段,更多的上调基因与接入Kashan相关,而在生殖阶段,更多的上调基因在Viroflay中被发现。在各阶段比较中,各阶段共有差异有216个,而在各阶段比较中共有差异有48个(图2)。2一种)。为了获得更全面的观点,在每个成对比较阶段和载体中识别的独特和常见参数的分布如图4所示。2c。另外,为了表征DEG的亚基组和染色体分布,在每种比较中的DEG的位置数据和LOG2折叠变化并绘制在菠菜的6个染色体上(图。S1-S2).结果表明,在营养期比较中,染色体1和2的DEGs数量最高,与Kashan和Viroflay的阶段比较相似,而在生殖期比较中,6条染色体的DEGs分布更为均衡。文件中提供了一个包含deg列表(DataS1)的文件补充材料.
基因分类预测舞台
为了解决DEGs的产品属性和功能分类,我们使用位于SpinachBase的基因分类工具,对在阶段和加入的两两比较中识别的所有DEGs采用了基因本体(GO)术语[29.].
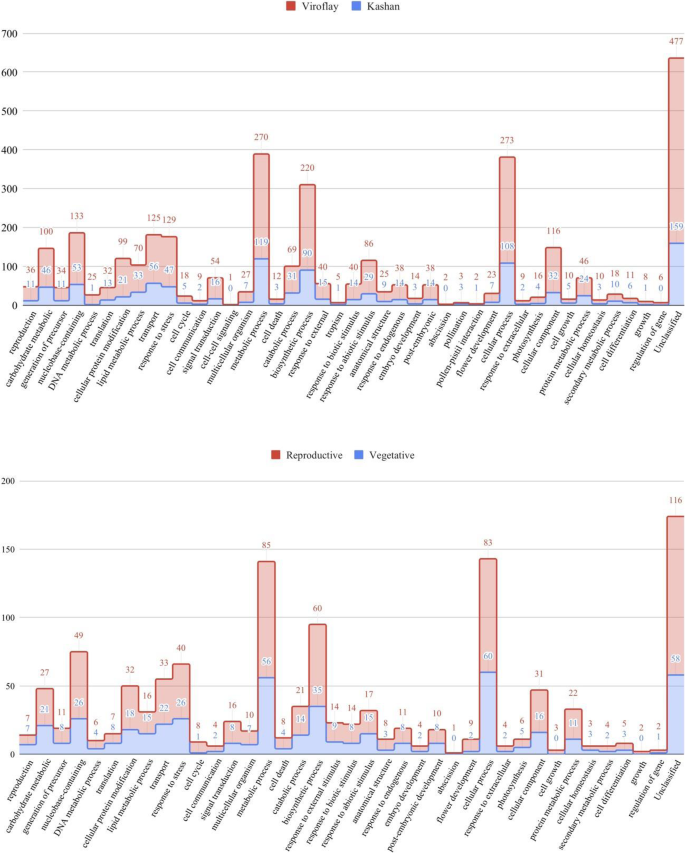
在accession Kashan的阶段比较中,在462个DEGs中,有303个、325个和200个成功使用GO作业在三个主要类别中进行了注释,包括生物过程(BP,图。3.),分子功能(MF,图。S3)和细胞成分(CC,图。S4), 分别。衍生自Viroflay的对应数分别为753,812和482个基因。关于营养阶段中的加入比较,137,139,80基因分别参与不同的BP,MF和CC类别。根据对生殖阶段的333次DEG的GO分析的细节,BP是具有275个基因的主要类别,其次是MF,具有220和CC,具有125个基因。
为了获得更深入和更好的理解,进一步的分析只包括与生物过程相关的氧化石墨烯术语。富集结果显示,在所有的生物过程比较中,类似的功能子类,包括“代谢过程”、“细胞过程”和“生物合成过程”占主导地位。此外,相对于各阶段的亲本比较,在生殖亚类(GO:0000003)和花发育亚类(GO:0009908)中有更多的DEGs,这与开花过程中发生的发育活动有关。此外,在胚胎发育(GO:0009790)、胚后期发育(GO: 0009791)、授粉(GO: 0009856)等方面的多个deg被注释为GO术语。众所周知,这些过程参与了从营养阶段到生殖阶段的过渡。
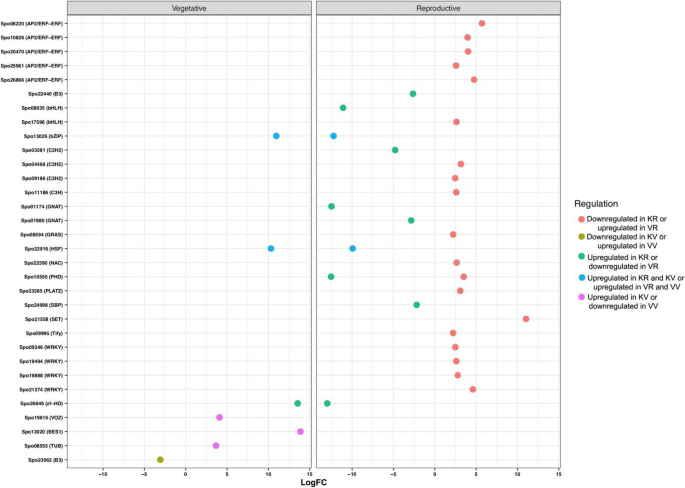
此外,为了总结和表征借助于螺栓调节网络的DEG,在各种开花途径中鉴定并分类了最流行的基因,包括春化,光周期/昼夜钟,GA,自主和老化途径。在对每个加入的植物和生殖阶段的比较中,搜索结果表明,18和20个功能基因,如铜型1(COL1),早开3(ELF3),开花基因座T(FT),静静脉(鉴定AgL)和Gigantea(GI)分别鉴定出肝脏和毒物碱的光周期途径。此外,GA和年龄的途径在喀山含有7和2点,在加入毒品粘土中的3和1次。更重要的是,春化的途径仅在加入毒品栏中含有8次。
与菠菜抽薹有关的转录因子
由于转录因子家族与花卉发育过程相关的事实,我们对差异转录因子进行了详细分析,以提供进一步的洞察螺栓底层的复杂分子机制的见解。
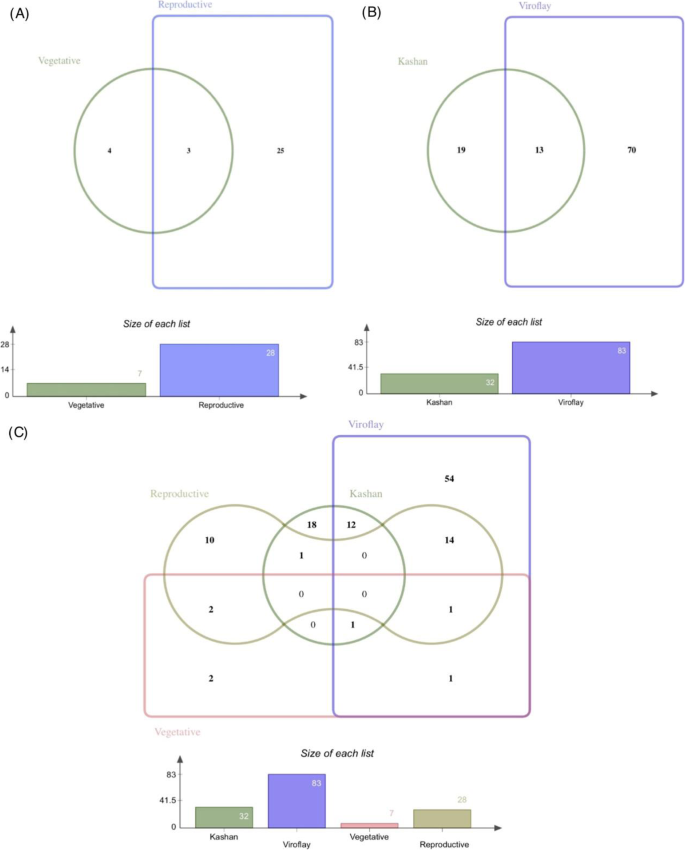
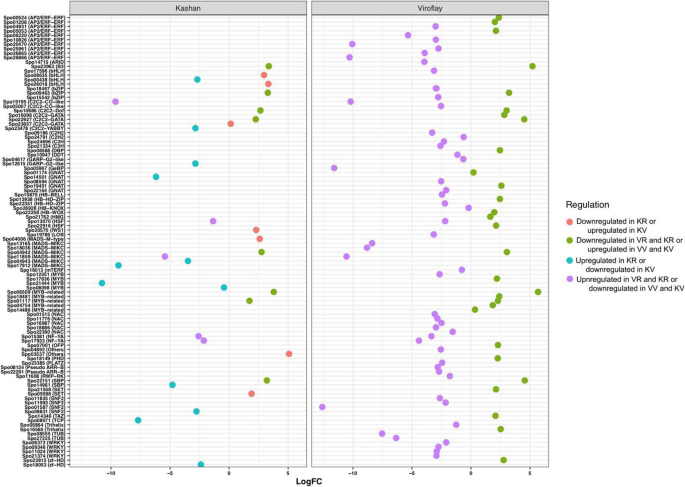
在每个加入营养和生殖阶段确定的所有参数中,分别在喀山和毒物鼠中共发现了总共32和83种差异表达的TFS。其中,在两种附加过程中通常表达13个TF(图。4一种)。在加入喀山,C2C2-GATA和MADS是具有大多数成员的TF系列(5个基因;图。5), MYB是第二大TF家族,有4个基因成员,其次是bHLH(3个基因)。其中AP2/ERF(10个基因)编码的转录因子所占比例最大,其次是MYB(7个基因)、C2C2和NAC(5个基因)编码的转录因子。在这两份研究中,大部分转录因子在生殖期表达高于营养期。各阶段比较,营养和生殖阶段差异表达的转录因子分别为7个和28个(图2)。4b)。由最大数量的差异表达成员表示的TF系列是生殖阶段的AP2 / ERF(5个基因),WRKY(4个基因)和C2H2(3基因)(图。6).大多数转录因子在加入Viroflay时显著上调。图中显示了每个阶段和入种的两两比较中确定的独特和共同的tf的分布。4c。
预测degs的基因集富集
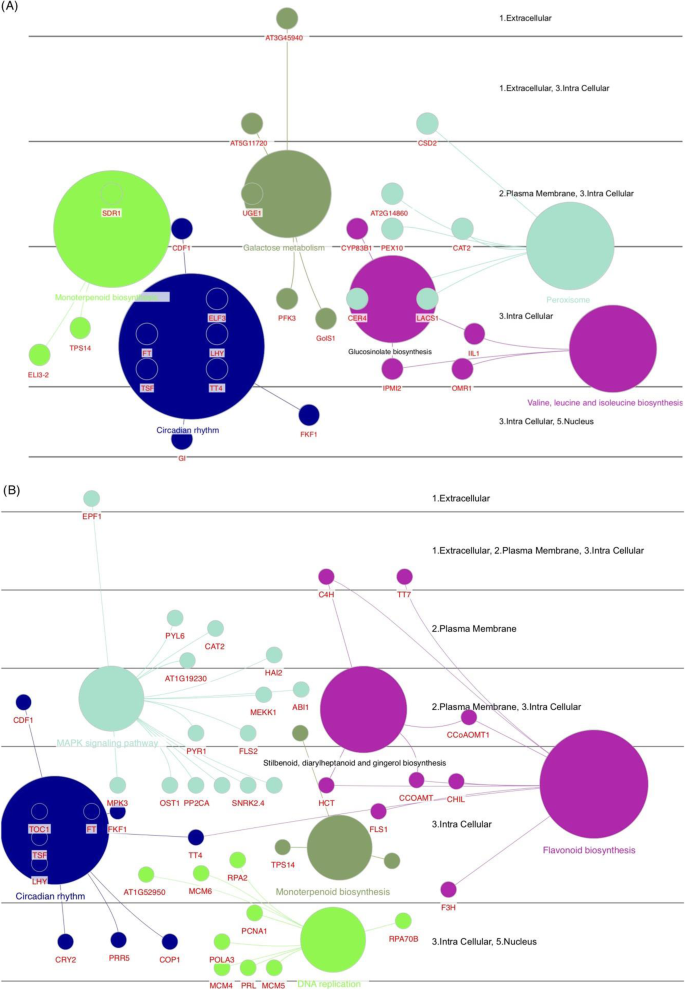
对DEG的基因设定浓缩分析表明,昼夜节律和单萜类生物合成在两种过程中常见富集的术语(图。7).在昼夜节律中,几种核心基因如循环DOF因子1(CDF1),FT,FT(TSF)的双妹妹,晚细长胚轴(LHY),F箱1(FKF1),以及透明TESTA 4(TT4),在两种过程中被确定。该术语还包括在加入喀山中包括GI和ELF3的两个开花相关基因(图。7a),而组成型光致1(COP1),含有五肽重复的蛋白5(PPR5)和密集色谱循环调节剂2(Cry2)基因在加入病毒栏中是独特的(图。7b).基于功能分析结果,我们检测了几个项,如MAPK信号通路和接入Viroflay特有的类黄酮生物合成,以及接入Kashan特有的DNA复制和半乳糖代谢。这表明从营养阶段到生殖阶段的转变可能受到这些途径中涉及的基因的影响。
使用QRT-PCR验证差异基因表达
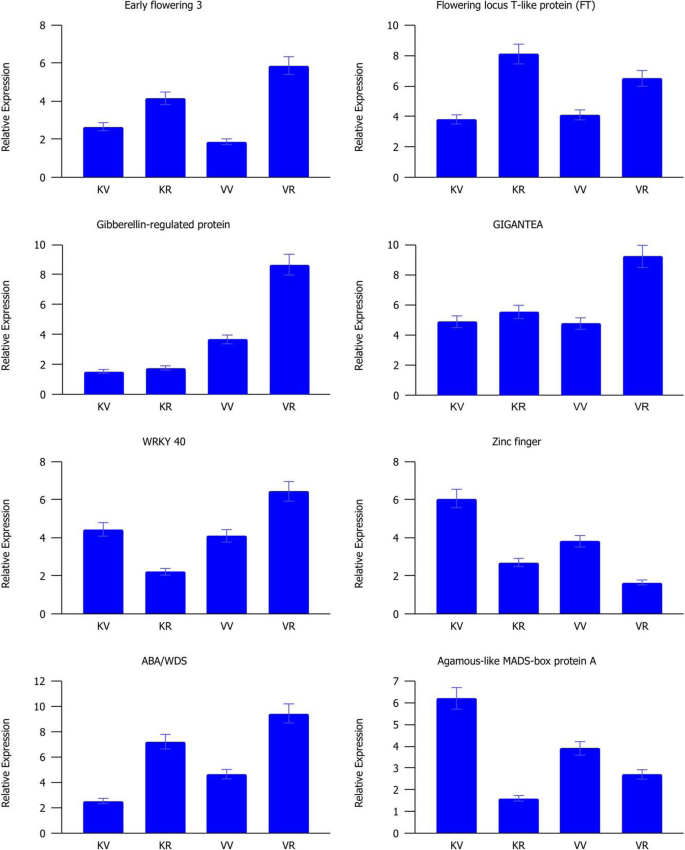
为了验证差异表达分析结果的结果,通过QRT-PCR检查八种与开花相关基因的相对表达(图。8).总体而言,所有选择的基因都表现出与RNA-seq数据一致的模式,验证了qPCR和RNA-seq结果之间的正相关(图)。S5).GI、FT、ELF3和ABA/WDS基因在生殖期显著上调,而Agamous-like蛋白和锌指基因在生殖期显著下调。WRKY 40在加入Kashan的繁殖阶段表达下调,而在加入Viroflay的繁殖阶段表达上调。赤霉素调控蛋白在病毒鞭毛虫从营养阶段向生殖阶段的转变过程中显著上调。
SNP呼叫
为了鉴定与螺栓连接相关的SNP并揭示SNP对相应基因的功能的影响,我们使用了两个菠菜索取的RNA-SEQ数据来识别SNP和可变基因组区域。在数量方面,使用GATK管道的12个文库共产生168,849个SNP。其中,使用截止值过滤后,59,022个SNP仍然存在。此外,对两种纯合和杂合的变体进行筛选这些高质量的SNP,其留下了3397个SNPS(表1).经过探索,从Viroflay中鉴定出大量纯合子参考SNPs(1829个SNPs),显著高于Kashan(550个SNPs),说明Viroflay与基因组参考的关系比登录Kashan更为密切。相比之下,Kashan的大量杂合子SNPs(2727个SNPs)表明,与Viroflay相比,该突变具有更高的遗传变异性。
在进一步调查中,SNP在功能上注释,以获得与SNP相关的基因的综合图,共提供3362个注释的SNP,使用SNPeff。其中,在所有六条染色体上分布了2152个SNPs(图。9).根据SNP对基因功能的影响,绝大多数变体被分类为改性剂的影响(79.12%),其次是低(11.08%),中等(9.36%),高(0.42%).显着的改性剂效果的大部分变体被观察到下游(25.84%),上游(17.1%),仲裁(14.61%)和内含子(10.3%)基因变体(图。S6),表明这些变异存在于未注释的外显子和/或非编码区域。低效应SNPs以UTR(11.77%)和同义(8.3%)变异为主,而中度影响SNPs以错义(11.03%)变异为主。此外,高影响snp以剪接变异为主(0.46%)。
另外,SNP还根据GO术语进行分类,以获得与SNP相关的基因的综合图。过滤的SNP的功能注释显示了SNP与涉及许多重要生物方法的基因的关联。在注释的生物过程中,大量的SNP与参与开花过程中的基因有关,包括光合作用(49个基因),碳水化合物代谢过程(200个基因),繁殖(77个基因),花发育(55个基因),授粉(11基因),胚胎发育(30个基因)和胚胎后发育(70个基因)。
讨论
螺栓的时间对于诸如菠菜等植物作物中的生产力成功至关重要。我们过去的屏幕加入调查肯定了喀山(用早期螺栓化表型加入)的螺栓连接时间因生物粘土而在生产中具有很大的潜力(加入晚螺栓表型)[30.].通过研究植物基因组和转录组,研究人员提供了关于与螺栓连接和开花调节相关的关键基因和机制的重要信息。因此,为了确定菠菜中的分子网络和螺栓连接相关基因,我们使用RNA-SEQ技术研究了不同发育阶段的两种过程中叶组织中最突出的基因表达变化。因此,通过转录组分析进行分级和静脉差异差异表达的大量螺栓和开花相关基因。,通过转录组分析进行再循环。,进入对调节菠菜的分子事件深入了解,用于Go,Kegg,TFS分析。
与DEGS的生物过程相关的术语包括“代谢过程”,“细胞过程”和“生物合成过程”是最高度代表的术语。在所有比较中确定的浓缩术语中,“繁殖”,“碳水化合物代谢过程”,“前体代谢物和能量”和“花卉发展”是最相关的术语,其中具有植物生殖过渡的作用。以前的证据表明碳水化合物在营养转变中的作用作为花序发育和信号分子的能量储备[15.].有趣的是,碳水化合物可以通过开花启动子的上调来促进螺栓化[31.].参与碳水化合物代谢的基因表达模式编码酶的严格分析表明阶段和拆分之间的透明差异模式。我们的一致性研究结果表明,与加入喀山(16个基因)相比,在Viroflay的营养阶段上调了大量的碳水化合物相关的碳水化合物(50个基因)。在这些基因中,参与糖酵解,葡糖生成和钙锌循环的果糖-1,6-双磷酸醛糖酶(FBA),具有重要作用在调节生长和发育过程中的作用[32.,33.发现在营养阶段的加入毒品栏中占据了上调。结论是,FBA活动的增加提高了光合产能,生长和植物生产率或生物量[34.,35.,36.],这与之前研究中报道的Viroflay的高产是一致的[30.],以及与“光合作用”相关的DEGs较多。在参与碳水化合物代谢的基因中,海藻糖-6-磷酸合成酶1 (TREHALOSE-6-PHOSPHATE SYNTHASE 1, TPS1)催化海藻糖-6-磷酸(TREHALOSE-6-PHOSPHATE, T6P)的形成,被认为是碳水化合物状态的代理和协调植物开花诱导的信号[37.,38.,39.].这样,在蔗糖和淀粉合成中起重要作用的α, α -海藻糖-磷酸合酶(TPS)基因[37.,38.[AND TPS1在加入Kashan的营养和生殖阶段的高度上调,而在Viroflay中,在从营养生长生长中过渡期间表达的增加。同样,喀山生长发育过程中蔗糖合成酶活性没有明显的差异(两个阶段的高表达),而其表达水平在从植物植物到阅览室中的繁殖过程中的过渡期间增加。这些结果表明了这些基因在加入毒品栏开花延迟中的潜在作用及其在菠菜中的基因组操纵和遗传改善中的靶向,以获得晚锚固品种。Degs的Go注释结果检索开花促进因子1(FPF1),转录因子疯箱,精灵和GI作为花开发子类别中最重要的基因,在加入喀山中高度表达。以前的研究表明,FPF1基因参与了开花的促进[40,从而启动螺栓。我们发现FPF1在Kashan的营养阶段高表达,而在加入Viroflay的生长过程中没有任何表达变化,这可能表明FPF1对加入Kashan的早期抽薹有更强的影响。另一方面,转录因子MADS-box在Kashan的营养向生殖过渡期间表达量急剧增加,而在加入Viroflay时被认为是一个不显著的基因。在以前的报道中,MADS-box转录因子已经在多种物种中得到了表征,如A. Tequilana.[15.],萝卜[16.], 萝卜 [17.]和生菜[18.]作为控制花卉过渡的主要调节因素,因此在不同发育阶段和不同组织中表现出差异表达模式。GI是一种独特的植物蛋白,涉及多种生物学功能,包括光周期开花,控制昼夜节律,光和激素信号传播[41.,42.,43.].小麦的GI过度表达[44.]和大麦[45.]改变开花时间,导致开花表型早。根据遗传数据,COP1和ELF3通过调节GI的稳定性来调控开花,因此ELF3使COP1与GI相互作用,导致GI降解[43.,46.].在我们的研究中,ELF3和GI在生殖阶段上调,而COP1在两种摘要的植物阶段上调。尽管所有三种基因在从营养阶段到生殖阶段的过渡期间显示出类似的表达趋势,但每个阶段的加入比较表现出不同的表达水平。结果表明了昆明植物营养阶段的ELF3和GI基因的表达水平较低。相比之下,COP1在类似的阶段和加入中显示出更高的表达,表明COP1在菠菜中的低表达导致早开花,可能是通过增加花卉诱导剂的成绩器的增加。此外,Flavin结合,Kelch重复,F盒蛋白1(FKF1),发现时钟控制的基因在加入生殖阶段都有上调[47.].据报道,FKF1通过与GI合成一种上调CO和FT的复合物来促进开花[41.,48.].实际上,这些关键整体基因的表达水平精确地调整了花卉特定基因的表达,并最终确定了精确的FT,以便在加入的viroflay营养阶段中的FKF1表达的低表达可能导致在本加入中延迟开花。
除了核心开花相关的基因外,据报道,TFS是一种必需调节因子,通过影响开花途径基因的表达和整合内源/外源信号来控制螺栓传输和开花[49.,50,51].由于转录因子家族也可以提供基因型或品种之间转录状态的比较,我们对差异表达的转录因子进行了详细的分析。在以往的研究中,许多特异性表达的转录因子如C2C2-GATA、AP2/ERF、MADS-box、MYB、bHLH和NAC在开花过程中被区分出来[15.,16.,18.,51,52,53].研究人员已经证明,GATA在调节开花时间方面具有重要作用,使得两个GATA因子GNC和CGA1答:芥直接抑制SOC1的表达,从而抑制开花[53].在我们的研究中,GATA转录因子在加入Viroflay的营养阶段被过度表达为上调基因,但未被鉴定为DEGs。AP2/ERF超家族成员对代谢调控、生长发育调控以及通过光周期途径调控开花等多种过程具有潜在影响[54].但是,有关如何调节开花时间的AP2 / ERF如何限制的信息。因此,已经讨论了在开花或螺栓上讨论了其他物种中AP2 / ERF的少数例子。例如,七个AP2基因的过表达甘氨酸最大导致提早开花[55]或MiR172的表达,其靶向AP2 TFS的转录物,抑制开花[56].本研究中获得的转录组谱表明,在加入毒物碱的营养组织中下调了7个AP2 / ERF TFS,而17 AP2 / ERF TFS在加入喀山的同一组织中上调,但它们的mRNA水平并未显示出对生殖的重大变化阶段。从本研究中提出的结果和先前的调查中,我们得出的结论是,AP2 TFS之间的不同表达,阶段和登录之间的不同表达应负责控制开花时间。在TF家族中,疯子盒(MIKC型)被引入植物中最重要的开花相关的TFS,螺栓敏感线,品种或物种具有更高的表达[15.,56,57,58].有趣的是,艾玛富集已知一种疯狂箱基因的亚家族,调节两个重要的开花时间调节剂,FLC和FT的转录[59].在我们的研究中,AGAMOUS-like MADS-box蛋白在Kashan入种的营养阶段有较高的表达,支持该入种的抽薹敏感表型。根据本研究中TFs的总体表达模式,我们总结出GATA、MADS-box和MYB TFs在菠菜中产生的转录组特征与那些营养物种相似,但抽薹和开花极大地限制了其产量。
最后,在最新的考虑,我们旨在使用转录组数据调查与菠菜的早期和晚期开花脱落的螺栓相关的SNP。来自转录组数据的SNP的启示产生了168,849个SNP的总和,其在激烈的滤波后,在附加过程中减少至59,022个多态性SNP。此外,对两种纯合和杂合的变体进行筛选这些高质量的SNP,导致VIROFLAY对喀山的纯合SNP。随后,从过滤的3397 SNPS,2152分布在六条染色体的长度上,这对于产生标记辅助的回Cross标记探针是有用的。然而,染色体中的SNP的数量变化;在染色体4中的数量较高,然后是染色体1和染色体5中最低的5。另外,在当前的研究中,SNP几乎已经注释,以获得与SNP相关的基因的综合图。功能性注释结果表明SNP与涉及许多生物过程中涉及的基因的关联。在注释的生物过程中,大多数SNP与参与细胞过程,生物合成过程和代谢过程中的基因有关,类似于萝卜,洋葱和辣椒中报告的SNP的功能注释[20.,52,60,61].有趣的是,大量的SNP也与参与开花过程中的基因有关,包括光合作用,碳水化合物代谢过程,繁殖和花卉发育。更多调查表明,所识别的SNP大多与锌指,AP2 / ERF,BHLH和WRKY等四个主要转录因子相关。详细地,鉴定了在开花途径中涉及的基因中的SNP。在这些基因中,CBF表达1(ICE1)的诱导剂,组蛋白 - 赖氨酸N-甲基转移酶,FKF1,LUX ARRHYTHMO(LUX),与春化途径和昼夜节律时钟相关的植物保护锁1(PCL1)被鉴定为开花的关键基因- 时间控制。
结论
在本研究中,通过使用RNA-SEQ,我们研究了两种菠菜牧草的转录变化从营养生长转变为生殖阶段。我们鉴定了一组与春化,光周期/昼夜钟表,赤霉素,自主和老化途径相关的一组。这些结果证明了一些这些特定基因在加入毒品鼠的开花延迟中的潜在作用及其足够的基因组操纵和菠菜遗传改善的靶标,以获得深锚固品种。
方法
植物材料
根据我们之前的研究[30.],选取Kashan和Viroflay两份材料,分别作为早抽薹和晚抽薹菠菜样品。在之前的研究中[30.],利用国际生物多样性植物遗传资源研究所调查的描述子对44份菠菜营养性状进行了评价。根据本研究结果,将Viroflay和Kashan两份材料分别置于晚花期菠菜和早花期菠菜组。事实上,在Viroflay (87 d)和Kashan (43 d)之间,“开花天数”的变异最大。使病情稳定和消除影响的环境因素,每个加入的种子播种在塑料锅(15厘米直径,25厘米高)与消毒土壤和种植生长室在春天生长条件下3个月在伊斯法罕科技大学,伊斯法罕,伊朗,2018年3月。在此条件下,以开花前的天数计算生长期,结果表明,Viroflay和Kashan的生长期分别为83天和43天。要获得这些示例,不需要权限。该植物材料的正式鉴定由德黑兰大学农业和自然资源学院的植物标本室进行,没有收集和保存凭据标本(这是没有必要的,因为我们没有描述一个新物种)。我们还声明,在伊斯法罕理工大学的实验温室和生长室进行的实地研究符合伊朗当地立法,不需要特定的许可证。
RNA分离、文库构建和测序
在使用Denazist柱RNA分离试剂盒的三种生物学复制的植物(四叶阶段)和生殖(当50%的植物产生的花茎)阶段中,从两种加入喀沙桑和病毒留言中提取总RNA。实际上,选择阶段,使大多数分化在阶段之间进行(日天到开花)。每个样品是从至少十株植物聚集的池中,以降低由基因表达中的细胞差异引起的差异。将RNA定量在琼脂糖凝胶上,使用纳米玻璃分光光度计(NanoDrop Technologies)基于吸光度比(260/280nm和260/230nm)测定质量。此外,根据制造商的建议,在Personformbio(中国上海)进行了后续质量控制,使用QC生物分析仪,cDNA文库制备和测序。在具有150bp配对端读卡器的Illumina平台上进行测序。从测序中获得的读数沉积在NCBI序列读取归档中(https://www.ncbi.nlm.nih.gov/)在加入号码Prjna630139下。
读取映射,表达级别计算和挖掘的挖掘
每个样本的干净的配对端读取分别与菠菜基因组组装版本1进行了定位[28.]使用Star V2.7.1 [62]软件,然后由StringTie v2.0.6汇编的文本[63]的默认参数(没有' -e '选项)。使用StringTie的合并功能将组装好的转录本进行合并,以为阶段和加入创建一组独特的转录本。使用Stringtie软件以合并的转录本作为方向重新组装映射的reads,并使用' -e '和' -B '选项来限制新的转录本预测,并生成一个用于识别DEGs的输入文件。为了进行差异表达分析,使用python脚本prepDE.py生成了用于阶段和加入的基因读计数数据矩阵。最后,通过IDEAMEX网站确定deg [64],使用EdgeR [65],deseq2 [66]和噪音[67].判断基因表达差异显著性的阈值为“FDR≤0.05,logFC>的绝对值= 2,CPM = 1”。
Degs的功能调查
利用基因功能分类工具和最新的基因组参考信息,对所有DEGs进行基因分类和转录因子鉴定分析美国oleracea在Spinachbase(http://spinachbase.org)[29.].对于基因设定富集分析,将所有次数映射到蛋白质序列的来源拟南芥(Araport11_genes.201606.pep.fasta)使用BLAST搜索。这是因为良好的维护和注释拟南芥基因组。最后,ClueGO [68] Cytoscape软件的v3.7.2插件[69用来识别重要通路,并在功能分组网络中可视化基因。
实时定量聚合酶链反应
为了验证螺栓和开花相关基因的表达模式,施用定量实时聚合酶链反应(QRT-PCR)以定量测量不同发育阶段的两种辅助叶组织中的八个候选基因表达。以这种方式,基因特异性引物(表2)使用Primer3软件设计熔融温度(TM)60°C(http://frodo.wi.mit.edu/primer3/).使用ABI系统(ABI VIIA 7实时PCR)在20μl最终体积中进行QRT-PCR反应,含有10μLSSYBR绿母混合物(Biofact,Korea),2μL稀释的cDNA,以及结合添加PCR级水,1μl每种引物(10μm)。QPCR实验基于95℃,在95℃,20 s的95℃,20s的每个引物的特定退火温度下,在72℃下的特定退火温度下进行QPCR实验,最终a熔化曲线计划。使用2 - ΔCT方法进行基因表达的统计分析[70] 通过使用肌动蛋白和GAPDH作为内部参照(家务)基因。
从RNA-seq数据中检测snp
通过联合基因分型方法从转录组数据调用SNP [71]使用基因组分析工具包(GATK 4.1)根据最佳实践工作流程用于RNA-SEQ数据的变体。我们首先使用与Star对齐器的双通映射策略(-twopassmode basic)[62]要生成坐标排序的BAM文件,然后使用Picard Tool AddRorePlacereadGroups添加读取组给Bam文件(https://broadinstitute.github.io/picard/).接下来,Picard工具标记重复读取,这样GATK工具可以自动忽略它们。随后,SAMtools v1.10 [72]应用于合并BAM文件属于每个阶段,并且还在每个合并的BAM文件上执行推荐的Split'N'Trim和Indel Realignings步骤。在这种方法的下一步中,使用具有-erc GVCF模式的单舱共光器算法调用潜在变体,从而导致GVCF文件的生产。然后,通过来自所有GVCF文件的联合基因分型分析调用变体。根据GATK最佳实践的推荐,在此步骤中执行VARIANT滤波,随着以下选项:--filter-expression“QD <2.0” - Filter-name“SNPQDFilter” - Filter-expression“FS> 30.0” -筛选名称“SNPFSFilter” - Filter-expression“MQ <40.0”--Filter-name“SNPMQFilter” - Filter-expression“MQRANKSUM <-12.5”--filter-name“SNPMQRSQFilter”--filter-expression“ReadPosranksum- --filter-name“snprprsfilter”--filter-expression“haplotypescore> 13.0”--filter-name“snphsfilter”--filter-expression“dp> 100 ||DP <5“。接下来,将该VCF文件馈入VCFTOOLS v0.1.16 [73]去除indels,最后,snpsift v4.3 [74用于拉出特定的基因型组合。
数据和材料的可用性
所有RNA-Seq数据以PRJNA630139 (https://www.ncbi.nlm.nih.gov/bioproject/prjna630139.).
缩写
- 度:
-
差异表达基因
- QRT-PCR:
-
实时定量聚合酶链反应
- TFs:
-
转录因素
- 去:
-
基因本体论
- SOC1:
-
二氧化碳过表达的抑制
- FT:
-
开花轨迹T
- LFY:
-
叶子
- CO:
-
君士坦斯
- FLC:
-
开花轨迹c
- SPL1:
-
Squamosa启动子结合蛋白1
- TPS1:
-
Trehalose-6-phosphate合酶1
- ICE1:
-
CBF表达1的诱导剂1
- FPF1:
-
开花促销因子1
- FKF1:
-
Flavin结合,Kelch重复,F盒蛋白1
- COL1:
-
铜般的1
- ELF3:
-
初花期3
- 榴弹炮:
-
Agamous-like
- GI:
-
Gigantea.
参考
- 1。
叶类蔬菜(生菜、菠菜、菊苣、朝鲜蓟、芦笋、羊生菜、大黄和火箭沙拉)的遗传资源收集:组成和差距。植物遗传资源学报。2012;59(6):981-97。https://doi.org/10.1007/s10722-011-9738-x.
- 2。
Koh E, Charoenprasert S, Mitchell AE。有机种植和常规种植制度对27个菠菜品种抗坏血酸、维生素C、类黄酮、硝酸盐和草酸的影响食品科学,2012;60(12):3144-50。https://doi.org/10.1021/jf300051f.
- 3.
联合国粮农组织统计数据库。2016。http://faostat fao / org/site/339 default aspx Acesso em 2018, 25。
- 4.
van treuren r,hoekstra r,van hintum tj。气候变化下荷兰农作物野生遗产的库存与优先级。BIOL CAREN。2017; 216:123-39。https://doi.org/10.1016/j.biocon.2017.10.003.
- 5.
van treuren r,de groot l,hisoriev h,khassanov f,法尔扎利耶夫v,Melyan G,等。Spinacia Turkestanica Iljin和S.Tetrandra Steven Ex M. Bieb的采集和再生。改善菠菜基因库集合。遗传资源作物evol。2020; 67(3):549-59。https://doi.org/10.1007/S10722-019-00792-8.
- 6.
Cho LH,Yoon J,G.通过环境因素控制开花时间。植物J. 2017; 90(4):708-19。https://doi.org/10.1111/tpj.13461.
- 7.
陈C,黄虎,侯k,吴W.锚杆,植物发育中的重要过程,植物两种类型。J植物BIOL。2019; 62(3):161-9。https://doi.org/10.1007/S12374-018-0408-9..
- 8。
ARIF M,Jatoi SA,Rafique T,Ghafique T. Adigenous菠菜遗传资源的遗传分歧,用于农艺性能和多元分析对未来选择标准的影响。J SCI Technol Dev。2013; 32(1):7-15。
- 9。
王志强,王志强,王志强,等。菠菜抽薹、株高和叶片直立性的群体结构及关联分析。HortScience。51 2016;(5): 481 - 6。https://doi.org/10.21273/HORTSCI.51.5.481.
- 10。
Ma J,Shi A,Mou B,Evans M,Clark Jr,Motes D等人。菠菜(Spinacia Oleracea L)叶状性状的缔解映射。植物品种。2016; 135(3):399-404。https://doi.org/10.1111/pbr.12369..
- 11.
拟南芥短日早抽薹与染色质重塑因子有关,并通过抑制FT调控开花。植物细胞学报2003;15(7):1552-62。https://doi.org/10.1105/tpc.012153.
- 12.
Lee Y-S,G.在水稻中的开花时间调节。J植物BIOL。2015; 58(6):353-60。https://doi.org/10.1007/S12374-015-0425-X..
- 13。
周立忠,张志强,张志强,等。玉米开花时间调控基因包括转录因子ZmMADS1。植物杂志。2016;172(1):389 - 404。https://doi.org/10.1104/pp.16.00285.
- 14。
Leijten W,Koes R,Roobeek I,Frugis G.将开花时间从Arabidopsis Thanala转换为Brassicaceae和Asteraceae作物种类。植物。2018; 7(4):111。https://doi.org/10.3390/plants7040111.
- 15.
关键词:水稻,抽薹,转录组分析A. Tequilana.揭示了Fligen,Mads,Fructans和Gibberellins的角色。BMC基因组学。2019; 20(1):473。
- 16.
聂胜,李超,徐立林,王永强,黄丹敏,等。萝卜(Raphanus sativus L.)的从头转录组分析及参与抽薹和开花关键基因的鉴定。BMC基因组学。2016;17(1):389。
- 17.
欧CG,毛泽东,刘LJ,李CJ,仁HF,赵ZW等。用转录组分析表征与红萝卜(Daucus Carota L.)开花时间相关的基因。植物BIOL。2017; 19(2):286-97。https://doi.org/10.1111/plb.12519..
- 18.
韩艳,陈志,吕胜,宁锴,季旭,刘旭,等。MADS-box基因和赤霉素调控莴苣的抽薹。植物科学学报2016;7:1889。
- 19。
ITO S,Song Yh,Josephson-Day Ar,Miller RJ,Breton G,Olmstead Rg等。开花的BHLH转录激活剂控制拟南芥光周期开花调节剂硫核苷酸的表达。PROC NATL ACAD SCI。2012; 109(9):3582-7。https://doi.org/10.1073/pnas.118876109.
- 20.
王勇,刘伟,徐丽,王勇,陈勇,罗晓霞,等。基于转录组序列的SNP标记的开发及其在萝卜种质鉴定中的应用。摩尔品种。2017;37(3):26。
- 21.
王志强,王志强,王志强,等。在拟南芥中,转录因子FLC通过抑制分生组织能力和系统信号传递来实现开花对春化的响应。基因Dev。2006;20(7):898 - 912。https://doi.org/10.1101/gad.373506.
- 22。
邓伟,应华,海利维尔,泰勒JM, Peacock WJ, Dennis ES。开花位点C (FLC)调控拟南芥整个生命周期的发育途径。中国科学院院刊。2011;108(16):6680-5。https://doi.org/10.1073/pnas.1103175108.
- 23。
植物squamosa启动子结合蛋白样(SPL)基因家族的功能进化。植物学报2013;4:80。
- 24。
冬季CM,Yamaguchi N,Wu MF,WAGNER D.在花卉形成时由绿叶和Apetala1调节的转录程序。physiol植物。2015; 155(1):55-73。https://doi.org/10.1111/ppl.12357.
- 25。
张Z,王p,李y,ma l,li l,yang r等人。产格术籼稻叶片开花调控基因的全局转录组分析及鉴定。DNA细胞BIOL。2014; 33(10):680-8。https://doi.org/10.1089/DNA.2014.2469.
- 26。
王志强,王志强,王志强,等。自交和自交植物花区转录组的序列分析。BMC基因组学。2011;12(1):298。https://doi.org/10.1186/1471-2164-12-298.
- 27。
张Z,王p,李y,ma l,li l,yang r等人。产格术籼稻叶片开花调控基因的全局转录组分析及鉴定。DNA细胞BIOL。2014; 33(10):680-8。https://doi.org/10.1089/DNA.2014.2469.
- 28.
Xu C,jiao c,sun h,cai x,wang x,ge c,等。菠菜草案和120种Spinacia access的转录组多样性。NAT Communce。2017; 8(1):1-10。
- 29.
Collins K,Zhao K,Jiao C,XU C,CAI X,Wang X等。菠菜:菠菜基因组学的中央门户网站。数据库。2019年; 2019年。https://doi.org/10.1093/database/baz072.
- 30.
Abolghasemi R,Haghhighi M,Etemadi N,Soorni A,Jafari P.筛选斯普兰山春季文化菠菜的筛选。伊朗农村res。2019; 38(1):87-99。
- 31.
于东,胡颖,王华,潘建平,李永华,娄丹。DELLA-CONSTANS转录因子级联整合赤霉酸和光周期信号调节开花。植物杂志。2016。
- 32.
zhao h, zhao h, zhang h, et al., et al. .古菌自养碳固定。微生物学报。2010;8(6):447-60。https://doi.org/10.1038/nrmicro2365.
- 33.
吕国勇,郭兴国,谢立平,谢春刚,张晓辉,杨勇,等。小麦(Triticum aestivum L.)果糖- 1,6 -二磷酸醛缩酶(FBA)基因家族的分子特征、基因进化及表达分析植物学报,2017;
- 34。
Furbank RT, Taylor WC。C3和C4植物光合作用的调控:分子途径。植物细胞。1995;7(7):797 - 807。https://doi.org/10.2307/3870037.
- 35。
卡尔文循环的再现。Photosynth研究》2003;75(1):1 - 10。https://doi.org/10.1023/a:1022421515027.
- 36。
Uematsu K,Suzuki N,Iwamae T,Inui M,Yukawa H.增加的果糖1,6-双磷酸醛糖酶提高了烟草植物的生长和光合作用。J Exp Bot。2012; 63(8):3001-9。https://doi.org/10.1093/jxb/sers004.
- 37。
Van dijken Aj,Schluepmann H,Smeekens SC。Arabidopsis海藻糖-6-磷酸合酶1对于正常营养生长和过渡到开花至关重要。植物理性。2004; 135(2):969-77。https://doi.org/10.1104/pp.104.039743.
- 38。
张晓东,张晓东,张晓东,等。海藻糖-6-磷酸信号对拟南芥开花的调控。科学。2013;339(6120):704 - 7。https://doi.org/10.1126/science.1230406.
- 39。
戴y,张某,太阳x,李g,元l,李f等。甘蓝型RAPA中不同含量络合期基因表达和调节特征的对比转录分析。基因。2020; 11(4):392。https://doi.org/10.3390/genes11040392.
- 40。
王X,范思,宋m,庞卡,魏h,yu j等。Upland Cotton Gene GHFPF1促进拟南芥促进开花时间和避免遮蔽应答。Plos一个。2014; 9(3):E91869。https://doi.org/10.1371/journal.pone.0091869..
- 41。
Sawa M, Nusinow DA, Kay SA, Imaizumi T. FKF1和GIGANTEA复合物的形成是测定拟南芥日长所必需的。科学。2007;318(5848):261 - 5。https://doi.org/10.1126/science.1146994.
- 42.
Dalchau N,Baek SJ,Briggs HM,Robertson FC,Dodd An,Gardner MJ,等。昼夜振荡器基因Gigantea介导拟南芥昼夜节拍时钟的长期反应。PROC NATL ACAD SCI。2011; 108(12):5104-9。https://doi.org/10.1073/pnas.1015452108.
- 43.
Brandoli C,Petri C,Egea-Cortines M,Weiss J. Gigantea:揭示花卉开发中的新功能。基因。2020; 11(10):1142。https://doi.org/10.3390/genes11101142.
- 44.
赵晓燕,刘明士,李jr,关明明,张新新。参与光周期开花的小麦TaGI1编码拟南芥GI ortholog。植物学报。2005;58(1):53-64。https://doi.org/10.1007/S11103-0055-4162-2.
- 45.
Zakhrabekova S,Gououls SP,Braumann I,Müller啊,Lundqvist J,Ahmann K,等。昼夜节日调节器垫的诱导突变 - 培养大麦的促进短季适应和范围延伸。PROC NATL ACAD SCI。2012; 109(11):4326-31。https://doi.org/10.1073/pnas.1113009109..
- 46。
刘建文,卢比奥V,李N-Y,白山,李世勇,金S-S,等。COP1和ELF3通过调节胃肠道稳定性来控制昼夜功能和光周期开花。摩尔细胞。2008;32(5):617 - 30。https://doi.org/10.1016/j.molcel.2008.09.026.
- 47。
Nelson DC,Lasswell J,Rogg Le,Cohen Ma,Bartel B.FKF1,一种调节到拟南芥开花过渡的时钟控制基因。细胞。2000; 101(3):331-40。https://doi.org/10.1016/s0092-8674(00)80842-9.
- 48。
Imaizumi T, Tran HG, Swartz TE, Briggs WR, Kay SA。FKF1在拟南芥的光周期信号转导中起重要作用。大自然。2003;426(6964):302 - 6。https://doi.org/10.1038/nature02090.
- 49。
Kim S-G,Kim S-Y,Park C-M。膜相关的NAC转录因子通过拟南芥中的开花基因座T调节盐响应性开花。Planta。2007; 226(3):647-54。https://doi.org/10.1007/S00425-007-0513-3.
- 50。
Reeves ph,ellis cm,ploense se,wu m-f,yadav v,tholl d等。协调花卉成熟的监管网络。Plos Genet。2012; 8(2):E1002506。https://doi.org/10.1371/journal.pgen1002506.
- 51。
ning y-q,ma z-y,huang h-w,mo h,zhao t-t,li l等。两种新的NAC转录因子通过与组蛋白脱甲基化酶JMJ14相关联调节基因表达和开花时间。核酸RES。2015; 43(3):1469-84。https://doi.org/10.1093/nar/gku1382.
- 52。
Kim J,Kim D-S,Park S,Lee H-E,Ahn Y-K,Kim Jh等人。通过转录组测序设定的高通量SNP标记的研制加速芸苔属RAPA的遗传背景选择。Hortic Environ Biotechnol。2016; 57(3):280-90。https://doi.org/10.1007/s13580-016-1036-2.
- 53。
李志强,李志强,李志强,等。拟南芥中so1与gata GNC和GNL/CGA1的交叉抑制作用。植物杂志。2013;162(4):1992 - 2004。https://doi.org/10.1104/pp.113.219238.
- 54.
朱L,刘D,Li Y,Li N.功能性磷蛋白蛋白酶分析表明,乙烯反应因子110的丝氨酸-62磷酸化同种型参与了拟南芥螺栓。植物理性。2013; 161(2):904-17。https://doi.org/10.1104/pp.112.204487.
- 55.
姜伟,张晓霞,宋晓霞,杨建军,庞勇。大豆种子发育APETALA2/乙烯响应元件结合因子超家族基因的克隆及表达分析。Front Plant Sci. 2020;11:1348。
- 56.
朱庆华,张海涛。miR172对植物开花时间和花型的调控。acta photonica sinica . 2011;62(2): 487-95。https://doi.org/10.1093/jxb/erq295.
- 57.
宁凯,韩勇,陈志,罗超,王胜,张伟,等。莴苣花发育过程中MADS-box家族基因的全基因组分析植物学报。2019;42(6):1868-81。https://doi.org/10.1111/pce.13523.
- 58。
MADS-box基因与作物驯化:所有性状的jack。英国:牛津大学出版社;2018.
- 59。
柳斯克,吴旭,李俊士,安俊赫。在拟南芥中,AGAMOUS-LIKE 6是一个花启动子,负调控FLC/MAF分支基因,正调控FT。植物j . 2011; 65(1): 62 - 76。https://doi.org/10.1111/j.1365-313X.2010.04402.x.
- 60.
杨玉英,安永康,李e -S,崔胜,等。新一代测序方法在全基因组范围内发现与辣椒的刺激性和抗病相关的单核苷酸多态性标记。Biomed Res Int. 2018;2018:1- - - - - -7.https://doi.org/10.1155/2018/5646213.
- 61.
Kim J,Manivannan A,Kim D-S,Lee E-S,Lee H-E。转录组序列辅助发现和计算分析与Raphanus sativus in-Brosed线条的开花相关的新型SNP的辅助发现分析,用于标记辅助回复繁殖。园艺res。2019; 6(1):1-12。
- 62。
Dobin A,Davis Ca,Schlesinger F,Drenkow J,Zaleski C,JHA S等人。星:超快通用RNA-SEQ对齐器。生物信息学。2013; 29(1):15-21。https://doi.org/10.1093/bioinformatics/bts635.
- 63。
Pertea M,Pertea gm,Antonescu Cm,Chang T-C,Mendell JT,Salzberg SL。Stringtie使得能够从RNA-SEQ读取改进转录组的重建。NAT BIOTECHNOL。2015; 33(3):290-5。https://doi.org/10.1038/nbt.3122.
- 64。
Jiménez-jacinto V,Sanchez-Flores A,Vega-Alvarado L.多实验的综合差异表达分析(IDeamex):用于集成RNA-SEQ数据分析的Web服务器工具。前群体。2019; 10:279。https://doi.org/10.3389/fgene.2019.00279.
- 65。
序列计数数据的差异表达分析。Nat 2010:1-1前。
- 66.
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。https://doi.org/10.1186/s13059-014-0550-8.
- 67.
Tarazona S,García-Alcalde F,Dopazo J,Ferrer A,Conesa A. RNA-SEQ中的差异表达:深度问题。Genome Res。2011; 21(12):2213-23。https://doi.org/10.1101/gr.124321.111.
- 68.
引用本文:王志强,王志强,王志强,等。ClueGO:一种用于破译功能分组的基因本体和通路注释网络的Cytoscape插件。生物信息学,2009,25(8):1091 - 3。https://doi.org/10.1093/bioinformatics/btp101.
- 69.
Shannon P,Markiel A,Ozier O,Baliga NS,Wang JT,Ramage D等人。Cytoscape:用于生物分子交互网络的集成模型的软件环境。Genome Res。2003; 13(11):2498-504。https://doi.org/10.1101/gr.1239303.
- 70。
Rao X,Huang X,周Z,Lin X.改进2(-Delta Delta CT)方法,用于定量实时聚合酶链反应数据分析。生物统计学生物信息学生物水肿学。2013;3.(3): 71。
- 71.
Brouard J-S, Schenkel F, Marete A, Bissonnette N. GATK联合基因分型工作流适用于RNA-seq实验中调用变异。生物技术学报。2019;10(1):44。https://doi.org/10.1186/s40104-019-0359-0..
- 72.
李洪波,李洪波,李洪波,等。序列对齐/映射格式和SAMtools。生物信息学。2009;25(16):2078 - 9。https://doi.org/10.1093/bioinformatics/btp352.
- 73.
DaneCek P,Auton A,Abecasis G,Albers Ca,Banks E,Depisto Ma,等。变体呼叫格式和vcftools。生物信息学。2011; 27(15):2156-8。https://doi.org/10.1093/bioinformatics/btr330..
- 74。
王丽萍,王丽萍,王丽萍,等。一个用于注释和预测单核苷酸多态性影响的程序,SnpEff:果蝇黑腹菌株w1118基因组中的SNPs;iso-2;iso-3。飞。2012;6(2):80 - 92。https://doi.org/10.4161/fly.19695.
致谢
作者非常感谢Sheikh Bahaei国家高性能计算中心(SBNHPCC),以提供计算设施和时间。SBNHPCC得到科技厅和伊斯法罕理工大学(IUT)的支持。
资金
该研究由伊朗国家科学基金会(INSF, No. 97014528)资助,以获得部分研究的资金支持。
作者信息
从属关系
贡献
AS,MH和NE有助于设计实验,AS和RA收集的样品和提取的RNA,如WS和RA分析和解释数据。写了这篇论文。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1
12份菠菜样本转录组测序结果总结。表S2来自12个菠菜样品的星形对准率概述。KV,KR,VV和VR分别代表喀山营养,喀山繁殖,病毒植物和病毒生殖。图。S1。度的分布。(A)营养阶段发现的基因差异比较(B)生殖阶段发现的基因差异比较。x轴表示DEGs在染色体上的位置。y轴是对数倍变化量。图。S2。在六条染色体上分布次数。(a)从阶段的阶梯(b)的比较从阶段的阶段的阶段的比较中发现的阶段的比较。x轴表示DEGs在染色体上的位置。y轴是对数倍变化量。图S3。鉴定的DEGS的基因分类。直方图显示了所有成对比较的分子函数类别下的DEG的分类。图。S4。鉴定的DEGS的基因分类。直方图显示了所有成对比较下的蜂窝分量类别下的DEG的分类。图S5。RT-QPCR和RNA-SEQ数据之间的基因表达相关性(折叠变化的LOG2值)。指示Pearson相关系数和线性回归线。图S6。类型和区域的变体效应的汇总统计。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Abolghasemi,R.,Haghighi,M.,Etemadi,N。et al。转录组结构揭示了菠菜螺栓调节的遗传网络。BMC植物杂志21,179(2021年)。https://doi.org/10.1186/s12870-021-02956-0
收到了:
接受:
发表:
关键字
- 螺栓
- 开花时间
- 菠菜
- RNA-Seq