摘要
背景
热休克因子(Hsfs)和热休克蛋白(Hsps)是控制正常和应激条件下细胞过程的重要分子调控因子。Hsfs和Hsps在不同胁迫条件下的模式植物物种中所起的作用众所周知。虽然植物Hsfs是维持细胞内稳态的信号转导响应的重要组成部分,但Hsps作为伴侣,在胁迫条件下帮助维持受损和新形成的蛋白质的折叠。生菜(摘要以)是一种在田间和水培系统中生长的高消耗蔬菜作物,这些基因家族对人造光响应的作用还没有很好地描述。
结果
利用全基因组分析方法,我们在生菜中鉴定出32个Hsfs和22个小热休克蛋白(LsHsps),其中一些在拟南芥、杨树和水稻中没有同源蛋白。lshsp60、lshsp90和lshsp100在双子叶和单子叶种中高度保守。令人惊讶的是,lshsp70的成员比拟南芥多三倍,比水稻多两倍。有趣的是,生菜基因组的三重复制并没有增加LsHsp70s基因的数量。大量的lshsp70是基因组串联复制的结果。染色体分布分析显示,LsHsp70s基因在Chr1、Chr7、Chr8和Chr9中有较大的串联重复序列。在转录水平上,LsHsfs、LsHsps、LsHsp60s和LsHsp70s家族的部分基因对紫外线和高强度光胁迫反应强烈,而LsHsp90s和lshsp100家族对光刺激反应不明显。
结论
我们的全基因组分析提供了莴苣中Hsfs和Hsps的详细鉴定。染色体定位和共线区分析,以及我们在不同光照条件下的转录分析,为育种项目提供了候选基因,旨在生产能够在使用人工光照的水培系统下健康生长的生菜品种。
背景
不断增加的人口、气候变化条件、水资源的减少以及病原体和昆虫的压力都影响了我们种植作物的方式。水培是作物生产的一种可行的替代方法,可以解决这些问题[1].蔬菜和水果是最常见的水培作物。在这些组别中,生菜(摘要以)是一种重要的蔬菜作物,具有二倍体基因组(2n = 2x = 18条染色体)[2],是水培系统中最常见的蔬菜之一[1,3.,4].生菜的一些生产和健康益处包括生产周期短、体积小以及其丰富的纤维、维生素、矿物质和植物化学成分[5].
生菜生产的很大一部分是依靠营养液和人工光照在室内水培种植的。光的强度和性质是调节光合作用和植物生长的关键因素。在整个生产周期中优化营养和光照可以为室内水培系统提供更好的生长条件[3.,4].然而,以紫外线或高强度光形式持续提供的高能辐射不仅会对植物的生长和发育产生负面影响[6,7],以及基因表达的转录模式[8,9].在这些条件下,胁迫响应基因的表达对保证植物的适应性和正常发育至关重要。两个已知的基因家族在应对不利条件的应激反应的前线:热休克因子(Hsfs)和热休克蛋白(Hsps)。Hsfs和Hsps参与胁迫反应机制,使植物控制蛋白质的折叠、积累和降解。
热休克因子是调控靶基因表达的转录激活因子。植物Hsfs不仅调节热应激反应的核心成分,还调节许多其他环境应激的核心成分,通过调节参与维持细胞内稳态的一大批基因的基因表达动态[10,11].在其他基因中,Hsfs控制着Hsps的转录激活和积累,Hsps作为伴侣,在发育和应激条件下帮助保持损伤和新形成的蛋白质的折叠[11,12].在拟南芥中,有超过200个基因在响应热胁迫时受到Hsfs的转录控制,这表明在胁迫条件下,该转录因子家族具有巨大的控制作用[13].Hsfs具有良好的保守的基本结构,这使得它们可以分为三大类:a型、B型和C型Hsfs [11].A型Hsfs是大多数物种中最大的Hsfs群,包括拟南芥(拟南芥)、水稻(栽培稻)和杨树(杨树trichocarpa) [12,14,15].A型Hsfs对早期反应是必需的拟南芥过度的光[16]和热应激[13].A型Hsfs具有转录激活能力,B型Hsfs作为基因表达的共激活物或阻遏物[17,18,19].例如,B型Hsfs通过促进大豆类黄酮的生物合成有助于耐盐性[19],并抑制拟南芥中的转录[17,18].相比之下,尽管人们认为Hsfs的C型成员不具有激活子功能[20.,21),HsfC1b被证明通过调节水稻对ABA的反应来调节耐盐性和发育[22].植物热休克蛋白比Hsfs更丰富,根据分子量可分为五个主要亚族:小Hsps (sHsps)、Hsp60s、Hsp70s、Hsp90s和hsp1000s。高sps负责蛋白质在正常发育条件和应激条件下的多种分子功能,包括折叠、组装、稳定、再折叠、易位和降解。在许多单子叶和双子叶植物中,Hsps成员被描述为对热、冷、干旱、盐和光胁迫的响应[12,14,15,23,24,25].
大多数关于生菜对光响应的研究都集中在紫外线(UV)和高强度光波波段的高能辐射对作物品质的影响[3.]和屈服[4].然而,Hsfs和Hsps对不同光处理的分子反应还没有被表征。在这里,我们描述了在不同光照条件下Hsfs和Hsps基因的全基因组分析。对Hsfs、sHsps、hsp60、hsp70、hsp90和hsp100的亚类进行了全面描述,为莴苣育种计划提供了新的候选基因。
结果
生菜热休克转录因子的鉴定及性质研究
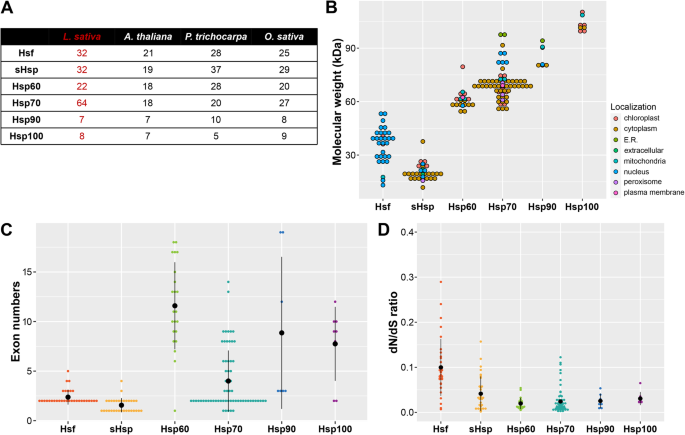
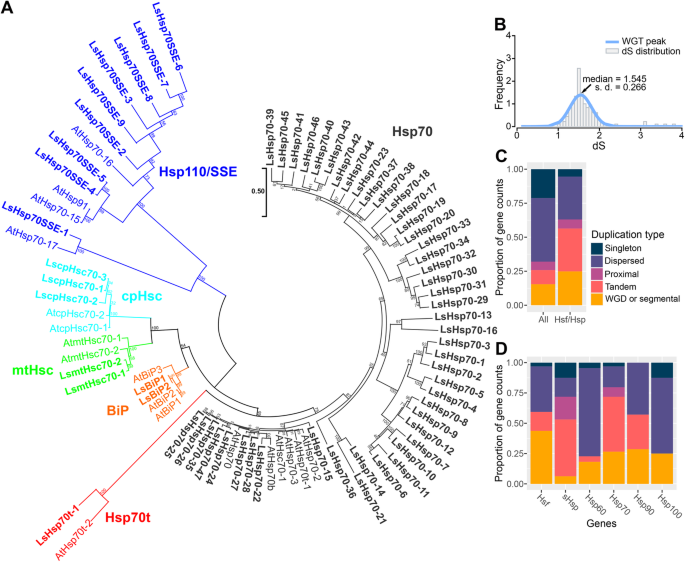
根据最近对莴苣基因组的测序[2],我们使用OrthoFinder识别LsHsfs家族成员[26]加上之前描述的拟南芥的本地自动BLASTP搜索[12)、大米(14],和杨树15Hsfs作为查询序列,然后手动管理。先前的Hsfs全基因组研究已经确定了21个thsfs, 28个OsHsfs和25个PtHsfs。我们的自动搜索得到32个LsHsfs家族成员(图。1a).考虑到测序的生菜基因组是一种二倍体植物,估计基因组大小为2.5 Gb,有趣的是,与水稻和杨树相比,生菜携带更多的Hsfs。
为了进一步描述LsHsfs,我们收集了它们的理化特征,包括染色体坐标、分子量(MW)、理论等电点(pI)、不稳定性指数、脂肪族指数、亲水性和预测的亚细胞定位1:表S1)。LsHsfs家族成员的mw变化很大,从大约13 kDa到54 kDa(图1)。1b).与它们作为转录因子的假设功能一致,大部分LsHsfs被预测定位在细胞核内;然而,LsHsfA1b和LsHsfA8显示出叶绿体信号肽(图。1b;额外的文件1:表S1)。研究这两个基因是否可以在细胞核和叶绿体中发挥双重功能将是有趣的。LsHsfs家族中另一个保守的基因组特征是外显子的数量,显示在2到5个外显子之间(图1)。1c)。
由于我们的分析显示LsHsfs的数量增加,我们决定量化LsHsfs和LsHsp中非同义位点和同义位点的替代率比率,以探索生菜全基因组三倍化过程中蛋白质的进化压力[2].LsHsfs的dN/dS比值最大(0.1);然而,正选择的标志特征被认为是dN/dS > 1 [27].所有LsHsps家族的dN/dS比值均小于或等于0.5(图1)。1d).总的来说,根据dN/dS比分析,在LsHsfs的其他成员和不同LsHsps家族上没有发现正选择的证据(图1)。1d;额外的文件2:表S2)。
生菜Hsfs的分类、基因结构及系统发育分析
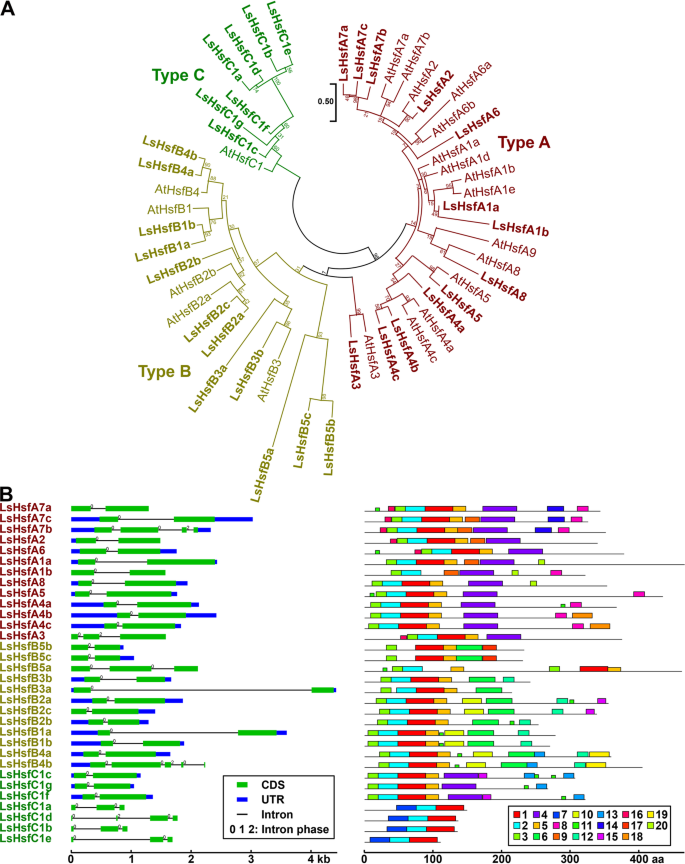
由于拟南芥Hsfs的特征很好,我们使用它的Hsfs蛋白在拟南芥和生菜之间使用OrthoFinder生成正交类群(额外文件3.:表S3)。LsHsfs主要分为三组(图。2a): a型(13个基因),B型(12个基因),C型(7个基因)。为了进一步评估Hsfs的进化关系,基于生菜和拟南芥的全长氨基酸序列构建了一个系统发生树(图1)。2a).虽然拟南芥a型亚家族的大多数成员具有相似数量的同源莴苣基因,但我们发现在A1亚群中只有两个成员(LsHsfA1a和LsHsfA1b)具有4个同源拟南芥Hsf基因。与拟南芥相比,LsHsfs B型和C型亚科的新成员数量更多。有趣的是,我们发现了一个拟南芥中不存在的莴苣亚群,我们将其命名为LsHsfB5。它有三个成员,其中两个属于同一个正交群(LsHsfB5b而且LsHsfB5c)和增加的成员,LsHsfB5a单独形成正交基团。值得注意的是,与拟南芥(1个基因)相比,我们还发现了大量的LsHsf C型基因(7个基因),这主要是LsHsfs家族数量整体增加的原因(图1)。2a). LsHsfs基因结构高度保守;然而,C型lshssfs家族的4个成员(LsHsfC1a, LsHsfC1b, LsHsfC1d, LsHsfC1e)和B型lshssfs家族的3个成员(LsHsfB1a, LsHsfB1b, LsHsfB1c)显示出不同的基因结构和可变基序分布(图1)。2b)。
莴苣的系统发育分析、外显子-内含子结构和motif分布热休克转录因子(LsHsf)基因家族。一个生菜和拟南芥Hsf蛋白的系统发育关系。LsHsf而且AtHsf每个亚族(A型、B型和C型)的成员用不同的颜色表示。b基因结构及基序组成分析LsHsf蓝框、绿框和黑线分别表示非翻译区(UTR)、编码序列(CDS)和内含子。每个内含子上的数字代表内含子阶段(0,1,或2)。系统发育分析是通过最大似然方法产生的。节点上的数字表示基于500个复制的引导值的百分比。所有图案的详细信息见附加文件4:表S4
生菜小热休克蛋白(LssHsps)
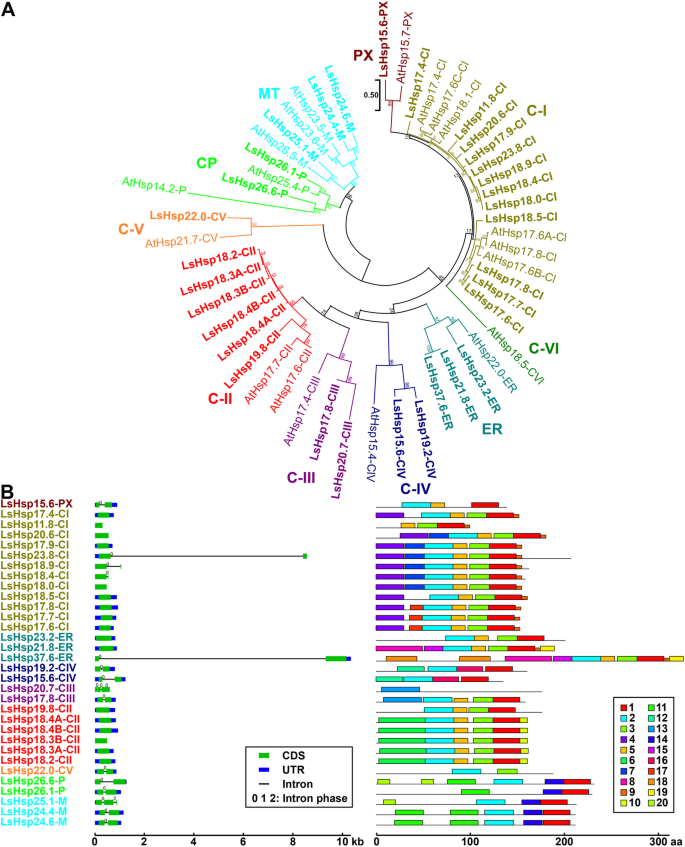
我们鉴定并将生菜小热休克蛋白(LssHsps)分为9个亚家族(图1)。3.a).根据预测的MW和亚细胞定位为每个亚家族命名(图5)。1b).理化特征和预测的亚细胞定位也进行了表征(附加文件1:表S1)。五个莴苣sHsp亚家族是细胞质定位的(C-I, C-II, C-III, C-IV和C-V)。其他4个亚家族预计在内质网(ER)、过氧化物酶体(PX)、叶绿体(CP)和线粒体(MT)中表达(图)。3.a).我们在生菜基因组中发现了大量属于C-I(12个基因)和C-II亚家族(6个基因)的成员,而在拟南芥基因组中只有6个C-I和2个C-II基因(图1)。3.a).有趣的是,我们没有发现LsHsp-CVI成员基于它们与拟南芥的同源性(图1)。3.a).值得注意的是,绝大多数LssHsps只有一个外显子(图1)。3.b);然而,LssHsp-PX、LssHsp-P和LssHsp-M子分支的成员有两个或三个外显子。在基因结构水平上,除了LsHsp23.8-CI和LsHsp37.6-ER含有长内含子,长度分别为7.77 kb和9.16 kb外显子/内含子结构相对均匀外显子/内含子结构(图1)。3.b).此外,尽管LssHsps的每个亚族都有一定程度的保守基序,但也有成员在基序上表现出变异。值得注意的是,预计在细胞质中表达的LssHsps亚家族显示出独特的基序(Motif 4),这可能是它们在植物细胞中的潜在功能的指示(图4)。3.b)。
生菜的鉴定、系统发育和基因结构分析小热休克蛋白(LssHsp)基因家族。一个LssHsp蛋白与答:芥.LssHsp蛋白以粗体标记。每个亚族中的LssHsp和AtsHsp成员(C-I、C-II、C-III、C-IV、C-V、C-VI、ER、MT、CP和PX)用不同的颜色表示。的分类LssHsp基因根据其分子量和亚细胞定位进行分配(附加文件1:表S1)。b基因结构及基序组成分析LssHsp基因。蓝框、绿框和黑线分别表示非翻译区(UTR)、编码序列(CDS)和内含子。每个内含子上的数字代表内含子阶段(0,1,或2)。系统发育分析是通过最大似然方法产生的。节点上的数字表示基于500个复制的引导值的百分比。所有图案的详细信息见附加文件4:表S4
LsHsp60,一个保守的基因家族
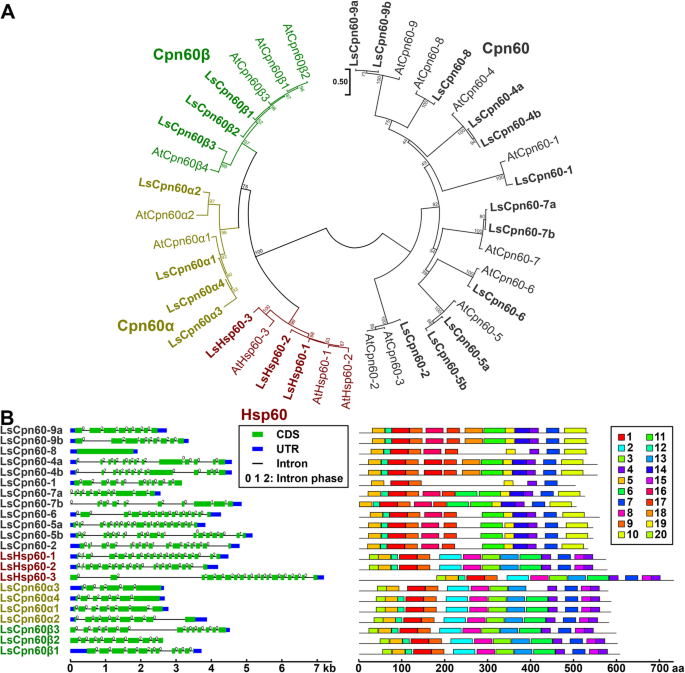
根据莴苣Hsp60家族与拟南芥Hsp60家族的系统发育关系,我们将LsHsp60家族分为4个亚类:Cpn60家族包含12个细胞质基因;Cpn60α,具有4个叶绿体成员;Cpn60β,含有三个叶绿体成员;以及由三个线粒体基因组成的Hsp60亚类(图。4a).一般来说,考虑到每个拟南芥Hsp60成员在生菜中至少有一个同源基因,Hsp60基因在拟南芥和生菜之间具有很好的保守性。此外,没有Hsp60莴苣特异性支(图。4a).在基因结构水平上,LsHsp60具有较好的保守基序结构;然而,外显子的数量在不同的亚科中是不同的。4b).还对LsHsp60进行了物理化学表征,可以在附加文件中找到1S1:表。
生菜的分类、进化关系、基因结构和motif分布热休克蛋白60(LsHsp60)基因家族.一个热休克蛋白60蛋白的系统发育关系l .漂白亚麻纤维卷而且答:芥.LsHsp60蛋白用粗体标记。LsHsp60而且AtHsp60每个亚族的成员(Cpn60, Cpn60α, Cpn60β和Hsp60)用不同的颜色表示。命名的LsHsp60基因是根据最接近的分配的AtHsp60基因。b基因结构及基序组成分析LsHsp60基因。蓝框、绿框和黑线分别表示非翻译区(UTR)、编码序列(CDS)和内含子。每个内含子上的数字代表内含子阶段(0,1,或2)。系统发育分析是通过最大似然方法产生的。节点上的数字表示基于500个复制的引导值的百分比。所有图案的详细信息见附加文件4:表S4
LsHsp60家族另一个有趣的特征是内含子相的可变性。根据外显子最后一个密码子的破坏情况,内含子被分为三种类型。第一个阶段称为第0阶段,在这个阶段内含子不会破坏密码子。第二阶段称为第一阶段,内含子破坏第一和第二碱基之间的密码子。最后是第二阶段,内含子破坏第二和第三碱基之间的密码子[28].与LsHsfs和其他LsHsps家族不同,每个LsHsp60基因至少有一个0期和2期内含子,唯一的例外是LsCpn60-8,它没有任何内含子(图1)。4b)。
生菜hsp70基因的串联复制
hsp70是应激反应的分子调节器,因为它们通过介导蛋白质折叠和/或蛋白质变性来维持蛋白质内稳态[29].Hsp70家族由DnaK亚家族组成,包括细胞质Hsp70 (Hsp70)、截断型Hsp70 (Hsp70t)、塑料型Hsp70 (cpHsp70)、线粒体型Hsp70 (mtHsp70)、内质网定位免疫球蛋白结合蛋白(BiP)和Hsp110/SSE亚家族[30.].我们发现Hsp70亚家族在生菜中大量扩展(图。5a).我们在生菜中鉴定了9个Hsp110/SSE基因、1个Hsp70t基因、3个cpHsc基因、2个mtHsc基因和2个BiP基因(图4)。5a).引人注目的是,莴苣基因组包含47个细胞质Hsp70基因(图1)。5a),这大大增加了Hsp70家族基因的数量(64个),而在拟南芥中发现的基因只有18个(图1)。1a).在细胞质Hsp70的47个成员中,只有5个成员在拟南芥中有同源,其余44个成员是新莴苣hsp60(图1)。5a).我们发现的另一个LsHsp70子类的新成员是LsHsp110/SSE(图1)。5a).在拟南芥中,Hsp110/SSE有4个成员被描述。我们的分析产生了9个成员,其中5个聚在一起,在拟南芥中没有正交同源(图1)。5一个)。
多样化的生菜热休克蛋白70s(LsHsp70s),因为串连复制。一个热休克蛋白70蛋白的系统发育关系l .漂白亚麻纤维卷而且答:芥.LsHsp70蛋白用粗体标记。LsHsp70而且AtHsp70每个亚族的成员(Hsp70, Hsp70t, mtHsc, cpHsc, BiP和Hsp110/SSE)用不同的颜色表示。命名的LsHsp70基因是根据名称分配的AtHsp70相似度最高的基因。b生菜基因组三倍性事件的鉴定。采用高斯混合模型拟合频率和dS值分布。c所有莴苣基因的单例、分散复制、近端复制、串联复制和全基因组复制(WGD)或片段复制的比例LsHsf或LsHsp基因。d中不同类型复制的比例LsHsf或LsHsp基因家族。系统发育分析采用最大似然法。节点上的数字表示基于500个复制的引导值的百分比
莴苣与其他菊科植物的同源分析表明,莴苣自与葡萄系分离以来发生了全基因组三倍化事件[2].为了测试LsHsps和LsHsfs是否在全基因组三倍序列中出现,我们确定了莴苣全基因组三倍序列的dS峰值,并估计了莴苣基因组中所有Hsps和Hsfs序列的dS平均值(附加文件5:表S5)。dS分布结果采用高斯混合模型进行拟合(图5)。5b).有趣的是,我们的分析表明,基于估计的dS值,生菜基因组三倍化并没有促进LsHsp70s基因或LsHsfs基因数量的增加。大多数LsHsfs和LsHsps落在整个基因组三倍高峰之外(平均= 1.545),这支持了这个家族中基因数量的大量增加源于不同的复制模式的证据。为了测试哪些其他可能的复制模式促进了lshsp70和LsHsfs基因的扩增,我们分析并比较了莴苣基因组中的基因复制模式。5c).这些复制模式可分为分散(分布在整个基因组中的不可预测的随机模式)、单拷贝(返回到单拷贝)、串联(在同一染色体上彼此紧密相邻的基因)、近端(彼此靠近但被其他几个基因隔开的基因副本)和全基因组复制(生成整个基因组的额外副本)[31,32].在莴苣基因组的所有基因家族中,分散基因复制(47%)的基因复制数量最多。单基因复制占21%,其次是全基因组复制(16%)、串联复制(10%)和近端复制(6%)。当只分析Hsfs和Hsps时(图。5C),串联复制(32%)是导致两个基因家族中基因数量增加的最大原因。分散复制(31%)和全基因组复制(15%)是导致Hsfs和Hsps基因数量增加的另外两个最大因素(图。5c)。
为了进一步了解lshsp70扩增的原因,我们对其基因复制类型进行了解剖。5d). lshsp70基因数量的增加主要来自串联复制,占全部基因复制类型的45%;绝大多数是细胞质lshsp70的成员6:表S6)。所有其他的复制模式,包括单例复制、分散复制、近端复制和全基因组复制,只占复制模式的一小部分。5d).总体而言,生菜Hsp70基因数量较拟南芥和杨树增加3倍以上,较水稻增加2倍以上。我们的研究结果支持了lshsp70数量增加是串联复制的结果,而与整个生菜基因组的三重复制无关的证据。
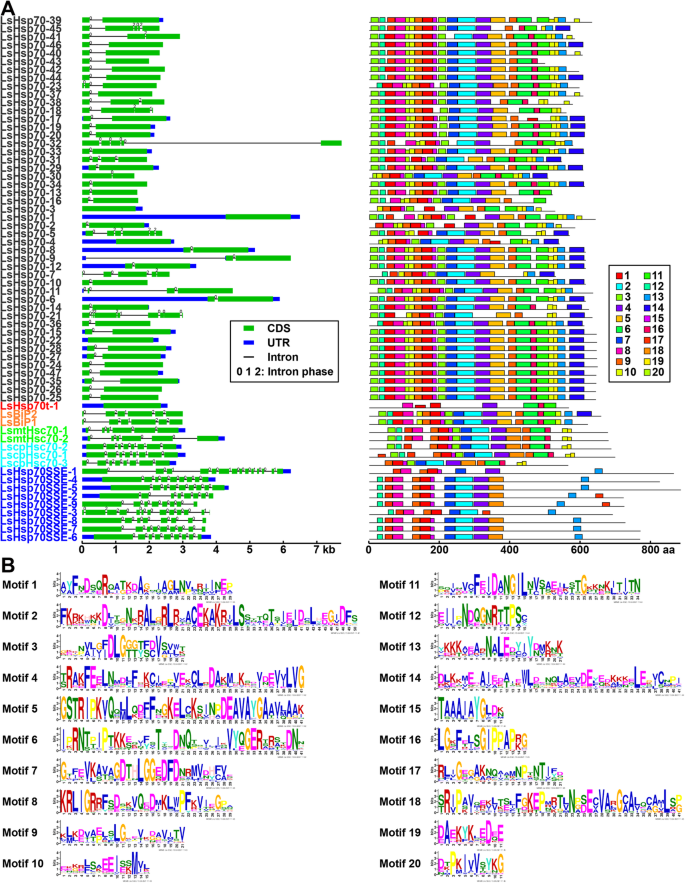
此外,Hsp70亚家族的一个有趣的基因特征是外显子数量少和motif组织保守。LsHsp70t子类的单个成员没有内含子和一些motif,与所有其他子类不同。细胞质中的Hsp70基因有一个内含子和一个保守的motif分布(图。6a).然而,除了motif 5、7、8、15、16、19和20外,有些残基并没有很好地保存(图4)。6b).综上所述,我们的研究结果表明LsHsp70家族的基因数量大幅增加,这可能与对环境信号的应激反应有关。
基因结构及基序组成分析LsHsp70基因。一个蓝框、绿框和黑线分别表示非翻译区(UTR)、编码序列(CDS)和内含子。每个内含子上的数字表示内含子阶段(0、1或2)。bLsHsp70蛋白的保守基序分析展示了20个识别的主题。系统发育分析采用最大似然法。节点上的数字表示基于500个复制的引导值的百分比。所有图案的详细信息见附加文件4:表S4
热休克蛋白90和100
hsp90和hsp100是热休克蛋白亚家族中分子量最高的两个亚家族(图。1b).与其他LsHsps家族不同,与拟南芥、水稻和杨树相比,在生菜全基因组三倍化过程中,LsHsp90和LsHsp100/ClpB家族的基因数量没有增加(图1)。1a).值得注意的是,62%的lshsp100位于叶绿体中,26%位于细胞质中,12%位于线粒体中(图1)。1b). LsHsp90s在包括ER、细胞核、细胞质和叶绿体在内的几个亚细胞间室中表现出更加多样化的定位,以及包括MW、pI和水亲水性在内的物理化学特征(图)。1b;额外的文件1:表S1)。
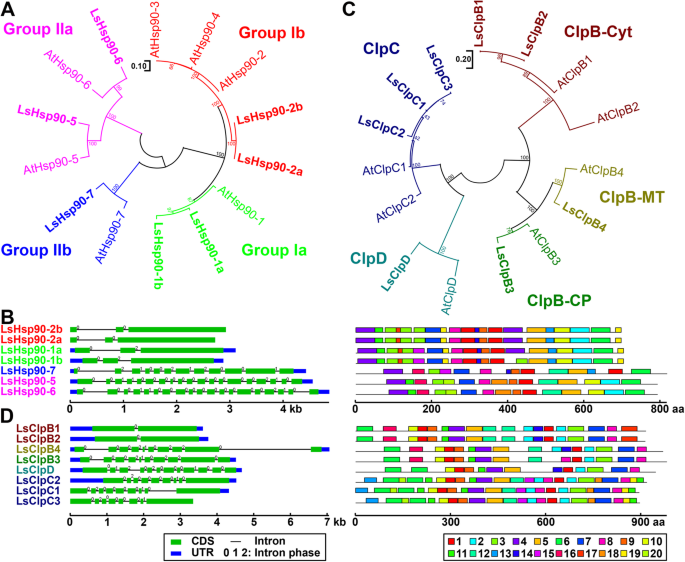
植物Hsp90家族蛋白被分为两个主要的类群(类群I和类群II),并分为四个亚类(类群Ia、Ib、IIa和IIb) [33].类似地,LsHsp90s亚族包含7个成员,分为4个子类。Ia组包括LsHsp90-1a和LsHsp90-1b。7a),拟南芥中单个成员的同源基因。同样,Ib组只包含两个AtHsp90-2/3/4组的正交向量(图5)。7a).在基因结构水平上,根据LsHsp90s的外显子数和基序数,LsHsp90s可分为两大类(图1)。7b). Ia和Ib组的所有成员都有3个外显子和高度相似的基序结构。相比之下,IIa和IIb组成员的外显子数量更多(分别为19和12个外显子),motif模式也不同于Ia和Ib组,但它们之间的motif模式相似(图1)。7b)。
描述的生菜热休克蛋白90(LsHsp90),热休克蛋白100(LsHsp100)基因家族。一个热休克蛋白90的系统发育树l .漂白亚麻纤维卷而且答:芥.生菜热休克蛋白用粗体标出。b基因结构及基序组成分析LsHsp90。c热休克蛋白100蛋白的系统发育分析l .漂白亚麻纤维卷而且答:芥。d基因结构及基序组成分析LsHsp100。a、c命名的LsHsp90而且LsHsp100基因是根据名字分配的答:芥同系物.生菜一半而且Hsp100家族成员根据他们的亚家族用不同的颜色表示(Hsp90ClpB-Cyt, ClpB-MT, ClpB-CP, ClpC和Hsp100中的ClpD中的Ia, Ib, IIa和IIb组。c, dExon-intron组织。蓝框、绿框和黑线分别表示非翻译区(UTR)、编码序列(CDS)和内含子。每个内含子上的数字代表内含子阶段(0,1,或2)。系统发育分析是通过最大似然方法产生的。节点上的数字表示基于500个复制的引导值的百分比。所有图案的详细信息见附加文件4:表S4
LsHsp100/ClpB族包含五个子类(图。7c)、CplB-Cyt(细胞质定位)、CplB-CP(叶绿体定位)、ClpB-MT(线粒体定位)、ClpC和ClpD。系统发育分析表明,生菜和拟南芥拥有相当数量的具有相似定位的群体成员(图。7c).莴苣Hsp100家族基因根据其亚类也表现出结构上的相似性。细胞质ClpB基因仅包含两个外显子;然而,叶绿体和线粒体ClpB, ClpC和ClpD基因包含8到12个外显子(图。7d)。
生菜中Hsf和Hsp基因的染色体分布和复制事件
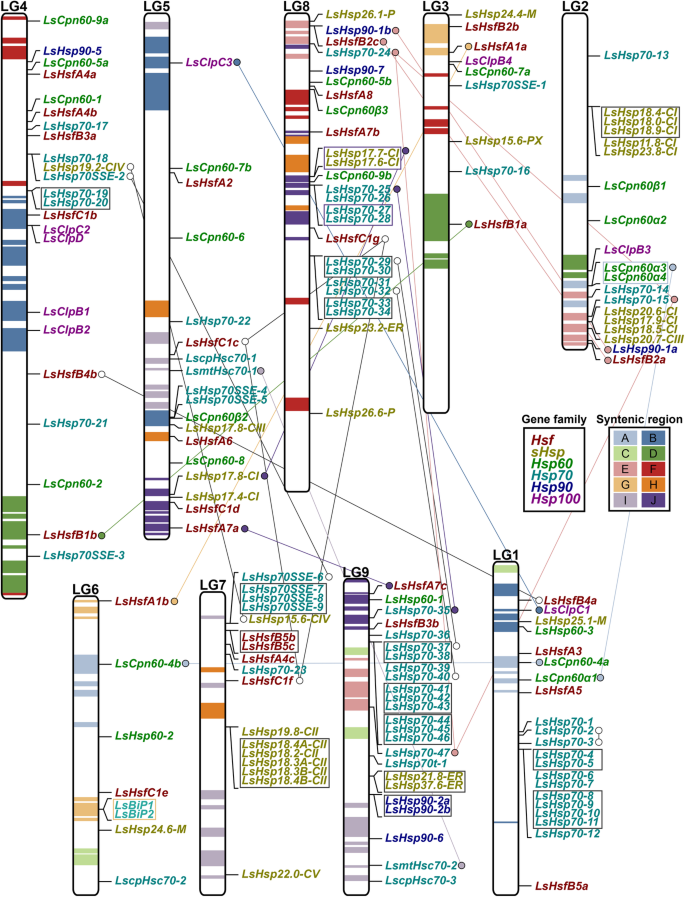
在我们最初的分析中,我们发现与其他物种相比,生菜中Hsfs和Hsps的数量增加了。1a).为了进一步研究哪些特定的Hsfs和Hsps亚家族发生了复制或基因组丢失,我们首先分析了它们的染色体分布。165个Hsfs和Hsps的组合随机分布在9条生菜染色体的每一条上。8).使用先前分类的共音区域[2,我们搜索位于这些区域的Hsps和Hsfs(图。8).值得注意的是,43.7%(14 / 32)的LsHsfs位于共线区。共纤区A出现在chr1、chr2和chr6中,只包含Hsps亚族60,特别是亚类LsCpn60。共频区B存在于chr1、chr4和chr5中,携带着LsClp子类(LsHsp100)的大部分成员。共tenic区域D携带chr3中的LsHsfB1a和chr4中的LsHsfB1b。它也存在于chr2;然而,没有其他LsHsf位于同纤区(D)。同纤区E更不均匀,它出现在chr2、chr8和chr9中。它携带LsHsfs以及LsHsp70和LsHsp90的成员。有趣的是,共纤区G只位于携带LsHsfA1A和LsHsfB2b的chr3,而携带LsBiP1和LsBiP2的chr6 (LsHsp70)。共tenic I区含有chr5中的LscpHsc70-1和LsmtHsc70-1,在chr9中分别发现了它们的重复基因LscpHsc70-3和LsmtHsc70-2。 Syntenic region H carries a diverse mix of LsHsfs and LsHsps and it is located in chr5, chr8 and chr9. Finally, syntenic regions C, F and H do not carry any Hsfs and Hsps.
为了进一步阐明LsHsps是否在生菜基因组中定位为基因簇,我们使用多重共线性扫描工具包X版本(MCScanX)在生菜基因组中进行了共线性分析,e值为10−5(附加文件5:表S6)。在莴苣基因组中发现的大部分基因簇代表LsHsp70s亚家族中的基因(图。8),分布在chr1、chr4、chr7、chr8和chr9中。有趣的是,chr1和chr9分别携带6个和8个lshsp70基因的基因簇。这表明,与拟南芥、水稻和杨树相比,生菜中Hsp70基因的数量更多,可能是聚集串联复制的结果。类似地,chr8携带两个lshsp70基因簇。在莴苣基因组中发现的第二组丰富的基因簇属于LssHsps家族。在chr2、chr7、chr8和chr9中发现LssHsps基因簇的串联重复。我们的研究结果表明,我们在生菜基因组中发现的LsHsfs和lshsp70数量的增加是串联复制的结果。
生菜Hsf和Hsp基因的顺式元素分析
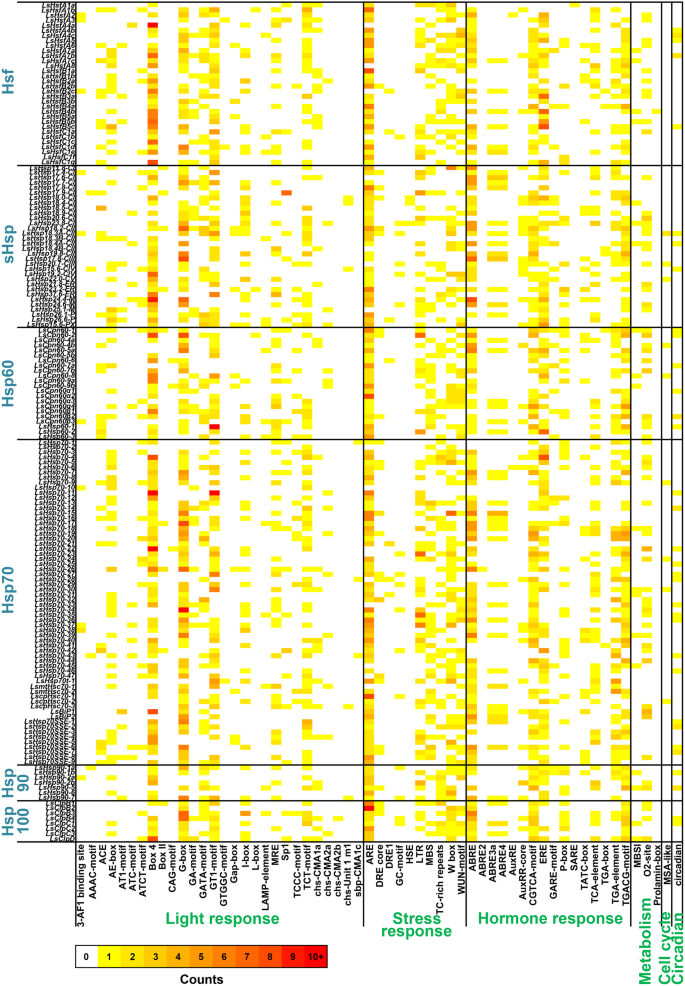
为了了解LsHsfs和LsHsps是如何被调控的,我们使用每个基因上游2 kb的区域对LsHsfs和LsHsps启动子进行了顺式调控元件分析。我们特别关注与光、压力、激素反应以及代谢、细胞周期和昼夜节律相关的顺式调节元素。9;额外的文件6:表S7)。在LsHsfs和LsHsp基因中共鉴定出59个顺式调控元件。有趣的是,在光响应顺式元件中,G-box、GT1基序、TCT基序和box 4在所有LsHsf和LsHsp基因家族中都高度丰富。ARE顺式元件在胁迫响应类中最为丰富,在LsHsfs和LsHsps基因的启动子中均存在多个ARE基序(图1)。9;额外的文件6:表S7)。在激素应激类中,ABRE普遍存在于LsHsfs启动子和大多数LsHsp启动子中。然而,ABRE基序在LsHsp90s的启动子区表达不足(图1)。9;额外的文件6:表S7)。与代谢、细胞周期和昼夜节律相关的顺式元素较少,表明LsHsfs和LsHsps在这些生物过程中的参与程度较低。
不同光照条件下LsHsfs和LsHsps的转录分析
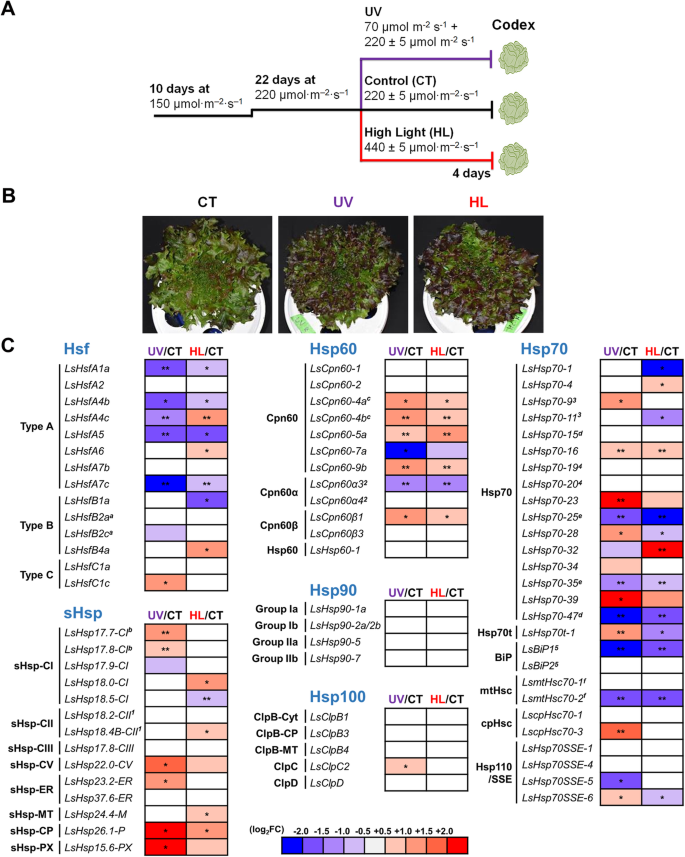
许多研究表明,Hsfs和Hsps基因参与了模式植物对非生物胁迫的响应[12]及其他作物品种[10,14,24,34].为了研究LsHsfs和LsHsps在不同光照条件下的作用,我们种植了莴苣简历。食典委在水培条件下。生菜植株发芽后,在平均光照150±5 μmol·m的广谱LED灯下生长10天−2·年代−1.然后将光照条件调整为220±5 μmol·m−2·年代−122天。对照植株保持在相同的光照条件下,而紫外线处理植株暴露在220 μmol·m的光照下−2·年代−1补充紫外线辐射。将植株暴露在440±5 μmol·m的高强度光照条件下−2·年代−1.所有生产结束处理均施用4天,然后收获成熟生菜植株进行基因表达分析(图1)。10a).总的来说,在紫外和强光条件下,生菜植株变红,而在对照条件下,生菜叶片保持绿色(图5)。10b)。
生菜基因表达分析Hsf而且Hsp不同光照条件下的基因。一个莴苣植株在不同光照处理下的实验设计示意图。l .漂白亚麻纤维卷栽培条件为150 μmol·m光照−2·年代−110天后为220 μmol·m−2·年代−1治疗22 d。控制光(μ摩尔·m−2·年代−1),紫外光(11 μmol·m−2·年代−1添加220 μmol·m−2·年代−1)和高强度光(440 μmol·m)−2·年代−1)施于生菜植株4 d。b外表的l .漂白亚麻纤维卷对照光(CT)、紫外线和高强度光(HL)处理4天后的品种“Codex”。c生菜Hsf和Hsp基因的相对表达。RT-qPCR检测mRNA水平,归一化至LsTUB水平。日志2给出了处理(UV和HL)与对照(CT)的相对表达量的FC (fold change)值。星号表示Wilcoxon 's烧焦等级检验(*)确定的处理和对照组之间的显著差异p< 0.05, * *p< 0.01,* * *p< 0.001)。带有相同字母(a-f)的基因代表分段复制基因;标记相同数量(1-5)的基因属于同一个串联复制基因簇
基于我们的全基因组分析,我们选择了LsHsfs和LsHsps每个亚家族的代表性成员。总体而言,LsHsfs A型构件对紫外线和高强度光应力反应良好。此前在拟南芥中观察到类似的反应[16].LsHsfA1、LsHsfA4b、LsHsfA5和LsHsfA7c是A型Hsfs,当生菜植株暴露在紫外线辐射和强光条件下时,LsHsfA4b、LsHsfA5和LsHsfA7c表现出显著的下调(图4)。10c).有趣的是,LsHsfA4c在紫外光下表达下调,而在高强度光下表达上调。相比之下,B型LsHsfs对紫外光没有反应。这个家族中只有两个成员出现了转录变化;LsHsfB1a表达下调,LsHsfB4a表达上调,对高强度光有响应,但对紫外线辐射无响应,与这类LsHsfs中的所有成员相似。在Hsfs C型的情况下,LsHsfC1c对紫外光和高强度光胁迫均无变化。LsHsfC1c仅对紫外线辐射有反应,表达上调(图。10c)。
值得注意的是,几乎所有LsHsps的亚类都在至少一种处理(紫外线辐射或高强度光)下上调。LsHsp-CP和LsHsp-PX的成员以及LsHsp17.7-Cl, LsHsp17.8-Cl, LsHsp22.0-CV和LsHsp23.2-ER对紫外线处理的响应显著上调,但对高强度光没有响应(图。10c)。
在紫外辐射和强光照射下,LsHsp60s的转录表达主要表现为其成员的上调;如LsCpn60-4a、LsCpn60-4b、LsCpn60-5a、LsCpn60-9b和LsCpn60ß1所示。然而,尽管LsCpn60-2、LsCpn60α4、LsCpn60ß3和LsCpn60-1对两种处理都没有反应,LsCpn60-7a和LsCpn60α3在两种处理、紫外线辐射和高强度光下均下调(图1)。10c)。
就lshsp70而言,大多数新成员对两种处理、紫外线和高强度光胁迫都有反应。LsHsp70s的转录反应是可变的。LsHsp70-23和LsHsp70-39在紫外光照射下表达显著上调,而在高强度光照射下则无响应。相反,LsHsp70-32在高强度光胁迫下表达上调,但在紫外条件下没有显著变化(图1)。10c)。
有趣的是,LsHsp70t-1在紫外线和高强度光下均显著上调和下调。LsBiP1和LsmtHsc70-2在UV和高强度光下均下调。值得注意的是,LsHsp90和LsHsp100对紫外线和高强度光处理没有反应,这表明它们可能不参与对光应激的反应。
由于我们发现了几个LsHsps基因的串联复制,我们选择了其中的几个基因来探索在光照条件下集群表达的可能性。令人惊讶的是,基于我们的RT-qPCR数据,我们没有发现任何复制基因的转录应答(图。10c).有趣的是,LsHsp18.2-CII对光胁迫无反应;而位于同一复制簇中的LsHsp18.4b-CII对强光的响应显著上调。另一个例子是LsCpn60α3和LsCpn60α4, LsCpn60α3在两种光处理下均显著下调,而LsCpn60α4则没有表现出基因表达的变化(图1)。10c).因为我们发现的大多数LsHsp70s新成员都位于星团中(图1)。8),我们测试了其中三个包含lshsp70基因的集群(图。10c).我们发现所有被测试的基因都没有表现出相似的转录模式。值得注意的是,这些集群的功能特征可能有助于更好地理解它们的调节作用。
讨论
植物的胁迫反应通常是协同和/或协调运作的同时机制的结果,以防止、维持和重建细胞内稳态[35,36,37].热休克蛋白反应是应激机制的最佳表征之一。研究表明,高sps在许多细胞应激反应过程中起着重要作用,这可能揭示了整个植物对多种环境胁迫的反应。这种特殊的应激反应机制涉及到不同热休克蛋白家族的激活[29,34由Hsfs调节产生快速的本构反应。因此,不同种类的Hsps与Hsf共同作用以维持细胞内稳态[12,29].在这项研究中,我们对生菜中的Hsfs和Hsps进行了全基因组分析,发现在大多数这些家族中,基因数量总体上有所增加。
多元化LsHsfs
Hsfs家族的组成到目前为止已经在模式植物物种和一些谷类作物中得到了充分的描述[10,12,14,15,38].拟南芥中有21个Hsfs (拟南芥),番茄中有27个Hsfs (茄属植物lycopersicum),稻米28 (栽培稻)、31种玉米(玉蜀黍属但是)及25株杨树(杨树trichocarpa) [23,38,39,40].然而,一些研究表明,基于Hsf家族的数量和组成,Hsf受到进化变化的影响[40].我们对生菜的全基因组分析发现了32个Hsfs基因;与拟南芥相比,其数量更高。1一个;无花果。2a).这种基因数量的增加主要是由于生菜基因组的串联复制[2].有趣的是,与Hsps不同的是,几乎所有的Hsfs在生菜基因组中都不位于串联重复序列中,除了LsHsf5b和LsHsf5c在chr7中位于串联重复序列中(图7)。8).这表明所有LsHsfs都是功能基因,可能在应激反应和内稳态维持中发挥作用。
Hsf蛋白的基本结构是由DNA结合结构域、寡聚结构域和c端激活结构域组成。植物Hsfs (A、B、C)的分类主要基于这三个区域的差异,特别是低聚区域。最明显的区别是在A型和C型Hsfs的低聚结构域插入了额外的氨基酸残基,而在B型和C型Hsfs的C端结构域没有转录激活子基序[10,38].在莴苣中,所有的hsf都遵循相同的基本结构。例如,C型成员缺乏C端结构域,导致基因数量较少(图5)。2b). A型Hsfs被认为是应激基因的转录激活因子。遗传和功能分析表明,HsfA1a和HsfA1b是热休克反应早期所需的中央调节因子[35,37,41].在拟南芥中,Hsfs A型成员在热休克反应基因表达中起着主要的正调控作用,包括Hsp70和Hsp90家族成员[42,43].我们观察到LsHsfA1a在紫外线和高强度光下的强烈下调(图。10),这可能解释了LsHsp90s和lshsps100对紫外和高强度光胁迫条件的反应不足。
串联复制在LsHsp70家族的多样化中发挥了重要作用
在植物中,通过全基因组复制(WGD)、单例、串联、近端或节段事件进行的基因复制是驱动基因家族扩张的主要力量[44,45].与许多其他植物的情况类似[12,14],生菜Hsfs和Hsps经历了复杂的生物重排,从而适应特定的条件(图。8) [2].我们将lshsp70与拟南芥、水稻和杨树进行了系统发育分析,发现了6个不同的组,分别为细胞质Hsp70、Hsp70t、BiP、MtHsc、cpHsc和Hsp110/SSE(图1)。5a).我们发现LsHsp70家族是Hsps中经历了最大串联复制的家族。在64个LsHsp70基因成员中,39%(25个成员)定位于生菜基因组的重复区块。
有趣的是,hsp70在动物中经历了串联复制[46,47],苔藓[48]和植物种类[49,50].例如,在potato (茄属植物tuberosum) [49和苔藓(Physcomitrella金属盘) [48],串联和片段复制事件促进了Hsp70成员在两个物种中的扩展。由于在不同的生物体中发现了Hsp70家族的扩展,以及应激反应的多样性,Hsp70基因被描述为响应非生物应激的重要遗传元素。然而,重要的是要注意到,即使Hsps在马铃薯和苔藓中进行了串联复制,但其扩展并不像我们在生菜中发现的那样大规模。我们的研究结果表明,LsHsp70经历了动态重排,这使得LsHsp70家族新成员的出现成为可能。5),这主要是由于串联复制。有趣的是,39%的lshsp70有一个外显子,所有这些外显子都来自细胞质中高度丰富的Hsp70亚类(图。6),这与之前的研究一致,即植物基因家族的进化与这些基因家族成员的外显子和内含子的多样化有关[51].
光质量对LsHsfs和LsHsps转录水平的影响
在植物的生命周期中,大量的基本过程都是受光调节的。这些过程包括光合作用、植物生长发育、花青素生物合成和基因表达等[3.,4,52,53].在拟南芥中,发现了三种a型Hsfs, HsfA1D, HsfA2和HsfA3调节过剩光能的早期反应[16].在生菜中,在紫外线和高强度光下,我们发现LsHsfA1a和LsHsfA7c的表达强烈下调。10c).此外,LsHsfB1a对强光的响应下调,LsHsfC1c对紫外线的响应上调。
有趣的是,LsHsp18.4B-CII和AtHsp17.6-CI两个基因位于同一个分支中。3.a)在高强度光和紫外线照射下表现出相似的转录表达模式(图。10c).在生菜中,LsHsp18.4B-CII在高强度光照下表达上调,但对紫外光没有反应。同样,在拟南芥中,高强度光处理也诱导了AtHsp17.6-CI,但在紫外光下没有检测到转录本丰度的变化[54].生菜和拟南芥中小热休克蛋白表达模式的相似性可能表明,正如之前在拟南芥中所显示的,在应对环境胁迫时,有一种内聚的家族水平表达模式[12].
一个有趣的发现是,在不同的光照条件下,大多数被研究的莴苣Hsp90和Hsp100家族成员没有发生转录变化。相比之下,LssHsp和LsHsp60家族的大多数成员显著上调(图。10c).一般来说,Hsp90和Hsp100受多种非生物和生物胁迫的应力调节[55],但在拟南芥中,Hsp90s和Hsp100s基因成员在不同胁迫条件下没有表达或发生轻微变化,包括UV [12].虽然还需要进一步的研究来阐明这些基因在紫外线和高强度光照条件下的功能,但我们的数据表明,我们在本研究中使用的水培条件不能触发LsHsp90s和lshsp1000s的分子反应,与在拟南芥中观察到的类似。
LsHsp70家族的许多成员对紫外线和高强度光的特异性反应可能与莴苣细胞质中Hsp70成员复制的增加有关。在光能过高的情况下,已观察到电子传递链的破坏导致光系统II (PSII)的几个亚基的不可逆损伤[56,57,58].因此,植物首先试图驱散以电子能量形式储存在叶绿体中的多余光,以避免热损伤[56].在绿藻的光合作用下衣藻reinhardtii,过表达的HSP70在光抑制期间和光抑制后给予PSII光保护和修复,而降低的HSP70水平(反义结构)导致光敏感性增加[58].与在生菜中观察到的相似,Hsp70成员数量的增加可能与抗高强度光和紫外线伤害能力的增强有关。
在紫外条件下,我们观察到Hsfs和Hsps的高转录表达。例如,LsHsp70-28和LsHsp70t-1在高强度光照条件下明显下调,但在紫外线下显著上调上述Hsps(图1)。10c)被观察到。有充分的文献证明,紫外线照射可诱发活性氧的产生[59].虽然活性氧是重要的信号分子,但当活性氧大量产生时,会对植物细胞造成严重损害[60].hsp70通过维持活性氧水平调节细胞氧化还原状态[55].拟南芥细胞质Hsp70蛋白序列分析显示,与其他Hsps相比,其Cys残基数量较高[54].Cys残基是氧化还原调控的关键元素。因此,在紫外光照射下,莴苣中几个hsp70的高转录水平可能与氧化还原状态的维持有关。我们的研究对不同光照条件下的生菜Hsfs和Hsps进行了初步评估;然而,在对照和胁迫条件下水培生菜的精确调控机制需要进一步研究。
结论
我们对莴苣的热休克因子和热休克蛋白进行了详细的全基因组分析,分别鉴定出32个和165个基因。拟南芥中Hsfs和Hsps基因的系统发育分析表明它们与其同源基因关系密切。有趣的是,在Hsfs、sHsps和Hsp70基因家族中也发现了大量的新成员,这是串联复制的结果。一些Hsfs、sHsps、Hsp60s和Hsp70s基因对紫外线和高强度光照条件具有高度反应,为培育出能够在使用人工光照的水培系统下生长得更健康的生菜品种提供了候选基因。
方法
植物材料和生长条件
红叶莴苣种子。食典委rz预萌发48 h,直至观察到胚根出芽。将发芽的种子移植到岩棉栓中[3.].在步入式生长室内,利用平均光合光子通量150±5 μmol·m繁殖10天−2·年代−1(24小时光周期),日光积分(DLI)为12.96 mol·m−2·d−1由广谱LED灯(飞利浦GP150红/深红/蓝低蓝高输出)提供。温度和相对湿度(RH)分别设置为24℃和60 ~ 80%;有限公司2浓度保持在环境水平。用直径5厘米的塑料杯将大小相近的幼苗移植到单独的深水培养封闭水培系统中。种植植物时使用一种商用水溶性肥料(OASIS®Grower solution水培肥16-4-17),以150 mg·L的浓度溶解在自来水中−1N (EC和pH =约。1.2 d·米−1和6.0,分别)。每个7.6升的水培系统都有一个透明的塑料管连接到一个气泵,以提供持续的曝气。
光治疗
生菜植株生长在一个配有两个相反的多层货架的生长室内。每个架子上都有一个四层的块,用作治疗室。所有舱室都有四个水培系统。植物在广谱LED灯下生长,平均DLI为15.84 mol·m−2·d−1(220±5 μmol·m−2·年代−1;20小时光周期从02:00至22:00 h)。试验室内环境日平均气温(02:00 - 22:00 h)和夜平均气温(22:00 - 02:00 h)分别设置为22℃和21℃;有限公司2浓度,RH分别设置为405 ppm和60 ~ 80%。在室内放置22天后,植物在4天内接受3种处理之一:生产结束(EOP) UV-A (11 μmol·m)−2·年代−1) +白光(220 μmol m−2·年代−1), EOP高强度光(440±5 μmol·m−2·年代−1)和对照组(220±5 μmol·m)−2·年代−1),无EOP处理(图。10一个)。
序列检索与系统发育重建
拟南芥、水稻和杨树的热休克因子(Hsfs)和热休克蛋白(Hsps)序列[12,14,15从公共数据库中检索到。当一个基因有剪接变异时,主要转录本被选为该基因的代表。鉴定假定的莴苣hsf而且热休克,检索到的序列被用作查询,使用自动BLASTP搜索Phytozome中的莴苣基因组数据库[61].E值阈值为1·E−20是使用。当对BLASTP中的一个位点进行多个转录本预测时,选择e值最低的一个转录本作为该位点的代表。为了构建同源基因家族,使用OrthoFinder工具[26].
系统发生树由最大似然法和Le_Gascuel_2008模型生成[62]使用MEGA X软件进行500个Bootstrap复制[63]如上文所述[64].离散伽马分布被用来模拟不同地点之间的进化速率差异。根据与拟南芥蛋白质的系统发育关系,确定了莴苣Hsfs和Hsps的基因名称。根据使用ProtParam工具获得的莴苣sHsps的分子量对其进行分类[65].系统发育分析数据存放在系统发育信息储存库TreeBASE中,可通过以下链接获取:http://purl.org/phylo/treebase/phylows/study/TB2:S27434?x-access-code=f2368699e8e38ce6d23cad64f44dc452&format=html
热冲击因子和热冲击蛋白的理化性质
利用ExPASy服务器上的ProtParam工具估算了所有莴苣Hsfs和Hsps的理化性质,包括分子量、等电点、不稳定指数、脂肪族指数和亲水性[65].利用WoLF PSORT预测生菜Hsfs和Hsps蛋白的亚细胞定位[66].拟南芥和生菜Hsfs和Hsps的多重序列比对采用MUSCLE [67].
生菜基因组Hsf和Hsp基因的染色体定位及共线性分析
从Phytozome中检索到莴苣Hsfs和Hsps基因的染色体位置,摘要以V5基因组数据库(61].所有莴苣蛋白序列都使用自动基本局部对齐搜索工具(BLAST)纳入本地数据库。BLASTP结果通过多重共线性扫描工具包X版本(MCScanX)进行分析[68e值为10−5在整个基因组中产生共线性块。提取Hsfs和Hsps共线性对,绘制共线性图。
非同义替换(dN)与同义替换(dS)比值(dN/dS)分析
每个生菜Hsf或Hsp基因及其对应拟南芥同源基因的非同义突变(dN)与同义突变(dS)之间的比值使用EMBOSS Water成对比对计算[69].使用PAL2NAL工具估计dN/dS比值,输入成对DNA序列比对[70].
为了分析全基因组三倍峰(dS),我们使用了γ-MYN方法[71]以计算dN和dS值,方法是执行上文所述的Tamura-Nei模型[32].由于同义位的饱和取代,dS值> 4被排除在进一步分析之外。采用高斯混合模型拟合生菜全基因组三倍性对的dS分布。
LsHsf和LsHsp基因的基因结构、保守基序和顺式调控元件分析
利用基因结构显示服务器- GSDS v2.0描述了莴苣Hsfs和Hsps的外显子-内含子结构[72].从Phytozome数据库中下载每个Hsf或Hsp基因的基因组序列和编码序列,并进行比对,预测外显子-内含子结构。
使用multiem for Motif Elicitation (MEME) Suite在线程序确定Hsfs和每个Hsp家族的保守基序分析,参数为:最大基序数= 20;站点分布=任意次数的重复;图案宽度= 6至50 [73].
利用PlantCARE数据库,利用每个生菜Hsf和Hsp基因的2000 bp上游区域,确定了莴苣Hsf和Hsp基因的顺式调控元件[74].
RNA分离和RT-qPCR
使用Trizol (Ambion)按照制造商的说明从22天龄的成熟植物的叶片中分离总RNA。利用反转录系统(Invitrogen SuperScript II)和oligo (dT)引物进行cDNA合成。如前所述,采用SYBR Green FastMix (Quantabio)进行实时PCR反应[75].莴苣微管蛋白(LsTUB)作为管家基因进行内部归一化调控。rt - qpcr在QuantStudio™3 Real-Time PCR系统(应用生物系统)中96孔反应板中进行。使用的引物在附加文件中有描述7:表S8。循环参数为95°C下5分钟,95°C下45次循环,持续15秒,60°C下30秒,72°C下30秒[76].RT-qPCR反应在每种光照条件的三个生物重复上对每个RNA样本进行三次重复。熔融曲线分析证实了扩增的特异性。从实时PCR扩增图的对数线性范围内的阈值点(Ct值)计算mRNA的相对量-ΔΔCt方法(77].
统计分析
RT-qPCR数据采用R软件/环境进行统计分析。采用三个独立实验,每个实验有四个生物重复。Wilcoxon(氏)烧焦秩检验[78]用于比较实验组(紫外线和高强度光)和对照组(正常光)的基因表达。平均数差异被认为是显著的p值< 0.05。
数据和材料的可用性
本研究期间产生或分析的所有数据均包含在本文及其补充信息文件中。
参考文献
- 1.
水泥柱嗯。水培食品生产:高级家庭园丁和商业水培种植者的权威指南。第七版。博卡拉顿:CRC出版社;2013.
- 2.
Reyes-Chin-Wo S, Wang Z, Yang X, Kozik A, Arikit S, Song C,等。生菜基因组组装与体外近距离连接数据和全基因组三倍化。Nat Commun。2017;8(1):14953。https://doi.org/10.1038/ncomms14953.
- 3.
Gómez C, Jiménez J.产末高能辐射对室内红叶莴苣营养品质的影响。长的矮。2020; 55:1055-60。
- 4.
周超,张颖,刘伟,查亮,邵明,李斌。光照品质对水培生菜生长及根系有机碳和自身毒素分泌的影响。植物。2020;9(11):1542。https://doi.org/10.3390/plants9111542.
- 5.
金敏敏,文勇,头周成,牟斌,华蓝NL。莴苣的营养价值、生物活性成分及保健价值。食品成分分析。2016;49:19-34。https://doi.org/10.1016/j.jfca.2016.03.004.
- 6.
Bayat L, Arab M, Aliniaeifard S, Seif M, Lastochkina O, Li t。不同光光谱下生长对玫瑰后续耐高光性的影响。国内植物。2018; 10(5)。https://doi.org/10.1093/aobpla/ply052.
- 7.
连续光谱光对榛子植株形态性状和叶片解剖结构的影响。植物科学进展2019;10:1318。https://doi.org/10.3389/fpls.2019.01318.
- 8.
黄军,赵旭,乔瑞杰。拟南芥转录组对强光胁迫的特异性和动态响应。细胞报告。2019;29:4186 - 4199. - e3。
- 9.
Crisp PA, Ganguly DR, Smith AB, Murray KD, Estavillo GM, Searle I,等。拟南芥在过光胁迫和恢复过程中的快速恢复基因下调。植物细胞。2017;29(8):1836 - 63。https://doi.org/10.1105/tpc.16.00828.
- 10.
郭敏,刘建辉,马旭,罗东祥,龚志华,陆明辉。植物热胁迫转录因子(HSFs):响应非生物胁迫的结构、调控和功能。7.植物科学进展,2016;https://doi.org/10.3389/fpls.2016.00114.
- 11.
Fragkostefanakis S, Röth S, Schleiff E, Scharf K-D。通过调节热应激转录因子和热休克蛋白网络工程作物耐热性的展望:提高作物耐热性的Hsfs和Hsps植物细胞环境学报,2015;38(9):1881-95。https://doi.org/10.1111/pce.12396.
- 12.
拟南芥热休克蛋白和转录因子的转录谱分析揭示了热应激和非热应激反应途径之间的广泛重叠。BMC基因组学。2007;8(1):125。https://doi.org/10.1186/1471-2164-8-125.
- 13.
刘红,常勇。拟南芥A1类和A2类热冲击因子在不同非生物胁迫响应和发育中的共同和独特功能。植物杂志。2013;163(1):276 - 90。https://doi.org/10.1104/pp.113.221168.
- 14.
胡伟,胡刚,韩斌。热休克蛋白和热休克因子的基因组调查和表达谱分析显示,水稻在非生物胁迫下存在重叠和应激特异性反应。植物科学。2009;176(4):583 - 90。https://doi.org/10.1016/j.plantsci.2009.01.016.
- 15.
张军,刘斌,李军,张磊,王勇,郑辉,等。杨树Hsf和Hsp基因家族:发育和应激反应中的全基因组识别、组织和相关表达。BMC基因组学。2015;16(1):181。https://doi.org/10.1186/s12864-015-1398-3.
- 16.
Jung H-S, Crisp PA, Estavillo GM, Cole B, Hong F, Mockler TC,等。拟南芥对过度光的早期反应所需的热休克转录因子子集。中国生物医学工程学报,2013;38(5):573 - 576。https://doi.org/10.1073/pnas.1311632110.
- 17.
czarneca -verner E, Pan S, Salem T, Gurley WB。植物B类hsf抑制转录,并表现出对TFIIB和TBP的亲和力。植物生物学杂志2004;56(1):57-75。https://doi.org/10.1007/s11103-004-2307-3.
- 18.
拟南芥HsfB1和HsfB2b作为热诱导基因表达的抑制因子hsf但正向调节获得性耐热性。植物杂志。2011;157(3):1243 - 54。https://doi.org/10.1104/pp.111.179036.
- 19.
边鑫,李伟,牛超,魏伟,胡勇,韩杰,等。在大豆驯化过程中选择的B类热冲击因子通过促进类黄酮的生物合成有助于大豆的耐盐性。新植醇。2020;225(1):268 - 83。https://doi.org/10.1111/nph.16104.
- 20.
Kotak S, Port M, Ganguli A, Bicker F, von Koskull-Döring P. c端结构域的表征拟南芥热胁迫转录因子(Hsfs)和植物a类Hsfs与AHA和NES基序的新特征组合的鉴定,这些基序对激活因子功能和细胞内定位至关重要。植物j . 2004; 39(1): 98 - 112。https://doi.org/10.1111/j.1365-313X.2004.02111.x.
- 21.
Andrási N, Pettkó-Szandtner A。植物热冲击因子的多样性:调控、相互作用与功能。中国植物学报,2017;29(5):369 - 369。https://doi.org/10.1093/jxb/eraa576.
- 22.
Schmidt R, Schippers JHM, Welker A, Mieulet D, Guiderdoni E, muller - roeber B.转录因子OsHsfC1b调控植物耐盐性及其发育栽培稻ssp。粳稻.国内植物。2012年,2012年。https://doi.org/10.1093/aobpla/pls011.
- 23.
杨欣,朱伟,张宏,刘楠,田松。番茄热激因子的基因组鉴定、发育和热胁迫下的系统发育分析及表达谱分析。PeerJ。2016; 4: e1961。https://doi.org/10.7717/peerj.1961.
- 24.
Begcy K、Weigert A、Egesa A、Dresselhaus t与澳大利亚品种相比,欧洲夏小麦(Triticum aestivum)在花粉发育阶段施加中度热胁迫时反应过度。农学。2018;8(7):99。https://doi.org/10.3390/agronomy8070099.
- 25.
王伟,王晓燕,王晓燕。植物热休克蛋白及其分子伴侣在非生物胁迫响应中的作用。植物科学进展2004;9(5):244-52。https://doi.org/10.1016/j.tplants.2004.03.006.
- 26.
Emms DM, Kelly S. OrthoFinder:解决全基因组比较中的基本偏差,极大地提高了正交群推断的准确性。基因组医学杂志。2015;16(1):157。https://doi.org/10.1186/s13059-015-0721-2.
- 27.
Kryazhimskiy S, Plotkin JB。dN/dS的群体遗传学。公共科学图书馆麝猫。2008;4 (12):e1000304。https://doi.org/10.1371/journal.pgen.1000304.
- 28.
真核基因中起始密码子后0期内含子的过量。BMC基因组学。2006;7(1):256。https://doi.org/10.1186/1471-2164-7-256.
- 29.
Rowarth NM, Dauphinee AN, Denbigh GL, Gunawardena AH。Hsp70在花边植物(马达加斯加Aponogeton madagascar)叶子重塑过程中的程序性细胞死亡中发挥作用。中国植物学报,2020;29(3):369 - 369。https://doi.org/10.1093/jxb/erz447.
- 30.
Herath V, Gayral M, Adhikari N, Miller R, Verchot J. tuberosum BiP基因的全基因组鉴定和表征揭示了启动子结构在BiP基因多样性中的作用。Sci众议员2020;10(1):11327。https://doi.org/10.1038/s41598-020-68407-2.
- 31.
王颖,王旭,唐宏,谭鑫,Ficklin SP, Feltus FA,等。基因复制模式对遗传新颖性和冗余性的贡献不同,但在不同的被子植物中表现出相似之处。《公共科学图书馆•综合》。2011;6 (12):e28150。https://doi.org/10.1371/journal.pone.0028150.
- 32.
乔旭,李强,尹浩,齐凯,李亮,王锐,等。植物多倍体-二倍体循环中的基因复制和进化。基因组医学杂志。2019;20(1):38。https://doi.org/10.1186/s13059-019-1650-2.
- 33.
张娟,李娟,刘斌,张亮,陈娟,陆敏。杨树Hsp90基因家族的全基因组分析揭示了不同表达模式、定位和热应激反应。BMC基因组学。2013;14(1):532。https://doi.org/10.1186/1471-2164-14-532.
- 34.
Hahn A, Bublak D, Schleiff E, Scharf K-D。番茄Hsp90和Hsp70伴侣蛋白与热胁迫转录因子之间的串扰。植物细胞。2011;23(2):741 - 55。https://doi.org/10.1105/tpc.110.076018.
- 35.
朱镕基j - k。植物的非生物胁迫信号与响应。细胞。2016;167(2):313 - 24。https://doi.org/10.1016/j.cell.2016.08.029.
- 36.
谷子生殖发育过程中对非生物胁迫的表观遗传响应。植物天线转换开关。2018;31(4):343 - 55。https://doi.org/10.1007/s00497-018-0343-4.
- 37.
植物对同时生物和非生物胁迫的响应:分子机制。植物。2014;3(4):458 - 75。https://doi.org/10.3390/plants3040458.
- 38.
林艳霞,蒋海燕,褚志祥,唐学林,朱树文,程宝杰。玉米热休克转录因子家族的全基因组鉴定、分类与分析。BMC基因组学。2011;12(1):76。https://doi.org/10.1186/1471-2164-12-76.
- 39.
王超,张强,寿辉。水稻OsHsfs基因的鉴定与表达分析。浙江大学学报(自然科学版)2009;10(4):291-300。https://doi.org/10.1631/jzus.B0820190.
- 40.
Scharf K-D, Berberich T, Ebersberger I, Nover L.植物热胁迫转录因子(Hsf)家族的结构、功能和进化。生物化学与生物物理学报——基因调控机制。2012;1819(2):104-19。https://doi.org/10.1016/j.bbagrm.2011.10.002.
- 41.
李辉,闫珊,赵亮,谭杰,张强,高峰,等。组蛋白乙酰化相关细胞壁相关基因上调参与盐胁迫诱导玉米根肿胀。植物生物学杂志,2014;14(1):105。https://doi.org/10.1186/1471-2229-14-105.
- 42.
吉田田,大滨N,中岛J,木大五郎S,水井J,中岛K,等。拟南芥HsfA1转录因子是热休克反应基因表达的主要正调控因子。中国生物医学工程学报,2011;28(5-6):381 - 381。https://doi.org/10.1007/s00438-011-0647-7.
- 43.
Albihlal WS, Obomighie I, Blein T, Persad R, Chernukhin I, Crespi M,等。拟南芥热休克转录因子a1b在良性和应激条件下调节多个发育基因。科学通报,2018;69(11):2847-62。https://doi.org/10.1093/jxb/ery142.
- 44.
Van de Peer Y, Maere S, Meyer A.古代基因组复制的进化意义。中国生物医学工程学报2009;10(10):725-32。https://doi.org/10.1038/nrg2600.
- 45.
Cannon SB, Mitra A, Baumgarten A, Young ND, May G.[找不到书名]。植物生物学2004;4:10。
- 46.
Metzger DCH, Hemmer-Hansen J, Schulte PM。硬骨鱼中hsp70序列的保守结构和表达。比较生物化学物理D基因组蛋白质组学。2016;18:10-20。
- 47.
贝当古BR,费德ME。黑腹果蝇种群中的Hsp70复制:两个是如何以及何时变成五个的?中华分子生物学杂志2001;18(7):1272-82。https://doi.org/10.1093/oxfordjournals.molbev.a003912.
- 48.
唐涛,于安,李萍,杨辉,刘刚,刘磊。苔藓中Hsp70家族的序列分析及其在非生物胁迫响应中的作用。Sci众议员2016;6(1):33650。https://doi.org/10.1038/srep33650.
- 49.
刘静,庞旭,程勇,尹勇,张强,苏伟,等。茄属植物Hsp70基因家族:全基因组鉴定、系统发育和表达模式Sci众议员2018;8(1):16628。https://doi.org/10.1038/s41598-018-34878-7.
- 50.
苏辉,邢明,刘旭,方铮,杨亮,庄明,等。对大白菜(芸苔甘蓝变种capitata) HSP70家族基因的全基因组分析揭示了它们参与花的发育。BMC基因组学。2019;20(1):369。https://doi.org/10.1186/s12864-019-5757-3.
- 51.
徐刚,郭超,单辉,孔辉。外显子-内含子结构中重复基因的发散。中国生物医学工程学报,2012;29(4):369 - 369。https://doi.org/10.1073/pnas.1109047109.
- 52.
儿子K-H, Oh M-M。红、绿、蓝发光二极管对两个生菜品种生长、光合和抗氧化参数的影响。中国生物工程学报。2015;56(5):639-53。https://doi.org/10.1007/s13580-015-1064-3.
- 53.
张颖,徐松,程勇,彭智,韩娟。光强对红叶莴苣花青素合成的影响。PeerJ。2018; 6: e4607。https://doi.org/10.7717/peerj.4607.
- 54.
研究植物热休克蛋白在氧化应激中的作用。植物信号行为学报2008;3(10):856-7。https://doi.org/10.4161/psb.3.10.6021.
- 55.
ul Haq, Khan, Ali K, Gai Z等。热休克蛋白:对抗植物生物和非生物胁迫的动态生物分子。IJMS。2019; 20:5321。
- 56.
光系统的质量控制II:对光和热胁迫的回避和耐受机制与类囊体的膜流动性密切相关。7.植物科学进展,2016;https://doi.org/10.3389/fpls.2016.01136.
- 57.
王晓燕,王晓燕。光合作用下电子传递和光抑制的调控。cpp。2014; 15(4): 351 - 62。https://doi.org/10.2174/1389203715666140327105143.
- 58.
叶绿体靶向热休克蛋白70 (HSP70)在光抑制过程中和光系统II的光保护和修复中起着重要作用。植物细胞。1999;11(6):1165 - 78。https://doi.org/10.1105/tpc.11.6.1165.
- 59.
Yokawa K, Kagenishi T, baluikka F. UV-B诱导活性氧的产生促进拟南芥根尖细胞bfa诱导间室的形成。6.植物科学进展,2016;https://doi.org/10.3389/fpls.2015.01162.
- 60.
Begcy K, Mariano ED, Mattiello L, Nunes AV, Mazzafera P, Maia IG,等。拟南芥线粒体解偶联蛋白使转基因烟草植株对干旱和盐胁迫具有耐受性。《公共科学图书馆•综合》。2011;6 (8):e23776。https://doi.org/10.1371/journal.pone.0023776.
- 61.
Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J,等。Phytozome:绿色植物基因组学比较平台。核酸学报,2012;40(D1): D1178-86。https://doi.org/10.1093/nar/gkr944.
- 62.
Le SQ, Gascuel O.一种改进的通用氨基酸替代基质。分子生物学与生物学报2008;25(7):1307-20。https://doi.org/10.1093/molbev/msn067.
- 63.
施特彻格,田村K,库马尔S. macOS的分子进化遗传学分析(MEGA)。分子生物学与生物学报2020;37(4):1237-9。https://doi.org/10.1093/molbev/msz312.
- 64.
Begcy K, Mariano ED, Lembke CG, Zingaretti SM, Souza GM, Araújo P,等。一种进化上保守的抗旱甘蔗基因的过表达增强了耐盐和抗旱能力。安机器人。2019;124(4):691 - 700。https://doi.org/10.1093/aob/mcz044.
- 65.
Gasteiger E, Hoogland C, Gattiker A, Duvaud S, Wilkins MR, Appel RD,等。ExPASy服务器上的蛋白质识别和分析工具。正确的做法:编辑沃克·JM。蛋白质组学协议手册。风险:胡玛纳出版社;2005.p . 571 - 607。https://doi.org/10.1385/1-59259-890-0:571.
- 66.
霍顿P, Park K-J, Obayashi T, Fujita N, Harada H, Adams-Collier CJ,等。WoLF PSORT:蛋白质定位预测器。核酸Res. 2007;35 Web Server: W585-7。
- 67.
埃德加钢筋混凝土。MUSCLE:多序列对齐,高精度,高吞吐量。核酸学报,2004;32(5):1792-7。https://doi.org/10.1093/nar/gkh340.
- 68.
王Y,唐H, DeBarry JD,谭X,李J,王X, et al。MCScanX:用于检测和进化分析基因共线和共线性的工具包。核酸学报,2012;40(7):e49。https://doi.org/10.1093/nar/gkr1293.
- 69.
常见分子子序列的鉴定。中华分子生物学杂志1981;147(1):195-7。https://doi.org/10.1016/0022 - 2836 (81) 90087 - 5.
- 70.
Suyama M, Torrents D, Bork P. PAL2NAL:蛋白质序列比对到相应密码子比对的鲁棒转换。核酸Res. 2006;34 Web Server: W609-12。
- 71.
王东鹏,万慧玲,张松,于娟。γ-MYN:一种考虑可变替代率的Ka和Ks估计新算法。直接杂志。2009;4:20。
- 72.
胡斌,金娟,郭爱云,张宏,罗杰,高刚。GSDS 2.0:升级版的基因特征可视化服务器。生物信息学。2015;31:1296-7。
- 73.
贝利TL,博登M,布斯克FA,弗里思M,格兰特CE, Clementi L,等。模因套件:发现和搜索模因的工具。核酸Res. 2009;37 Web Server: W202-8。
- 74.
Lescot M. PlantCARE,植物顺式作用调控元件数据库和启动子序列硅分析工具门户。核酸学报2002;30(1):325-7。https://doi.org/10.1093/nar/30.1.325.
- 75.
用叶领法跟踪玉米花粉发育。植物天线转换开关。2017;30(4):171 - 8。https://doi.org/10.1007/s00497-017-0311-4.
- 76.
周丽珍,周丽珍,周丽珍。玉米花粉发育四分体期瞬时热胁迫对雄性不育的影响。植物杂志。2019;181(2):683 - 700。https://doi.org/10.1104/pp.19.00707.
- 77.
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25(4):402 - 8。https://doi.org/10.1006/meth.2001.1262.
- 78.
袁js, Reed A,陈f, Stewart CN。实时PCR数据的统计分析。BMC生物信息学。2006;7(1):85。https://doi.org/10.1186/1471-2105-7-85.
确认
不适用。
世界自然保护联盟政策声明
生菜种子从Kalera公司获得。我们对生菜植物的实验研究,包括植物材料的收集,符合相关的机构、国家和国际指导方针和立法。本研究没有使用濒临灭绝的植物品种。
作者的信息(可选)
T.K;轮上;j;C. G和K. B来自佛罗里达大学环境园艺系,盖恩斯维尔,佛罗里达。T. L来自佛罗里达大学园艺科学系,盖恩斯维尔,佛罗里达。
资金
这项工作得到了佛罗里达大学农业和生命科学学院的种子竞争基金研究计划(资助号为00129910)的支持。我们也感谢Kalera公司对水培实验的资助。
作者信息
从属关系
贡献
T.K.和s.s.进行了生物信息学分析。T.K.和J. J进行了实验。C.G.提供了植物材料。T. L提供了设备和试剂。K.B.构思了这个实验。T. K和K. b .分析了数据。T.K.准备了无花果。KB写的手稿从T.K.输入所有的作者阅读和批准的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:表S1。
的列表LsHsf而且LsHsp基因及其理化性质。
附加文件2:表S2。
莴苣与拟南芥同源基因间的dNdS比值。
附加文件3:表S3。
植物Hsfs和Hsps基因的正交群答:芥而且l .漂白亚麻纤维卷。
补充文件4:表S4。
各基因家族的模因分析。
附加文件5:表S5。
用γ-MYN方法计算dS峰。
附加文件6:表S6。
莴苣的串联和分段复制Hsf而且Hsp基因。
附加文件7:表S7。
顺式调控元件分析存在于2kb的启动子区域LsHsf而且LsHsp基因。
附加文件8:表S8。
RT-qPCR分析所用引物列表。
额外的文件9。
补充索引。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
金,T,萨姆拉吉,S, Jiménez, J。et al。生菜热冲击因子和热冲击蛋白在紫外和强光胁迫下的基因组识别。BMC植物杂志21日,185(2021)。https://doi.org/10.1186/s12870-021-02959-x
收到了:
接受:
发表:
关键字
- 生菜
- 热休克因子
- 热休克蛋白
- 基因复制
- 光照条件