抽象的
背景
西瓜的果肉颜色(Citrullus lanatus)评估外观质量和影响消费者偏好的关键贡献者的一个很好的指标。但这种复杂性状的分子机制仍然很大程度上是未知的。在此,分析了在栽培西瓜的果实开发过程中的类胡萝卜素和转录组动力学进行了分析。
结果
在5个西瓜基因型中共检测到13个类胡萝卜素基因和16781个差异表达基因,包括1295个转录因子(TFs)。类胡萝卜素的综合积累模式与肉色密切相关。通过比较转录组分析发现许多潜在的结构基因和转录因子与类胡萝卜素生物合成途径有关。差异表达基因分为6个亚群,分布在不同的氧化石墨烯条件和代谢途径中。此外,我们进行了加权基因共表达网络分析,预测了决定类胡萝卜素含量的6个主要模块中的枢纽基因。Cla018406(伴侣蛋白dnaJ-like蛋白)可能是β-胡萝卜素积累的候选基因,并在橙色果肉中高表达。CLA007686.锌指CCCH结构域蛋白在红瓤西瓜中高度表达,可能是番茄红素积累的关键调控因子。CLA003760.(膜蛋白)和Cla021635(光照I反应中心亚基II)预计是集线器基因,可能在黄色肉形成中发挥重要作用。
结论
5个西瓜基因型的类胡萝卜素组成和含量差异较大。通过代谢产物和转录组的联合分析,揭示了一系列候选基因。这些结果为分析西瓜果实果肉颜色形成的候选基因和分子基础提供了重要的数据来源。
背景
西瓜(Citrullus lanatus)属于葫芦科,原产于非洲。目前,西瓜已成为世界五大鲜食水果之一,我国西瓜产量和消费量居世界首位。西瓜果肉含有很多营养物质,如番茄红素、瓜氨酸等与人类饮食有关的促进健康的化合物[1].类胡萝卜素是人类生命和健康所必需的[2那3.].据报道,番茄红素涉及预防癌症和心血管疾病[4.].-胡萝卜素、-隐黄质和-胡萝卜素是维生素A的主要前体[5.],在视力保护中起重要作用[6.].
在植物中,类胡萝卜素主要参与光合作用,光收获和光保护[7.].类胡萝卜素也是植物激素(脱落酸和胞嘧啶)的基本前体,这是用于植物开发和应力响应的关键调节因子[8.].阿皮皮毒素是类胡萝卜素氧化和酶切割衍生物。阿皮皮毒素参与各种生物过程的植物生长和发展[9.那10.],也有助于花瓣或水果的风味和香气[11.].
栽培的西瓜有能力在水果中合成各种类胡萝卜素,负责生动的肉体颜色,包括白色,黄色,橙色,粉红色,红色和混合颜色[12.].西瓜是一种合适的模型物种,用于研究肉质水果中胡萝卜素生物合成的调节机制,因为各种颜色肉体。番茄红素是红肉西瓜的主要颜料[13.]、叶黄素(玉米黄质及其衍生物、新黄质和紫黄质)是黄瓤西瓜的主要色素[14.].β-胡萝卜素,ζ-胡萝卜素,脯番茄红素是橙瓤西瓜中的主要色素[15.].一些研究集中在西瓜果肉颜色的遗传上。淡黄色(C)占红色/粉红色/橙色的占主导地位(C),白色的肉(Wf)是黄色肉体的背景[16.].这PY基因产生淡黄色的肉[17.].鲜红的红肉,y可控硅,珊瑚红肉是占主导地位[12.].报道了与西瓜中的肉颜色相关的一些定量性状基因座(QTL)。用综合遗传联系地图鉴定在连杆组2和8上鉴定出与红肉相关的QTL相关[18.].Bang等人(2010)发现Clcyb.600标记与红色或黄色果肉表型完美共生[17.].Liu等(2015)在一个红、淡黄色果肉遗传群体的第4染色体上报道了番茄红素含量和红果肉颜色相关的QTL [19.].轨迹y可控硅首先使用源自猩红色和珊瑚红色肉品种的分离的群体在染色体6上映射到染色体6上的猩红色红肉[20.].与β-胡萝卜素果实中的QTL在西瓜果实中映射到染色体1 [21.].染色质定位的磷酸盐转运体升高clpht4; 2表达水平对于类胡萝卜素积累和肉颜色形成是必需的[22.].根据最近的一项研究,ClLCYB基因通过减少其蛋白质水平而不是转录水平来促进红色肉颜色[23.].
一些研究侧重于番茄红素含量与番茄红素代谢的基因表达水平的关系,跨越青年对西瓜成熟水果的时期[24.那25.].朱等人发表了对比对红色转录分析对浅黄色西瓜。(2017)[26.].然而,在各种颜色的西瓜基因型中形成肉体颜色形成的综合分子机制仍然是模糊的,并且在比较转录组和共表达网络分析的基础上报道了与西瓜颜色相关的稀有调节剂。在这里,我们在不同果实发育阶段的五种肉类西瓜中进行了对比较转录组和类胡萝卜素的综合分析。通过成对转录组比较确定一些候选调节剂。通过加权基因共表达网络分析(WGCNA)证实了每种类胡萝卜素的共表达基因和枢纽基因的模块。数据集在控制肉颜色中提供了关于动态基因表达网络的全面视图及其潜在作用。这项工作还为了解西瓜肉颜色形成的分子调节机制提供了重要的数据依据。
结果
5个西瓜基因型果实发育过程中的果肉颜色评价及类胡萝卜素含量变化
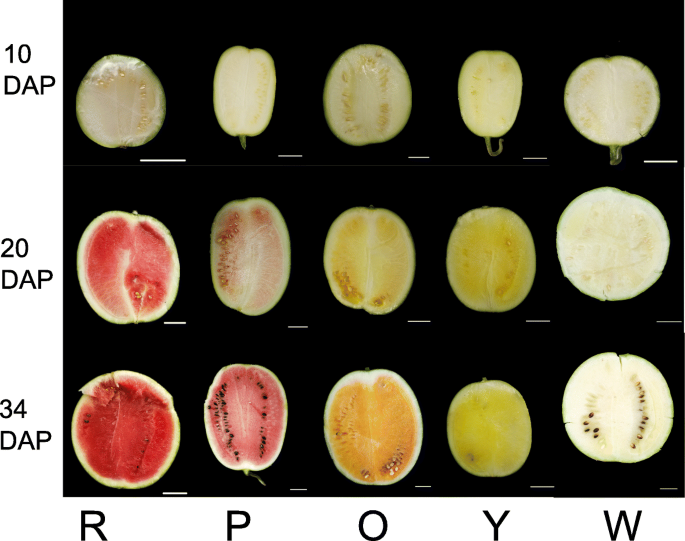
在不同发展阶段的西瓜肉体特征已显示在图2中。1。我们确定了颜色空间值以确认肉体颜色变化。在授粉后10天(DAP)所有水果是白肉,不同基因型之间的颜色空间参数没有显着差异(附加文件1:表S1)。在20个Dap,水果的肉体呈现出不同程度的白色,粉红色或黄色欠类胡萝卜素积累。20 dap是迅速积聚颜料的关键时期。在34 dap,果实成熟,肉体具有鲜艳的色彩,除了白色肉基因型。在20 dap和34个Dap的不同肉体水果中观察到L *,A *,B *和色度(c)的显着差异。肉颜色的差异出现在20个DAP上,在这项研究中在34个DAP中更明显。
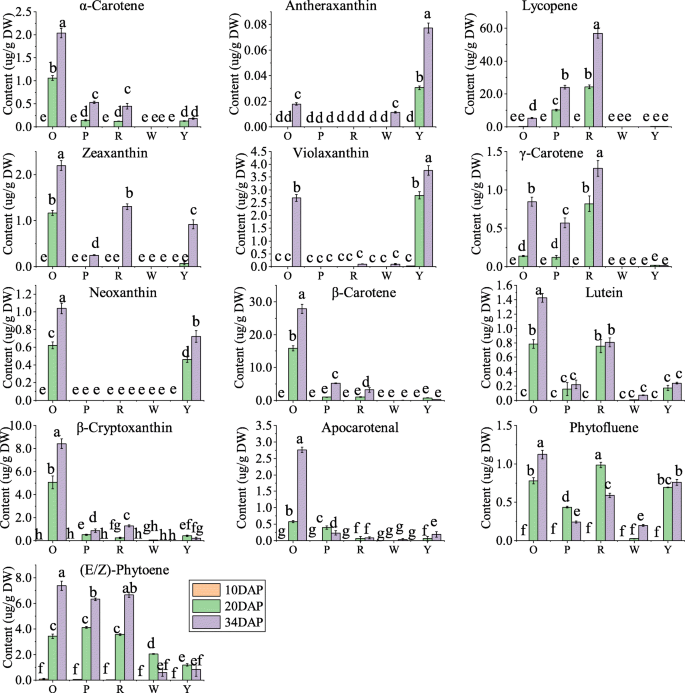
西瓜果实中的肉颜色由类胡萝卜素组成和含量决定。使用液相色谱 - 质谱法测量三个阶段的不同果实的类胡萝卜素在不同果实中的变化(附加文件1:表S2,图2).使用了十八类胡萝卜素标准,并在本研究中检测到13例类胡萝卜素。PCA结果和颜色比较分析表明代谢数据的可靠性(附加文件2:图S1)。在DAP的10个点,除了幼嫩果实中微量的植物烯外,其他色素均未检测到。在DAP 20和34时,类胡萝卜素含量随果实发育和成熟而逐渐增加。番茄红素、β-胡萝卜素和紫黄素分别在红色、橙色和黄色果肉中含量最高。番茄红素也是粉红果肉的主要色素。白肉果中类胡萝卜素含量极低,在34 DAP时测定了植物荧光素、植物烯、紫黄质、蒽黄质和叶黄素的微量含量1:表S2,图2).此外,红肉西瓜的总类胡萝卜素含量最高,34个系列,其次是橙色,粉红色,黄色和白色肉体(附加文件1:表S2)。
连合在一起,颜色空间值和类胡萝卜素水平揭示了红色,粉红色,橙色,黄色和白色基因型之间的大量变化。可以想到,在5种不同的肉状西瓜果实中的三个阶段的次数可能在确定肉颜色形成时起着重要作用。
不同颜色西瓜果肉的转录本序列分析
为了探讨5个基因型西瓜果实发育过程中果肉着色的潜在分子机制,对西瓜果肉进行rna测序分析,获得转录组谱。从5个基因型中获得了三个关键时期(DAP 10、DAP 20、DAP 34)的果肉样品。1).分析所有样品作为三个独立的生物重复。
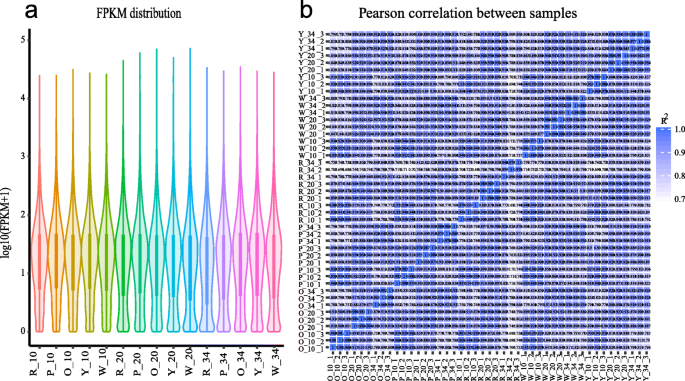
共有45个文库,并分析了45个图书馆。除去低质量读后,平均读数为5190万,平均GC含量为44.15%(附加文件1:表S3)。RNA-SEQ读数与西瓜(97103)基因组的参考图(http://cucurbitgenomics.org/organism/1)使用HISAT(版本2.0.4)[27.].超过97%的干净读取在Q20水平上具有类似phred的质量分数(附加文件1:表S3)。最终通过Cufflinks v2.1.1鉴定出24,794个基因(包括1354个新基因)[28.].在每个样品中鉴定的转录物数量在FPKMS中表达。大约39.08%的表达基因在0-1fpkm的范围内,13.48%的表达基因显示出高表达水平(60 fpkm)(附加文件1:表S4)。从随后的分析中除去具有归一化读数的基因。在图2中比较了不同实验组中的基因表达水平。3.a.生物重复样本之间的表达模式高度一致(图。3.b)并且相关系数接近1(附加文件1:表S5)。因此,这一高质量的RNA-Seq数据为识别西瓜果实发育过程中参与类胡萝卜素合成的关键基因提供了坚实的基础。
在五种基因型中鉴定差异表达基因
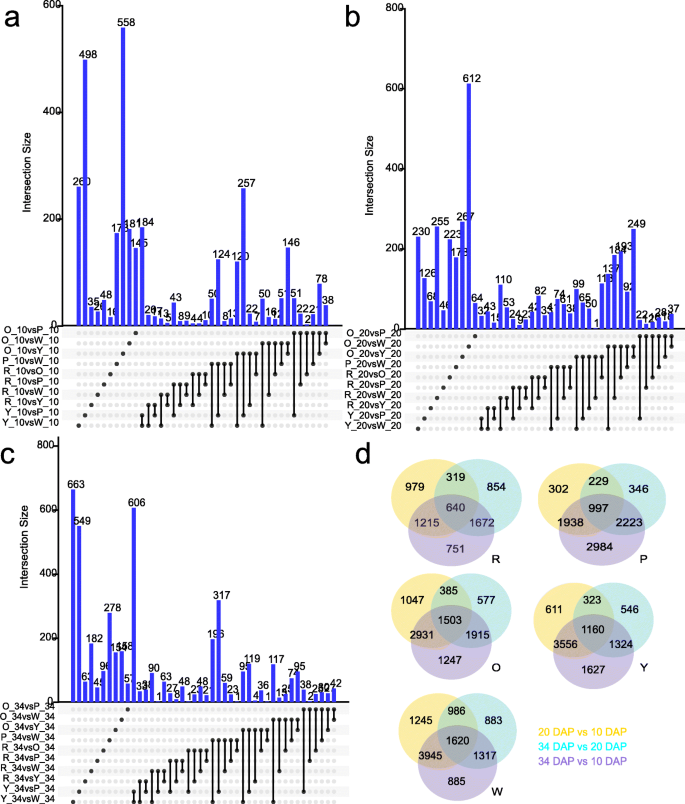
我们在五种基因型的三个发育阶段进行了对比较,以鉴定与西瓜肉颜色相关的基因。使用FDR <0.05筛选DEGS2以(FoldChange)| > 1为阈值,每两两比较中显著差异基因(上调和下调)的数量和列表见Additional file1:表S6和附加文件3.-6.:DataSet 1-4。共有16,781个基因在至少一个比较之间差异表达。
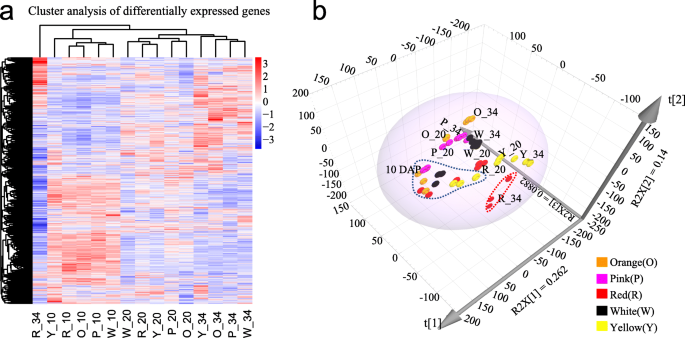
全局分层群集(图。4.a)和主成分分析(图。4.b)基于所有DEG的FPKM值进行。结果表明,通常可以将45个样品分为基于基因表达模式对应于对应于开发阶段的三个主要组。将10个DaP的样品明显地聚集成一个组,除了在34d红色肉的样品外,将来自20个DAP和34个DAP的样品被聚集成另一组(图。4.a),表明在水果发育过程中,不同基因型中大多数次数的表达模式一致。特别地,与PCA分析中的10 dap和20 dap的相比,基因型之间的基因型之间的基因表达模式的差异在34个dap中变得更加清晰(图。4.b)。在20 dap和34 dap,白色,粉红色和橙色基因型聚集在一起,而黄色和红色基因型彼此分离(图。4.b)。34 dap在34个Dap中的三种生物重复不会聚集在一起(图。4.B),可能是由于栽培过程中的环境差异造成的。基因整体表达模式的差异表明,一定存在一组与西瓜肉色差异相关的差异表达基因。
在早期发育阶段(10 dap),鉴定了总共5318个显着表达的基因(图。5.一个,附加文件3.:DataSet 1)。具体地,与粉红色,橙色,黄色和白色肉类基因型相比,在红色肉类基因型中鉴定了510,262,588,349差异表达基因。其他成对比较的数量列于附加文件中1:表S6。候选基因与果实形状相关,ClFS1(Cla011257),在10 dap的不同基因型中差异表达,与前一项研究一致[29.].CLA019403编码木葡聚糖内转糖化酶与植物细胞生长有关[30.]在这个阶段高度表达(附加文件2:图S2a,附加文件1:表S7)。生长素反应因子(ARF.那Cla009800),一个生长调节因子5(GRF.那CLA006802),一种生长素诱导的Saur样蛋白质(CLA016617),与水果开发和扩张有关[31.]在早期发育阶段高度表达(附加文件2:图S2a,附加文件1:表S7)。与西瓜果实发展的后期阶段相比,10个DAP的DEG较少。
在颜料累积阶段(20 dap),鉴定了11,814个显着表达的基因(图。5.b,附加文件4.:数据集2)。其中,红肉基因型与粉红色、橙色、黄色和白色肉基因型相比,鉴别出2498、4830、3123、4876个差异表达基因。其他成对比较的数量列于附加文件中1:表S6。香叶酰焦磷酸合酶(CLA015797.)那植物合酶蛋白(Cla005425)、植物烯去饱和酶(Cla010898)、类胡萝卜素异构酶(Cla017593)那番茄红素环化酶(CLA016840),violaxanthin脱氧酶相关蛋白(Cla007759),9-CIS-环氧碳二恶氧酶(Cla015245)参与类胡萝卜素生物合成,在5种基因型中差异表达(附加档案2:图S2b,附加文件1:表S7)。二AP2-EREBPs(CLA000701那cla017389.)和二bHLHs(Cla020193那Cla022119)以5种基因型差异表达(附加文件2:图S2b,附加文件1:表S7)。表达水平cla017389.在15个实验组中与番茄红素(Pearson r = 0.85)和γ-胡萝卜素(R = 0.69)的含量正相关。表达水平Cla020193与植物荧光素(r =−0.60)和植物荧光素(r =−0.57)含量呈负相关,Cla022119与植物氟芴(R = - 0.59)和植物的含量负相关(r = - 0.58)。这AP2.和bHLHs是其他作物的颜色调节剂[2那32.].
在成熟期(34个DAP),鉴定出了10779个显著差异表达的基因。5.C,附加文件5.:数据集3)。具体地,与粉红色,橙色,黄色和白色肉类基因型相比,在红色肉基因型中鉴定了2097,2572,2429,3316差异表达基因。其他成对比较的数量列于附加文件中1:表S6。大多数类胡萝卜素途径基因和许多TFS在该阶段的5个基因型中差异表达。Geranylgeranyl还原酶(Cla003139那CLA019109),天竺葵焦磷酸合酶(CLA015797.那CLA020121)、植物烯合酶蛋白(Cla005425那CLA009122),植物去饱和酶(CLA010898.),类胡萝卜素异构酶(cla017593.那Cla011810),番茄红素环酶(CLA005011.那Cla017416那CLA016840),9-CIS-环氧碳二恶氧酶(Cla015245那Cla009779那Cla005404那Cla005453那Cla019578),β-胡萝卜素羟化酶(CLA011420那CLA006149.),Zeta-胡萝卜素去饱和酶(CLA003751.)、玉米黄质环氧氧化酶(CLA020214),以及许多TFs (AP2-EREBPs那麦斯那mybs.那G2喜欢那NACS.那奥克斯州),在34个DAP差异表达(附加文件2:图。S2C,附加文件1:表S7)。Cla015245和Cla0054049-顺式环氧类胡萝卜素双加氧酶(9-cis-环氧类胡萝卜素双加氧酶)在白色果肉中高表达可能导致叶黄素的降解和无色果肉。然而,更值得注意的是,Cla015245和Cla005404在成熟的粉红色水果中具有最高的表达水平(附加文件2:图。S2C,附加文件1:表S7)。结果表明,不同的基因型具有不同的颜色形成机制。cla017389.和CLA015515(AP2-ERFBP.)分别在红色和粉红色果实中高表达。cla017389.和CLA015515与乙烯响应转录因子同源RAP2-2(e-value:1.4e-28和3.0e-82)参与Carotenoid生物合成的调节拟南芥蒂利亚纳[33.].更重要的是,表达水平之间存在正相关性cla017389.和番茄红素的含量(r = 0.85)。转录因子bHLH与番茄中的类胡萝卜素代谢有关[34.],木瓜[35.]和柑橘[36.].在这项研究中,表达式CLA006599和Cla022119(bHLH)与10 dap相比,在20和34个dap下降低,并且它们的表达模式类似于CpbHLH1/2调节木瓜中的类胡萝卜素生物合成[35.)(附加文件2:图。S2C,附加文件1:表S7)。进一步分析表明表达水平CLA006599与植物荧光素(r =−0.56)和植物烯(r =−0.62)含量呈负相关。表达水平Cla022119与植物荧光素和植物烯含量也呈负相关。这里我们也注意到锌指CCCH结构域的蛋白质(CLA007686.)在成熟阶段的红色果实表达水平(〜3次)显着增加,比早期阶段(附加文件)1:表S7),表达量与15个样本组的番茄红素含量显著相关(r = 0.81)。5个MYB相关基因(CLA020633.那Cla007790那CLA009263那CLA017995., 和CLA019223.)在34个DAP的5个基因型中差异表达(附加文件1:表S7)。植物烯含量与基因表达量呈正相关CLA009263(r = 0.67)和CLA017995.(r = 0.62)。
对于每个基因型,6430,9019,9605,9147和10,881种涉及果实开发的发育次数,分别是在红色,粉红色,橙色,黄色和白斑的西瓜基因型中获得的(图。5.D,附加文件6.:DataSet 4)。这些结果表明,大量基因涉及西瓜果实发育的调节。在白色肉质西瓜中差异表达了更多基因,表明该基因型中的基因表达的非常复杂的调节网络。我们还鉴定了使用比较转录组分析的一些与果实发育有关的差异表达基因。一种细胞蛋白脱氢酶基因(CLA022463)高度表达在10dap(附加文件1:表S7),可能有助于早期果实发展。紫鼠抗性1样蛋白(PYL8)可能通过介导ABA信号通路参与植物的生长和胁迫响应拟南芥[37.].在这里,我们发现了四种脱离酸受体的表达PYL8(Cla004235那CLA004904那Cla015009那CLA021167.)在5个西瓜基因型中存在显著差异2:图。S2D,附加文件1:表S7)。基因表达水平CLA004904与花药(R = - 0.61),violaxanthin(R = -0.59)和Neoxanthin(R = - 0.58)的含量进行负相关性。该基因可参与类胡萝卜素降解和果实发育中的脱落酸代谢。
基于基因表达模式将DEG分为六组
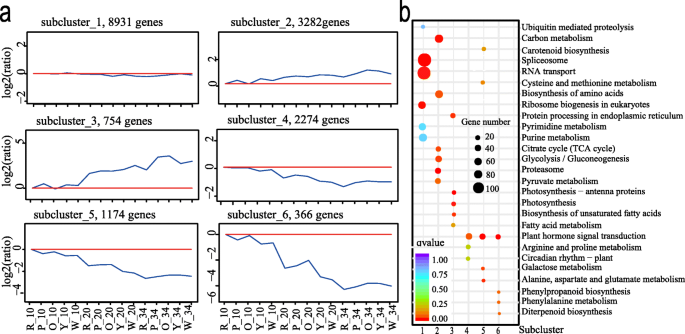
根据基因表达模式,采用h-聚类方法将16781个deg聚类为6个不同的亚簇。6.一个,附加文件1:表S8)。在同一群体中分组的基因共享类似的表达模式并具有类似的功能或参与相同的生物过程。在不同阶段和基因型中具有相对稳定的表达水平的基因在亚簇中1.基因表达在亚体蛋白2和3中表现出一般的向下趋势,而根据发育阶段的副压蛋白4,5和6的一般上升趋势(图。6.一种)。
为了表征DEGS在子簇1中的生物学作用,进行富集分析。将几乎与生物过程,细胞组分和分子功能富集的几乎相同的基因比例。GO术语与各种基本寿命活动有关,例如结合,细胞大分子代谢过程,细胞内和细胞(附加文件2:图。S3A,附加文件7.:DataSet 5)。另外,通过基因和基因组(Kegg)分析,富集这些DEG富含抗磷酸体,RNA转运和核糖体生物发生途径(图。6.b,附加文件7.:DataSet 5)。以前的研究表明,HY5(ZIP)参与拟南芥和番茄中的叶绿体生物发生[38.那39.].这里是转录因子Cla016581那Cla017361那CLA002873., 和CLA021184(邮政编码)在不同的样本中差异表达(附加文件1:表S7)。基因表达CLA002873.与γ-胡萝卜素(R = 0.77)和番茄红素(R = 0.85)的含量呈正相关。基因表达Cla017361γ-胡萝卜素(r = 0.66)和番茄红素(r = 0.72)的含量也呈正相关。二GLK2.TFS(CLA010265那Cla020369),在不同的样本中差异表达(附加文件1:表S7)。基因表达CLA010265与番茄红素(R = 0.77)和总类胡萝卜素的含量呈正相关(r = 0.74)。基因表达Cla020369还与番茄红素的含量有关(r = 0.74)。转录因子的表达水平CLA010815在20dap和34dap(附加文件1:表S7)和与番茄红素含量有关(r = 0.55)。CLA010815(麦斯)是同源的SlMADS1,这在番茄中作为抑制调节剂的果实熟练起着重要作用[40](E值:3E-76,身份:77.24%)。表达Cla009725(麦斯)与植物含量(R = - 0.86),γ-胡萝卜素(R = -0.82),番茄红素含量(R = - 0.73)和总类胡萝卜素(R = - 0.85)呈负相关。这种tf是同源的CSMADS6.,它与柑橘的果实发育和着色相同表达[41.](E值:4E-108,身份:68.62%)。锌手指CCCH含域蛋白质(CLA007686.)也在亚群中1。
在子簇2中,存在3282个基因,在20 dap时具有稍高的表达,并且34dap比10dap(图。6.一种)。富集了单生物理代谢过程,小分子代谢过程和有机核化合物代谢过程等术语(附加档案2:图。S3B,附加文件7.:DataSet 5)。Kegg富集分析表明,最具显着富集的途径是蛋白酶体,生物合成的氨基酸,碳代谢途径,TCA循环,糖酵解/葡糖生成蛋白酶体和丙酮酸代谢途径。蛋白酶体途径含有26S蛋白酶调节亚基基因和蛋白酶体亚基类型基因。乙酰-CoA羧化酶生物素羧酸酶,丙酮酸激酶和母酸脱氢酶在丙酮酸代谢途径中(图。6.b,附加文件7.:DataSet 5)。转录因子cla000691.对此是同源的SlMADS1在番茄果实成熟中扮演抑制调制剂[40](E-VALUE:2E-87,身份:64.93%),在粉红色肉体西瓜果实中高度表达在后期的开发阶段(附加文件1:表S7)。
子簇3表示在34个dap高度表达的基因,并且变化范围比子簇2更明显(图。6.a).该聚类中754个DEGs根据GO项分析主要划分为分子功能和生物过程,其中310个DEGs和287个DEGs分别划分为代谢过程和催化活性(附加文件)2:图。S3C,附加文件7.:DataSet 5)。值得注意的是,这些DEG涉及与光合作用 - 天线蛋白生物合成,光合作用,内质网中的蛋白质加工相关的途径,以及不饱和脂肪酸的生物合成(图。6.b,附加文件7.:DataSet 5)。CLA006149.和CLA011420(β-胡萝卜素羟化酶)CLA009122(八氢番茄红素合成酶),Cla009779(9-CIS-环氧丙酮酸二氧化碳酶)与类胡萝卜素途径有关,以5种基因型差异表达(附加文件2:无花果。S2b和S2c,附加文件1:表S7)。在子群3中,找到了一些差异表达的转录因子(附加文件7.:数据集5)mybs.那AP2-ERFBPS.那bHLHs那NACS., 和WRKYs可能是果实开发和成熟中的重要调节因素[2].二mybs.(Cla018631和Cla006739)和二怀疑s (CLA002243和Cla002084)分别以黄色和粉红色肉体表达(附加文件2:图。S2E,附加文件1:表S7)。基因表达水平Cla018631和Cla006739与Antheraxanthin和violaxanthin的内容相关(R:CLA018631 -Antheraxanthin = 0.88,CLA018631 -violaxanthin = 0.69,CLA006739 -antheraxanthin = 0.85,CLA006739 -violaxanthin = 0.69)。基因表达CLA002243与violaxanthin的含量负相关(r = - 0.58),但表达式之间存在正相关性Cla002084植物烯含量(r = 0.64)。
在4、5、6亚群中分别有2274、1174和366个基因。这些基因在DAP第10个阶段高表达,在后期以不同的变化幅度下降到低表达水平(图1)。6.a).亚簇4的GO富集分析表明生物过程富集最多。(附加文件2:图。S3D,附加文件7.:数据集5). KEGG分析表明,与植物激素信号转导途径有关的基因,如信号转导组氨酸激酶(cla000685.那Cla005808),毒素响应蛋白(Cla003635)和ein3结合f-box蛋白(Cla020970) (图。6.b,附加文件7.:DataSet 5)。转录因子CLA019630(麦斯)的同源性CSMADS6.与柑橘果实发育和着色相协调[41.](E值:2E-98;身份:75.27%),其基因表达与violaxanthin的含量负相关(r = - 0.57)。去富集分配给生物过程和分子功能的子簇5基因,例如蛋白质磷酸化,蛋白激酶活性(附加文件2:图。S3E,附加文件7.:数据集5)。通过KEGG富集植物激素信号转导、丙氨酸、天冬氨酸、谷氨酸代谢等基因(图5)。6.b,附加文件7.:DataSet 5)。在子簇6中,富集的GO术语主要与分子功能和生物过程相关,例如酶抑制剂活性和内肽酶调节剂活性(附加档案2:图S3f,附加文件7.:DataSet 5)。Kegg富集大多数与植物激素信号转导,苯丙醇丙烷生物合成和苯丙氨酸代谢的途径有关(图。6.b,附加文件7.:DataSet 5)。Cla019806那CLA0004102那CLA002975., 和CLA016617与后期果发育阶段相比,参与激素合成,在果实开发的早期表达高度表达(附加档案2:图。S2F,附加文件7.:DataSet 5,附加文件1:表S 7)。
共表达网络分析鉴定了Carotenoid相关的DegS.
识别与不同种类类胡萝卜素积累高度相关的潜在基因(结构基因和公认的转录因子)。以每个样本中的类胡萝卜素含量作为表型数据,并利用16781个DEGs进行加权基因共表达网络分析(WGCNA)。
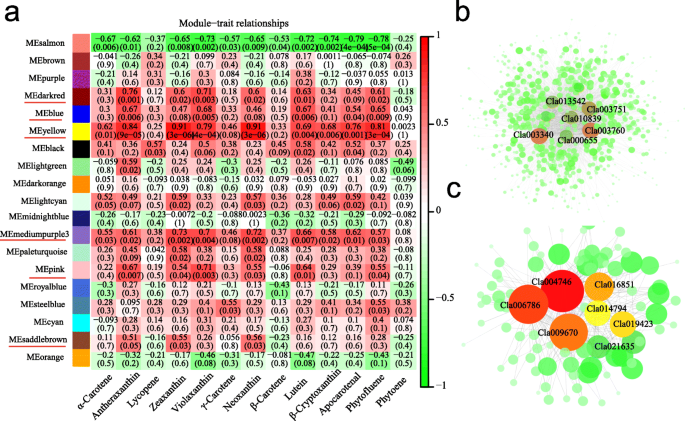
利用树状图和性状热图分析了各表型参数在不同发育阶段的表达情况(附加文件2:无花果。S4a)。模块构造的最佳参数值确定为7.7用于此数据集(附加文件2:无花果。S4b)。总共40个不同的共表达模块根据基因表达的所有样品和单个基因的共表达模式的成对相关性形成,如群集树枝图所示(附加文件2:图S5a)。此外,还绘制了基因模块中所有deg的网络热图,以显示模块之间的相关性(附加文件2:图。S5B)。值得注意的是,六个共表达模块(用红色下划线表示)具有与大多数类胡萝卜素的高正相关(图。7.a),这意味着这些模块中的基因在类胡萝卜素积累中起重要作用。
模块 - 类胡萝卜素关系(一种)和黄色(B.)和黑暗的(C) 模块。每行对应于模块,用颜色标记为附加文件2:图。S5A。行列交叉处的小区的值表示模块和类胡萝卜素之间的相关系数,并根据右侧的颜色刻度显示。每个单元格中括号中的值代表P.价值。显示了连接度高的前10个基因及其相关边缘
' Yellow '模块包含846个基因(包括34个TFs)(附加文件1:表S9)表现出与Zeaxanthin(相关系数,r = 0.91),Neoxanthin(R = 0.91),植物黄嘌呤(R = 0.79),植物黄嘌呤(R = 0.81),Apocarotenal(r = 0.76),β- 晶状体(r = 0.68),叶黄素(r = 0.69)和α-胡萝卜素(r = 0.62)(图。7.a).在本模块中,我们鉴定了一组与细胞代谢过程相关、参与丙酮酸代谢和蛋白酶体途径的基因(附加文件2:图。S6)。丙酮酸是碳水化合物,脂肪和蛋白质代谢的重要介体,并参与体内几种重要的代谢途径。该蛋白酶与番茄中的类胡萝卜素含量的调节有关[42.].该模块包含黄色/橙皮基因型和红色/粉红色/白肉类基因型之间的差异表达基因(附加文件2:图。S7A),也许是黄色颜料积累的重要因素。根据基因函数注释,CLA005011.是西瓜中的番茄红素-环化酶[23.].CLA003751.编码-胡萝卜素去饱和酶CLA020214编码Zeaxanthin环氧酶。因此,它们参与了类胡萝卜素途径(附加文件2:图。S2C,附加文件1:表S7和S9)。Cla018406(伴侣蛋白DNAJ样蛋白)在橙色和黄色肉体中高度表达,其基因表达水平与β-胡萝卜素含量(R = 0.71)和Neoxanthin含量(R = 0.93)有关。这CLA014416(plastid-lipid-associated蛋白质,CLPAP.)是同源的SLPAP.(NP_001234183.1)对番茄类胡萝卜素含量的影响[43.](E值:1E-145,身份:68.67%)。表达水平CLA014416黄色/橙色肉体比本研究中使用的红色/粉红色/白肉类基因型更高(附加文件2:图S2g,附加文件1:表S7和S9)。此结果与上一个报告不同CLPAP.以红色/橙色高表达黄色/白色颜色基因型[44.),可能是因为这两项研究中使用的基因型不同。CLA000655.(编码细胞色素P450)与叶黄素缺乏蛋白5 (CYP97A3),参与叶片的生物合成拟南芥蒂利亚纳[45.](电子值:6.5E-267,身份:80.47%)。CLA010839.对15-CIS-ZETA类胡萝卜素异构酶同源拟南芥蒂利亚纳[46.] (e值:1.1e-135,身份:67.43%)。CLA018347(编码细胞色素p450)与类胡萝卜素ε-单氧化酶(CYP97C1) 在拟南芥蒂利亚纳[47.](电子值:1.2E-233,身份:76.20%)。CLA000655.那CLA010839., 和CLA018347在黄色和橙色的颜色水果中高度表达(附加文件2:图S2g,附加文件1:表S7和S9),也许参与西瓜中叶黄素的生物合成。MYB转录因子可以调节类胡萝卜素内容物Mimulus Lewisii.花卉 [48].Cla013280和Cla010722属于MyB系列,在黄色的果实中高度表达(附加文件2:图S2g,附加文件1:表S7和S9)。基因表达Cla013280与花药(R = 0.85)和violaxanthin的内容呈正相关(r = 0.81)。基因表达Cla010722还与花药(R = 0.75)和violaxanthin的内容有关(r = 0.75)。使用Cytoskape细胞凋亡进一步分析与该模块相关的轮毂基因进行分析(图。7.b),ATP合酶蛋白I,(CLA013542),半胱氨酸脱硫蛋白SUFE(CLA003340),膜蛋白(CLA003760.),其他人被鉴定为负责西瓜黄色形成的轮毂基因(附加文件2:图。S8,附加文件1:表S9和S10)。
含有111个基因的“深红色”模块与黄质和紫黄质含量呈正相关,相关系数分别为0.76和0.71。热图(附加文件2:图。S7B)表明,“暗红色”模块特异性基因是表示富含氮原虫的样品(黄色,橙色,白色)和violaxanthin。CLA004704编码照相II氧气发展复合蛋白PSBP,Cla005429编码氧化增强剂蛋白2,叶片塑料,PSBP.。CLA004746编码叶绿素A-B结合蛋白6a(附加文件2:图S2g,附加文件1:表S7和S9)。Cla021635编码光系统I反应中心亚基II,作为该模块中的顶部集线基因等级(图。7.C,附加文件2:图。S8,附加文件1:表S10)。该模块中的许多基因也与叶绿体或光系统I、II相关(附加文件1:表S7)。
“中紫色3”模块共鉴定出32个基因,与α-胡萝卜素、紫黄质、新黄质、叶黄素和玉米黄质含量的相关系数分别为0.55、0.70、0.72、0.66和0.73。7.一种)。热线图显示在附加文件中2:图S7c。CLA005637.那CLA017046., 和CLA011297.被标识为该模块的集线器基因(附加文件2:图。S8,附加文件1:表S10)。“黑色”模块特异于番茄红素含量(r = 0.57)和叶黄素(r = 0.58)。“SteelBlue”模块分别特异于γ-胡萝卜素(R = 0.55)和植氟芴(R = 0.55)的含量(图。7.一种)。转录因子CLA019630(麦斯)上面提到的基因也在“鞍布镇”模块中,其与玉米蛋白(R = 0.55),Neoxanthin(R = 0.56)和花后蛋白(R = 0.51)的含量相关(图。7.一种)。他们的枢纽基因被列入额外的文件中1:表S10和表达水平显示在附加文件中2:图S8。
通过WGCNA,我们发现存在于黄色模块中存在的大多数类胡萝卜素途径基因(附加文件2:图。S7A)。绘制了共表达网络,以识别与八个所选模块中的粘血类胡萝卜素内容有关的轮毂基因(附加文件1:表S10)。
QRT-PCR验证关键次数的表达
用21个DEGs进行qRT-PCR分析,以验证RNA-Seq数据的质量。我们发现RNA-Seq和qRT-PCR数据之间有很强的相关性(r = 0.90 ~ 0.99,每个基因单独计算相关性),表明我们的转录组数据的可靠性(附加文件2:图S9)。
讨论
不同肉色西瓜中的类胡萝卜素
类胡萝卜素是全球第二个最丰富的天然颜料[3.],广泛存在于水果,蔬菜和鲜花中。类胡萝卜素分为两种亚组,即胡萝卜素(非含氧,β-胡萝卜素,番茄红素,α-胡萝卜素,δ-胡萝卜素,γ-胡萝卜素,15-CIS-植物,和9,15,9'-Tri-CIS- - 胡萝卜素)和Xanthophylls(氧化,叶黄素,violaxanthin,α-relyptoxanthin,β-密度毒素,Zeinoxanthin,Zeaxanthin,violaxanthin和Neoxanthin)[2].类胡萝卜素的不同组成和含量导致从白色到黄色和红色的颜色。西瓜肉体颜色是一种重要的外观质量,与消费者的偏好密切相关。LV等人检测到在果实发育过程中七种类胡萝卜素在果实开发期间的累积模式进行了检测。[49].Liu等人检测到12类胡萝卜素和红色和黄色肉体成熟西瓜中的六个异构体。[14.].通过Fang等人来测量红色,橙色和黄色肉体成熟西瓜果实中的12个类胡萝卜素。[44.].在这项研究中,我们在使用LC-MS / MS的五个肉状西瓜基因型(所有是培养基因型)的果实发育过程中测量了13类胡萝卜素。果肉在早期发育阶段是白色的,然后由于颜料积聚的差异而在后来阶段改变为各种颜色。番茄红素是红色和粉红色肉体基因型中的主要颜料,与之前的报道一致[44.那49].本研究还观察到红色果实中积累了γ-胡萝卜素、玉米黄质、α-胡萝卜素。如之前的报道所述,橙子的果肉颜色主要取决于β-胡萝卜素的含量[14.].此外,在目前的研究中,我们发现橙色果肉也具有最高的夹竹桃素、β隐黄质、叶黄素、玉米黄质、α-胡萝卜素和新黄质水平。柑橘类胡萝卜素种类多,总胡萝卜素含量高,可能成为一种新的保健消费类型。先前的研究报道紫黄素、叶黄素或新黄素是黄色果肉中的主要类胡萝卜素[14.那17.那49].然而,在这里使用的黄色肉体果实中也积聚了氧化体,玉米黄嘌呤和β-密集蛋白。violaxanthin和叶黄素在白色肉体中的痕量积聚[49],在白色肉体水果中观察到肌肉黄嘌呤作为新发现。此外,我们还确定了在水果发育过程中五种基因型中植物氟和植物的累积模式,它们是类胡萝卜素生物合成途径的重要上游代谢物。在橙皮的水果中观察到番丙烯,它可以作为β-胡萝卜素的中间代谢物存在。α-胡萝卜素可用性可以部分解释西瓜中的叶黄素含量。Apocarotenal特异性累积在橙皮的水果中,这可能产生该基因型的独特风味[2].总而言之,我们在不同颜色西瓜中检测到五种基因型中的13种类动物骨,以及在水果发育过程中的类胡萝卜素的最全面的累积模式。作为特殊表型性状,类胡萝卜素的组合物和含量是分子研究的基础。
不同肉类西瓜类胡萝卜素生物合成途径的调节
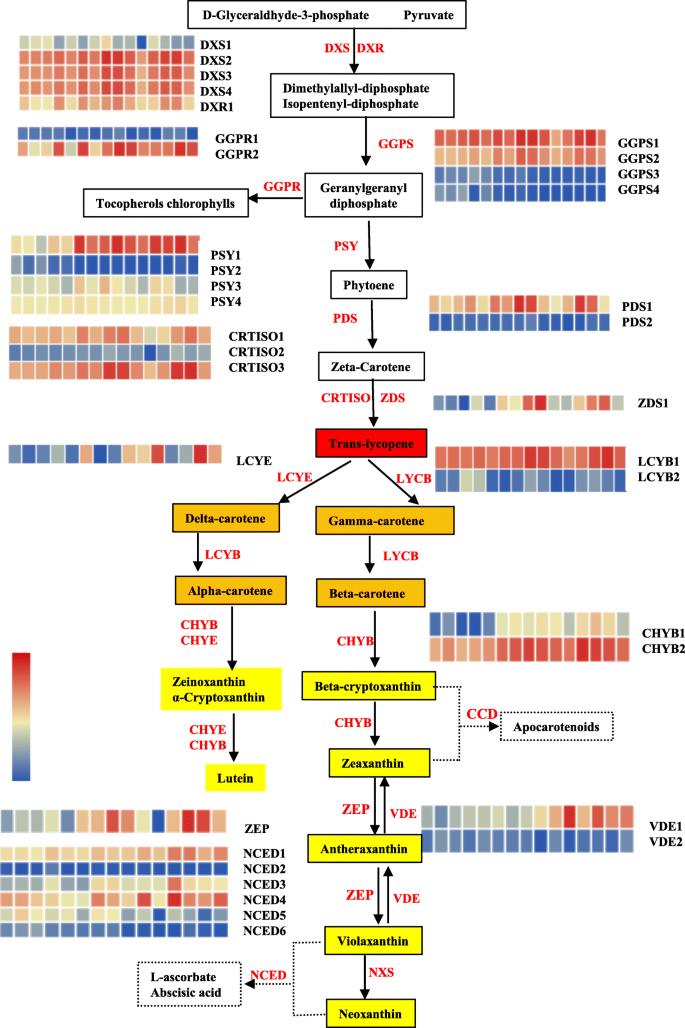
肉颜色是由于颜料的积累,其由由一系列生物合成,劣化和稳定的储存相关基因组成的复杂网络进行调节和控制。为了确定西瓜肉体中颜料含量的潜在调节网络,我们进行了比较转录组合分析与WGCNA相结合以鉴定与类胡萝卜素积累高度相关的枢纽基因。在我们的研究中,在5个基因型的不同样品中差异表达了44个类胡萝卜素途径基因(附加文件1:表S11),其中大部分分配到类胡萝卜素途径中(图。8.).植物合酶(CLA009122),类胡萝卜素生物合成助焊剂的速率限制酶,在后期的发育阶段高度表达,并在水果中提供类胡萝卜素积累(图。8.).表达式CLA009122基因与植物荧光素含量成正比(r = 0.74),与总类胡萝卜素含量不成正比(r = 0.39)。植物烯合酶可能是类胡萝卜素合成的关键因素,但不是每个下游代谢产物积累的决定因素。番茄红素β -环化酶是类胡萝卜素合成途径中的一个重要分支。8.).番茄红素β环酶的表达水平(CLA005011.)与Neoxanthin(r = 0.81),αsheraxanthin(r = 0.75)和violaxanthin(r = 0.75)呈正相关,但与番茄红素的含量弱相关(r = - 0.44),表明这一点CLA005011.基因表达量不是番茄红素积累的主要原因。实际上,番茄红素的含量与番茄红素β-环化酶蛋白的表达水平有关[23.].β-胡萝卜素羟化酶(CLA006149.)在发育后期的橙色和黄色果肉中高度表达,可能参与了叶黄素的合成。但成熟粉红果实中-胡萝卜素羟化酶基因表达水平最高,表明该基因型中有更复杂的调控机制(附加文件1:表S11,图。6.).橙色基因,莽汉和CMOR.,编码富含含量的富含含型域的含域蛋白质,是花椰菜类胡萝卜素生物合成的重要调节因子[50]和甜瓜果[51].Cla018406对此是同源的莽汉(E值:5E-120;身份:61.44%)和CMOR.(E值:3E-130;同一性:65.00%)及其基因表达模式与橙肉和β-胡萝卜素含量有关。因此,我们考虑过Cla018406成为橙色肉体的强烈候选基因(附加文件2:图S9,附加文件1:表S11)在染色体4上,与先前鉴定的QTL不同于西瓜染色体1中的β-胡萝卜素积累[21.].
不同肉色西瓜类胡萝卜素途径相关基因的表达谱基因的FPKM列在附加文件中1:表S11。从左到右的Heatmap Cell代表R_10DAP,P_10 DAP,O_10 DAP,Y_10 DAP,W_10 DAP,R_20 DAP,P_20 DAP,O_20 DAP,Y_20 DAP,W_20 DAP,R_34 DAP,P_34 DAP,O_34 DAP,Y_34 DAP和w_34 dap。彩色电池根据颜色尺度表示归一化基因表达水平。代谢物背景根据它们的复合颜色着色。酶以红色字体呈现。DXS,1-脱氧-D-木糖-5-磷酸合成酶;DXR,1-脱氧-D-木糖-5-磷酸氧化酯酶;GGPS,天竺葵二磷酸二磷酸合成酶;GGPR,天竺葵二磷酸还原酶; PSY, phytoene synthase; PDS, phytoene desaturase; ZDS, ζ-carotene desaturase; CRTISO, carotenoid isomerase; LCYE, lycopene ε-cyclase; LCYB, lycopene β-cyclase; CHYB, β-carotene hydroxylase; ZEP, zeaxanthin epoxidase; VDE, Violaxanthin de-epoxidase; NXS, neoxanthin synthase; NCED, 9-cis-epoxycarotenoid dioxygenase
许多转录因子参与了类胡萝卜素代谢的调控[2].我们在本研究中发现了一些差异表达的转录因子基因(附加文件2:图S10a)。SlBBX20(锌 - 手指转录因子)是番茄类胡萝卜素积累的阳性调节剂[52].在这里我们确定了表达水平CLA007686.(锌指CCCH结构域含蛋白)与番茄红素含量相关(r = 0.81),如结果所示。为进一步证实这一结果,对相关基因的表达水平进行了研究CLA007686.测定了另外53份西瓜品种的番茄红素含量2:图。S11a,附加文件1:表S12),得到表达量与番茄红素含量正相关(r = 0.77)(附加文件2:图。S11B)。然后我们怀疑CLA007686.可以是用于番茄红素积累的关键调节剂。以前的研究表明,转录因子Golden2样(MYB)参与拟南芥和番茄中的叶绿体生物发生[38.那39.].我们发现与此相符的是CLA010265和Cla020369(GLK2.TFS)与番茄红素的含量有关。R2R3-MYB蛋白家族作为番茄中的类胡萝卜素途径的调节功能[53].这里,基因表达CLA009263和CLA017995.(R2R3-MYB.)在34个DAP的5个基因型中差异表达(附加文件2:图。S10A,附加文件1:表S11)和与植物含量有关。转录因子SlMADS1和CSMADS6.在番茄成熟中很重要[40]和柑橘类水果色素[41.,它们的同源基因(cla000691.和CLA010815那Cla009725和CLA019630在本研究中确定了)。也许这些转录因子是控制西瓜颜色形成的调节因子。除了潜在的转录因子外,我们确定了与叶绿素生物合成有关的26次(附加档案2:图S10b,附加文件1:表S11)。质体是类胡萝卜素合成和储存的场所,质体的发育与类胡萝卜素的积累密切相关。22个DEGs被注释参与质体的生物发生(附加文件2:图S10c,附加文件1:表S11)。与叶绿素生物合成和塑性发育有关的基因可以间接调节西瓜中的类胡萝卜素途径。类胡萝卜素合成是一个非常复杂的过程,随着不同的基因型而变化。挖掘和猜测结构基因或转录因子是阐明类胡萝卜素积累的分子机制的第一步。
鉴于目前对肉色形成的分子机制还不清楚,本研究提供的候选基因可以通过分子生物学方法进一步验证。研究结果有助于进一步了解西瓜颜色形成的具体分子机制。
结论
在这项研究中,我们在五种栽培西瓜中的不同发育阶段进行了比较转录组科,以不同的肉体颜色来理解类胡萝卜素积累模式和调节机制。红细胞和橙皮水果中的类胡萝卜素含量高于成熟阶段的粉红色,黄色和白皮西瓜。通过比较转录组分析,聚类分析,转入术语分析,KeGG分析和WGCNA分析,这里报道了许多关于果实发育和颜色形成的候选基因。WGCNA是识别特异性模块和轮毂基因的有用方法。我们推测Cla018406(伴侣蛋白DNAJ样蛋白),CLA007686.(含锌CCCH含CCCH结构域蛋白质),CLA003760.(膜蛋白)和Cla021635(电极系统I反应中心亚基II)分别是橙色,红色和黄色肉体的候选基因。需要进一步研究基因功能验证,以具有西瓜果实着色的遗传和分子机制深入了解。
方法
植物材料及取样
58种西瓜种子的种子由多倍的西瓜研究组(郑州,中国),中国农业科学院郑州水果研究所提供。橙皮的近亲Qitouhuang,黄色肉体近亲Xihua,红肉体近交联郑州3号,粉红色肉体近亲,以及白肉体近亲Bingtangcui(图。1)用于不同的发育阶段分析。2018年4月,温室中的温室播种了西瓜种子(充满了营养媒体)。在新乡实验农场(新乡,河南,中国)的开放领域移植了一个月大的西瓜幼苗,间距为30厘米在植物之间和行之间的150厘米之间。植物通过基因型和复制分离。现场管理遵循公共园艺实践(施肥,灌溉,病原体预防和虫害控制),用于开放的西瓜生长。
对花进行人工授粉并标记,记录授粉后天数(DAP)。在西瓜发育的3个关键时期(10、20、34个),西瓜果肉均无损伤。这些样品立即在液氮中冷冻,并在使用前保存在−80°C。3个水果的混合样本作为一个生物重复,每个处理3个个体生物重复。我们分别采集了大约10克和50克的肉样本进行rna测序分析和类胡萝卜素谱测定。
表型
水果采摘后,纵向切开,先在视觉上标出果肉的颜色。图像取自所有水果。使用日本科尼卡-美能达CR-400色度仪测量每个果区的CIE颜色空间值(L*, a*, b*)。颜色饱和度计算公式:色度(C) = [(a*)]2 + (b*)2]1/2。
定量类胡萝卜素
如前所述进行类胡萝卜素提取和测量[54].采用含0.01%丁基羟基甲苯(BHT)的正己烷-丙酮-乙醇(体积比为2:1:1)提取冻干肉粉。提取的样品使用UPLC-APCI-MS/MS系统(API 6500 Q TRAP)进行测定。测量条件和APCI源运行参数与前面描述一致[54].从Sigma-Aldrich公司(美国)购买的化学标准。每个样品的相对内容对应于光谱峰值强度值。使用标准曲线的线性方程计算绝对内容。
RNA提取和测序
对于不同的西瓜肉样品,在制造商的说明之后使用植物总RNA净化试剂盒(Genemark,北京)提取总RNA。在1%琼脂糖凝胶上监测RNA降解和污染。使用Nanophotometer®分光光度计(Implen,Ca,USA)检查RNA纯度,浓度和完整性,Qubit®20Ullower(Life Technologies,CA,USA),RNA纳米6000测定套件分别生物分析仪2100系统(Agilent Technologies,CA,USA)。
使用每个样品的总量为5μg总RNA。根据illumina的套件产生测序文库。使用TruseQ PE簇套件V3-CBOT-HS(illumia)对CBOT集群生成系统进行样品的聚类。在Illumina Hiseq平台上测序图书馆制剂,并产生125bp / 150bp配对读数。通过删除包含适配器的读取获得的高质量数据(清洁读取),包含从原始数据的PLOY-N和低质量读取的读取。同时,计算清洁数据的Q20,Q 30和GC含量。从网站下载西瓜参考基因组(97,103 v1)(http://cucurbitgenomics.org/organism/1).配对结束清洁读数使用Hisat2 V2.0.4与参考基因组对齐。
基因表达水平的定量
HTSEQ V0.9.1用于将映射到每个基因的读数计数,然后基于基因的长度计算每个基因的FPKM,并且读数映射到该基因的读数[28.].
差异表达分析
使用DESEQ R包(1.18.0)进行差异表达分析。调整的基因P.-Value <0.05通过DESEQ发现被分配为差异表达。
差异表达基因的GO term和KEGG富集分析
基因本体(GO)差异表达基因的富集分析由Goseq R包来实施,其中基因长度偏压被校正。纠正的条款P.差异表达基因显著富集值小于0.05。我们使用KOBAS软件检测KEGG通路中差异表达基因的统计学富集。
共表达网络分析
使用R包WGCNA进行共表达网络分析[55],并使用Cytoscape软件进行可视化[56[基于16,781标准化的FPKM值和表示不同样品中类胡萝卜素水平的特征数据。使用CytoHubba分析每个模块中的轮毂基因。
QRT-PCR验证DEGS表达
根据制造商的协议,使用具有GDNA橡皮擦(Takara,Kusatsu,Shiga,日本)的Prime ScriptTM RTNA,从1μgRNA合成第一链cDNA。通过用GDNA橡皮擦在制造商的说明(Takara,Japan)之后的GDNA橡皮擦从1μg总RNA合成cDNA。对于定量逆转录聚合酶链反应(QRT-PCR),使用Roche Lighcycler480 RT-PCR系统(Roche,Swiss)测量靶基因的相对基因表达水平。根据制造商的说明,将SYBR绿色实时PCR混合物加入到反应系统中。使用基于葫芦基因组学数据库的底漆总理6设计了引物(http://cucurbitgenomics.org/)并列入其他文件1:表向。所有的基因在三个生物重复中进行三次重复。采用LCS 480软件1.5.0.39 (Roche, Swiss)对qRT-PCR的原始数据进行分析,采用2-ΔΔct方法。西瓜ClACTIN基因被用作内部控制[57].
统计分析
使用SPSS 19.0进行统计分析和色素含量的内容物,并根据Tukey的后HOC测试进行。
可用性数据和材料
转录组原始reads已经作为一个生物项目保存了下来:PRJNA644468。作品出版后,经合理要求,可向通讯作者索取资料。
缩写
- DAP:
-
授粉后的几天
- 接待员:
-
红色的
- P:
-
粉色的
- o:
-
橙子
- Y:
-
黄色的
- W:
-
白色
- 可见:
-
差异表达基因
- TFs:
-
转录因素
- WGCNA:
-
加权基因共表达网络分析
- C:
-
浓度
- PCA:
-
主要成分分析
- FPKM:
-
每千票读数读取每百万映射的读数
- QRT-PCR:
-
定量实时聚合酶链反应
- 去:
-
基因本体论
- Kegg:
-
Kyoto基因和基因组的百科全书
- TCA周期:
-
三羧酸循环
- CC:
-
相关系数
- BHT:
-
丁hydroxytoluene
- DXS:
-
1-脱氧-D-木糖糖-5-磷酸合酶
- DXR:
-
1-脱氧-D-木糖糖-5-磷酸氧化酯酶
- GGPS:
-
天竺葵二磷酸二磷酸合成酶
- GGPR:
-
天竺葵二磷酸还原酶
- Psy:
-
植物合成酶
- PD:
-
八氢番茄红素desaturase
- ZDS:
-
ζ - 胡萝卜素去饱和酶
- Crtiso:
-
类胡萝卜素异构酶
- LCYE:
-
番茄红素ε-环缩
- LCYB:
-
番茄红素β-环酶
- CHYB:
-
β-胡萝卜素羟化酶
- ZEP:
-
玉米黄质环氧酶
- VDE:
-
violaxanthin de-环氧酶
- NXS:
-
Neoxanthin合成酶
- nced:
-
9-CIS-环氧丙酮蛋白二氧化酶
参考
- 1。
Perkins-Veazie P,Collins JK,Clevidence B.西瓜和健康。Acta Hortic。2007; 731:121-8。
- 2。
袁H,张家,Nageswaran D,Li L.类胡萝卜素代谢与园艺作物的调节。Hortic Res。2015; 2(1):15036。https://doi.org/10.1038/hortres.2015.36。
- 3.
Nisar N,Li L,Lu S,Khin NC,Pogson BJ。植物中的类胡萝卜素代谢。莫尔植物。2015; 8(1):68-82。https://doi.org/10.1016/j.molp.2014.12.007。
- 4.
番茄红素的抗癌和抗动脉粥样硬化作用研究进展。食品科学与技术。2005;16(8):344-50。https://doi.org/10.1016/j.tifs.2005.02.002。
- 5.
Apgar J,Makdani D,Sowell Al,Gunter Ew,Hegar A,Potts W等人。血清类胡萝卜素浓度及其在伯利兹儿童的再现性。AM J Clin Nutr。1996年; 64(5):726-30。https://doi.org/10.1093/ajcn/64.5.726。
- 6.
齐格勒RG。一项关于类胡萝卜素降低癌症风险的流行病学证据的综述。J减轻。1989;119(1):116 - 22所示。https://doi.org/10.1093/jn/119.1.116。
- 7.
Sun T,Yuan H,Cao H,Yazdani M,Tadmor Y,Li L.类胡萝卜素代谢在植物中:塑性的作用。莫尔植物。2018; 11(1):58-74。https://doi.org/10.1016/j.molp.2017.09.010。
- 8.
Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P等。从β-胡萝卜素到类独角金内酯的植物激素卡拉内酯的途径。科学。2012;335(6074):1348 - 51。https://doi.org/10.1126/science.1218094。
- 9。
Cazzonelli Ci,Pogson BJ。源进入:植物中胡萝卜素生物合成的调节。趋势植物SCI。2010; 15(5):266-74。https://doi.org/10.1016/j.tplants.2010.02.003。
- 10。
Havaux M.类胡萝卜素氧化产品作为植物中的应力信号。植物J. 2014; 79(4):597-606。https://doi.org/10.1111/tpj.12386.。
- 11.
沃尔特MH,Strack D.类胡萝卜素及其切割产品:生物合成和功能。Nat Prod Rep。2011; 28(4):663-92。https://doi.org/10.1039/c0np00036a.。
- 12.
Gusmini G, Wehner TC。西瓜皮纹和果肉颜色的质性遗传。J在这里。2006;97(2):177 - 85。https://doi.org/10.1093/jhered/esj023。
- 13。
Perkins-Veazie P,Collins JK,Davis AR,Roberts W.类胡萝卜素含量为50个西瓜品种。JAgric Food Chem。2006; 54(7):2593-7。https://doi.org/10.1021/jf052066p.。
- 14。
刘C,张H,戴Z,刘X,刘y,邓x等。西瓜中挥发性化学和类胡萝卜素谱[Citrullus寻常魅力(研究)。(葫芦科)]有不同的果肉颜色。食品科学与技术。2012;21(2):531-41。https://doi.org/10.1007/s10068-012-0068-3。
- 15.
Tadmor Y,King S,Levi A,Davis A,Meir A,Wasserman B等人。西瓜和番茄中的比较果子着色。食物res int。2005; 38(8-9):837-41。https://doi.org/10.1016/j.foodres.2004.07.011。
- 16.
亨德森,斯科特GH,Wehner Tc。肉体基因在西瓜中的相互作用。j hered。1998年; 89(1):50-3。https://doi.org/10.1093/jhered/89.1.50。
- 17.
Bang H,Davis Ar,Kim Sg,Leskovar di,King Sr。金丝雀黄色,浅黄色和红色西瓜之间的肉体颜色遗传和基因相互作用。J Amer SoC Hort SCI。2010; 135(4):362-8。https://doi.org/10.21273/JASHS.135.4.362。
- 18.
Hashizume T,Shimamoto I,Hiral M.建设联系地图和西瓜园艺性状的QTL分析[Citrullus lanatus(研究)。使用RAPD, RFLP和ISSR标记。中国生物医学工程学报,2003;https://doi.org/10.1007/s00122-002-1030-1。
- 19。
Liu S, Gao P, Wang X, Davis AR, Baloch AM, Luan F.番茄红素含量和果实性状数量性状位点的定位Citrullus lanatus。Euphytica。2015; 202(3):411-26。https://doi.org/10.1007/S10681-014-1308-9。
- 20。
李恩,尚j,王继,周d,李恩,ma s.发现基因组区域和候选基因的发现猩红色红肉颜色(yscr.)西瓜的基因座(Citrullus lanatusL.)。前植物SCI。2020; 11(116)。
- 21。
Branham S,Vexler L,Meir A,Tzuri G,Frieman Z,Levi A等。西瓜β-胡萝卜素综合QTL的遗传映射。mol繁殖。2017; 37(12):146。https://doi.org/10.1007/S11032-017-0747-0.。
- 22。
张健,郭胜,任勇,张辉,龚刚,周敏,等。一种新的色质体磷酸盐转运蛋白ClPHT4;2的高水平表达是西瓜果肉颜色发育所必需的。新植醇。2017;213(3):1208 - 21所示。https://doi.org/10.1111/nph.14257。
- 23.
张俊,孙H,郭某,任y,李米,王j等。番茄红素β-环苯二屈氏蛋白质丰度降低导致驯化西瓜的红肉。植物理性。2020; 183(3):1171-83。https://doi.org/10.1104/pp.19.01409。
- 24.
窦建林,袁宝玲,赵淑娟,何楠,朱洪军,高磊,等。倍性水平对西瓜番茄红素生物合成基因表达及激素积累的影响(Citrullus lanatus)果实发育和成熟。积分学报。2017;16(9):1956-67。https://doi.org/10.1016/s2095-3119(16)第6161618-0.。
- 25.
袁培林,刘国威,赵淑娟,卢晓琴,闫志华,何宁,等。四倍体西瓜番茄红素含量及番茄红素合成酶和番茄红素β-环化酶基因的表达见:葫芦科第十届桉树遗传育种会议。2012:315-24。
- 26.
朱Q,高P,刘S,朱Z,Amanullah S,Davis Ar等。两种对比西瓜基因型在果实发育过程中的比较转录体分析。BMC基因组学。2017; 18(1):3。https://doi.org/10.1186/s12864-016-3442-3。
- 27.
Kim D,Langmead B,Salzberg SL。他妈的。具有低内存要求的快速拼接对齐器。NAT方法。2015; 12(4):357-60。https://doi.org/10.1038/nmeth.3317。
- 28.
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,等。通过RNA-SEQ的转录程序组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。https://doi.org/10.1038/nbt.1621。
- 29.
窦杰,赵松,卢鑫,何宁,张玲,阿里阿,等。遗传图谱揭示了一个候选基因(ClFS1)西瓜的形状(CitrullusLanatus L.).中国科学(d辑),2018;https://doi.org/10.1007/S00122-018-3050-5。
- 30.
SaladiéM,玫瑰JKC,Cosgrove DJ,Catalác。新的木葡聚糖内葡萄糖蛋糖酶/水解酶(xth)的表征来自成熟的番茄果实和酶促作用多种模式的影响。工厂J. 2006; 47(2):282-95。https://doi.org/10.1111/j.1365-313X.2006.02784.x。
- 31。
Horiguchi G,Kim GT,Tsukaya H.转录因子AtgrF5和转录同型An3调节叶原叶中的细胞增殖拟南芥蒂利亚纳。工厂J. 2005; 43(1):68-78。https://doi.org/10.1111/j.1365-313X.2005.02429.x。
- 32。
Llorente B, D'Andrea L, ruz - sola MA, Botterweg E, Pulido P, Andilla J等。番茄果实的类胡萝卜素生物合成通过光依赖机制调整到实际的成熟过程中。植物j . 2016; 85(1): 107 - 19所示。https://doi.org/10.1111/tpj.13094.。
- 33。
Welsch R,Maass D,Voegel T,Dellapenna D,Beyer P.转录因子RAP2.2及其互动伙伴Sinat2:拟南芥的雌核发生器中的稳定元素。植物理性。2007; 145(3):1073-85。https://doi.org/10.1104/pp.107.104828。
- 34。
张立,康J,谢Q,龚j,沉h,陈y等。基本螺旋环 - 螺旋转录因子BHLH95影响番茄中的果实成熟和多种代谢。J Exp Bot。2020; 71(20):6311-27。https://doi.org/10.1093/jxb/eraa363。
- 35。
周丹,沈勇,周平,Fatima M,林俊,岳军,等。木瓜CpbHLH1/2在番木瓜果实成熟过程中调节类胡萝卜素生物合成相关基因。Hortic Res。2019; 6(1):80。https://doi.org/10.1038/s41438-019-0162-2。
- 36。
Endo T,Fujii H,Sugiyama A,Nakano M,Nakajima N,Ikoma Y等。柑橘碱性螺旋环 - 螺旋转录因子的过度表达(cublh1),是同源的拟南芥激活标记的bri1抑制因子1互作因子基因,调控转基因番茄的类胡萝卜素代谢。植物科学。2016;243:35-48。https://doi.org/10.1016/j.plantsci.2015.11.005。
- 37。
拟南芥py8在ABA信号转导和干旱胁迫应答中起着重要作用。植物病理学杂志2013;29(4):471-6。https://doi.org/10.5423/ppj.nt.07.2013.0071.。
- 38。
托莱多奥蒂斯G,约翰逊H,Lee KP,Bou-Torrent J,Stewart K,Steel G等。HY5-PIF调节模块坐标光合基因转录的光和温度控制。Plos Genet。2014; 10(6):E1004416。https://doi.org/10.1371/journal.pgen.1004416。
- 39.
Powell AL, Nguyen CV, Hill T, Cheng KL, Figueroa-Balderas R, Aktas H, et AL .;统一的成熟编码A.金色2般的调节番茄水果叶绿体发展的转录因子。科学。2012; 336(6089):1711-5。https://doi.org/10.1126/science.1222218。
- 40。
董涛,胡震,邓磊,王勇,朱敏,张娟,等。番茄MADS-box转录因子SlMADS1,是果实成熟的负调节因子。植物杂志。2013;163(2):1026 - 36。https://doi.org/10.1104/pp.113.224436。
- 41。
acta photonica sinica, 2011, 38(5): 689 - 693 .卢绍文,张勇,朱凯,杨伟,叶建林,柴玲,等。柑橘转录因子CsMADS6通过直接调控类胡萝卜素生成基因来调节类胡萝卜素代谢。植物杂志。2018;176(4):2657 - 76。https://doi.org/10.1104/pp.17.01830。
- 42。
唐x,miao m,niu x,张d,cao x,金x等。泛素 - 缀合的降解黄金2样转录因子是由Cul4-DDB1的番茄中的CUL4-DDB1的E3连接酶复合物介导。新植物。2016; 209(3):1028-39。https://doi.org/10.1111/3/13635。
- 43。
Kilambi HV,Kumar R,Sharma R,Sreelakshmi Y. Chromoplakshmi Y. Combopople特异性类胡萝卜素相关的蛋白质似乎是增强HP1番茄水果中类胡萝卜素的积累。植物理性。2013; 161(4):2085-101。https://doi.org/10.1104/pp.112.212191。
- 44。
方旭,刘松,高鹏,刘慧,王旭,栾峰,等。表达式CLPAP.和ClPSY1在西瓜与染色体分化,类胡萝卜素积聚和肉颜色形成相关。SCI Hortic。2020; 270:109437。https://doi.org/10.1016/j.scienta.2020.109437。
- 45。
Kim J,Dellapenna D.定义植物中叶黄素合成的主要途径。Arabidopsis类胡萝卜素β-环羟化酶CYP97A3的作用。Proc Natl Acad Sci U S A. 2006; 103(9):3474-9。https://do.org/10.1073/pnas.0511207103。
- 46。
陈y,李福,沃特茨尔等。隔离和表征的z-Iso.在植物中编码类胡萝卜素生物合成的缺失组分的基因。植物理性。2010; 153(1):66-79。https://doi.org/10.1104/pp.110.153916。
- 47.
天L,Magallanes-Lundback M,Musetti V,Dellapenna D.拟南芥β-和ε-环形类胡萝卜素羟基酶的功能分析。植物细胞。2003; 15(6):1320-32。https://doi.org/10.1105/tpc.011403。
- 48.
Sagawa JM,Stanley Le,Lafountain Am,Frank Ha,Liu C,元yw。R2R3-MYB转录因子调节类胡萝卜素色素沉着Mimulus Lewisii.花卉。新植物。2015; 209(3):1049-57。
- 49.
lv p,li n,liu h,gu h,赵我们。类胡萝卜素谱的变化以及在果实发育过程中胡萝卜素代谢基因的表达模式和四种西瓜品种成熟。食品化学。2015; 174:52-9。https://doi.org/10.1016/j.foodchem.2014.11.022。
- 50.
Lu S, Van Eck J, Zhou X, Lopez AB, O’halloran DM, Cosman KM,等。的菜花或者基因编码DnaJ富含半胱氨酸结构域的蛋白质,介导β -胡萝卜素的高水平积累。植物细胞。2006;18(12):3594 - 605。https://doi.org/10.1105/TPC.106.046417。
- 51.
Tzuri G,周X,Chayut N,Yuan H,Portnoy V,Meir A等。一个'金色'snpCMOR.管辖瓜的果肉颜色(Cucumis Melo.).植物j . 2015; 82(2): 267 - 79。https://doi.org/10.1111/tpj.12814。
- 52.
熊c,罗d,林a,张c,山l,他p等。番茄B盒蛋白质SlBBX20通过直接激活来调节类胡萝卜素生物合成八氢番茄红素合成酶1,并靶向26s蛋白酶体介导的降解。新植物。2019; 221(1):279-94。https://doi.org/10.1111/nph.15373。
- 53。
关键词:番茄,过表达,果实成熟,生理变化Slan2.,R2R3-MYB因子。植物理性生物化学。2015; 89:24-30。https://doi.org/10.1016/j.plaphy.2015.02.005。
- 54。
Hao Z,Liu S,Hu L,Shi J,Chen J.转录组分析和代谢分析揭示了类胡萝卜素在花瓣着色中的关键作用鹅掌楸tulipifera。Hortic Res。2020; 7(1):70。https://doi.org/10.1038/s41438-020-0287-3。
- 55。
杨杰,余H,刘立,赵Z,刘L,MA LX等。DCGL v2.0:用于从差分共表达揭示差分调节的R包。Plos一个。2013; 8(11):E79729。
- 56。
杨永平,杨永平,杨永平。利用Cytoscape软件探索生物网络。生物信息学。2008;23:8.13.1-8.13.20。
- 57。
孔强,袁静,高玲,赵玲,程飞,黄勇,等。西瓜果实发育过程中基因表达正常化的内参基因评价。《公共科学图书馆•综合》。2015;10 (6):e0130865。https://doi.org/10.1371/journal.pone.0130865.。
致谢
不适用。
资金
在这项工作中,物料种植,样品收集得到了农业科学和技术创新计划(CAAS-ASTIP-ZFRI-07)。中国国家重点研发计划(2018YFD0100704),中国农业研究系统(CARS-25-03)和中国国家自然科学基金(31672178和31471893)支持RNA测序。河南省科技项目支持QRT-PCR实验(202102110197)。资金机构在研究和收集,分析和解释方面没有作用,数据和撰写手稿。
作者信息
隶属关系
贡献
W.L.和P.Y.构思并设计了这些实验。p.y., n.h., S.Z., x.l., H.Z., w.d., C.G.和H.G.准备了材料和样品。P.Y.进行了实验室实验。P.Y.和m.j.u进行了数据分析。P.Y.制作了数字/表格并写了整个手稿。P.Y.和m.j.u检查了手稿。所有作者已阅读并批准最终稿件。
通讯作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
表S1。
不同发展阶段西瓜果实中颜色坐标值的估计。表S2。类胡萝卜素化合物的含量(UG / g)。表S3。RNA-Seq数据概述。表S4。每个样本中检测到的转录本数量。表S5。Pearson相关系数列表样本之间。表S6。两两比较中差异表达基因(DEGs)的数量。表S7。本研究中列出的基因FPKM。表S8。每个亚群的基因列表。表S9。基因组模块列表。表S10。使用CytoHubba计算的模块中的集线基因。表S11。与类胡萝卜素生物合成相关的基因。表S12。番茄红素含量和基因表达CLA007686.在53种西瓜酱中。表向。引物用于实时荧光定量PCR分析。
附加文件2图S1。
使用Carotenoid代谢物相对含量的对数转换数据的所有样品的PCA图。图。S2。本研究中列出的关键deg的表达。图S3。对子集团1-6的术语分析。图。S4。(a)在每个发育阶段的样品树木和模块特征热图。(b)参数,软阈值,模块构造的确定。图。S5。(a)转录组的基因集群树木(层次集群树)。(b)所选基因的网络热图。图。S6。黄色模块基因的Go term和KEGG分析。图S7。(A)黄色模块,(B)黑暗模块和(C)紫色模块的热簇分析。图S8。枢纽基因的热图。图S9。通过QRT-PCR验证所选择的DEGS表达。图S10。(a)键转录因子基因,(b)叶绿素生物合成基因的热映射,(c)塑体生物生成基因。图。S11。(a)相对基因表达水平CLA007686.和相对番茄红素含量在53个西瓜肠道中。(b)番茄红素含量与番茄红素含量之间的相关性CLA007686.基因mRNA水平。
附加文件3数据集1。
基因型间10dap的差异表达。
附加文件4数据集2。
在基因型之间的20个DAP下进行DEG。
数据集3。
在基因型之间的34个dap下的DEG。
数据集4。
各基因型不同阶段间的差异基因。
附加文件7数据集5。
Go和Kegg分析六个子轮匠中的基因。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
袁平,吴国强,何立新。等等。五种肉色西瓜类胡萝卜素的转录组调控(Citrullus lanatus).BMC植物杂志21,203(2021)。https://doi.org/10.1186/s12870-021-02965-z
已收到:
公认:
发表:
关键词
- Citrullus lanatus
- 脸色
- 胡萝卜素
- 转录调节
- 候选基因
- WGCNA