抽象的
背景
常见的bean (phoudolusulus vulgaris.是一种重要的豆科植物,可作为未成熟的豆荚和干燥的种子,经复水和蒸煮后食用。豆荚形态性状有许多基因和QTL,以及它们之间的上位性相互作用。然而,并不是所有的基因都被绘制或验证,也没有提出候选基因。我们试图通过GWAS研究影响豆荚形态和颜色特征的基因组区域。
结果
单和多座全基因组关联分析来探讨荚性状一组西班牙多样性小组(SDP)的301条豆线。所述SDP用通过测序来自基因分型获得32812个SNP基因分型。将该板在两个季节生长和表型数据被记录在4个荚字符分组17个新鲜荚果性状:荚长度,荚果的横截面,荚颜色,每荚的种子数。在所有的,检测到23 QTL为荚长度,6的横截面,18荚色彩,6每荚相关联的两个或更多个字符荚种子和9的数量。大多数QTL分别位于染色体PV01,Pv02,Pv04,Pv08,Pv09和PV10的端粒区域。十八检测QTL共定位与28先前报道的QTL。检测到二十一涉及发展进程的潜在候选基因底层11 QTL的荚形态特征,他们四人同源答:芥基因FIS.2,SPL10.,TTG2.和AML4影响长角果的大小。共发现8个可能参与色素合成的候选基因,其中5个QTL与豆荚颜色相关。
结论
通过对豆荚形态性状和颜色性状的GWAS分析,共鉴定出62个QTL,其中18个与已有报道的QTL共定位,16个QTL由25个候选基因组成。共鉴定出44个新QTL和18个现有QTL,为进一步了解普通菜豆荚果大小和颜色性状的复杂遗传奠定了基础,为今后的验证工作提供了机会。
背景
常见的bean (phoudolusulus vulgaris.)是一种重要的豆科植物,在拉丁美洲的两个不同地区被驯化,代表着不同的中美洲和安第斯基因库[1].栽培大豆的基因型在生长习性、花色、豆荚和种子的形状、大小和颜色等方面表现出广泛的多样性。未成熟豆荚表型多样性包括种子开始发育前的长度和弯曲度(直的vs弯曲的)、横截面(直径、平的、圆的、筛的大小)和颜色(黄色、绿色、紫色)的变化。一些基因型豆类的未成熟豆荚作为新鲜的绿豆(syn. Garden, green, pole, snap, haricot or French beans)食用,当豆荚达到最大长度时,种子仍在形成,而干燥的豆类作为成熟的种子,在重新水化和烹饪后食用。总而言之,2.29马赫注定会在2019年被用于豆瓣作物,而33.8马赫被用于干豆瓣作物(http://www.fao.org/faostat/).Snap Bean组包括不同的市场类,例如“String Snap Bean”,指的类型必须在消耗之前删除POD Suture Strings的类型;“黄色蜡”和“绿豆”,分别指的是黄色和绿色豆荚;“罗马类型”,带有非常大而扁平的豆荚;和蓝绿色豆荚的“蓝湖型”,仍然是无缝和纤维的[2].此外,油豆角可根据加工适应性可分为:冷冻,罐装,或新鲜的市场。
豆荚形态性状的遗传控制已有不同的研究报道。普通菜豆的经典遗传学研究描述了控制菜豆横截面的主要基因(ea和EB.基因(3.,4]),豆荚膜(F A,FB., 和FC.基因(3.,4]),羊皮纸豆荚(IA.,IB.基因(3.,4,5];),无缝豆荚(圣基因(6];),捻线荚(太瓦基因(7])和直豆荚(达,D b[3.,4]).圣被映射到染色体pv02 [8],附近的菜豆同源基因PvIND,一个基因控制荚果开裂[9].荚果破碎(开裂荚果)是与种子扩散有关的一个重要性状,在驯化过程中被改良为不开裂荚果[8].最近的研究表明,位于染色体PV03上的两个主要定量性状基因座(QTL)(PVPDH1 [10])和PV05(QPD5.1-PV [11)也会影响破荚特性。
大豆荚果长度、厚度和宽度的数量遗传及控制这些性状的QTL鉴定的研究报道不多[12,13,14,15].哈格蒂等人使用干豆和短豆重组近交系种群来绘制地图:圣(Pod Suture String)到PV02;重叠荚壁纤维,宽度和厚度至pV04;和pod长度到pv09 [14].Murube等人,使用两个嵌套种群,发现位于染色体上PV01,Pv02,Pv07和Pv11 4个的基因组区域与荚果大小字符和每荚的种子数重叠QTL [15].
未成熟豆荚的颜色的遗传控制是通过影响Y和参数基因:ÿ精氨酸展示绿色豆荚,y arg.黄色的蜡吊舱,y arg.绿灰色(银色)荚,和y arg.白色pod [4].的y通过Koinange等人将赋予黄色荚颜色的等位基因映射到PV02。[8].的B调节高于二氢戊糖酚形成水平的花青素途径的生产的基因也存在于PV02上[16].的基因咕噜咕噜叫了n罗依影响一系列豆荚颜色,从玫瑰色到紫色豆荚[17].的王牌基因产生闪亮豆荚[18].Myers等。鉴定与CIE L *,A *,B *颜色空间值相关的定量性状核苷酸(QTNS),用于在149个Snap Bean access的面板上的PV02,PV03和PV05上的POD颜色的豆荚[19].
综上所述,豆荚形态性状是由许多基因和QTL及其相互作用决定的。然而,并不是所有的基因都被绘制出来,也没有提出候选基因。此外,QTL还需要在不同的遗传背景和环境中进行验证,才能直接用于植物育种或寻找潜在的候选基因。参考基因组P.寻常魅力[20.为豆荚形态性状的精细定位和QTL调控及候选基因的鉴定提供了依据。参考基因组与高通量基因分型相结合,改进了检测标记-性状关联的统计程序,并获得了比双亲本群体具有更大变异的多样性面板,增加了识别控制特定性状的假定基因组区域的机会[21].
从本地西班牙种质收集建立了308条线的西班牙常见豆豆分集面板(SDP),其中包括用于豆荚消费的体重群和老化和精英品种[22].本研究的主要目的是通过SDP的全基因组关联分析(GWAS),研究控制豆荚大小和颜色性状的基因组区域。研究结果将有助于发现与荚果性状相关的新基因组区域,验证已报道的QTL,并鉴定相关性状的候选基因。
结果
表型变异,相关性和遗传
对301个SDP品系的17个形态性状进行了鉴定。结果表明,对16个数量性状进行评估的结果具有广泛而连续的变异(见图S)1和表S.1).例如,PL和NSP,两个与产率相关的性状,分别在7.1至26.4cm和2.2至8.3种以之间。SDP对绿色(241线),黄色(38),紫色(3),绿色斑驳(16)和黄色斑驳(2)豆荚进行了宽的颜色变化。通过CIE尺度测量的豆荚颜色也表现出宽的变化,以及L *,A *和B *载体。例如,B *变化 - 4.38至40.8。H.216个数量性状的估计值较高,PSW为0.31,PLW为0.91(见表S1).
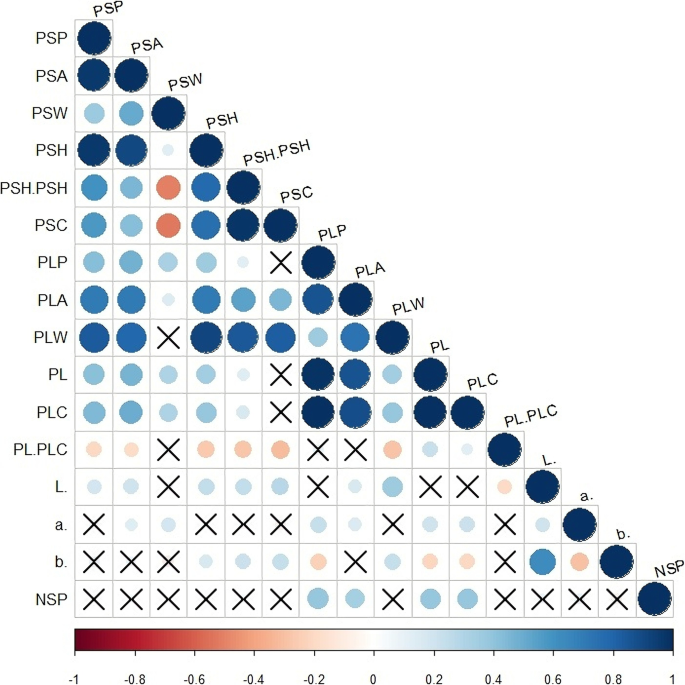
相关分析表明许多评估性状(图之间显著的关系。1).有六个荚状部分性状和PSH / PSW,PSC和PSW一个显著负相关之间显著的正相关。大多数六个荚长变量的除了PL / PLC与PLP和PLA均显著相关。相关性分析也揭示了除了在5箱子截面和长度性状的有意义的相关性;PSC与PLP,PL和PLC和PSW与PLW和PL / PLC。NSP四个荚长性状(PLA,PLP,PL和PLC)的显著相关。最后,三个荚颜色变量(L *,A *,B *)也显著相关。
Corrplot示出评估的16个定量荚性状的Pearson相关(见表1).X表示无显著相关(α = 0.05)
snp的鉴定和检测
对GBS文库的测序共产生了约4.18亿reads,共包含301条SDP线。约76.3%的reads与普通菜豆参考基因组成功对齐,21.5%的reads被定位到一个以上的位点,23.7%的reads未被定位。NGSEP基因分型管道在11条染色体和参考基因组中产生了346,819个双等位基因SNPs。在过滤参数后,分布在11条大豆染色体上的32,812个SNPs被保留(图S)2).这些snp主要存在于编码区(51.1%),其中沉默突变占46.1%,错义突变占32.6%,无义突变占5.4%,启动UTR区占15.9%。内含子区和基因间区分别占31.2和17.8%。全基因组转位/转位(Tr/Tv)比值为1.17。
格干
SL-GWAS (MLM)共检测到63个显著QTNs,其中57个QTI位于9个基因组区(QTI),其中7个QTI位于荚果长度区,1个QTI位于荚果横切面区,1个QTI位于荚果颜色区。6个QTN显示单一关联(表S2).PCOL和NSP未检测到QTN。有趣的是,在染色体PV01(45,582,871至48,454,962)的远端在染色体PV07的端粒中检测到染色体PV01(45,582,871至48,454,962,454,962)和9 QTNS的染色载体B *的28个QTNS。
ML-GWAS,使用mrMLM包中的6个多位点模型,显示103个QTN(表S3.,S.4,S.5).索引PSC未检测到QTN。MRMLM方法检测到大多数关联(37),而FastMREMMA检测到最少的关联(21)。总而言之,找到了14个豆荚部分特征的重要QTNS(表S.3.),每个字符的QTN数从PSH的5,PSA和PSW的只有一个。荚果长度性状检测到52个QTN(表S4),其中18个由至少两种不同的GWAS方法鉴定。用于PL / PLC A和PLP,PLA,PLC和NSP的10的QTN的数量。这些QTN大多位于PV01和PV02的端粒区域。关于CIE空间测量的豆荚颜色,检测了总共27个QTNS(对于载体L *,2个用于B *,9的载体L *),而在视觉上以定性特征测量的豆荚颜色(表S)5).这些QTNs大多位于Pv02(7)和Pv08(5)染色体的端粒区。ML-GWAS检测到的31个QTNs被归为11个QTI。两种方法均鉴定出3个QTI (SL-GWAS和ML-GWAS): Chr01:48090873-48,454,962;Chr02: 47302543 - 47669811;chr07:32026373 - 32413401。
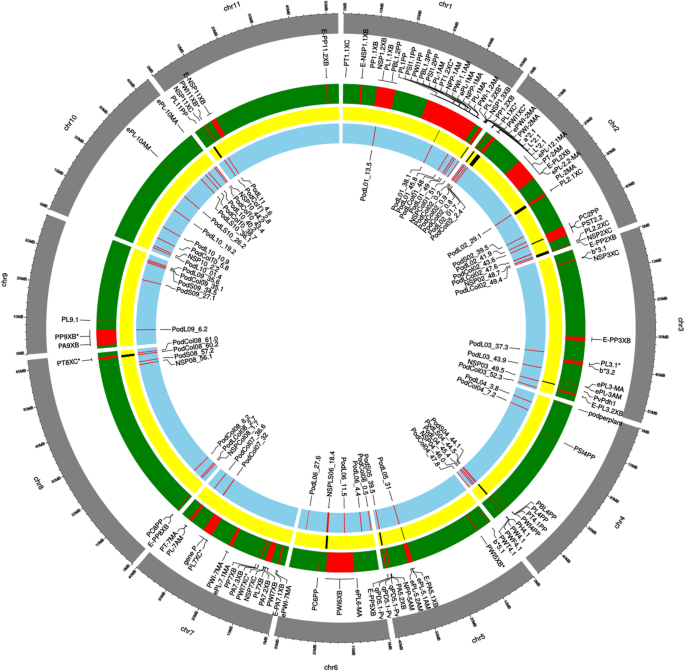
166 QTNS检测到62 QTL,23为Pod长度,6个用于横截面,18个用于豆荚,6个用于每个POD的种子,以及与多个字符相关的9个QTL(表1).最QTL分别位于染色体Pv02(12),Pv04(7),Pv08(7),和PV10(11)(参照图2).
协同定位的QTL
96个已报道的QTL的基因组位置[10,12,14,15,19用于检查用于与在这项工作中(图中确定的QTL重叠在共同豆荚形态性状。2).有15个基因组区域,其中在本研究中检测到的QTL和QTL对POD特征重叠(表2;无花果。2).这些区域分别位于Pv01、Pv02、Pv03、Pv04、Pv05、Pv06、Pv08和Pv11染色体上。Pv02(542087-959,169)染色体的起始位点只定位了与角果颜色相关的QTL,而其他QTL的重叠位点则与角果形态性状相关或形态性状与角果颜色性状同时存在。
在硅基因组勘探中
在底层特征的62 QTL下面的注释基因的硅分析中显示出16个QTL中的25个潜在候选基因(表3.).6个荚大小性状QTL中共有12个候选基因。这些候选基因中有5个是细胞色素P450, 5个是WRKY或MYB转录因子,这些蛋白参与多种过程,如对生物和非生物胁迫的反应、发育、分化、代谢、防御和色素合成[23,24].7个调控荚果发育的基因分别为:phvull . 001g229900、phvull . 001g221500、phvull . 002g016100、phvull . 004g144900、phvull . 006g076800、phvull . 006g077200和phvull . 010g010200 [25].四个基因,与控制角果大小的基因同源答:thalina[26在QTL NSPCOL01_51中检测到与尺寸和颜色特征相关的QTL相关QTL:PHVUL.001G262600,QTL NSPCOL01_51中的SPL10基因;PHVVUL.002G141800与QTL PODL02_29.1附近的FIS2基因;QTLPODLSN06_18.4中具有TTG2基因的PHVVUR.006G074600;在QTL NSPCOL08_1.7中用AML4基因的PHVVUL.008G019500。Della蛋白基因Phvvul.001G230500,控制植物生长和开发的各个方面,包括开花和豆荚环境和发展[27],是QTL Podlcol01_48.4的候选者。
荚果颜色性状QTL中,编码Cytochrome P450蛋白的6个候选基因组成了QTL PodCol02_2.4、PodCol02_43.6、PodLCol02_47.6和PodCol10_38.7,编码MYB转录因子的5个候选基因组成了QTL PodLCol01_48、PodCol07_32和PodCol08_60.23.).此外,Phvul.001G261500编码黄酮类化合物3'-羟化酶是一个候选基因QTL PodColN01_51和编码黄酮/黄酮醇7-O-β-d葡萄糖苷基因簇malonyltransferase接壤QTL PodLCol08_2.7。
讨论
Pod形态和颜色是常见豆类的重要性状,因为它们影响了许多基因型作为绿豆被食用的豆荚的消费偏好。本研究确定了控制西班牙多样性面板中的基因组区域。本面板包含广泛的遗传[22和荚果颜色、荚果大小、荚果横截面和每荚果种子数的表型变异(见图S1).例如,POD长度的变化范围在26.5和7.5cm之间,对于SDP203,具有非常大的绿色POD和SDP138,分别具有非常短且平坦的绿色豆荚的罗马型。豆荚颜色从绿色变化为黄色到紫色,并通过定量分类(CIE Scale)。使用的实验设计(每季重复的随机完整块)可能会影响特征估计的准确性,特别是在大型试验中。然而,记录的特质具有高遗传性和大多数特征,H2估计很高,表明涉及一些主要基因。相关性分析结果支持四个字符中的特性分组(豆荚长度,POD横截面和豆荚颜色特征以及每个POD的种子)。POD字符内的大多数特征显着相关(图。2).每个豆荚(NSP)的种子数量,主要产量组分[28荚果长、荚果面积、荚果周长和荚果弯长与荚果长呈极显著正相关。
关联研究中使用的大多数现有方法都是基于全基因组扫描与群体结构的单一标记关联,并考虑严格控制假阳性率的方法[29,30.]使一些关联可以不由单一基因座模型检测[29,30.].ML-GWAS总共103名关联与荚的性状(14荚截面字符,42荚长度字符,10为每荚的种子数和37荚彩色)显示,而SL-GWAS为荚果显示63个关联(3的横截面,50荚长度,10每荚的种子数和10荚颜色)。所有这些均协会在62 QTL分组;23 QTL参与荚长度字符,6荚截面字符,18荚色,6 NSP和9在两个字符(表1;无花果。2).
我们观察到,18 QTL与早期描述的QTL用于各种群体的Pod大小。QTL跨不同研究和人群的QTL支持QTL验证和稳健QTL的处置。下面详述的五种染色体地区的POD特性:
Pv01 (50–51 Mb) where PodColN01_51 overlaps with QTL PP1.2XB.,PL1XC.*和PWI1XC.* [15为荚果长度。在这个区域内Phvul.001G262600拟南芥SPL10基因AT1G27370的同源基因,被认为是拟南芥角果长度的候选基因芸苔属植物显著[26].SPL基因也参与调控花青素生物合成[31],这可以解释为什么相同区域具有涉及POD颜色和荚尺寸控制的QTL。
Pv02 (0.54–0.95 Mb) where PodCol02_0.8 overlap with the reported QTL a*2.1, L*0.9 and L*2.1 [19]用于豆荚颜色。
Pv02 (29.1-30.2 Mb),其中PodL02_29.1与报告的QTL PL2.1重叠XC.对于荚长度[15].Phvul.002G141800,在没有授粉的情况下抑制种子发育的拟南芥基因FIS2(AT2G35670)的同源物,是该区域在该区域中荚的植物长度的候选基因。FIS2也与Wang等人的硅大小有关。[26].
PV02(48.6-49.6 MB)其中QTL NSP02_48.7和PODLCOL02_49.4重叠报告的QTL PL2.2XC.,NSP2XC.和E-PP2XB.对于豆荚长度,每个豆荚和豆荚周长的种子数[15].
Pv06 (18.3-19.3 Mb),其中PodLSNS06_18.4重叠QTL PWI6XB.用于豆荚宽度[15].Phvul.001G173700拟南芥TTG2基因(At2G37260)是拟南芥TTG2基因的同源基因,它影响着拟南芥种子的大小和重量,并为拟南芥角果长度QTL奠定了基础芸苔属植物显著[26,是该区域的候选基因。
对于荚果颜色,作为数量变量(CIElab尺度)比作为质量性状检测到更多的QTL(5),这表明前者的评价提供了额外的信息。与荚果颜色性状同时相关的QTL有6个:NSPCol01_51、NSPCol08_1.7、PodCol02_0.8、PodCol04_47.8、PodCol04_7.2、PodCol10_43.4和podcol02_47.6。通过定性评估,基因Y控制黄蜡,被定位到Pv02的近端[8].定量评估在PV02上的相同近端位置中检测到的A *和L *颜色变量的显着QTL [19].结果表明,该区域的QTL与荚果颜色相关,且与荚果颜色相关。Myers等人提出Phvul.002G004400(一种五碳肽重复序列)作为候选基因Y基因(19].然而,在PodCol02_0.8和PodCol02_2.3之间存在着其他可能参与色素合成的基因,如我们PHVVUL.002G014700.和PHVVUL.002G014800.编码异黄酮2'-羟化酶,和Phvul.002G022800和Phvul.002G022900编码细胞色素p450相关蛋白。类黄酮与叶绿素和类胡萝卜素一起,是高等植物中的主要色素之一,其中一些可以影响黄色的颜色[32].
细胞色素P450是植物中最大的基因家族之一,参与不同的细胞过程,包括色素的合成[23,24,33].另外两个细胞色素p450(Phvul.002G263700, Phvul.002G263900QTL PodCol02_43.6的相关基因进一步表明它们可能在影响荚色中起作用。事实上,基因B,参与种皮色素的产生,并与基因紧密相连我(赋予BCMV抗药性[34]),映射在PV02的类似远端端粒区域中。这种抗性基因座的特征在于,位于Phvul.002G323200附近的Bean基因组中,CHR02:48805820-48,810,839 [35].据报道,影响特性的实际基因通常远远超过由GWAS检测到的峰值SNP的2Mbps [36].类似地,接近QTL PodCol08_2.7分别为10个基因(2.567.331-2.636.603pb)与颜料的合成(Phvul.008G031900,Phvul相关黄酮/黄酮醇7-O-β-d葡糖苷丙二酰转移函数.008G032000,Phvul.008G032100,Phvul.008G032200,Phvul.008G032400,Phvul.008G032450,Phvul.008G032501,Phvul.008G032551,Phvul.008G032600,和Phvul.008G032700)。接壤QTL PodCol07_32和PodCol10_40.2是候选基因Phvul.007G206200(MYB61 [26]),PHVVUL.010G117200(ARF18 [36,37]),Phvul.010G117100(CYP78A9 [38]),而phvul.010g118700(nts1 [39]),其具有与参与长角果的对照基因的同源性(见表4).最后,undelaying的QTL PodLCol01_48,PodCol07_32和PodCol08_60.2发现基因编纂MYB转录因子(Phvul.001G229900,Phvul.001G221500,Phvul.007G206200,Phvul.008G262700)。MYB蛋白在调节网络的关键因素控制的发展,代谢包括花青素的合成[40].
总之,GWA揭示了新的和已知的基因组区域,其中QTL影响荚尺寸,豆荚颜色和种子数的每荚。在未来的遗传分析中应验证参与植入荚尺寸或颜色遗传控制的新识别的区域。重叠到以前报道的十八个区域QTL提供了有关开发育种计划和遗传分析的相关信息,专注于这些角色。
方法
植物材料
的308线豆西班牙多样性面板(SDP)被坎帕等人描述。[22].简而言之,SDP包括:220个地方种族,大部分来自更新的西班牙核心收集;51个优质品种,主要在欧洲栽培,用于消费菜豆;37个系代表传统老品种和知名育种品种。排序豆基因型,G19833 [20.]及BAT93 [41]被列为安第斯和中美洲基因库的代表。面板显示出荚果性状的广泛表型变异(见图S)3.).之前由Campa等人描述的种群结构和连锁不平衡[22[表示,两组与Andean和Mesoisherican基因库和第三组相对应的两个主要组,所述第三组具有两个基因库的混合物。
表型
在两个季节(2017年和2018年春季),SDP在Villaviciosa(43°2901,5°2611 W;海拔6.5米)的温室中,SDP在温室中表现出来。每年代表单个1米行图的单一重复,包括每行8-10株植物。实验设计是随机完整的块。标准农艺耕作,灌溉,施肥和杂草和昆虫控制措施,以确保植物增长和发展。在四个主要豆荚特征中分组的一组17个POD特征进行表型:Pod长度,Pod横截面,豆荚颜色和数量种子(见表)4).当豆荚达到最大长度和种子开始扩大时,在R8阶段开始收获新鲜的豆荚。十二个定量字符包括POD纵向(PLP,PLA,PLW,PL,PLC,PL / PLC)和截面(PSP,PSA,PSW,PSH,PSH / PSW,PSC)尺寸,其每条扫描新鲜豆荚10尺寸在番茄分析仪软件的帮助下[42].外部豆荚颜色视觉上记录为绿色,黄色,斑驳的绿色,斑驳的黄色和紫色。为了在表型类中记录变化,使用番茄分析仪软件量化的新鲜豆荚颜色,CIE级别测量三个向量:L *检测到0(黑色)到100(白色)的亮度,a *表示来自绿色的颜色(负值)到红色(正值),B *测量蓝色(负值)到黄色(正值)。并行地,新鲜的豆荚颜色视觉上记录为绿色,黄色,斑驳的绿色,斑驳的黄色和紫色。最后,每POD(NSP)的种子数量被手动记录为平均10个豆荚。
通过变异系数(CV)来调整平均值识别异常值。超过25%的CV不接受。通过GGPLOT2产生的频率分布可视化单个性状的表型变化[43].这些特征之间的皮尔逊相关系数也使用软件包“corrplot”进行了调查[44].的广义遗传(H2)对于每个特征,估计了使用包装'遗传性'[45].表型数据的遗传力及后续统计分析在R平台上进行[46].
基因分型
逐个测序(GBS),如Elshire等人所述。[47,在BGI-Tech(哥本哈根,丹麦)使用ApeKI限制性内切酶。将酶切后的DNA连接到独特的核苷酸适配器(条形码)上,然后用带有流细胞附着位点标记的引物进行PCR,得到GBS序列库。使用Illumina HiSeq4000和100x Paired-End进行测序。不同基因型的测序reads用条形码进行反卷积,并与phoudolusulus vulgaris.L. v2参考基因组(https:///phytozome.jgi.doe.gov/pz/portal.html# !info?alias=org_pvulgaris.).
使用NGSEP-GBS管道进行SNP发现和基因型调用[48,49].最大基本质量得分设置为30,并将用于报告变体的最小质量设置为40.保留了缺少50%缺失值和次要等位基因频率(MAF)0.05的所有SNP标记,以将IMPUTEVCFFF模块进行归纳为NGSEP,这是在包快速子中实现的隐马尔可夫模型(HMM)的重新实现(http://stephenslab.uchicago.edu/software.html).使用NGSEP的命令进行算法进行变体。用CMPLOT封装可视化SNP沿染色体的分布(https://github.com/yinlilin/r-cmplot.)R项目[46].SNPs根据大豆基因组中的物理位置命名:染色体和基因组位置(bp)。
基因组关联分析
采用单基因座- gwas (SL-GWAS)和多基因座- gwas (ML-GWAS)模型对所有性状进行关联分析。SL-GWAS在Tassel V5.1中进行[50]使用混合线性模型(MLM)方法与PCA(3)和耐用矩阵作为辅助因子。使用MRMLM V4.0封装进行ML-GWA(https://cran.r-project.org/web/packages/mrmlm/index.html.)代表了六种不同的多基因效应性状统计模型(mrMLM;FASTmrMLM;伊希斯EM-BLASSO;FASTmrEMMA;pLARmEB;pKWmEB)。将GAPIT生成的5个pc作为协变量,使用GAPIT R包中实现的高效混合模型关联(EMMA)算法创建按状态身份的亲属矩阵[51].
对三个数据集进行关联分析;两个季节(2017年春季和2018年春季)和两个季节的平均值。SL-GWAS的显著性临界值为-log(p) > 5, ML-GWAS的显著性临界值为LOD > 5。当在三个分析中检测到显著性状- snp (QTN)关联时考虑。定量性状间隔(QTI)定义为多个QTNs位于0.3 Mbp以下。根据荚果性状将显著QTN分为QTL (PodL、pod、PodCol和NSP),根据基因组位置(染色体和位置Mbp)命名QTL。
QTL定位
在QTL定位方面,4个独立的研究报告了普通豆荚形态性状的QTL定位数据[10,12,13,14,15,19] 被认为是。使用物理位置来研究在该工作中鉴定的基因组区域与先前报道的QTL之间的对应关系。来自文献的QTL的物理位置基于使用BLASTN算法与豆类参考(G19833)基因组序列V2.1对准的侧翼或下面标记物(https://phytozome.jgi.doe.gov/pz/portal.html).标记序列从PhaseolusGenes (http://phaseolusgenes.bioinformatics.ucdavis.edu/)或包含由GBS分析提供的SNP的标签序列。Shinycircos包[52],利用基础标记显示每个QTL在大豆基因组中的位置。
候选基因开采
在豆类基因组V2.1中研究了潜在的候选基因(www.phytozome.net)通过所检测到的QTL的基础的基因的功能注释的探索。我n the case of single QTN, a window ±75,000 bp from the QTN position was considered. Genes with a known function in developmental processes were considered. In addition, homologous genes to genes involving in the control of silique traits in拟南芥蒂利亚纳车型品种进行了检查[26,36].
可用性数据和材料
在本研究期间生成或分析的所有数据都包含在本发表的文章[及其补充信息文件]中,或者可以从相应的作者提供合理的请求。
参考
- 1.
belucci E, Bitocchi E, Rau R, Rodriguez M, Biagetti E, Giardini A,等。基因组学的起源,驯化和进化phoudolusulus vulgaris..出自:Tuberosa R, Graner A, Frison E, editors。植物遗传资源基因组学。多德雷赫特:施普林格;2014.p . 483 - 5007。https://doi.org/10.1007/978-94-007-7572-5_20.
- 2.
华莱士L,Arkwazee H,Vining K,Myers Jr。卡扣豆内的遗传多样性及其与干豆的关系。基因。2018; 9(12):587。2018年11月28日发布。https://doi.org/10.3390/genes9120587.
- 3.
兰姆普雷希的Beitrage H.祖尔Genetik冯菜豆。II。尤伯杯Vererbung冯HülsenfarbeUNDHülsenform。Hereditas。1932; 16:295-340。
- 4.
兰姆普雷希H.细长型菜豆和其他一些成果的继承。农业园艺遗传学。1947; 5:72-84。
- 5.
兰姆普雷希H. Weitere koppelungsstudien的菜豆MIT einerÜbersicht黚死Koppelungs GRUPPEN。农业园艺遗传学。1961; 19:319-32。
- 6。
prakken r. phoudolusulis l. genetica中的颜色和豆荚字符的继承。1934; 16(3-4):177-294。https://doi.org/10.1007/BF02071498.
- 7。
巴格特JR,菜豆豆荚扭曲的基恩D.继承(菜豆L.)。J Amer SoC Hort SCI。1995; 120(6):900-1。https://doi.org/10.21273/JASHS.120.6.900.
- 8。
Koinange Emk,Singh Sp,Gepts P.常见豆中驯化综合征的遗传控制。农作物科学。1996; 36(4):1037-45。https://doi.org/10.2135/cropsci1996.0011183X003600040037x.
- 9。
拟南芥INDEHISCENT基因同源物的鉴定与鉴定。J在这里。2013;104(2):273 - 86。https://doi.org/10.1093/jhered/ess102.
- 10.
帕克TA,伯尼MY,特兰JC,Palkovic A,JernstedtĴ,Gepts P.波德indehiscence是菜豆驯养干旱弹性性状。新植物。2020; 225(1):558-70。https://doi.org/10.1111/nph.16164.
- 11.
劳d,的Murgia ML,Rodriguez的男,Bitocchi E,贝鲁奇E,FOIS d,等。在常见的豆荚落粒的基因组解剖:在非直系同源基因位点在表型趋同进化的下豆科树种驯化的基础上的突变。植物杂志2019; 97(4):693-714。https://doi.org/10.1111/TPJ.14155..
- 12.
González AM, Yuste-Lisbona FJ, Saburido S, Bretones S, DeRon AM, Lozano R, et al.;开花时间和营养生长对普通豆类植物生产的主要贡献,从比较遗传作图推断。PlantSci前面。2016; 7:1940。https://doi.org/10.3389/fpls.2016.01940.
- 13.
yuste-lisbona fj,gonzálezam,卡西布·克·卡塞尔·乔卡尔·乔,德·米,等。遗传变异底层底层和普通豆颜色特征取决于具有认证效应的定量性状基因座。mol品种。2014; 33(4):939-52。https://doi.org/10.1007/S11032-013-0008-9..
- 14.
张志强,张志强,张志强,等。菜豆与菜豆杂交群体中菜豆荚果和颜色性状的遗传定位。中国科学(d辑:地球科学)2016;https://doi.org/10.21273/JASHS.141.2.131.
- 15.
Murube E,Campa A,Song Q,McClean P,Ferreira JJ。使用两种嵌套重组近交线群体验证与普通豆类中的豆荚和种子大小相关的QTL。mol繁殖。2020; 40(1):7。https://doi.org/10.1007/s11032-019-1085-1.
- 16.
菜豆(Phaseolus vulgaris) B和asp种皮基因的化学和形态表达中国科学(d辑:地球科学)2016;https://doi.org/10.21273/JASHS.125.1.52.
- 17。
LamprechtH.ÜBERieVülsenfarbebeiulerusulbungder Rotenbei寻常。农业园艺遗传学。1951; 9:84-7。
- 18。
扁豆(Phaseolus vulgaris L.)有光泽荚果突变体。北京科技大学学报(自然科学版)1957;38:820-4。
- 19。
Myers Jr,Wallace Lt,Mafi Moghaddam S,Kleintop Ae,Echeverria D,Thompson HJ,等。改善豌豆的健康益处:总酚类含量的基因组关联研究。营养素。2019; 11(10):2509。https://doi.org/10.3390/nu11102509.
- 20。
吴桂英,张晓东,张晓东,等。普通豆的参考基因组和双驯化的全基因组分析。自然基因。2014;46(7):707 - 13所示。https://doi.org/10.1038/ng.3008.
- 21。
植物全基因组关联图谱的构建。植物学报。2017;2(1):22-38。https://doi.org/10.1002/cppbb.20041.
- 22.
Campa A,Murube E,Ferreira JJ。遗传多样性,人口结构和联系在西班牙常见豆豆分集面板中通过逐次测序揭示的群体。基因。2018; 9(11):518。https://doi.org/10.3390/genes9110518.
- 23.
魏新宇,王振。细胞色素P450超家族在植物发育和防御中的作用。农业工程学报。2015;14(9):1673-86。https://doi.org/10.1016/s2095-3119(14)(14)60980-1.
- 24.
安巴瓦特,沙玛,亚达夫NR,亚达夫RC。MYB转录因子基因作为植物反应的调控因子:综述。植物学报。2013;9(3):307-21。https://doi.org/10.1007/s12298-013-0179-1.
- 25.
gómez-martínc,capel c,gonzálezam,lebrónr,yuste-lisbona fj,hackenberg m等。普通豆荚成熟的转录动力学和候选基因(phoudolusulus vulgaris.L.)。植物。2020; 9(4):545。https://doi.org/10.3390/plants9040545.
- 26.
王X,陈L,王A,王H,田杰等。定量特征基因座分析与基因组的硅质相关性状芸苔属植物显著.BMC植物BIOL。2016; 16(1):71。https://doi.org/10.1186/s12870-016-0759-7..
- 27.
赤霉素信号抑制因子LlDELLA1调控黄羽扇豆花和荚果的发育(Lupinus危害L.)。int j mol sci。2020; 21(5):1815。https://doi.org/10.3390/ijms21051815.
- 28.
亚当斯兆瓦。作物产量构成补偿的依据,特别以大田菜豆(Phaseolus vulgaris)为例。作物科学。1967;7(5):505 - 10。https://doi.org/10.2135/cropsci1967.0011183x000700050030x..
- 29。
李晓东,李晓东,李晓东,等。通过全基因组关联研究和QTL荟萃分析,发现了控制面包小麦钾利用效率和农艺性状的新的基因组位点。Front Plant Sci. 2020;11:70。https://doi.org/10.3389/fpls.2020.00070.
- 30.
张扬,贾诗,Dunwell JM。社论:新型多基因座GWAS方法在复杂性状遗传解剖中的应用。前植物SCI。2019; 11(10):100。https://doi.org/10.3389/fpls.2019.00100.
- 31。
苟杰,Felippes FF,刘CJ,Weigel D,Wang JW。用MIR156靶向SPL转录因子对拟南芥中花青素生物合成的负调节。植物细胞。2011; 23(4):1512-22。https://doi.org/10.1105/tpc.111.084525.
- 32。
Falcone -Ferreyra Ml,Rius SP,Casati P.Flavonoids:生物合成,生物功能和生物技术应用。前植物SCI。2012; 28(3):222。https://doi.org/10.3389/fpls.2012.00222.
- 33。
花色素和细胞色素P450。中国生物科学(英文版)2013;368(1612):20120432。https://doi.org/10.1098/rstb.2012.0432.
- 34.
陈志强,陈志强。菜豆对5种病毒的超敏反应与B基因座的连锁反应。中华菜豆杂志1988;79:208 - 11。https://doi.org/10.1093/oxfordjournals.jhered.a110516.
- 35.
Vallejos Ce,Astua Monge G,Jones V,Plyler Tr,Sakiyama NS,Mackenzie SA。去除调水剂的遗传和分子表征。遗传学。2006; 172(2):1229-42。https://doi.org/10.1534/Genetics.105.050815.
- 36.
致病基因可能与SNP有多远?2016.核酸学报2016;44(13):6046-54。https://doi.org/10.1093/nar/gkw500.
- 37.
刘继华,胡z,胡z,杨h,张l,李河,邓l,太阳x,王x,王h.ARF18基因的自然变化同时影响多倍体油菜籽种子重量和硅质宽度。Proc Natl Acad Sci U S A. 2015; 112(37):E5123-32。https://doi.org/10.1073/pnas.1502160112.
- 38.
石磊,宋健,郭超,王国珍,杨鹏,陈旭,等。BnaA9上游区域的一种类似cacta的转座元件。CYP78A9在油菜中起促进角果长度和种子重量的作用。植物j . 2019; 98(3): 524 - 39。https://doi.org/10.1111/tpj.14236.
- 39.
Kaur J, Akhatar J, Goyal A, Kaur N, Kaur S, Mittal M, et al.;芥菜及其祖种抗裂性的全基因组关联定位及候选基因分析。引用本文:https://doi.org/10.1007/s11033-020-05384-9.
- 40。
Dubos C,Stracke R,Grotewold E,Weisshaar B,Martin C,Lepiniec L.拟南芥的转录因子。趋势植物SCI。2010; 15(10):573-81。https://doi.org/10.1016/j.tplants.2010.06.005.
- 41。
Vlasova A, Capella-Gutiérrez S, Rendón-Anaya M, Hernández-Oñate M, Minoche AE, Erb I, et al.;中美洲普通菜豆的基因组和转录组分析及基因复制在建立组织和时间专门化基因中的作用。基因组医学杂志。2016;17(1):32。https://doi.org/10.1186/s13059-016-0883-6.
- 42。
Brewer MT,Lang L,Fujimura K,Dujmovic N,Gray S,Knaap E.一种受控词汇和软件应用程序的开发,分析番茄和其他植物物种的果实形状变化。植物生理学。2006; 141:15-25。https://doi.org/10.1104/pp.106.077867.
- 43。
Wickham H. GGPLOT2:用于数据分析的优雅图形。纽约:Springer-Verlag;2016. ISBN 978-3-319-24277-4,https://ggplot2.tidyverse.org
- 44。
Wei T, Simko V. R软件包“corrplot”:相关矩阵的可视化(版本0.84)。2017.可以从https://github.com/taiyun/corrplot..
- 45。
Kruijer W,波尔MP,Malosetti男,洪水PJ,安B,Kooke R,等人。基于标记的遗传力估计在不朽的人群。遗传学。2015; 199(2):379-98。https://doi.org/10.1534/genetics.114.167916.
- 46.
r核心团队。统计计算的R项目。2019.可提供:www.R-projectorg.访问:2019年9月。
- 47.
Elshire RJ,Glaubitz JC,Sun Q,Poland Ja,Kawamoto K,Buckler Es,等。一种高分辨率物种的鲁棒,简单的基因分序列(GBS)方法。Plos一个。2011; 6(5):E19379https://doi.org/101371/journalpone0019379..https://doi.org/10.1371/journal.pone.0019379.
- 48.
Perea C, De La Hoz JF, Cruz DF, Lobaton JD, Izquierdo P, et al.;NGSEP基因型测序(GBS)的生物信息学分析BMC基因组学。2016;17 (S5): 498。https://doi.org/10.1186/S12864-016-2827-7.
- 49.
Lobaton JD,Miller T,Gil J,Ariza D,De La Hoz JF,Soler A等人。常见豆的重新抑制鉴定基因间池间迟发的区域,并为分子育种提供综合资源。植物基因组。2018; 11(2):170068。https://doi.org/10.3835/plantgenome2017.08.0068..
- 50。
Bradbury PJ,张Z,Kroon de,Casstevens TM,Ramdoss Y,Buckler Es。TASSEL:多样化样本中复杂性状的关联映射软件。生物信息学。2007; 23(19):2633-5。https://doi.org/10.1093/bioinformatics/btm308.
- 51。
Lipka的AE,田楼王Q,的PeifferĴ,李男,布拉德伯里PJ等。GAPIT:基因组关联和预测集成工具。生物信息学。2012; 28(18):2397-9。https://doi.org/10.1093/bioinformatics/bts444.
- 52。
俞y,欧阳y,姚w. shinycircos:互动创建大道情节的R /闪亮申请。生物信息学。2018; 34(7):1229-31。https://doi.org/10.1093/bioinformatics/btx763.
确认
这项工作部分得到了AEI-西班牙政府的格兰特2017-87050-R的支持。作者感谢M. Bueno,J.A.Poladura和F.Díaz的技术援助。
资金
这项工作部分得到了西班牙政府国家研究局(AEI) AGL2017-87050-R的资助。
作者信息
隶属关系
贡献
CG,进行表型分析和硅分析。AC,进行基因分型。AS进行了基因组分析。PM,对手稿的撰写有贡献。JJF,构思和编写稿件,并进行统计数据分析。所有作者阅读并批准了最后的版本。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有利益冲突。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
García-fernández,C.,Campa,A.,Garzón,A.。等等。普通豆荚形态和颜色性状的GWAS。BMC植物杂志21,184(2021)。https://doi.org/10.1186/s12870-021-02967-021-02967-021-02967-021-02967-021-02967-021-02967-021-02967-
已收到:
接受:
发表:
关键词
- phoudolusulus vulgaris.L.
- 西班牙多样性面板
- 表型
- 协会
- Meta QTL候选基因