- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
BdERECTA控制脉管系统模式和韧皮部-木质部组织gydF4y2BaBrachypodium distachyongydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba,文章号:gydF4y2Ba196gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植物的维管系统由木质部和韧皮部两种主要组织类型组成。这些组织被组织成维管束,维管束被安排成一个复杂的网络,贯穿整个植物,这对陆地植物的生存能力至关重要。尽管它们具有明显的重要性,但在草类中,有关维管组织组织的基因仍然知之甚少。gydF4y2Ba
结果gydF4y2Ba
对模型草茎的维管网进行了详细研究gydF4y2BaBrachypodium distachyongydF4y2Ba并在维管束和薄壁组织中鉴定出大量差异表达的基因。为了破译草类血管化的分子机制,我们对异常血管进行了正向遗传筛选。我们发现了一个严重影响血管组织组织的突变。该突变体在血管网络的吻合上有缺陷,且两维管束不常见。因果突变是一个过早的终止密码子gydF4y2BaERECTA,gydF4y2Ba一种LRR受体样丝氨酸/苏氨酸蛋白激酶。该基因的突变是多效性的,表明它在植物发育过程中起多种作用。该突变体还表现出细胞壁组成、基因表达和激素稳态的变化。gydF4y2Ba
结论gydF4y2Ba
综上所述,ERECTA在短柄纲中具有多效性。我们提出了ERECTA在短肢类动物血管吻合和血管组织组织中的主要作用。gydF4y2Ba
简介gydF4y2Ba
脉管系统的形成是植物进化的关键一步,它使植物能够在陆地上殖民。脉管系统形成一个相互连接的网络,在整个植物中运输水和光合产物[gydF4y2Ba1gydF4y2Ba].双子叶植物的血管个体发育和模式已经得到了广泛的研究。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba]而单子叶植物则较少[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].维管束起源于初级分生组织,在初级分生组织中,激素机制的精确编排控制着维管束的层状结构和模式(VB) [gydF4y2Ba7gydF4y2Ba].双子叶植物和单子叶植物都具有相同的基本初级维管平面,由巨大的顶端分化的静脉组成,然而,草茎的特征是重复的植瘤,需要沿着茎连接在一起以获得适当的水力供应。VB的内部组织因物种和组织的不同而不同,并可以以不同的模式组织:侧枝(木质部和韧皮部位于不同的两极,韧皮部位于远端),两性(木质部被韧皮部包围)或两性(韧皮部被木质部包围)。侧枝是在大多数植物中观察到的形态。有趣的是,在被子植物的进化过程中,导电元素的组织发生了分化。例如,当草的维管系统形成时,它缺乏次生分生组织产生的维管组织的增厚,次生分生组织位于一个开放的侧枝VB中,它将大多数双子叶植物的木质部和韧皮部分开[gydF4y2Ba8gydF4y2Ba].究竟是双子叶植物获得了这种能力,还是草类失去了这种能力,仍然存在争议[gydF4y2Ba9gydF4y2Ba],但重要的是,精确的维管结构对于单子叶植物至关重要,因为它们缺乏形成层,而形成层可以让一些双子叶植物在一生中通过木材的形成来调整它们的水导率。与双子叶类植物相比,草类植物中驱动维管模式的分子和遗传基础尚未得到充分研究gydF4y2Ba拟南芥gydF4y2Ba芥gydF4y2Ba(拟南芥)和杨树虽然有一些与激素稳态相关的特征基因影响水稻和玉米的血管模式[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2BaBrachypodium distachyongydF4y2Ba(短柄草属)被认为是细胞壁研究的相关模式植物[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba],但迄今为止,它还没有被广泛用于鉴定负责血管发育的基因,尽管已发表的血管解剖学描述[gydF4y2Ba19gydF4y2Ba].最近,医生观察到脉管系统发育异常。gydF4y2Ba20.gydF4y2Ba时,一个参与导管坑形成的基因MAP20在短叶藻中被敲除。在本文中,我们发现了拟南芥一个同源系的两个等位基因gydF4y2BaERECTAgydF4y2Ba诱导维管束融合(称为吻合)和短柄草节间的异常模式,这种表型在其他禾草中未见报道gydF4y2BaerectagydF4y2Ba突变体。而拟南芥ERECTA被认为是一个发育主基因,通过激活油菜素类固醇和生长素信号通路来调节组织伸长和植物结构[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba对于它在草类中的作用却知之甚少。水稻OsERECTA1先前被证明与耐热性有关[gydF4y2Ba24gydF4y2Ba]最近,通过间接激活细胞分裂素氧化酶,成为每穗小穗数的负调节因子[gydF4y2Ba25gydF4y2Ba].在短柄纲ERECTA突变体中,激素稳态被破坏,部分VB缺乏极性,表现为两孔表型。在这项工作中,我们使用激光捕获显微解剖(LCM)来发现主要在新生VB中表达的基因并进行定位gydF4y2BaBdERECTAgydF4y2Ba在顶端分生组织中。这些结果表明,富含亮氨酸重复受体样激酶(LRR-RLK) BdERECTA是控制短柄藻维管组织吻合的关键因素。gydF4y2Ba
结果gydF4y2Ba
短柄藻茎的维管网呈规则分布gydF4y2Ba
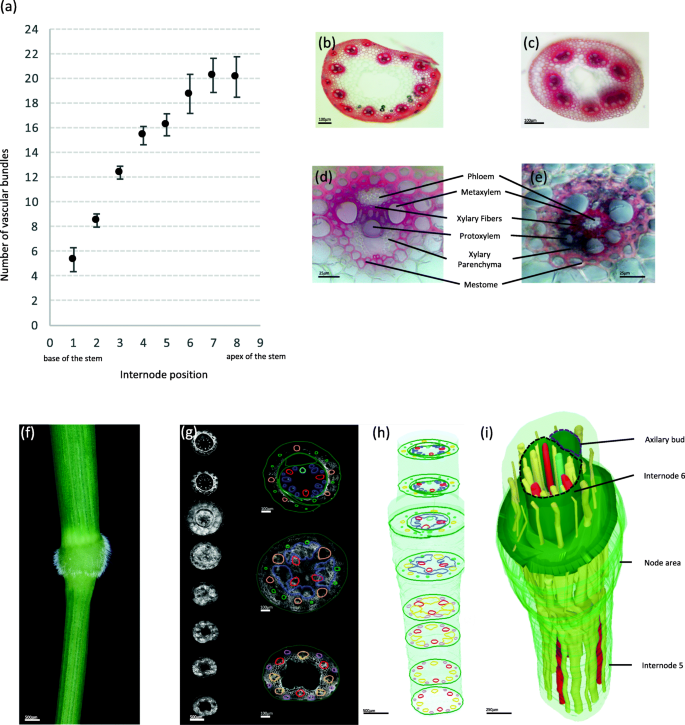
为了描述短柄草茎的维管网络,我们在开花阶段和茎完全拉长时,沿着7株植物的主茎,在每个节间顶部以下1厘米处(从基部开始编号1-9)做了横切面。gydF4y2Ba1gydF4y2Ba).切片用间苯三酚-盐酸染色,木质化组织染红;因此,突出VBs。VBs的数量和大小在茎部各不相同(图。gydF4y2Ba1gydF4y2Baa)各节点间VBs数量稳定。事实上,茎基部(第一个节间)的VBs数量从4个增加到7个,而花梗的VBs数量平均为20个。gydF4y2Ba
短柄草沿主花茎的维管束图案。gydF4y2Ba一个gydF4y2Ba短柄草(Brachypodium)主主干维管束数目(VB) (gydF4y2BangydF4y2Ba= 7)。中所述,所有VBs均显示为侧边形状gydF4y2BadgydF4y2Ba除第一个节间外,其中20%与至少一个其他VB融合,14%表现为两胚囊表型gydF4y2BaegydF4y2Ba.gydF4y2BabgydF4y2Ba短柄草WT茎萌发后45天(DAG)第五节间手横切面。gydF4y2BacgydF4y2Ba, 45 DAG时WT茎第一节间的手横截面。gydF4y2BadgydF4y2Ba在45 DAG时,短柄草茎第五节间的大侧枝VB。(e)在45 DAG时WT短茎第一节间具有两胚囊表型的VB。所有切片均用间苯三酚-盐酸染色。gydF4y2BafgydF4y2Ba第5个淋巴结用于制作横切面,然后用共聚焦显微镜成像。gydF4y2BaggydF4y2Ba8个横切面展示了一系列共聚焦显微镜成像的36个切片(在三个不同的样本中重复)(左),并说明了如何在不同区域手动识别VBs(右)。在节点间,所有的VB都是不同的。在节点间以粉红色表示的大多数小VBs在上部叶子中可识别为未来的小静脉(绿色圆圈)。节间橙色的大维管束在节内相互连接(深蓝色),并在节间上部形成新的VB。三个维管束(红色)穿过结节,没有任何可见的吻合。一个新的维管束(浅蓝色)在腋芽前的节中发育。gydF4y2BahgydF4y2Ba重建节点中堆叠的典型截面示意图。gydF4y2Ba我gydF4y2Ba节点间区域三维重建(共聚焦748幅图像进行三维重建)。在本次重建中,VBs为黄色,未在节点内吻合的三个维管束为红色,新形成的VB为蓝色。使用FreeD软件手动识别每个维管束gydF4y2Ba
节间的典型茎VB包含两个大的偏木质部血管,由较小的连接木质部细胞隔开。gydF4y2Ba1gydF4y2Bab, d).但在靠近节点处切片时,可观察到较多的甲基部细胞。连接木质部细胞的是由几层高度木质化的木质部纤维与韧皮部细胞隔开的导电元件。在连接的木质部细胞下方可观察到原生木质部血管。这些元素显示环状木质增厚。原生木质部血管与木质部薄壁细胞相邻。韧皮部细胞位于原木质部细胞的远端。在C3草中,整个VB被一层称为间口的厚壁组织包围[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].在第一个节点间(茎的底部),VBs在茎内部有不同的模式(图。gydF4y2Ba1gydF4y2Bac)和不同形状(图。gydF4y2Ba1gydF4y2Bae).的确,我们观察到在第一个节间存在的VBs中,一些VBs在VB中间与韧皮部组织吻合或表现为两血管形状,而木质部血管位于VB外侧(图。gydF4y2Ba1gydF4y2Bae).在7种植物中,20%的VBs与另一个VB融合,12.5%的VBs在第一个节间表现为两胚囊型,而在上部节间未观察到这些表型。gydF4y2Ba
为了更全面地观察血管网络在节点间过渡的过程,我们从第5个节点下方1cm到其顶部制作了36个截面(每个截面100 μm),并在3个不同的节点上重复此实验。随后,我们将一个节点的748张共聚焦图像叠加在一起,重建三维血管网络(图2)。gydF4y2Ba1gydF4y2Ba外:我)。如上所述,节点间的VBs在汇聚到节点之前是不连接的,因为我们清楚地观察到在节点间切片的最远端区域,大VBs和小VBs交替出现(图2)。gydF4y2Ba1gydF4y2Bag, h,图。gydF4y2Ba2gydF4y2Bab,图SgydF4y2Ba1gydF4y2Ba).大多数VBs在该节点上进行了吻合。这种现象很容易看到,因为大多数VBs在节点区域放大(图SgydF4y2Ba1gydF4y2Ba).然而,尽管吻合使节点内血管网络的识别复杂化,我们注意到三个VBs(图中红色部分)。gydF4y2Ba1gydF4y2Bah, i和图SgydF4y2Ba1gydF4y2Ba)穿过该节点时,没有与其他血管发生明显的吻合,因为这三个VBs在该节点上没有扩大(图S . 5)gydF4y2Ba1gydF4y2Ba).吻合使VBs继续沿茎向上,到达上节间或分支进入叶鞘(如图绿色部分所示)。gydF4y2Ba1gydF4y2Bag, h, i)。此外,一个新的VB(浅蓝色,图。gydF4y2Ba1gydF4y2BaH, i)在毗邻侧芽的节上发育。gydF4y2Ba
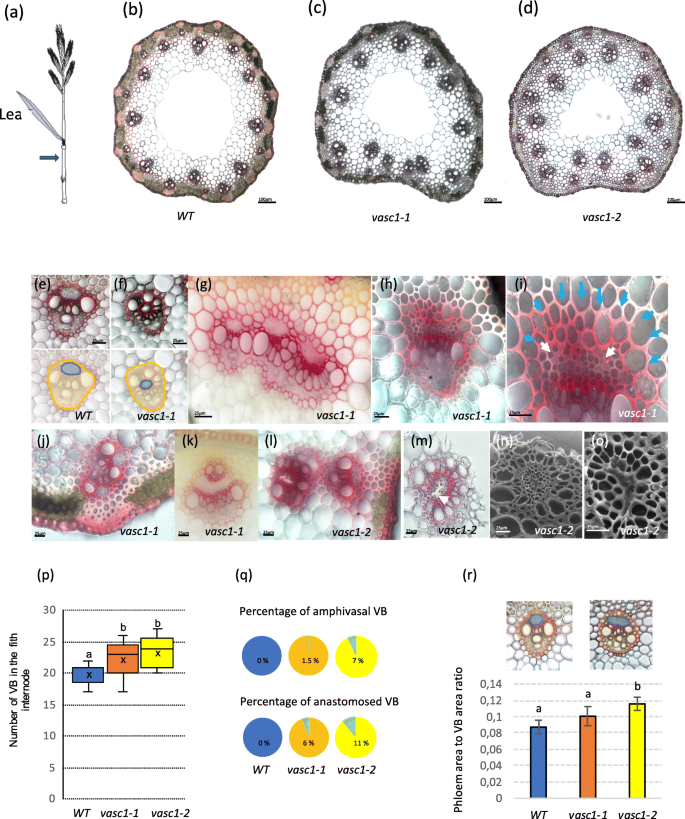
血管表型gydF4y2BaVasc1-1和vasc1-2gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba穗状花序(包括花梗)、最后一片叶子、最后一个节和倒数第二个节间的图示。蓝色箭头显示了横截面的位置。gydF4y2BabgydF4y2BaWT茎截面。gydF4y2BacgydF4y2BaVasc1-1gydF4y2Ba.gydF4y2BadgydF4y2BaVasc1-2gydF4y2Ba.gydF4y2BaegydF4y2Ba小波波的维管束(VB), VB和小波波的韧皮部区分别用橙色和蓝色描绘(下图)。gydF4y2BafgydF4y2Ba两类VB在gydF4y2Bavasc1-1gydF4y2Ba.VB和韧皮部的面积gydF4y2Bavasc1-1gydF4y2Ba分别用橙色和蓝色描绘(底部)。gydF4y2BaggydF4y2Ba3个VBs在节点间吻合gydF4y2Bavasc1-1gydF4y2Ba.gydF4y2BahgydF4y2BaVB从gydF4y2Bavasc1-1gydF4y2Ba.gydF4y2Ba我gydF4y2Ba放大的gydF4y2BahgydF4y2Ba在韧皮部区域。白色箭头表示异常韧皮部细胞。蓝色箭头表示韧皮部附近木质化的间质细胞增大。gydF4y2BajgydF4y2Ba,两个VBs在gydF4y2Bavasc1-1gydF4y2Ba.gydF4y2BakgydF4y2Ba小VB插入大VB韧皮部组织(gydF4y2Bavasc1-1gydF4y2Ba).gydF4y2BalgydF4y2BaVB放错地方了gydF4y2Bavasc1-2gydF4y2Ba.gydF4y2Ba米gydF4y2BaVB中gydF4y2Bavasc1-2gydF4y2Ba.箭头显示异常韧皮部组织。gydF4y2BangydF4y2Ba的扫描电镜照片gydF4y2Ba米gydF4y2Ba.gydF4y2BaogydF4y2Ba重点观察韧皮部区域(n)。除gydF4y2BangydF4y2Ba而且gydF4y2BaogydF4y2Ba.gydF4y2BapgydF4y2BaWT中VBs的数量和突变体倒数第二节点间的数量如gydF4y2BabgydF4y2Ba.以上直方图字母表示显著差异(gydF4y2BapgydF4y2Ba经Tuckey 's配对检验,基因型间差异< 0.05)(gydF4y2BangydF4y2Ba= 17)。gydF4y2Ba问gydF4y2BaWT中两血管或吻合的VBs的百分比,gydF4y2Bavasc1-1gydF4y2Ba,gydF4y2Bavasc1-2gydF4y2Ba.(r) WT下典型侧枝型VBs韧皮部面积与整个VB面积的比值,gydF4y2Bavasc1-1gydF4y2Ba,gydF4y2Bavasc1-2gydF4y2Ba.以上直方图字母表示显著差异(gydF4y2BapgydF4y2Ba经Tuckey 's配对检验,基因型间差异< 0.05)(gydF4y2BangydF4y2Ba= 6个植物,每个部分由17到24个VBs组成)gydF4y2Ba
BdERECTAgydF4y2Ba控制短柄藻维管束的发育gydF4y2Ba
为了鉴定参与血管组织的基因,我们对300 M2的化学诱导短肢藻突变体群体进行了正向遗传筛选[gydF4y2Ba28gydF4y2Ba].我们在茎梗以下节间上部制作手横切面,用间苯三酚-盐酸染色,以可视化VBs中甲生部细胞、血管内纤维和间孔细胞壁上的木质素[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
在一个诱变系的后代中,被命名为gydF4y2Bavasc1-1gydF4y2Ba,部分植物节间维管束形态明显不规则(图2)。gydF4y2Ba2gydF4y2Ba).而大多数野生型(WT)节间在茎周围呈圆形排列,大束和小束交替排列(第一个节间除外)(图2)。gydF4y2Ba2gydF4y2Baa, b),突变体显示出错位的束,大束偶尔位于近端区域(图。gydF4y2Ba2gydF4y2Bac),这是WT中从未观察到的组织。此外,我们偶尔也观察到两血管的VBs(图。gydF4y2Ba2gydF4y2Bae, f)和大VBs融合在一起(图。gydF4y2Ba2gydF4y2Bag和j),少数情况下,小VBs完全嵌入大VBs的韧皮部组织(图。gydF4y2Ba2gydF4y2Bak).部分VB的组织结构在gydF4y2Bavasc1-1gydF4y2Ba.例如,在WT中韧皮部筛元经常塌陷,韧皮部附近的间口细胞与间口相比体积过大(图2)。gydF4y2Ba2gydF4y2Bah, i).同样,在WT第一个节间以上的节间中未观察到这些表型。gydF4y2Ba
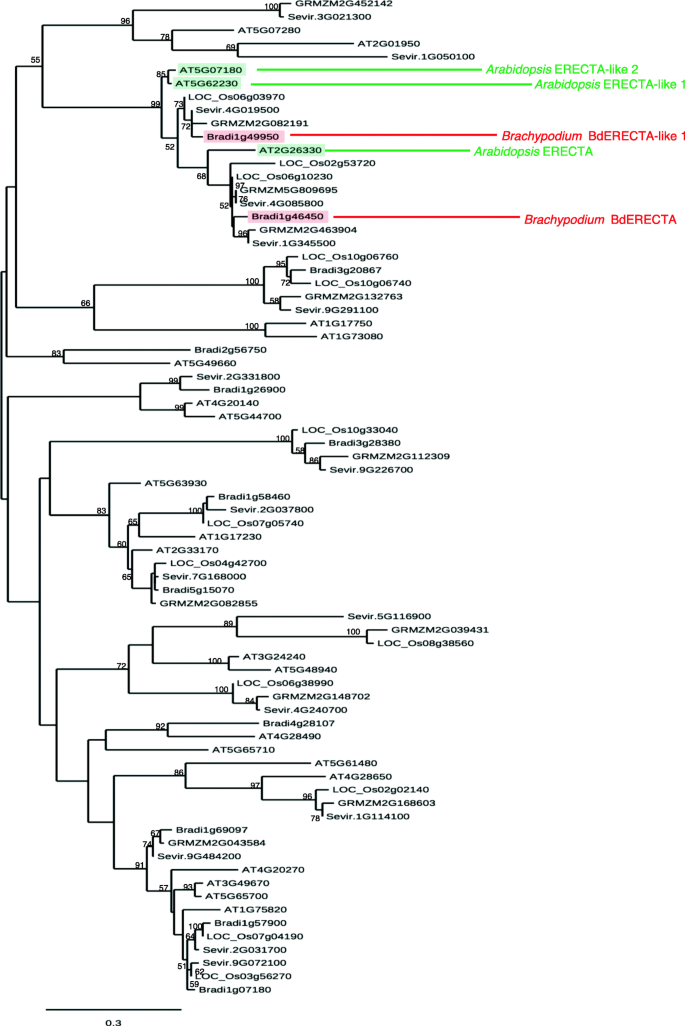
纯合子的gydF4y2Bavasc1-1gydF4y2Ba植株几乎是不育的,但通过检查杂合子M2系的后代,我们注意到表型是隐性的,并且以典型的3:1的比例分离,这表明它是由单个突变诱导的。我们对16株M2和M3植物的DNA进行了测序,显示了突变的血管表型。我们一共发现了1377个突变,其中只有4个是纯合的(表SgydF4y2Ba1gydF4y2Ba).其中3个突变位于基因间区或内含子,因此不太可能是因果突变(表S1)。第四个纯合突变特别有趣,因为它从编码富亮氨酸重复受体样激酶(leucin - rich Repeat Receptor-Like Kinase, Bradi1g46450)基因的预测起始密码子引入了1026 bp的无义突变(gydF4y2Bahttps://phytozome.jgi.doe.gov/gydF4y2Ba).这种突变在蛋白质的n端区域早期诱导了一个过早的终止密码子,并且只允许翻译20个氨基酸(aa),而不是在WT中预测的978个氨基酸(图SgydF4y2Ba2gydF4y2Ba).这表明这种突变是完全的敲除。Bradi1g46450编码一个富亮氨酸重复受体样激酶,与拟南芥ERECTA蛋白相似度为85%。有趣的是,研究表明ERECTA参与拟南芥脉管系统形成层的维持[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].研究表明,Bradi1g46450是拟南芥ERECTA蛋白(At2g26330)的同源体。因此,我们将Bradi1g46450命名为,gydF4y2BaBdERECTAgydF4y2Ba.另一个我们命名的基因,Bradi1g49950gydF4y2BaBdERECTA-like 1gydF4y2Ba是一个紧密的para(图。gydF4y2Ba3.gydF4y2Ba表SgydF4y2Ba2gydF4y2Ba).有三个同源蛋白gydF4y2BaSetaria veridisgydF4y2Ba,gydF4y2Ba玉米,水稻和gydF4y2Ba拟南芥(无花果。gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba.gydF4y2Ba以明确验证该等位基因对Bradi1g46450的作用gydF4y2Bavasc1-1gydF4y2Ba表现型,我们选择一个突变体进行基因分型,gydF4y2Bavasc1-2,gydF4y2Ba含有T-DNA插入[gydF4y2Ba33gydF4y2BaBradi1g46450的编码序列(图SgydF4y2Ba2gydF4y2Ba).T-DNA插入到Bradi1g46450的第一个内含子,在起始密码子299 bp处。gydF4y2BaBradi1g46450gydF4y2Ba在成熟和完全伸长的茎(45 DAG)中未检测到转录本gydF4y2Bavasc1-2gydF4y2Ba,证实该T-DNA突变体为的零等位基因gydF4y2BaBradi1g46450gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba).毫不奇怪,gydF4y2BaBradi1g46450gydF4y2Ba转录本被检测到gydF4y2Bavasc1-1gydF4y2Ba(化学诱导突变体),尽管与WT相比水平较低(图SgydF4y2Ba2gydF4y2Ba).gydF4y2Bavasc1-2gydF4y2Ba还清楚地显示血管缺陷。我们发现两个突变体在位于茎梗下方的倒数第二节间有明显更多的VBs(图2)。gydF4y2Ba2gydF4y2Bab-d, p),其中相当一部分位于茎内,呈两血管状或吻合(图。gydF4y2Ba2gydF4y2Baa-d, l, p, q)gydF4y2Bavasc1-1gydF4y2Ba的扫描电子显微镜gydF4y2Bavasc1-2gydF4y2Ba韧皮部和筛元形态异常(图;gydF4y2Ba2gydF4y2Bam-o)。我们定量韧皮部面积gydF4y2Bavasc1-1gydF4y2Ba,gydF4y2Bavasc1-2gydF4y2BaVBs中的WT表现出与WT相似的典型侧支模式,因此排除了吻合或两血管的VBs。相对于整个韧皮部面积,韧皮部面积较大gydF4y2Bavasc1-2gydF4y2Ba而且gydF4y2Bavasc1-1gydF4y2Ba与WT相比,gydF4y2Bavasc1-2gydF4y2Ba差异有统计学意义(图;gydF4y2Ba2gydF4y2Bar)。gydF4y2Ba
来源的亮氨酸-富受体激酶蛋白的邻居连接系统树gydF4y2BaBrachypodium distachyongydF4y2Ba,gydF4y2Ba水稻,狗尾草,玉米和拟南芥gydF4y2Ba.该树由与拟南芥ERECTA有超过35%氨基酸相同的蛋白质制成(At2g26330,表SgydF4y2Ba2gydF4y2Ba).节点值为引导值。图例显示了每kb的替换数gydF4y2Ba
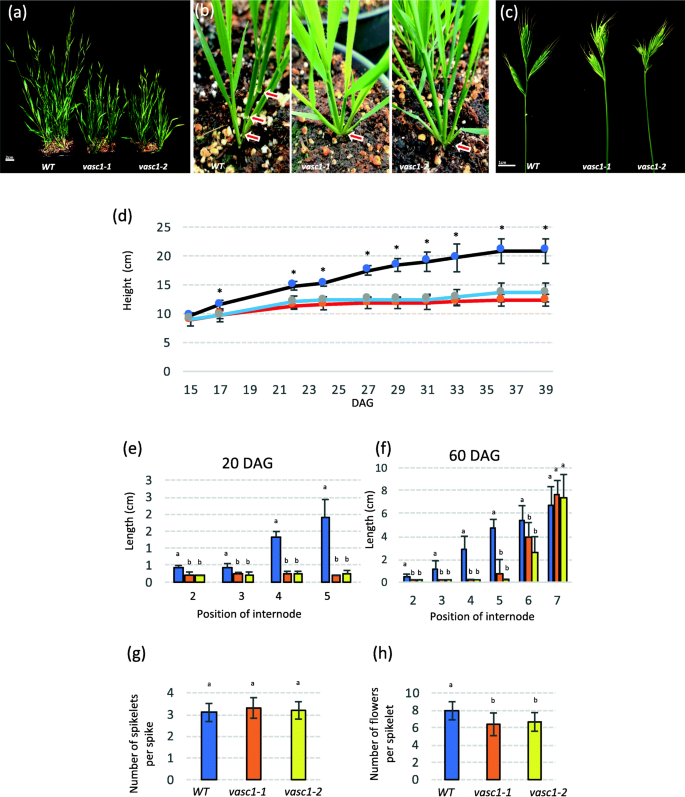
这两个gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba与WT相比缩短(图;gydF4y2Ba4gydF4y2Baa, d),这是由于减少节间伸长(图。gydF4y2Ba4gydF4y2Bab).这种表型在营养期被量化(20 DAG,图。gydF4y2Ba4gydF4y2Bae)和成熟期(完全拉长茎干时,60 DAG,图。gydF4y2Ba4gydF4y2Baf).这表明,上部节间受影响程度不如下部节间。在两种突变体中,尖刺的形状都不正常。gydF4y2Ba4gydF4y2Bac).突变体和野生型的每小穗数基本相同,但突变体和野生型的每小穗花数较少gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bag, h).这两个突变体都表现出严重的不育性,因为在123个突变体中只有29个和3个存活的种子gydF4y2Bavasc-1-1gydF4y2Ba和146年gydF4y2Bavasc1-2gydF4y2Ba在我们的培养条件下,每株WT植物产生100到300颗种子。gydF4y2Ba
表型的gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba.gydF4y2Ba一个gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba突变体在萌发后45天(DAG)比WT短。gydF4y2BabgydF4y2Ba这两个突变体在开花前的节间伸长(20 DAG)受到严重影响。红色箭头表示可见节点的位置。gydF4y2BacgydF4y2Ba两者都影响小穗的发育gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba.gydF4y2BadgydF4y2Ba突变体生长曲线(高度)(红线,gydF4y2Bavasc1-1gydF4y2Ba;蓝线,gydF4y2Bavasc1-2gydF4y2Ba)和WT(黑线)从15到39 DAG。恒星表现出显著的差异(单向方差分析,gydF4y2BapgydF4y2Ba< 0.01,gydF4y2BangydF4y2Ba= 10)。gydF4y2BaegydF4y2Ba20 DAG时的节间大小(gydF4y2BangydF4y2Ba= 10)。gydF4y2BafgydF4y2Ba成熟期节间大小(60 DAG,gydF4y2BangydF4y2Ba= 10)。gydF4y2BaggydF4y2Ba50 DAG时每穗小穗数(gydF4y2BangydF4y2Ba= 23个尖峰)。gydF4y2BahgydF4y2Ba50 DAG时每小穗平均花数(gydF4y2BangydF4y2Ba= 64)。以上直方图字母表示显著差异(gydF4y2BapgydF4y2BaTuckey 's两两检验,基因型间差异< 0.05)gydF4y2Ba
BdERECTAgydF4y2Ba在维管束和薄壁组织中都有表达gydF4y2Ba
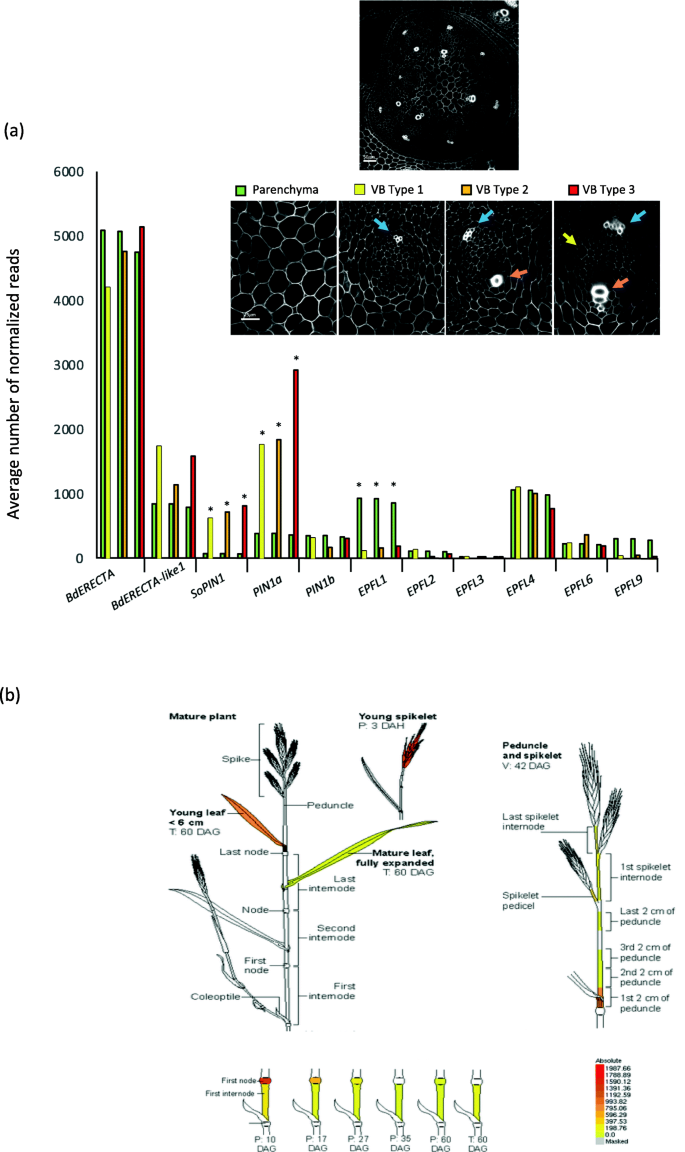
为了鉴定参与维管组织形成的基因并进行量化gydF4y2BaBdERECTAgydF4y2Ba我们对三种不同类型的维管束进行了激光捕获显微解剖(LCM)和RNAseq分析。维管原形成层细胞起源于靠近茎尖分生组织的区域,并随着VBs的成熟而增加。因此,为了捕捉VBs的不同发育阶段,我们从20 DAG(开花前,图S .)的茎尖区连续冷冻切片中,根据可见原生木质部细胞数量选择VBsgydF4y2Ba3.gydF4y2Ba).我们使用从茎中央微解剖的薄壁组织作为对照(图SgydF4y2Ba3.gydF4y2Ba,无花果。gydF4y2Ba5gydF4y2Ba).由于原形成层在早期很少有叶绿素,我们利用这一特征来检测芽尖的新生VBs(图SgydF4y2Ba3.gydF4y2Bab, c).在VB type 1中(未检测到任何原生木质部细胞(图S3和图。gydF4y2Ba5gydF4y2Ba),我们发现VB与薄壁细胞中有541个基因差异表达,其中286个基因上调(其中70个基因仅在VB1中检测到,而在薄壁细胞中未检测到)(表S .)gydF4y2Ba3.gydF4y2Ba).在VB型2中(显示一个或两个可检测到的原始木质部细胞)gydF4y2Ba3.gydF4y2Ba和无花果。gydF4y2Ba5gydF4y2Ba),我们发现VB与薄壁细胞中有495个基因差异表达,其中175个基因上调(35个基因仅在VB2中检测到,在薄壁细胞中未检测到)(表S .)gydF4y2Ba3.gydF4y2Ba).在VB型3中(显示三个可检测到的原始木质部细胞)gydF4y2Ba3.gydF4y2Ba和无花果。gydF4y2Ba5gydF4y2Ba),我们发现,与薄壁细胞相比,VB中有614个基因差异表达,其中179个基因上调(其中25个基因仅在VB3中检测到,而在薄壁细胞中未检测到)(表S .)gydF4y2Ba3.gydF4y2Ba).然而,当我们将所有VB转录组加在一起与仅比较薄壁组织时,我们发现1769基因在这两种类型的组织中表达不同(表SgydF4y2Ba4gydF4y2Ba).许多基因的直系同源最近被证明参与了拟南芥的维管分化和木质部/韧皮部分化[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba]显示高表达水平。例如,TMO6的同源基因Bradi1g26570 (At5g60200)在VBs中较薄壁细胞上调4倍,PXY的同源基因(Bradi3g17567, At5g61480)在VB中较薄壁细胞上调3 - 5倍(根据VB类型)。为了明确确认我们的LCM实验正确地区分了VB和薄壁组织,我们检查了一些已知在草VBs中特异性表达的基因的表达模式,这些基因已经发表。木质部半胱氨酸蛋白酶(XCP1, Bradi2g39320)是RNAseq数据中第二大差异表达基因,在VBs中的表达量是薄壁组织的30倍。pXCP1:XCP1::gus系表示特异表达gydF4y2BaXCP1gydF4y2Ba在根尖区原木质部和转木质部细胞中(图SgydF4y2Ba4gydF4y2Ba)先前在stem by [gydF4y2Ba36gydF4y2Ba].同样的,gydF4y2BaPIN1agydF4y2BaVB type1和VB type3的转录水平分别比实质高10倍和16倍。PIN1a-citrine [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba37gydF4y2Ba]明确、特异性地定位于根尖区VBsgydF4y2BaPIN1agydF4y2Ba与实质相比,在VB中表达差异很大(图SgydF4y2Ba4gydF4y2Ba).这些结果证实了我们的LCM样品明显富集了VBs。gydF4y2BaBdERECTAgydF4y2Ba在所有组织中均有高表达,差异无统计学意义(图;gydF4y2Ba5gydF4y2Baa).有趣的是,我们观察到gydF4y2BaBdERECTA-like 1gydF4y2Ba在VBs中表达高于实质,但差异无统计学意义。因为拟南芥ERECTA与不同的配体相互作用,这取决于在植物中的定位[gydF4y2Ba38gydF4y2Ba],我们把注意力集中在骨科上gydF4y2Ba表皮因子样,即gydF4y2BaEPFL1, 2, 3, 4, 6和9转录本(图2。gydF4y2Ba5gydF4y2Baa).后者中,gydF4y2BaBdEPFL1gydF4y2Ba(也称为水稻中的RAE, Os08g0485500, [gydF4y2Ba39gydF4y2Ba])在各阶段薄壁组织中表达均显著高于VB。gydF4y2BaEPFL9gydF4y2Ba表现出和gydF4y2BaEPFL1gydF4y2Ba,但这种模式在统计上并不显著。gydF4y2Ba
表达模式gydF4y2BaBdERECTAgydF4y2Ba在Brachypodium。gydF4y2Ba一个gydF4y2Ba部分精选基因在三种不同类型维管束(VBs)和茎尖薄壁组织中的表达量。图片显示共焦图像,突出显示不同类型的VB所选择的位置(见图SgydF4y2Ba3.gydF4y2Ba): VB型,激光微解剖VBs未见原生木质部细胞(细胞壁较厚);VB型2,激光显微解剖VBs中仅检出1 ~ 2个原生木质部细胞;VB Type 3,激光显微切片可见3个原生木质部细胞。gydF4y2BaBdERECTAgydF4y2Ba(Bradi1g46450.1),gydF4y2BaBdERECTA-like1gydF4y2Ba(Bradi1g49950.1),gydF4y2BaSoPINgydF4y2Ba(Bradi4g26300.2),gydF4y2BaPIN1agydF4y2Ba(Bradi1g45020.1),gydF4y2BaPIN1bgydF4y2Ba(Bradi3g59520.1),gydF4y2BaEPFL1gydF4y2Ba(Bradi3g38740.1),gydF4y2BaEPFL2gydF4y2Ba(Bradi1g10080.1),gydF4y2BaEPFL3gydF4y2Ba(Bradi2g05865.1),gydF4y2BaEPFL4gydF4y2Ba(Bradi1g74380.1),gydF4y2BaEPFL6gydF4y2Ba(Bradi2g22340.1),gydF4y2BaEPFL9gydF4y2Ba(Bradi2g58540.1)。蓝色箭头表示原韧皮部细胞。红色箭头表示原生木质部细胞。黄色箭头表示新生的偏骨质部。星星显示显著值(错误发现率,见表S)gydF4y2Ba3.gydF4y2Ba).gydF4y2BabgydF4y2Ba在硅片表达水平gydF4y2BaBdERECTAgydF4y2Ba使用eFP浏览器对部分样本器官进行分析gydF4y2BaBrachypodium distachyongydF4y2Ba(Sibout et al., 2017)。表达式值gydF4y2BaBdERECTAgydF4y2Ba转录本由颜色梯度表示(右下),其中黄色表示未检测到表达,而红色表示最高表达gydF4y2Ba
在宏观尺度上,gydF4y2BaBdERECTAgydF4y2Ba在叶片、穗、节和节间基部等年轻组织中表达。gydF4y2Ba5 bgydF4y2Ba)根据BAR (gydF4y2Bahttps://bar.utoronto.ca/efp_brachypodium/cgi-bin/efpWeb.cgigydF4y2Ba和行星(gydF4y2Bahttps://aranet.sbs.ntu.edu.sg/responder.py?name=gene bdi !5672gydF4y2Ba)数据库[gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
根据PlaNet上的数据,gydF4y2BaBdERECTAgydF4y2Ba与几个激素反应基因(例如SAUR基因)共表达,这些基因参与茎尖分生组织发育和血管化(CLAVATA1和YABBY同源物[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba]),以及细胞壁生物合成基因(如木葡聚糖半乳糖基转移酶,纤维素合成酶样)(表SgydF4y2Ba5gydF4y2Ba) (gydF4y2Bahttps://aranet.sbs.ntu.edu.sg/responder.py?name=gene bdi !5672gydF4y2Ba[gydF4y2Ba40gydF4y2Ba].有趣的是,我们发现gydF4y2BaBdERECTA-like 1gydF4y2Ba在137个基因中与gydF4y2BaBdERECTAgydF4y2Ba.gydF4y2Ba
微阵列分析gydF4y2Bavasc1-1gydF4y2Ba揭示脉管系统和激素代谢的变化gydF4y2Ba
我们对20株DAG植物进行了微阵列分析。在这个阶段,植物还没有开始开花和可见的表型gydF4y2Bavasc1-1gydF4y2Ba与WT不容易区分(图SgydF4y2Ba5gydF4y2Ba).我们选择这一阶段是希望捕获更多的初级转录组反应,而不是由于BdERECTA活性的丧失而可能发生的间接发育反应。因为gydF4y2Bavasc1-1gydF4y2Ba是一种具有多重突变的化学诱导突变体,我们比较了四种纯合子的转录组gydF4y2Bavasc1-1gydF4y2Ba植株与四株植物为杂合子gydF4y2Bavasc1-1 BdERECTAgydF4y2Ba突变的等位基因gydF4y2Ba.gydF4y2Ba我们发现Bonferroni和Benjamini-Hochberg错误发现方法分别有215和541个基因差异表达(表S .)gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
通过RT-PCR检测成熟茎(图SgydF4y2Ba2gydF4y2Ba),微阵列分析证实其含量较低gydF4y2BaBdERECTAgydF4y2Ba转录本水平为纯合子gydF4y2Bavasc1-1gydF4y2Ba与杂合子相比gydF4y2Bavasc1-1gydF4y2Ba在这个阶段。关于血管表型,我们注意到gydF4y2BaBradi3g10270gydF4y2Ba而且gydF4y2BaBradi4g07570gydF4y2Ba它们是特定韧皮部蔗糖转运体的同源物,gydF4y2Ba拟南芥甜7gydF4y2Ba(gydF4y2BaAt4g10850gydF4y2Ba),gydF4y2Ba11gydF4y2Ba(gydF4y2BaAt3g48740gydF4y2Ba)过表达(1.5倍)gydF4y2Bavasc1-1gydF4y2Ba纯合突变体(表SgydF4y2Ba6gydF4y2Ba).同样,的转录水平gydF4y2BaBradi2g0025gydF4y2Ba,是拟南芥韧皮部特异性蛋白PP2的同源物(gydF4y2BaAt4g19840gydF4y2Ba)的含量也比纯合子高1.45倍gydF4y2Bavasc1-1gydF4y2Ba与杂合子植株相比。短叶藻在木质部分化和增殖中起作用的假设通过下调gydF4y2BaBradi3g13291gydF4y2Ba(纯合子表达低1.5倍gydF4y2Bavasc1-1gydF4y2Ba和杂合子),气管元件分化相关的直系同源7 (TED7,gydF4y2BaAt5g48920gydF4y2Ba)参与气管发育的gydF4y2BaZinnia线虫gydF4y2Ba[gydF4y2Ba43gydF4y2Ba](表SgydF4y2Ba6gydF4y2Ba).最后,在突变体中发现与糖代谢相关的基因被错误调控(表SgydF4y2Ba6gydF4y2Ba).一般来说,在20 DAG时,参与激素生物合成或内稳态的一小组基因被解除调控。例如,的表达式gydF4y2BaBradi2g06030gydF4y2Ba,是拟南芥细胞分裂素氧化酶的同源物(gydF4y2BaCKX5gydF4y2Ba)和米(gydF4y2BaOsCKX2gydF4y2Ba)在20 DAG时降低了1.35倍(表SgydF4y2Ba6gydF4y2Ba)表明细胞分裂素的周转受到了影响gydF4y2Bavasc1-1gydF4y2Ba.这一结果与最近水稻ERECTA1间接控制OsCKX2表达的发现相一致。gydF4y2Ba25gydF4y2Ba].相反,乙烯形成酶(EFE)的同源物编码氨基环丙烷-1-羧酸氧化酶4 (gydF4y2BaBradi4g31820gydF4y2Ba/gydF4y2BaAt1g05010gydF4y2Ba)和蛋白磷酸酶2C (PP2C,gydF4y2BaBradi2g54810gydF4y2Ba/gydF4y2BaAt2g2938gydF4y2Ba0)参与ABA信号通路的蛋白均过表达(1.5倍,表S6)。在20 DAG下,我们没有检测到生长素生物合成或降解相关基因的表达变化,但典型的生长素反应基因如PILS1 (gydF4y2BaBradi3g60740gydF4y2Ba/的同音词gydF4y2BaAt1g20925gydF4y2Ba)或小生长素上调RNA (SAUR16,gydF4y2BaBradi3g1389gydF4y2Ba/的同音词gydF4y2BaAt4g38860gydF4y2Ba)在纯合子中分别上调1.5倍和2倍gydF4y2Bavasc1-1gydF4y2Ba表SgydF4y2Ba6gydF4y2Ba).重要的是,gydF4y2BaBdERECTA-like1gydF4y2Ba不是在解除管制吗gydF4y2Bavasc1-1gydF4y2Ba与杂合子植物相比,纯合子植物的蛋白质含量较高(表SgydF4y2Ba6gydF4y2Ba)gydF4y2Ba.gydF4y2Ba这表明gydF4y2Bavasc1-1gydF4y2Ba不是由变化来调解的吗gydF4y2BaBdERECTA-like 1gydF4y2Ba表达式。gydF4y2Ba
激素内稳态被改变gydF4y2Bavasc1-1gydF4y2Ba
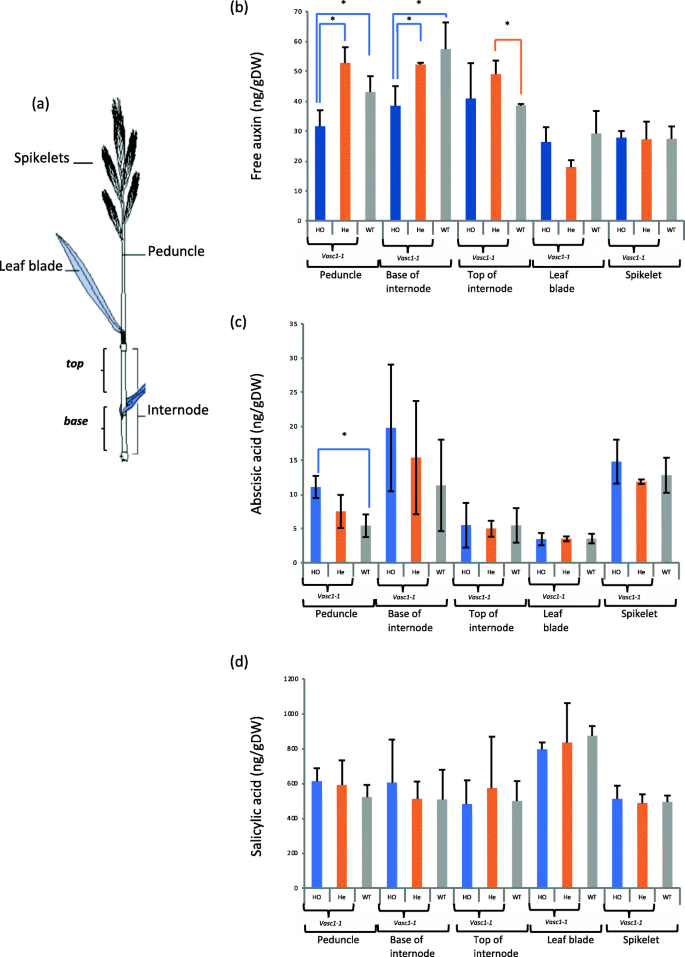
茎部发育的改变gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba以及在PlaNet数据库中观察到的激素稳态相关基因与BdERECTA的共表达(gydF4y2Bahttps://aranet.sbs.ntu.edu.sg/responder.py?name=gene bdi !5672gydF4y2Ba)使我们量化了成熟WT和不同组织中的激素含量gydF4y2Bavasc1-1gydF4y2Ba42 DAG时茎完全拉长的植株(图;gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).为了控制背景突变,我们定量了WT和杂合和纯合的激素gydF4y2Bavasc1gydF4y2Ba突变体。我们使用了整个花梗,最后一个真正节间的基部和顶部,叶子和小穗(图2)。gydF4y2Ba6gydF4y2Ba一个)。gydF4y2Bavasc1-1gydF4y2Ba与WT和杂合突变体相比,突变体整个花梗和节间基部游离生长素含量显著降低(图2)。gydF4y2Ba6gydF4y2Bab).虽然是杂合的,但在节间顶部没有发现这种差异gydF4y2Bavasc1-1gydF4y2Ba在叶片和小穗中检测到生长素含量,但没有发现显著差异(图2)。gydF4y2Ba6gydF4y2Ba).纯合子的ABA水平较高gydF4y2Bavasc1-1gydF4y2Ba纯合子与杂合子间无显著差异gydF4y2Bavasc1-1gydF4y2Ba除花梗中ABA含量为纯合子外,其他组织均为WTgydF4y2Bavasc1-1gydF4y2Ba高于WT,但不杂合gydF4y2Bavasc1-1gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Bac).同样,各基因型的水杨酸含量无差异(图。gydF4y2Ba6gydF4y2Bad)。gydF4y2Ba
游离生长素含量、脱落物和水杨酸含量gydF4y2Ba在vasc1-1gydF4y2Ba.42-DAG不同器官的激素水平gydF4y2Bavasc1-1gydF4y2Ba纯合子植物(gydF4y2Bavasc1-1gydF4y2Ba何gydF4y2Ba),gydF4y2Bavasc1-1gydF4y2Ba杂合植物(gydF4y2Bavasc1-1gydF4y2Ba他gydF4y2Ba)和WT植物。gydF4y2Ba一个gydF4y2Ba方案对不同器官取样进行激素含量定量。gydF4y2BabgydF4y2Ba无生长素含量。gydF4y2BacgydF4y2Ba脱落酸含量。gydF4y2BadgydF4y2Ba水杨酸含量。误差条是标准差。恒星在基因型之间表现出显著差异(方差分析,gydF4y2BapgydF4y2Ba值< 0.05,gydF4y2BangydF4y2Ba= 3)gydF4y2Ba
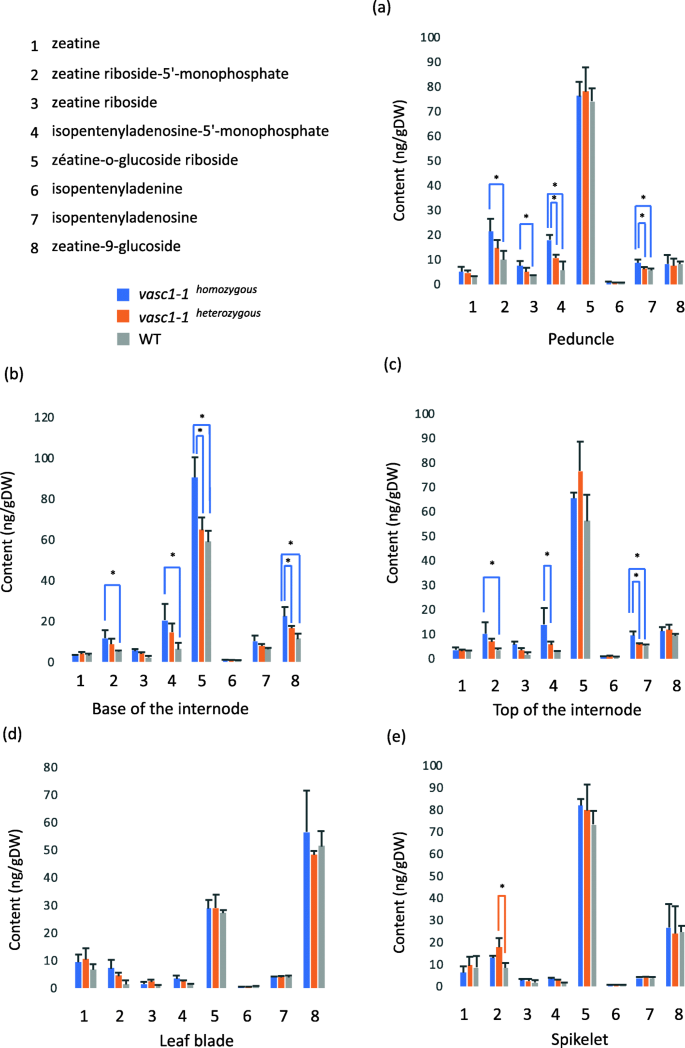
细胞分裂素含量gydF4y2Bavasc1-1gydF4y2Ba.细胞分裂素在不同器官中被定量(见图。gydF4y2Ba6gydF4y2Baa) 42 DAG。gydF4y2Ba一个gydF4y2Ba花梗。gydF4y2BabgydF4y2Ba节间基部。gydF4y2BacgydF4y2Ba节间顶部。gydF4y2BadgydF4y2Ba叶子。gydF4y2BaegydF4y2Ba小穗。误差条是标准差。各基因型间差异有统计学意义(ANOVA, p值≤0.05,gydF4y2BangydF4y2Ba= 3),gydF4y2Bavasc1-1gydF4y2Ba纯合子植物(gydF4y2Bavasc1-1gydF4y2Ba何gydF4y2Ba),gydF4y2Bavasc1-1gydF4y2Ba杂合植物(gydF4y2Bavasc1-1gydF4y2Ba他gydF4y2Ba)和WT植物gydF4y2Ba
我们量化了8种不同细胞分裂素的水平(图。gydF4y2Ba7gydF4y2Ba).从生长素的含量来看,叶片和小穗的细胞分裂素含量变化不大。然而,与游离生长素含量相比,纯合子花梗和节间细胞分裂素含量增加gydF4y2Bavasc1-1gydF4y2Ba与WT相比。gydF4y2Ba
木质纤维素含量受到影响gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba
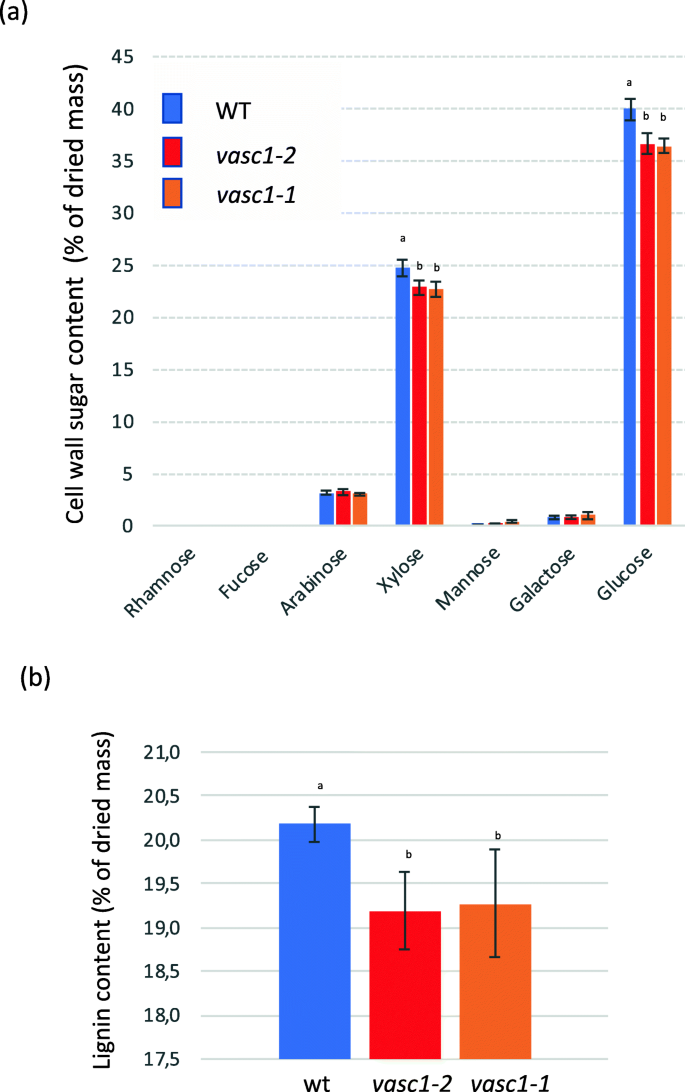
次生细胞壁富集维管组织。突变脉管系统中观察到的严重表型促使我们量化干燥茎的细胞壁糖和木质素含量是否受到影响。水解无溶干茎材料,然后进行气相色谱分析,突出了突变体中木糖和葡萄糖的显著减少(图。gydF4y2Ba8gydF4y2Baa).这些结果表明,短柄草茎中木聚糖和纤维素(主要多糖)含量较少gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba茎。乙酰溴对木质素含量的定量分析表明,两者的木质素沉积量均降低了5%gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba与WT相比的突变体(图;gydF4y2Ba8gydF4y2Bab)。gydF4y2Ba
讨论gydF4y2Ba
短叶草茎部表现出典型的C3单子叶维管束结构,类似于水稻、小麦或大麦[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].每个节间的维管束数量取决于节间沿茎的位置。这种现象可能与连接到节点上的叶子的大小有关,因为第一片叶子比后来长出来的叶子要薄。有趣的是,我们注意到,在第一个节点间,VBs的组织更加多变,一些VBs显示为两栖组织。在野生型植物的上部植物节间,未观察到VBs的两孔组织和吻合gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba突变体。然而,在野生型植物的节点上自然发生了吻合。这种组织需要将叶脉与节点连接起来。我们假设在节点上不吻合的三个主要维管束保持了对节点以上茎的水供应。事实上,连接到节点的叶子的任何损伤都可能导致栓塞,从而完全中断节点中的水运输,从而中断主茎的上部。总的来说,这种维管网络类似于水稻中描述的组织[gydF4y2Ba45gydF4y2Ba].我们的数据表明BdERECTA控制着节间维管束的正确模式。最近,KNOTTED1-like homeobox (KNOX)转录因子BLH12和BLH14被提出用于预防玉米幼茎前维管束早熟吻合[gydF4y2Ba6gydF4y2Ba].的gydF4y2Bablh12/14gydF4y2Ba双突变体表现出株高的降低gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba但静脉也更少,这是一种没有在gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba.在拟南芥中,一类KNOTTED1-like homeobox (KNOX)转录因子BREVIPEDICELLUS是一种控制维管形成层活性的成分,有趣的是,数据表明,木质部发育的调控是通过gydF4y2BaERECTAgydF4y2Ba,gydF4y2BaERECTA-like1gydF4y2BaSOBIR1/EVR依赖于短花梗[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].拟南芥gydF4y2BaERECTAgydF4y2Ba,gydF4y2BaERECTA-like1gydF4y2BaSOBIR1/EVR还能防止纤维分化过程的过早启动,从而增强木质化(纤维分化过程中的一个关键现象)gydF4y2BaBdERECTAgydF4y2Ba功能丧失gydF4y2Bavasc1gydF4y2Ba突变体。事实并非如此。相反,干燥成熟gydF4y2Bavasc1gydF4y2Ba突变体多糖和木质素含量较低。虽然在本研究中不可能确定BdERECTA直接控制细胞壁含量和组成,但脉管系统的扰动可能部分解释了这些变化。我们没有注意到束间纤维形状的严重表型gydF4y2Bavasc1gydF4y2Ba茎并不比WT更倾向于弯曲,这是在细胞壁缺乏的情况下预期的现象。然而,我们不能排除与WT相比,这两个突变体的尺寸减小(节间伸长受损)可能是由细胞壁缺陷引起的。有趣的是,木质素含量较低gydF4y2Bavasc1gydF4y2Ba突变体是符合最近观察到的高粱过表达gydF4y2BaERECTAgydF4y2Ba的基因,gydF4y2BaSbER2-1gydF4y2Ba玉米在中等和重度干旱胁迫下诱导木质素含量升高[gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
我们的微阵列分析表明韧皮部功能受到影响gydF4y2Bavasc1-1gydF4y2Ba因为拟南芥甜7和甜11同源物以及PP2蛋白的转录本过表达。后者属于在筛元和伴生细胞的功能和完整性中起重要作用的基因家族[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].突变体中畸形筛元的存在明确表明韧皮部元素分化受BdERECTA控制。木质部的发育也缺乏一种功能gydF4y2BaBdERECTAgydF4y2Ba等位基因。在VBs内部,木质部组织是紊乱的,BdERECTA在木质部分化和增殖中的作用通过下调管状元件分化相关的同源谱7 (gydF4y2BaTED7gydF4y2Ba,gydF4y2BaAt5g48920gydF4y2Ba).事实上,在拟南芥中,可诱导的TED7 RNAi系显示出异常的导管元件(在后叶质部中不连续或有间隙的血管)和不寻常的次级细胞壁[gydF4y2Ba43gydF4y2Ba].两种突变体的两血管表型的复发表明木质部的增殖以韧皮部组织为代价,然而在“正常”的侧枝VBs中,我们发现一些侧枝VBs的韧皮部面积更大gydF4y2Bavasc1-2gydF4y2Ba突变体(此差异不显著gydF4y2Bavasc1-1gydF4y2Ba).而我们不能描述组织特异性表达gydF4y2BaBdERECTAgydF4y2Ba在VB内部,我们的LCM数据表明gydF4y2BaBdERECTAgydF4y2Ba在VB和茎尖薄壁组织中表达相似。考虑到拟南芥gydF4y2Ba呃gydF4y2Ba在拟南芥茎的韧皮部和木质部组织中检测到表达[gydF4y2Ba51gydF4y2Ba木质部和韧皮部组织都受到了影响gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2,gydF4y2Ba短柄芥和拟南芥很可能存在类似的调控机制。然而,我们的数据表明gydF4y2BaBdEPFL1gydF4y2BaBdERECTA的一个假定配体,在茎尖薄壁组织中比在发育中的VB中更丰富。正如之前在拟南芥内胚层中观察到的ERL1,这一结果对假定的位于实质的配体在维管束个体发育中的模式和组织作用提出了质疑。有趣的是,(gydF4y2Ba39gydF4y2Ba)建议gydF4y2BaRAE2gydF4y2Ba在水稻中,EPFL1的同源基因可能促进芒长所必需的脉管细胞的增殖,[gydF4y2Ba51gydF4y2Ba]用于AtEPFL4和AtEPFL6。因此,蛋白的高表达水平gydF4y2BaBdEPFL1gydF4y2Ba在短柄藻茎部顶端薄壁中可以说明其在VB模式中的假定作用。最后,事实是gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba反之,BdERECTA是VB数的负调节因子。另一种假设是,在缺乏BdERECTA的情况下,BdERECTA样1促进了VB的丰度。gydF4y2Ba
我们的研究结果显示,在gydF4y2Bavasc1-1gydF4y2Ba.在单子叶植物中,细胞分裂和伸长发生在节间基部,成熟组织位于节间顶部,因此在节间发现生长素梯度并不奇怪。生长素转运素在短柄藻中的作用最近得到了研究。gydF4y2Ba37gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].有趣的是gydF4y2BaBdaux1gydF4y2Ba显示出较短的茎和不育gydF4y2Bavasc1-1gydF4y2Ba.生长素信号通路在拟南芥中被改变gydF4y2BaerectagydF4y2Ba突变体(gydF4y2Ba22gydF4y2Ba],结果表明,在短柄藻中,BdERECTA对茎部生长素含量有影响。这一结果与之前的数据一致,表明gydF4y2Ba呃erl1 erl2gydF4y2Ba三突变体含有低水平的生长素[gydF4y2Ba22gydF4y2Ba],提高外源或内源生长素水平可部分挽救小鼠的细胞伸长缺陷gydF4y2Ba呃erl1 erl2gydF4y2Ba三突变体。然而,有趣的是,生长素的含量受到影响gydF4y2Bavasc1gydF4y2Ba与较低的节间相比,花梗的大小没有变化。拟南芥ERECTA家族基因全部缺失导致花发育异常和胚珠分化异常[gydF4y2Ba23gydF4y2Ba].这些缺陷被认为是细胞增殖严重减少的结果。我们的研究结果表明,破坏gydF4y2BaBdERECTAgydF4y2Ba基因仅足以引起与拟南芥相似的表型gydF4y2BaerectagydF4y2Ba三突变体,因此,尽管存在短柄藻的基因冗余较少gydF4y2BaBdERECTA-like 1gydF4y2Ba他的角色还有待发现。草类中ERECTA与细胞分裂素的相互作用尚不清楚[gydF4y2Ba53gydF4y2Ba].表明细胞分裂素负向调节原生木质部分化,而AHP6抵消细胞分裂素信号,允许拟南芥原生木质部的形成。这可以部分解释为什么特定的韧皮部基因如PP2和韧皮部蔗糖转运蛋白在ERECTA中过表达,以及为什么与韧皮部组织相反,原生木质部和转木质部在ERECTA中丰富gydF4y2Bavasc1gydF4y2Ba突变体。此外,(gydF4y2Ba54gydF4y2Ba表明,细胞分裂素信号通路指定了影响杨树形成层生长素梯度幅度的分生组织活动。我们的研究表明,尽管该物种不存在形成层,但在短柄草茎VB中,激素串声协调了维管组织的组织。事实上,我们的工作表明,BdERECTA活性的丧失会增加茎中的细胞分裂素含量。最近的研究表明,细胞分裂素信号在调控水稻生长发育中起着至关重要的作用[gydF4y2Ba55gydF4y2Ba]和最近[gydF4y2Ba25gydF4y2Ba]报道了ERECTA1 (OsER1)在不影响产量的情况下是每穗小穗数的负调节因子,作用于OsMKKK10-OsMKK4-OsMPK6级联的上游[gydF4y2Ba25gydF4y2Ba].一些证据表明乙烯和BdERECTA之间的相互作用在调节血管发育中起作用。乙烯信号在gydF4y2Ba热带病研究和培训特别规划gydF4y2Ba突变体(gydF4y2Ba56gydF4y2Ba]并且已知TDR和ERECTA通路都有助于原形成层细胞的维持[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba57gydF4y2Ba].我们的数据还显示了EFE基因的上调,我们发现该基因在VBs中有差异表达。总的来说,ERECTA蛋白除了部分控制茎部韧皮部-木质部模式外,还影响草茎中生长素和细胞分裂素之间的平衡(至少在短柄草和水稻中)。gydF4y2Ba
结论gydF4y2Ba
BdERECTAgydF4y2Ba属于LRR受体样丝氨酸/苏氨酸蛋白激酶家族,已被证明可以调节多种发育过程。在水稻中,ERECTA对穗的形成有主要影响,但在水稻中未见血管系统缺陷的报道gydF4y2BaOser1gydF4y2Ba据我们所知。我们的研究清楚地证明了这一点gydF4y2BaBdERECTAgydF4y2Ba在短柄藻中具有多效性。突变干扰gydF4y2BaBdERECTAgydF4y2Ba功能导致主茎内维管束形态的紊乱。更引人注目的是,这些突变改变了一些维管束的内部组织,导致维管束元素的两维管组织,这种组织通常只存在于第一个节间。然而,突变体中只有部分VBs(不是全部)表现为两胚层表型。虽然我们不知道VB形态之间的转换是如何被控制的,但这种开关可能是由激素平衡调节的,特别是生长素/细胞分裂素平衡,在体内明显改变gydF4y2Bavasc1-1gydF4y2BaBdERECTA的EPF/ epfl样配体目前还不清楚,他们的研究可能部分解释了为什么和如何在草中被ERECTA控制VB组织。gydF4y2Ba
材料与方法gydF4y2Ba
植物材料gydF4y2Ba
Brachypodium种子(登记号Bd21-3) [gydF4y2Ba58gydF4y2Ba]),从种子萌发到脱水(约70 DAG),每周用水或营养液(Plant Prod. NPK 15- 15- 30,1 g/l)浇灌两次。植株在21/18°C光照18小时/暗6小时的循环条件下生长。光强是130我。mgydF4y2Ba−1gydF4y2Ba.s−1gydF4y2Ba.为了对小穗下的VBs进行量化,从小穗下的第一个新出节间到最后一个节间(在本文中也称为花序梗)进行节点编号。为了进行生长量化,当植物开花时,从第一个节的基部到最近的叶子或小穗的顶部进行测量。gydF4y2Ba
激素含量分析gydF4y2Ba
化学分析用纯合子和杂合子的幼花、顶叶、花梗和花梗以下的第一节间(顶部和基部)gydF4y2Bavasc1-1gydF4y2Ba和WT均采自开花植物(42 DAG,茎完全拉长)。gydF4y2Ba
每个样品用0.8 mL丙酮/水/乙酸(80/19/1 v:v:v)提取1mg干粉。脱落酸、水杨酸、茉莉酸、吲哚-3-乙酸和细胞分裂素稳定标记同位素用作内标,制备方法如[gydF4y2Ba59gydF4y2Ba].每种标准品各加1克到样品中。将提取物大力摇晃1分钟,在25 Hz下超声1分钟,在10°C的温度计(Eppendorf®)中摇晃10分钟,然后离心(8000 g, 10°C, 10分钟)。收集上清液,用0.4 mL相同的提取液重新提取两次,然后大力摇振(1 min)和超声(1 min;25 Hz)。离心后,将三种上清液混合并干燥(最终体积1.6 mL)。gydF4y2Ba
每个干提取物溶于100 μL乙腈/水(50/50 v/v)中,过滤后使用Waters Acquity超高效液相色谱耦合Waters Xevo三重四极杆质谱TQS (UPLC-ESI-MS/MS)分析。化合物在反相色谱柱(Uptisphere C18 UP3HDO, 100*2.1 mm*3 μm;Interchim,法国)使用0.4 mL / min的流速gydF4y2Ba−1gydF4y2Ba二元梯度:(a)乙酸0.1%水溶液(v/v)和(B)乙腈0.1%乙酸,柱温为40℃。对于脱落酸、水杨酸、茉莉酸和吲哚-3-乙酸,我们使用以下二元梯度(时间,% A):(0 min。, 98%),(3分钟。,70%), (7.5 min., 50%), (8.5 min., 5%), (9.6 min., 0%), (13.2 min., 98%), (15.7 min., 98%), and for cytokinins (time, % A): (0 min., 95%), (13 min., 40%), (16 min., 0%), (16.5 min., 95%), Mass spectrometry was conducted in electrospray and Multiple Reaction Monitoring scanning mode (MRM mode), in positive ion mode for the indole-3-acetic acid and in negative ion mode for the other hormones. Relevant instrumental parameters were set as follows: capillary 1.5 kV (negative mode), source block and desolvation gas temperatures 130 °C and 500 °C, respectively. Nitrogen was used to assist the cone and desolvation (150 L h−1gydF4y2Ba和800 L hgydF4y2Ba−1gydF4y2Ba,分别为),氩气为碰撞气体,流量为0.18 mL mingydF4y2Ba−1gydF4y2Ba详见[gydF4y2Ba59gydF4y2Ba].gydF4y2Ba
沿茎研究维管组织的样品制备gydF4y2Ba
为了对整株植物的维管束网络进行研究,将45-50株DAG植株的主茎收获,并在1 x磷酸盐缓冲盐水(PBS, Eurobio),缓冲-0,1% tritonX100 (Bioprobe)中,4%多聚甲醛(Sigma-Aldrich)中,在真空条件下冰下固定2小时。样品在固定液中4°C O/N孵育,然后在PBS中洗涤,4°C保存直到使用。采用法国MicroMicrotech公司的hm650v振动仪进行30 μm切片。为了三维重建节点,将第5个节点(包括WT主茎的上下节间)的3cm按上述方法固定,然后在10%,20%蔗糖各孵育1小时,30%蔗糖在4℃过夜。除去多余的蔗糖后,将样品置入低温包埋介质(NEG-50TM, Thermo scientific)中,用液氮冷冻。组织切割在−16°C进行(CryostarTM NX70, Thermo scientific), 100 μm切片放在superfrost载玻片上(Thermo scientific),并在−20°C保存或安装在citifluor AF1(琼脂scientific)中进行共聚焦成像。gydF4y2Ba
共聚焦成像和扫描电子显微镜gydF4y2Ba
使用蔡司710共聚焦显微镜,405nm二极管,Plan APOCHROMAT X25油浸物镜(NA 0.8, WD 0.57 μm)拍摄图像。获得了XY平面体素分辨率为0.24 μm, z轴体素分辨率为4或8 μm的三维堆栈图像。利用紫外灯(405二极管)显示细胞壁自身荧光。扫描电镜取花梗以下节间顶部30 μm截面。这些植物横截面使用环境扫描电子显微镜(ESEM, Quattro S, Thermo Scientific, US)进行分析。图像是在试样没有任何溅射涂层的环境条件下(10°C, 1000 Pa,导致湿度约84%RH)获得的。采用了10千伏的加速电压。gydF4y2Ba
维管束网络的三维重建gydF4y2Ba
将连续切片的共焦图像加载到FreeD软件中,至少每100 μm手动分割维管束,总长度3.6 mm。使用与FreeD软件相关的工具Sdfexport和sviewer对维管束网络进行三维重建并可视化。gydF4y2Ba
激光捕获显微解剖和RNA提取gydF4y2Ba
植株在18/21°C光照18小时/暗6小时的循环条件下生长。采集20株DAG植株(开花前)主茎顶节(1厘米),将其埋植于低温埋植培养基(NEG-50TM,Thermo scientific)中,然后用液氮冷冻。gydF4y2Ba
样品在- 20°C下使用冷冻切片机(CryostarTM NX70, Thermo scientific)以30 μm厚度进行切片,并在无rnase条件下安装在聚萘二甲酸乙二醇酯(PEN)膜载玻片(Zeiss)上。gydF4y2Ba
使用PALM MicroBeam系统(蔡司)进行激光捕获显微解剖。从连续切片中,每个维管束组织被独立地微解剖,以尽量减少相邻细胞和组织类型的污染。为每个发育阶段和组织类型捕获三个生物重复。每个生物复制由从一到三株植物(从10到20个微解剖元件)捕获的组织组成。所有组织在10分钟内被收集到带胶粘剂帽(蔡司)的管中,以最大限度地提高RNA质量。收集微解剖元件,并直接培养到RNA提取缓冲液中。提取总RNA (PicoPure®RNA分离试剂盒;在RNA纯化柱上用无rnase的DNase(在RDD缓冲液中1:8稀释DNase I;试剂盒)。采用微毛细管电泳检测RNA数量和质量(RNA 6000 Pico Chip, Agilent 2100 BioAnalyzer; Agilent Technologies). RNA Integrity Numbers (RIN) obtained were around 7.1.
RNA-SeqgydF4y2Ba
cDNA合成使用smart超低输入RNA试剂盒进行测序-v4 (Takara Bio,美国加州),文库根据DNA样品制备Illumina试剂盒说明书制备,每个样品有不同的条形码(Illumina,美国加州)。样本使用Illumina测序仪测序,从260 bp大小的选定文库中获得100 bp的配对端链reads。每个样品产生了大约2800万个成对端链读数。gydF4y2Ba
RNA-seq生物信息学处理和分析gydF4y2Ba
RNA-Seq预处理包括修剪库适配器和执行质量控制。原始数据(fastq)用Trimmomatic [gydF4y2Ba60gydF4y2Ba]工具用于Phred质量评分Qscore > 20,读取长度> 30个碱基,核糖体序列用工具sortMeRNA去除[gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
绘图器领结版本2 [gydF4y2Ba62gydF4y2Ba]用于根据短柄藻转录组(使用本地选项和其他默认参数)对reads进行比对。每个34,310个基因的丰度是通过一个本地脚本计算出来的,该脚本只使用成对的末端读取来解析SAM文件,两个末端读取都明确地映射到一个基因。根据这些规则,大约73%的配对端搁浅读被计算在内。差异表达式分析遵循[gydF4y2Ba63gydF4y2Ba].简单地说,在至少一半的样本中,经过百万次计数(CPM)归一化后,小于1个reads的基因被丢弃。库大小采用m值修剪均值(TMM)方法归一化,计数分布采用负二项广义线性模型。离散度由edgeR方法估计(Version 1.12.0, [gydF4y2Ba64gydF4y2Ba])的统计软件“R”(版本3.2.5 R开发核心团队(2005))。用似然比检验比较3个样本的表达差异gydF4y2BapgydF4y2Ba-值通过Benjamini-Hochberg程序进行调整,以控制错误发现率(FDR)。如果一个基因被调整,则被宣布为差异表达gydF4y2BapgydF4y2Ba-value < 0.05。gydF4y2Ba
微阵列分析gydF4y2Ba
原杂合子v .的4个杂合子下行系的后代gydF4y2Baasc1-1gydF4y2Ba在生长室中播种,在相同的条件下生长(每株6 ~ 10株)。所有的植物都进行了基因分型,将个体分为两组(根据感兴趣的位点,杂合或纯合)。产生了4个独立的生物重复。在微阵列实验中,基因分型纯合和杂合植株在20 DAG(营养期)收获整株(不含根)。叶子被切除以保留主茎和叶鞘,因此被冷冻在液氮中。RNA用QIAGEN公司的RNAeasy试剂盒提取,按照QIAGEN公司的建议用RNase-free DNase纯化。RNA质量控制和微阵列分析由巴黎萨克雷植物科学研究所(IPS2, Gif sur Yvette,法国)通过该研究所的POPS平台进行,如[gydF4y2Ba65gydF4y2Ba,并作如下修改。我们采用了基于AGILENT技术的4plex_Brachypodium阵列(AMADID 066852)。单个高密度4plex_短肢微阵列载玻片包含总共127,258个特征,分布在四个腔室中。每个室包含31651个引物和654个对照。gydF4y2Ba
微阵列数据的统计分析gydF4y2Ba
实验由IPS2的基因组网络团队设计。对于每个阵列,原始数据包括波长635 nm(红色)和532 nm(绿色)的中位数特征像素强度的对数。对于每个阵列,使用黄土程序进行全局强度相关归一化[gydF4y2Ba66gydF4y2Ba],以纠正染料偏置。差异分析基于重复探针和技术重复的平均对数比。因此,每个基因的可用数据数量等于生物复制的数量,并用于计算调节t检验[gydF4y2Ba67gydF4y2Ba].gydF4y2Ba
在原假设下,Limma没有突出显示探针之间特定方差变化的证据,因此假设调节后的t统计量遵循标准正态分布。控制错误发现率,调整gydF4y2BapgydF4y2Ba-使用优化的FDR方法[找到的值gydF4y2Ba68gydF4y2Ba都是经过计算的。我们将调整后的p值≤0.05的探针视为差异表达。采用R软件进行分析。通过计算经验贝叶斯后验均值,利用库边界的SqueezeVar函数平滑特定方差。使用kerfdr库来计算调整后的p值。gydF4y2Ba
DNA测序和变异呼叫gydF4y2Ba
DNA被随机剪切成约250 bp的片段,然后用于创建Illumina片段库。在联合基因组研究所的Illumina HiSeq2500上进行配对端部2 × 100测序。Illumina reads, ~ 30倍覆盖率,对准Bd21-3 v1.1参考基因组(gydF4y2Bahttps://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_BdistachyonBd21_3_ergydF4y2Ba)与BWA (v0.7.17) 78,过滤与Picard工具(v2.18) FixMateInformation和markduplicate (gydF4y2Bahttps://broadinstitute.github.io/picardgydF4y2Ba),然后使用GATK (v4.0) 79进行基础质量评分重新校准,并使用GATK最佳实践建议中的标准硬过滤参数发现SNV [gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba].gydF4y2Ba
种系发生分析gydF4y2Ba
邻居连接系统发生树由来自短叶藻的亮氨酸-富受体激酶蛋白组成,gydF4y2Ba水稻,狗尾草,玉米和拟南芥gydF4y2Ba与拟南芥ERECTA有超过35%的同源性。节点值为引导值(%)。图例显示每kb的替换数。分析是在gydF4y2BaPhylogeny.frgydF4y2Ba平台(gydF4y2Ba71gydF4y2Ba].序列与MUSCLE (v3.8.31)进行对齐,配置为最高精度(默认设置为MUSCLE),并使用Gblocks进行策划,以删除不明确的区域。利用PhyML程序(v3.1/3.0 aLRT)中实现的最大似然方法重建最终的系统发育树。树表示使用TreeDyn (v198.3)。gydF4y2Ba
rt - pcr分析gydF4y2Ba
按照Biobasic(加拿大)的指导方针,使用EZ-10 Spin柱Plant RNA Miniprep Kit从WT和突变体完全伸长茎(45 DAG)中提取总RNA。40 μl用DNAse1 (New England Biolabs, USA)处理1 h,然后用Qiagen(德国)公司的RNeasy Clean Up试剂盒纯化RNA,最后用15 μl洗脱。RNA浓度由BioTek(美国)Epoch分光光度计测定。用转录子第一链cDNA合成试剂盒(Roche, Switzerland)和锚定寡核苷酸d(T)从500 ng RNA中合成cDNA。使用前将cdna稀释1/10。对1 μl cDNA进行半定量PCR。转录cdna按照制造商说明用Q5热启动高保真DNA聚合酶(New England Biolabs, USA)扩增。我们使用相同的熔化杂交(60°C)和延伸时间(10秒),根据感兴趣的基因进行25到30个循环。用以下引物扩增感兴趣基因:gydF4y2BaERECTA-1gydF4y2Ba/ brad1g46450fw: ATGGCGACGACGGCGGCGGCGTCCG, brad1g46450 rev: CAATCTCATCAGGGATCTGGCCGGTAAGCCC;宅养基因(Bradi5g14640) /SamDCfw: CGGCAAGCTTGCTAATCTGCTCCAAT和SamDCrev: CAGAGCAACAATAGCCTGGCTGGC。gydF4y2Ba
细胞壁中性糖分析及木质素含量gydF4y2Ba
用1 M H水解醇不溶性残基后,监测细胞壁多糖的中糖组成gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba在100°C下放置2小时。在72% H的条件下进行预水解gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba在25°C下放置30分钟,从纤维素中释放葡萄糖。每种糖在衍生化后定量为乙酰糖糖醇,气相色谱分析按[gydF4y2Ba72gydF4y2Ba].采用AcBr法定量木质素含量,详见[gydF4y2Ba73gydF4y2Ba].gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本文中使用的所有数据和材料均由作者提供。gydF4y2Ba
本文中的微阵列数据保存在国际存储库GEO, Gene Expression Omnibus ([gydF4y2Ba74gydF4y2Ba),gydF4y2Bahttps://www.ncbi.nlm.nih.gov/geo/gydF4y2Ba),登记号码为GSE139323。实验的所有步骤,从生长条件到生物信息和统计分析,都在CATdb数据库中详细描述([gydF4y2Ba49gydF4y2Ba),gydF4y2Bahttps://tools.ips2.u-psud.fr/CATdb/gydF4y2Ba;项目:4 plex_Brachy_2016_01),根据“关于微阵列实验的最小信息”标准。gydF4y2Ba
RNAseq实验的所有步骤,从生长条件到生物信息学分析,也在CATdb数据库中进行管理([gydF4y2Ba49gydF4y2Ba]gydF4y2Bahttps://tools.ips2.u-psud.fr/CATdb/gydF4y2Ba)项目编号为ANR-JC-BRAVO。本项目由CATdb提交至国际基因库GEO (Gene Expression Omnibus, [gydF4y2Ba74gydF4y2Ba),gydF4y2Bahttps://www.ncbi.nlm.nih.gov/geogydF4y2Ba)使用ProjetID = GSE162395。gydF4y2Ba
缩写gydF4y2Ba
- 英国石油公司:gydF4y2Ba
-
碱基对gydF4y2Ba
- CPM:gydF4y2Ba
-
每百万计数gydF4y2Ba
- DAG:gydF4y2Ba
-
发芽后的日子gydF4y2Ba
- 整体:gydF4y2Ba
-
环境扫描电子显微镜gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- 中国大陆:gydF4y2Ba
-
激光捕获显微解剖gydF4y2Ba
- LRR-RLK:gydF4y2Ba
-
富亮氨酸重复受体样激酶gydF4y2Ba
- RIN:gydF4y2Ba
-
RNA完整性编号gydF4y2Ba
- TMM:gydF4y2Ba
-
m值的修剪平均值gydF4y2Ba
- VB:gydF4y2Ba
-
维管束gydF4y2Ba
- WT:gydF4y2Ba
-
野生植物gydF4y2Ba
- 3 d:gydF4y2Ba
-
3个维度gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Lucas WJ, Groover A, Lichtenberger R, Furuta K, Yadav SR, Helariutta Y,等。植物维管系统:演化、发育与功能。中国生物工程学报,2013;29(4):344 - 344。gydF4y2Bahttps://doi.org/10.1111/jipb.12041gydF4y2Ba.gydF4y2Ba
- 2.gydF4y2Ba
杨晓燕,王晓燕,王晓燕。植物维管束发育的遗传网络研究。中国农业科学。2017;51(1):335-59。gydF4y2Bahttps://doi.org/10.1146/annurev-genet-120116-024525gydF4y2Ba.gydF4y2Ba
- 3.gydF4y2Ba
傅志强,李志强,李志强,等。植物维管组织发育的研究进展。Curr Top Dev biology 2019; 131:141-60。gydF4y2Bahttps://doi.org/10.1016/bs.ctdb.2018.10.005gydF4y2Ba.gydF4y2Ba
- 4.gydF4y2Ba
玉米维管束的个体发育。Hilgardia。1943;15:327 - 68。gydF4y2Ba
- 5.gydF4y2Ba
玉米茎的维管系统:水分运输和木质部安全的意义。学报学报,2000;86(2):245-58。gydF4y2Bahttps://doi.org/10.1006/anbo.2000.1171gydF4y2Ba.gydF4y2Ba
- 6.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。KNOTTED1辅助因子BLH12和BLH14调控玉米节间模式和静脉吻合。植物学报。2017;29(5):1105-18。gydF4y2Bahttps://doi.org/10.1105/tpc.16.00967gydF4y2Ba.gydF4y2Ba
- 7.gydF4y2Ba
黄志刚,李志刚,李志刚。生长素转运对叶片维管形态的调控。基因开发,2006;20(8):1015-27。gydF4y2Bahttps://doi.org/10.1101/gad.1402406gydF4y2Ba.gydF4y2Ba
- 8.gydF4y2Ba
Shi D,等。双面形成层干细胞在植物径向生长过程中产生木质部和韧皮部。发展。2019;146(1)。gydF4y2Ba
- 9.gydF4y2Ba
李志刚,李志刚,李志刚。单子叶植物木质形成基因的缺失。中国生物医学工程学报,2019;11(7):1986-96。gydF4y2Bahttps://doi.org/10.1093/gbe/evz115gydF4y2Ba.gydF4y2Ba
- 10.gydF4y2Ba
O'Connor DL, Runions A, Sluis A, Bragg J, Vogel JP, Prusinkiewicz P,等。在草的器官形成过程中pin介导的生长素模式的分裂。计算机科学进展。2014;10(1):e1003447。gydF4y2Bahttps://doi.org/10.1371/journal.pcbi.1003447gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
Yasui Y, Ohmori Y, takbayashi Y, Sakakibara H, Hirano HY.水稻叶片早期发育中与wuschell相关的HOMEOBOX4的关键调控因子。PLoS Genet, 2018;14(4):e1007365。gydF4y2Bahttps://doi.org/10.1371/journal.pgen.1007365gydF4y2Ba.gydF4y2Ba
- 12.gydF4y2Ba
Kuijt SJ,等。水稻KNOX 1类同源结构域蛋白的不同亚细胞定位和运输特性。植物分子生物学杂志,2004;55(6):781-96。gydF4y2Bahttps://doi.org/10.1007/s11103-005-1967-ygydF4y2Ba.gydF4y2Ba
- 13.gydF4y2Ba
植物维管束形态的形成。中国生物医学工程学报,2010;gydF4y2Bahttps://doi.org/10.1016/s0070 - 2153 (10) 91008 - 9gydF4y2Ba.gydF4y2Ba
- 14.gydF4y2Ba
斯卡佩拉E,鲁伯S,梅杰AH。RADICLELESS1基因是水稻维管形态形成所必需的。发展。2003;130(4):645 - 58。gydF4y2Bahttps://doi.org/10.1242/dev.00243gydF4y2Ba.gydF4y2Ba
- 15.gydF4y2Ba
Sakaguchi J, Itoh JI, Ito Y, Nakamura A, Fukuda H, Sawa S. COE1,一个负责水稻合脉图案形成的LRR-RLK。植物学报,2010;36(3):344 - 344。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2010.04250.xgydF4y2Ba.gydF4y2Ba
- 16.gydF4y2Ba
IBI。模式草短柄草(Brachypodium diachyon)基因组测序与分析。大自然。2010;463(7282):763 - 8。gydF4y2Bahttps://doi.org/10.1038/nature08747gydF4y2Ba.gydF4y2Ba
- 17.gydF4y2Ba
吉林T, David LC, Chardin C, Sibout R, Krapp A, Ferrario-Méry S,等。短柄草:模式物种和谷物之间有希望的枢纽。中国科学(d辑),2014;26(4):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/eru376gydF4y2Ba.gydF4y2Ba
- 18.gydF4y2Ba
Coomey, j.h., R. Sibout, S.P. Hazen,草次生细胞壁gydF4y2Ba,短柄藻gydF4y2Ba作为发现的模型gydF4y2Ba.gydF4y2BaNew Phytol, 2020年。gydF4y2Ba
- 19.gydF4y2Ba
马涛,李志刚,李志刚。短柄藻茎节间的细胞壁和发育解剖学研究。公共科学学报,2013;8(11):e80640。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0080640gydF4y2Ba.gydF4y2Ba
- 20.gydF4y2Ba
Smertenko, T.等,短叶藻二穗子MAP20在大叶松坑发育中起作用,并有助于干旱恢复gydF4y2Ba.gydF4y2BaNew Phytol, 2019。gydF4y2Ba
- 21.gydF4y2Ba
蔡华,柴敏,陈峰,黄勇,张敏,何强,等。HBI1在ERECTA和SWR1的下游作用,通过激活油菜素类固醇和生长素信号通路调节花序结构。中国植物学报,2018;29(1):414-28。gydF4y2Bahttps://doi.org/10.1111/nph.16840gydF4y2Ba.gydF4y2Ba
- 22.gydF4y2Ba
曲霞,赵志,田志。拟南芥ERECTA通过激活生长素生物合成调控细胞伸长。植物科学进展,2017;gydF4y2Bahttps://doi.org/10.3389/fpls.2017.01688gydF4y2Ba.gydF4y2Ba
- 23.gydF4y2Ba
Shpak ED, Berthiaume CT, Hill EJ, Torii KU。三种erecta家族受体样激酶的协同作用通过促进细胞增殖控制拟南芥器官生长和花朵发育。发展。2004;131(7):1491 - 501。gydF4y2Bahttps://doi.org/10.1242/dev.01028gydF4y2Ba.gydF4y2Ba
- 24.gydF4y2Ba
沈华,钟霞,赵峰,王勇,闫波,李强,等。过表达受体样激酶ERECTA可提高水稻和番茄的耐热性。中国生物工程学报。2015;33(9):996-1003。gydF4y2Bahttps://doi.org/10.1038/nbt.3321gydF4y2Ba.gydF4y2Ba
- 25.gydF4y2Ba
郭涛,卢志强,单建新,叶文文,董nq,林海霞。ERECTA1位于OsMKKK10-OsMKK4-OsMPK6级联的上游,通过调控水稻细胞分裂素代谢来控制小穗数量。植物科学进展。2020;32(9):2763-79。gydF4y2Bahttps://doi.org/10.1105/tpc.20.00351gydF4y2Ba.gydF4y2Ba
- 26.gydF4y2Ba
杨晓明,杨晓明,杨晓明,等。叶形与维管形态的关系。植物学报,2001;4(1):50-6。gydF4y2Bahttps://doi.org/10.1016/s1369 - 5266 (00) 00135 - 7gydF4y2Ba.gydF4y2Ba
- 27.gydF4y2Ba
张志刚,张志刚。水稻(Oryza sativa)和玉米(Zea mays)纵静脉的细胞分化和合静脉的形成。中国植物学报,2008;26(6):553 - 553。gydF4y2Bahttps://doi.org/10.1007/s10265-008-0189-1gydF4y2Ba.gydF4y2Ba
- 28.gydF4y2Ba
Dalmais M, Antelme S, ho - yue kuang S, Wang Y, Darracq O, d 'Yvoire MB,等。短柄藻功能基因组学的TILLING平台。公共科学学报,2013;8(6):e65503。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0065503gydF4y2Ba.gydF4y2Ba
- 29.gydF4y2Ba
Bouvier d'Yvoire M, bouchabk - coussa O, Voorend W, Antelme S, Cézard L, Legée F,等。破坏肉桂醇脱氢酶1基因(BdCAD1)会改变短柄藻的木质化和改善糖化。植物学报,2013;29(3):344 - 344。gydF4y2Bahttps://doi.org/10.1111/tpj.12053gydF4y2Ba.gydF4y2Ba
- 30.gydF4y2Ba
Le Bris P,等。LACCASE8和LACCASE5基因失活导致木质素含量严重下降,糖化产量大幅增加,且不影响植株完整性。生物技术生物燃料,2019;12(1):181。gydF4y2Bahttps://doi.org/10.1186/s13068-019-1525-5gydF4y2Ba.gydF4y2Ba
- 31.gydF4y2Ba
Ikematsu S, Tasaka M, Torii KU, Uchida N. erecta家族受体激酶基因冗余防止拟南芥下胚轴二次生长过早进展。中国生物医学工程学报,2017;29(4):379 - 379。gydF4y2Bahttps://doi.org/10.1111/nph.14335gydF4y2Ba.gydF4y2Ba
- 32.gydF4y2Ba
内田,李志强,李志强,等。植物维管干细胞内胚层来源的epfl家族肽激素和韧皮部表达的erecta家族受体激酶的调控。中国机械工程学报,2013;26(4):539 - 539。gydF4y2Bahttps://doi.org/10.1093/jxb/ert196gydF4y2Ba.gydF4y2Ba
- 33.gydF4y2Ba
夏文敏,李文杰,李志强,等。短柄草T-DNA序列的测序和功能验证。植物学报,2017;29(3):369 - 369。gydF4y2Bahttps://doi.org/10.1111/tpj.13582gydF4y2Ba.gydF4y2Ba
- 34.gydF4y2Ba
史密特·梅,高夫·C, Bågman AM,索雅斯·CL,等。pxy介导的转录网络整合信号机制控制拟南芥维管发育。植物科学进展。2020;32(2):319-35。gydF4y2Bahttps://doi.org/10.1105/tpc.19.00562gydF4y2Ba.gydF4y2Ba
- 35.gydF4y2Ba
王宁,等。在拟南芥维管组织中,PXY和ER受体激酶的副核苷酸之间的器官特异性遗传相互作用加强了径向模式。发展。2019;146:10。gydF4y2Ba
- 36.gydF4y2Ba
Valdivia ER, Herrera MT, Gianzo C, Fidalgo J, Revilla G, Zarra I,等。NAC转录因子对短柄草单子叶次生壁合成和细胞死亡的调控。中国机械工程学报,2013;32(5):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/ers394gydF4y2Ba.gydF4y2Ba
- 37.gydF4y2Ba
O'Connor DL, Elton S, Ticchiarelli F, Hsia MM, Vogel JP, Leyser O. PIN生长素外排蛋白家族的跨物种功能多样性。eLife。2017; 6: e31804。gydF4y2Bahttps://doi.org/10.7554/eLife.31804gydF4y2Ba.gydF4y2Ba
- 38.gydF4y2Ba
Tameshige T, Ikematsu S, Torii KU, Uchida N.通过维管组织的茎发育:EPFL-ERECTA家族信号在韧皮部内外反弹。中国生物医学工程学报,2016;36(1):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/erw447gydF4y2Ba.gydF4y2Ba
- 39.gydF4y2Ba
王晓燕,王晓燕,王晓燕,王晓燕,等。RAE2是一种以前未被识别的EPFL,其功能的丧失是栽培亚洲水稻无芒所必需的。中国科学:自然科学(英文版),2016;gydF4y2Bahttps://doi.org/10.1073/pnas.1604849113gydF4y2Ba.gydF4y2Ba
- 40.gydF4y2Ba
张晓东,张志强,张志强,张志强,等。表达图谱和比较共表达网络分析揭示了短柄藻木质化细胞壁形成的重要基因。中国农业科学,2017;29(3):344 - 344。gydF4y2Bahttps://doi.org/10.1111/nph.14635gydF4y2Ba.gydF4y2Ba
- 41.gydF4y2Ba
鸟羽T,原田K,高村A,中村H,市川H, Suzaki T,等。水稻YABBY基因家族的分子特征及OsYABBY1的表达分析。中国生物医学工程学报。2007;27(5):457-68。gydF4y2Bahttps://doi.org/10.1007/s00438-006-0202-0gydF4y2Ba.gydF4y2Ba
- 42.gydF4y2Ba
林志伟,张志伟,张志伟,张志伟,等。植物干细胞CLAVATA1受体激酶信号通路的研究进展。动物学报,2011;21(5):345-52。gydF4y2Bahttps://doi.org/10.1016/j.cub.2011.01.039gydF4y2Ba.gydF4y2Ba
- 43.gydF4y2Ba
远藤S, Pesquet E,山口M,田代G,佐藤M,丰香K,等。在百日菊和拟南芥中鉴定参与导管元件次级细胞壁形成的新成分。植物学报。2009;21(4):1155-65。gydF4y2Bahttps://doi.org/10.1105/tpc.108.059154gydF4y2Ba.gydF4y2Ba
- 44.gydF4y2Ba
Mertz RA, Brutnell TP。草叶的束鞘化:表征的多重障碍。中国生物医学工程学报,2014;26(3):342 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/eru108gydF4y2Ba.gydF4y2Ba
- 45.gydF4y2Ba
Yamaji N, Ma JF。节点,禾本科植物中矿物养分分配的枢纽。植物科学进展,2014;19(9):556-63。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2014.05.007gydF4y2Ba.gydF4y2Ba
- 46.gydF4y2Ba
拟南芥木质部形成过程中ERECTA和ERECTA样基因控制发育转变。中国生物医学工程学报,2017;29(4):344 - 344。gydF4y2Bahttps://doi.org/10.1111/nph.14440gydF4y2Ba.gydF4y2Ba
- 47.gydF4y2Ba
杨晓明,陈晓明,陈晓明,等。SOBIR1/EVR通过BP和ERECTA机制防止木材发育过程中纤维分化的早熟。中国科学(d辑),2019;26(3):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1807863116gydF4y2Ba.gydF4y2Ba
- 48.gydF4y2Ba
李华,等。高粱中富含亮氨酸的重复受体样激酶基因SbER2-1 (gydF4y2Ba高粱双色gydF4y2Ba)使玉米具有耐旱性。BMC基因组学。2019;20(1):737。gydF4y2Ba
- 49.gydF4y2Ba
李文杰,李志强,李志强,等。CATdb:来自URGV-CATMA平台的拟南芥转录组数据的公开访问。核酸决议2008;36(数据库issue): D986-90。gydF4y2Bahttps://doi.org/10.1093/nar/gkm757gydF4y2Ba.gydF4y2Ba
- 50.gydF4y2Ba
李文杰,朱永华,李文杰,等。被子植物韧皮部凝集素超家族(韧皮部蛋白2)的多样性。植物科学进展。2003;31(1):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.013086gydF4y2Ba.gydF4y2Ba
- 51.gydF4y2Ba
内田N,李JS,霍斯特RJ,赖HH, Kajita R, Kakimoto T,等。内皮层和韧皮部之间的组织间层配体-受体通信对花序结构的调节。中国科学:自然科学(英文版),2012;gydF4y2Bahttps://doi.org/10.1073/pnas.1117537109gydF4y2Ba.gydF4y2Ba
- 52.gydF4y2Ba
van der Schuren A, Voiniciuc C, Bragg J, Ljung K, Vogel J, Pauly M,等。短柄藻AUX1的广谱发育作用。中国生物医学工程学报,2018;29(4):344 - 344。gydF4y2Bahttps://doi.org/10.1111/nph.15332gydF4y2Ba.gydF4y2Ba
- 53.gydF4y2Ba
Mahonen AP,等。细胞分裂素信号及其抑制剂AHP6在血管发育过程中调节细胞命运。科学。2006;311(5757):94 - 8。gydF4y2Bahttps://doi.org/10.1126/science.1118875gydF4y2Ba.gydF4y2Ba
- 54.gydF4y2Ba
Immanen J, Nieminen K, Smolander OP, Kojima M, Alonso Serra J, Koskinen P,等。细胞分裂素和生长素表现出不同但相互关联的分布和信号通路,以刺激形成层活动。动物学报,2016;26(15):1990-7。gydF4y2Bahttps://doi.org/10.1016/j.cub.2016.05.053gydF4y2Ba.gydF4y2Ba
- 55.gydF4y2Ba
石峰,王敏,安阳。b型细胞分裂素反应调控因子(OsORR2)的过表达降低水稻株高。植物生态学报。2020;15(8):1780405。gydF4y2Bahttps://doi.org/10.1080/15592324.2020.1780405gydF4y2Ba.gydF4y2Ba
- 56.gydF4y2Ba
Etchells JP, Provost CM, Turner SR.植物维管细胞分裂是通过PXY和乙烯信号的相互作用来维持的。公共科学图书馆,2012;8(11):e1002997。gydF4y2Bahttps://doi.org/10.1371/journal.pgen.1002997gydF4y2Ba.gydF4y2Ba
- 57.gydF4y2Ba
Etchells JP, Provost CM, Mishra L, Turner SR. WOX4和WOX14作用于PXY受体激酶下游,调节植物维管增殖,独立于维管组织中的任何角色。发展。2013;140(10):2224 - 34。gydF4y2Bahttps://doi.org/10.1242/dev.091314gydF4y2Ba.gydF4y2Ba
- 58.gydF4y2Ba
刘志强,李志强,李志强,等。农杆菌介导的短柄藻自交系Bd21-3的高效转化。植物细胞学报,2008;27(3):471-8。gydF4y2Bahttps://doi.org/10.1007/s00299-007-0472-ygydF4y2Ba.gydF4y2Ba
- 59.gydF4y2Ba
Le Roux C,等。hnRNP-Q蛋白LIF2参与植物免疫反应。公共科学图书馆,2014;9(6):e99343。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0099343gydF4y2Ba.gydF4y2Ba
- 60.gydF4y2Ba
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btu170gydF4y2Ba.gydF4y2Ba
- 61.gydF4y2Ba
Kopylova E, Noe L, Touzet H. SortMeRNA:在meta转录组数据中快速准确地过滤核糖体rna。生物信息学,2012,28(24):3211 - 7。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/bts611gydF4y2Ba.gydF4y2Ba
- 62.gydF4y2Ba
Langmead B, Trapnell C, Pop M, Salzberg SL.人类基因组短DNA序列的超快和内存高效对齐。中国生物医学工程学报。2009;10(3):R25。gydF4y2Bahttps://doi.org/10.1186/gb-2009-10-3-r25gydF4y2Ba.gydF4y2Ba
- 63.gydF4y2Ba
Rigaill G, Balzergue S, Brunaud V, Blondet E, Rau A, Rogier O,等。用于RNA-seq差异分析关键成分鉴定的合成数据集。生物信息学报,2018;19(1):65-76。gydF4y2Bahttps://doi.org/10.1093/bib/bbw092gydF4y2Ba.gydF4y2Ba
- 64.gydF4y2Ba
麦卡锡DJ,陈勇,史密斯GK。生物变异方面的多因素RNA-Seq实验差异表达分析。中国生物医学工程学报,2012;40(10):4288-97。gydF4y2Bahttps://doi.org/10.1093/nar/gks042gydF4y2Ba.gydF4y2Ba
- 65.gydF4y2Ba
李志强,李志强,李志强,等。灌溉制度相互作用栽培番茄的基因型:从连锁定位和基因表达的经验教训。应用理论,2016;29(2):395-418。gydF4y2Bahttps://doi.org/10.1007/s00122-015-2635-5gydF4y2Ba.gydF4y2Ba
- 66.gydF4y2Ba
杨永华,杜doit S, Luu P, Lin DM,彭V, Ngai J,等。cDNA微阵列数据的归一化:一种稳健的处理单片和多片系统变异的复合方法。中国生物医学工程学报,2002;30(4):e15-115。gydF4y2Bahttps://doi.org/10.1093/nar/30.4.e15gydF4y2Ba.gydF4y2Ba
- 67.gydF4y2Ba
史密斯星期。微阵列实验中评估差异表达的线性模型和经验贝叶斯方法。中华生物医学杂志2004;3:1。gydF4y2Ba
- 68.gydF4y2Ba
王志强,王志强,王志强,等。全基因组研究的统计学意义。中国科学(d辑),2003;21(3):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1530509100gydF4y2Ba.gydF4y2Ba
- 69.gydF4y2Ba
李华,杜斌。基于钻穴-轮变换的快速精确短读对准。生物信息学,2009,25(14):1754 - 60。gydF4y2Bahttps://doi.org/10.1093/bioinformatics/btp324gydF4y2Ba.gydF4y2Ba
- 70.gydF4y2Ba
麦肯纳,汉娜M,班克斯E, Sivachenko A, Cibulskis K, Kernytsky A,等。基因组分析工具包:用于分析下一代DNA测序数据的MapReduce框架。基因组学报2010;20(9):1297-303。gydF4y2Bahttps://doi.org/10.1101/gr.107524.110gydF4y2Ba.gydF4y2Ba
- 71.gydF4y2Ba
Dereeper A, Audic S, Claverie JM, Blanc G. BLAST-EXPLORER帮助您建立系统发育分析的数据集。中国生物医学工程学报,2010;10(1):8。gydF4y2Bahttps://doi.org/10.1186/1471-2148-10-8gydF4y2Ba.gydF4y2Ba
- 72.gydF4y2Ba
英伦斯,卡明斯。植物性食品中膳食纤维非淀粉多糖含量测定的改进方法。中国化学杂志。1988;71(4):808-14。gydF4y2Ba
- 73.gydF4y2Ba
丹斯连续波。在:林YS,丹斯CW,编辑。木质素的测定,见《木质素化学方法》。-:施普林格;1992.33 - 61页。gydF4y2Ba
- 74.gydF4y2Ba
埃德加R,多姆拉切夫M,鞭策AE。基因表达综合:NCBI基因表达和杂交阵列数据存储库。核酸研究,2002;30(1):207-10。gydF4y2Bahttps://doi.org/10.1093/nar/30.1.207gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
我们非常感谢Philippe Andrey和Jasmine Burget提供的FreeD软件以及他们关于用于分支重建的几何和数学概念的建议。我们感谢Aurélie Lemaire对突变体筛选的帮助。我们感谢Devin O 'Connor提供PIN1a:CITRINE系列和Javier Sampedro提供XCP1:GUS系列。gydF4y2Ba
资金gydF4y2Ba
这项工作由RS获得的ANR项目BRAVO (ANR-14- ce19 - 0012-01)资助,由美国能源部联合基因组研究所开展的工作得到了美国能源部科学办公室的支持。DE-AC02-05CH11231。POPS平台受益于LabEx Saclay Plant Sciences-SPS (ANR-10-LABX-0040-SPS)的支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
KS、SC、SA、PL、SD、AB、AO、AC、FT、SP、GM、JCP、RS进行实验;DLC, AC和JV测序gydF4y2Bavasc1-1gydF4y2Ba突变体和提供gydF4y2Bavasc1-2gydF4y2Ba种子。ED对microarray和RNAseq数据进行统计分析。所有作者都分析了数据。RS起草了手稿。作者们阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1gydF4y2Ba
.中snp的识别gydF4y2Bavasc1-1gydF4y2Ba.gydF4y2Ba
附加文件2:表S2gydF4y2Ba
.不同物种中与拟南芥ERECTA相似的亮氨酸-富受体激酶氨基酸序列列表,用于系统发育分析(图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
附加文件3:表S3gydF4y2Ba
.野生型植物三种不同类型维管束和薄壁组织LCM-RNAseq数据的统计分析gydF4y2Ba
附加文件4:表S4gydF4y2Ba
.各维管束与薄壁组织基因表达水平的统计分析。gydF4y2Ba
附加文件5:表S5gydF4y2Ba
.共表达基因gydF4y2BaBdERECTA。gydF4y2Ba
附加文件6;表S6gydF4y2Ba
.微阵列数据:纯合子中的差异表达基因gydF4y2Bavasc1-1gydF4y2Ba与杂合的gydF4y2Bavasc1-1gydF4y2Ba
附加文件7:图S1gydF4y2Ba
.短柄茎主干上沿第五节的8个最大维管束的表面积。gydF4y2Ba图S2gydF4y2Ba.突变位点及表达gydF4y2BaBradi1g46450gydF4y2Ba在WT,gydF4y2Bavasc1-1gydF4y2Ba而且gydF4y2Bavasc1-2gydF4y2Ba.gydF4y2Ba图S3gydF4y2Ba.激光捕获显微解剖。gydF4y2Ba图S4gydF4y2Ba.LCM数据的验证。gydF4y2Ba图S5gydF4y2Ba.20 DAG时WT和突变体的图片。gydF4y2Ba图S6gydF4y2Ba.全长凝胶gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Sakai, K., Citerne, S., Antelme, S.。gydF4y2Baet al。gydF4y2BaBdERECTA控制脉管系统模式和韧皮部-木质部组织gydF4y2BaBrachypodium distachyongydF4y2Ba.gydF4y2BaBMC植物生物学gydF4y2Ba21日,gydF4y2Ba196(2021)。https://doi.org/10.1186/s12870-021-02970-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02970-2gydF4y2Ba
关键字gydF4y2Ba
- BrachypodiumgydF4y2Ba
- ERECTAgydF4y2Ba
- 激素gydF4y2Ba
- 韧皮部gydF4y2Ba
- 木质部gydF4y2Ba