摘要
背景
套袋是生产优质水果的重要技术之一。在实际栽培中,我们发现了一种新的苹果果皮褐变现象,这种褐变现象发生在采收前,贮藏期间恶化。对贮藏果实褐变的代谢组学分析研究较多,但对采前褐变机理的研究较少。
结果
本研究以‘瑞雪’5岁树(CNA20151469.1)为材料。以未套袋果实(BFW)和套袋果实(BFB)为试验组,以未套袋果实(NBF)为对照。经偏最小二乘判别分析(PLS-DA), 50种代谢物具有重要的预测价值P值< 0.05。其中黄酮和脂质分子是最重要的差异代谢物,与NBF相比,BFW中有11种黄酮和6种脂质分子显著减少。褐变后,BFB中11种黄酮类化合物和7种脂类化合物的含量较BFW进一步降低。同时,显著富集的代谢途径包括半乳糖代谢、ABC膜转运蛋白、类黄酮生物合成和亚油酸代谢途径等。生理指标表明,与NBF相比,丙二醛(MDA)、过氧化氢(H2.O2.),超氧阴离子(O2.-)果皮中BFW和BFB含量显著增加,其中BFB的差异更为显著。同时,BFW和BFB的抗氧化酶活性受到抑制,加速了细胞结构的破坏。此外,代谢组学和生理学数据表明,黄酮类化合物的显著减少与果皮褐变呈正相关。因此,我们分析了黄酮类化合物相关基因的表达,发现与NBF相比,黄酮类化合物合成基因的表达量增加MdLAR公司和mdanr.在BFW和BFB中显著上调,但是,下游类黄酮相关的聚合基因MdLAC7和MdLAC14型也有显著表达。
结论
结果表明,套袋改变了果实的微环境,细胞结构的破坏、黄酮类化合物的减少和三萜类化合物的增加是果皮褐变的主要原因。
背景
苹果是世界上产量最大的水果之一,在世界水果贸易中占有重要地位[1.].中国已成为世界上最大的苹果生产国(联合国,粮农组织的食品和农业组织)。2018年,中国的苹果栽培区已达到20.72亿小时2.,占全球总培养面积的57.7%,总产量达到392.35亿吨,占世界苹果制作总产量的54.5%。
果实色泽鲜艳,表面光滑,无农药残留,深受消费者青睐。果实套袋是生产优质果实的最重要的农业规范之一[2.,3.].它已用于几种水果作物,以改善果皮颜色和表面光滑,并减少疾病、害虫、果皮晒伤和鸟类损害的发生率[3.,4.,5.,6.,7.,8.].它已广泛应用于中国,澳大利亚,日本,以及美国为桃子,苹果,梨,葡萄,枇杷等种植[3.,9]. 然而,套袋也会对果实产生一些负面影响。套袋后的微环境会降低果皮厚度和果实中糖、酸、矿质元素等内溶性物质的含量[7.,10]. 套袋后,黑暗条件可抑制果实中黄酮类、酚类等抗氧化物质的合成和积累[11,12,13因此,降低了果实对应力的抵抗力。
一个有趣的现象是,套袋果实,尤其是一些晚熟品种,如富士、金冠、粉红淑女、艳羡、瑞雪等,在田间果实生长后期(9~10月)极易发生果皮褐变。1.)。虽然没有褐变发生在未加工的水果中。新种类的褐变与浅表鳞片不同,在收获之前发生并在储存期间发生恶化,并且黄酮类化合物显着降低,并且三萜类化合物随着褐变而增加。虽然,血液烫伤仅在储存期间发生,而α-法呢烯合成酶(MdAFS1型)TPS酶及其氧化产品已被确定为造成肤浅烫伤的关键因素[14].在收获之前,褐色开始于茎腔,然后扩展到整个表面。同时,秸秆腔和其他扩展部分从浅棕色到棕色和深褐色的变化(图。2.). 在贮藏过程中,健康的表面由茎腔向外扩散而逐渐退化。严重的是,棕色部分可以渗透到水果内部,没有任何异味。虽然新的褐变不影响其口感,但影响了果实的外观,降低了其价值[15,16].
以往对果实褐变的研究主要集中在贮藏期。包括长期低温贮藏诱发梨、苹果、芒果、香蕉等果皮褐变[17,18,19].罗发现抗氧化剂和氧化还原系统直接通过代谢族技术在低温下与苹果软烫伤开发有关[19].jordi表明,通过代谢术语解释了低温下乙烯介导的梨剥离机制[20].陈还使用了代谢文体,表明剥离褐变可以诱导从氨基酸转化到萜烯的代谢产物[17].先前的分析揭示了三羧酸循环(TCA)和γ-氨基丁酸(GABA)分流产生的反应性氧物种的代谢的变化,这导致Mesocarp内的应力条件。此外,降低抗氧化剂水平和溶解在Mesocarp中的反应性氧物种劣化果实生理学。这种氧化胁迫均沿着果实氨基酸,糖和酶的水平呈果实[18,19,21].但是,袋装诱导的褐变尚未彻底研究。此外,很少有研究试图使用比较代谢组学研究收获前剥离褐变的机制。
我们假设套袋改变了苹果果实的微环境,降低了果皮的抗氧化能力,导致果皮变薄,在昼夜温差较大的地区,果实中的抗氧化成分减少,细胞结构发生改变,而果实的酶促褐变是在细胞膜破裂后引起的。本研究以敏感品种“瑞雪”为研究对象,采用代谢组学方法研究苹果皮褐变机理。研究结果有助于我们了解采收前果皮的生理变化,完善采收前栽培技术和贮藏技术。
结果
套袋对果皮厚度的影响
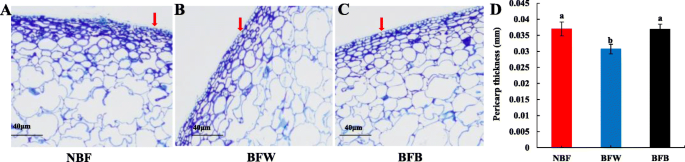
果皮在保护水果免受外界刺激方面起着重要作用[22,23]. 我们测量了果皮的厚度,以确定套袋是否会改变细胞结构。NBF的上皮细胞包括5-6层(图。3.套袋果实(BFW和BFB)的上表皮细胞只有4-5层(图1)。3.B-C),表明袋装改变了果实周围的微环境,并减少了剥离中的细胞层的数量。
BFW的剥离厚度仅为0.031 mm,与NBF相比显著降低(16.2%)(图。3.d) 是的。与BFW相比,BFB的果皮厚度没有减少,但显著增加(增加16.0%),表明果皮细胞壁增厚。
袋装对剥离细胞微观结构的影响
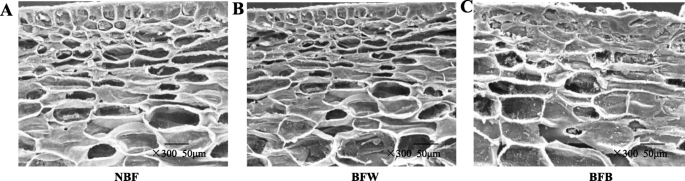
我们使用透射电子显微镜来确定剥离的微观结构。NBF和BFW的果实保持了原有的组织结构,蜂窝结构均匀、完整、清晰,细胞表面光滑平整(图1)。4.A-B)。BFB的细胞结构明显变形并萎缩,皮下细胞已开始下垂,结构松散蓬松,细胞结构不再蜂窝状,表面组织破裂,细胞结构被破坏(如图。4.C)。
代谢物分析
QC样品主成分分析及代谢物强度分布评估
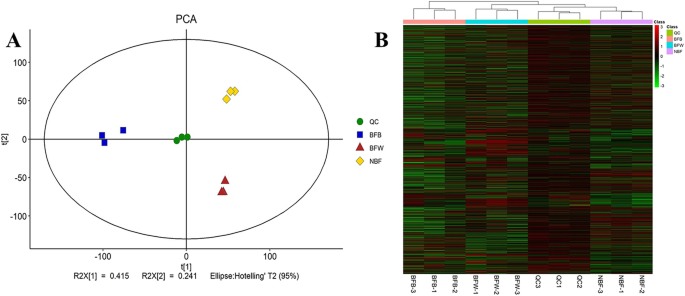
为了测试质谱系统的稳定性,我们混合样品(按同等比例)来创建QC样品。首先分析了QC样本的主成分;通过7次交叉验证(7个交叉验证周期)获得的PCA模型图如图所示。5.a. QC样品聚类紧密,说明实验稳定,重复性好。所有代谢物表达水平的分层聚类直观地说明了QC与其他样本之间的关系是稳定的(图5)。5.b) 是的。质控品与其他三个样品的代谢物强度分布无显著差异,数据稳定、准确。
果皮褐变部分代谢物的测定
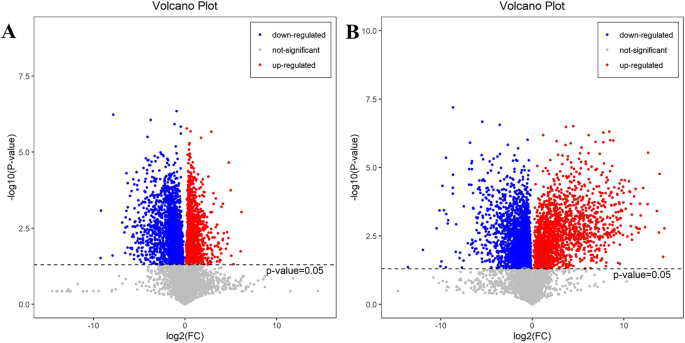
我们分析了NBF,BFW和BFB中所有代谢物的差异。与NBF,分别在BFW中显着上调和下调2775和2089代谢物(图。6.a).与BFW相比,BFB中2211和2534代谢物显著上调和下调(图5)。6.b).采用多维分析与单维分析相结合的方法筛选标记代谢物。与VIP > 1和P-价值< 0.05被认为是差异显著的代谢物。与NBF相比,BFW有131种代谢产物显著上调,217种代谢产物显著下调;与BFW相比,有198种代谢产物显著上调,178种代谢产物下调。
差异代谢物的筛选
为了研究样品之间的关系和代谢物的差异,对所有那些检测到显着差异的代谢物的表达水平进行分层聚类分析。根据VIP值,对第一前50个差分代谢物的表达水平进行视觉分析。结果表明,与NBF,13种黄酮(包括Apigenin,Rutin,Myricetin 3-葡糖苷,异喹蛋白,槲皮素,槲皮素3-O-葡糖苷,氟胺,6-羟基曲素6-木糖苷,原霉素B2,槲皮素3-阿拉伯苷和Morin显着下降,克劳林醇和姜蛋白B均显着增加),10种碳水化合物化合物(包括乳果酱,D-甘露醇,蔗糖,D-半乳糖,D-麦芽糖、麦芽三糖、葡萄糖1-磷酸、呋喃果糖和3-岩藻糖基乳糖显著增加,D-GlucopyranoSide显着降低),10个脂质分子(D-GlucopyranoSide,羟甲硫酸盐,1-己醇阿拉伯西酰葡糖苷,Corchoionol C 9-葡糖苷和番糖醇显着降低,2-羟基酰亚乙酸,SM(D18:1/18:1(9Z)),Scillirsidin,Pi(15:0/0:0) and C16 sphinganine were significantly increased), nine benzene ring-type compounds (including eugenol, anthraquinone and buclizine were significantly decreased, benzene-1,3,5-triol, thiabendazole, triphenyl-phosphate-thiabendazole, pandamarilactam-3x, citbismine C and pterosin H were significantly increased), five organic acids and their derivatives (including raltitrexed, isocitrate and 1-o-p-coumaroyl-beta-d-glucose were significantly increased, ustiloxin D and oxane-2-carboxylic acid were significantly decreased), one scatterbrained lipid (armillaripin was significantly increased) and two other types metabolites (including 2,2-dichloro-1,1-ethanediol was significantly increased, atorvastatin was significantly decreased) had significantly changed in BFW (Fig.S1A、 表S1)。
差分代谢物进一步细分。与NBF相比,下调差分代谢物主要是BFW中的黄酮类化合物。众所周知,大多数植物含有黄酮类化合物[24],在植物生长中起着重要作用。黄酮类化合物作为一种次生代谢物,可以清除自由基,延缓组织细胞的正常凋亡[25]. 然而,黄酮类化合物不包括在BFW的上调代谢产物中。为了确定褐变的原因,或褐变产生的物质,检测了BFB和BFW组的代谢产物。在显著变化的代谢物中(图。S1B),我们鉴定出12种黄酮类化合物(包括原花青素b2、根皮苷、羟基木犀草素、槲皮素3-阿拉伯糖苷、姜酮B、槲皮素3-o-葡萄糖苷、异槲皮苷、槲皮苷、桑椹苷和黄皮烯醇明显减少,芡实酮和马耳菌素半乳糖苷明显增加),13种三萜(包括灵芝酸A显著降低,药原酸、12-齐墩二烯二烯-28-oic酸、二十二酸、氧杂烷-2-羧酸、植tolaccinic酸、灵芝酸B、原碱性酸、灵芝酸E、16alpha-hydroxygypsogenic acid、pokebergenin、corosin显著升高),11种脂质及其相关分子(包括SM(d18:1/18:1(9Z))、c16 -鞘氨醇、scillirosidin、雌二醇- 17β -3-硫酸酯、2-羟基己二酸和vomifolol、tetranor-PGDM显著降低,酸浆内酯B、EB-1213、戊胆钙化醇和环胆甾醇显著升高),7种有机酸及其衍生物(包括绿原酸、阿魏酰c1 -葡萄糖醛酸、顺式5-咖啡酰基奎宁酸、雷替曲塞和奎宁酸)显著降低,乙酰-l-三丁酸-l-柠檬酸和异柠檬酸显著升高,4种糖类化合物(包括D-麦芽糖,D-呋喃果糖基、3-岩藻糖基乳糖和蔗糖含量显著降低),2个苯环类化合物衍生物(包括citbismine C含量显著降低,C2-(4-甲基-1,3-戊二烯基)蒽醌含量显著增加),1个脂质(阿米拉肽含量显著降低),1个其他化合物((17Z)-1α,25-二羟基-26,27-二甲基-17,20,22,22,23,23-六脱氢鹰嘴豆醇显著升高)在BFB中有显著变化(图。S1B,表格S2)。
差异代谢物的富集分析
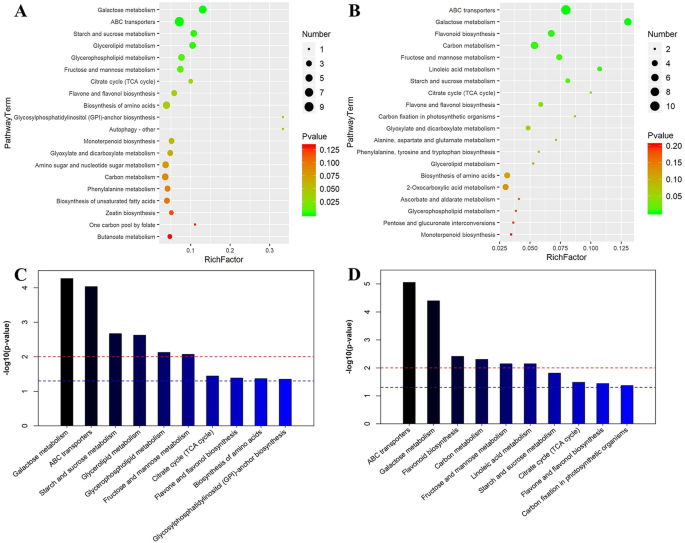
通过比较京都基因与基因组百科全书(KEGG)中的差异代谢物,了解不同样本的差异代谢途径,https://www.kegg.jp/)在数据库中,选择了具有显著富集的前20个代谢途径进行气泡图绘制(图。7.). 半乳糖代谢、ABC膜转运蛋白、淀粉和蔗糖代谢、甘油酯/磷脂代谢、果糖和甘露糖代谢在BFW与NBF相比发生了显著变化(图。7.a-c)。
为了更好地了解套袋诱导果实褐变的最终主要代谢产物和代谢途径,我们对BFW和BFB的差异代谢产物和代谢途径进行了富集分析。与BFW相比,BFB的多种代谢途径发生了显著变化:ABC膜转运蛋白、半乳糖代谢、类黄酮生物合成、碳代谢、果糖和甘露糖代谢以及亚油酸代谢(图。7.b-d)。从前50种差异代谢产物来看,类黄酮生物合成的抑制导致抗氧化物质的减少,而抗氧化物质是导致果实褐变的直接原因,而细胞膜的损伤可能是类黄酮生物合成和转运受到抑制的直接原因。
套袋对膜脂过氧化的影响
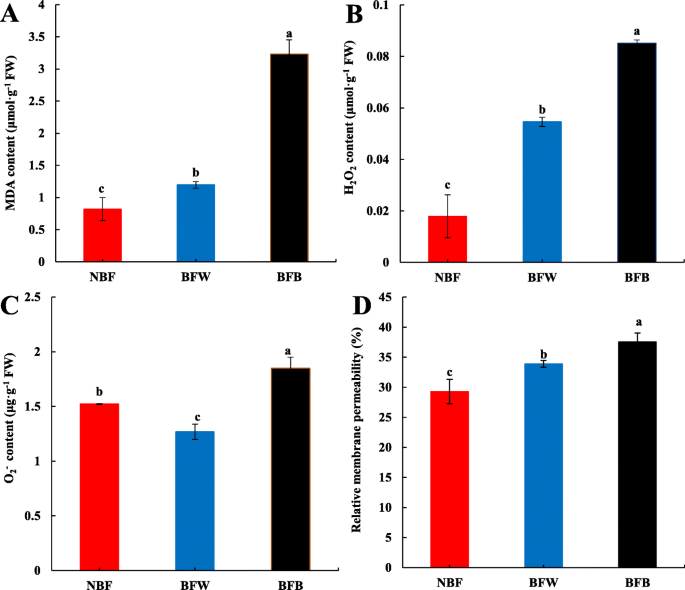
通过对果皮显微结构的测定,确定套袋后褐变与细胞结构的完整性密切相关。进一步测定膜脂过氧化程度。与NBF相比,BFW和BFB的果皮MDA含量分别显著增加0.46倍和2.94倍(图。8.a) ;H2.O2.BFW和BFB的含量分别显著增加了2.05倍和3.75倍(图。8.b);和O2.-BFW中含量显着降低了16.6%,但BFB中显着增加了21.5%(图。8.c).这表明套袋后微环境的改变加速了细胞膜的过氧化作用。我们还测量了细胞膜透性,发现与NBF相比,BFW和BFB的细胞膜透性分别显著提高了15.7和28.2%(图)。8.d) 是的。
袋装对SOD,猫和豆荚活性的影响
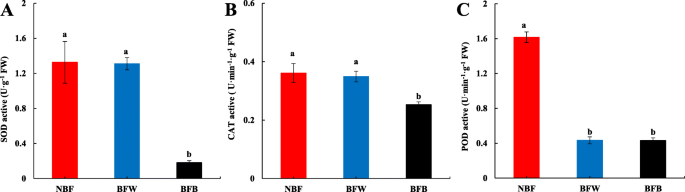
SOD、CAT和POD是关键的活性氧清除酶,能清除ROS,防止ROS积累[26,27,28].如图。9套袋后,SOD、CAT和POD活性受到显著影响。与NBF相比,BFB的SOD和CAT活性分别下降了82.3%和30.1%,呈下降趋势,而BFW的SOD和CAT活性无明显变化(图1)。9A-B)。此外,与NBF相比,袋装后POD的活性显着降低,BFW和BFB剥离的豆荚的活性分别显着降低73.2和73.3%(图。9C)。
套袋对果皮抗氧化能力的影响
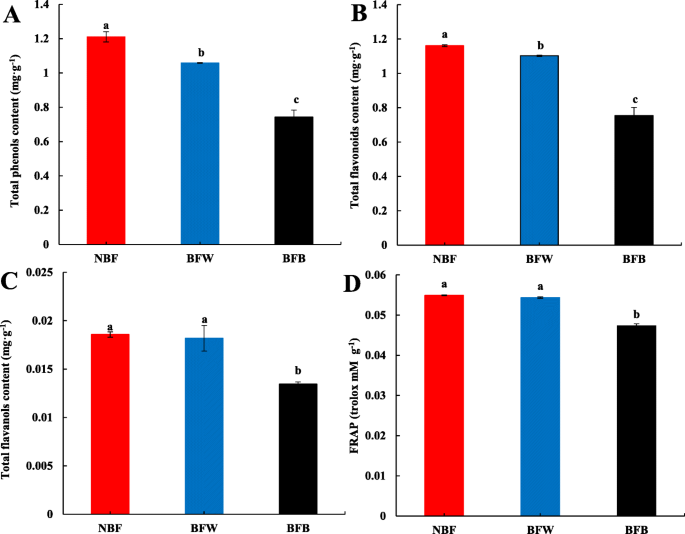
通过代谢组学分析,套袋显著降低了果皮中抗氧化物质的积累,抑制了褐变后黄酮类化合物的合成。为了进一步验证抗氧化剂的降低是否导致褐变,我们测定了果皮中总酚(TP)、总黄烷醇(TFA)和总黄酮(TFO)的含量。如图。10袋装后,抗氧化物质的积累显着降低,BFB的还原程度更为显着。与NBF相比,分别在BFW中显着降低TP和TFO的含量显着降低12.6%和5.1%,TFA的含量表现出降低但不具有重要趋势。与NBF相比,BFB中TP,TFO和TFA的含量分别显着降低了38.6,35.1和28.0%。
套袋对果皮酚酸组成的影响
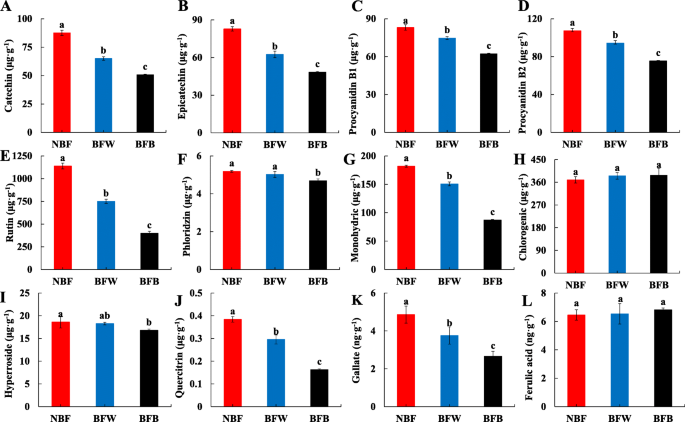
由于其抗氧化活动及其对人体健康的有益影响,酚类酸在水果和蔬菜中获得了很大的关注[29].通过测量果皮中的酚醛酸组合物,我们发现,在袋装之后,果皮中的酚酸显着降低。如图所示。11尤其是儿茶素、表儿茶素、原花青素B1、原花青素B2、芦丁、一元酸、槲皮素、没食子酸盐的含量分别比NBF显著降低25.8%、24.6%、10.1%、12.1%、34.1%、17.2%、21.1%、22.6%;果皮褐变后,BFB中这些物质的含量分别显著降低42.1%、41.6%、25.1%、29.7%、65.0%、52.1%、57.9%、45.3%。进一步解释了套袋对果皮抗氧化物质积累的影响。
分析相关黄酮类化合物的基因表达
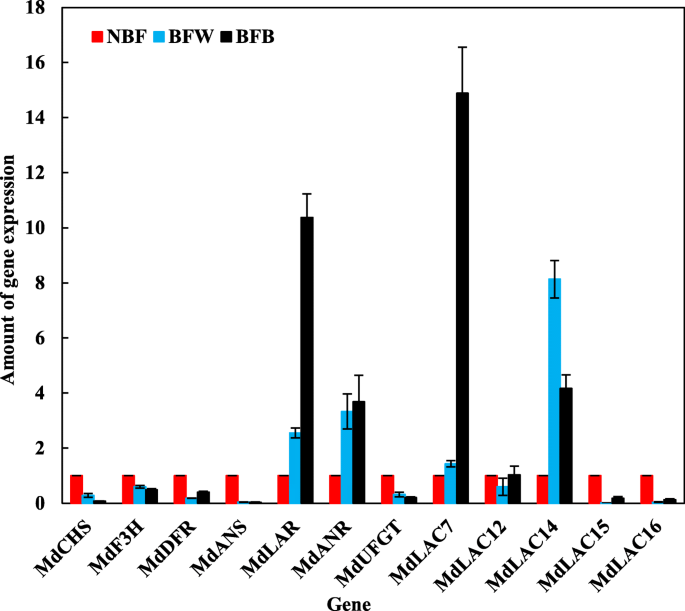
如图。12与NBF相比,黄酮类化合物的合成基因MdCHS,MdF3H型,MdDFR公司,莫斯和MdUFGT公司在BFW和BFB中显着下调,而MdLAR公司基因在BFW和BFB中显著上调2.55倍和9.37倍mdanr.基因分别在BFW和BFB中显着上调2.33和2.69倍。有趣的是,随着类黄酮类相关合成基因的高表达,下游的黄酮类化合物相关聚合物基因也高度表达,其中MdLAC7和MdLAC14型表达最显著。与NBF相比,MdLAC7在BFW和BFB中显着上调0.43和13.88倍,以及MdLAC14型分别在BFW和BFB中显着上调7.13和3.17次。
讨论
果实中的褐变,包括酶促褐变和非酶促褐变,酶促褐变的发生与细胞膜的完整性密切相关。酶促褐变是由分布在弹性体和底物中的酶引起的[30].当细胞受到胁迫时,果实清除自由基的能力下降,导致活性氧(O2.-)加速膜脂过氧化,增加膜透性[30]. 这个结论与我们测量的结果一致(图。8.),套袋后,更多的H2.O2.,O.2.-和MDA在果皮中产生,加速了细胞结构的破坏。此外,先前的研究发现,通过酶多酚氧化酶(PPO)的氧化氧化是剥离褐变症状的关键因素[31,32].During storage at low temperature, the cellular organelle’ internal membranes was destroyed, promoting the reaction between PPO (stored in the plastid) and chlorogenic acid (stored in the vacuole), leading to the production of quinones and melanin, which finally resulting in the dark-discolored areas on the fruit peel [20,33].王王研究了,如在苹果的NO褐色果皮中,其高表达的绿原酸含量,可能与剥离褐变的抑制相关,外源绿原治疗显着增强了类黄酮的生物合成中涉及的基因的表达,木质素合成基因被抑制表达[34].但,我们的结果表明,内源性的绿原酸含量没有用褐变减少(图。11)因此,我们认为绿原酸不是采前褐变最适宜的底物。
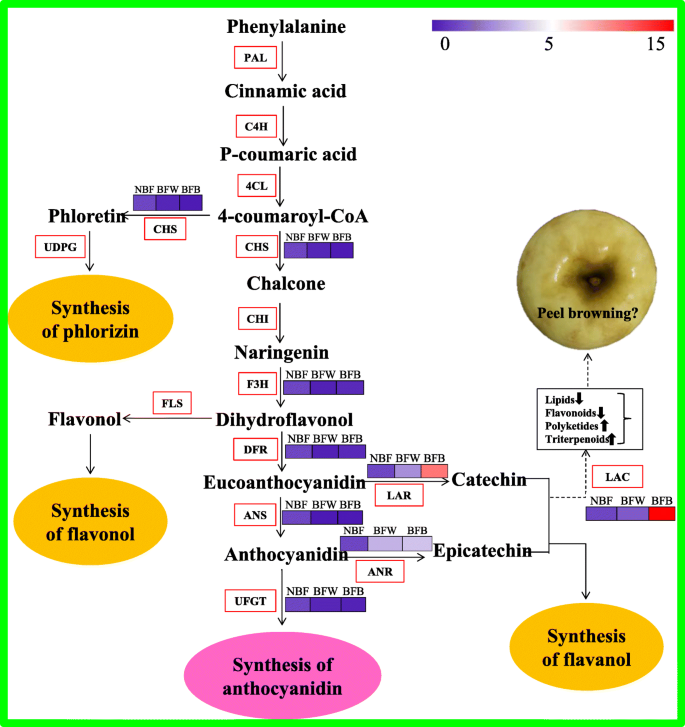
众所周知,黄酮类化合物是主要的次生代谢产物,包括花青素,黄酮,黄酮,原霉素,异黄酮和橙色酮不同亚组[35],在细胞中发挥一系列作用,诱导颜色变化,提高植物的抗氧化能力[36,37].通过从苯丙氨酸开始并由苯丙氨酸氨基丙氨酸催化,在植物中在植物中合成黄酮类化合物。朋友)形成肉桂酸,然后形成P-辛尼甲酯4-羟化酶催化coa的研究(C4H.)4-香豆素COA Ligase(4CL.)。在Chalcone合成酶的关节作用下(CHS公司),查尔酮异构酶(芝加哥)、黄酮3-羟化酶(F3H型)和黄烷酮3-羟基化酶(DFR公司),P-香豆素coa转化为黄酮类化合物[38]. 下游结构基因虫胶已证明其与黄酮类化合物在苯肾上腺素代谢途径上的氧化聚合密切相关[39]. 以前的研究表明漆酶(P-双酚:O2.-氧化剂。C 1.10.3.2)编码方式虫胶与水果褐变直接相关[40]. 漆酶作为一种胞内酶,参与木质素的生物合成,能够进行单醇氧化聚合,参与黄酮类物质的聚合[40].漆酶编码TT10在模型工厂拟南芥,作为类黄酮氧化酶,催化表儿茶素的氧化聚合产生不同于无色原花青素的黄色和棕色色素[41]. 表儿茶素和原花青素分泌到质粒中,可以解释在种子干细胞死亡过程中,表儿茶素和原花青素苷与胚泡破裂相互作用TT10,最初无色的前氰基糖苷和细胞壁多糖和其他酚类化合物形成氧化物化合物,可以容易地导致组织暗[39].一些漆基因(如LAC14.和LAC15.)在水果锈的果皮中也有更高的表达[42,43].在荔枝,ADE/LAC公司位于液泡中,运输到细胞壁起作用,与果皮中的儿茶素发生氧化聚合,加速原花青素降解,促进果皮褐变[39]. 有趣的是,漆酶的底物范围比PPO更广[44]. 与相关的多酚氧化酶类似,漆酶不仅能够氧化o-diphenols,还有P- 尽管许多这些反应的机制,但甲氧基取代的单选酚,二胺和非芳烃尚未阐明[45]. 在我们的研究中发现,在褐变过程中,MdLAC14型同时也伴随着高表达MdLAC7,我们推测两者之间有一种互动关系MdLAC7和MDLAC14。而儿茶素、表儿茶素和原花青素的含量随着褐变的发生而显著降低,因此,我们认为这些化合物可能是漆酶引起新的酶促褐变的底物。但是,具体的分子机制还需要我们去探索。数字13显示了类黄酮的代谢途径。
此外,通过分析代谢物数据,我们也发现了一个有趣的事情:袋装后,在BFB中富集的更多三萜,而Triterpenes的积累在NBF或BFW的剥离中并不明显。Terpenoids广泛存在于自然界中,是一些植物精华,树脂和颜料的主要组成部分(如玫瑰油,桉树油,松节油)[46,47,48].例如,ganolucic acid, Kubota等人首先提出[49],是一种高度氧化的羊毛脂三萜,一种常见于灵芝中的三萜。它一般是黄棕色的,味道很苦[49].因此,我们怀疑果皮中过量的三萜可能是果皮褐变的主要原因。此外,高表达的MdLAC公司这不仅与果实中黄酮类化合物的减少有直接关系,而且与果实成熟期萜类化合物的氧化聚合也有直接关系?套袋对三萜合成的影响还有待研究。
结论
综上所述,细胞结构的破坏、细胞膜脂质过氧化的增加、黄酮类化合物含量的减少和三萜类化合物含量的增加是造成瑞雪套袋果皮褐变的主要原因。更重要的是,两者之间是否有直接关系MdLAC公司黄酮类化合物表达量的降低和三萜类化合物的增加有待进一步研究。
材料和方法
实验设计
该实验在西北A&F大学的白水县苹果考试站(35°2'N,109°6'e),于2019年10月。该测试站拥有温暖的温带大陆季风气候海拔915米,年平均降雨量为578毫米,年平均温度为11.4°C。在果实生长的中期和晚期,白天大气和内袋的最高温度分别为31.7°C,相对湿度分别为40.7和35.9%,最低温度在夜间的最低温度为4.1°C和4.6°C分别和相对湿度为100%,在补充图4中给出日期的细节。S2. 将瑞雪接穗嫁接到M26砧木上。以5年生瑞雪果树为材料,瑞雪已通过国家品种认证。根据国际植物品种权规则,树木和芽木可用于研究目的,这可以从西北农林科技大学的郑洋朝获得。品种数为CNA20151469.1)。这些树被培养成纺锤形(1.5) × 3 m) 是的。2019年5月中旬进行套袋,外袋褐色,内袋红色(果袋规格155) 毫米 × 180 嗯,外纸是57.0 g木浆复合纸,外层为纸浆色,内层为黑色,内层为32.0 g红纸,两面涂蜡)。以三行套袋和不套袋果实为生物重复系,每行10株。果实在成熟期(2019年10月)用袋子收获。随机选择无褐变套袋水果(BFW)和有褐变套袋水果(BFB)为试验组,无褐变套袋水果(NBF)为对照组。选择30个大小、成熟度相同、无任何机械损伤的果实进行分析。用无菌手术刀对茎腔果皮进行取样,然后立即在液氮中冷冻保存− 80 摄氏度。
方法
苹果剥褐色的分类
根据陈的方法[17),根据果皮褐变面积(以S表示)将套袋果实分为5个等级(图1)。1.):
0,果实表面无褐斑;
一、 褐变面积为0 < S ≤ 1/5;
II,褐变面积为1/5 < S≤1/4;
III,褐变面积为1/4 IV,褐变面积为1/3 < S≤1/2; 五、 褐变面积为1/2 < S ≤ 1. 果皮厚度采用石蜡切片法[50].每个组中的每个剥离部分在秸秆腔剥离的三个不同位置随机选择。在100倍的视野下描绘了整个组织区域,以确保每张照片的一致背景光。我们将外部三层细胞选择为测量剥离厚度的关键。Image-Pro加6.0(媒体Cybernetics,Inc.,Rockville,MD,USA)用于测量每个切片的五个点的表皮的厚度(mm),为100倍的标准。 细胞的超微结构按陈氏方法测定[17]. 将果皮片固定在4%戊二醛覆盖的玻璃上5分钟 h,用乙醇以递增梯度(10–100%)洗涤10分钟 每片组织在100%乙醇中浸泡10分钟 分钟,然后在烘干机中过夜。将完全脱水的组织在真空中转移到双面碳带铝堆中,然后溅射镀金,并精细切片。在20岁时分析了可视化的三维模型 kV使用扫描电子显微镜(FEI Quanta 200,Thermo Fisher Scientific,Bedford,MA,USA)。 采用ACQUITY UPLC超高效液相系列AB Triple TOF 5600高分辨质谱仪测定液质耦合。测定时,取80 mg样品。然后,内标(20 μL) (l -2-氯苯丙氨酸,0.3 mg/mL;Lyso PC17:0;将1.0 mL甲醇:水(V:V = 7:3,含0.01 mol/L BHT(2,6-二叔丁基-对甲酚))混合。然后加入两个小钢球,样品在−20℃预冷2min后放入磨床(60hz, 2min)。超声提取30分钟后,在−20℃下静置20分钟,然后离心10分钟(13000 rpm, 4℃)。上清300 μL摇干后,用400 μL甲醇:水(V:V = 1:4)重新溶解,涡流30 s,超声2 min。离心10 min (13000rpm, 4℃)后,用注射器吸收150 μL的超流体,用0.22 μL的有机相针孔过滤器过滤。然后将过滤后的有机相转移到LC进样瓶中,在−80℃保存至LC- ms分析。 Three biological repeats were tested in each group. The quality control sample (QC) was prepared by mixing an equal volume of the extract of all samples; the final volume of each QC was the same as the sample volumes. All extracted reagents were pre-cooled at − 20 °C before use. MDA根据Sun描述的方法测量[51](细致修改)。我们服用1.0ml上面提取的样品上清液并加入2.0ml 0.67%硫酰比呋喃酸(TBA)。将含有1.0ml水的样品被设定为阴性对照。接下来,将样品置于沸水浴中15分钟,然后通过浸入冷水中快速冷却,并将它们倒入10ml离心管中。将所有管以400rpm离心20分钟,并确定所有样品的吸光度在600nm,532nm和450nm中使用分光光度计。 O2.-根据Zhao描述的方法测量[52](细致修改)。双点零克新鲜样品,然后使用65mmol·L− 1.将磷酸盐缓冲液(pH7.8)提取,恒定体积至10mL,离心(10,000rpm,10分钟),并提取上清液以供以后使用。然后萃取2.0ml上清液,加入1.5ml磷酸盐缓冲液和0.5ml羟胺盐酸盐,混合并在水浴中保持温热,在25℃下保持20分钟。沐浴后萃取2.0mL上清液,加入2.0ml 7mmol·L− 1.α-萘胺和2.0 17毫升 毫摩尔·升− 1.磺酸,在30℃下沐浴30分钟,测量530nm的所有样品的吸光度使用分光光度计。 H含量2.O2.根据Zhao描述的方法测量[52]. 称取2.0克新鲜植物组织,加2.0克 ml预冷丙酮。然后,在3000℃离心 10转/分 最小,然后,提取0.3 ml上清液,加入0.1 ml 5%硫酸钛和0.2 ml浓氨水,离心(3000 每分钟转数10 min),然后,用丙酮沉淀反复洗涤3次 ~ 5次,加5.0 ml硫酸(2.0 毫摩尔·升− 1.),完全溶解后,在415℃测量所有样品的吸光度 nm使用分光光度计。 根据简化方法测量细胞膜渗透性[52]. 简单地说,水果用自来水清洗,然后用蒸馏水冲洗两次。取茎腔0.5g果皮50份 ml离心管,20 加入ml蒸馏水,摇匀。然后用DDS-307电导仪(中国上海精密科学仪器有限公司)测量电导率。将喷嘴密封置于沸水浴中10分钟 min,用自来水冷却,摇匀,按公式测定电导,计算细胞膜透性。 SOD、CAT、POD活性按赵[52].简而言之,称重0.5g新鲜样品,加入4.0ml磷酸盐缓冲液(0.05mol− 1.然后,将萃取(4℃3000rpm 10分钟)提取物,在使用前在-20℃下预冷地预冷(4℃3000rpm)。通过氮蓝四唑光化学减少方法测量SOD活性。使用kar和mishra方法的猫活动[45,53]. 用愈创木酚法测定POD活性。 根据李和柳条的方法[54], 1.0 g皮在液氮中磨碎。然后是1.5 ml乙醇-丙酮混合物(v:v = 加入7:3),37℃孵育 °C,适用于1 H然后将匀浆在13000℃下离心 转速为20转/分 °C持续10分钟 上清液立即贮存在培养基中− 20 °C冰箱,用于测定总抗氧化活性和抗氧化物质的含量。 根据Folin-Ciocalteu方法分光光度测定总酚含量[55].用亚硝酸铝 - 氯化铝测定黄酮类化合物[56]使用芦丁作为标准,并使用Rutin校准曲线计算结果。用4-dmaca检测到黄烷醇含量[39]. 采用铁还原法测定果皮的总抗氧化能力。 根据张[57]测定酚酸组成(稍加修改)。简而言之,0.1 称取新鲜样品g,置于1.5μg的容器中 mL离心管,然后添加1.0 mL提取物(甲醇:水:甲酸 = 25:24:1; v:v:v),超声波20分钟 最小25 摄氏度(40 赫兹,100 W) ,然后震惊了20分钟 最小,离心(10000 每分钟转数15 最小值)。用注射器吸取上清液后,过滤至0.25%的棕色琥珀色瓶中 μm有机尼龙过滤器,采用液相质谱法测定酚酸组分。流动液A为0.1%甲酸水,流动液B为100%甲醇。 使用RNA植物加试剂盒(天根,中国)并使用Primesscript™RT试剂盒(Takara,Dian,China),从果皮苹果(设定三个独立的重复)中提取总RNA(设定三个独立的重复)。使用SYBR预混物(Takara),在ABI7500系统中进行定量聚合酶链反应(QPCR)。QRT-PCR的计算方法为2-△△计算机断层扫描. 每个样品至少有三个重复用于qPCR。表中列出了用于qPCR的底漆1.. 从实验数据中提取了三个生物重复序列。使用microsoftexcel2010、sigmaplot13和progenesqiv2.3软件对数据进行处理和绘图,并使用spss24.0软件进行单因素方差分析(ANOVA)。数据分析采用t检验。数据以平均值表示 ± 标准误差。意义定义于P < 0.05.剥离厚度
剥离细胞的微观结构
代谢物分析
膜脂过氧化
SOD、CAT和POD活性
总抗氧化能力
酚酸组成
总RNA提取及qPCR分析
统计分析
数据和材料的可用性
使用标识符MTBLS2384已将原始代谢物学数据存放到EMBL-EBI METABolights数据库。可以在此处访问完整的数据集:https://www.ebi.ac.uk/metabolights/MTBLS2384/descriptors.
缩写
- BFW:
-
果实套袋不褐变
- BFB:
-
装袋水果与褐变
- NBF公司:
-
非袋装水果
- PLS-DA公司:
-
偏最小二乘判别分析
- VIP:
-
投影的可变重要性
- MDA:
-
丙二醛
- H2.O2.:
-
过氧化氢
- O2.-:
-
超氧化物阴离子
- 粮农组织:
-
联合国粮食及农业组织
- TCA公司:
-
三羧酸周期
- γ-氨基丁酸:
-
γ-氨基丁酸
- 质量控制:
-
质量控制
- PCA:
-
主成分分析
- KEGG:
-
Kyoto基因和基因组的百科全书
- ROS:
-
反应性氧气
- 草皮:
-
超氧化物歧化酶
- 猫:
-
溶酶微球菌过氧化氢酶
- 豆荚:
-
过氧化物酶
- 总磷:
-
总酚类
- TFA公司:
-
总黄烷醇
- TFO:
-
总黄酮
- PPO:
-
酶多酚氧化酶
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- C4h:
-
肉桂酸4-羟化酶
- 4毫升:
-
4-香豆酸辅酶A连接酶
- CHS:
-
Chalone合成酶
- Chi:
-
查尔酮异构酶
- 第三层:
-
黄烷酮3-羟化酶
- DFR:
-
二氢黄酮醇还原酶
- ANS:
-
花青素合成酶
- 拉丁美洲:
-
白细胞花青素还原酶
- ANR:
-
花青素还原酶
- UFGT公司:
-
UGP葡萄糖 - 黄酮醇3-O-葡萄糖基
- LAC:
-
对二酚氧氧化还原酶
- QRT-PCR:
-
定量实时聚合酶链反应
- cDNA:
-
互补DNA
- 4-DMACA公司:
-
4-(二甲基氨基)肉桂醛
参考文献
- 1.
赵家,泉PK,刘香港,李立,齐SY,张女所。转录组和代谢分析在长期冷储存过程中为苹果果实质量下降提供了新的见解。JAgric Food Chem。2020; 68(16):4699-716。https://doi.org/10.1021/acs.jafc.9b07107.
- 2.
张旭杰、王立新、刘一林、陈XX、杨依兹、赵ZY。史密斯奶奶苹果果皮着色差异基因表达分析。S Afr J机器人。2013;88(9):125–31.https://doi.org/10.1016/j.sajb.2013.07.009.
- 3.
Sharma Rr,Pal Rk,Sagar VR,Parmanick KK,Rana Mr,Gupta VK等。采用不同色袋对果皮的影响对果皮果皮,虫害虫,病虫害病虫病患者的发生率。j hortic sci biotechnol。2014; 89(6):603-18。
- 4.
卡拉拉H、艾哈迈达M、乌拉哈H、瓦吉德M、祖拜尔B M、拉扎布H。套袋防治芒果复合病虫害的效果及其对果实品质的影响。霍尔特科学生物技术杂志。2019;2(2):45–8.
- 5.
Bentley WJ,Viveros M. Brown-Bagging'Granny Smith'苹果在树上停止了蛾伤害。加利福尼亚州大学。1992年; 46(4):30-2。https://doi.org/10.3733/ca.v046n04p30..
- 6.
Hofman PJ, Smith LG, Joyce DC, Johnson GL, Meiburg GF。芒果(Mangifera indica ' keitt ')的套袋影响果实的品质和矿物质组成。采后生物技术。1997;12(1):83-91。https://doi.org/10.1016/S0925-5214(97)00039-2.
- 7.
Amarante C,银行NH,Max S.预热袋对梨果质量和采后生理学的影响(Pyrus Communis)。n z j crop hort sci。2002; 30(2):99-107。https://doi.org/10.1080/01140671.2002.9514204.
- 8.
Xu HX,Chen JW,谢M.不同透光纸袋对枇杷果实质量和抗氧化能力的影响。J SCI食物农业。2010; 90(11):1783-8。
- 9
Tran DH、Yen CR、Chen YKH。套袋对火龙果果实特性及物理保护的影响。生物农业激素。2015;31(3):158–66.https://doi.org/10.1080 / 01448765.2014.991939..
- 10
Shlomo M.袋装石榴果实的效率。Acta Hortic。2015; 1089(66):485-8。
- 11
陈CS,张D,王YQ,李PM,马FW。套袋对金冠苹果、红冠苹果和皇家嘎拉苹果果皮和果肉酚类物质含量的影响。科幻电影。2012;142(7):68–73.https://doi.org/10.1016/j.scienta.2012.05.001.
- 12
王l,张x,刘y,shi x,王y,zhang c等。水果袋对“奶奶史密斯”苹果的颜色,酚类化合物和调控基因的颜色,酚类化合物和调节基因的影响。EUR FOITE RECONGOL。2013; 237(6):875-85。https://doi.org/10.1007/s00217-013-2055-1.
- 13
冯芳、李明、马芳、程莉。研究了套袋和去袋对苹果果实品质、代谢产物及花青素合成基因表达的影响。科幻电影。2014;165(1):123–31.https://doi.org/10.1016/j.scienta.2013.11.008.
- 14
苹果果皮组织中(E, E)- α -法烯合酶cDNA的克隆及功能表达。足底。2004;219(1):84 - 94。https://doi.org/10.1007/S00425-003-1191-4.
- 15
赵克。“瑞思”苹果果实的未知疾病分析[D]。中国知网:西北农林科技大学;2018.摘要用英语
- 16
[6]李娟。苹果新品种‘瑞雪’专用果袋的筛选[D].北京:中国农业出版社,2009。中国知网:西北农林科技大学;2019.英文文摘
- 17
陈旭,吴庆新,陈泽泽,李特,张泽科,高海杰,等。4个荔枝品种褐变过程中果皮代谢产物谱的变化。《国际食品研究》,2019年;120(6):339–51.https://doi.org/10.1016/j.foodres.2019.02.046.
- 18
橡木P,Deshpande A,Giri A,Gupta V.代谢组动力学在成熟过程中显示出海绵组织紊乱的氧化应激Mangifera籼L.水果。代谢物。2019; 9(11):255。
- 19
罗h,宋j,toivonen p,龚yh,叉菜c,palmer lc等。冷储存期间“氨肥胖”苹果果实的蛋白质组学变化,响应延迟冷却处理。波萨斯匹配Biol Technol。2018; 137(11):66-76。https://doi.org/10.1016/j.postharvbio.2017.11.011.
- 20。
研究了洛伐他汀和1-甲基环丙烯对梨果实表面烫伤生理影响的转录组和代谢变化。“blanquilla”)。如果短杂志2020;49。
- 21。
林森,李建刚,李恩杰。猕猴桃“Jecy绿”果实品质和gc - ms代谢产物图谱的比较:自然和外源乙烯诱导成熟。食品化学。2017;234(11):81 - 92。https://doi.org/10.1016/j.foodchem.2017.04.163.
- 22。
刘立德,曾q,ji qx,刘cf,刘某,刘y。从野生型'newhall'肚脐橙(柑橘Sinensis osbeck cv.dewhall)的水果切割蜡的超微结构和组成比较有光泽的突变体。植物细胞批准。2012; 31(12):2239-46。https://doi.org/10.1007/s00299-012-1333-x.
- 23。
何益智,韩建伟,刘瑞斯,丁义德,王建q,孙莉,等。茉莉酸介导的柑桔蜡缺乏突变体对病原真菌的综合转录组学和代谢组学分析。2018年《霍特决议》;5(1):237–51.
- 24。
张丽,胡锦涛,汉XL,李杰,高y,理查兹C-M等人。高质量的苹果基因组组装揭示了回析隆和红色果子颜色的关联。NAT Communce。2019; 10(1):1494。https://doi.org/10.1038/s41467-019-09518-x.
- 25。
孙海达,高原,安晓丽,蒋晓丽,朴学成,靳美美,等。优化了不定根培养产生黄酮类化合物和三萜的培养基Actinidia Arguta.采用正交设计过程。中国科学院植物研究所,2014;https://doi.org/10.1007/S11240-020-01977.1..
- 26
王YC,瞿光,李海英,吴玉杰,王聪,刘广发,等.柽柳锰超氧化物歧化酶转基因杨树耐盐性的提高。《分子生物学报告》,2009年;37(2):1119–24.
- 27
Aebi h .过氧化氢酶。摘自:编辑伯格迈耶·胡(Bergmeyer HU)酶分析方法。第二版。纽约:学术出版社;1974.p . 673 - 84。https://doi.org/10.1016/B978-0-12-091302-2.50032-3.
- 28
Pütter J。过氧化物酶。作者:Bergmeyer HU,编辑。酶分析方法。第二版,纽约:学术出版社;1974年。685–90.https://doi.org/10.1016/B978-0-12-091302-2.50033-5.
- 29
王XQ,魏泽,马FW。水果袋对红肉苹果中的酚类化合物和调节基因的酚类化合物水平和表达的影响。流程生物化学。2015; 50(11):1774-982。https://doi.org/10.1016/j.procbio.2015.06.024.
- 30.
朱h,陈c,zeng j,yun z,liu yl,qu hx等。MicroRNA528,一种通过靶向单焦度中编码含铜蛋白质的各种基因来调节ROS稳态的轮毂稳压剂。新植物。2019; 225(1):385-99。https://doi.org/10.1111/3/16130.
- 31.
尼古拉B,Brian F,Alice T,Urska V,Luca C,Franco B等人。苹果(Malus x Domestica Borkh)浅表烫伤期间的靶标代谢物和基因转录分析。BMC植物BIOL。2014; 14(1):193。
- 32.
Busatto N,Farneti B,Tadiello A,Vrhovsek U,Cappellin L,Biasioli F等人。乙烯介导的苹果果实浅纹耐药性与不同的代谢过程有关。植物J. 2018; 93(2):270-85。https://doi.org/10.1111/tpj.13774.
- 33
Martins SIFS,Jongen WMF,Boekel Majsv。对食品中美丽反应的综述及对动力学建模的影响。趋势食品SCI技术。2000; 11(9):364-73。https://doi.org/10.1016/s0924-2244(01)00022-x.
- 34
王立杰,李建华,高建杰,冯XX,施ZX,高飞,等。绿原酸对金冠苹果果实褐变的抑制作用。科幻电影。2014;178(10):14–22.https://doi.org/10.1016/j.scienta.2014.07.038..
- 35
植物色素的生物合成:花青素,甜菜素和类胡萝卜素。植物j . 2008; 54(4): 733 - 49。https://doi.org/10.1111/j.1365-313X.2008.03447.x.
- 36
林奕祥,蒋丽丽,陈强,李丽丽,张奕婷,罗勇,等。对红白果肉草莓(Fragaria x ananassa)的转录组比较分析为花青素途径的调控提供了新的视角。植物生理学杂志。2018;59(9):1844-59。https://doi.org/10.1093/pcp/pcy098.
- 37
张XX,张S,杨年,王D,高海。天然巴里酚样三萜类化合物对药物化学贡献的综述。植物化学。2019;161(5):41–74.https://doi.org/10.1016/j.phytochem.2019.01.017.
- 38
Telias A,Bradeen JM,Luby JJ,Hoover EE,Allan AC.苹果果皮花青素积累的调节。霍特牧师。2011;38:357–91.
- 39
方友,萌杰夫,张A,刘建,徐Tf,yu Wl等。山西葡萄园赤霞珠葡萄浆果组成及抗氧化活性萎缩的影响。J SCI食物农业。2011; 91(4):749-57。https://doi.org/10.1002/jsfa.4246.
- 40。
龚英华,宋杰,杜伦,文克维斯特M,帕尔默LC,菲尔莫尔S,等。苹果果实采后漆酶的特性及其对二苯胺和1-甲基环丙烯处理的响应。食品化学。2018;253:314–21.
- 41。
普赛尔一世、罗图伯一世、基豪斯一世、卡波切一世、勒皮涅克一世、德比约恩一世。透明TESTA10编码一种漆酶样酶,参与黄酮类化合物的氧化聚合拟南芥种子的外套。植物细胞。2005;17(11):2966 - 80。https://doi.org/10.1105/tpc.105.035154.
- 42。
Legay S, Guerriero G, Deleruelle A, Lateur M, Evers D, André CM,等。通过rna序列镜头看到的苹果褐变:外果皮细胞壁的强烈改变。中国生物医学工程学报,2015;https://doi.org/10.1007/s11103-015-0303-4.
- 43。
赵Q,Nakashima J,Chen F,Yin Y,Fu C,Yun J,等。在拟南芥中血管发育期间,对于木质素聚合的过氧化物酶是必要和非冗余的。植物细胞。2013; 25(10):3976-87。https://doi.org/10.1105/tpc.113.117770.
- 44。
Lonegan G,Baker WL。真菌漆酶底物的比较研究。Lett苹果microbiol。1995年; 21(1):31-3。https://doi.org/10.1111/j.1472-765X.1995.tb01000.x.
- 45。
二酚氧化酶,酶催化褐变和植物抗病性。生物技术基因工程1998;15(1):457–98.https://doi.org/10.1080/02648725.1998.10647966.
- 46。
波巴A、克斯特恩K、科扎克B、沃吉塔西克W、库尔马A。尖孢镰刀菌侵染激活亚麻萜类生物合成途径的质体分支,导致ABA合成增加。足底。2020;251(2):50.https://doi.org/10.1007/s00425-020-03339-9.
- 47。
天然产物萜烯在自然界中的作用。化学生物学报。2007;3(7):408-14。https://doi.org/10.1038/nchembio.2007.5.
- 48。
哈拉兰皮迪斯K、特洛伊奥斯卡M、奥斯本A-E。植物三萜皂苷的生物合成。生物化学工程生物技术高级。2002;75(2):31–49.https://doi.org/10.1007/3-540-44604-4_2.
- 49。
久保田T、朝日Y、三浦一世、森H。灵芝中两种新的山莨菪碱型苦味三萜&灵芝酸a和b的结构。祝你好运。1982;65(2):611–9.https://doi.org/10.1002/hlca.19820650221.
- 50
班琦、韩妍、孟克、侯丽尔、饶杰平。柿子生长、果实成熟及对丙烯和1-甲基环丙烯反应的β-半乳糖苷酶基因特性研究。植物生长调节。2016;35(4):1025–35.https://doi.org/10.1007/S00344-016-9601-6.
- 51
Sun MX,Peng Ft,小Ys,yu W,张YF,GAO HF。外源性磷脂酰胆碱处理减轻了干旱胁迫并保持了桃中根细胞膜的完整性。SCI Hortic-Amsterdam。2020; 259:108821。https://doi.org/10.1016/j.scienta.2019.108821.
- 52
赵SJ,Shi Ga,Dong XC。植物生理学的实验指导,VOL。55-57。北京:中国农业出版社;2015. p。142-3。(用中文(表达)
- 53
德拉,Angelico R,Macciola V,Ceglie A.多酚酶氧化对初榨橄榄油氧化稳定性的影响。食物res int。2013; 54(2):2001-7。
- 54.
李HS,柳条L。荔枝果皮中的花青素色素。食品科学杂志。1991;56(2):466–8.https://doi.org/10.1111/j.1365-2621.1991.tb05305.x.
- 55.
Andriyani R,Budtiati Ta,Pudjiraharti S.提取方法对Zingiberis Officinale Refiane Zingiberis Revizome的总黄酮,总酚类含量,抗氧化剂和抗菌活性的影响。Proc Chem。2015; 16:149-54。https://doi.org/10.1016/j.proche.2015.12.023.
- 56.
Koyama K,Gotoyamoto N.在不同发展阶段的束阴影影响了“赤霞珠”葡萄的浆果皮中的酚类生物合成。J Amer SoC Hort SCI。2008; 133(6):743-53。https://doi.org/10.21273/JASHS.133.6.743.
- 57
张yz,李下来,程吕。“蜜虫”苹果肉中碳水化合物,有机酸,氨基酸和酚类化合物的发育变化。食品化学。2020; 123:1013-8。
致谢
在编写本手稿期间,我们赞赏TopEdit(www.topeditsci.com)提供的语言援助。我们感谢上海倾省生物科技有限公司(中国上海)提供代谢组织服务。
基金
这项工作得到了国家现代农业产业技术体系建设专项资金(CARS-28)和中国现代农业产业技术研究体系(CARS-27)的支持;西北农林科技大学(2014 YB 086),中央大学基础研究经费(2452020033)。资助者并没有在研究的实验设计、结果分析或手稿撰写中发挥作用,但确实为手稿提供了资金支持。
作者信息
隶属关系
贡献
ZYZ、HW和LLS构思并设计了实验。HW、SW、MMF和SHZ进行了实验。硬件、软件和MMF提供了试剂、材料和数据分析。ZYZ,HW和LLS写了这篇论文。所有作者都已阅读并批准了手稿。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版物
所有作者都同意出版。
利益争夺
作者没有利益冲突要声明。
附加信息
出版商说明
斯普林格自然保持中立,就管辖权的要求,在出版的地图和机构的联系。
补充信息
附加文件1:图S1。
用于筛选不同代谢物的分层聚类图。- 答:BFW-NBF组;B:BFW-BFB组。注意:横坐标表示示例名称,纵坐标表示差分代谢物。从绿色到红色的颜色表明从低到高的代谢物的表达丰度,即Reder表示不同代谢物的表达丰度。
附加文件2:图S2。
收获早期温度和湿度的变化。注意:Abscissa表示日期,主纵坐标轴代表每日最高温度,二次纵坐标轴代表平均相对湿度。Ahtemp表示NBF的每日最高温度;BHTEMP代表了BF的每日最高温度;ahumi代表了Nbf的平均相对湿度;Bhumi代表了BF的平均相对湿度。
附加文件3:表S1。
BFW-NBF组前50名的详细代谢物。
附加文件4:表S2。
BFW-BFB组前50名代谢物详情。
权利和权限
开放存取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王,H.,王,S.,范,MM。等等。代谢解洞穴进入袋装果皮果皮果实的褐变。BMC植物生物学21,209 (2021). https://doi.org/10.1186/s12870-021-02974-y
收到了:
认可的:
发表:
关键词
- 海棠borkh。
- 水果装袋
- “鲁伊·雪”
- 褐变
- 代谢物