- 研究
- 开放获取
- 发布:
通过比较转录组分析揭示苦荞赤霉素途径调控机制(Fagopyrum tataricum.(L.)Gaertn。)矮人突变体
BMC植物生物学体积21,物品编号:206.(2021.)
摘要
背景
苦荞是一种重要的小种作物,具有很高的营养和药用价值,在世界范围内广泛种植。苦荞麦植株高大,茎秆中空,容易倒伏,严重影响产量,阻碍苦荞麦产业的发展。
方法
用甲基磺酸乙酯(EMS)处理黑峰1号种子,获得突变体库。侏儒突变ftdm选自诱变群体,并评估产生矮化表型的农艺特征。进行超快速液相色谱 - 电喷雾电离串联质谱(UFLC-ESI-MS / MS)以确定野生型(WT)与野生型表型以下的因素ftdm植物。另外,通过Hiseq 2000平台进行RNA测序(RNA-SEQ),分析所得转录组数据以鉴定差异表达的基因(DEGS)。单核苷酸多态性(SNP)变体分析显示出与矮主义相关的可能位点。WT和WT与潜在次数的表达水平ftdm然后通过qRT-PCR和每千碱基的转录本每百万mapping reads (FPKM)检测突变体。
结果
植株高度(PH值)ftdm突变体降低至WT的42%,并与WT,突变体和具有较高的断裂力(BF)和较低的住宿指数(Li)进行比较。在茎的茎中检测到较低的GA4和GA7含量和茉莉酸(Ja),水杨酸(SA)和铜卷饼(BR)的较高含量。ftdm与wt相比突变体。外源性天然气无法恢复矮主义ftdm突变体。在转录组分析的基础上,确定了146个纯合SNP基因座。总共有12只具有非纯突变的次数,其被认为是与矮化特征有关的潜在候选基因。当比较表达的八个基因的序列并进行了上调表达的四个基因时,Skip14,仲裁蛋白与拟南芥中Sly1同源的序列为85%的F型蛋白质,呈现了氨基酸变化(从Ser到Asn)并且在茎的较低水平上表达ftdm与wt相比突变体。因此,我们推测SkIP14中的该氨基酸变化导致GA信号转导的破坏,间接地降低了GA含量和下调参与Ga生物合成或GA反应的基因的表达。需要进一步的研究来确定侏儒表型以下的分子基础ftdm突变体。
结论
我们报道了一个苦荞EMS矮化突变体,ftdm,适用于高密度种植和商业养殖。在该过程中检测到GA4和GA7水平的显着降低ftdm突变体,12次表达在茎的茎中ftdm选择突变体作为矮化基因候选体。发现了一个非同义突变SKIP14基因的ftdm突变后,该基因的转录水平较WT低。
背景
鞑靼荞麦(Fagopyrum tataricum.(l)蓼科植物),一种一年生草本作物,在世界范围内种植[1,2].苦荞可以在贫瘠的土壤中生长,适合干旱和半干旱的土地。该物种非常适合在中国偏远山区种植,对潜在的扶贫工作具有重要意义。苦荞含有天然生物活性黄酮类化合物,与普通荞麦相比具有较高的营养和利用价值;此外,后者还含有比前者高出10到100倍的芦丁[3.- - - - - -5].该化合物用作减少血糖,血脂和胆固醇的药物;软化血管;减少毛细血管脆性;并防止皮肤癌和阿尔茨海默病[6,7].
随着工业荞麦产品需求的增加,需要适合机械化收获的荞麦新品种。苦荞麦植株高大,有非常脆的空心茎;因此,这些植物容易倒伏和弯曲,导致收获困难,直接降低产量[8,9].因此,重要的是要通过育种抗衡住宿的更短,更强的植物来提高季后荞麦的产量。
在20世纪60年代,IR8的大规模应用,第一个半矮水稻突变体,大大增加的水稻产量并迎来了农业的绿色革命[10].自20世纪60年代以来,株高(PH)已成为现代作物育种最重要的目标之一,因为研究表明,引入半矮化谷物作物品种可以提高收获指数和产量,部分原因是提高了抗倒伏能力[11].米饭(sd1)和小麦(Rht)矮化突变体以及下密植条件进行,对抗倒伏,和本提高的产率[12,13].植物中患者的机制是复杂的:激素合成,信号转导和基因调节与侏儒有关[14].植物矮化涉及许多解剖和生理变化,如节间长度缩短、节间数目减少、细胞壁或细胞伸长异常、植物激素合成或信号转导的差异等[15,16].通过对植物矮化的深入研究,可以为鉴定调控植物优良性状的基因以及将这些基因应用于分子育种奠定基础。研究表明,植物激素信号通路的改变是矮化的重要原因。降低后的高度(Rht小麦的基因和sd1基因抑制赤霉素(gibberellin, GA)信号转导途径,导致内生赤霉素合成减少。此外,前人研究发现生长素(IAA)、油菜素内酯(BRs)和独角兽内酯(SL)与植物矮化有关[17- - - - - -19].
我们获得了矮人突变线(ftdm)通过大规模筛选乙基甲磺酸盐(EMS)的乙酰甲磺酸盐(EMS)的含有含有Heifeng No.1。通过系统繁殖多年来,突变体(图3)的野生型(WT)至60-80厘米的pH从160℃降至210厘米(图。1).通常,荞麦以行长20cm,在行之间有15厘米。假设〜60,000和〜80,000 wt和dwarf突变体幼苗/ 667米2,分别计算容积率来反映潜在生产力。WT的体积率为0.011(平方米/单个工厂= 667米2/ 60,000),其与0.0083形成鲜明对比(667米2/8万)矮人变种人。这种种植密度和矮秆突变体的抗倒伏性不仅增加了种群的株数,还提高了荞麦潜在产量。矮秆突变体可作为未来矮秆育种的遗传资源,并可用于激素合成、其他代谢途径、细胞学和矮秆形成的分子机制等方面的研究。此外,该矮化突变体的可利用可为促进苦荞产业的发展做出重要贡献。
方法
农艺性状的植物材料,生长条件和测量
以黑峰1号(WT系)为材料构建突变体文库。育种过程如下:1)将1万粒种子在1.2% EMS溶液中浸泡过夜(10-12 h),然后用1% Na中和2S.2O3.5分钟(重复3-5次)。随后将种子在通风罩下干燥,然后立即在该领域播种。2014年,我们收获了M1种子并获得了第一个突变库。然后我们种植了从M2-M6组成所选单独矮线线图书馆的种子。2019年,一种遗传稳定的矮人突变线,ftdm,获得了。之后,ftdm和WT lines were grown in the field at Shanxi Agricultural University’s (northern China, 37°25′N, 112°29′E) experimental station during the summers from 2014 to 2019, and all the agronomic trait data were measured in 2019. One hundred plants from each line were planted in 2 m long rows spaced 0.3 m wide. Ten individuals of both theftdm以野生型株系为对照,测定PH (cm)、IL (cm)、茎粗(SD;mm)、千粒重(1000-GW;g)。播种后43 d PH值(DAS;用公制尺测量了65das(开花期)和145das(成熟期),最小量程为0.01 m。在收获时测定鲜重(FW, g)和根冠比(RS)。
抗倒伏指数和茎秆强度指标的测定
Tarrary Buckwheat的Stem住宿通常发生在较低的间(第三(N3)或第三(N5)来自底部的节间)。根据从植物顶部到顶部的顺序确定的节间数。使用植物数字力量计(YYD-1,Tuopuyunong Co.,Tuopuyunong Co.,China)测量N3和N5节间的断裂力(BF);每个特征都包括五种复制。测试仪的ulcra之间的距离设定为10cm。住宿指数(LI)根据Zhang等人发表的公式计算。[20.]:
细胞组织切片和显微镜
将茎的N3节间切成0.5 cm2在福尔马林-醋酸-酒精(FAA)溶液(5 mL福尔马林,5 mL醋酸,90 mL 70%酒精)中固定过夜的切片。切片在分级乙醇系列(50、70、95和100%)中脱水,然后包埋在石蜡(58-60°C)中。试样在37℃干燥2 ~ 3天后,从预埋块上切下横向和纵向切片。切片随后用0.5% Fast Green (Sigma-Aldrich,上海,中国)在室温下染色30-60秒,然后用显微镜(Olympus,日本)拍摄图像。
RNA提取和RNA测序(RNA-seq)
N3茎节间取自3株植物ftdm和WT个人在盛放,汇集并然后用于RNA提取和RNA-seq的分析。三个独立的生物学重复实验包括了RNA-seq的。使用TRIzol试剂(Invitrogen,USA)提取总RNA,然后用DNA酶I(Thermo Scientific的,USA)处理。S.ix separate cDNA libraries were constructed, each with a 300 bp fragment insert size. Quality control checks for all the libraries were performed with an Agilent 2100 Bioanalyzer system according to the manufacturer’s protocol. The qualified cDNA libraries were ultimately sequenced by an Illumina HiSeq 2000 instrument (Gene Denovo, Guangzhou, China), and 150 bp paired-reads were generated. Clean reads were obtained by removing adapters, reads containing poly-N and low-quality reads, were then mapped to the tartary buckwheat genome (download fromwww.mbkbase.org/pinku1.)使用Hisat2 [21].后映射清洁读取到参考基因组,该基因的表达水平与HTseq定量[22].
单核苷酸多态性(SNP)和功能注释的鉴定
要从RNA-SEQ数据识别SNP,我们使用GATK识别在测序样本和参考基因组之间的单碱基错配作为潜在的SNP基因座。此外,通过爆炸查询这些SNP基因座以识别它们在基因组中的位置,然后使用非冗余核苷酸数据库注释。SNP基因座之间的变化ftdm筛选突变体和WT以确定这些SNP是否是潜在的因果突变。根据以下方案(版本2019)手动进行该筛选,根据以下方案:1)过滤并移除具有读取深度≤10的SNP变化基因座;2)过滤并除去少于三个生物重复的SNP;3)过滤并除去杂合的SNP基因座。纯合的SNP,具有单基变化ftdm突变体和WT用于进一步的因果突变分析。
分析差异表达基因(DEGS)
校正阈值P.- 通过虚假发现率(FDR)(FDR <0.001,|≥1)确定值,以及用于识别DEG的标准跟随先前描述的方法,具有几种修改。所有的DEG都被基因本体(GO)注释术语和基因和基因组(KEGG)途径的京都百科全书进行注释[23,24].当Bonferroni (q值)校正后,GO项和KEGG通路分析结果被认为是显著的P.值≤0.05。富集的KEGG通路使用R软件确定,该软件也用于构建结果的散点图[25].此外,根据GO项和KEGG通路注释的结果,使用与遗传算法合成相关的关键DEGs构建热图。
定量实时PCR(QRT-PCR)分析
来自叶子,花,茎和种子的总RNA样品ftdm利用RNAprep Pure Kit (DP441,天根生物技术,北京,中国)收集并提取突变株和WT植株。每个样本包括三个独立的生物重复。采用One Step PrimeScript™RT-PCR试剂盒(RR064A, Takara Biomedical Technology, Shanghai, China)合成cDNA,进行qRT-PCR分析。利用在线软件(https://www.ncbi.nlm.nih.gov/tools/primerblast/)(表S1).将CDNA稀释100倍以用作QRT-PCR分析的模板。20μl的总反应体积包括8μl稀释的cDNA,2μl的正向和反向引物,以及10μlssbr绿色实时PCR主混合物(FP205,天根Biotech,北京,中国);反应在Bio-Rad CFX96仪器中进行。的组蛋白基因作为对照,对表达值进行归一化处理。用2−ΔΔCt方法。
确定内源性植物激素和芦丁含量的测定
对于ftdm和WT系,从N3间收集的0.5g新鲜干草组织被研磨成使用液氮的细粉,砂浆和杵。从三种单独的生物复制中收集样品,并称重至0.1g以进行萃取。将所有样品用750μl冷萃取缓冲液(80%甲醇:19%水:1%乙酸(V:V:V),高效液相色谱(HPLC级),在1.5ml管中,高效液相色谱法。缓冲液对于第一种处理,补充了内部标准。使用超快速液相色谱 - 电喷雾电离串联质谱法定量了植物激素,包括IAA,细胞素,GA,BRS,茉莉酸(JA)和水杨酸(SA)(UFLC-esi-MS / MS)仪器配备自动进样器(水域,ACQUITY,USA),并在三舒生物技术公司(中国上海)的工作人员进行。
采用高效液相色谱法对芦丁含量进行分析。26].简而言之,来自wt和wt的大约0.2g茎组织ftdm线条被冻结在液氮中,然后用研磨机研磨成细粉。然后将粉末加入1 mL甲醇中,浸泡30 min,在50℃超声提取。在12,000×g离心10分钟后,取上清液,转移到HPLC瓶中。HPLC分析采用C18柱(150 mm×4.6 mm,5μm)。流动相由甲醇:H组成2O(46:54),芦丁在257nm处的保留时间为4.9±0.5 min。芦丁含量测定采用标准曲线(图。S1).每种样品分析三种生物重复,并通过最终的3000多种HPLC系统(Thermo Scientific,USA)分析所有样品。
外生GA治疗
用20日龄的幼苗来研究野生型和野生型之间GA反应的差异ftdm用GA4处理后的线(G8920,Solarbio Life Sciences,北京,中国)或与H治疗2o只有。每7天用10μm的GA4 + 7喷洒三种植物。wt和wt的高度ftdm分别在喷施后8 d、10 d和14 d进行植株测定。在同一组植株上喷洒H2o,用作控制。
系统发育树的序列分析与构建
的烦恼(FtPinG0009116500.01)序列通过DNAMAN版本12软件分析。通过国家生物技术信息中心(NCBI)服务器对同源蛋白和保守的FLY域进行BLAST搜索。系统发育分析采用MEGA version 6软件,基于最大似然法[27,28].
结果
比较的表型特征ftdm突变体和WT植物
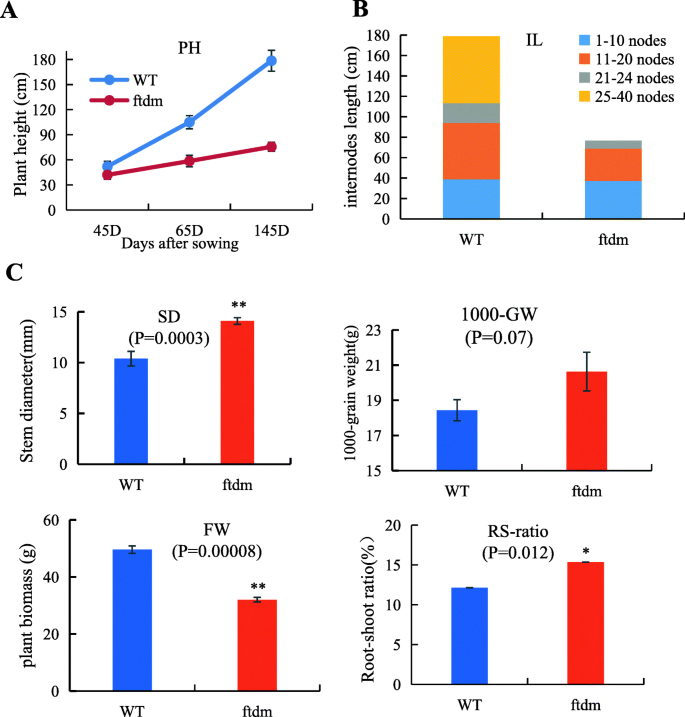
为了了解植物在不同发育阶段的生长规律,研究了植物的高度ftdm在三个不同的时间点测量WT植物。与WT植物相比,ftdm植物从43 das到145 das生长缓慢。在145 das,平均高度ftdmWT植株的平均身高为178±12.77 cm。的ftdm突变体比wt短约42%(图。2a)。所有干细节的总长度ftdmWT植物的差异与总体PH测量值的差异类似。WT植株主茎节40个;然而,只有24个ftdm植物。第11 ~ 20节间的长度差异显著ftdm突变体和wt(图。2b),与那些相比ftdm突变体(SD为14.09±0.33mm),WT的茎(SD为10.39±0.72mm)显着稀释(P< 0.01)。FW和RS比在ftdm突变体和wt。令人惊讶的是,与WT的相比,1000 GW的比较ftdm突变体(20.6g)略高,但这没有显着差异(图。2c)。
评估细胞尺寸和耐盖抗性
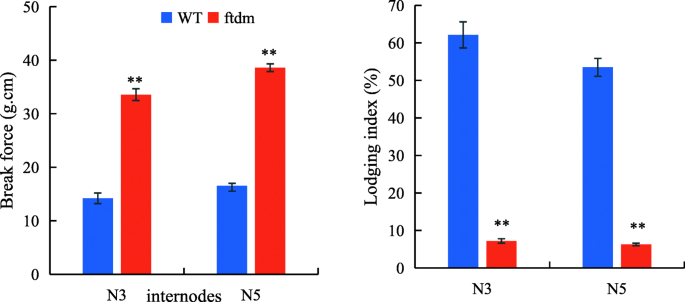
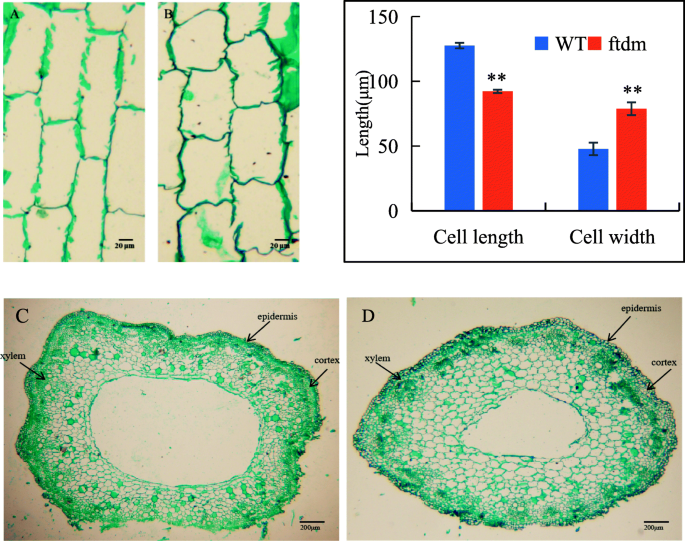
李ftdm突变体显着低于WT的突变体,而BFftdm突变体则更高(图。3.).在N3和N5节间,与WT相比,BFftdm突变体分别为150.4和133%;相比之下,李ftdm突变体为88.39%(N3)和88.27%(N5)降低。总体而言,茎细胞壁ftdm突变体比WT更厚,空腔更小,细胞长度和宽度都在一定程度上比WT更短更宽(图2)。4).干细胞长度和宽度,细胞壁厚度和中空腔宽度显着不同ftdm突变体和WT (P< 0.01)。野生型干细胞的长度和宽度分别为127.6±2.15 μm和47.8±1.33 μmftdm突变体分别为92.2±4.8μm和78.8±4.96μm。
内源激素谱、GA反应和芦丁含量
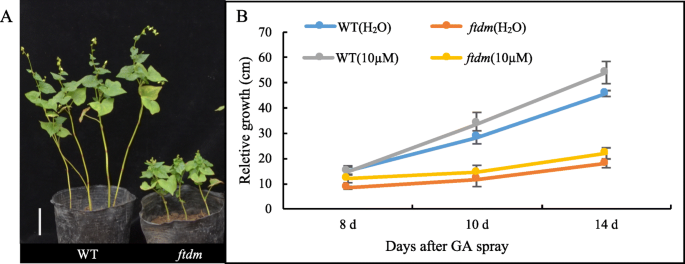
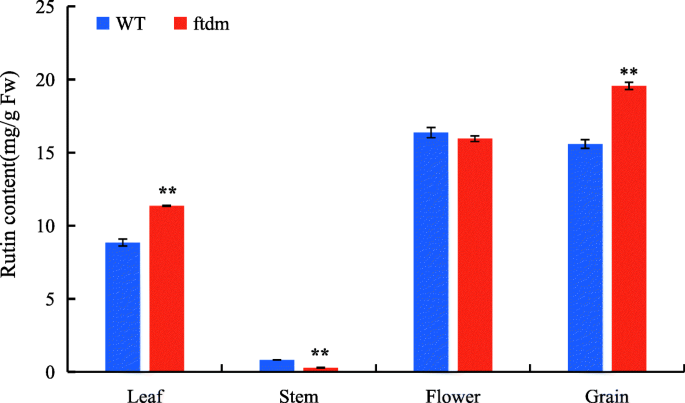
为了探讨植物激素在pH的可能作用和矮种突变体的茎伸长,15种植物甾酮均合格和量化。就西区胰岛素而言,两种植物类型之间的反式酶,2-IP和2-IPA的含量没有显着差异。Zeepin含量(15.20 ng / g fw)显着高于ftdm突变比在wt(P < 0.05). With respect to the four bioactive GAs, the contents of both GA4 (0.03 ng/g FW) inftdm显著低于野生型(0.14 ng/g FW)。GA7中含量为0.03 ng/g FWftdm显著低于野生型(0.25 ng/g FW)。而JA、JA- leu和SA含量则显著高于对照ftdm突变体的茉莉酸甲酯(Me-JA)含量显著低于野生型ftdm突变体(P < 0.01; Table1).此外,与H2只有O处理,外源性GA4 + 7处理ftdm突变体和wt导致pH值ftdm突变体改变很少。在同一阶段,WT植株明显比突变植株高,但它们对GA4 + 7的反应也非常小(图4 + 7)。5).在不同组织中分析了芦丁含量ftdm和WT植物。我们发现芦丁的浓度很低ftdm与WT相比突变体,但花组织中的芦丁含量没有显着差异。令人惊讶的是,叶片和谷物中的芦丁含量ftdm突变体(11.36和19.56 mg/g FW)分别是WT的1.28和1.25倍。6).
RNA-SEQ数据的质量评估及样品的相关分析
关于六个样品的RNA-SEQ数据,其中包括WT(WT-1,WT-2和WT-3)的三个生物学重复的数据,Q20的范围为96.60至97.68%,最小值Q30绝不小于90.81%,GC含量范围为45.57至46.15%。Q20的ftdm突变体(ftdm-1,ftdm-2,和ftdm-3)范围为97.55 ~ 97.66%,最小Q30值从不低于92.76%,GC含量范围为45.73 ~ 45.81%,表明测序数据质量较好(表2)S2).总体而言,数据表明了相似样本之间的强度再现性,但在WT和WT之间显示出大的差异ftdm行(无花果。S2).
DEGs的KEGG富集分析
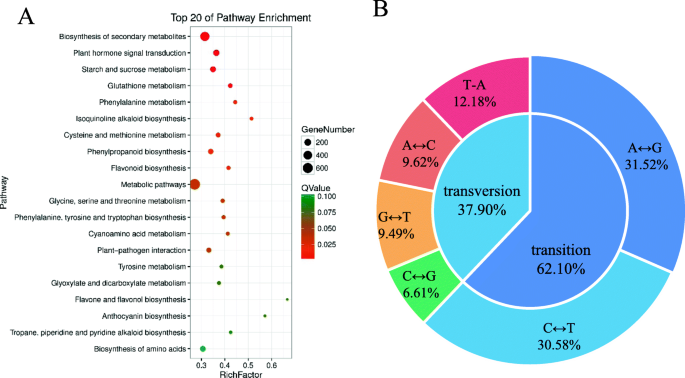
以RNA-seq数据为基础,探讨两种基因在特定生物学途径相关基因表达方面的潜在差异ftdm突变体和WT共鉴定出1614个DEGs,并定位到129个KEGG通路上。20条KEGG通路显著富集(图。7a)及列于表中S3.第一个主要的富集KEGG途径是次生代谢产物的生物合成,共涉及454个DEGs,占总DEGs的28.13%。其次为植物激素信号转导、淀粉和蔗糖代谢、苯丙类生物合成和氨基酸生物合成,分别占总deg的8.67、7.06、5.27和6.01%。
通过比较转录组数据确定的SNP位点
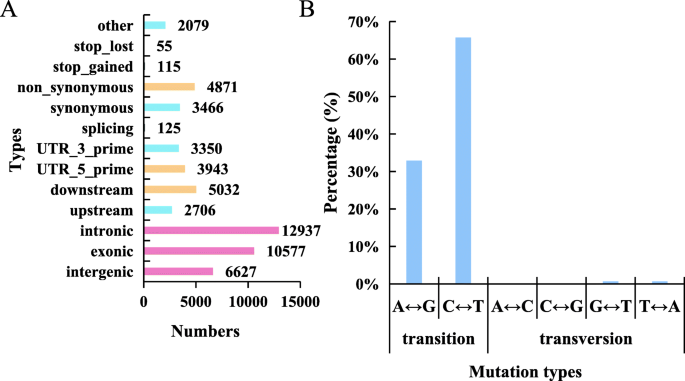
总共通过RNA-SEQ数据和参考基因组的比较鉴定了28,008个SNP基因座。具体地,检测17,393个SNP过渡部位和10,615个SNP转化位点,分别占总SNP的62.1和37.9%。SNP过渡部位的数量大于横向位点的数量大于1.63倍(图。7b)。另外,在这些SNP变异中,C-TO-G转变的比例最低,占占的6.61%。总共有12,937个SNP,位于内含子区,占28.12%,其频率明显高于其他类型。另外,10,577,6627和5032个SNP分别位于外显子,非基区和基因下游区域中。在这些SNP中,检测到4871个非同义词和3466个同义突变(图。8a)。
最后,通过手动过滤检测到的SNP,通过比较来识别146个纯合SNP基因座的突变ftdm突变体和wt。SNP过渡站点占总数的98.63%。共有48〜至G和96个C-TO-T转化,分别占总纯合子SNP的32.88%和65.75%。另外,剩余的1.37%的SNP基因座包含G-TO-T和T-TO-A转变突变。检测到涉及A至C或C至G的过渡(图。8b)。这些纯合的SNP涉及101个非纯突变,三个终止密码子和42个同义突变。
矮秆性状相关候选基因的预测与鉴定
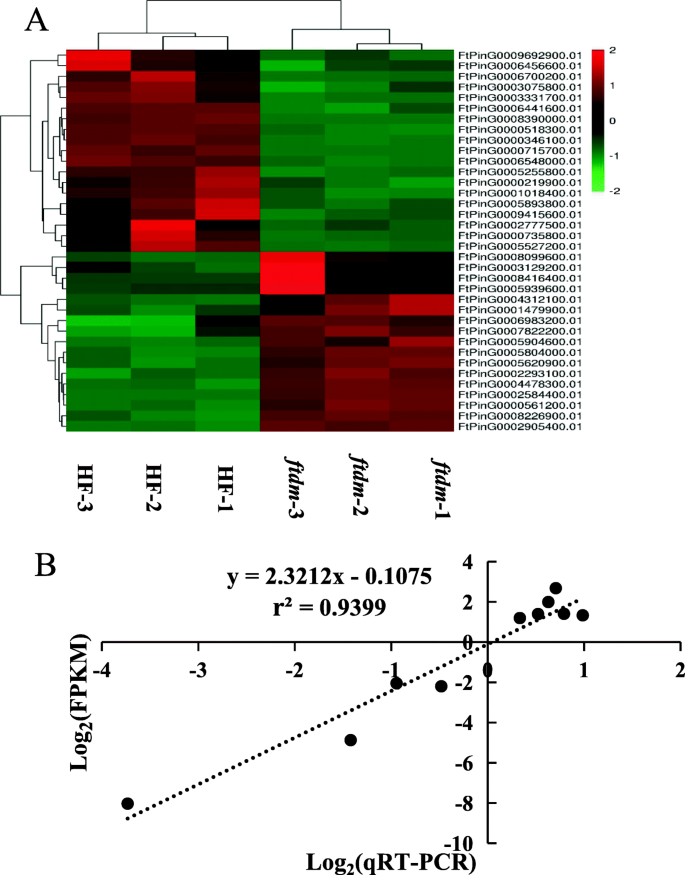
为了鉴定与侏儒性状有关的候选基因,评估了涉及非纯突变的纯合SNP,以分析它们对差动表达的影响ftdm共发现12个具有非同义SNPs的deg,其中8个表达下调,4个表达上调ftdm突变体,但不在WT中(图。9a)。这些DEG中的突变类型包括九个C-TO-T和三个G-TO-A转变。这些DEG的功能注释表明,分子函数有七种基因,三种基因参与细胞组分,以及生物过程中的一种基因。这些基因被命名为GPAT8,WAT1,SkIP14,Pub 30,CIPK14,Med15a,Chup1,str4,Ss1,Zfp1,ABCG21和UGT92J1,并在UniProt蛋白注释信息的基础上预测其同源/功能(表S4).
这12个候选基因在茎组织中的表达水平ftdm突变体和WT,通过qRT-PCR确定,与RNA-seq分析的结果强相关(R2 = 0.9399) and the DEG analysis (Fig.9b)。
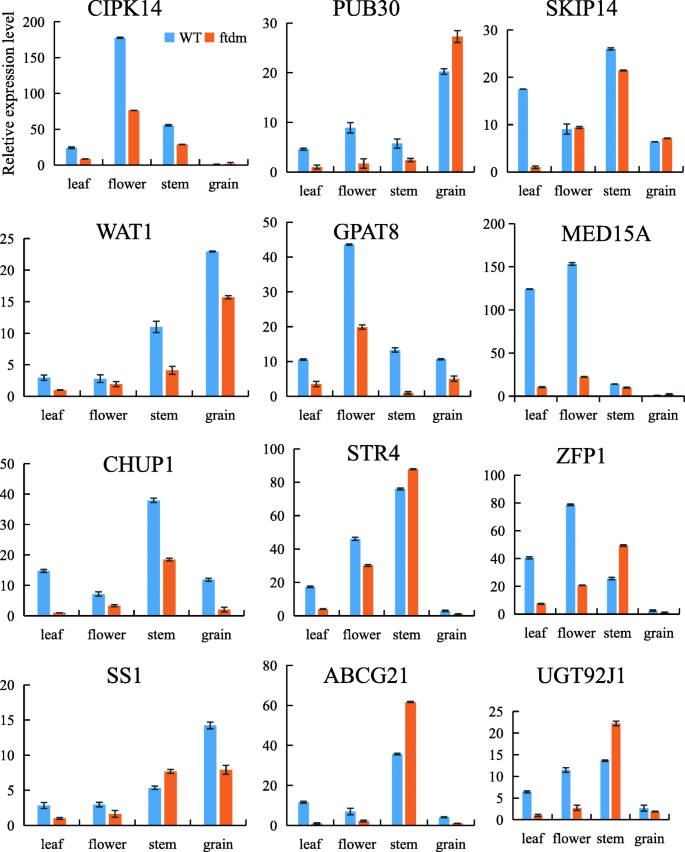
单核苷酸多态性在叶、花组织、茎和谷粒中的组织特异性表达ftdm突变体和WT进一步分析。数据显示,SKIP14、CHUP1、STR4、ABCG21和UGT92J1基因在茎中的表达量显著高于其他组织。CIPK14、GPAT8、ZFP1和MED15A在花器官中的表达量高于其他器官。同样,PUB30、WAT1和SS1在谷粒中的表达量也高于其他组织(图3)。10).我们注意到skip14在茎中的特异性表达以及在茎中的相对表达量ftdm突变体比wt中的突变体低4.48倍。
选择基因在不同wt和的表达ftdm组织,测量通过QRT-PCR。CIPK 14:CBL相互作用丝氨酸/苏氨酸 - 蛋白激酶14;酒吧30:含有U字箱结构域的蛋白质30样;Skip14:F-Box蛋白,Skip14;Wat1:墙壁薄1状;GPAT8:甘油-3-磷酸酰基转移酶8;Med15a:RNA聚合酶II转录亚基15的介体;Chup1:蛋白Chup1,叶片同种型X1;str4:含罗丹种含域的蛋白质4;ZFP1:含锌CCCH域域1; SS1: starch synthase 1; ABCG21: ABC_tran domain-containing protein/ABC2_membrane domain-containing protein; UGT92J1: glycosyltransferase UGT92J1
与GA合成途径相关的基因序列特征和基因的表达模式
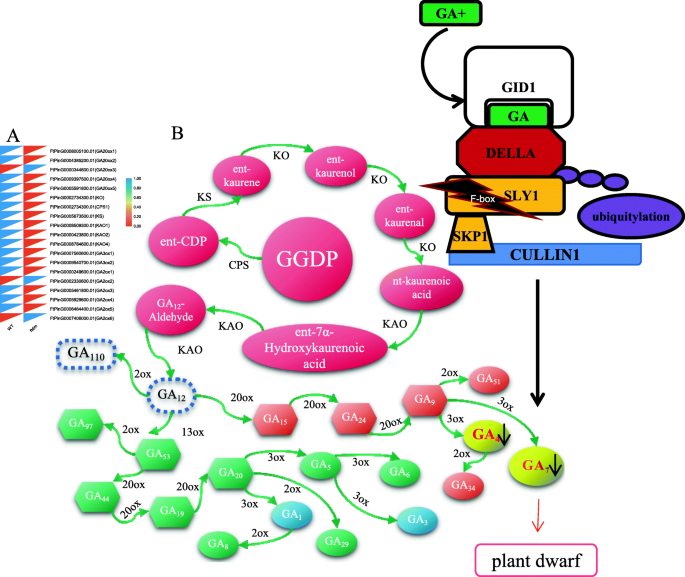
我们检测涉及丝氨酸在WT的变化连接到Asn的氨基酸突变ftdm突变体位于SKIP14的GGL保守域内。通过系统发育分析,我们发现SKIP14 (FtPinG0009116500.01)与at斯莱1、bn斯莱1、HaSLY1、lj斯莱1、ZmGID2和OsGID2根据同源性聚在一起(图2)。11a). SKIP14推断的蛋白序列显示了类似的保守结构域,包括F-box、GGL和LSL结构域,这些结构域与其他物种的相关蛋白具有同源性(图2)。11b).这些结果表明苦荞中的SKIP14编码一个F-box蛋白,该蛋白是ASK-cullin-F-box (SCF) E3泛素连接酶复合物的组成部分,可能具有与拟南芥中斯莱1相似的功能。基于序列同源性,该基因可能负责DELLA蛋白的泛素化和随后的蛋白酶体降解,控制GA应答信号。
从转录组学数据中鉴定了19个参与GA合成途径的基因,其中16个在茎中以较低水平表达ftdm突变体与WT相比(图。12a)。这些基因的较低表达水平可能导致GA4 + GA7含量的降低ftdm突变体。此外,在蛇纤维14和GA生物合成相关基因中观察到协调表达趋势ftdm突变体(图。12b)。
GA生物合成途径相关基因的表达水平(A.)和F-box基因调控矮化的模型ftdm突变体(B.).GGDP:二磷酸二磷酸二磷酸酯;CPS:Ent-copalyldiphosphate合酶;KS:Ent-Kaurene合成酶;KO:Ent-Kaurene氧化酶;Kao:Entkaureno酸氧化酶;20ox:Ga 20-氧化酶;3ox:Ga 3-氧化酶;2ox:Ga 2-氧化酶;GID:胃泌盐素受体蛋白; SLY: SLEEPY. The black arrow indicates a decrease in the contents of GA4 and GA7. The black asterisk indicates the mutation detected in the F-box protein SKIP14
讨论
抗倒伏性的评价ftdm突变体和WT
我们通过从EMS诱变的人群中进行选择来确定一颗季后荞麦矮人突变体。在上个世纪,侏儒和半侏儒小麦和水稻突变体的成功应用大大增加了作物产量,从而改善了亚洲的食物供应[12,29- - - - - -31].随着人口的增加和可用耕地的减少,人们越来越重视小型作物物种,以提高粮食供应的多样性,应对气候变化和粮食危机。苦荞麦是我国重要的小种,是我国粮食灾害防治的常用作物。尽管苦荞的重要性,很少有研究是通过降低PH来提高产量。
PH、SD、茎秆BF和作物生物量与抗倒伏能力密切相关[32,33].由于鞑靼荞麦的高度和分支特征,收获期间的住宿是一个非常严重的问题,防止这种作物物种的经济发展。Shimizu确定了Tartary Buckwheat的两个半矮种基因(SDA和SDB)[34],并培育出半矮秆品种Darumadattan,其高度由单核隐性基因sdA控制[35].我们评估了矮种突变体的封闭性抗性ftdm,它来自EMS诱变。以前的研究评估了季节性荞麦四种基因型的抗衰性;结果表明,Li与木质素含量,BF和血管束数显着呈负相关[9].另一项研究表明,抗倒伏能力与SD和茎长显著相关[36].结果表明,矮化突变体的抗倒伏能力高于野生型,这主要是由于矮化突变体的株高降低了42%,SD增加了。2,3.).在细胞学证据的基础上,我们发现较短且较厚的茎ftdm突变体与野生型相比,是由于该器官中的细胞更大。周(37]研究371鞑靼主要农艺性状荞麦加入和发现高度,1000-GW,和单株粒重是影响产量的重要组件。我们的研究结果表明,较短的高度和更厚的SD可以提高鞑靼荞麦耐倒伏。不过,与WT相比,ftdm突变体没有显著降低1000-GW或其他主要产量性状。鉴于这些结果,我们推测,与WT相比,ftdm突变体具有增产潜力,适合机械化收获。
ftdm是芦丁含量增加的ga不敏感矮化突变体吗
植物激素是影响植物生长、发育和应激反应的关键调节剂[38].气,包括GA1,GA3,GA4和GA7,包括大量激素组和在水稻不同的发展阶段[已经检测到39].GA信号转导的当前分子模型可以概括如下:在没有GA合成的情况下,Della蛋白积聚并抑制GA信号响应,从而抑制植物生长;在足够的Ga合成或外源Ga诱导的条件下,Ga结合受体GID1刺激Ga-GID1-della蛋白复合物的形成,之后遍布复合物的F箱蛋白。随后通过26s蛋白酶降解Della蛋白以释放由Della蛋白调节的生长抑制,并引发GA信号转导响应[40].最新研究表明,通过集群,定期间隙,短文重复(CRISPR)/ CRISPR相关的9(CAS9)技术,编辑番茄Della蛋白的活性结构域可以增强Della蛋白的稳定性;然后使Della蛋白的降解被阻断,导致Ga - 不敏感函数矮种突变体,并用作人工产生矮种突变体的手段[41].在我们的研究中,在燃气方面,只有GA4和GA7含量均在矮秆突变体比WT显著降低。治疗ftdm外源GAs突变体不能恢复WT PH表型。这些结果表明ftdm突变体无法强烈反应GA4和GA7.然而,这并不能解释GA生物合成相关基因的低表达(图。12或茎中GA4和GA7含量较低ftdm突变体与WT比较(表1).此外,与wt的那些,茎的植物血型型曲线相比ftdm突变体玉米素、JAs(除Me-JA外)和SA含量显著升高。综上所述,这些发现可能最好的解释是突变体中影响不止一种激素的激素信号和反馈调节的改变。突变体中玉米素、JA和SA含量的升高可能会上调其他基因的表达,如参与次级代谢和应激反应的基因。
之前我们发现SA和Me-JA处理可以提高苦荞叶片中的芦丁含量[26,42].苦荞麦叶片和籽粒中芦丁含量显著高于苦荞麦ftdm突变比wt。可能的解释是,茎中的内源SA含量增加可以诱导芦丁合成,然后将其通过血管组织传送到叶子和晶粒。BR缺席了茎ftdm这可以解释矮化突变体株高降低、分枝数减少的原因。朱(43]发现BR受体基因沉默的转基因番茄植株BR含量降低,表现出矮化表型。考虑不同激素之间的相互作用也很重要;特别是,GAs的调节因子DELLA蛋白的失活,抑制BR受体,调节体内BR含量[44].
F-box蛋白可能是矮化表型相关的关键候选基因ftdm突变体
根据我们最近的研究,杂交种群ftdm突变体(♀)和黑峰1号♂。对F2代的后代分离率进行了研究,结果与经典的3:1孟德尔比值一致。因此,我们推测导致植株矮化的基因可能是由一个隐性单基因控制的(数据未发表)。我们发现,16个参与GA合成途径的基因的表达水平显著降低ftdm突变比wt。这些基因的表达模式与关于GA缺乏的结果一致。然而,我们通过转录组测序分析没有发现这些基因中的任何核苷酸序列突变。我们搜索了与高度和GA信号相关的基因功能可能损失的迹象,并且可能与矮化表型有关.通过SNP变异分析,我们鉴定了12个具有非同义突变的基因,并发现一些基因在茎中以较低水平表达ftdm与wt相比突变体。Wat1,Skip14和UGT92J1特定于茎ftdm突变体中SKIP14的表达水平低于野生型。与野生型相比,拟南芥中SKIP14的表达水平低于野生型Wat1.突变体的茎较短,积累了大量的黄酮醇和黄酮醇苷WAT1基因负责控制木质素和黄酮类化合物的纤维中的二级壁发育[45].SKIP14编码一个F-box蛋白,该蛋白与拟南芥中的SLY1高度同源。SKIP14是SCF E3泛素连接酶复合物的组成部分,可能介导DELLA蛋白的泛素化和随后的降解。在SKIP14中检测到的SNP可能表明DELLA蛋白不能被降解;这一现象可能会抑制GA的合成或在体内的信号转导,并可能导致GA不敏感的矮化表型。因此,我们推测SKIP14可能是调控赤霉素GA反应的关键候选基因ftdm突变体,虽然目前,没有直接证据证明Skip14中的突变改变其功能。
也有可能不止一个基因负责矮化表型。例如,较高的芦丁和黄酮醇苷积累在ftdm突变体与WT相比,也可能与WAT1表达下调有关。ABCG21参与IAA运输和环境应激反应[46]和植物的茎作为增长和发展的一个重要的调节[47].先前的报告显示CIPK14与钙碱B样蛋白(CBL)相互作用,并控制拟南芥中的葡萄糖信号。在烟草中,ATZFP10基因的过表达导致矮化表型,异常叶表型和早期开花。在我们的研究中,对ATZFP10高度同源的ZFP1的表达水平被上调在茎中ftdm突变体,其现象可能与矮化表型有关。矮秆性状的主要调控基因,以及利用QTL分析和基因工程验证该基因的功能,尚需进一步研究。
结论
通过对苦荞麦EMS突变体群体的筛选,鉴定出苦荞麦矮化突变系。检测到几个点突变的差异表达候选矮化基因,包括FtSKIP14的F-box结构域的单个氨基酸突变。内源GA4 + 7含量显著降低ftdm与wt相比突变体.本研究首次建立了苦荞矮化系,并对苦荞矮化机制进行了研究。
数据和材料的可用性
支持本文结果的所有数据集包含在文章及其补充信息中。
改变历史
2021年5月28日
参考资料
- 1.
Tsuji K,Ohnishi O.栽培鞑靼荞麦的起源(Fagopyrum tataricum.Gaertn。)通过RAPD分析揭示。遗传资源庄稼EV。2000; 47(4):431-8。
- 2.
周ml。荞麦种质在世界第二世界概述了世界上荞麦资源。2018. p。1-7。
- 3.
KREFT I,Fabjan N,Yasumoto K.荞麦芦丁含量(Fagopyrum esculentum Moench)食品和产品。食品化学。2006; 98(3):508-12。
- 4.
蒋鹏,Burczynski F, Campbell C, Pierce G,奥地利JA, Briggs CJ。三种荞麦中芦丁和类黄酮的含量fagopyrum esculentum,F. tataricum,和f . homotropicum以及对脂质过氧化的保护作用。食品科学进展。2007;40(3):356-64。
- 5.
Borovaya SA, Klykov AG。荞麦类黄酮生物合成与积累的几个方面。植物生物工程2020;14(22):213-25。
- 6。
Stokić E, Mandić A, Sakač M, Mišan A, Pestorić M, Šimurina O,等。富荞麦面包的品质及其对他汀类药物治疗患者的降血脂作用。食品科学技术。2015;63:556-61。
- 7。
Habtemariam S. Rutin作为阿尔茨海默病的自然治疗:洞察其行动机制。Curr Med Chem。2016; 23:860-73。
- 8。
Hagiwara M,Izusawa H,Inoue N,Matano T.滴落在季后遇荞麦中拍摄增长特征的品种差异。Fagopyrum。1999年; 16:67-72。
- 9。
王C,Ruan Rw,元Xh,Hu D,Yang H,Lin Tt,等。解剖结构与木质素代谢与荞麦中秆耐腐蚀性的关系。Acta Agron Sin。2014; 40(10):1846-56。
- 10.
作者单位:田中勇,刘志强,刘志强,等。绿色革命:水稻赤霉素合成基因的突变体。大自然。2002;416(6882):701 - 2。
- 11.
Hedden P.构建矮米饭。NAT BIOTECHNOL。2003; 21(8):873-4。https://doi.org/10.1038/nbt0803-873.
- 12.
Spielmeyer W, Ellis MH, Chandler PM。半矮化水稻(sd-1),“绿色革命”水稻,含有缺陷的赤霉素20氧化酶基因。美国国家科学院学报。2002; 99(13): 9043 - 8。
- 13.
皮尔斯S,萨维尔R,沃恩SP,钱德勒PM,WILLHELM EP,火花CA,等人。托马斯的分子特征rht-1六倍体小麦的矮化基因。植物理性。2011; 157(4):1820-31。
- 14.
王Y,Xiao X,Wang XL,Zeng J,Kang Hy,Fan X等。RNA-SEQ和ITRAQ揭示了矮人波兰小麦的矮化机制(Triticum polonicuml .)。国际生物学杂志。2016;12(6):653-66。
- 15.
Wang T, Liu L, Wang XJ, Liang LX, Yue JJ, Li LB. Comparative analysis of解剖结构、激素水平和基因表达谱揭示生荫竹矮化的潜在机制Phyllostachys Edulis F.tubaeformis.).中华医学杂志。2018;19(6):1697。
- 16.
Lan J,Lin QB,周Cl,Ren Yk,Liu X,Miao R等人。小谷物和半矮星,衣服转录因子,通过稳定水稻SLR1表达来负调节植物高度和粒度。植物mol biol。2020; 104(4-5):429-50。
- 17。
赵波,王波,李振华,郭涛,赵建文,管志林,等。一个新的矮秆基因座的鉴定与鉴定DS-4编码Aux/IAA7蛋白芸苔属植物显著.Al Appl Genet。2019; 132(5):1435-49。
- 18。
Adedze Ymn,Wei Xj,Sheng Zh,Jiao Ga,Tang Sq,Hu PS。米饭的特征矮人和窄叶2突变体。医学杂志。2016;61(1):1 - 10。
- 19。
Yao Rf,Wang L,Li Yw,Chen L,Li Sh,Du XX等。米矮人14作为股骨内酯的非传统激素受体。J Exp Bot。2018; 69(9):2355-65。
- 20。
张文杰,吴丽伟,吴晓荣,丁艳峰,李光华,李建勇,等。粳稻抗倒伏性(奥雅萨苜蓿(L.):追施氮肥引起的形态和解剖特征。大米。2016;31。
- 21.
Pertea M, Kim D, Pertea GM, Leek JT, Salzberg SL. HISAT、StringTie和Ballgown RNA-seq实验的转录水平表达分析。Nat Protoc。2016;11(9):1650 - 67。
- 22.
Anders S. Htseq:用Python分析高吞吐量排序数据。(HTSEQ);2010年。
- 23.
Ashburner M,Ball Ca,Blake Ja,Botstein D,Butler H,Cherry JM等。基因本体:生物学统一的工具。NAT Genet。2000; 25(1):25-9。
- 24.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M. KEGG资源解码的基因组。核酸学报2004;32:277-80。
- 25.
谢C,毛XZ,黄杰,丁y,吴杰,董某等。Kobas 2.0:用于注释和鉴定富集途径和疾病的Web服务器。核酸RES。2011; 39:316-22。
- 26.
孙泽勋,侯淑英,杨卫东,韩永华。外源水杨酸增加了芦丁的积累,影响了芦丁生物合成相关基因的表达模式Fagopyrum tartaricum盖恩叶。植物生长调节。2012; 68(1):9-15。
- 27.
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物医学进展。2011;28(10):2731-9。
- 28.
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 29。
Hedden P.绿色革命的基因。趋势类型。2003; 19:5-9。
- 30.
Xiong HC,Guo Hj,谢yd,Zhao Ls,Gu Jy,Zhao Sr等。增强患有诱导诱变诱变的高产潜力的矮小麦种质。植物类型resour-c。2016; 16:74-81。
- 31。
杜y,chen l,王y,杨z,saeed i,daoura bg等。矮化基因的组合rht4.和rht8.降低植物高度,提高雨量面包小麦的产量性状(Triticum aestivum.l .)。现场裁剪。2018; 215:149-55。
- 32。
李东升,张玉强,朱少森,胡xx, bhanbro LB,等。水稻抗倒伏性状的有利等位基因挖掘(栽培稻)通过关联映射。Planta。2018; 248(1):155-69。
- 33.
周R,王XZ,陈HF,张XJ,Wu JS。大豆中QTL分析及相关性状。Acta Agron Sin。2009; 35(1):57-65。
- 34.
Morishita T, Mukasa Y, Suzuki T, Shimizu A, Yamaguchi H, Degi K, et al.。苦荞半矮化突变体的特征与遗传Fagopyrum tataricum.伽玛射线和离子束辐照诱导的。繁殖研究》2010;12(2):39-43。
- 35.
Shimizu A,Yamaguchi H,Degi K,Morishita T. Darumadattan',一个使用伽马射线照射的Semidwarf抗性抗耳果荞麦品种。品种sci。2020; 70(5):623-30。
- 36.
向东,宋勇,吴强,马春荣,赵建林,万勇,等。苦荞茎秆性状与抗倒伏性的关系(Fagopyrum tataricum.).植物刺激科学。2019; 22(2):202-10。
- 37.
周D.分析塔特拉里荞麦资源的主要农艺性状和黄酮类化合物含量变化:西北A&F大学;2016年。
- 38.
王志强,王志强。植物抗逆性和抗逆性的研究进展。植物学报。2011;14(3):290-5。
- 39.
Camilo LC, Xavier S, Olga J, Salvador N, Marta LC。水稻激素谱分析方法:GA20ox突变对粳稻品种赤霉素含量的影响植物学报。2019;10:773。
- 40。
太阳TP。的Molecular Mechanism and Evolution of the GA–GID1–DELLA Signaling Module in Plants. Curr Biol. 2011;21 (9):338-45
- 41。
杨勇,杨志勇,杨志勇。利用crispr/cas9基因组编辑技术构建番茄赤霉素响应显性矮della等位基因。生物技术学报2018;17(1)。
- 42。
侯Sy,Sun ZX,Linghu B,王Yg,Huang Ks,Xu DM等。荞麦菌荞麦植物再生和外源激素对芦丁含量和芦丁生物合成基因表达的影响。植物细胞组织org。2015; 120(3):1159-67。
- 43。
朱思宫,梁立清,陈庚,唐,田某,胡泽。番茄SLBRI1沉默分离芸苔类固醇受体基因和矮化植物的重新色谱。植物生长调节。2019; 89(1):59-71。
- 44。
Ross JJ, Quittenden LJ。油菜素内酯与赤霉素的相互作用:合成还是信号传导?植物细胞。2016;28(4):829 - 32。
- 45.
Ranocha p,denancén,vanholme r,freydier a,martinez y,hoffmann l等。墙壁是薄1(WAT1),拟南芥Headago Truncatula Nodulin21的同源物,是纤维中的二次壁形成所需的铜绿素局部化蛋白。工厂J.2010; 63(3):469-83。
- 46.
Titapiwatanakun B,Murphy As。转录型转录蛋白:细胞贩运,蛋白质磷酸化,蛋白质成熟,泛素化和膜组合物。J Exp Bot。2009; 60(4):1093-107。
- 47.
意图。植物atp结合盒转运体。植物学报。2007;58(1):347-75。
致谢
我们要感谢英国诺丁汉大学唐纳德格尔德教授,讨论和帮助稿件。
资金
这项工作得到了中国国家重点研发计划(2017年FFE0117600)的支持;NSFC(32070365);山西省大学顶级奖项项目(2019KJ020);山西农业科学院(YGC2019FZ2),山西青年科技研究基金(201801D221296)与中国农业研究体系(CARS-07-A-2)的应用基础研究计划。
作者信息
隶属关系
贡献
ZS和SH构思和设计了实验。ZS和RL写了稿件。XW,RL,WD和MM执行了实验并分析了数据。YH,LL,HL和SH管理该项目。yh和sh修改了稿件。所有作者都读过并提供了最终批准的出版物。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者声明他们在这篇论文中没有利益冲突。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
本文的原始在线版本已修订:作者在作者的关系中确定了一个错误。赵雪孙,泗宇侯和袁华汉也隶属于3.山西小型作物种质创新与分子育种重点实验室,太原,030031,中国山西030031。明川马和龙龙刘是4.山西农业大学农业遗传资源研究中心,太原,030031,中国山西030031。
补充信息
附加文件1:图S1。
芦丁的峰面积(a)和标准曲线(b),通过HPLC测定。
附加文件2:图S2。
热图显示了WT和WT之间的示例性相关性ftdm突变体。所有的样本都涉及三次生物复制。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于在这篇文章中提供的数据,除非在信用额度的数据另有说明。
关于这篇文章
引用这篇文章
孙众,王旭东,刘锐。et al。通过比较转录组分析揭示苦荞赤霉素途径调控机制(Fagopyrum tataricum.(L.)Gaertn。)矮人突变体。BMC植物杂志21日,206(2021)。https://doi.org/10.1186/s12870-021-02978-8
收到:
接受:
发表:
关键字
- 苦荞麦
- 矮人突变体
- 转录组
- 植物激素