摘要
背景
水稻叶枯病是一种世界性的毁灭性疾病,它就是由这种细菌引起的Xanthomonas oryzae.光伏.oryzae.(XOO).水稻启动子区转录激活因子样1 (transcription activator like 1, UPT)效应箱上调XA13基因起着关键作用XOO致病性。UPT盒中键细菌蛋白结合位点的突变XA13废除pxo99诱导的XA13表达是改善细菌耐水稻的一种方法。
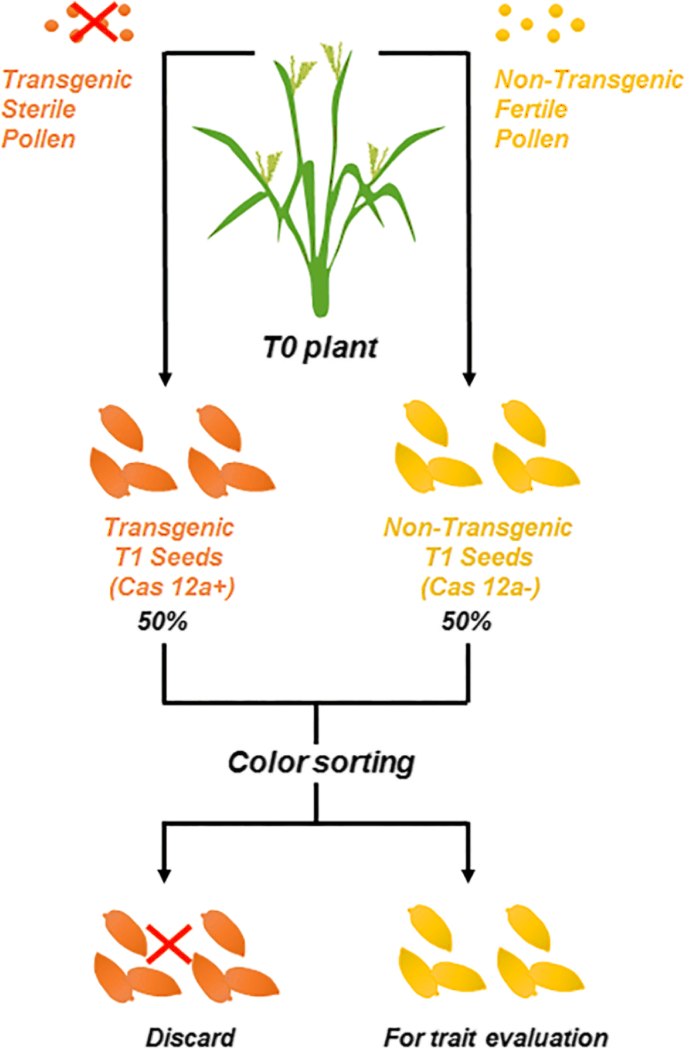
高效的产生和选择无科学的编辑植物有助于缩短和简化基于基于基于基于基于基于基于基于基于类型的育种过程。T0植物的转基因花粉的选择性消除可以丰富T1转基因的后代的比例,并且种子中的颜色标记基因的表达使T2植物的选择非常方便和有效。在该研究中,基因组编辑和复用选择系统用于产生细菌叶片抗性和无转基因稻植物。
结果
我们使用CRISPR / CAS12A技术向UPT盒引入UPT盒,以妨碍转录激活剂样效应器(TAL)蛋白质结合和基因活化,并产生改善的细菌枯燥的耐药性。通过α-淀粉酶基因的花粉特异性表达消除了T0植物的转基因花粉ZMAA1,转基因植物的比例从T1代中的单个T-DNA插入事件中的25%升至50%。目视鉴定转基因种子并通过DSRED的特异性炎热的表达丢弃,其降低了50%的成本,并导致了选择转基因编辑植物的精度高达98.64%。
结论
我们证明核心核苷酸在UPT盒中删除XA13启动子通过引入多路复用选择来赋予水稻枯萎病的抵抗力,并促进了无转基因的植物。基因组编辑和转基因选择的组合是加速功能基因组研究和植物育种的有效策略。
背景
使用新的育种技术,例如基因组编辑,已经扩展到基因改性(GM)输入特征产品之外,并扩展了基因组编辑的输出特征产品的商业化[1].基因组编辑对以前的技术具有许多优点,最显着的是,它允许整个植物基因组的靶向,单基因突变[1].在不留下异源遗传元件的情况下,特定DNA基因座的改变提供了该系统在传统的遗传修改方法中的显着优势。
快速高效地产生无基因编辑的植物对于缩短基因编辑育种过程至关重要。编辑机构的存在增加了评估目标编辑植物的遗传力和表型稳定性的难度。残留编辑机制产生的新突变给解释突变基因型的遗传带来了困难。此外,脱靶突变的几率也增加了[2]可能导致与转基因生物相关的监管担忧[3.].通过在随后的世代中的后代进行后代并基于分子检测鉴定,可以获得转基质植物。然而,这些方法昂贵,费力且耗时。据报道了几种策略用于筛选或富集无转基因的后代。荧光蛋白麦克饼的特异性表达拟南芥种子用于视觉选择编辑的后代[4.].选择无转基因植物的另一个策略是将编辑载体与RNAi表达盒结合,该表达盒可以沉默编码P450细胞色素蛋白的抗除草剂基因CYP81A6。这一策略可以通过使用除草剂从易感转基因植物中分离出苯他松抗性的转基因植物[5.].虽然这些策略极大地促进了无转基因植株的选择,但它们并没有增加想要的无转基因植株在种群中的比例。最近,He等人报道了一种通过程序化自我消除系统(转基因杀手CRISPR, TKC)主动地自动消除任何含有T-DNA插入的植物的无转基因分离新策略[2].细菌barnase利用胚胎偏好启动子REG2驱动的基因和CaMV 35S启动子驱动的水稻ORFH79基因分别杀死含有该基因的任何胚胎和雄配子体。这种方法是有效和彻底的;另一方面,它也会导致恢复少量编辑事件的高风险。当转基因成分可以通过子代分离去除时,理想的转基因植物也可能失去被选择的机会。此外,利用水稻ORFH79杀死雄配子限制了TKC在不同作物中的应用。与杀死胚胎和雄配子体相比,只杀死转基因雄配子体更有利于降低上述风险,增加无转基因子代的比例,还可以防止转基因花粉的传播。选择单子叶植物或双子叶植物的共同成分可以提高系统的效率。的α淀粉酶基因ZMAA1是在种子生产技术(SPT)中成功应用的潜在候选者通过在转基因花粉成熟期间破坏淀粉积累来杀死转基因花粉,这剥夺了必要的能量施肥[6.].其他花粉失活基因,如barnase和大肠杆菌DNA(腺苷-N6 - ) - 甲基转移酶(坝)那已被用来在不同的植物中递送雄性不育[7.那8.那9.那10那11].因此,这些基因可用作构建基因编辑载体的潜在组分,以在不同植物物种中杀死转基因花粉,并增加非触发后代的比例。此外,视觉标记,例如DSRED.或者麦克里,也可与杀花粉盒一起使用,以便通过简单的目视检查将非转基因后代与转基因后代区分开来。
水稻白叶枯病Xanthomonas oryzae.PV。oryzae.(XOO)导致严重的产量损失,特别是在亚洲和非洲[12那13].大约42个基因对不同品种的XOO已在稻米的栽培和野生亲属中鉴定[14].这XA13编码质膜蛋白的基因是完全隐性的,并赋予抗性菲律宾Xoo语比赛6(菌株PXO99)[15].抗性等位基因XA13基因仅从其编码区中的优势(易感)等位基因不同的是仅一种氨基酸残基;显性XA13蛋白的第238个残基(丙氨酸)被苏氨酸替代的隐性XA13突变蛋白[16].然而,抗病性不是通过氨基酸残基的变异,而是启动子区域的改变,这导致了抗性等位基因和易感等位基因的表达差异[15那16].与显性等位基因相比,所有隐性等位基因在启动子序列位置-86至-69中的相应区域中有缺失,突变和取代,表明启动子突变可能导致XA13介导的抗病抗性[15].通过分析截断和突变驱动的基因表达水平XA13在水稻的启动子中,已表明启动子XA13Harbors通过转录激活剂样1(UPT)效应盒上调,这是唯一的PXO99响应性CIS.- 激活中的元素XA13盒子的表达和5'-末端第二,第三和第四核苷酸是细菌蛋白的结合位点[17那18].李等人。报告称,在UPT中删除了149英镑的删除XA13启动子剥夺了细菌性疫病的诱导能力XA13基因表达和授予的种特异性抗性[19].UPT盒子的鉴定促进了基因组编辑技术在敲除关键区域和授予抗性方面的应用。
在这里,我们报告了一种生成的方法XOO通过CRISPR/ cas12a介导的靶向UPT box的结合位点,对水稻的抗性进行了研究XA13启动子区域,并进一步证明关键核苷酸(5′端第二,第三和第四核苷酸)转录激活剂样(TAL)效应蛋白结合和XA13激活。我们通过应用GM Pollen消除和DSRED标记选择系统来改善无转基因植物选择,这大大富集了无转基因编辑后代的比例和选择效率(图。1).流线型程序证明了其在基因组编辑中的植物育种和基础研究的实用性,具有改进的工艺效率。
结果
LBCAS12A转基因水稻植物的产生以及XA13启动子UPT中的编辑的事件
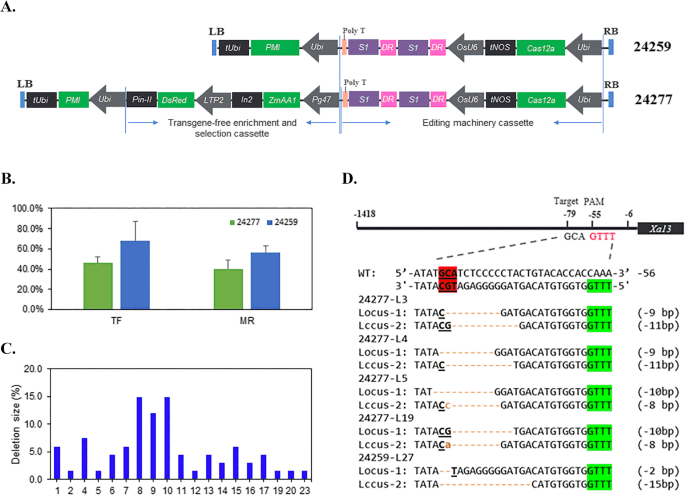
授予XOO耐水稻,我们构建了两种LBCAs12A质粒载体,含有24 nt CRRNA靶向米饭的UPT盒XA13(DQ421395.1)启动子,是细菌TAL效应蛋白的结合位点。核心靶点GCA位于- 79位置XA13启动子距离相对链下游的TTTV原间隔-邻近基序(PAM)基序24 bp(图1)。2d).采用多路选择系统增加T1代无t - dna植株的比例并进行选择。该多路复用系统由pPG47::Bt1:Zm-aa1和pLTP2::DsRed表达盒组成。pPG47是玉米多聚半乳糖醛酸酶基因的启动子,特异表达于晚发花粉中,pLTP2是从大麦胚乳偏好脂质转移蛋白(LTP2)基因中克隆而来[6.].为了衡量系统的有效性,创建了一个构造,24277,其中包含两者ZMAA1和DSRED.表达式盒;另一种构建体24259用作对照(图。2a).将构建物通过基因导入籼稻品种IR58025B农杆菌介导的转换。测定T-DNA拷贝数,TaqMan检测突变,然后进行菌落测序。我们对24277和24259两种结构体的转化频率(TF、阳性事件数/感染外种数)和突变率(MR、突变事件数/阳性事件数)进行了调查(表2)1和图。2b)。tf和mf的XA13LbCas12a靶向启动子分别为24277和24259的46.1%(227/492)和39.6%(90/227),分别为68.3%(314/460)和56.4%(177/314)。24277组的TF和MR均低于24259组。TF较低的主要可能原因是结构尺寸较大,24277是24 kb,比24259大8 kb。多拷贝事件比24259(83.09%)高于24277(73.26%),这解释了MR较高的原因,与先正达其他研究的类似发现相似。在42个突变体中,LbCas12a的缺失大小在1 ~ 23 bp之间,大多数缺失大小在8 ~ 10 bp之间。2C和补充表1).44个T-DNA插入和无脊椎骨T0事件,三个核心核苷酸缺失XA13选择来自两个构建体的启动子以产生T1种子以进行进一步评价(图。2d)。
转基因花粉清除提高了后代的非转基因率,并通过颜色标记基因的表达直观地鉴定出非转基因种子
采用TaqMan qPCR方法分析了10个单拷贝T-DNA插入T0事件的T1代T-DNA分离和RFP表达情况。如表所示2在24259个事件中,T1植株中大部分携带了不再需要的T-DNA基因,无转基因后代植株比例为19.68 ~ 29.65%。24277株无转基因植株的比例为46.92 ~ 50%,与转基因植株的比例接近1:1。结果表明ZMAA1导致转基因花粉的无菌导致无转基因后代的比例增加。
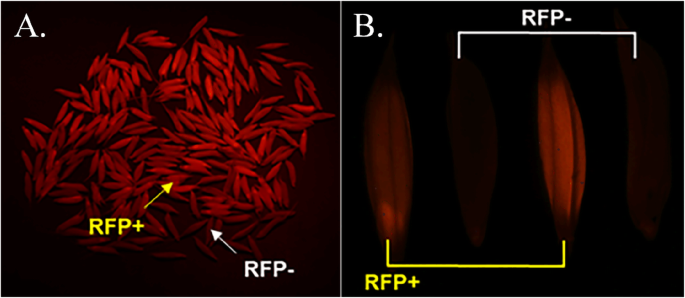
正常情况下,转基因植物是通过PCR或其他分子检测,如TaqMan检测来鉴定的。然而,传统的方法费时费力,效率低下,且无转基因植物必须在种子萌发后才能鉴定出来。为了快速高效地检测无转基因种子,在胚乳偏好启动子的控制下表达RFP,利用荧光检测器可以直观地鉴定无转基因植株(图1)。3.).这ZMAA1和DSRED.表达盒和其他转基因成分定位在同一T-DNA内,因此紧密连接和共分离。因此,24277的T1种子表现出强烈的红色荧光为转基因种子,容易与不表现出任何荧光的无转基因种子区分。为了验证这种视觉检测方法的准确性,我们对T1种子进行了发芽和TaqMan检测。如表所示2,视觉检测的平均准确率达到98.62%,验证了该方法对转基因无基因子代种子的高效鉴定。
核苷酸缺失XA13启动子中的UPTPTHXO1导致对PXO99的抗性
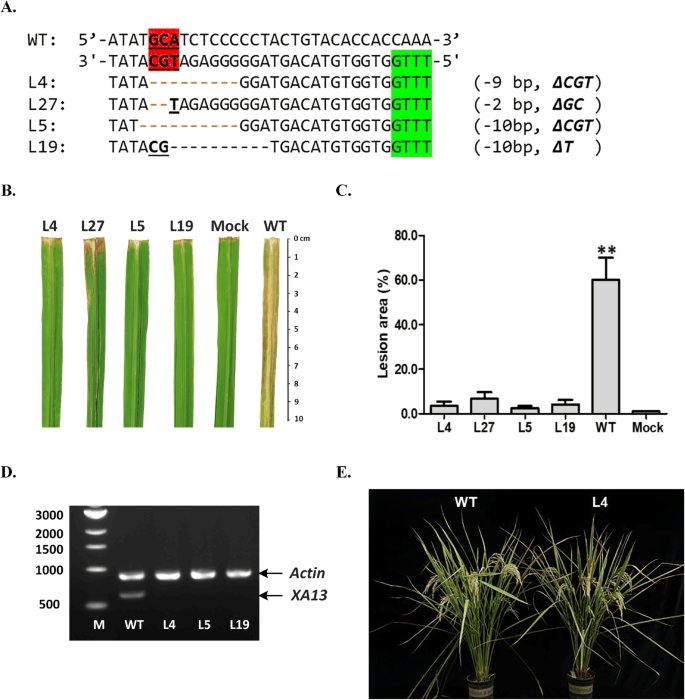
为了鉴定对细菌性叶枯病的抗性,4个纯合子突变体T1系,即L4、L5、L19和L27,在UPT框中缺失一个、两个或全部三个核心核苷酸(图)。4.a),被选为与菲律宾感染XOO6(应变PXO99)在标题阶段,以及相对表达水平XA13在PXO99感染后,通过RT-PCR在野生型和突变线72h的叶片中测定基因。突变线显示出对PXO99菌株的显着抗性(图。4.b),平均病变面积为2.4±0.8%至6.7±3.1%,而野生控制IR58025B的60.0±9.9%(图。4.C和补充表2).表达式的XA13未检测到突变线中的基因,这表明在UPT盒中缺失核心核苷酸导致XA13基因失去了PXO99诱导的能力(图。4.d)。在具有三种核心核苷酸的各种缺失的突变线中,病变区没有明显的差异(P. < 0.001, data not shown). The results show that these three nucleotides of the UPT box are important for bacterial TAL effector protein binding and gene activation. The result showing that mutations in any one of these sites abolished PXO99-induced gene expression and conferred race-specific resistance is consistent with previous reports [17那19].在具有目标编辑的突变线中,在突变线中没有观察到消极的农艺表型,例如生育或种子设定率降低XA13启动子(图。4.e)。
XA13启动子的靶向突变,增强细菌枯萎病的抗性。一种纯合的诱变在XA13选择4个T1系进行抗性评价的启动子。B.抽穗期WT和突变体的叶片在抽穗期表现出对白叶枯病的抗性或敏感性。在14 dpi时从接种植株上分离叶片拍照。C野生型和突变线接种后14天的病变区。wt,野生型;嘲笑,没有病原体。星号(**)表示显着差异(P.< 0.01, Student’s t检验)。D.表达式的XA13(DQ421395.1)基因在PXO99感染后野生型和突变线72h叶片中的RT-PCR测定。这奥特林以基因AY212324为内对照。E.野生型和突变型的形态。凝胶图像在(D.)出现;原始凝胶图像见补充图。1
讨论
基因组编辑已经成为育种家在植物育种中改进作物农艺性状的有力工具[20.].基因组编辑的主要目的是获得具有理想性状表现的无转基因编辑植物或种子。在自交后代中,单拷贝T-DNA插入T0株系的T1植株中只有大约25%的植株是无转基因的,大约75%的工作量浪费在分析不良转基因植株上。在T1代增加经过编辑的无转基因后代的种子数可以显著增加选择理想编辑株系的机会,从而缩短育种周期。他等人报道了一种高效的方法来消除任何含有CRISPR/Cas9系统的T1植物,而TKC系统杀死了任何含有转基因的胚胎和雄配子体;然而,这种制度就像一把双刃剑,既带来风险,又能提高效率。crispr介导的基因组编辑效率在不同物种之间,甚至在同一植物物种的不同组织之间存在显著差异[21].特别是植物基因精确编辑的低效率,包括DNA片段敲入和基因替换,仍然是一个主要的挑战[22].含有所需编辑但仍然含有T-DNA组分的珍贵植物将被TKC杀死,而不是通过偏析除去以除去以除去的组分。因此,在我们的研究中,我们通过仅妨碍雄性配子体的T-DNA的透射而不会干扰雌性配子,增加了无转基因后代的比例,并且额外的益处通过花粉预防转基因的扩散。
无转基因选择系统可以用作编辑基础向量的公共组件,以提高编辑管道的效率。米饭ORFH79基因限制了TKC系统在不同作物中的应用。转基因花粉的消除ZMAA1在PG47启动子下已成功应用于一些单子叶作物,例如玉米,米饭和小麦[6.那23那24].因此,该盒子是作为单码裁剪编辑载体的基本组分的理想候选者。为了在双子象作物中延长无转基因选择系统的应用,我们将进一步测试另一种花药翅膀特异性启动子TA29,以驱动花粉致死基因的表达。
由于我们的系统中允许在雌性配子体中的T-DNA透射,因此包括选择组分以区分从非转基因的后代的转基因子代。表达式的DSRED.胚乳优选的促进剂LTP2下的基因用于视觉上选择无转基因种子,这是非常方便和有效的。这种视觉分拣盒在玉米和水稻种子中成功,但由于厚的种子涂层,大豆种子失败。
我们通过突变PXO99的靶位点,获得了抗细菌病原PXO99侵染的无转基因T1植株XA13CRISPR/Cas12a基因启动子。与李的报告相反,在水稻的细菌耐药性是通过149 bp的缺失XA13该启动子是由双sgrna位点定向突变产生的,我们通过删除UPTpthxo1的两个核心核苷酸来实现这一效果XA13启动子(L27)。我们还验证了UPTPTHXO1箱的5'-末端第二,第三和第四个核苷酸中的任何一个可以赋予比赛特异性阻力,提供直接证据支持在人民币报告中结论[17].此外,抗病突变株没有表现出不育或产量下降。
结论
我们开发了一种无转基因的植物富集和选择方法,以产生细菌病原体耐植物水稻。可以应用该方法以加速基因组编辑材料的育种。
材料和方法
矢量建筑
水稻密码子优化Cas12aLachnospheae细菌ND2006在其N-和C-Termini上包含两个核定位信号(NLS),如前一个报告所述,除了为删除2 BSP119i站点和一个RSRII网站而进行的3-BP变更[25].该基因由甘蔗泛素4启动子(Prsoubi4)在两个二进制载体中驱动。由OSU6启动子驱动的串联复制CRRNA阵列(DR-S1-DR-S1)如Wang等人所述设计。[26].用一个9 bp的poly (T)短序列终止crRNA (OsU6-DR-S1)表达盒。与基载体24259相比,测试载体24277多出了两个表达片段。
植物改造和苗圃
IR58025B米用于转化。农杆菌-介导的转化根据先前报道的方案进行[27].通过含有甘露糖的选择培养基鉴定出pmi阳性植株[28].存活的植物用TaqMan方法检测T-DNA拷贝数和目标序列突变XA13启动子。单拷贝T-DNA插入的植物,无骨干和靶位点突变XA13启动子被送到温室。植物在170×150毫米的盆中种植温室,每个罐装,每个泥炭藓和营养丰富的土壤,比例为3:2:1加40克肿瘤,3-4个月控释肥料(17-7-12)。通过滴灌灌溉进行浇水。当天生长条件为30±2℃,晚上25±2°C,光周期设定为12小时,12小时。
Taqman测定和靶向突变的序列分析
采用TaqMan定量PCR (qPCR)检测T-DNA拷贝数和目的序列突变。采用Promega Magbeads植物基因组提取试剂盒提取叶片基因组DNA。采用PrimerExpress3.0软件设计基因特异性引物/探针,由Life Technologies公司合成。Real-time (RT) qPCR采用ABI 7900HT实时荧光定量PCR系统。每个10 μl real-time PCR包含5 μl 2x Sigma JumpStart Master Mix (Sigma- aldrich Corporation), 3 μl DNA, 0.2 μl 50倍TaqMan分析原液(引物最终浓度为300 nM,探针最终浓度为100 nM)和1.6 μl水。real-time PCR条件为:95℃,5 min;40个循环,95°C 5 s,然后60°C 30 s。数据采用SDS 2.4软件进行分析。
通过菌落测序进一步证实了由Taqman测定筛选的候选物。靶向区域用kod-plus-neo(Toyobo)扩增,并克隆到植物载体中(促成速零克隆试剂盒,转基因)。选择十种独立的随机克隆用于Sanger测序(Life Technologies)。序列与载体NTI中的野生型序列对齐。
种子颜色分类
荧光检测器用于种子颜色分选。通过匹配屏障滤镜眼镜,可以容易地从非重新荧光种子中排序红色荧光种子。手动计数不同T1事件中的红色荧光和未重新荧光种子的数量。
病原体接种
XOOPXO99在含YDC培养基的培养皿中培养。从培养皿中刮取病原菌,用ddH以5dpi制成悬液2O,调整悬液浓度至OD值1.0进行接种。水稻孕穗期采用剪叶法接种,对照用ddH处理2o [29].接种后的植株在25°C的生长室内黑暗培养24 h后转入水稻正常生长条件。接种后14 d测量病变长度和面积,计算平均值和标准差进行分析XOO抵抗性。
基因表达分析
用RNAPREP纯植物套件(Tiangen Biotech)提取叶子,花香和稻的根部的总RNA(Tiangen Biotech,www.tiangen.com);使用上标III第一链合成系统(Invitrogen)和寡聚-DT引物,1μg总RNA用于cDNA合成。如Zhou等人所述进行了半定量的RT-PCR。[30.].PCR引物XA13分别为5 ' -ATGGCAGGAGGTTTCTTGTCC-3 '和5 ' -AAGAAGCCGCCCACGTTC-3 '。引物序列奥特林(AY212324)对照基因为5'-gcagaAGGATGCCTTGTTG-3'和5'-GGACCCTCCTATCCAGACAC-3'。
可用性数据和材料
本研究中产生或分析的所有数据均包含在本文(及其附加文件)中。由于专利和许可的限制,这些材料无法公开获得。
缩写
- XOO语:
-
Xanthomonas oryzae.PV。oryzae.
- UPT:
-
由拇指效应上调
- :
-
Transcription-activator-like效应
- GM:
-
基因改造
- TKC:
-
转基因杀手CRISPR
- SPT:
-
种子生产技术
- 帕姆:
-
Protospacer-adjacent主题
- TF:
-
转换频率
- 先生:
-
突变率
- 招标书:
-
红色荧光蛋白
- LTP:
-
脂质转运蛋白
- rt - pcr:
-
逆转录-聚合酶链反应
参考
- 1.
Lassoued R, Macall DM, Hesseln H, Phillips PWB, Smyth SJ。基因编辑作物的好处:专家意见。转基因研究》2019年;28(2):247 - 56。https://doi.org/10.1007/S11248-019-00118-5.
- 2.
何勇,朱敏,王磊,吴娟,王强,王锐,等。CRISPR/Cas9结构的程序化自消除极大地加快了编辑和无转基因水稻植株的分离。摩尔。2018;11(9):1210 - 3。https://doi.org/10.1016/j.molp.2018.05.005.
- 3.
琼斯高清。基因组编辑的监管不确定性。Nat植物。2015;1(1):14011。https://doi.org/10.1038/nplants.2014.11.
- 4.
关键词:拟南芥,cas9突变体,CRISPR/ cas9,基因编辑植物杂志。2016;171(3):1794 - 800。https://doi.org/10.1104/pp.16.00663.
- 5。
卢海平,刘思敏,徐双林,陈文英,周旭,谭玉英,等。CRISPR-S:一种用于快速、廉价地选择基因组编辑、无转基因水稻植株的主动干扰元件。植物生物学学报(英文版);2017;15(11):1371 - 1372。https://doi.org/10.1111/pbi.12788.
- 6。
吴y,fox tw,trimnell mr,wang l,xu rj,cigan am等。玉米杂交种子生产新型隐性遗传性雄性不育体系的发展与其他交叉授粉作物。植物Biotechnol J. 2016; 14(3):1046-54。https://doi.org/10.1111/pbi.12477.
- 7。
Paddon CJ, Vasantha N, Hartley RW。解淀粉芽孢杆菌胞外RNase的翻译与加工。J Bacteriol。1989;171(2):1185 - 7。https://doi.org/10.1128/JB.171.2.1185-1187.1989.
- 8。
安格尔,贝兹,徐瑞,希根AM。在转化玉米中,邻近基因的选择和定位影响dam介导的雄性不育。转基因研究》2001;10(5):409 - 22所示。https://doi.org/10.1023/A:1012032000383.
- 9.
关键词:转基因茄子,花粉育性,Cre/loxp-mediated,位点特异性重组系统中国生物防治杂志。2010;33(2):298-307。https://doi.org/10.1590/S1415-47572010005000043.
- 10。
Tsuchiya T,Toriyama K,Nasrallah Me,Ejiri S.在微孔阶段在水稻花药中大量表达的基因分离。植物mol biol。1992年; 20(6):1189-93。https://doi.org/10.1007/BF00028907.
- 11.
Garcia-Sogo B,Pineda B,Roque E,Anton T,Atares A,Borja M,等人。生产长寿命和雄性无菌天竺葵植物。BMC植物BIOL。2012; 12(1):156。https://doi.org/10.1186/1471-2229-12-156.
- 12.
Nino-Liu Do,Ronald PC,Bogdanove AJ。Xanthomonas Oryzae Patovars:模型作物的群体病原体。莫尔植物途径。2006; 7(5):303-24。https://doi.org/10.1111/j.1364-3703.2006.00344.x..
- 13.
作物损失的量化和建模:目的综述。植物病理学杂志,2006;44(1):89-112。https://doi.org/10.1146/annurev.phyto.44.070505.143342.
- 14.
Kim Sm,Reinke Rf。一种新型抗菌酶抗菌性抗菌基因,GWA鉴定的XA43(t),通过双亲本群QTL映射证实了QTL映射。Plos一个。2019; 14(2):E0211775。https://doi.org/10.1371/journal.pone.0211775.
- 15.
楚诗,元M,姚杰,Ge x,元b,xu c等。花粉发育至关重要基因的启动子突变导致水稻抗病抗性。基因开发。2006; 20(10):1250-5。https://doi.org/10.1101/gad.1416306.
- 16。
摘要/ abstract袁敏,初正,李晓,徐超,王山。水稻隐性R基因xa13的表达功能缺失是水稻小种特异性细菌抗性的关键因素。植物生理学杂志。2009;50(5):947-55。https://doi.org/10.1093/pcp/pcp046.
- 17。
关键词:水稻,Xa13,启动子,顺式作用元件摩尔。2011;4(2):300 - 9。https://doi.org/10.1093/mp/ssq076.
- 18。
Romer P,Recht S,Strauss T,Elsaesser J,Schornack S,Boch J等人。水稻易感基因的启动子元素受到细菌枯萎病原体,Xanthomonas oryzae PV的特定TAL效应的约束和激活。oryzae。新植物。2010; 187(4):1048-57。https://doi.org/10.1111/j.1469-8137.2010.03217.x.
- 19.
李C,李W,周Z,陈H,谢C,林Y.一种新型水稻育种方法:CRISPR / CAS9系统编辑XA13启动子培养无转基因细菌抗性稻米。植物Biotechnol J. 2019。
- 20。
琼斯高清。基因组编辑育种的未来掌握在监管者手中。转基因食品。2015;6(4):223-32。https://doi.org/10.1080/21645698.2015.1134405.
- 21。
基于crispr技术的植物基因组编辑研究进展。细胞生物学杂志。2020;235(2):666-82。https://doi.org/10.1002/JCP.29052..
- 22。
马X,朱q,陈啊,刘yg。植物中的基因组编辑的CRISPR / CAS9平台:发展和应用。莫尔植物。2016; 9(7):961-74。https://doi.org/10.1016/j.molp.2016.04.009.
- 23.
常震,陈震,王宁,谢刚,陆军,闫伟,等。利用核雄性不育基因构建杂交水稻雄性不育系及制种。国家自然科学基金资助项目:国家自然科学基金资助项目。https://doi.org/10.1073/pnas.1613792113.
- 24.
Singh M, Kumar M, Thilges K, Cho MJ, Cigan AM。MS26/CYP704B在面包小麦花药和花粉壁发育中是必需的(小麦L.)和所有三个家业中的结合突变导致雄性不育。Plos一个。2017; 12(5):E0177632。
- 25.
唐X,dredder lg,zhang t,malzahn aa,zheng x,Voytas df等。用于植物中有效基因组编辑和转录抑制的CRISPR-CPF1系统。Nat植物。2017; 3(7):17103。https://doi.org/10.1038/nplants.2017.103.
- 26.
王敏,毛勇,陆勇,陶鑫,朱继康。利用CRISPR-Cpf1系统对水稻进行多重基因编辑。摩尔。2017;10(7):1011 - 3。https://doi.org/10.1016/j.molp.2017.03.001.
- 27。
关键词:籼稻,组培,组织培养,组织培养Plant Cell rep 2006;25(5): 392-402。https://doi.org/10.1007/s00299-005-0100-7.
- 28。
关键词:籼稻,PMI (manA),基因表达,最优选择压力Plant Cell Rep. 2014;33(7): 1081-90。https://doi.org/10.1007/s00299-014-1596-5.
- 29。
陈H,王S,张Q. ZHANG Q.在染色体12染色体中抗菌性抗性的新基因63,精英恢复系。植物病理学。2002; 92(7):750-4。https://doi.org/10.1094/PHYTO.2002.92.7.750.
- 30.
周B,Peng K,Zhaohui C,王S,张Q.抗抗响应基因显示水稻病原体感染后增强和压抑表达的抗抵抗基因(Oryza Sativa L.)。科学硕士。2002; 45(5):449-67。https://doi.org/10.1360/02yc9050.
致谢
感谢河北农业大学生命科学学院刘国真教授为我们提供了PXO99(种族6)菌株。感谢薛晓丹和曹万红的对外沟通和物资获取。我们感谢张玉国和高杨提供的技术援助。我们感谢胡国群和Chris Leming对知识产权的指导。同时感谢阙秋登对稿件的修改。
资金
先正达公司内部资金。
作者信息
隶属关系
贡献
KY和XC设计了实验。KY在温室中写了稿件和管理植物护理。ZL进行了病原体接种和电阻评估实验。Hg进行了水稻转化。LG执行了矢量设计和施工。JW进行了塔克曼测定和突变体的序列分析。JL进行了QRT-PCRXA13.DL,JX和XC提供了技术支持。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:补充表1。
T0线XA13启动子突变序列分析。
附加文件2:补充表2。
突变株的病变长度、面积及感染后的野生型的原始数据和方差分析。
附加文件3:补充图1. 1。
RT-PCR测定的XA13基因表达的原始凝胶图片
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
于凯,刘哲,桂洪。等等。利用基因组编辑和多路选择系统高效生产抗叶枯病和转基因水稻。BMC植物BIOL.21,197(2021年)。https://doi.org/10.1186/S12870-021-02979-021-02979-7.
已收到:
公认:
发表:
关键词
- 细菌枯萎
- 疾病
- 基因组编辑
- 无转基因