摘要
背景
胡萝卜是一种具有广泛表型和分子多样性的作物。在栽培胡萝卜中,西方基因库包括具有不同储存根形态的类型。第一个西红柿品种起源于基于广泛的人口。随后是代表早期开放授粉品种的植物中的交互,与群众表型选择进行了兴趣的特征。选择性育种改善了根系均匀性,并导致了一系列根系形状和大小不同的品种的发展。基于根形和品种的市场使用,已经区分了十几个市场类型。尽管其表达表型变异性,但若干研究表明西方栽培胡萝卜种质是遗传上无结构化的。
结果
九十三分散控制系统-ILP标记和2354个SNP标记用于评估78个西方型开放式胡萝卜品种的收集中遗传多样性的结构,各自由五种植物代表。在栽培品种内的多态位置偏析的平均百分比从31.18℃变化到89.25%分散控制系统-ILP标记和从45.11到用于SNP标记91.29%,揭示高水平帧内品种的异质性,而相比之下,其明显的表型稳定性。所有品种的平均近亲系数均为阴性分散控制系统-LIL和SNP,而通过F的全部市场课程整体遗传分化圣,两种标记系统具有可比性。为了分散控制系统-ILPs占总遗传变异的90-92%,而SNPs的取值范围为91 - 93%。主成分判别分析主要依据品种的市场类型归属,实现了8大类品种的分离。无论使用何种标记系统进行基因分型,阿姆斯特丹、Chantenay和Imperator三组品种均具有高同源性。
结论
这两种标记系统均能检测不同市场类型胡萝卜植株间的显著差异,因此可用于种质鉴定和基因组关系分析。该结果可能揭示了西方胡萝卜基因库的实际遗传多样性结构,并指出了品种护照数据可能存在的差异。
背景
栽培胡萝卜是一种二年生块根蔬菜,生长在世界各地的温带和亚热带地区。它是一个异交二倍体,相对较小的基因组约473 Mb,组织成2n = 18条染色体[1].胡萝卜是重要的营养,置于人类饮食中最重要的β-胡萝卜素中。它是全球生产方面的十大蔬菜中[2].胡萝卜是欧洲,亚洲和北美的土着,中亚被确定为栽培胡萝卜的起源地[3.].胡萝卜很可能是在1100年前的中亚被作为根茎作物驯化的。早期驯化的胡萝卜是紫色和黄色的[4.].构成现代商业品种基础的大多数栽培类型是在小亚细亚(土耳其)和欧洲温带地区发展起来的。因此,上述地区被认为是胡萝卜的次要原产地中心[5.].到目前为止,一些分子方法,如同工酶,alfp, RFLPs和SNPs已经被用来检查内部的遗传关系d .胡萝卜[3.那6.那7.那8.].包含四个主要群体的人口结构已在内部观察到d .胡萝卜物种[3.那9.那10那11].欧洲野生d .胡萝卜群体的特点是高度的多样性,包括几个d .胡萝卜亚种;亚洲野生类群没有那么复杂,主要包括d .胡萝卜无性系种群。胡萝卜. 西方栽培的胡萝卜形成了一个数量众多的群体,其特点是在贮藏根特征方面具有高度的多样性,但通常是橙色的。东方栽培的胡萝卜具有更均匀的根系特征,但在颜色方面表现出更多的变异性,因为它们通常有黄色或紫色的根系。Arbizu等人确定了进一步的地理结构[12],导致另外两个群体的分离:伊比利亚半岛和摩洛哥的野生胡萝卜(1)和巴尔干半岛、中东和北非(不包括摩洛哥)的地方品种(2)。马等对近120份代表中国栽培胡萝卜和西方栽培胡萝卜的材料进行了调查[13]表明这两个基因库都有明确的分离,表明东方栽培品种的根色素沉着存在独立的过程。
胡萝卜是一种具有广泛的表型和基因型变异的作物,可能对育种者有用。自17世纪以来,很多育种工作都集中在根系性状上,如形状、根系表面的光滑性或根系的完整性[14那15].最早的胡萝卜品种起源于广泛的群体。其次是代表早期开放传粉(OP)品种的植株间的杂交,结合对感兴趣性状的大规模表型选择。20世纪40年代末,由于细胞质雄性不育的发现,导致了由OP型品种向具有较高均匀度的杂交品种的转变。尽管如此,OP品种仍然是遗传多样性的宝贵来源,并通过基因库和公共育种项目为全世界的育种者免费提供了很大一部分植物材料[16].
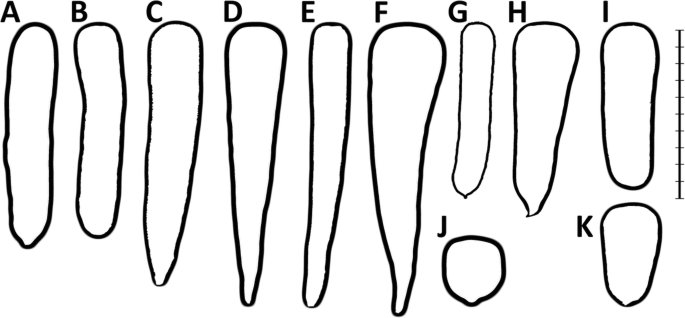
选择性育种改善了根系均匀性,并导致了一系列根系形状和大小不同的品种的发展。根据胡萝卜品种的根系形状和市场用途,已区分出12种市场类型(或品种群)[17] (图。1).一些较旧的市场类型是典型的培育和欧洲发达国家(例如龙橙色,阿姆斯特丹和巴黎市场),而另一些则适用于美国市场(如大将军或丹弗斯)的特性。邦加工作[14]是迄今为止对西方主要栽培胡萝卜类型最全面的描述。他描述了西方胡萝卜素现代类型的关键特征和用途,并讨论了它们与已建立的原始品种的联系。尽管在市场类别中观察到明显的表型变异,但一些研究表明,西方栽培的胡萝卜种质是基因非结构化的[3.那9.那10].后来Stelmach等人进行了研究[18]为西方栽培胡萝卜的根型相关遗传多样性的可能结构提供了分子证据。他们发现,Daucus Carota Stowaway(DCSTO)基于微型反转重复转座因子(MITE)的分子标记(分散控制系统-ILP技术在不同来源的胡萝卜植株间检测到了显著的变异,可用于种质鉴定和基因组关系分析。螨虫是非自主的DNA转座子,需要一个相关的自主元件作为转座酶的供体来诱导它们的转座在反式. 整体分析DcSto他们最近的流动性提供了证据,并确定了候选人的自主元素螨,DcMar1,作为可能的转座酶来源[19].
在本研究中,我们调查了来自一系列OP-western型胡萝卜品种的植物,这些品种产生不同形状的根,并代表了几个品种群。我们的目的是检测可能的遗传结构潜在的明显表型差异之间的成熟市场类型。我们开发并比较了两个共显性分子标记系统,分散控制系统-ILPs和SNPs,因为我们认为前一个系统可能能够揭示最近产生的变化,由转位活性DcSto螨虫。
结果
DcS-ILP和SNP基因分型显示遗传多样性
共93分散控制系统-ILP标记和2354个SNP标记,沿着9条胡萝卜染色体分布(附加文件1:图S1),对78个西方型胡萝卜品种进行遗传多样性评价。为了分散控制系统-ilp基因分型等位基因数一种有效等位基因数NE.为1.411,而SNP分型对应的N一种和NE.数值分别为1.783和1.512。观察到的杂合度HO.(0.323)高于分散控制系统-ILPs(0.253),以及预期的杂合度HE.(snp为0.295,snp为0.239分散控制系统-ilps)。HE.估计的品种范围为0.115(LC1)至0.323(BE7)分散控制系统-ILPs,从0.174 (LO1)到0.350 (GU3)。(附加文件2:表S1和附加文件3.:表S2)。品种内多态性位点的平均分离率为31.18% (LC1) ~ 89.25% (BE7)分散控制系统-ILP标记,从45.11% (LC1)到91.29% (SV1)的SNP标记(附加文件4.:表S3)揭示了高水平的品种内异质性,而不是其表面表型的稳定性。阿姆斯特丹市场类品种的H组平均值最低O.(适用于0.255和0.316)分散控制系统-ILP和SNP),而Imperator市场类别的品种在H组中的平均值最高O.(0.277 for.分散控制系统-ILPs和0.329为单核苷酸多态性;额外的文件5.:表S4)。群体内遗传多样性(用HE.)普遍低于HO.为0.204 (Chantenay) ~ 0.267 (Berlikum)分散控制系统-ILP和0.269(荧光)和0.336(圣Valery)用于SNP。平均近亲繁殖系数f是对于所有品种对两者都是阴性的分散控制系统-ILP( - 0.055)和SNP( - 0.097),再次表明含有高水平的栽培品种异质性。所有市场课程的整体遗传分化,由F衡量圣,两种标记系统具有可比性(0.294分散控制系统-ILPs和0.279为单核苷酸多态性;表格1).
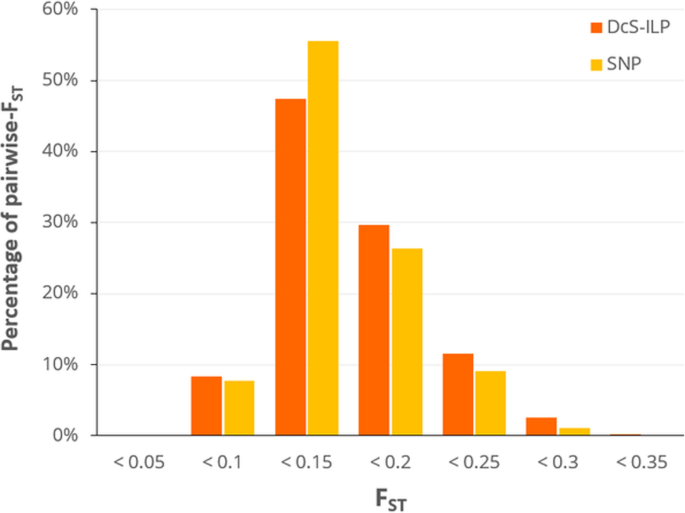
F圣分析表明市场课程之间的中等区别。在属于阿姆斯特丹和圣Valery市场课程的品种之间观察到最强烈的分化(0.260分散控制系统-ILP和0.214的SNPs;额外的文件5.:表S4)。类内HO.值高于成对F圣值,表明在栽培品种遗传变异方面对整体多样性具有更大的贡献,而不是品种变异性。成对F圣对两种标记系统计算的估计数具有可比性,其范围为0.046 (IM3 vs. IM5)至0.332 (LC1 vs. AM1)分散控制系统-ILP标记,从0.052 (NA2 vs. NA3)到0.323 (LC1 vs. AM1)的SNPs(附加文件6.:表S5和附加文件7.:表S6)。百分比的成对百分比圣在0.1-0.15之间(DcS-ILP为47.5%,SNPs为55.6%);图。2).两者的Amova分散控制系统-ILP和SNP基因分型数据显示,在所研究的品种中观察到了更多的遗传变异(71%的品种)分散控制系统-ilp和snps的68%)比其中(29%用于分散控制系统-ILP和32%的SNPs),进一步揭示了胡萝卜OP品种间存在显著的异质性。
利用基于模型的方法评估遗传结构
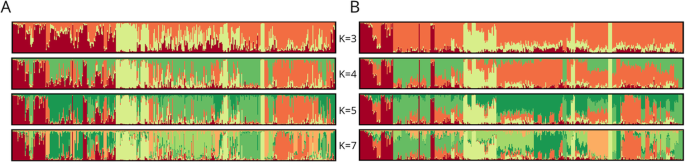
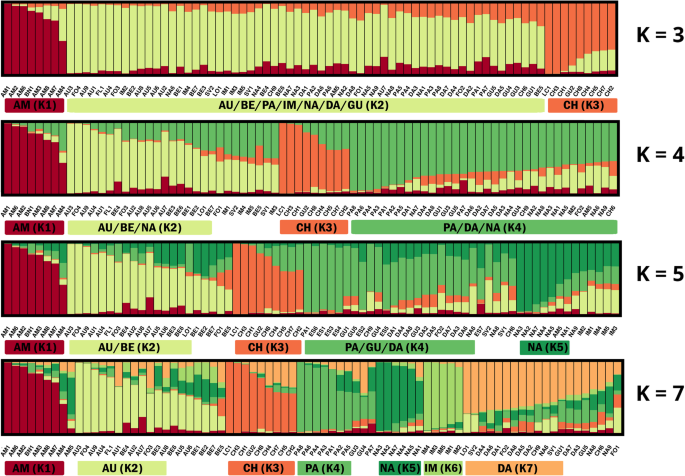
在没有任何分类的情况下,推测了西方栽培胡萝卜可能的遗传结构。利用基于混合模型的聚类分析法对390株胡萝卜植株进行了分析。3.).ΔK值(附加文件8.:表S7)表示最可能的簇数为分散控制系统-ILP基因分型为3,4,7,K = 4是最可能的(ΔK = 61.498),而SNP基因分型为3,4,5,K = 3是最可能的(ΔK = 133.541)。因此,对K = 3 ~ 5和K = 7进行了更详细的遗传结构评估和比较。
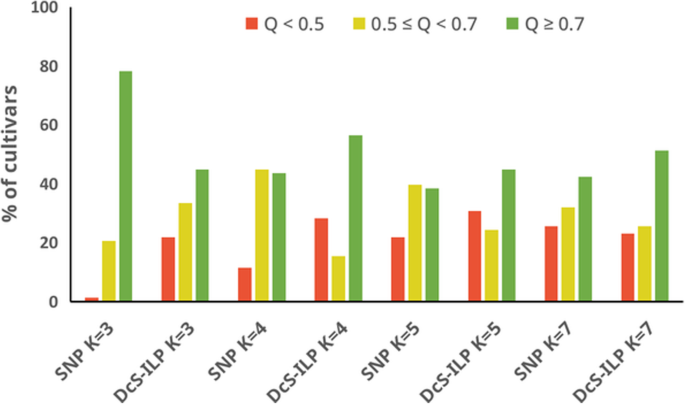
通常,与SNP数据推断的遗传结构的特征在于分配给假定簇的更多种品种(成员系数值(Q)≥0.5)相比分散控制系统-ILP数据。的percentage of populations assigned was as followed: 98.7% for K = 3, 88.5% for K = 4, 78.2% for K = 5 and 74.4% for K = 7. For分散控制系统-ILP数据显示,该百分比通常较低10至20个百分点,K的百分比为69.2% = K为5至78.2% = 3.然而,属于高置信度聚类的品种数(> 0.7)分散控制系统当K大于3时的-ILP数据集,与SNP数据集相比(表2那无花果。4.).
SNP标记
K = 3是最可能的群数,代表阿姆斯特丹和Baby Nantes市场类型的人群明显分离(组K1,图1)。5.).无论假设簇的数量如何增加(K = 7),这种模式都是显而易见的。K1内的Q平均值很高(0.89;表格3 b). 只有一个阿姆斯特丹型品种(AM4)的特点是高水平的混合,而品种AM5因此被归为南特市场类型的品种。另一个明显分离的类群(K3)几乎没有变化,尽管K的数量增加,包括8个属于Chantenay类型的品种。该组的平均Q值也很高(0.78)。K2组由代表不同市场类型的种群组成,例如秋王(AU)、贝里库姆(Berlikum)和帝王(IM),其特征是树桩根长;或巴黎市场(PA),Guerande(GU),Danvers(DA)和Nantes(NA),通常具有较短(短到中等),较厚的圆锥根。假设集群内个体之间的平均距离(以H为单位)E.)对于K2(0.40)最高,而对于相对于品种来源的簇,它们分别为0.31和0.30(表4 b).
基于SNPs估计78个胡萝卜品种的遗传结构,K = 3-5和K = 7。两个字母的缩写用于指示胡萝卜市场类型:AM - Amsterdam, AU - Autumn King (Flakkee), BE - Berlikum, PA - Paris market, IM - Imperator, NA - Nantes, DA - Danvers, GU - Guerande (Oxheart), CH - Chantenay, FO - fodder carrot。三个字母的缩写对应于附加文件中列出的品种符号11:表S10
将团簇数目增加到4个导致K2分离成两个单独的团簇:新的团簇K2由AU/BE/FO组成,K4由PA/GU/DA/NA组成。假设有5个聚类,从K4中分离出6个属于南特市场类型的品种,形成聚类K5。当聚类数增加到7个时,5个帝王型品种(K6)的Q值均在0.85以上。第七组(K7)主要是属于丹弗斯和圣瓦莱里市场类型的品种。当K = 7.对于四个品种,至少有一个代表品种的植株被分配到与大多数品种不同的聚类中,因此代表不同的基因库。在另外8个品种中,至少有一种代表该品种的植物被混合(Q < 0.5),因此无法分配给任何已定义的群集。
分散控制系统-ILP标记
当假设存在三个集群时,两个集群(K1和K2)将许多起源不同的种群分组,如K1组中的阿姆斯特丹、Berlikum、Autumn King或K2组中的Nantes、Imperator和St. Valery。K1阿姆斯特丹品种的Q值较高,平均值为0.85,其他类型品种的Q值较低,不超过0.77。K1内总体Q均值为0.74(表3).10个Chantenay市场类型的品种中有8个被分为两个Guerande型和两个巴黎市场类型的品种组成一个聚类K3(图1)。6.). 在K3范围内,Chantenay品种的平均Q值为0.89,而K3的总体平均Q值为0.79。当假设四个类群时,前一个类群K1主要减少到阿姆斯特丹型品种,因此平均Q值增加到0.85。K2组始终包含代表各种根类型的群体,如Imperator、秋王和巴黎市场,平均Q值为0.75。K3组减少到七个Chantenay类型的品种和一个属于Guerande市场类型的品种,因此尽管集群数量增加(平均Q = 0.87). 对于K = 4、新分离的K4群由19个品种组成,其中9个为南特型(平均Q = 0.74). 将假定的团簇数目增加到5个导致K5的分离(平均Q = 0.75)。K5由属于帝国和巴黎市场类型的品种组成。对于K = 5、K2将秋王市场型的7个品种、4个饲用胡萝卜群体和长橙和圣瓦莱里的单群体进行了分组。该聚类的平均Q值为0.64。K4仅限于代表南特类型的品种(平均Q = 0.74). 当假设有7个类群时,代表帝王类型的种群与一个饲料胡萝卜种群(Q = 0.80). K7组是异质的,由11个不同市场类型的品种组成。该组的平均Q值为0.77。对于K = 17个品种为混合聚类,而在另外22个品种中,至少有一个代表该品种的植株被混合(Q < 0.5),因此无法分配给任何已定义的群集。平均HE.在假设的聚类中,K2的个体间差异最大(0.34),而在品种来源更为均匀的聚类中,K1和K3的个体间差异较小(分别为0.28和0.24;表4).
对78个胡萝卜品种的遗传结构进行了分析分散控制系统-ILP标记,为K推断 = 3–5和K = 7.胡萝卜市场类型用两个字母缩写表示:AM–阿姆斯特丹、AU–秋王(弗莱基)、BE–贝里库姆、PA–巴黎市场、IM–帝国、NA–南特、DA–丹弗斯、GU–格兰德(牛心)、CH–尚特奈、FO–饲料胡萝卜。三个字母的缩写对应于附加文件中列出的品种符号11:表S10
对于最可能的团簇数,K = 3,K = 4和K = 7对两组进行AMOVA分析分散控制系统-LIL和SNP基因分型数据。通常,大多数总遗传变异导致分配给预定簇的品种之间的差异。为了分散控制系统-ILPs占总遗传变异的90 ~ 92%,而SNPs为91 ~ 93%。对于K = 3和K = 4,由假设的簇间差异导致的总变异的百分比为7%的SNPs和8%的分散控制系统-伊尔普斯。当预定义的聚类数目增加到7个时,snp和snp的百分比分别上升到9%和10%分散控制系统分别-ILPs。
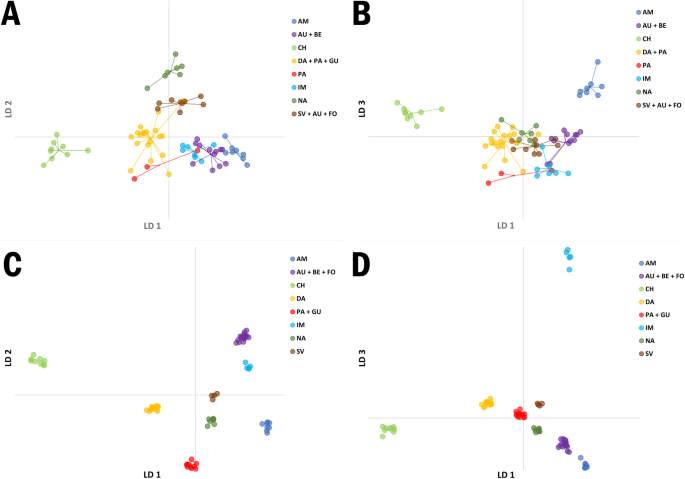
主成分判别分析
分析结果为研究品种提供了一个非模式的新分类选择。两种数据集的最佳组数(K)均为8个,从而使品种分类结果具有可比性(图1)。7.).在品种水平上的赋值精度为65.39%,即51个品种归属于同一组1 ~ 8。390个植株中有277个被分配到同一组,在植株水平上获得了71.03%的分配精度。通常,DAPC使品种的分离取决于其市场类型隶属关系。无论使用哪种标记系统进行基因分型,3组品种均具有较高的同源性:Amsterdam(第1组)、Chantenay(第3组)和Imperator(第6组)。第6组在品种水平上的赋值准确性为71%,第1组和第3组的赋值准确性为100%。其余的群体在特定市场类型的分类方面更为异质。为了DCS-ILPs第4组最多(附加文件)9.:表S8)。在这一群体中,丹弗斯、巴黎市场和格朗德类型盛行。它包括6个丹弗斯型品种、4个巴黎市场型品种、4个盖兰德型品种以及2个南特型品种NA1和NA5)、1个阿姆斯特丹型品种(AM5)和1个饲料胡萝卜品种(FO2)。其次为秋王型7个品种,Berlikum型4个品种和饲料胡萝卜(FO4) 1个品种。类群7由南特型7个品种组成。8组由圣瓦莱里型、长橙(LO1)、秋王型(AU1、AU7和FL1)、Berlikum型(BE5)、Chantenay型(CH9)和饲料胡萝卜(FO4)组成。数量最少的品种只有3个,其中2个为巴黎市场型(PA1、PA8), 1个为丹弗斯型(DA6)。
对于SNPs,组2是最多的,包括19个品种的秋王和Berlikum类型和饲料胡萝卜(附加文件10:表S9)。巴黎市场和格兰德类型的13个品种和Chantenay类型的1个品种(CH9)被归入第5组,而Danvers类型的8个品种和4个不同类型的品种(BE5、CH6、NA8、FO2)被归入第5组,将7个南特型品种与1个阿姆斯特丹型品种(AM5)组合。第8组只包括四个品种:其中两个是圣瓦莱里型,一个是南特型(NA6),一个是长橙型(LO1)。
讨论
先前对不同种类的野生和栽培胡萝卜进行的研究表明,无论是野生的还是栽培的(西方和东方)胡萝卜,都没有独特的基因结构[3.那8.那9.那11那13那16那20.].尽管如此,上述研究是在大型的非常多样化的胡萝卜种质上进行的。由于野生和培养基因库之间的明显和非常独特的遗传差异,它们可能无法检测到西方蛋白栽培中存在的遗传多样性的结构。从历史上看,西部栽培胡萝卜的第一个市场课程在十八世纪被选中,从展示类似的储存根形态学[21].因此,分类到一个市场类别的品种可能是相对接近的亲戚。然而,正如之前Iorizzo等人所报道的[1],在栽培胡萝卜中没有观察到明显的瓶颈,这表明野生胡萝卜和栽培胡萝卜之间可能存在连续的基因流动,不同品种之间也很可能存在这种流动。基于植物形态的传统选择导致了现有类型胡萝卜品种的发展,表现出明显的形态和农艺特性,显然允许在OP品种中保留大量的遗传异质性。
Codominant.分散控制系统-ILP标记系统的开发,本研究可能揭示遗传变异最近出现DcSto螨虫在胡萝卜基因组中显示出极端的插入多态性[19那22]. 也许,他们最近的动员可能导致了西方胡萝卜基因库中的基因多样化。尽管有许多优点,高通量分子标记系统,如SNPs或DArTs不能检测转座因子(TE)插入衍生的变异性。图像的分辨率分散控制系统-ILP面板之前曾在23个西方胡萝卜OP品种的收集上演示过[18]. 高质量的单核苷酸多态性具有成本效益的优势,通过测序衍生标记,但减少到约2300个基因座均匀分布在整个基因组中,并涉及到高质量的基因组组装[1],从而为在更大的数据集中评估遗传结构提供了时间和计算效率。这两组标记可以很容易地通过附加位点进行扩展,以获得额外的生物学信息或可能修改种群结构的分辨率。
结果的AMOVA,连同高值HO.,两个品种和市场一流水平表明内品种遗传多样性的显著较高水平,主要贡献品种的收集研究中观察到的总体遗传多样性。这个观察是按照Maksylewicz和巴兰斯基[以往的研究10],因为它们表明,几乎三分之二的胡萝卜栽培品种和地方品种的高度多样化收集观察到总变化的归因于群体内的变化。在研究中既先进品种和地方品种的藏品近交系数的值由巴兰斯基等进行。[9.Maksylewicz和Baranski [10]表明纯合位点过多,这可能表明在以生产统一、先进的品种为目标的育种程序中存在重复自交。然而,使用一组更稳健的多态性,我们没有在我们的OP品种收集中观察到正的近交系系数。
Chantenay、Amsterdam和Paris Market类型的品种的基因多样性较低(HE.),而Berlikum、St. Valery和Imperator类型是异质性最大的品种。结构集群导致最可能的组数量从11个预定义的市场类别减少到最可能的3个到5个或7个集群。非模型DAPC分组也表明,在检测的品种收集中,相对同质的类群数量较少。对于最可能的簇数的选择比较模糊分散控制系统-ILP标记作为ΔK值的差异相对较小,但一般来说,随着确定簇数的增加,未分配品种的比例降低,簇内平均隶属系数(Q)增加。这种趋势在SNP基因分型数据中被逆转。聚类越多,组内Q值均值越低。然而,大多数属于阿姆斯特丹和尚特奈类型的品种总是与其他品种明显分离,其特征是Q组内的最高值与H组内的最低值E..根据Banga提出的胡萝卜市场类型分类[14阿姆斯特丹和Chantenay两种类型都代表了“Horn”群体,其中包括大量优质胡萝卜品种,至少细分为八个市场类别(图)。8.).阿姆斯特丹市场类型指的是强迫胡萝卜品种在掩体下生长或在露天进行早期生产。使用阿姆斯特丹品种最初仅限于一个早期生产的掩护下。育种家们正在寻找一种具有高产和相当长的植物材料,同时活力是培育品种的关键特征。在19世纪,只有很少的品种能够满足人们的期望UTRECHT强迫在他们中间。现代阿姆斯特丹的OP品种被认为是直系后代UTRECHT强迫[14].
迄今为止,还没有证据表明任何其他育种材料被用于培育阿姆斯特丹品种。这与我们的结构和DAPC聚类结果相一致,表明阿姆斯特丹胡萝卜与其他市场类型有较强的区别,可能保留了其特定的农业特性。混合的性质Amsterdamska简历。可能反映了南特育种材料在品种发展过程中的应用。Chantenay市场类型包括为生产夏至冬末胡萝卜而开发的品种。这种类型被认为是与代表“后半长角”市场类型群的主要类型的偏差,是作为Guerande类型的平行选择而发展的,并被认为起源于奥朗德赛跑简历 [14]但是,大多数辛烷品种在一个明显独特的集群中被分组,具有非常高的会员价值。无论分子标记基因分型系统,两个品种,即谢琴龙型和克里拉,其特征是掺量高。有趣的是,根据Banga提出的分类,这两个品种的主要遗传成分都来自拥有共同祖先的市场类别[14].两个主要的遗传成分谢琴龙型品种指向的育种材料之间的杂交属于丹弗斯和皇帝类型。自谢琴龙型起源于美国,丹弗斯类型的育种材料可以在品种开发的过程中被引入,特别是因为这个市场类型起源于美国19世纪70年代中,并仍在使用集束[14].相对较高比例的遗传成分来源于Imperator,可能是Chantenay和Imperator为获得更长的贮藏根而杂交的结果。同样,群集的原因克里拉品种与Danvers类型的品种有品种(最初被归类为Chantenay),可以使用源自北美的最容易获得的父母育种材料。它突出了与特定市场类相对于其表型及其实际血统归因于特定市场课程的护照数据之间可能的差异。马等人。[13[据报道,中国橙胡萝卜,分享与西橙胡萝卜的许多形态特征,与中国红胡萝卜聚集,暗示中国橙色品种和地塑料可能从原始亚洲胡萝卜品种中出现。它表明,类似的表型特征可以由来自不同基因池的选择来引起的。因此,所呈现的结果可能揭示了西部胡萝卜基因库中的实际遗传多样性,再加上具有显着的栽培品种异质性和显着的混合物。
结论
本研究旨在探讨不同市场类型西部胡萝卜表型差异的可能遗传结构。我们开发了两种分子标记系统,SNPs和TE插入衍生的DcS-ILPs,为大数据集的时间和成本效率评估提供了工具。这两种标记系统均能检测不同市场类型胡萝卜植株间的显著差异,可用于种质鉴定和基因组关系分析。基于模型的结构聚类和非模型的DAPC聚类均表明,与以表型性状为主的分类方法相比,OP品种相对同质的类群数量有所减少。该结果可能揭示了西方胡萝卜基因库的实际遗传多样性,并指出了品种护照数据可能存在的差异。
方法
植物材料和DNA提取
本研究中使用的胡萝卜开放授粉品种来自华威遗传资源单位(WGRU)(附加文件11:表S10). 2014年和2016年,按照标准农业实践,在Gołębiew(波兰)的田间种植了390株代表78个不同主根形状和市场类型的OP西式胡萝卜品种(每个品种5株),以最佳方式灌溉、施肥和保护免受病原体侵害。使用改良的CTAB方案从新鲜幼叶中分离DNA(Briard等人,2000年)。
DCS-通过GBS发现ILP基因分型和SNP
用93分散控制系统-ilp标记(附加文件12:表S11)按照Stelmach等人的描述进行[18].的分散控制系统- ILP标记文件被手动评分。每个等位基因的得分分别为:1(空插入位点)、2(占位插入位点)、0(无扩增位点)。创建了二倍体个体的共显性标记矩阵(附加文件13:表S12)。对于SNP发现植物进行基因分型采用测序(GBS)在威斯康星大学麦迪逊生物技术中心进行,如埃里森等人所描述的那样。23].使用Tassel 5.2.31调用SNPs [24那25]参考胡萝卜基因组LNRQ00000000.1[1].使用VCFTOOLS过滤多态性[26].仅高质量的SNP(参数:--max等位基因2 --max缺失-计数95 --maf 0.1 --minDP 8)被保留,并使用PLINK 1.9软件[所得VCF文件随后被重新编码为所述结构格式矩阵27)(附加文件14:表S1)。
数据分析
遗传多样性指数如:等位基因数(N一种),有效等位基因数量(nE.),观察杂合度(HO.)和期望杂合度(HE.)都计算过了分散控制系统使用GenAlEx 6.51 [-ILP和SNP共显性标记系统28].成对F圣使用FinePop2 R包[29].研究了遗传多样性结构2.3 [30.].贝叶斯聚集在两者上进行了分散控制系统-ILP和SNP基因分型数据矩阵。燃烧期的长度设定为100,000,并且在烧毁之后的Markov链蒙特卡罗(MCMC)复制的数量被分配为500,000,为每组簇(k)设置为2到11(数量)预定义的市场课程)。对每个模拟值进行了与混合物和相关等位基因频率模型的五个独立迭代K不使用了关于分析人群起源的先验知识。根据Evanno等人的描述,使用ΔK值确定了信息量最大的K。[31].Nei’s遗传距离和成对F圣GenAlEx 6.51中计算了估算值。对GenAlEx 6.51共显性基因分型距离矩阵进行分子方差分析(AMOVA),共有999个排列。为了在不预先假设种群结构的情况下评估研究样本的遗传多样性,我们进行了主成分分析(PCA)和主成分判别分析(DAPC)adegenet2.1.1 R包[32].对两者进行了分析分散控制系统-ILP和SNP数据集。在DAPC中,使用交叉验证确定保留主成分的最佳数量(xval公司函数实现adegenet). 150和60个主成分分别解释了76%(SNP)和89%(分散控制系统保留总方差的-ILP)进行SNP和DAPC分析分散控制系统-ILP数据集。组数是使用find.clusters ()函数实现adegenet.根据贝叶斯信息准则(Bayesian Information Criterion, BIC)的递减值选择最优K值。然后每个人被分配到集群中。
数据和材料的可用性
支持本文结论的数据集包含在文章及其附加文件中,或者可以从合理的请求中获取相应的作者。
参考
- 1.
1 .黄俊等。基于遗传算法的生物信息学分析。高质量的胡萝卜基因组组装为类胡萝卜素积累和小行星基因组进化提供了新的见解。Nat麝猫。2016;48(6):657 - 66。https://doi.org/10.1038/ng.3565.
- 2.
西蒙PW。经济和学术重要性。编者:西蒙P、伊奥里佐M、格泽贝鲁斯D、巴兰斯基R。胡萝卜基因组。C科尔,剧集编辑。植物基因组简编。瑞士施普林格自然公司;2019年。1–8.
- 3.
Iorizzo M, Senalik DA, Ellison SL, Grzebelus D, Cavagnaro PF, Allender C,等。胡萝卜(Daucus carota subsp。巨大成功)(伞形科)。中国生物医学工程学报,2013;https://doi.org/10.3732/ajb.1300055.
- 4.
Stolarczyk J, Janick J. Carrot:历史与肖像学。时间Horticult。2011;51:13-8。
- 5.
邦加O.起源和西方种植胡萝卜的分布。遗传学供应商Agrar。1963; 17:357-70。
- 6.
Vivek BS,Simon PW。红萝卜分子标志物和储存根特征之间的联系关系(Daucus Carota L. SSP。苜蓿)。Al Appl Genet。1999; 99(1-2):58-64。https://doi.org/10.1007/s001220051208.
- 7.
Shim SI, Jørgensen RB。栽培及野生胡萝卜的遗传结构(Daucus Carota.L.)。理论应用,2000;101:227-33。
- 8.
Bradeen JM、Bach IC、Briard M、le Clerc V、Grzebelus D、Senalik DA等。栽培胡萝卜的分子多样性分析(Daucus Carota.L.)和野生dawus种群揭示了遗传非结构组成。J Amer Soc Hort Sci. 2002; 127:383-91。
- 9。
Baranski R,Maksylewicz-Kaul A,Nothnagel T,Cavagnaro PF,Simon PW,Grozebelus D.胡萝卜遗传多样性(Daucus Carota.(1) SSR位点分析。遗传资源与作物进化。2012;
- 10.
Maksylewicz A,Baranski R.植物内植物遗传多样性培养胡萝卜(Daucus Carota.L.)通过分析微卫星标志物评估。Acta Biochim Pol。2013; 60:753-60。
- 11.
Grzebelus D、Iorizzo M、Senalik D、Ellison S、Cavagnaro P、Macko Podgorni A等。多样性阵列技术(DArT)标记揭示的胡萝卜(Daucus carota L.)基因组的多样性、遗传图谱和驯化特征。摩尔品种。2014;33(3):625–37.https://doi.org/10.1007/s11032-013-9979-9.
- 12.
Arbizu CI, Ellison SL, Spooner DM, Senalik D, Simon PW。基因测序技术为研究甘蓝亚种提供了鉴别能力。生物医学工程学报。2016;16(1):234。https://doi.org/10.1186/s12862-016-0806-x.
- 13.
马志刚,孔世平,刘立杰,欧聪,孙特,赵志伟,等。我国柑桔胡萝卜品种的独特起源。大提琴。2016;212(1):37–49.https://doi.org/10.1007/S10681-016-1753-8.
- 14.
甘薯O.西方胡萝卜素主要种类及其来源。Zwolle: N.V. Uitgevers-Maatschappij W.E.J. Tjeenk Willink;1963.
- 15.
Simon PW, Freeman R, Vieira J, Boiteux LS, Nothnagel T, Michalik B等。胡萝卜。选:Prohens J, Nuez F, editors。蔬菜:豆科,百合科,茄科,伞形花科。纽约:施普林格纽约;2008.327 - 57页。https://doi.org/10.1007/978-0-387-74110-9_8.
- 16.
卢比CH,戈德曼IL。提高自由胡萝卜育种通过胡萝卜八个开源复合种群的发展工作(Daucus Carota.l . var.巨大)。维持。2016;8:479。
- 17.
Rubatzky VE、Quiros CF、Simon PW。胡萝卜及相关蔬菜伞形科。纽约:国际出租车公司,沃林福德;1999
- 18.
小型倒置重复转座子插入为胡萝卜内含子长度多态性标记提供了来源(Daucus Carota.l .)。植物科学与技术,2017;
- 19.
Macko-Podgórni A, Stelmach K, Kwolek K, Grzebelus D. Stowaway微型反向重复序列转座因子是推动近期野生和栽培胡萝卜基因组多样性的重要因素。暴徒的DNA。2019; 10(1): 47。https://doi.org/10.1186/s13100-019-0190-3.
- 20
阿尔维苏C,Ruess H,Senalik d,西蒙PW,斯普纳DM。胡萝卜属Phylogenomics(胡萝卜,伞形科)。牛J博特。2014; 101:1-20。
- 21.
邦加O.原始欧洲胡萝卜材料的发展。Euphytica。1957年; 6:64-76。
- 22.
Macko-Podgorni A, Nowicka A, Grzebelus E, Simon PW, Grzebelus D. DcSto:胡萝卜偷猎者样元素丰富、多样、多态。遗传。2013;141(4):255 - 67。https://doi.org/10.1007/s10709-013-9725-6.
- 23.
Ellison SL, Luby CH, Corak KE, Coe KM, Senalik D, Iorizzo M,等。类胡萝卜素的存在与驯化胡萝卜中的或基因有关。遗传学。2018;210(4):1497 - 508。https://doi.org/10.1534/genetics.118.301299.
- 24.
张志明,张志明,张志明。TASSEL:用于在不同样本中进行复杂性状关联映射的软件。生物信息学。2007;23(19):2633 - 5。https://doi.org/10.1093/bioinformatics/btm308.
- 25.
3 . Glaubitz JC, Casstevens TM, Lu F, Harriman J, Elshire RJ, Sun Q,等。TASSEL-GBS:通过测序分析管道进行高容量基因分型。《公共科学图书馆•综合》。2014;9 (2):e90346。https://doi.org/10.1371/journal.pone.0090346.
- 26.
(1) Danecek P, Auton A, Abecasis G, Albers C, Banks E, DePristo M,等。变体调用格式和VCFtools。生物信息学。2011;27(15):2156 - 8。https://doi.org/10.1093/bioinformatics/btr330.
- 27.
Purcell S,Neale B,Todd Brown K,Thomas L,Ferreira MAR,Bender D,et al.《PLINK:全基因组关联和群体连锁分析的工具集》。我是吉英。2007;81(3):559–75.https://doi.org/10.1086/519795.
- 28.
将二次熵转换为多样性:动物和等位基因都是多样化的,但有些比其他的更多样化。《公共科学图书馆•综合》。2017;12 (10):e0185499。https://doi.org/10.1371/journal.pone.0185499.
- 29.
Nakamichi R、Kishino H、Kitada S。精细人口分析。2020https://cran.r-project.org/web/packages/finepop..进入2020年12月27日。
- 30
Pritchard JK,Wen X,Falush D。结构软件:版本2.2.3。芝加哥大学,芝加哥;2008
- 31
关键词:个体聚类,结构模型,个体聚类摩尔生态。2005;14(8):2611 - 20。https://doi.org/10.1111/j.1365-294X.2005.02553.x.
- 32
Jombart T. Adegenet:A R包遗传标记的多变量分析。生物信息学。2008; 24(11):1403-5。https://doi.org/10.1093/bioinformatics/btn129.
确认
不适用。
资金
该研究由波兰农业和农村发展部批准的2014-2020年农业生物学进展基础研究基金资助;KS得到了波兰国家科学中心(Narodowe Centrum Nauki)的资助,ETIUDA 7项目,项目编号。2019/32 / T / NZ9/00198。
作者信息
从属关系
贡献
KS和DG设计了这项研究;KS制备植物材料和预先形成的DCS-ILP基因分型;AM-P和KS在GBS数据的Silico分析中进行;KS进行了遗传多样性的评估;KS,DG和CA写了稿件。所有作者均阅读,审查,并批准了最终手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
出版许可
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
单核苷酸多态性的基因组分布及其意义分散控制系统-ILP标记在胡萝卜基因组的九个染色体上;图例:黑色垂直条对应于SNP和DCS-ILP标记的位置;名字分散控制系统- ilp是大胆的栗色。
附加文件2:表S1。
分散控制系统-ILP面板概述分析的胡萝卜品种集合的统计数据。
附加文件3:表S2。
单核苷酸多态性小组汇总统计分析收集的胡萝卜品种。
附加文件4:表S3。
分析品种间多态性位点百分率的比较。
附加文件5:表S4。
平均h.O.和HE.估计和成对F圣为预定义的市场课程获得的值。
附加文件6:表S5。
F的成对栽培圣根据93年的分散控制系统-ILP标记。
附加文件7:表S6。
F的成对栽培圣基于2354个SNP标记。
附加文件8:表S7。
基于Evanno的∆K方法估计最优簇数。
附加文件9:表S8。
DAPC分组结果进行分散控制系统独立的基因数据。
附加文件10:表S9。
DAPC分组结果采用SNP基因分型数据。
附加文件11:表S10。
该研究中使用的78种胡萝卜品种的特征。
附加文件12:表S11。
93年的描述分散控制系统-利用ILP标记对78个OP胡萝卜品种进行基因分型。
附加文件13:表S12。
Codominant.分散控制系统-ILP标记基质用于收集390株胡萝卜。
附加文件14:表S13。
以390株胡萝卜为材料,获得了共显性SNP标记矩阵。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
施特尔马奇,Macko-Podgórni, A,阿伦德,C。et al。西式胡萝卜的遗传多样性结构。BMC植物杂志21,200(2021)。https://doi.org/10.1186/s12870-021-02980-0
收到:
公认:
出版:
关键字
- Daucus Carota.
- 遗传多样性
- 人口结构
- 市场类别
- 根的形状
- 单核苷酸多态性
- DcSto
- DAPC.