- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
比较转录组分析和共表达网络分析揭示了与早期抗病相关的关键基因gydF4y2Ba黄曲霉gydF4y2Ba在玉米gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21gydF4y2Ba,文章号:gydF4y2Ba216gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
真菌gydF4y2Ba黄曲霉gydF4y2Ba(gydF4y2Ba答:flavusgydF4y2Ba)对玉米构成严重威胁(gydF4y2Ba玉米gydF4y2Ba)全球生产。由于黄曲霉毒素的高度毒性,黄曲霉毒素会造成相当大的产量和经济损失,并对人和牲畜的健康构成威胁。然而,关键基因和调控网络赋予玉米抗性gydF4y2Ba答:flavusgydF4y2Ba不清楚,尤其是在感染的早期。在这里,我们对两个具有不同抗性的玉米自交系进行了全面的转录组分析gydF4y2Ba答:flavusgydF4y2Ba感染。gydF4y2Ba
结果gydF4y2Ba
在接种后6 h内,每一株系模拟籽粒与感染籽粒的两两比较表明,玉米对病毒的抗性明显增强gydF4y2Ba答:flavusgydF4y2Ba感染具有基因型和感染阶段的特异性,抗性系的防御途径增强。通过对这两个玉米品系的进一步比较发现,抗性品系中差异表达基因(DEGs)的上调可能是抗性增强的基础。通过加权基因共表达网络分析(weighted Gene co-expression network analysis, WGCNA),鉴定出7个与不同感染阶段显著相关的模块,以及这些模块的110个枢纽基因。这些关键调控因子主要参与脂肪酸和抗生素的生物合成。此外,90个候选基因为玉米抗性gydF4y2Ba答:flavusgydF4y2Ba先前研究中获得的感染和/或黄曲霉毒素污染在前6 hpi内被证实在抗性和易感品系之间有差异表达。gydF4y2Ba
结论gydF4y2Ba
这项工作揭开了更多的面纱gydF4y2Ba答:flavusgydF4y2Ba并提供了早期抗性的详细调控网络gydF4y2Ba答:flavusgydF4y2Ba在玉米。gydF4y2Ba
背景gydF4y2Ba
玉米是世界上主要的主食和饲料作物,易受多种植物病原体的侵害。真菌gydF4y2Ba答:flavusgydF4y2Ba可在收获前后感染玉米,导致玉米穗和玉米粒腐烂,随后受到黄曲霉毒素污染[gydF4y2Ba1gydF4y2Ba].黄曲霉毒素具有剧毒和致癌性,主要损害人和动物的肝组织。据估计,全球4.6-28.2%的肝癌是由长期过量摄入黄曲霉毒素引起的[gydF4y2Ba2gydF4y2Ba].选育抗病玉米品种被认为是防治玉米病害的最具成本效益的措施gydF4y2Ba答:flavusgydF4y2Ba.因为抵抗gydF4y2Ba答:flavusgydF4y2Ba是一个复杂的数量性状[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],分子技术,包括标记辅助选择(MAS),转基因育种和基因编辑,将促进抗性品种的发展。然而,探索抗病基因及其调控网络是玉米抗病分子育种的前提gydF4y2Ba答:flavusgydF4y2Ba.gydF4y2Ba
在过去的20年里,定量性状位点(QTL)分析被广泛应用于玉米抗病基因的定位gydF4y2Ba答:flavusgydF4y2Ba感染和黄曲霉毒素积累。许多使用连锁映射方法解释表型变异不超过20%的qtl已被报道[gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2Ba13gydF4y2Ba].此外,许多与玉米抗性相关的单核苷酸多态性已通过全基因组关联研究(GWAS)确定[gydF4y2Ba14gydF4y2Ba- - - - - -gydF4y2Ba16gydF4y2Ba].到目前为止,没有与基因相关的gydF4y2Ba答:flavusgydF4y2Ba通过正向遗传学方法克隆了玉米的侵染和黄曲霉毒素积累。然而,通过定量PCR (qPCR)、RNA干扰(RNAi)等方法已经鉴定和鉴定了几个与玉米防御相关的基因或蛋白质。例如,致病相关(PR)蛋白,如PR10 [gydF4y2Ba17gydF4y2Ba],几丁质酶[gydF4y2Ba18gydF4y2Ba], PRm [gydF4y2Ba19gydF4y2Ba]和脂氧合酶[gydF4y2Ba20.gydF4y2Ba],被报道参与宿主病原体识别和易感性gydF4y2Ba答:flavusgydF4y2Ba感染和黄曲霉毒素积累。玉米信号通路中的一些蛋白,如钙依赖性蛋白激酶、呼吸爆发氧化酶和WRKY家族转录因子,主要在调节抗氧化和抗氧化蛋白的表达中起作用gydF4y2Ba公关gydF4y2Ba基因表达[gydF4y2Ba21gydF4y2Ba].其他因子,包括植物激素和多胺,也被认为是调控玉米抗病性的重要因素gydF4y2Ba答:flavusgydF4y2Ba.例如,玉米籽粒中乙烯含量的增加促进了玉米的增殖gydF4y2Ba答:flavusgydF4y2Ba[gydF4y2Ba22gydF4y2Ba].此外,多胺代谢促进了玉米的黄曲霉毒素抗性和整体抗逆性[gydF4y2Ba23gydF4y2Ba].虽然特定的基因和途径与玉米抗性有关,但真菌感染期间的转录组动态和转录网络的详细描述值得进一步研究。gydF4y2Ba
基于微阵列和RNA测序(RNA-seq)技术的转录组分析可以为病原体感染的转录网络提供关键的系统级洞察。许多差异表达基因(DEGs)和信号通路已被证实参与了抗性的调节gydF4y2Ba答:flavusgydF4y2Ba多项玉米转录组研究[gydF4y2Ba24gydF4y2Ba- - - - - -gydF4y2Ba27gydF4y2Ba].最近,双RNA-seq分析已用于生成基因共表达网络,包括玉米和玉米gydF4y2Ba答:flavusgydF4y2Ba基因,为了更好地理解两种生物之间复杂的相互作用[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].然而,这些研究大多集中在基因表达在几天后的动态变化gydF4y2Ba答:flavusgydF4y2Ba接种,但不接种到植物-病原体相互作用的早期阶段。以往的研究表明,病原体感染总是在初始阶段引发快速反应。早在接种后3h (hpi),gydF4y2BaZmCCTgydF4y2Ba玉米茎秆腐病定量抗病位点的致病基因达到最高表达水平[gydF4y2Ba30.gydF4y2Ba].在前6 hpi中,已鉴定出抗镰刀菌穗腐病的候选基因在抗性和易感玉米品系之间存在差异表达[gydF4y2Ba31gydF4y2Ba].在1hpigydF4y2Ba5种gydF4y2Ba,七个土豆(gydF4y2Ba茄属植物tuberosumgydF4y2Ba)抗病品种中致病/防御相关基因的诱导程度高于易感品种[gydF4y2Ba32gydF4y2Ba].前期的动态变化gydF4y2Ba答:flavusgydF4y2Ba感染仍然难以捉摸。因此,有必要对早期玉米籽粒的转录组进行分析gydF4y2Ba答:flavusgydF4y2Ba感染。gydF4y2Ba
在本研究中,我们比较和分析了两个具有不同抗性的玉米自交系的动态转录组重编程gydF4y2Ba答:flavusgydF4y2Ba.鉴定与玉米抗病性相关的早期反应基因和基因共表达网络gydF4y2Ba答:flavusgydF4y2Ba,分别在0、0.5、1.5、3、6 hpi取样。通过对DEGs和共表达网络的综合分析,确定了决定玉米抗性的关键调控机制。研究了先前发现的赋予玉米抗性的候选基因的表达模式。本研究结果为揭示玉米抗病性的关键因素和分子机制提供了依据gydF4y2Ba答:flavusgydF4y2Ba感染。gydF4y2Ba
结果gydF4y2Ba
玉米自交系接种后的评价gydF4y2Ba答:flavusgydF4y2Ba
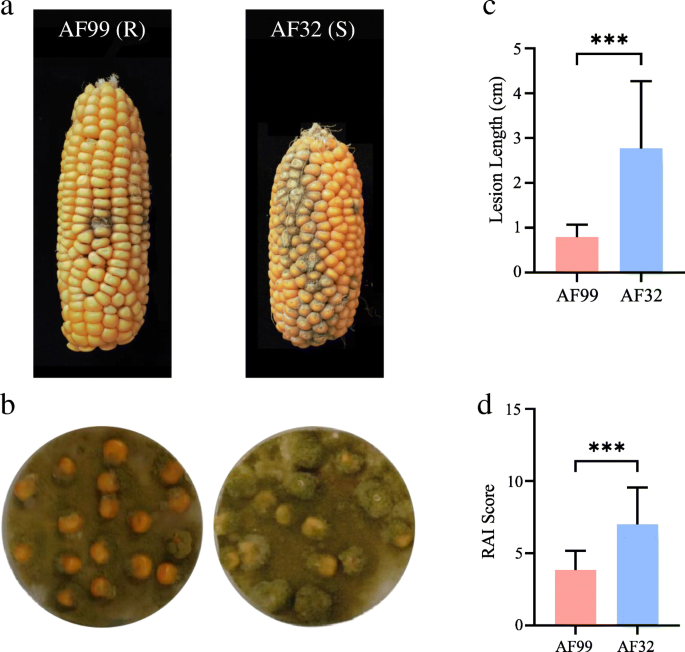
选择2个玉米自交系AF99和AF32进行抗性研究gydF4y2Ba答:flavusgydF4y2Ba通过在收获前和收获后的时间点用分生孢子接种籽粒(图。gydF4y2Ba1gydF4y2Ba).在收获前接种gydF4y2Ba答:flavusgydF4y2Ba在AF99中,感染主要局限于接种点,而在AF32中,它扩展到许多其他的内核,导致一个大的真菌斑块(图2)。gydF4y2Ba1gydF4y2Baa). AF32的菌斑明显长于AF99(图。gydF4y2Ba1gydF4y2Bab).收获后接种时,AF32的籽粒表面真菌覆盖率(RAI评分)显著高于AF99(图。gydF4y2Ba1gydF4y2Bac, d).因此,这两个玉米自交系对gydF4y2Ba答:flavusgydF4y2Ba收获前和收获后接种AF99的抗性均高于AF32。gydF4y2Ba
两个玉米品系收获前和收获后表型的研究。gydF4y2Ba一个gydF4y2Ba.取AF99和AF32的穗接种gydF4y2Ba答:flavusgydF4y2Ba收获前(授粉后15天)孢子悬浮。gydF4y2BabgydF4y2Ba.AF99和AF32的耳朵病变长度。数值为均值±标准差;gydF4y2BangydF4y2Ba= 15;***经t检验差异显著(gydF4y2BaPgydF4y2Ba< 0.001)。gydF4y2BacgydF4y2Ba.收获后,AF99和AF32玉米籽粒与真菌板共孵育。gydF4y2BadgydF4y2Ba.AF99和AF32籽粒RAI得分。RAI分数表示菌丝和孢子覆盖籽粒表面的比例。数值为均值±标准差;gydF4y2BangydF4y2Ba= 60;***经t检验差异显著(gydF4y2BaPgydF4y2Ba< 0.001)gydF4y2Ba
两个玉米自交系的整体转录组测序gydF4y2Ba
目的:研究病毒感染早期的转录组动态gydF4y2Ba答:flavusgydF4y2Ba,我们对AF99(抗性系)和AF32(敏感系)的籽粒进行了RNA-seq分析gydF4y2Ba答:flavusgydF4y2Ba接种(样品R和S)和ddHgydF4y2Ba2gydF4y2Ba各时间点(T0、T1、T2、T3、T4,详见方法)O接种(样品编号RC、SC)。共构建并测序了60个文库。每个库大约生成6.8 Gb的数据。在过滤低质量reads后,每个文库包含超过4500万条reads,其中81.17%映射到B73参考基因组(表S .)gydF4y2Ba1gydF4y2Ba).生物学重复之间的皮尔逊系数大于0.97,表明重复之间具有较高的一致性(图SgydF4y2Ba1gydF4y2Ba).为了进一步验证RNA-seq数据,随机选择5个基因进行实时RT-PCR分析(图SgydF4y2Ba2gydF4y2Ba表SgydF4y2Ba2gydF4y2Ba).结果表明,RNA-seq检测结果可靠,数据可用于进一步分析。gydF4y2Ba
侵染期间对照和侵染玉米籽粒DEGs的鉴定gydF4y2Ba
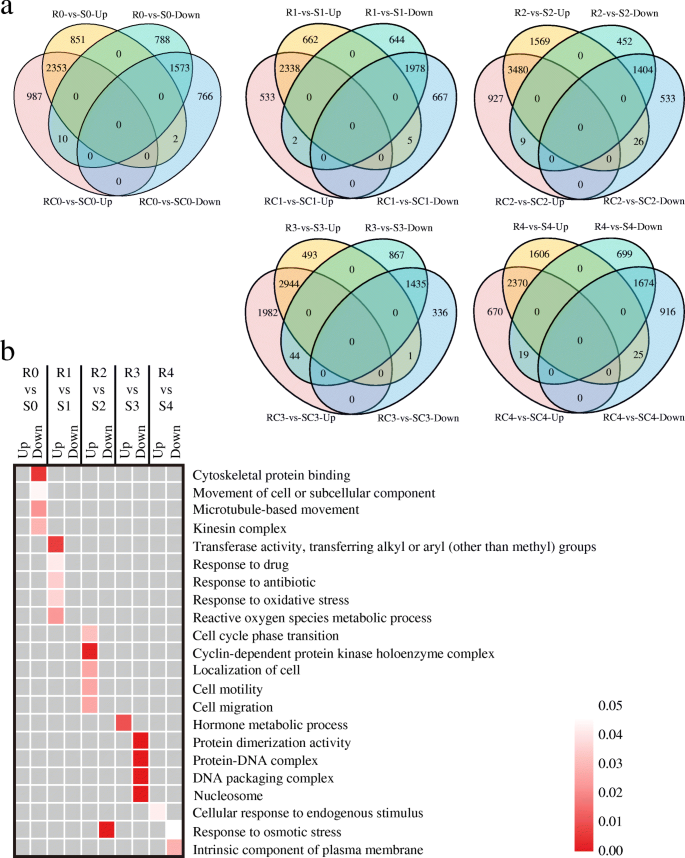
我们对模拟接种和真菌接种的籽粒(R vs. RC, S vs. SC)进行了成对比较,以确定对真菌接种有反应的基因gydF4y2Ba答:flavusgydF4y2Ba每个自交系每个时间点的感染情况。在起始阶段(T0期),在AF99和AF32中分别鉴定出395个(R0 vs. RC0)和300个(S0 vs. SC0) deg(表2)gydF4y2Ba1gydF4y2Ba).这些可能是参与宿主反应的初始基因。在T0期之后,两系中deg的数量都在不断变化gydF4y2Ba1gydF4y2Ba).这些发现的DEGs在每个时间点上在基因数量和基因功能上在两种系之间都有区别(图SgydF4y2Ba3.gydF4y2Ba).接种后,只有少数表达模式相似gydF4y2Ba答:flavusgydF4y2Ba(各时间点,两株分别上调5、2、47、70、204个基因,下调4、14、7、2、69个基因)(图SgydF4y2Ba3.gydF4y2Ba),这表明这些基因可能会对gydF4y2Ba答:flavusgydF4y2Ba两条线都感染了。我们还分析了感染期间同一基因型的基因表达模式,发现只有少数基因在一个以上的时间段内存在差异表达(图SgydF4y2Ba4gydF4y2Ba,年代gydF4y2Ba5gydF4y2Ba).综上所述,玉米籽粒对gydF4y2Ba答:flavusgydF4y2Ba感染具有基因型特异性和感染阶段特异性。gydF4y2Ba
通过对上述DEGs的GO分析,在T3期之前,很少有基因项被富集,随后大量基因优先与几个GO项相关(图。gydF4y2Ba2gydF4y2Baa).在T4期,真菌接种AF99 (R)的上调基因在几个不同的术语中富集,主要与防御反应有关,包括“响应外部生物刺激”(GO:0043207,更正)gydF4y2BapgydF4y2Ba-value = 0.0019),“氧化应激反应”(GO:0006979,更正gydF4y2BapgydF4y2Ba-value = 0.0001), " response to toxic substance " (GO:0009636,更正gydF4y2BapgydF4y2Ba-value = 0.0008),“活性氧代谢过程”(GO:0072593,更正gydF4y2BapgydF4y2Ba-value = 3.03E-06), " response to fungus " (GO:0009620,更正gydF4y2BapgydF4y2Ba-value = 0.045)和“激素结合”(GO:0042562,更正gydF4y2BapgydF4y2Ba-value = 0.043)。我们还观察到基于下调基因的与内核发育相关的术语,如“种子发育”(GO:0048316,更正)gydF4y2BapgydF4y2Ba-value = 0.0001)和“胚胎发育”(GO:0009790,更正gydF4y2BapgydF4y2Ba-value = 0.0028)(图gydF4y2Ba2gydF4y2Baa).在易感系AF32中,上调基因富集在相对较少的与植物防御相关的通路中,而下调基因也聚集在一些与免疫相关的术语中,如“oxidoreductase activity”(GO:0016491, corrected)gydF4y2BapgydF4y2Ba-value = 0.0267),“激素介导的信号通路”(GO:0009755,更正gydF4y2BapgydF4y2Ba-value = 0.0002), " response to endogenous stimulus " (GO:0009719, correctedgydF4y2BapgydF4y2Ba-value = 5.37E-06)和“诱导系统性耐药,茉莉酸介导的信号通路”(GO:0009864,校正gydF4y2BapgydF4y2Ba-value = 0.009)gydF4y2Ba2gydF4y2Baa). KEGG分析表明,接种后,一些与植物抗性相关的代谢物,如苯并恶嗪类、类固醇和类胡萝卜素的合成在易感系中受到抑制(图SgydF4y2Ba6gydF4y2Ba).gydF4y2Ba
差异表达基因对gydF4y2Ba答:flavusgydF4y2Ba在感染时接种AF99和AF32。gydF4y2Ba一个gydF4y2Ba.富集基因本体(富集基因本体,GO)是下调和上调基因对疾病的反应gydF4y2Ba答:flavusgydF4y2BaAF99和AF32在不同时间点接种(感染vs模拟处理)。颜色深度表示显著性程度,如底部刻度所示(已校正)gydF4y2BapgydF4y2Ba-value被规范化)。R0-R5和S0-S5分别为AF99和AF32中0、0.5、1.5、3和6 hpi受到病原体攻击的样品;RC0-RC5和SC0-SC5代表ddH处理过的样品gydF4y2Ba2gydF4y2Ba在AF99和AF32中分别为0、0.5、1.5、3和6 hpi。gydF4y2BabgydF4y2Ba.生物应激途径的可视化搜索已知基因的反应gydF4y2Ba答:flavusgydF4y2Ba通过MapMan软件对AF99(上)和AF32(下)进行T4期接种。每个小方块代表一个基因。蓝色表示下调的基因(loggydF4y2Ba2gydF4y2Ba(R4/RC4)或日志gydF4y2Ba2gydF4y2Ba(SC4/S4) <−1),红色表示上调基因(loggydF4y2Ba2gydF4y2Ba(R4/RC4)或日志gydF4y2Ba2gydF4y2Ba(sc4 / s4) > 1)。−1到+ 1表示标准化的日志gydF4y2Ba2gydF4y2Ba(折叠变化)gydF4y2Ba
接下来,我们可视化了响应的deg的表达谱gydF4y2Ba答:flavusgydF4y2Ba在T4阶段通过MapMan工具。根据细胞反应的一般概述,生物应激反应是诱导的主要反应(图SgydF4y2Ba7gydF4y2Ba).很明显,大多数对生物胁迫反应的DEGs(220/260)在AF99中上调,而只有一半的基因(344/665)在AF32中上调。gydF4y2Ba2gydF4y2Bab,表SgydF4y2Ba3.gydF4y2Ba).九个gydF4y2BaWRKYgydF4y2Ba在AF99(全部上调)和AF32(一半上调)中鉴定出8个基因,其中3个(gydF4y2BaLOC100193498gydF4y2Ba,gydF4y2BaLOC100501702gydF4y2Ba,gydF4y2BaLOC103635353gydF4y2Ba)在两系中均普遍上调。大多数编码其他转录因子的基因,如ERF、bZIP、MYB和DOF,以及激素相关基因在易感系中表达下调。乙烯途径中三分之二的基因在抗性品系AF99中表达上调。其中,gydF4y2BaLOC103651133gydF4y2Ba,编码乙烯响应传感器1,上调13.9倍。在易感系AF32中,乙烯途径基因有一半下调,其中折叠变化排名前两位的是DEAD box RNA解旋酶假基因(gydF4y2BaLOC100272753gydF4y2Ba, 19.6倍)和乙烯响应转录因子ERF109-like (gydF4y2BaLOC103647485gydF4y2Ba16倍)。此外,大多数参与防御途径的基因,如细胞壁、信号、蛋白水解等,在抗性系中表达上调,在易感系中表达下调。gydF4y2Ba
两个玉米自交系侵染过程中DEGs的鉴定gydF4y2Ba
不管有没有挑战gydF4y2Ba答:flavusgydF4y2Ba结果表明,在每一阶段均有超过5000个基因在两系(RC vs. SC, R vs. S)之间存在差异表达,表明这些基因的表达受其遗传背景的影响(表2)gydF4y2Ba1gydF4y2Ba).Venn图显示,一小部分DEGs仅在真菌接种的籽粒中表现出差异表达(R vs. S)(图2)。gydF4y2Ba3.gydF4y2BaA),表明它们的表达差异可能是由真菌感染引起的。以T0期为例,无论接种与否,2353和1573 DEGs普遍上调或下调gydF4y2Ba答:flavusgydF4y2Ba.但851个和788个DEGs分别只在真菌接种的籽粒中上调或下调(图2)。gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2Ba
AF99和AF32在受或不受胁迫时的差异表达基因gydF4y2Ba答:flavusgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba.维恩图显示了AF99和AF32之间在每个阶段的deg的数量gydF4y2Ba答:flavusgydF4y2Ba接种。上调和下调基因的总数(loggydF4y2Ba2gydF4y2Ba折叠变化≥1或≤- 1且gydF4y2BaPgydF4y2Ba与AF32相比,模拟接种组(RC vs SC)和真菌接种组(R vs S) AF99的表达均< 0.05)。gydF4y2BabgydF4y2Ba.真菌接种AF99和AF32籽粒的特异性差异表达基因中富集了基因本体术语。颜色深度表示显著性程度,如右侧刻度所示(已修正)gydF4y2BapgydF4y2Ba值)gydF4y2Ba
接下来,我们通过功能富集分析,只研究了真菌接种的5个侵染阶段籽粒中的DEGs。根据GO分析,我们发现这些上调的DEGs主要参与植物的胁迫反应,如“对药物的反应”(GO:0042493)、“对抗生素的反应”(GO:0046677)、“活性氧代谢过程”(GO:0072593)、“激素代谢过程”(GO:0042445)(图4)。gydF4y2Ba3.gydF4y2Bab). KEGG分析也表明,这些上调的基因参与了不同的信号通路和次级代谢产物的生物合成,如抗生素和prodigiins(图SgydF4y2Ba8gydF4y2Ba),而下调的DEGs在防御反应中并没有得到富集。这些结果表明,真菌接种玉米籽粒中特异性上调的DEGs可能参与了免疫应答gydF4y2Ba答:flavusgydF4y2Ba挑战。gydF4y2Ba
期间基因共表达分析gydF4y2Ba答:flavusgydF4y2BaWGCNA感染gydF4y2Ba
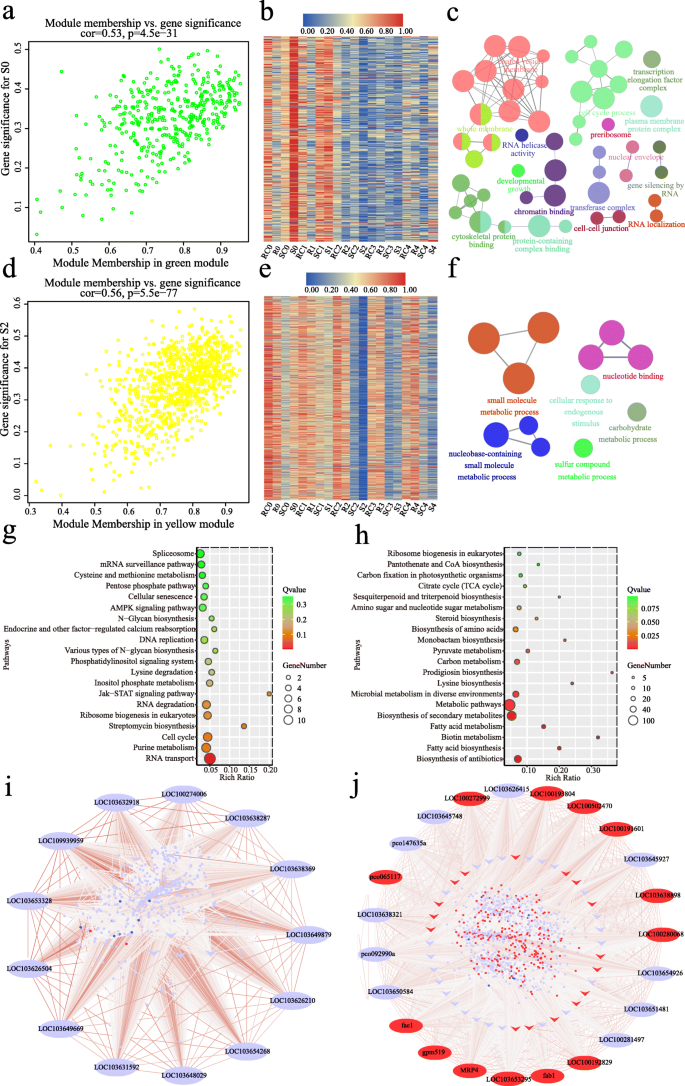
为了便于我们了解玉米基因型特异性和侵染期特异性反应的调控网络gydF4y2Ba答:flavusgydF4y2Ba60个样本及其表达数据集,包括34315个基因进行WGCNA检测。然后选择15409个基因(中位数绝对偏差(MAD)的前75%,MAD> 0.25)构建有向网络。基于无标度拓扑准则,我们选择β = 12的幂来生成层次聚类树(图SgydF4y2Ba9gydF4y2Ba,无花果。gydF4y2Ba4gydF4y2Baa).最终共鉴定出9个共表达模块(mergeCutHeight = 0.25),每个模块的基因数在38 ~ 7259之间。每个模块用不同的颜色标记,2438个不属于任何模块的基因被放入灰色模块。gydF4y2Ba
AF99和AF32的转录本WGCNA。gydF4y2Ba一个gydF4y2Ba.采用平均连锁层次聚类方法构建全转录组谱的基因树状图,每条线代表一个基因。集群树下面的模块颜色显示了动态树切割(Dynamic tree Cut)分配模块的结果。gydF4y2BabgydF4y2Ba.模块特征基因与线/阶段之间的相关性。每个模块的颜色与(中的颜色相同gydF4y2Ba一个gydF4y2Ba).每个模块的基因号显示在模块名称底部的括号中。表型的定义见图SgydF4y2Ba10gydF4y2Ba.相关系数和gydF4y2BapgydF4y2Ba-value在每个单元格中显示gydF4y2Ba
然后研究各模块特征基因与基因型/阶段之间的相关性(图SgydF4y2Ba10gydF4y2Ba,无花果。gydF4y2Ba4gydF4y2Bab).大部分模块与不同玉米自交系呈显著相关,其中4个模块(蓝色、红色、绿松石色和黄色)呈显著正相关,3个模块(棕色、品红和粉色)呈显著负相关。绿松石基因模块占WGCNA基因总数的近一半,与玉米自交系(gydF4y2BargydF4y2Ba= 1,gydF4y2BapgydF4y2Ba= 2 e - 66)。值得注意的是,这些基因在绿松石模块中的表达几乎不受真菌接种或感染阶段的影响。gydF4y2Ba4gydF4y2BaB),暗示他们可能没有参与抵抗gydF4y2Ba答:flavusgydF4y2Ba在早期阶段。gydF4y2Ba
我们发现三个模块(蓝色、棕色和绿色)的基因表达模式与感染时间显著相关。例如,蓝色和棕色模块的基因在T2阶段之前表达量较低,在T3和T4阶段逐渐不同程度地增加,而绿色模块的基因则相反。然而,没有发现与接种相关的模块(模拟接种或真菌接种),这可能是由于它们在遗传背景上的巨大差异和基因表达的快速动态变化。gydF4y2Ba
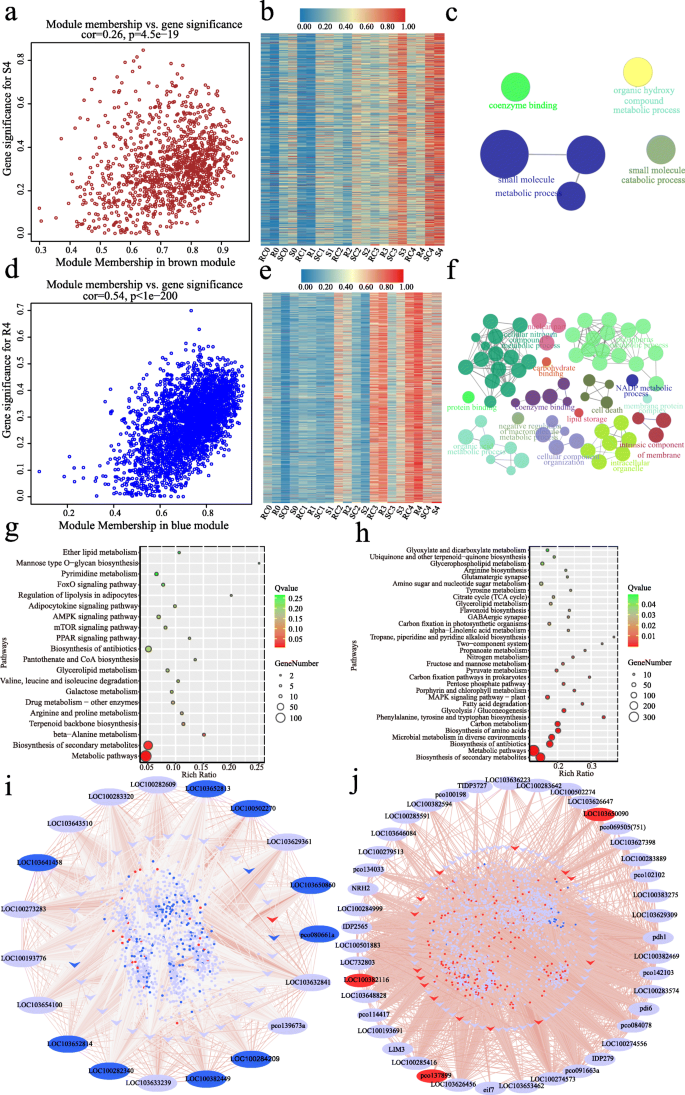
为了研究感染过程中精确的基因调控网络,我们在连续感染阶段将基因共表达模块连接到四个组(R、RC、S、SC)进行WGCNA。总的来说,有7个模块(蓝色、棕色、绿色、黄色、黑色、粉红色和品红)被发现与特定的感染阶段相关(图。gydF4y2Ba4gydF4y2Bab).在T0阶段,绿色模块(410个基因)与S0 (gydF4y2BargydF4y2Ba= 0.43,gydF4y2BapgydF4y2Ba= 7e-04),而brown模块(1140个基因)与R0 (gydF4y2BargydF4y2Ba=−0.36,gydF4y2BapgydF4y2Ba= 0.005)。在T1期,品红模块(38个基因)和粉色模块(104个基因)与SC1 (gydF4y2BargydF4y2Ba= 0.43,gydF4y2BapgydF4y2Ba= 0.001)和S1 (gydF4y2BargydF4y2Ba= 0.35,gydF4y2BapgydF4y2Ba= 0.005)。在T2阶段,黄色模块(919个基因)和黑色模块(122个基因)均与S2呈显著负相关。在T3和T4阶段,棕色模块与S3呈正相关(gydF4y2BargydF4y2Ba= 0.36,gydF4y2BapgydF4y2Ba= 0.005)和S4 (gydF4y2BargydF4y2Ba= 0.44,gydF4y2BapgydF4y2Ba= 7e-04),蓝色模块(2753个基因)与R4 (gydF4y2BargydF4y2Ba= 0.39,gydF4y2BapgydF4y2Ba= 0.002)。gydF4y2Ba4gydF4y2Bab).各模块中特定阶段基因表达与模块隶属度(MM)之间存在显著相关性(图。gydF4y2Ba5gydF4y2Baa, d, Fig。gydF4y2Ba6gydF4y2Baa d SgydF4y2Ba11gydF4y2Ba).四个关键模块(基因号> 400)将在接下来的章节中进一步分析。gydF4y2Ba
绿色和黄色模块中的表达谱和转录调节网络。gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba绿色/S0 (gydF4y2Ba一个gydF4y2Ba)和黄色模块/S2 (gydF4y2BadgydF4y2Ba),具有相关性和gydF4y2BapgydF4y2Ba值表示。gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba绿色为基因热图(gydF4y2BabgydF4y2Ba)和黄色模块(gydF4y2BaegydF4y2Ba).红色表示高表达,蓝色表示低表达。颜色刻度代表z分数。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba绿色基因GO分析(gydF4y2BacgydF4y2Ba)和黄色模块(gydF4y2BafgydF4y2Ba).每个圆圈代表一个富集类别,圆圈的大小表示基因的数量。详细的富集结果见表SgydF4y2Ba4gydF4y2Ba和SgydF4y2Ba5gydF4y2Ba.gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba绿色的前20个相关KEGG路径(gydF4y2BaggydF4y2Ba)和黄色模块(gydF4y2BahgydF4y2Ba).gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba绿色模块的共表达式网络(gydF4y2Ba我gydF4y2Ba)和黄色模块(gydF4y2BajgydF4y2Ba).外圆的椭圆代表枢纽基因,内圆的箭头代表转录因子,圆中的小圆点代表每个模块中的其他共表达基因。所有基因之间的关系都是用线连接起来的,线的颜色代表权重。红色椭圆/箭头/圆点表示上调(loggydF4y2Ba2gydF4y2Ba(R/S) > 1),蓝色椭圆/箭头/圆点表示电阻线(log . S)下调gydF4y2Ba2gydF4y2Ba(R/S) <−1)在两个特定阶段(绿色模块为T0,黄色模块为T2)gydF4y2Ba
棕色和蓝色模块中的表达谱和转录调节网络。gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Babrown/S4的基因显著性与模块隶属度的散点图(gydF4y2Ba一个gydF4y2Ba)和蓝色模块/R4 (gydF4y2BadgydF4y2Ba),具有相关性和gydF4y2BapgydF4y2Ba值表示。gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba棕色基因热图(gydF4y2BabgydF4y2Ba)和蓝色模块(gydF4y2BaegydF4y2Ba).红色表示高表达,蓝色表示低表达。颜色刻度代表z分数。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba棕色基因GO分析(gydF4y2BacgydF4y2Ba)和蓝色模块(gydF4y2BafgydF4y2Ba).每个圆圈代表一个富集类别,圆圈的大小表示基因的数量。详细的富集结果见表SgydF4y2Ba6gydF4y2Ba和SgydF4y2Ba7gydF4y2Ba.gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba棕色(gydF4y2BaggydF4y2Ba,前20名)和蓝色模块(gydF4y2BahgydF4y2Ba,纠正gydF4y2BapgydF4y2Ba-value < 0.05)。gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba棕色模块的共表达网络(gydF4y2Ba我gydF4y2Ba)和蓝色模块(gydF4y2BajgydF4y2Ba).外圆的椭圆代表枢纽基因,内圆的箭头代表转录因子,圆中的小圆点代表每个模块中的其他共表达基因。所有基因之间的关系都是用线连接起来的,线的颜色代表权重。红色椭圆/箭头/圆点表示T4期抗性线log2(R/S) > 1上调,蓝色椭圆/箭头/圆点表示log2(R/S) <−1下调gydF4y2Ba
转录调控模块的特征和枢纽基因与不同感染阶段相关gydF4y2Ba
在绿色模块中,与模拟接种组相比,真菌接种的AF32 (S)在T0期基因表达上调(图。gydF4y2Ba5gydF4y2Bab).根据GO分析,我们得到了50个显著的GO项(更正)gydF4y2BapgydF4y2Ba< 0.05),前两项为“质膜蛋白复合物”(GO:0098797,更正)gydF4y2BapgydF4y2Ba-value =2.36E-08)和“细胞周期过程”(GO: 002402,已更正gydF4y2BapgydF4y2Ba-value =5.04E-07)gydF4y2Ba5gydF4y2Bac,表SgydF4y2Ba4gydF4y2Ba).KEGG分析表明,这些基因与RNA转运密切相关(图2)。gydF4y2Ba5gydF4y2Ba此外,还鉴定出13个hub基因(图。gydF4y2Ba5gydF4y2Bai,表SgydF4y2Ba8gydF4y2Ba),包括gydF4y2BaLOC109939959gydF4y2Ba的同系物编码gydF4y2Ba拟南芥gydF4y2BaDNA去甲基化酶沉默抑制因子1 (gydF4y2BaROS1gydF4y2Ba,gydF4y2BaAT2G36490gydF4y2Ba).拟南芥的gydF4y2Baros1gydF4y2Ba突变体显示许多基因启动子的甲基化水平较高,对病原体的易感性增加[gydF4y2Ba33gydF4y2Ba- - - - - -gydF4y2Ba36gydF4y2Ba].另一个中枢基因,gydF4y2BaLOC103631592gydF4y2Ba它可能也参与调节甲基化水平,因为它与拟南芥同源gydF4y2BaAT5G04290gydF4y2Ba(gydF4y2BaSPT5LgydF4y2Ba)是rna定向DNA甲基化所必需的[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].一致的,GO分析也表明绿色模块中的基因在“去甲基化”中富集(GO:0070988,更正)gydF4y2BapgydF4y2Ba-value = 0.0019),“RNA沉默基因”(GO:0031047,更正gydF4y2BapgydF4y2Ba-value = 0.0184)和“基因沉默”(GO:0016458,更正gydF4y2BapgydF4y2Ba-value = 0.0192)。综上所述,我们推测基因组甲基化水平的改变和基因沉默可能与玉米籽粒早期抗性有关gydF4y2Ba答:flavusgydF4y2Ba感染。gydF4y2Ba
在黄色模块中,S组和SC组的基因表达水平在T2期急剧下降,S2组的下降比SC2组更明显(图2)。gydF4y2Ba5gydF4y2Bae).氧化石墨烯富集分析显示,有12个氧化石墨烯术语显著过代表(更正)gydF4y2BapgydF4y2Ba-value < 0.05),包括“小分子代谢过程”(GO:0044281,更正)gydF4y2BapgydF4y2Ba-value = 1.94E-10)和“细胞对内源性刺激的反应”(GO:0071495,更正gydF4y2BapgydF4y2Ba-value = 0.0450)(图gydF4y2Ba5gydF4y2Baf,表SgydF4y2Ba5gydF4y2Ba).KEGG通路分析结果显示,最显著的两条通路分别为“抗生素生物合成”和“脂肪酸生物合成”(图2)。gydF4y2Ba5gydF4y2Bah).此外,本模块共筛选出23个hub基因。5 (gydF4y2Bafab1gydF4y2Ba,gydF4y2BaLOC100192829gydF4y2Ba,gydF4y2BaLOC100281497gydF4y2Ba,gydF4y2Bagpm519gydF4y2Ba,gydF4y2Bafae1gydF4y2Ba)及两个(gydF4y2Bapco065117gydF4y2Ba而且gydF4y2BaLOC100191601gydF4y2Ba),分别与脂肪酸生物合成和脂质代谢过程直接相关(图。gydF4y2Ba5gydF4y2Baj,表SgydF4y2Ba8gydF4y2Ba).gydF4y2Ba
在棕色模块中,SC组和S组这些基因的表达量增加,其中S2的增加更为明显(图2)。gydF4y2Ba6gydF4y2Bab).根据GO和KEGG分析,只有6个术语(更正gydF4y2BapgydF4y2Ba-value< 0.05)和3条富集通路(gydF4y2Ba问gydF4y2Ba值< 0.05)。gydF4y2Ba6gydF4y2Bac, g,表SgydF4y2Ba6gydF4y2Ba).在该模块中鉴定的19个枢纽基因(图。gydF4y2Ba6gydF4y2Bai,表SgydF4y2Ba8gydF4y2Ba)、三种Barwin家族蛋白(gydF4y2BaLOC100282340gydF4y2Ba,gydF4y2BaLOC103652813gydF4y2Ba,gydF4y2BaLOC103652814gydF4y2Ba)具有几丁质酶活性,可能作为PR蛋白在酶切过程中发挥重要作用gydF4y2Ba答:flavusgydF4y2Ba感染(gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].gydF4y2BaLOC100193776gydF4y2Ba的正交正交gydF4y2BaLAZY1gydF4y2Ba在水稻中,参与调控生长素转运和生长素信号通路,也是棕色模块的枢纽基因[gydF4y2Ba41gydF4y2Ba].此外,其他四个中心基因(gydF4y2BaLOC100382449gydF4y2Ba,gydF4y2Bapco080661agydF4y2Ba,gydF4y2BaLOC100273283gydF4y2Ba,gydF4y2BaLOC103632841gydF4y2Ba)被认为参与了对各种生物或非生物胁迫的反应。gydF4y2Ba
在蓝色模块中,RC组和R组基因表达增加,之后趋势更明显gydF4y2Ba答:flavusgydF4y2Ba感染(R)(图;gydF4y2Ba6gydF4y2Bae).经GO和KEGG分析,有71个术语和32个通路具有统计学意义(图。gydF4y2Ba6gydF4y2Baf, h,表SgydF4y2Ba7gydF4y2Ba).值得注意的是,在蓝色模块中,226个基因参与了“氧化还原过程”(GO:0055114, corrected)gydF4y2BapgydF4y2Ba-value = 0.0017)和8个与“植物型超敏反应”相关的基因(GO:0009626,已校正)gydF4y2BapgydF4y2Ba-value = 0.0075)(图gydF4y2Ba6gydF4y2Baf, h). KEGG分析还显示,该模块基因在“抗生素生物合成”、“氨基酸生物合成”、“糖酵解/糖异生”、“脂肪酸降解”等途径中富集(图。gydF4y2Ba6gydF4y2Bag).本模块共鉴定出43个hub基因(图。gydF4y2Ba6gydF4y2Baj,表SgydF4y2Ba8gydF4y2Ba).6 (gydF4y2BaLOC103636223gydF4y2Ba,gydF4y2BaLOC100382469gydF4y2Ba,gydF4y2BaLOC103650090gydF4y2Ba,gydF4y2BaLOC100284999gydF4y2Ba,gydF4y2BaLOC103626647gydF4y2Ba,gydF4y2Bapco102102gydF4y2Ba),它们都与抗生素的生物合成密切相关。另一个中枢基因,gydF4y2BaIDP2565gydF4y2Ba编码aPR10蛋白,在玉米宿主防御中至关重要gydF4y2BaPR10gydF4y2Barnai沉默的成熟籽粒显示出更多的真菌定植和黄曲霉毒素的产生[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].枢纽基因gydF4y2BaLOC100274556gydF4y2Ba的同源物gydF4y2BaAT1G68010gydF4y2Ba,其蛋白质具有过氧化氢酶活性,使拟南芥能够耐受多种非生物胁迫[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
7个模块中共有110个枢纽基因与不同的感染阶段相关。这些基因在GO术语中富集,“细胞胺代谢过程”、“对真菌的防御反应”和“脂肪酸合成酶活性”(图SgydF4y2Ba12gydF4y2Ba表SgydF4y2Ba9gydF4y2Ba).KEGG的前两条通路分别是“脂肪酸生物合成”和“抗生素生物合成”(图SgydF4y2Ba12gydF4y2Ba).因此,这些中枢基因和生物途径可能在调节防御反应中发挥重要作用gydF4y2Ba答:flavusgydF4y2Ba玉米感染。gydF4y2Ba
整合先前识别的候选基因和转录组数据gydF4y2Ba
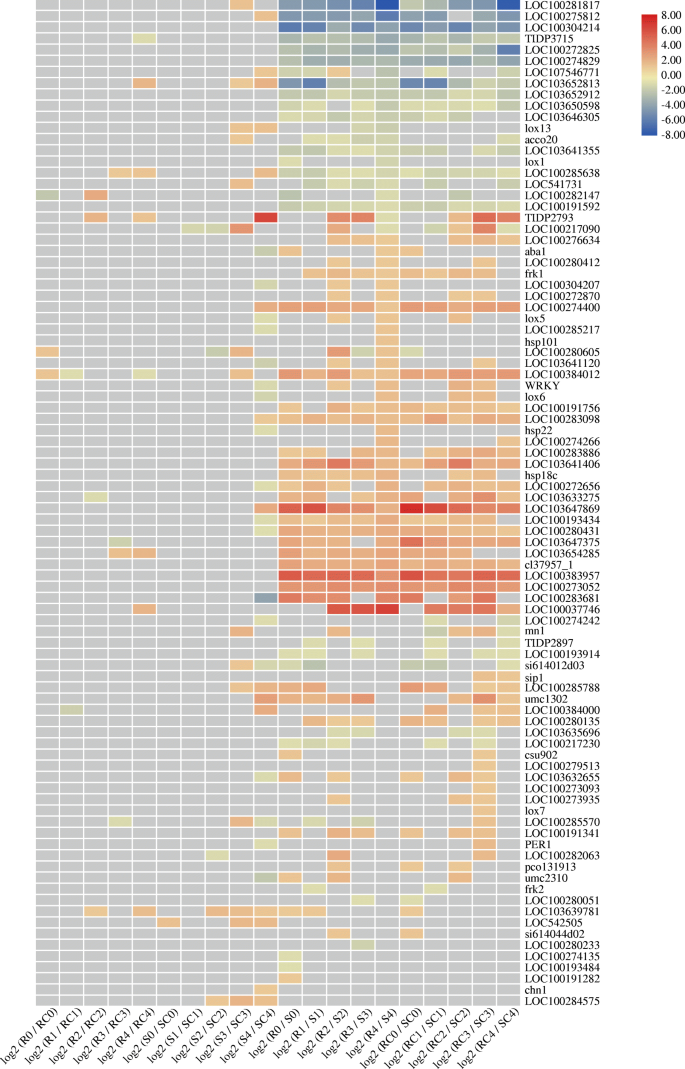
玉米抗性195个候选基因的列表gydF4y2Ba答:flavusgydF4y2Ba曾有感染及/或黄曲霉毒素污染的报告[gydF4y2Ba45gydF4y2Ba].有趣的是,我们注意到这些基因在感染早期在两种株系中的表达差异。在前6个hpi中,这些基因中有90个被发现有差异表达(图2)。gydF4y2Ba7gydF4y2Ba).基因型间(RC与SC、R与S)的表达差异显著高于处理间(RC与R、SC与S),与对照组(RC和SC)相比,AF99和AF32中分别有14个和42个基因表达差异。其中八个基因(gydF4y2BaLOC103652813gydF4y2Ba,gydF4y2BaLOC103639781gydF4y2Ba,gydF4y2BaLOC100280605gydF4y2Ba,gydF4y2BaTIDP2793gydF4y2Ba,gydF4y2BaLOC100285638gydF4y2Ba,gydF4y2BaLOC100384012gydF4y2Ba,gydF4y2BaLOC100384000gydF4y2Ba,gydF4y2BaLOC103633275gydF4y2Ba)的诱导。在T4期,AF99中有6个基因上调,包括Barwin-like (gydF4y2BaLOC103652813gydF4y2Ba),转录因子MYB41 (gydF4y2BaLOC100037746gydF4y2Ba)、几丁质酶2 (gydF4y2BaLOC100285638gydF4y2Ba), WRKY转录因子23 (gydF4y2BaLOC103654285gydF4y2Ba),可能是WRKY转录因子53 (gydF4y2BaLOC103639781gydF4y2Ba),gydF4y2BaLOC100272820gydF4y2Ba编码一种未知蛋白质。其中,gydF4y2BaLOC103652813gydF4y2Ba,gydF4y2BaLOC100285638gydF4y2Ba,gydF4y2BaLOC100272820gydF4y2Ba,gydF4y2BaLOC103639781gydF4y2BaAF32也上调。此外,AF32中有18个基因下调,而AF99中只有2个基因下调,说明诱导了更多的抗病性,进而促进了AF99的抗性。gydF4y2Ba
我们还分析了这些候选基因与我们通过WGCNA获得的hub基因之间的关系,发现110个hub基因中有3个在列表中。蓝色模块中有两个中心基因,gydF4y2BaLOC100279513gydF4y2Ba而且gydF4y2BaLOC100285591gydF4y2Ba,或与两个作图群体中的qtl有关,或与先前报道的GWAS面板中的黄曲霉毒素积累有关[gydF4y2Ba45gydF4y2Ba].一个枢纽基因(gydF4y2BaLOC103652813gydF4y2Ba)的绿色模块(位于bin 4.02),也在合并列表中[gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
讨论gydF4y2Ba
玉米籽粒防御系统的分子机制和精确调控网络gydF4y2Ba答:flavusgydF4y2Ba在早期都是有限的。在这项工作中,我们重点研究了真菌感染6小时内耐药和易感系的转录组重编程。诱导的deggydF4y2Ba答:flavusgydF4y2Ba分析两系间的感染情况。在T0期,两系均鉴定出超过300个deg(表gydF4y2Ba1gydF4y2Ba),而在先前的研究中,只有一个基因在感染初期被发现[gydF4y2Ba29gydF4y2Ba],这表明玉米籽粒对真菌入侵的反应非常迅速。这种差异可能是由于本研究采用了改进的真菌接种方法。在这里,将玉米粒纵向切开,浸泡在孢子悬浮液中。玉米细胞之间的充分接触gydF4y2Ba答:flavusgydF4y2Ba可消除种皮造成的干扰。本研究以接种于0、0.5、1.5、3、6 hpi的籽粒为样本,各时间点的DEGs均有变化,说明在早期存在动态调节。我们采样时间的密度将有助于我们了解玉米抗的精确表达调控网络gydF4y2Ba答:flavusgydF4y2Ba在初始阶段gydF4y2Ba.gydF4y2Ba与模拟接种组相比,除T0期外,易感系AF32比抗性系AF99具有更多的deg(表2)gydF4y2Ba1gydF4y2Ba).这一发现与先前在72 hpi下抗性和易感籽粒中分别诱导214和2159个基因的结果一致[gydF4y2Ba46gydF4y2Ba].这些结果表明,易感系易受gydF4y2Ba答:flavusgydF4y2Ba感染,导致接种后基因表达的剧烈变化。gydF4y2Ba
基于动态转录组分析,gydF4y2Ba答:flavusgydF4y2Ba感染诱导了大量的deg,其中大多数与宿主防御有关(图2)。gydF4y2Ba2gydF4y2Ba).其中,接种AF99(R)后,84%的DEGs表达上调,而接种AF32后,仅有48%的DEGs表达上调。(无花果。gydF4y2Ba2gydF4y2Ba).此外,90个候选抗性基因中的大多数在AF99中表现出高于AF32的基本表达水平(图3)。gydF4y2Ba7gydF4y2Ba).综上所述,这些可能是造成耐药性差异的主要原因。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
综合GO分析、KEGG分析和WGCNA分析表明gydF4y2Ba答:flavusgydF4y2Ba玉米的抗性是基因型- /阶段特定的(图;gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).WGCNA是系统生物学中一个完善的工具,它可以用来描述多个样本中基因之间的相关性模式。通过WGCNA,我们采用全基因组表达数据构建完整的共表达网络,认为7个模块与不同感染阶段相关(图2)。gydF4y2Ba4gydF4y2Ba).这些模块的GO和KEGG分析显示,参与质膜蛋白复合体、细胞周期过程、RNA转运和DNA甲基化的基因在感染的初始阶段(T0和T1)受到影响;一些次生代谢过程,如抗生素的生物合成、脂肪酸的生物合成和生物素代谢物,在T2阶段被感染激活;在T3和T4阶段发现了更多参与激素信号、抗生素和脂肪酸生物合成、脂质储存和超敏细胞死亡反应(HRs)的DEGs或枢纽基因(图2)。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,年代gydF4y2Ba6gydF4y2Ba,年代gydF4y2Ba8gydF4y2Ba).为分子育种提供了新的遗传资源,加深了我们对玉米抗病性的认识gydF4y2Ba答:flavusgydF4y2Ba.gydF4y2Ba
答:flavusgydF4y2Ba是一种以死亡宿主细胞为食的坏死性真菌病原体。传统上认为,HR以及HR触发的程序性细胞死亡(PCD)可以增强坏死性病原体的毒力[gydF4y2Ba47gydF4y2Ba- - - - - -gydF4y2Ba49gydF4y2Ba].然而,近年来,一些研究报道,增加触发HR的某些基因的表达也可能增强植物对坏死性病原体的抗性[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].因此,轮毂基因的功能分析和与侵染阶段相关的7个模块的GO富集分析表明,HR和PCD参与的基因可能在玉米抗病性中发挥关键作用gydF4y2Ba答:flavusgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba表SgydF4y2Ba8gydF4y2Ba).我们分析了35个与HR和PCD相关的基因,发现11个基因位于蓝色模块,并在T4期AF99(R)中上调(图S)gydF4y2Ba13gydF4y2Ba).其中,gydF4y2BaLOC100502274gydF4y2Ba的同源物gydF4y2BaAT4G38360gydF4y2Ba(gydF4y2BaLAZ1gydF4y2Ba)对拟南芥中与HR相关的PCD有贡献[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba].而AF32(S)中35个基因中有4个在T4期上调,其中3个聚集在棕色模块中(图S)gydF4y2Ba13gydF4y2Ba).特别是两个基因(gydF4y2BaLOC103652814gydF4y2Ba而且gydF4y2Bapco080661agydF4y2Ba)为棕色模块的枢纽基因,提示易感系HRs在T4期受到刺激。这些结果表明,PCD和HRs可能是在此之后触发的gydF4y2Ba答:flavusgydF4y2Ba这两个品系接种后,还需要进一步的实验来验证它们与玉米对寄主防御的关系gydF4y2Ba答:flavusgydF4y2Ba.gydF4y2Ba
KEGG富集分析表明,与抗生素合成相关的基因可能参与调节宿主防御(图2)。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,年代gydF4y2Ba8gydF4y2Ba,年代gydF4y2Ba12gydF4y2Ba).植物源性抗生素是植物产生的抗微生物次生代谢产物。它们既含有健康植物中固有的预制抗真菌化合物,也含有应对病原体入侵而合成的诱导抗真菌化合物(植物毒素)[gydF4y2Ba54gydF4y2Ba].在玉米中,几种抗生素的动态调节,包括苯并恶嗪类、苯丙类、氧脂素和萜类,在受到不同病原体挑战时,对宿主的抗性有很大的贡献[gydF4y2Ba55gydF4y2Ba- - - - - -gydF4y2Ba61gydF4y2Ba].在我们的研究中,在抗性和敏感品系中,调节苯丙烷、二萜和萜类骨架生物合成的基因在真菌攻击时都上调了(图SgydF4y2Ba6gydF4y2Ba).根据WGCNA的结果,在黄色模块和蓝色模块中,AF99中分别有58个和388个抗生素生物合成相关基因被增强;而在棕色模块的AF32中只发现了38个相关基因。这些结果表明AF99可能具有更强的抗生素合成能力(图2)。gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).因此,我们推测植物源性抗生素参与了玉米抗性的调控gydF4y2Ba答:flavusgydF4y2Ba在感染早期,可能是基因型间耐药变异的重要因素。gydF4y2Ba
结论gydF4y2Ba
总的来说,在收获前和收获后接种抗性不同的两个玉米品系的RNA-seq数据为研究玉米籽粒抗性提供了强有力的资源gydF4y2Ba答:flavus。gydF4y2Ba在此,我们研究了玉米对病毒的基因型特异性和侵染阶段特异性反应gydF4y2Ba答:flavusgydF4y2Ba发现某些防御途径的抑制可能导致易感系宿主抗性的降低。我们还利用WGCNA构建了前6 hpi的基因共表达网络,发现DNA甲基化、抗生素生物合成、脂肪酸生物合成、激素信号和HRs对宿主抗性有很大影响。此外,在这项工作中鉴定的110个枢纽基因可能是玉米抗性的重要靶点gydF4y2Ba答:flavusgydF4y2Ba在今后的育种工作中。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
从RA与Z58杂交的重组自交系中筛选出AF99(抗性系)和AF32(敏感系)两个玉米自交系。以中国优良自交系叶478和丹340为亲本,杂交获得了抗病能力优良的RAgydF4y2Ba黄曲霉gydF4y2Ba在多年的反复实验中[gydF4y2Ba62gydF4y2Ba].另一个亲本系Z58是中国的精英自交系。gydF4y2Ba
所有个体于2019年生长季在扬州大学实验站(18°18′06″N 109°39′32″E)的田间种植。植株生长在0.55 × 0.25 m的样地中,每株植株均为自花授粉,以确保有足够的材料进行进一步研究。gydF4y2Ba
接种方法及表型评价gydF4y2Ba
的gydF4y2Ba答:flavusgydF4y2Ba本研究所用菌株由扬州大学环境科学与工程学院尹世学教授分离[gydF4y2Ba63gydF4y2Ba].gydF4y2Ba答:flavusgydF4y2Ba在改良的捷克琼脂培养基上,30°C暗培养7天,分生孢子悬液(2 × 10gydF4y2Ba6gydF4y2Ba孢子毫升gydF4y2Ba−1gydF4y2Ba)接种前用无菌水配制。gydF4y2Ba
采收前接种选择授粉后15 d的玉米穗,采用钉打法人工接种。每耳注射2次,每次注射1 ml孢子。在收获时,通过测定抗病性的程度来确定抗病性表型gydF4y2Ba答:flavusgydF4y2Ba耳朵上的赘肉。gydF4y2Ba
对于收获后的接种,在实验室用分生孢子悬浮液接种收获的穗。接种程序及籽粒抗病性评分gydF4y2Ba答:flavusgydF4y2Ba感染(RAI)是根据我们之前研究中描述的程序进行的[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].根据菌丝和孢子覆盖玉米粒表面的比例,将RAI评分分为11级(0为未侵染,10为完全侵染),每级代表覆盖10%。gydF4y2Ba
RNA-seq和DEG分析gydF4y2Ba
授粉后15 d,选取AF99和AF32发育良好的玉米穗,收集穗中部的籽粒作进一步研究。每个果仁用无菌手术刀纵向切开,分成两等份;一半种子在孢子悬浮液中浸泡5 min,另一半种子在无菌水中浸泡5 min,记为0 h。然后,将所有果仁半部分转移到改良的Czapek琼脂培养基中,在30°C的培养箱中培养。在0、0.5、1.5、3和6小时(分别命名为T0、T1、T2、T3和T4),收集至少4个半仁作为一个样本,用液氮快速冷却,并保存在−80°C的深冰箱中。每个样品有三次生物学重复,以尽量减少实验误差。详细的处理方法已在前面描述[gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
总RNA采用乙醇沉淀法和CTAB-PBIOZOL试剂(Vazyme Biotech)分离。RNA使用NanoDrop分光光度计和Agilent 2100生物分析仪(Thermo Fisher Scientific, MA, USA)进行鉴定和定量。转录组测序在bgisisq500平台(BGI-Shenzhen, China)上进行。使用SOAPnuke (v1.5.2)过滤包含测序适配器或未知碱基超过5% (' N '碱基)的原始读取,以及低质量读取碱基比(碱基质量≤5)大于20%的原始读取[gydF4y2Ba65gydF4y2Ba].然后HISAT2 (v2.0.4) [gydF4y2Ba66gydF4y2Ba]用于将清洁reads与玉米参考基因组GCF_000005005.2_B73_RefGen_v4(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/assembly/gydF4y2BaGCF_000005005.2)。gydF4y2Ba
RSEM (v1.2.12) [gydF4y2Ba67gydF4y2Ba]用于计算每千碱基转录本每百万映射reads (FPKM)的片段数。DESeq2 (v1.4.5) [gydF4y2Ba68gydF4y2Ba]以fold change≥2.00为标准进行鉴定,并进行调整gydF4y2BapgydF4y2Ba值≤0.05。gydF4y2Ba
实时rt - pcrgydF4y2Ba
从0.5 μg总RNA中提取cDNA,采用HiScript®Q RT SuperMix进行qPCR (Vazyme, China)。定量RT-PCR采用StepOnePlus Real Time PCR系统和ChamQ SYBR qPCR Master Mix (Vazyme, China)进行。基因特异性引物(表SgydF4y2Ba2gydF4y2Ba)采用qantprime qPCR引物设计工具(gydF4y2Bahttps://quantprime.mpimp-golm.mpg.degydF4y2Ba).以引物ZmUBQ-qRT+/−扩增泛素1作为对照,用2计算相关基因表达量gydF4y2Ba-gydF4y2Ba△gydF4y2Ba△gydF4y2BaCtgydF4y2Ba方法。每个样品有3个生物重复,其中3个技术重复,以尽量减少实验误差。gydF4y2Ba
基因本体和KEGG通路富集分析gydF4y2Ba
ClueGO (v. 2.5.7) [gydF4y2Ba69gydF4y2Ba],使用Cytoscape的Cytoscape插件软件进行基因本体(GO)富集分析(gydF4y2BapgydF4y2Ba-value校正Bonferroni阶降≤0.05)。KEGG (gydF4y2Bahttps://www.kegg.jp/gydF4y2Ba)富集分析采用Phyper (gydF4y2Bahttps://en.wikipedia.org/wiki/Hypergeometric_distributiongydF4y2Ba)基于超几何检验(gydF4y2BapgydF4y2Ba-value校正Bonferroni阶降≤0.05)。MAPMAN软件[gydF4y2Ba70gydF4y2Ba]用于鉴定AF99和AF32中对gydF4y2Ba答:flavusgydF4y2Ba感染。gydF4y2Ba
加权基因共表达网络分析gydF4y2Ba
采用加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA) R包描述多样本基因间的相关模式[gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].所有基因表达数据均基于log进行标准化处理gydF4y2Ba2gydF4y2Ba(1 + FPKM)值,根据无标度拓扑准则,选择软性阈值= 12,生成相邻矩阵。然后将邻接矩阵转换为拓扑重叠矩阵(TOM),根据基因间的不相似度对基因进行层次聚类。采用动态砍树算法切割层次聚类树状图(mergeCutHeight = 0.25),定义模块(最小模块数为30)。为了估计模块与基因特异性表达(基因型特异性或感染阶段特异性表达)的相关性,使用二元指标(阶段/基因型= 1,所有其他样本= 0),如所述[gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba].在每个时间点,阶段- /基因型特异性模块(|r| > 0.35,gydF4y2BapgydF4y2Ba< 0.05)和枢纽基因(|基因显著性| > 0.4和|感兴趣模块的模内连通性| > 0.9)。Cytoscape软件版本3.6.0 [gydF4y2Ba74gydF4y2Ba]被用来可视化共表达网络。使用TBtools绘制维恩图和热图[gydF4y2Ba75gydF4y2Ba].gydF4y2Ba
数据和材料的可用性gydF4y2Ba
原始数据可从国家生物技术信息中心SRA Explorer (gydF4y2Bahttps://sra-explorer.info/?gydF4y2Ba)加入PRJNA691427。gydF4y2Ba
缩写gydF4y2Ba
- 答:flavusgydF4y2Ba:gydF4y2Ba
-
黄曲霉gydF4y2Ba
- 现病史:gydF4y2Ba
-
接种后小时gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达网络分析gydF4y2Ba
- QTL:gydF4y2Ba
-
数量性状位点gydF4y2Ba
- GWAS:gydF4y2Ba
-
全基因组关联研究gydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
程序性细胞死亡gydF4y2Ba
- 人力资源:gydF4y2Ba
-
过敏性细胞死亡反应gydF4y2Ba
- 疯了:gydF4y2Ba
-
绝对偏差中位数gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
伊顿DL,加拉格尔EP。黄曲霉毒素致癌机制。医药科学,1994;34(1):135-72。gydF4y2Ba
- 2.gydF4y2Ba
刘颖,吴峰。黄曲霉毒素诱导的肝细胞癌的全球负担:风险评估。环境卫生展望。2010;118(6):818-24。gydF4y2Ba
- 3.gydF4y2Ba
坎贝尔KW,怀特DG。玉米抗曲霉穗腐病、籽粒侵染和黄曲霉毒素产生基因型的评价。植物科学,1995;79(10):1039。gydF4y2Ba
- 4.gydF4y2Ba
汉布林AM,怀特DG。Tex6对玉米抗曲霉病和黄曲霉毒素产生的遗传研究。植物病理学。2000;90(3):292。gydF4y2Ba
- 5.gydF4y2Ba
Paul C, Naidoo G, Forbes A, Mikkilineni V, White D, Rocheford T.两个相关玉米群体低黄曲霉毒素生产的数量性状位点。应用理论与实践。2003;37(2):379 - 379。gydF4y2Ba
- 6.gydF4y2Ba
布鲁克斯TD,威廉姆斯WP,温德姆GL,威尔科克斯MC,阿巴斯HK。玉米自交系Mp313E抗黄曲霉毒素积累的数量性状位点Cropence。2005;45(1):171 - 4。gydF4y2Ba
- 7.gydF4y2Ba
Warburton ML, Brooks TD, Krakowsky MD, Shan XY, Windham GL, Williams WP。玉米对黄曲霉毒素积累抗性新来源的鉴定和定位。作物科学,2009;49(4):1403-8。gydF4y2Ba
- 8.gydF4y2Ba
marilyn W, Thomasd B, Garyl W, Paul WW。玉米抗黄曲霉毒素积累QTL的鉴定。生物育种,2011;27(4):491-9。gydF4y2Ba
- 9.gydF4y2Ba
Mayfield KL, Murray SC, Rooney WL, Isakeit T, Odvody GA。玉米试验组合中降低黄曲霉毒素QTL的确认。作物科学,2011;51(6):2489。gydF4y2Ba
- 10.gydF4y2Ba
杨文杰,杨文杰,杨文杰,杨文杰,等。确定不同遗传背景下Mp313E抗黄曲霉毒素的数量性状位点。Mol Breed. 2013;32(1): 15-26。gydF4y2Ba
- 11.gydF4y2Ba
尹喆,王勇,吴峰,顾晓,边勇,王勇,等。利用重组自交系玉米抗黄曲霉侵染的定量性状位点定位。Mol Breed. 2014;33(1): 39-49。gydF4y2Ba
- 12.gydF4y2Ba
Mideros SX, Warburton ML, Jamann TM, Windham GL, Williams WP, Nelson RJ。影响玉米真菌毒素污染的数量性状位点:连锁作图分析、近等基因系表征和元分析。作物科学2014;54(1):127。gydF4y2Ba
- 13.gydF4y2Ba
达卡·R, Windham GL, Williams WP, Subudhi PK.减少玉米黄曲霉毒素积累的QTL。Mol Breed. 2016;36(12):164。gydF4y2Ba
- 14.gydF4y2Ba
Warburton ML, Tang JD, Windham GL, Hawkins LK, Murray SC,徐ww,等。黄曲霉与玉米黄曲霉毒素积累抗性的全基因组关联图谱。作物科学,2015;55(5):1857-67。gydF4y2Ba
- 15.gydF4y2Ba
Farfan IDB, De La Fuente GN, Murray SC, Isakeit T, Huang PC, Warburton M,等。干旱、黄曲霉毒素抗性和亚热带玉米杂交种重要农艺性状的全基因组关联研究。PLoS One. 2015;10:2。gydF4y2Ba
- 16.gydF4y2Ba
唐俊杰,黄曲霉毒素积累抗性与玉米黄曲霉毒素积累抗性的关系。BMC Genomics. 2015;16:1。gydF4y2Ba
- 17.gydF4y2Ba
陈志智,布朗RL,柯达曼,克利夫兰TE。PR10在玉米中的表达及其对宿主抗黄曲霉感染和黄曲霉毒素产生的影响。植物病理学杂志,2010;11(1):69-81。gydF4y2Ba
- 18.gydF4y2Ba
Hawkins LK, Mylroie JE, Oliveira DA, Smith JS, Ozkan S, Windham GL,等。玉米几丁质酶基因的鉴定及其对黄曲霉和黄曲霉毒素抗性积累的影响。PLoS One. 2015;10:6。gydF4y2Ba
- 19.gydF4y2Ba
马宗达尔,K Rajasekaran, C Sickler, M Lebar, BM Musungu, AM Fakhoury,等。玉米种子致病相关基因(PRms)在抵抗黄曲霉侵染和黄曲霉毒素污染中发挥作用。中国植物科学,2017;8:1758。gydF4y2Ba
- 20.gydF4y2Ba
Ogunola OF, Hawkins LK, Mylroie E, Kolomiets MV, Borrego E, Tang JD,等。玉米脂氧合酶基因家族与黄曲霉毒素积累抗性的研究。PLoS One, 2017;12:7。gydF4y2Ba
- 21.gydF4y2Ba
Parish F, Williams WP, Windham GL, Shan XY。玉米黄曲霉毒素还原数量性状位点相关信号通路基因的差异表达(gydF4y2Ba玉米gydF4y2Bal .)。前沿微生物。2019;10:2683。gydF4y2Ba
- 22.gydF4y2Ba
史伟,彭永顺,杨杨,鲍雷戈,郭锡泉,等。种子衍生乙烯促进黄曲霉在玉米中的定殖,但不产生黄曲霉毒素。前沿植物研究,2017;8(206):415。gydF4y2Ba
- 23.gydF4y2Ba
马宗达尔,米诺查,Lebar MD, Rajasekaran K, Long S, Carter-Wientjes C,等。玉米多胺和氨基酸代谢对抵抗黄曲霉感染和黄曲霉毒素产生的贡献。前沿植物学报2019;10:692。gydF4y2Ba
- 24.gydF4y2Ba
姜涛,周勃,罗敏,Abbas HK, Kemerait R, Lee RD,等。不同耐黄曲霉毒素自交系玉米籽粒胁迫相关基因的表达分析毒素。2011;3(6):538 - 50。gydF4y2Ba
- 25.gydF4y2Ba
kelly RY, Williams WP, Mylroie JE, Boykin DL, Harper JW, Windham GL,等。与寄主植物对黄曲霉感染和黄曲霉毒素积累抗性或易感性相关的玉米基因鉴定。PLoS One, 2012;7:5。gydF4y2Ba
- 26.gydF4y2Ba
Dolezal AL, Shu XM, OBrian GR, Nielsen DM, Woloshuk CP, Boston RS,等。黄曲霉侵染引起玉米籽粒发育过程中的转录和物理变化。《前沿微生物》2014;5:384。gydF4y2Ba
- 27.gydF4y2Ba
舒XM,利文斯顿DP,沃罗舒克CP,佩恩GA。黄曲霉和黄萎病镰刀菌侵染玉米籽粒的组织学和转录比较分析。中国植物科学,2017;8:2075。gydF4y2Ba
- 28.gydF4y2Ba
穆松古,D Bhatnagar, Brown RL, Payne GA, OBrian G, Fakhoury AM,等。玉米/黄曲霉病理系统基因共表达的网络方法,以映射宿主/病原体相互作用途径。前热内。2016;7:206。gydF4y2Ba
- 29.gydF4y2Ba
穆松古B, Bhatnagar D, Quiniou S, Brown RL, Geisler M.双RNA-seq在玉米与黄曲霉相互作用系统生物学分析中的应用。前沿微生物。2020;11:1。gydF4y2Ba
- 30.gydF4y2Ba
赵伟,秦勇,杨伟祥,李勇,郭东。玉米对赤霉病的定量抗性与转座子介导的ZmCCT表观遗传变化有关。中国植物学报,2017;29(4):344 - 344。gydF4y2Ba
- 31.gydF4y2Ba
姚玲,李勇,马超,杜丽芳,徐敏。基于基因组关联研究和转录组分析,发现了玉米抗镰刀病候选基因。中国生物医学工程学报,2015;29(3):344 - 344。gydF4y2Ba
- 32.gydF4y2Ba
Orlowska E, Fiil A, Kirk HG, Llorente B, Cvitanich C.抗性和易感马铃薯品种在疫霉感染早期阶段的差异基因诱导。植物细胞学报,2012;31(1):187-203。gydF4y2Ba
- 33.gydF4y2Ba
朱俊华,卡普尔A,斯里达尔VV,阿吉斯F,朱俊杰。DNA糖基化酶/裂解酶ROS1在拟南芥DNA甲基化模式修剪中的作用。动物学报,2007;17(1):54-9。gydF4y2Ba
- 34.gydF4y2Ba
李志强,李志强,朱庆华,等。DNA去甲基化酶靶向启动子转座元件正向调控拟南芥胁迫响应基因。中国生物工程学报。2014;15:9。gydF4y2Ba
- 35.gydF4y2Ba
杨晓明,李志刚,李志刚,李志刚,等。拟南芥DNA甲基化在免疫应答中的作用。植物学报,2016;26(3):366 - 366。gydF4y2Ba
- 36.gydF4y2Ba
龚喆,莫拉莱斯-鲁伊斯T,阿里扎RR, Roldan-Arjona T, David L,朱建科。ROS1是拟南芥转录基因沉默的抑制因子,编码DNA糖化酶/裂解酶。细胞。2002;111(6):803 - 14所示。gydF4y2Ba
- 37.gydF4y2Ba
Bies-Etheve N, Pontier D, Lahmy S, Picart C, Vega D, Cooke R,等。rna导向的DNA甲基化需要SPT5延伸因子家族中agag4相互作用的成员。EMBO报告2009;10(6):649-54。gydF4y2Ba
- 38.gydF4y2Ba
何晓军,徐玉峰,朱帅,Wierzbicki AT, Pontes O, Pikaard CS,等。拟南芥中rna定向DNA甲基化的效应物是ARGONAUTE 4和rna结合蛋白。细胞。2009;137(3):498 - 508。gydF4y2Ba
- 39.gydF4y2Ba
李晓东,夏斌,姜玉明,吴启勤,王春英,何立林,等。石蒜中一种新的致病相关蛋白LrPR4及其对稻瘟病菌的抗真菌活性。Mol生物学杂志2010;37(2):995-1001。gydF4y2Ba
- 40.gydF4y2Ba
斯文森B,斯文森I,赫厄鲁普P,罗普斯托夫P,路德维森S,波尔森FM。barwin的初级结构:一种大麦种子蛋白,与由创伤诱导植物基因编码的蛋白质的c端结构域密切相关。生物化学,1992;31(37):8767 - 70。gydF4y2Ba
- 41.gydF4y2Ba
董志斌,蒋超,陈晓霞,张涛,丁磊,宋文斌,等。玉米LAZY1通过调节生长素转运、生长素信号转导和光响应调节芽向地性和花序发育。中国生物医学工程学报,2013;29(3):344 - 344。gydF4y2Ba
- 42.gydF4y2Ba
谢玉玲,陈志勇,Brown RL, Bhatnagar D.玉米发病相关蛋白10基因的表达与功能表征。植物营养学报。2010;26(2):329 - 329。gydF4y2Ba
- 43.gydF4y2Ba
Corpas FJ, Barroso JB。铅诱导的胁迫会触发拟南芥过氧化物酶体中一氧化氮(NO)和超氧阴离子(O-2(中心点-))的产生,影响过氧化氢酶的活性。一氧化氮生物学报,2017;68:103-10。gydF4y2Ba
- 44.gydF4y2Ba
Piacentini D, Corpas FJ, D'Angeli S, Altamura MM, Falasca G.镉和砷诱导胁迫对拟南芥根系结构、过氧化物酶体分布、酶活性和一氧化氮含量的差异调节植物物理生物化学。2020;148:312-23。gydF4y2Ba
- 45.gydF4y2Ba
Hawkins LK, Warburton ML, Tang JD, Tomashek J, Oliveira DA, Ogunola OF,等。玉米抗黄曲霉和/或黄曲霉毒素感染候选基因的研究。毒素。2018;2。gydF4y2Ba
- 46.gydF4y2Ba
罗敏,黄曲霉诱导玉米抗逆性的转录谱分析。毒素。2011;3(7):766 - 86。gydF4y2Ba
- 47.gydF4y2Ba
姚宁。细胞程序性死亡在植物-病原菌相互作用中的作用和调控。细胞微生物学。2004;6(3):201-11。gydF4y2Ba
- 48.gydF4y2Ba
王辉,林杰,常永华,蒋长忠。比较转录组分析表明,乙烯/ h2o2介导的超敏反应和程序性细胞死亡决定了沙梨和互炼孢的相容互作。植物科学进展(英文版);gydF4y2Ba
- 49.gydF4y2Ba
曹智,李玲,李丽娟。耐、易感重组单倍体自交系与嗜死性弱囊霉互作基因表达谱分析。前沿微生物,2020;11:1259。gydF4y2Ba
- 50.gydF4y2Ba
朱晓亮,卢广昌,杜丽萍,叶小刚,刘旭,Coules A,等。小麦NB-LRR基因TaRCR1是宿主对坏死性真菌病原体谷丝枯菌防御反应所必需的。中国生物工程学报,2017;15(6):674-87。gydF4y2Ba
- 51.gydF4y2Ba
库宰Y,木村M,渡边M,库树K,大阪D,铃木T,等。水杨酸依赖免疫有助于水稻和短叶藻抵抗枯叶枯病的一种坏死真菌。生态学报,2018;26(2):771-83。gydF4y2Ba
- 52.gydF4y2Ba
Frederikke G. Malinovsky, Peter Brodersen, Berthe Katrine Fiil, Lea Vig McKinney, Stephan Thorgrimsen, Martina Beck, H. Bjørn Nielsen, Stefano Pietra, Cyril Zipfel, Silke Robatzek, Morten Petersen, Daniel Hofius, John Mundy, Mohammed Bendahmane, (2010) DUF300蛋白Lazarus1与拟南芥acd11和超敏反应相关的程序性细胞死亡有关。PLoS ONE 5 (9):e12586。gydF4y2Ba
- 53.gydF4y2Ba
Malinovsky FG, Brodersen P, Fiil BK, McKinney LV, Thorgrimsen S, Beck M, Nielsen HB, Pietra S, Zipfel C, Robatzek S, Petersen M, Hofius D, Mundy J, Bendahmane M. Lazarus1, DUF300蛋白参与拟南芥acd11和超敏反应相关的程序性细胞死亡。PLoS ONE。2020; 5 (9): e12586。gydF4y2Ba
- 54.gydF4y2Ba
Morrissey JP, Osbourn AE。真菌对植物抗生素的耐药性是其发病机制之一。中华微生物学杂志,1999;29(3):344 - 344。gydF4y2Ba
- 55.gydF4y2Ba
Christensen SA, Sims J, Vaughan MM, Hunter C, Block A, Willett D,等。商业杂交和突变基因型揭示了玉米诱导萜类化合物防御的复杂保护作用。中国生物医学工程学报,2018;69(7):1693-705。gydF4y2Ba
- 56.gydF4y2Ba
赫芬顿A,卡普兰F,沃恩MM,达福NJ,倪XZ,罗卡JR,等。新型酸性倍半萜类化合物是玉米中病原菌诱导的植物抗毒素的主要种类。中国生物医学工程学报,2011;26(4):344 - 344。gydF4y2Ba
- 57.gydF4y2Ba
Balmer D, de Papajewski DV, Planchamp C, Glauser G, Mauch-Mani B.玉米诱导抗性基于器官特异性防御反应。植物学报,2013;26(2):344 - 344。gydF4y2Ba
- 58.gydF4y2Ba
Schmelz EA, Huffaker A, Sims JW, Christensen SA, Lu X, Okada K,等。单子叶萜类植物抗毒素的合成、诱导及作用。植物学报(自然科学版);2014;26(4):457 - 457。gydF4y2Ba
- 59.gydF4y2Ba
Christensen SA, Huffaker A, Kaplan F, Sims J, Ziemann S, Doehlemann G,等。玉米死亡酸,9-脂氧合酶衍生的环戊酮,作为细胞毒性植物抗毒素和转录介质具有活性。美国国家科学院。2015; 112(36): 11407 - 12所示。gydF4y2Ba
- 60.gydF4y2Ba
丁永泽,Huffaker A, Kollner TG, Weckwerth P, Robert CAM, Spencer JL,等。硒烯挥发物是促进玉米防御的重要前体物质。中国生物医学工程学报,2017;29(3):344 - 344。gydF4y2Ba
- 61.gydF4y2Ba
丁勇,韦克沃斯PR,波列茨基E,墨菲KM, Sims J, Saldivar E,等。介导玉米先天免疫的相互关联抗生素途径的遗传学阐明。植物科学进展。2020;6(11):1375。gydF4y2Ba
- 62.gydF4y2Ba
邓晓东,姜世祥,王玉军,边柳林,陈俊杰,薄娟。玉米抗黄曲霉侵染的遗传分析(gydF4y2Ba玉米gydF4y2Bal .)。J Integr Agric。2009; 8(6): 761 - 5。gydF4y2Ba
- 63.gydF4y2Ba
D.抗黄曲霉玉米种质鉴定。植物学报。2002;3:22。gydF4y2Ba
- 64.gydF4y2Ba
张勇,崔敏,张娟,张磊,李超,阚旭,等。利用连锁和关联作图的方法确定玉米抗黄曲霉毒素的一个主要QTL并进行精细作图。毒素。2016;8(9):258。gydF4y2Ba
- 65.gydF4y2Ba
李仁强,李YR, Kristiansen K,王娟。SOAP:短寡核苷酸比对程序。生物信息学,2008;24(5):713 - 4。gydF4y2Ba
- 66.gydF4y2Ba
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。gydF4y2Ba
- 67.gydF4y2Ba
李B,杜威CN。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。生物信息学。2011;12:1。gydF4y2Ba
- 68.gydF4y2Ba
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。中国生物工程学报。2014;15:12gydF4y2Ba
- 69.gydF4y2Ba
王晓明,王晓明,王晓明,等。ClueGO:一个Cytoscape插件,用于破译功能分组的基因本体和通路注释网络。生物信息学,2009,25(8):1091 - 3。gydF4y2Ba
- 70.gydF4y2Ba
李文杰,李志强,李志强,等。MAPMAN:一个用户驱动的工具,将基因组数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004;37(6):914-39。gydF4y2Ba
- 71.gydF4y2Ba
张斌,张志强,张志强,等。加权基因共表达网络分析的总体框架。中华流行病学杂志2005;4:1。gydF4y2Ba
- 72.gydF4y2Ba
朗菲尔德P,霍瓦特S. WGCNA:加权相关网络分析的R包。生物信息学报。2008;9:1。gydF4y2Ba
- 73.gydF4y2Ba
Garg R, Singh VK, Rajkumar MS, Kumar V, Jain M.通过全球转录组和共表达网络分析,揭示了与鹰嘴豆种子发育和种子大小/重量决定相关的品种特异性分子特征。中国植物学报,2017;29(6):344 - 344。gydF4y2Ba
- 74.gydF4y2Ba
王俊杰,王俊杰,王俊杰,等。细胞景观:生物分子相互作用网络集成模型的软件环境。基因组学报,2003;13(11):2498-504。gydF4y2Ba
- 75.gydF4y2Ba
陈佳杰,陈宏,张勇,Thomas HR, Frank MH,何永华,等。TBtools:为大生物数据的交互式分析而开发的综合工具包。植物学报。2020;13(8):1194-202。gydF4y2Ba
确认gydF4y2Ba
我们感谢邓德祥教授(扬州大学,中国)对手稿的大量修改。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金项目(31901551)、国家科技部科技重大专项项目(2018ZX08009-04B)、江苏省农业科技创新基金项目(CX(20) 1002)、江苏省高等学校重点学科建设项目、江苏省作物科学学科发展专项资金项目(yzuxk202006)资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
yinzhitong和Huanhuan Liu对研究设计有贡献;刘欢欢、吴浩峰、王燕、王欢、陈赛华为实验执行和数据分析做出贡献;尹志桐、刘欢欢和吴浩峰撰写了这篇论文。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
60个样本测序数据的Pearson配对相关系数。gydF4y2Ba图S2。gydF4y2Ba实时RT-PCR检测感染过程中基因的动态表达谱。gydF4y2Ba图S3。gydF4y2Ba特定的和常见的deg响应的维恩图gydF4y2Ba答:flavusgydF4y2BaAF99和AF32(感染vs.模拟治疗)在不同时间点(a, 0 hpi;B, 0.5 hpi;1.5 c,主诉;D, 3 hpi;E, 6 hpi)。gydF4y2Ba图S4。gydF4y2BaAF99中不同时间点DEGs上调和下调的维恩图。gydF4y2Ba图S5。gydF4y2BaAF32中不同时间点上调和下调DEGs的维恩图。gydF4y2Ba图S6。gydF4y2BaKEGG通路富集在下调和上调基因中,对gydF4y2Ba答:flavusgydF4y2BaAF99和AF32(感染vs.模拟治疗)在不同时间点。颜色深度表示校正后的颜色gydF4y2BapgydF4y2Ba价值。gydF4y2Ba图S7。gydF4y2Ba基于mapman的AF99(a)和AF32(b) T4期细胞反应概述的可视化。gydF4y2Ba
附加文件2:图S8。gydF4y2Ba
真菌接种AF99和AF32籽粒特异性差异表达基因的KEGG分析颜色深度表示显著性程度,如右侧的刻度(校正后的p值)所示。gydF4y2Ba图S9。gydF4y2Ba软阈值功率(β)的确定。a:无标度拓扑拟合指标作为软阈值功率的函数,红线表示RgydF4y2Ba2gydF4y2Ba等于0.85。B:作为软阈值功率函数的平均连通性。gydF4y2Ba图S10。gydF4y2Ba样本树状图和性状热图。行:“0”为AF32,“1”为AF99;Ino:“0”表示mock,“1”表示gydF4y2Ba答:flavusgydF4y2Ba接种;时间:“0、0.5、1.5、3、6”表示接种后的时间;RC0:“1”表示AF99(模拟处理)在T0阶段的三个生物重复,“0”表示其他样品;R0:“1”为AF99的三个生物学重复(gydF4y2Ba答:flavusgydF4y2Ba接种))为T0期,其他样品为“1”;SC0:“1”表示AF32(模拟处理)在T0阶段的三个生物重复,“0”表示所有其他样品;S0:“1”表示AF32的三个生物学重复(gydF4y2Ba答:flavusgydF4y2BaT0期接种),其余样品均为“0”;其余与“RC0”、“R0”、“SC0”、“S0”相似。gydF4y2Ba图S11。gydF4y2Ba棕色/R0(a),品红/SC1(b),粉色/S1(c),黑色/S2(d)和棕色/S3(e)的基因显著性与模块隶属度的散点图,与gydF4y2BapgydF4y2Ba值表示。gydF4y2Ba图S12。gydF4y2Ba本研究鉴定的110个hub基因的GO和KEGG通路分析。a. 110个hub基因的GO分析。每个圆圈代表一个富集类别,圆圈的大小表示基因的数量。详细的富集结果见表SgydF4y2Ba9gydF4y2Bab. 110个枢纽基因的前20个相关KEGG通路。gydF4y2Ba图向。gydF4y2Ba与超敏反应和程序性细胞死亡相关的35个基因的热图。红色表示高表达,蓝色表示低表达。去除极低表达基因(平均FPKM< 0.5)。gydF4y2Ba
附加文件3:表S1。gydF4y2Ba
不同样本组测序的详细信息。gydF4y2Ba
附加文件4:表S2。gydF4y2Ba
Real-time RT-PCR所用引物清单gydF4y2Ba
附加文件5:表S3。gydF4y2Ba
MapMan中所有基因信息。gydF4y2Ba
附加文件6:表S4。gydF4y2Ba
绿色模块基因GO分析。gydF4y2Ba
附加文件7:表S5。gydF4y2Ba
黄色模块基因GO分析。gydF4y2Ba
附加文件8:表S6。gydF4y2Ba
brown模块基因GO分析。gydF4y2Ba
附加文件9:表S7。gydF4y2Ba
蓝色模块基因GO分析。gydF4y2Ba
附加文件10:表S8。gydF4y2Ba
本研究中鉴定的轮毂基因列表。gydF4y2Ba
附加文件11:表S9。gydF4y2Ba
110个中枢基因的GO分析。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘浩,吴浩,王勇。gydF4y2Baet al。gydF4y2Ba比较转录组分析和共表达网络分析揭示了与早期抗病相关的关键基因gydF4y2Ba黄曲霉gydF4y2Ba在玉米。gydF4y2BaBMC植物生物学gydF4y2Ba21日,gydF4y2Ba216(2021)。https://doi.org/10.1186/s12870-021-02983-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-02983-xgydF4y2Ba
关键字gydF4y2Ba
- 玉米gydF4y2Ba
- 黄曲霉gydF4y2Ba
- 转录组分析gydF4y2Ba
- WGCNAgydF4y2Ba
- 早期的阻力gydF4y2Ba