抽象的
背景
驱动蛋白(KIN)是一种多功能的纳米机器,参与植物生长发育的多种重要过程。然而,驱动蛋白基因家族在西瓜这个有价值和营养价值的水果中还没有被鉴定出来,其功能还没有被鉴定出来。尤其是它们参与西瓜果实发育的早期过程,直接决定了西瓜果实的大小、形状、产量和品质,目前尚不清楚。
结果
在本研究中,我们进行了全基因组调查和全面分析的驱动蛋白基因c . lanatus.系统发育分析共鉴定出48个驱动蛋白,并将其划分为10个驱动蛋白亚家族。通过分布分析发现它们在11条染色体上分布不均匀。保守基序分析表明,驱动蛋白的atp结合基序在所有亚家族中都是保守的,而微管结合基序不保守。通过共系和系统发育方法检测到10个片段重复对基因,结果显示驱动蛋白基因家族扩增c . lanatus基因组在进化过程中。此外,5克里克斯根据综合表达型谱分析,基因在早期果实发育阶段中特别且大量表达,这意味着在早期果实开发期间临时调节作用。我们的数据还表明大多数Kinesin基因对植物激素的反应性,揭示了它们在植物激素的信号通路中的潜在参与。
结论
本研究对西瓜驱动蛋白基因家族进行了全面分析,为进一步开展西瓜驱动蛋白基因的功能研究奠定了基础c . lanatus驱动蛋白基因,并提供了新的见解,以其生物学功能。此外,这些结果也为理解植物激素和驱动蛋白基因之间的关系提供了有用的信息c . lanatus.
背景
Kinesins,广泛分布于所有真核生物中[1]是一组基于微管的电动机蛋白,沿着微管(MT)原生料,通过水解ATP提供动力,以驱动各种必需的生物过程[2].所有Kinesin蛋白质共享约350个氨基酸的保守电机结构域。“电动机头”域由ATP酶催化位点和MT结合位点组成,其具有催化ATP酶和MT结合能力[3.].Kinesin家族分别被分类为N型,中间和C型Kinesins,在N-末端,中间的N-末端或附近的电动机头域,靠近分子的C-末端。“电动机头”域之后是秸秆区域和在Kinesin分子的相对端的“小球形尾”。“电动机头”域负责由ATP水解的蛋白质运动[4,5,6].而“柄/尾”结构域对于与全酶亚基或货物分子的相互作用非常重要[4,7,8].“头部”和“茎/尾”之间的短“颈部”区域对于诸如活性的运动方向等功能是必不可少的[9].每个驱动蛋白亚家族的运动结构域都很保守,而在同一亚家族中,运动结构域外的茎/尾结构域差异很大,反映了同一亚家族内的不同生物功能。
基于使用保守的机动结构域序列的系统发育分析,Kinesins分为十四个家庭,指定为Kinesin-1至Kinesin-14。不属于这些亚属中的kinesins被认为是孤儿,但是鉴定的大多数kinesins都可以很容易地分配给特定的家庭[10].大多数运动蛋白家族成员有一个n端运动结构域称为n型运动蛋白,而很少家族有一个内部运动结构域或c端运动结构域。不同家族的运动蛋白的方向性是不同的,这有时与运动域的位置有关。一般来说,具有n端马达域的驱动蛋白向MTs的正端移动,而c端马达向MTs的负端移动[11,12,13,14].
先前的表达谱分析表明,植物驱动蛋白基因在果实发育中起着重要的作用。在苹果公司海棠品种富士,驱动蛋白基因kin2.在果实发育早期强烈表达[15].进一步的调查显示kin2.基因也主要表达于另外两种苹果基因型“Gala”和“Golden Delicious”[16].这证明了驱动蛋白基因kin2.对苹果早期果实开发进行监管作用。在黄瓜,kinesin基因CSKF1-7在果实发育早期高表达,并参与细胞快速分裂或扩张[17].而且,这是CsKF1和CsKF3在黄瓜果实伸长期显著活跃,这表明它们在黄瓜果实长度调控中起着重要作用[18].有趣的是,番茄(Solanum lycopersicum.),即驱动蛋白基因sppakrp.主要在4-DPA(假期后的)果实中在胎盘组织中表达,所以sppakrp.可能参与通过调节胎盘发展来控制早期水果开发[19,20.].西瓜果实和番茄都属于浆果类水果,果实的可食用部分由胎盘发育而来[21].此外,葫芦果实的尺寸,产量和质量依赖于早期水果发育期间胎盘的调节[22,23,24].因此,Kinesin的鉴定和功能分析是探讨Kinesin基因在调节西瓜早期果实发育中的显着分子机制的理想入学点。此外,已经验证了其他Kinesin基因以参与不同的生物学功能,包括根,茎和叶各种营养组织发育基因(例如,DBS1.,BC12/GDD1号,AtKINESIN-4A / FRA1)[25,26,27,28];加上花药、雄配子体、胚、胚乳和种子发育基因(如:SRS3和NtKRP公司)[29,30.,31].这些作品揭示了植物Kinesins在植物发育中许多基本过程中的关键作用,包括植物植物生长,而且包括植物生殖过程。然而,到目前为止,对西瓜的Kinesin家族基因很少熟知。在早期果实开发期间,在功能上识别出很少有Kinesins。因此,很值得广泛地调查其在经济作物中的作用,如西瓜。
西瓜是世界上消耗的新鲜水果。这是一种高度营养的有价值的水果,称为“夏季王国王”。早期的水果开发直接决定了西瓜果实的尺寸,形状,产量和质量。考虑到番茄中胎盘发育的早期水果开发中的培素基因参与[19,20.[西瓜的基因组研究是探索关键发育过程中真正作用的理想积分,特别是在西瓜早期果实发育中。因此,分析了Kinesin基因Citrullus lanatus基因组。对编码蛋白的系统发育关系、基因结构、染色体位置和保守基序进行了研究。所有的组织特异性表达模式克里克斯进一步研究西瓜中的基因,以及克里克斯激素处理条件下的表达。特别是,五克里克斯基因在果实发育早期表现出特异性和丰富的表达。本研究为深入研究驱动蛋白基因调控西瓜早期果实发育的分子机制提供了有用的信息,也为西瓜产量和品质调控机制提供了新的思路。
结果
基因组鉴定Kinesin基因Citrullus lanatus
从西瓜基因组中鉴定了总共63个候选基因(Cucurbit基因组学数据库,http://www.icugi.org/)以氨基酸序列分析为基础。15个候选基因不包含保守的运动驱动蛋白结构域,排除在进一步分析之外。此外,其余48个驱动蛋白基因也可以通过隐马尔科夫模型(HMMs)分析搜索功能保守的pam结构域进行验证,这与上述序列相似性爆破一致。综上所述,在西瓜基因组中有48个具有完整功能结构的驱动蛋白基因,命名为克里克斯以后
为了探索每个Kinesin的基本性质,分别是基因组DNA和蛋白质序列的长度,内含子和外显子的数量,等电点和理论分子量(表S1).驱动蛋白基因Citrullus lanatus基因组编码序列长度为927 ~ 8670个碱基核苷酸,编码蛋白长度为308 ~ 2889个氨基酸,预测分子量为25.0 ~ 330.3 KDa。理论等电点计算表明,驱动蛋白等电点(pI)分布在5.10-9.65范围内(表5)S1).
为了研究驱动蛋白基因在西瓜基因组中的分布,进一步研究了驱动蛋白基因在西瓜染色体上的物理位置。48个驱动蛋白基因被定位到11条染色体上(图。1),表现出西瓜基因组的不均匀分布。Chr10含有最多8个驱动蛋白基因,只有2个基因位于Chr7上。其他染色体,包括Chr1、Chr2、Chr3、Chr4、Chr5、Chr6、Chr8、Chr9、Chr11,分别含有3-6个驱动蛋白基因。
驱动蛋白家族的系统发育分析
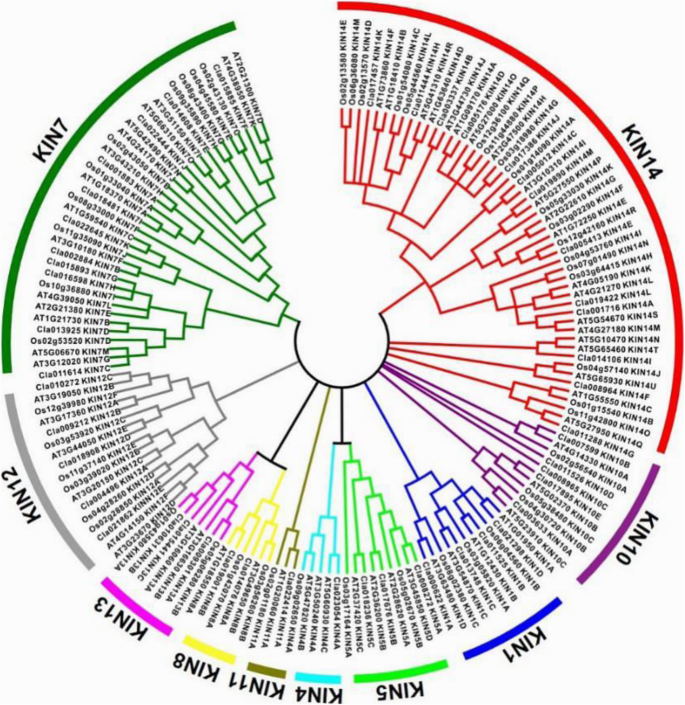
为了研究不同植物中西瓜驱动蛋白与其他已知驱动蛋白的系统发育关系,将西瓜驱动蛋白的运动结构域序列与双子叶模式植物的序列进行多序列比对,A.拟南芥,和单圈的作物,o .漂白亚麻纤维卷,使用软件肌肉进行,然后使用邻近加入方法用Mega 6.06产生这些kinesin的系统发育树(图。2).系统发育分析表明,3种不同物种的驱动蛋白可分为10个科:KIN1、KIN4、KIN5、KIN7、KIN8、KIN10、KIN11、KIN12、KIN13、KIN14(图5)S1和图S2).其中,Kin14家族是由52个Kinesins组成的最大家庭。Kin7家族是第二大家庭,拥有36名Kinesin成员。Kin11是最小的家庭,只有3个kinesins。来自西瓜的Kinesin数跟随与其他两个物种相同的分布趋势。13西瓜Kinesins属于Kin14亚家族,这是最大的家庭。7个kinesins被分组为Kin7,第二大亚家族。只有1个kinesin是在Kin11家族中,代表最小的亚家族。为了进一步探索水果植物中的胰岛素中的进化关系,我们发现了来自果植物番茄的53种Kinesin同源物。系统发育分析表明,在进化期间膨胀了Kinesin-14和7个亚壳,其与拟南芥和米饭一致(图S3).双子叶植物和单子叶植物的系统发育关系没有明显的区别,说明驱动蛋白在整个植物界具有功能保护作用。
西瓜驱动蛋白家族基因的基因结构及保守基序分布分析
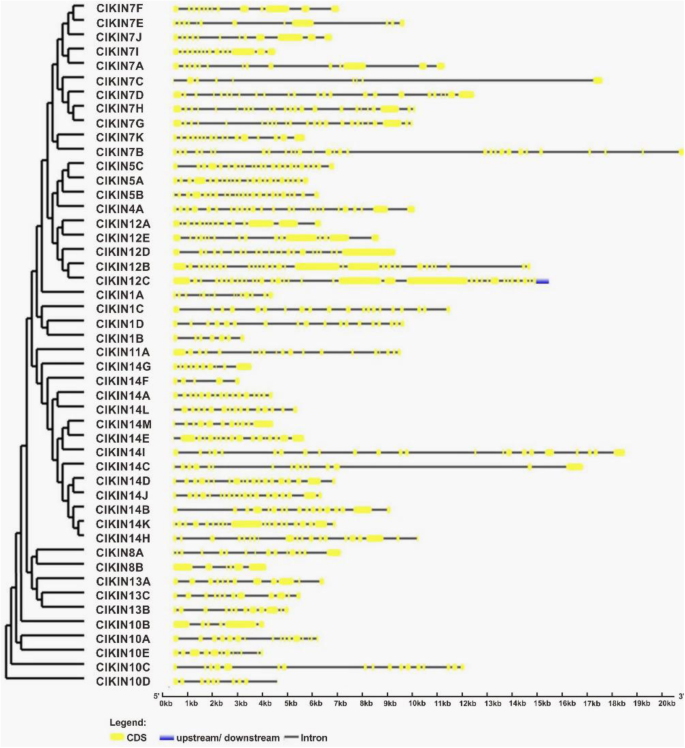
基因结构和内含子/外显子排列克里克斯通过比较每个基因的cDNA序列来确定基因ClKIN基因组DNA序列。分析结果显示所有内含子数克里克斯基因范围为4至34。ClKIN14F只有4个内含子,而存在34个内含子ClKIN12C(无花果。3.).
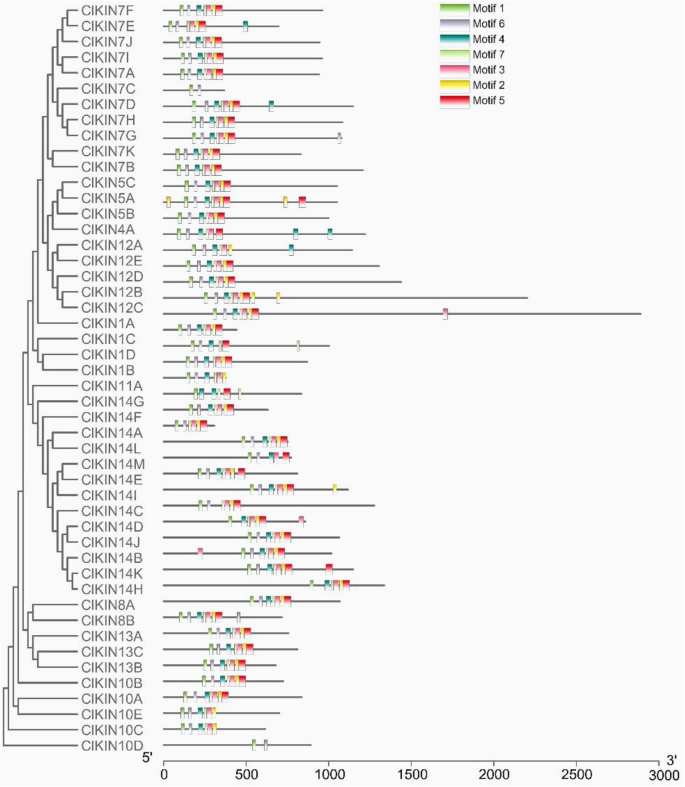
利用MEME在线软件对西瓜驱动蛋白序列进行多序列比对分析,探索ClKIN蛋白的序列特征和功能基序。7个典型的驱动蛋白家族的保守基序,命名为基序1-7(图。4).所有西瓜驱动蛋白中均存在atp结合位点内高度保守的肽基序1 (FAYGQTGSGKT)和保守的微管结合位点(SSRSH)基序6。除ClKIN7C、ClKIN10D、ClKIN14A和ClKIN14C外,在大多数ClKINs中均可检测到Motif 4,即另一个保守的微管结合位点VDLAGSE [32].除ClKIN1D、ClKIN7C、ClKIN10D、ClKIN12A、ClKIN14M和ClKIN14G外,大多数ClKINs中存在motif 2,微管结合位点HIPYR。Motif 3是颈区起始K/RxIxNxxxVIN的保守Motif。Motif 5是高度保守的颈部Motif,由疏水重复模式ø-xx(x)- ø-xxx-ø-xx-ø- g组成。Motif 3和Motif 5出现在大多数ClKINs中[33].结果表明,ClKINs蛋白含有驱动蛋白家族典型的保守特征基序。
Kinesin基因家族的复制与同步分析
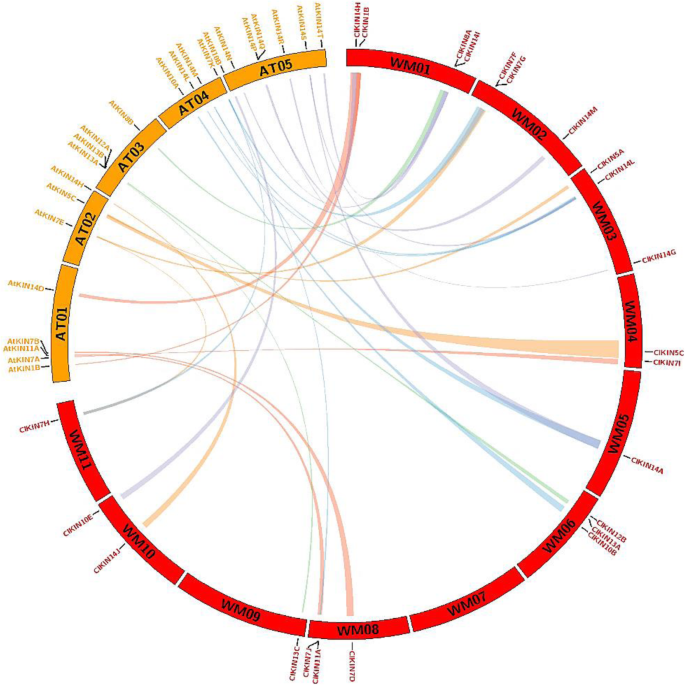
串联和片段复制在基因家族的扩展和功能中发挥着重要作用[34,35].为揭示驱动蛋白基因家族可能的进化关系,对驱动蛋白家族的重复事件、片段重复基因对和串联重复基因对进行了研究c . lanatus和答:芥.结果暗示了Kinesin基因没有发生串联基因组重复事件。然而,鉴定了15对分段重复事件,其中每对基因位于西瓜基因组的单独染色体上,例如clkin1b / clkin1d.,clkin7f / clkin7j,ClKIN14L / ClKIN14A,ClKIN13B / ClKIN13C(无花果。5).总体而言,同革分析表明西瓜在西瓜中的Kinesin家族仅通过节段性重复扩大。
西瓜不同组织中驱动蛋白基因的表达谱
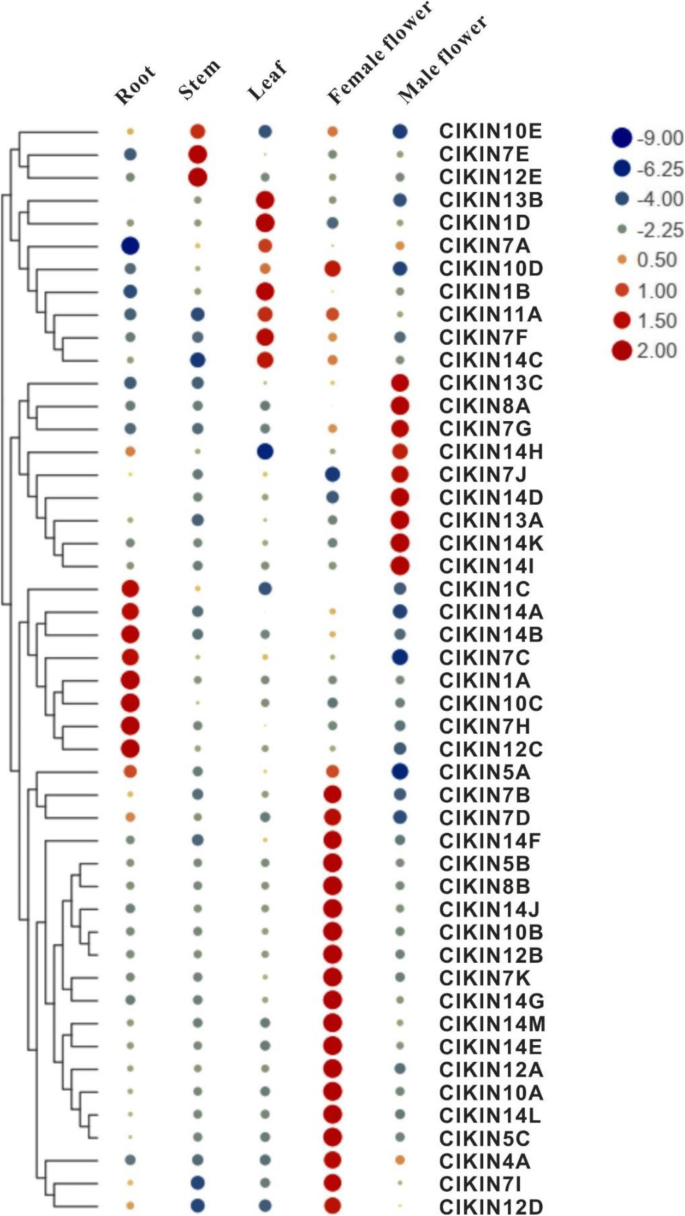
表达式模式对于评估潜在的角色很重要克里克斯植物生长和发育过程中的基因。因此,我们检查了48的表达式模式克里克斯五种不同组织中的基因,包括通过定量逆转录PCR(QRT-PCR)的根,茎,叶,女性和雄性花(图。6).qRT-PCR结果表明,西瓜的驱动蛋白基因表现出有限的表达模式,只能在一个或两个组织中检测到。西瓜驱动蛋白基因(Cla013748、Cla001716、Cla003337、Cla011614、Cla000622、Cla008965、Cla016598和Cla010272)在根、茎和叶营养器官中均有高表达,表明它们在营养器官发育中具有潜在的作用。另外,有20个驱动蛋白基因在雌花中优先表达。9个驱动蛋白基因在雄花中特异表达。总体而言,38个驱动蛋白基因在生殖器官中大量表达,表明它们在生殖组织的生长发育中起着关键作用。
参与早期果实发育的关键驱动蛋白基因鉴定
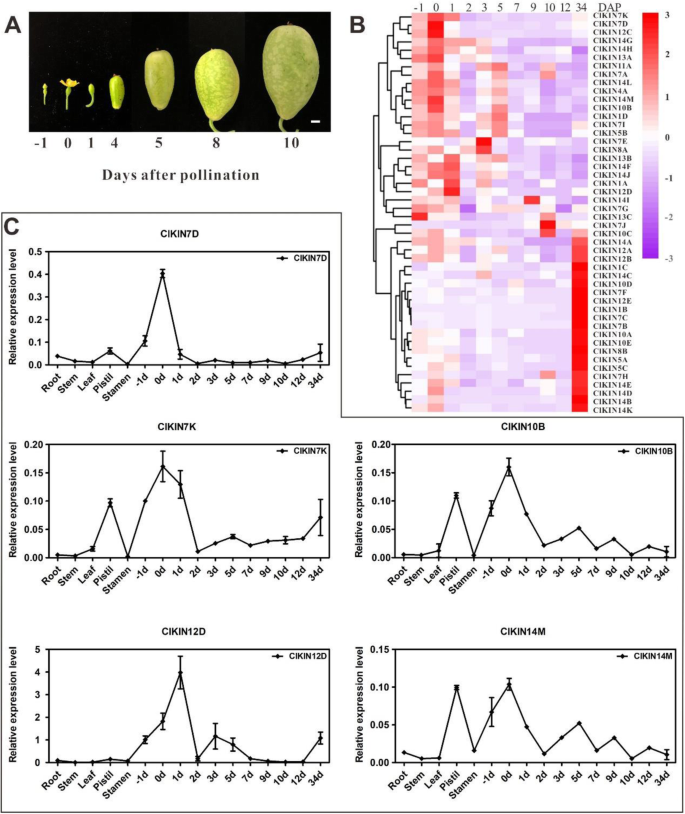
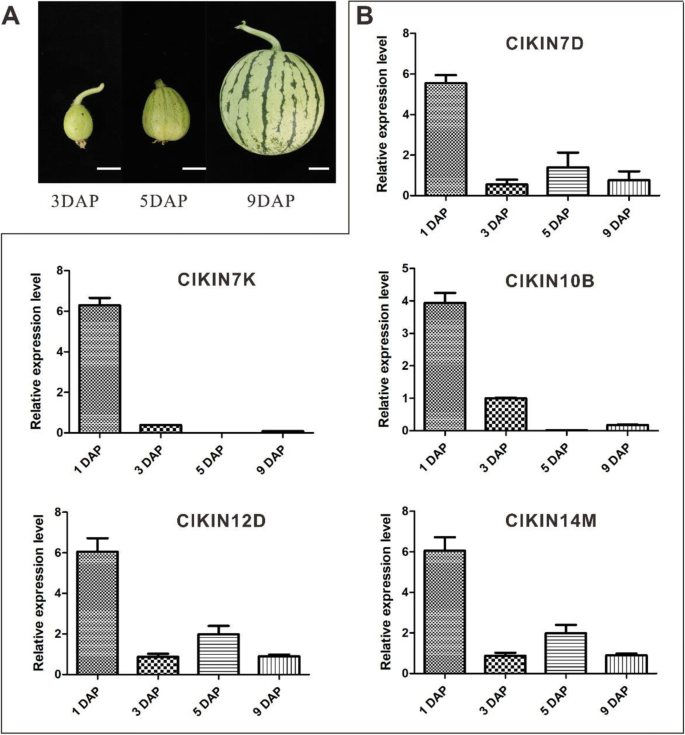
西瓜作为一种瓜类植物,其果实发育遵循典型的四个阶段:子房发育;果设置;广阔的水果增长;成熟与成熟[21,22,36].在四个阶段中,发育的前三个阶段(卵巢发展,水果套装,膨胀果实生长)被定义为早期果实开发阶段。早期果实开发阶段在授粉后约10天完成,直接确定水果的尺寸,形状和质量[37].此外,先前的转录组和QRT-PCR分析结果表明,Kinesin家族基因参与了早期果实发展的调控海棠和Cucumis巨大成功[15,17]. 因此,为了研究驱动蛋白家族基因在西瓜早期果实发育过程中的作用,利用授粉后-1、0、1、2、3、5、7、9、10、12、34天的果实cDNA进行qRT-PCR。采用层次聚类法和热图分析法对驱动蛋白基因表达进行可视化分析。从驱动蛋白表达谱的概述来看克里克斯可以在不同发育阶段的果实中检测到测试的基因,在果实发育的特异性阶段具有不同的转录水平(图。7).其中,21克里克斯结果表明,DAP后34天果实中有较高的转录水平,处于成熟和成熟发育阶段。总共27个克里克斯在-1,0,1,2,3,5,7,9,10,12天的水果中表现出不同的表达水平,这是在早期果实开发阶段的DAP。进一步的详细分析显示14个kinesins(CLA022645,CLA013925,Cla010272,CLA009301.,Cla019890,CLA007599,Cla014608,Cla014076,CLA000622,CLA018908,CLA014106,CLA015441.,Cla022444和Cla008965)在早期发育的果实中有特异或丰富的表达。此外,西瓜果实的主要可食部分由雌蕊组织发育和分化而来。因此,对早期果实和雌蕊组织表达水平的比较分析表明,5种驱动蛋白克里克斯基因(CLA022645,CLA013925,Cla019890,CLA007599和CLA018908)在发育早期的果实和雌蕊均表现出相对特异或最高的表达量。为了更好地联系驱动蛋白基因家族在果实早期发育中的功能,我们还检测了5克里克斯中草西瓜的基因是圆形和中等果实形状,与QRT-PCR具有长而大的果实形状的西瓜YL。结果表明5克里克斯这些基因在果实发育早期大量表达,特别是在DAP . 1时的果实中。8).表达5克里克斯在不同DAP的种子中进一步分析基因。和5克里克斯基因在种子中显示出不同的表达水平。尤其,ClKIN7D和ClKIN12D在授粉后6和8天的种子表达水平更高(图S4).结果表明:5克里克斯基因(ClKIN7D,ClKIN7K,ClKIN10B,ClKIN12D和ClKIN14M)在早期果实开发期间参与水果/种子发展。
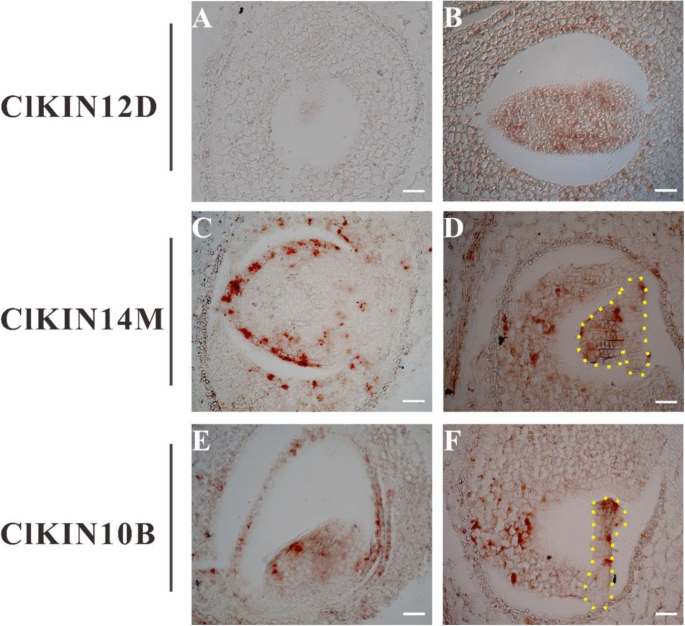
为了准确检查克里克斯基因组织表达模式和验证基因功能,以上5个基因中的3个(ClKIN10B,ClKIN12D和ClKIN14M),用原位杂交法进一步验证。详细分析表明ClKIN10B,ClKIN12D和ClKIN14M在早期果实/种子发育中有较强的表达(图。9).这些数据表明,不同的驱动蛋白成员在西瓜果实/种子发育过程中表现出不同的表达模式,可能具有阶段性的作用。特别是被测的3个驱动蛋白基因可能在西瓜早期果实/种子发育过程中起作用。
驱动蛋白家族基因在激素治疗应答中的潜在作用
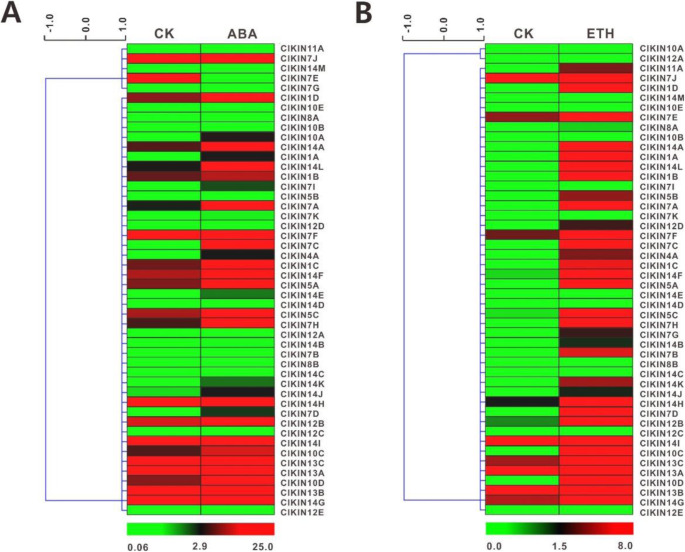
为了了解西瓜kinesin基因和主要激素之间的可能关系,在ABA和Eth激素治疗后研究了每个Kinesin基因的相对转录水平。基于相对表达水平创建热图(图。10).结果表明,至少有1/3的驱动蛋白基因对ABA或ETH处理有响应。此外,23克里克斯基因受ABA和Eth的调节,但在不同的激素处理下显示出非常不同的表达模式。在ABA治疗之后,表达水平的两个克里克斯(ClKIN11A和ClKIN7G)急剧下调(<双重),而表达水平为21克里克斯显著增加(>翻倍)。然而,不同于ABA处理,大多数驱动蛋白基因(32克里克斯)响应Eth刺激而表现出显着的上调。在eth治疗后,表达水平ClKIN7K,ClKIN10B和ClKIN14M但是并没有突然发生变化,ClKIN7D和ClKIN12D表现出显着的上调(>双重),有趣的是,ClKIN7D在ABA处理后也急剧上调(< 2倍)。结果表明ClKIN7D和ClKIN12D可能参与调节植物激素途径。一般来说,这些详细的表达水平分析暗示克里克斯基因可以参与植物激素途径的调节。
讨论
西瓜(Citrullus lanatus(Thunb。)matsum。&Nakai]包括主要葫芦,是世界上的第五次消耗水果。它也是全世界种植的最重要的经济作物之一。水果发育特征是西瓜育种中的重要农艺性状。西瓜早期果实发育直接影响随后的农艺性状,包括果实尺寸,形状和质量。Kinesins是重要的基于微管的电动机蛋白,包括所有真核生物中的保守电动机域。它们在植物发育中的囊泡和细胞器,细胞因子,信号转导,形态发生,细胞分裂和细胞生长的单向传输中发挥着关键作用。38,39,40,41].此外,先前的研究表明,kinesin家族基因也参与了植物的生殖发育[29,30.,31,42].其中,驱动蛋白家族基因已被证实在果实早期发育的调控中起重要作用海棠和Cucumis巨大成功[15,17].因此,这些作品宣布了在植物中进行了广泛调查的植物,特别是在经济作物中的紧急调查,预计会提高作物产量。然而,鉴定和分析西瓜素,特别是在水果生殖组织中的Kinesin家族基因的详细表达特征和功能仍然是难以捉摸的。随着完成的c . lanatus基因组序列,克里克斯基因可以被系统地识别和分析[43].在本研究中,我们鉴定了48个驱动蛋白家族基因克里克斯在西瓜基因组中,并综合分析了这些基因的系统发育关系,染色体位置,基因结构,保守的基序分布和重复和同步分析。此外,我们表现了广泛的分析克里克斯不同组织、不同果实早期发育阶段及对激素处理的响应。特别是果实发育过程中的表达模式分析,阐述了西瓜驱动蛋白家族基因在西瓜发育中的总体特征和具体动态。总之,我们的研究为进一步研究它们在西瓜生殖发育中的具体作用和对激素影响的反应提供了明确的线索。
西瓜中Kinesin家族基因的特征
如结果部分所述,大多数西瓜驱动蛋白中存在一些典型的驱动蛋白家族的保守基序。驱动蛋白运动结构域由一个Walk a ATP结合基元“FAYGQTGSGKT”和一个微管结合结构域组成[44,45,46].微管结合域通常包含三个微管结合基序(SSRSH、xDLAGSE和HxPYR) [32].在ATP结合基序中的高度保守肽序列“FaygqTgsgkt”可以通过它们的氨基酸序列的所有对准在所有西瓜序列中发现,这负责水解ATP,以产生直接的力,以沿着微管原子细胞单向行进,以便沿着微管原制液和电力单向行进临界细胞过程。典型的微管粘合位点“SSRSH”可以在所有的kinesin中检测到,但其他两个微管粘合基序可以在大多数kinesins中发现少数例外的kinesins。特别地,在两个Kinesins Clkin7C和Clkin10D中只能检测一个微管绑定基序“SSRSH”,但是找不到三种微管粘合基序中的其他两个。结果表明,微管结合位点“SSRSH”是最保守的微管结合位点。然而,CLKIN7C和CLKIN10D蛋白是否具有微管结合能力,只有一个微管结合位点需要进一步验证。
基于驱动蛋白序列的系统发育分析对西瓜驱动蛋白基因进行了分类,拟南芥把大米分成十个家庭[47].有趣的是,来自三种物种的所有这些基因的数量分布趋势在十组中几乎相同,并且没有显示出不同的单子叶或分布特征。对一致趋势的分析表明,Kinesin-14和Kinesin-7分别是第一和第二大组。Kinesin-14家族是一个保守的家庭,并在有丝分裂和细胞器运输中发挥了重要作用,在染色体隔离中进行了重要作用[48].无论是动物还是植物,驱动蛋白-14家族成员的数量都是最多的[48,49].Kinesin-11亚家族含有最小量的三蛋白蛋白,其中三种中的每一个只有一个Kinesin-11蛋白。Kinesin-11系列成员在信号转导或发散催化核中起作用,很少被发现。此外,由于陆地植物不存在Kinesin-2,3和9个亚壳,因此西瓜kinesin超级家族缺乏三个亚属植物[50].系统发育分析的结果暗示,在不同植物分类群中的一些基本发育过程中,在空间上和功能挽救的Kinesin家族基因的结果。
驱动蛋白家族基因在果实早期发育中的重要作用
先前的基因芯片和表达谱分析表明,一些驱动蛋白基因是苹果和黄瓜早期果实发育所必需的[15,17,18,51].然而,在包括西瓜在内的大多数经济物种中,驱动蛋白基因在果实早期发育过程中的确切作用尚不清楚。因此,本文对早期果实发育中驱动蛋白家族基因的表达谱进行了综合分析。qRT-PCR结果表明,在不同发育阶段的早期果实中可以检测到大多数驱动蛋白基因的转录本。一个显著的特征是,大多数驱动蛋白基因的表达水平在果实发育早期较高,然后在果实成熟和成熟时急剧下降。对瓜类早期果实发育的研究表明,早期果实生长主要是由于细胞数量的增加,换句话说,主要是受细胞分裂的驱动[52].此外,快速细胞分裂的时期伴随着微管相关的kinesin基因的峰值表达增加[18].微管促进染色体对准术中椎间盘赤道[53].因此,果实发育早期高表达的驱动蛋白基因可能通过调控细胞骨架和微管动力学来调控有丝分裂过程中的染色体组织,最终导致细胞数量或大小的改变[53].
西瓜驱动蛋白基因调控哪一个发育过程最终控制果实的早期发育?这个问题很有趣,需要在未来加以研究。西瓜果和番茄果都属于浆果类水果,因为它们厚厚的果皮包含着许多种子。两种水果的可食部分要么主要由胎盘构成,要么由胎盘组织发育分化[21].综合组织特异性转录组分析显示出胰岛素基因sppakrp1.在果实发育早期的胎盘组织中表达高峰茄属植物pimpinellifolium野生栽培的番茄[19,20.].这说明番茄驱动蛋白基因sppakrp1.可以通过调节胎盘组织发育来参与早期果实开发。这意味着西瓜kinesin基因克里克斯在果实发育早期特异性或大量表达,也可通过调控胎盘组织发育来调控果实早期发育。这为研究早期果实发育的分子机制提供了一个理想的切入点。然而,这些驱动蛋白基因的确切作用还有待进一步研究和证实。
驱动蛋白家族基因在激素治疗中的潜在作用
植物激素是一组小信号分子,已被批准在植物生长和发育过程中发挥基本作用。已知更多的基因的表达水平由不同的植物激素调节。以前的研究发现了激素如乙烯(Eth)如乙烯(Eth)在葫芦科中特异性花动器官的性测定和发育的贡献[54,55].此外,研究表明,驱动蛋白-4基因OsGDD11参与植物激素的信号通路[27].更重要的是,在瓜类作物中,授粉被认为是释放激素酶的关键过程,特别是生长素,这反过来又刺激果实肥大[23].早期的研究表明,植物激素促进瓜类果实的早期发育,尽管关于哪种激素最关键还存在争议[23,56].瓜类果实有丝分裂过程中,有丝分裂驱动蛋白在染色体组织中起重要作用[17,53].这些研究暗示植物激素和镰状之间存在联系。在水稻中首先核实了这一事实,其中Kinesin蛋白基因BC12/GDD1号通过调节激素GA生物合成途径介导细胞伸长[27].为了进一步探讨西瓜植物激素和胰岛素之间的关系,在我们目前的作用中,研究了激素治疗后Kinesin基因的相对表达水平。结果表明,荷尔蒙治疗后大多数Kinesin基因的转录水平改变,表明其响应于不同激素的关键作用。虽然一些基因可以对相同的激素作出反应,但其他一些刺激家族基因的成员呈差异响应某些激素而差异。有趣的是,ClKIN7E和ClKIN7G这与其他驱动蛋白基因有很大不同,表明它们在响应ABA激素处理过程中起着独特的作用。这些数据为进一步研究植物发育过程中驱动蛋白响应植物激素的分子机制提供了有用的线索。
结论
总之,48克里克斯确定基因c . lanatus在全基因组水平。将这些基因分为10个亚壳。染色体地点,外显子/内含子结构,保守的主题分布,以及Kinesin家族成员的同步分析c . lanatus确定了。综合分析与表达剖析克里克斯进行基因以确定早期果实发育中的潜在功能,并响应激素刺激。此外,详细表达分析显示了组织特异性和高表达模式克里克斯基因。最后,5克里克斯基因,包括ClKIN7D,ClKIN7K,ClKIN10B,ClKIN12D和ClKIN14M,在早期果发育中同时表现出相对特别和最高的表达水平,表明他们在早期果发育中的重要作用。
方法
驱动蛋白基因家族的鉴定Citrullus lanatus
所有BLAST搜索都是在西瓜基因组数据库(Cucurbit Genomics database,http://www.icugi.org/)的运动结构域序列分别为人类的KHC (n -末端运动)、小鼠的KIF2(内部运动)和KCBP (c -末端运动)拟南芥)查询。利用e值截断1生成63个候选基因,其中包含驱动蛋白和一些不相关的蛋白质。此外,从Pfam数据库(PF00225)中下载了运动域隐马尔科夫模型(HMM)剖面(PF00225)。http://pfam.xfam.org/).然后Hmmer 3.0软件用于搜索Kinesins。智能电机域分析(http://smart.embl-heidelberg.de/)和Interporcan(http://www.ebi.ac.uk/Interpro/)进行,缺失没有保守的电机结构域的蛋白质。最后,通过在线工具扩展进一步分析了西瓜中的候选节毒基因(http://www.expasy.org/tools/)来预测等电点(PI)和分子量(MW)。
西瓜驱动蛋白基因的染色体定位分析
所有染色体位置信息克里克斯基因从西瓜基因组数据库中下载。利用MapChart在线软件实现染色体定位、长度等信息的可视化。
Kinesin基因的系统发育分析
驱动蛋白氨基酸序列来自c . lanatus与答:芥,o .漂白亚麻纤维卷和Solanum lycopersicum.使用带有默认多个对齐参数的Muscle软件进行对齐。利用MEGA 6.06软件采用邻居连接法构建系统发育树。bootstrap复制测试值设置为1000。
Kinesin蛋白的基因结构和保守基序分析
的克里克斯利用GSDS2.0(基因结构显示服务器,http://gsds.cbi.pku.edu.cn/).保守的主题c . lanatus通过使用程序MEME鉴定Kinesin蛋白质(多个用于主题诱导,http://meme-suite.org/tools/meme).主题的最大数量被设置为7,其他为默认值。
西瓜的共线性分析克里克斯基因
它们之间的同系物对c . lanatus和答:芥使用BLASTP程序识别。GFF文件用作McScanx的输入文档,以分析同时性关系[57].利用CIRCOS软件(http://circos.ca/).
植物材料和荷尔蒙治疗
97103是北京市蔬菜种质改良重点实验室徐勇博士提供的自交系。YL西瓜材料采自陕西省榆林沙漠地区。在正常条件下,包括根、茎、叶、雌花、雄花和果实在内的各种组织在授粉后的不同天数内c . lanatus提取RNA。西瓜植株在温室的自然光照下生长,光照温度为28-35°C/ 16-20°C(白天/夜晚)。在激素处理方面,播种后4周龄幼苗采用植物激素处理。用100 μM脱落酸(ABA)喷洒幼苗叶片[58]和10mm乙烯利(ETH) [59]并在12小时治疗后收集。除了相应的激素之外,用相同的溶液喷洒对照幼苗。将具有三种生物重复的样品在液氮中冷冻并在RNA提取之前储存在-80℃。
RNA提取和qRT-PCR
根据制造商的说明,使用快速RNA分离套件(华为阳生物技术有限公司)的快速RNA孤立试剂盒(华为阳生物技术有限公司)提取大理体组织的总RNA。使用上标III转录酶(Invitrogen)用1μg总RNA合成第一链cDNA。
定量反转录PCR (qRT-PCR)在ABI StepOnePlus机上使用SYBR Premix Ex Taq™(TaKaRa)进行。每组进行3个独立的生物重复ClKIN基因。所有的特定引物克里克斯使用Primer3Plus在线软件(http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi)并在补充表中列出S2.相对表达水平克里克斯基因被标准化抗西瓜肌动蛋白基因(基因ID:Cla007792)记录。
RNA原位杂交
为了分析西瓜YL系果实发育早期果实中驱动蛋白基因的组织表达模式,我们用西瓜YL系果实中的2- dap、3- dap和5-DAP进行了RNA原位杂交[42].果实在含0.1% Triton X-100和0.1% Tween 20的4%多聚甲醛溶液中固定16 h。样品经分级乙醇脱水和二甲苯玻璃化后,包埋在石蜡中。石蜡块切成8 μm厚的切片。通过添加底物硝基蓝四氮唑/5-溴-4-氯-3-吲哚基磷酸盐(NBT/BCIP),原位杂交检测信号的反应结果为紫红色。用Axio成像M2显微镜(Zeiss)观察杂交信号并拍照。
数据和材料的可用性
当前研究期间生成的数据集可在GenBank存储库中使用,http://www.ncbi.nlm.nih.gov/Genbank注册编号如下:ClKIN1A (MW882942)、ClKIN1B (MW882943)、ClKIN1C (MW889992)、ClKIN1D (MW889993)、ClKIN5A(MW889995)、ClKIN5B (MW889996)、ClKIN5C (MW889997)、ClKIN7A(MW889998)、ClKIN7B(MW889999)、ClKIN7C(MW890000)、ClKIN7D(MW890001)、ClKIN7E(MW890002)、ClKIN7F (MW958182)、ClKIN7G (MW958184)、ClKIN7I (MW958185)、ClKIN7J (MW958186)、ClKIN7K (MW958187)、ClKIN8A (MW958188)、ClKIN8B (MW958189)、ClKIN10A (MW958190)、ClKIN10B (MW958191)、ClKIN10C (MW958192)、ClKIN10D (MW958193)、ClKIN10E (MW958194)、ClKIN11A (MW958195)、ClKIN12A (MW958196)、ClKIN12B (MW958197)、ClKIN12C (MW958198)、ClKIN12D (MW958199)、ClKIN12E (MW958200)、ClKIN13A (MW958201)、ClKIN13B (MW958202)、ClKIN13C (MW958203)、ClKIN14A (MW958204)、ClKIN14B (MW958205)、ClKIN14C (MW958206)、ClKIN14D (MW958207)、ClKIN14E (MW958208)、ClKIN14F (MW958209)、ClKIN14G (MW958210)、ClKIN14H (MW958211)、ClKIN14I (MW958212)、ClKIN14J (MW958213)、ClKIN14K (MW958214)、ClKIN14L (MW958215)、ClKIN14M (MW958216)。
缩写
- 氯:
-
Citrullus lanatus
- 亲属:
-
驱动蛋白
- 公吨:
-
微管
- 存在:
-
定量反转录PCR
- PAKRP:
-
Phragmoplast-associated kinesin-related蛋白质
参考
- 1.
Richardson DN, Simmons议员,Reddy AS。光合真核生物动力蛋白的综合比较分析。BMC基因组学。2006;七18。
- 2.
Vale RD, Reese TS, Sheetz MP。鉴定一种新的力产生蛋白,驱动蛋白,涉及微管基础的运动。细胞。1985;42(1):39-50。
- 3.
Sablin EP, Kull FJ, Cooke R, Vale RD, Fletterick RJ。驱动蛋白相关马达ncd的运动域晶体结构。大自然。1996;380(6574):555 - 9。
- 4.
Hirokawa N,Pfister Kk,Yorifuji H,Wagner Mc,Brady St,Bloom GS。通过电子显微镜和单克隆抗体装饰鉴定的牛脑咽部细胞分子结构域。细胞。1989; 56(5):867-78。
- 5.
关键词:驱动蛋白马达,开关机构,控制机制大自然。2001;411(6836):439 - 45。
- 6.
nita R, Kikkawa M, Okada Y, Hirokawa N. KIF1A交替使用两个环结合微管。科学。2004;305(5684):678 - 83。
- 7.
Diefenbach RJ,Mackay JP,Armati PJ,Cunningham Al。普遍存在的人类蛋白重链的茎域的C末端区域含有Kinesin轻链的结合位点。生物化学。1998年; 37(47):16663-70。
- 8.
Kanai Y,Dohmae N,Hirokawa N.Kinesin运输RNA:分离和表征RNA输送颗粒。神经元。2004; 43(4):513-25。
- 9。
Endow SA,瓦利戈拉KW。运动蛋白马达极性的决定因素。科学。1998;281(5380):1200–2.
- 10.
Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J等。一种标准化的动力蛋白命名法。中国生物医学工程学报,2004;
- 11.
Reddy。分子马达及其在植物中的作用。Int Rev cell . 2001; 204:97-178。
- 12.
麦当劳HB,斯图尔特RJ,Goldstein LS。果蝇的Kinesin样NCD蛋白是较小的终点的微管电机。细胞。1990年; 63(6):1159-65。
- 13.
Walker RA, Salmon ED, Endow SA。果蝇红葡萄酒分离蛋白是一个负端定向运动分子。大自然。1990;347(6295):780 - 2。
- 14.
Endow Sa,kang sj,staterwhite ll,玫瑰md,skeen vp,salmon编辑。酵母Kar3是一个负端式微管电机蛋白,其优先在负端稳定微管。Embo J. 1994; 13(11):2708-13。
- 15.
Lee YP,Yu GH,SEO YS,HAN SE,CHOI YO,KIM D,MOK IG,KIM WT,SUNG SK。苹果基因表达的微阵列分析,从事早期果实开发。植物细胞代表2007; 26(7):917-26。
- 16.
索里亚·格塞拉Re,Rosales-Mendoza S,Gasic K,Wisniewski Me,Band M,Korban SS。基因表达在苹果的早期果实中受到高度调节。植物mol biol报告。2011; 29(4):885-97。
- 17.
杨XY,王Y,江WJ,刘XL,张XM,于HJ,黄SW,刘GQ。黄瓜驱动蛋白基因在早期果实发育中的特性和表达谱:揭示驱动蛋白在黄瓜果实指数细胞产生和膨大中的作用。J实验机器人。2013;64(14):4541–57.
- 18.
姜璐,闫珊,杨伟,李勇,夏明,陈智,王强,严林,宋鑫,刘瑞等。转录组学分析揭示了微管相关基因和转录因子在黄瓜果实长度调控中的作用。Sci代表2015;5:8031。
- 19.
Breyne P,DreeSen R,Vandepoele K,De Veylder L,Van Breusegem F,Callewaert L,Rombauts S,Raes J,Cannoot B,Engler G等。植物细胞分裂过程中的转录体分析。Proc Natl Acad Sci U S A. 2002; 99(23):14825-30。
- 20。
Pattison RJ,Csukasi F,郑Y,Fei Z,Van der Knaap E,Catala C.综合组织特异性转录组分析显示出在早期番茄果实开发期间的明显的监管计划。植物理性。2015; 168(4):1684-701。
- 21.
《水果:一个发展的视角》。植物细胞。1993;5(10):1439 - 51。
- 22.
关键词:番茄,甜瓜,果实形态,遗传基础实验机器人。2014;65(16):4625-37。
- 23.
付芳琼,毛文华,史凯,周永红,麻美涛,余建强。油菜素内酯在黄瓜早期果实发育中的作用。实验机器人,2008;59(9):2299-308。
- 24.
Ando K,Carr Km,Rumet R.早期黄瓜果实生长的转录组分析鉴定了与发育阶段相关的不同基因模块。BMC基因组学。2012; 13:518。
- 25.
水稻矮竹笋1突变体是nack型驱动蛋白样基因的一个泄漏突变体,它可以启动器官原基,但不能启动器官发育。植物生理学杂志。2005;46(12):194 - 194。
- 26.
关键词:脆性Culm 12,细胞周期,壁特性,驱动蛋白-4,水稻abstract:植物j . 2010; 63(2): 312 - 28。
- 27.
李军,姜军,钱强,徐勇,张超,肖军,杜超,罗伟,邹刚,陈明,等。水稻BC12/GDD1编码一种与GA生物合成基因启动子结合的驱动蛋白样蛋白,其突变导致细胞伸长受损的侏儒症。植物细胞。2011;23(2):628 - 40。
- 28.
Kong Z,Ioki M,Braybrook S,Li S,Ye ZH,Julie Lee YR,Hotta T,Chang A,Tian J,Wang G,等。驱动蛋白-4在植物皮层微管的囊泡运输中起作用,并在细胞伸长过程中调节细胞壁力学。摩尔植物。2015;8(7):1011–23.
- 29.
Kitagawa K,Kurinami S,Oki K,Abe Y,Ando T,Kono I,Yano M,Kitano H,Iwasaki Y.一种新型Kinesin 13蛋白调节水稻种子长度。植物细胞生理。2010; 51(8):1315-29。
- 30.
吴涛,沈勇,郑敏,杨超,陈勇,冯智,刘旭,刘松,陈智,雷超,等。SGL基因是一种具有反转录活性的驱动蛋白样蛋白,与水稻的粒长和株高有关。Plant Cell Rep. 2014;33(2): 235-44。
- 31。
天S,吴j,李f,zou j,liu y,zhou b,白y,sun mx。NTKRP,Kinesin-12蛋白,调节胚胎/种子大小和种子萌发,涉及G2 / M转变的细胞周期进展。SCI REP。2016; 6:35641。
- 32。
植物生理学杂志,2011,29(5):639 - 644。咕咕叫医学杂志。2000;10(13):797 - 800。
- 33.
valerrd, Fletterick RJ。电机的设计方案。Annu Rev Cell Dev Biol. 1997; 13:45 - 77。
- 34.
视觉TJ,布朗DG,坦克斯利SD。拟南芥基因组复制的起源。科学。2000;290(5499):2114–7.
- 35.
Cannon Sb,Mitra A,Baumgarten A,Young Nd,May G.分段和串联基因复制在拟南芥中大型基因家族演变中的作用。BMC植物BIOL。2004; 4:10。
- 36.
Okello RCO, Heuvelink E, de Visser PHB, Struik PC, Marcelis LFM。是什么促使水果生长?植物学报。2015;42(9):817-27。
- 37.
郭胜光,刘佳,郑勇,黄美美,张海燕,龚光贵,何洪军,任勇,钟双林,费志军,等。西瓜果实发育过程中转录组动力学特征:测序、组装、注释和基因表达谱。BMC基因组学。2011;12:1-13。
- 38.
夏普DJ,棕色HM,kwon M,罗杰斯GC,荷兰G,Scholey JM。果蝇胚胎三种有丝分子电机的功能协调。mol Biol细胞。2000; 11(1):241-53。
- 39.
yddy,日是。拟南芥基因组中的kinesins:真核生物中的比较分析。BMC基因组学。2001; 2:2。
- 40。
拟南芥细胞骨架马达的研究进展。61个驱动蛋白和17个肌凝蛋白。植物杂志2004;136(4):3877 - 83。
- 41。
田中波,田中波,田中波。驱动蛋白超家族运动蛋白及其胞内转运。细胞生物学杂志。2009;10(10):682-96。
- 42。
田S,吴j,刘y,黄x,李f,王z,太阳mx。核糖体蛋白NTRP117与Kinesin-12家族蛋白NTKRP相互作用,并在调节胚胎/种子尺寸和胚根生长中的作用。J Exp Bot。2017; 68(20):5553-64。
- 43。
郭S,张j,sun h,salse j,lucas wj,张h,zheng y,mao l,ren y,wang z等。西瓜草案(柑橘类Lanatus)草案及20种不同的梳理重组。NAT Genet。2013; 45(1):51-8。
- 44。
Hirokawa N.Kinesin和Dynein Superfamily蛋白质和细胞器运输机制。科学。1998; 279(5350):519-26。
- 45.
valerrd, Fletterick RJ。电机的设计方案。Annu Rev Cell Dev Bi. 1997; 13:45 - 77。
- 46.
Kim AJ,Endow Sa。一个kinesin家谱。J Cell SCI。2000; 113(21):3681-2。
- 47.
黄益,王鹤,黄X,王Q,王J,D,李继,王W,吴Y.玉米VKS1调节早期胚乳发育期间的丝分裂和细胞因子。植物细胞。2019; 31(6):1238-56。
- 48.
Miki H,Okada Y,Hirokawa N. Kinesin Superfamily的分析:洞察结构和功能。趋势细胞BIOL。2005; 15(9):467-76。
- 49.
拟南芥有丝分裂特异性驱动蛋白的研究。植物科学学报,2006;
- 50.
拟南芥微管马达蛋白激酶超家族的功能研究。原生质。2012;249(4):887 - 99。
- 51。
Malladi A,Johnson LK:细胞周期基因的表达分析显示Carpel发育,水果集和苹果果实生长期间细胞生产的关键促进者(Malusxdomestma Borkh。)。j Exp Bot 2011; 62(1):205-19。
- 52。
Sinnott EW。葫芦中细胞尺寸与果实大小关系的发展分析。我是J机器人。1939年; 26(4):179-89。
- 53。
Ganguly A,Dixit R.植物Kinesins调节的机制。CurrOp植物BIOL。2013; 16(6):704-9。
- 54。
Yamasaki S,Fujii N,Takahashi H.植物中性表达的荷尔蒙调控。维生素霍姆斯。2005; 72:79-110。
- 55。
Boualem A、Troadec C、Camps C、Lemhemdi A、Morin H、Marie-Agnes S、frankel - zagouri R、Kovalski I、Dogimont C、Perl-Treves R等。瓜类的雄蕊基因揭示了单性花的发育和雌雄异株的形成。科学。2015;350(6261):688 - 91。
- 56。
陈建平,陈建平,陈建平,等。授粉对雌蕊型黄瓜果实发育和细胞分裂的影响。植物营养与肥料学报,2014,26(5):457 - 464。Sci Hortic。2008;116(1):1 - 7。
- 57.
王颖,唐浩,Debarry JD,谭鑫,李俊,王鑫,Lee TH, Jin H, Marler B, Guo H,等。MCScanX:一个用于基因共线性和共线性检测和进化分析的工具包。2012;40(7):e49。
- 58.
宋Q,李德,戴Y,刘S,黄l,洪y,张h,歌曲f。Makk和Mapkkk基因的表征,表达模式和功能分析在西瓜(Citrulluslanatus)。BMC植物BIOL。2015; 15:298。
- 59.
关键词:WRKY, WRKY,非生物胁迫,西瓜abstract: WRKY genes in the growth and stress stress in watermelon (Citrullus lanatus)PLoS ONE。2018; 13 (1): e0191308。
确认
不适用。
许可声明
我们确保我们有权在本研究中收集植物样本。
资金
感谢国家优秀人才计划(A279021801)、西北农林科技大学基本科研业务费专项资金(Z111021903)、陕西省自然科学基金项目(2021j -089)、陕西省国内博士学科点项目(F2020221012,)的资助。F2020221013);西北农林科技大学博士科研基金(2452018069,2452018113)。资助机构没有参与设计、分析、解释数据或手稿的撰写。
作者信息
隶属关系
贡献
TS和YL负责数据分析和实验设计。TS和YL写的手稿。TS、JJ、XG、WT、LQ、CX、LM、LZ、LM、YL负责项目和稿件的修改。所有作者都对最终稿件进行了评论、阅读和批准。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1
:图S1.驱动蛋白基因的系统发育树c . lanatus使用neighbor-joining方法。图S2.驱动蛋白基因的系统发育树c . lanatus和答:芥使用neighbor-joining方法。图S3.驱动蛋白基因的系统发育树c . lanatus和S. lycopersicum.使用neighbor-joining方法。驱动蛋白家族的邻居连接系统发生树。不同的驱动蛋白亚家族分别用不同的颜色标记。图S4.5 .比较表达分析克里克斯通过qRT-PCR检测授粉后不同天数种子中的基因。ClACTIN基因用于定量RT-PCR结果的归一化。3个生物重复的标准差用误差条表示。表S1. 驱动蛋白基因家族成员的鉴定Citrullus lanatus。表S2.pcr扩增的特异性引物为48个克里克斯基因。
权利和权限
开放获取本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
田松,蒋军,徐国强。et al。基因组广泛分析Kinesin基因家族Citrullus lanatus揭示早期果实发展中的重要作用。BMC植物杂志21日,210 (2021). https://doi.org/10.1186/s12870-021-02988-6
已收到:
接受:
出版:
关键字
- 驱动蛋白基因
- 表达模式
- 早期水果开发
- 激素的反应
- Citrullus lanatus