抽象的
背景
脱落是一种活性,有组织的和高度协调的细胞分离过程,通过改变植物体上称为脱落区的特定位点的细胞 - 细胞粘附和细胞壁分解来脱离空中器官。在拟南芥花器官和茎叶的脱落是由激素肽(IDA)、一对冗馀的受体样蛋白激酶HAESA (HAE)和HAESA- like2 (HSL2)以及体细胞胚胎发生受体样激酶(SERK)共同受体的相互作用调控的。然而,这个脱落信号模块的功能尚未在其他植物物种中得到证实。
结果
对的表达式NbenIDA1同源异型基因与受体nbenhae.1.在花冠管基部接种两个病毒诱导的基因沉默(VIGS)结构体抑制了病毒的表达烟草benthamiana.这些基因抑制事件抑制了花冠脱落,但对植物生长没有明显影响。与对照相比,VIGS植株保留了更多的花冠附着在花上,这与花冠断裂强度更大有关。花冠脱落的停止与花冠筒基部薄壁组织的保存有关,相比之下,正常花冠的薄壁组织实际上是塌陷的。相反,接种一种病毒载体构造使表达量增加恩贝尼达在花冠管的基础上,对接种植物的生长加速了Corolla衰老和脱落的同步。但是,柑橘的异源异位过度表达花旗3和拟南芥阿蒂亚在N. Benthamiana.没有改变标准植物表型,表明蛋白水解加工机械不能产生活性肽。
结论
在这里,我们证明了这对NbenIDA1编码小肽的家庭偶像- 般的家庭和受体nbenhae.1.在花冠筒的基部控制细胞的分裂,在这里不定的AZ应该形成,因此,花冠脱落N. Benthamiana.鲜花。总之,我们的结果提供了第一个证据,支持被子植物中IDA-HAE/HSL2信号模块是保守的。
背景
脱落是植物生物学中的一个基本的细胞分离过程,它对植物的进化适应起着非常有利的作用:即丢弃受感染的、衰老的或生理上受损的器官和高效的种子传播[1]. 然而,从农业的角度来看,脱落对产量影响巨大,导致高产量损失。因此,对离体过程的控制知识越丰富,农艺性状的培育就越有效。
脱落花器官和尾叶拟南芥(从现在开始,拟南芥)通过脱落(IDA)的激素肽花序的相互作用,这两个冗余受体样蛋白激酶HaESA(HAE)和HAESA样(HSL2)和体细胞胚胎发生受体 -像激酶(SERK)共同受体[2,3.].一旦IDA肽和hae样/SERK异质二聚体之间形成稳定的复合物,激酶结构域相互转磷酸化,并将信号传递到丝裂原激活的蛋白激酶(MAPK)级联[4,5]. 已确定MAPK级联抑制来自拟南芥1(KNAT1)的打结样同源盒(KNOX)转录因子短花梗(BP)/打结样的活性,其进而去抑制其他KNOX基因(克纳特2和克纳特6)诱导一组细胞壁改造酶的表达和改性蛋白质,允许花器官脱落[6,7].除了拟南芥,偶像类似基因也已经在一些作物物种中被鉴定出来。因此,有报道说这是具体的偶像- 在番茄,大豆,油棕榈,柑橘,荔枝或黄羽鼠中,在脱盐区(AZS)中高度表达,荔枝或黄羽屑,也在花冠管的底部烟草benthamiana脱落期间的花[8,9,10.,11.,12.,13.].这些观察结果强烈建议偶像-类似的基因可能在其他物种中保留与之相同的功能偶像在器官脱落期间施加拟南芥调节细胞分离。还表明,合成IDA肽能够在拟南芥中诱导早期花器官脱落[14.[分别在黄色羽扇豆,油棕和白杨中脱落花,成熟的水果和叶子[12.,15.].此外,偶像柑橘类(花旗3)和荔枝(lcida1.)在拟南芥中表达的功能是产生早期花器官脱落和拯救细胞IDA2.离层不足(10.,11.].同样,a豪荔枝的状同源物,LCHSL2.,完全挽救了拟南芥双突变体的花器官脱落hae/hsl2型[16.].最后,异位表达LcKNAT1公司,拟南芥的荔枝同源物英国石油公司/克纳特1,防止了番茄和拟南芥的脱落鲜花和花粉[17.]. 尽管有大量的结果表明IDA-HAE/HSL2信号模块在各种被子植物中是保守的,但科学界仍不愿意将其功能推广到其他植物物种[18.].因此,建议在拟南芥以外的植物种类中提供明确的常规证明其功能,以解决仍然与IDA-HAE / HSL2脱落信号模块的保护相关的疑虑和反对意见。
在过去的二十年中,病毒载体已被用作一种有效的工具,利用病毒诱导的基因沉默(VIGS)来阐明许多基因的功能,或表达参与植物发育过程(包括器官脱落)的有价值的蛋白质。以番茄叶片脱落为例,用VIGS方法证明了多聚半乳糖醛酸酶(PGs)在番茄叶片脱落中的重要性烟草拨浪鼓病毒(和富)基于载体[19.]作为PGS参与番茄植物不同空中器官的中隙中薄片的溶解(审查,见[20.])。还使用番茄作为植物材料和和富基于载体,表明沉默SlPIN1码通过增加子房中生长素的积累和降低叶柄中生长素的含量来促进花的脱落[21.]. VIGS对生长素结合水解酶的下调作用SlILL1,SlILL5,SlILL6显著降低花梗中生长素的含量,提高花的脱落率[22.].
VIGS也被应用于花瓣脱落的研究。生长素/吲哚-3-乙酸(Aux/IAA)转录抑制物和两种乙烯反应因子(ERFs)在杂交月季花瓣脱落中的作用(Rosa Hybrida),由使用VIGS证明和富也是基于向量的[23.]. 向上调节6辅助/IAA在花瓣脱落期间在玫瑰花瓣AZ中检测到基因,其中一个上调之一的沉默辅助/IAA基因,RhIAA16型,受到Vigs加速的花瓣脱落表明,可能需要在花瓣AZ中的Aux / Iaa蛋白转录抑制来预防过早脱落。还表明两个ERF的表达水平,Rherf1.和Rherf4.,分别受乙烯和养肝剂在花瓣落下期间的玫瑰花瓣AZ调节[24.].乙烯处理降低了玫瑰的表达Rherf1.,虽然表达了Rherf4.生长素对花瓣AZs的诱导作用显著。两种玫瑰ERFs的VIGS沉默加速了玫瑰花瓣的脱落,这一过程与玫瑰花瓣AZ中果胶半乳糖的减少有关,并与β-半乳糖苷酶的表达水平有关rhbgla1.[24.].
瞬时表达研究和VIGS已被证明是特别可行的N. Benthamiana.为了进行功能研究。实际上,N. Benthamiana.由于对病毒和其他病原体敏感,是进行宿主-病原体相互作用研究最常用的模式植物有机体之一[25.].它也被证明了柑橘叶片斑点病毒(CLBV公司基于的病毒载体能够沉默基因(CLBV3'载体)或表达蛋白质(clbv3'pr病媒)在柑橘和N. Benthamiana.植物 [26.,27.,28.,29.].的CLBV公司病毒不限于韧皮植物,因此达到并累积在分娩和植物和生殖器官中[30.]. 事实上,绿色荧光蛋白(GFP)的检测在花冠瓣叶的花冠N. Benthamiana.植物接种了构造clbv3'pre.-GFP感染克隆证明这些载体在生殖组织中也有效[30.].
在本次调查中,基于CLBV公司VIGS载体被用来描述调控作用的对NbenIDA1家庭及其潜在的受体激酶豪类似科的花冠脱落N. Benthamina花。
结果
沉默和过度表达烟草benthamiana艾达例如,豪-就像基因利用病毒载体柑橘叶片斑点病毒
在之前的一项研究中,我们发现了两种表达模式NbenIDA1和恩本哈同系物平行于花冠脱落过程N. Benthamiana.[13.].c端脯氨酸丰富的签名N. Benthamiana.ida样肽,所谓的pip结构域[31.[对Nbenida1肽的一对Nbenida1a和Nbenida1b,保守氨基酸残基Ser62,Pro64,Ser65和Asn69,其证明是Arabidopsis atida与Athae受体的肽结合口袋的相互作用[5](附加文件1).关于HAE肽结合袋内的氨基酸残基是与IDA相互作用的关键[5[一对Nbenhae受体,Nbenhae.1和Nbenhae.2还保护了配体 - 受体结合(Glu266,PHE289,Ser311,Arg407和Arg409)的五种临界氨基酸残基等,以及具有次要作用的其他临数α(额外文件)1).这些观察结果表明,这对Nbenhae家庭受体和一对Nbenida1家庭肽可以符合Corolla脱落中的功能信号模块N. Benthamiana.鲜花。为了探索这种可能性,我们生成了CLBV公司基于沉默的载体NbenIDA1或恩本哈homeologs (CLBV3'-nbenida1和CLBV3'-NbenHAE构建,分别)通过选择两对同源基因共同的沉默触发序列(附加文件2).此外,我们产生了额外的构建体以研究异位表达的效果恩贝尼达(clbv3'pr-NbenIDA1构造)和其他偶像-比如基因花旗3基因柑橘和阿蒂亚拟南芥的基因(clbv3'pr-CitIDA3和clbv3'pr- 分别是atida结构,在N. Benthamiana.植物(附加文件)2).
接种CLBV3'-NbenIDA和CLBV3'-NbenHAE构建阻滞花冠脱落
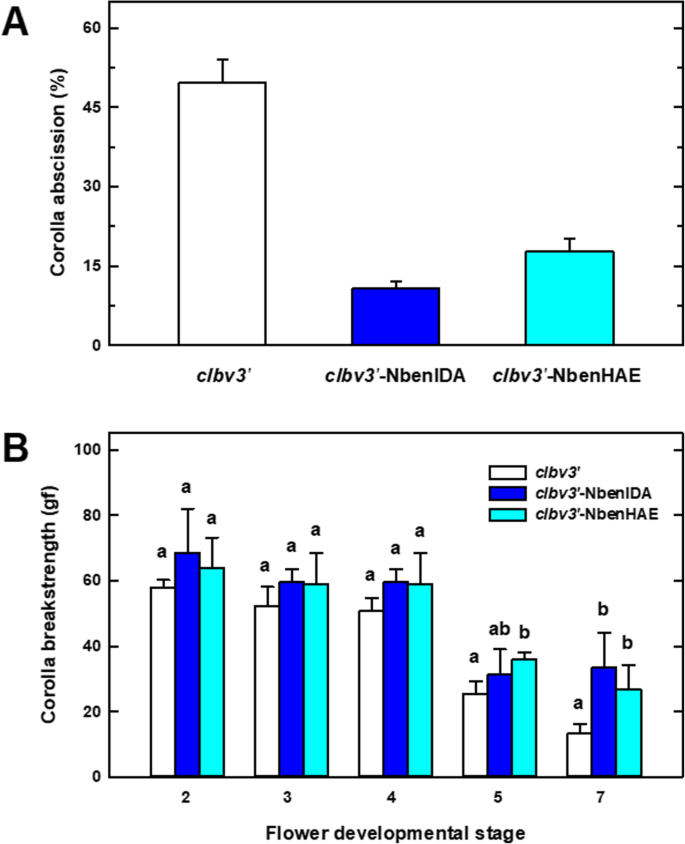
在形态学水平上,接种CLBV3'-NbenIDA和CLBV3'-Nbenhae构建体没有对植物生长产生任何明显的影响,影响接种植物的主要植物或繁殖器官的发育速率或大小(图。1a和c和附加文件3.).但是,尽管接种的植物与任何一个构建体接种而成,但通常就像对照一样,但它显着地呈卡罗拉管依赖于花容器(图。1d和附加文件3.).已经去除了萼片环(Calyx)的沉默花的特写表明坏死的花冠管仍然附着在容器上。这种观察结果相当相关,因为在对照工厂中,花冠管的基部是在花发育的高级阶段消失的过程中(图。1a、 花#5到#7),剩下的衰老花冠弱地附着在果实的顶端尖端,在茄科烟草亚科称为蒴果(图。1b)。为了识别不确定的沉默构建,我们进行了RNA-SEQ分析N. Benthamiana.Corolla基于花发育阶段4,来自对照(CLBV)和沉默构建体(idasil和haesil)接种植物(附加文件4).正如预期的那样,接种的CLBV3'-NBENIDA沉默构建体导致抑制了这对NbenIDA1花冠筒基部的同源体CLBV3'-nbenhae沉默构造只会抑制表达式nbenhae.1.,但不是那样的nbenhae.2..
自然脱落N. Benthamiana.花冠在花开发的第7阶段进行,恰逢花冠的衰老过程(附加文件)5).用沉默构建体接种植物中保留/脱落卡罗拉斯数的定量clbv3'-nbenida或clbv3'-NbenHAE发现,在发育第7阶段后,它们在花上保留了比对照更多的花冠。在两组沉默植物中CLBV3'-NbenIDA结构产生的留存率略高(图。2一种)。在这一花阶段,大约50%的矢伦斯在对照植物中脱离,而在接种的植物中,Corollas的总脱落分别为10%和18%clbv3'-NbenIDA和clbv3'-Nbenhae构造。
接种了控制载体的植物的花冠附着CLBV3'和沉默CLBV3'-NbenIDA和CLBV3'-NbenHAE构造显示花冠在花发育第7阶段后脱落的百分比(一个)和去除花冠所需的力(花冠断裂强度;哥伦比亚广播公司)(b).所有结果均为4种沉默实验,涉及每次接种的6株植物(每花发育阶段≥40测量)±标准误差。图中的不同字母。2B表示Vigs构建体之间的显着差异(学生的T-Test,P < 0.05)
为了确定去掉花冠所需要的力N. Benthamiana.使用不同的花发育阶段测量植物,花冠断裂长度(CBS)(图。2b)。对照植物在阶段2至7中表现出鲜花中CBS值的逐渐下降。两个控制和沉默的植物都需要与阶段2至4之间的花朵中的花朵中的脱离碎片相似的力。相反,控制厂需要较低的力值来分离与花阶段5和7的沉默植物相比,Corollas与植物中的植物测量CLBV3'-nbenida1和CLBV3'-Nbenhae沉默构建体在阶段5至7期间保持稳定(图。2b)。在花阶段7中,用力弱达10 GF的力量达到控制植物中的花冠脱落,而在clbv3'-NbenIDA和clbv3'-NbenHAE接种植株需要更高的力,分别约40和30 gf。这一特征与保持花冠筒基部与花托的附着以及在沉默植物中观察到的花冠脱落停止有关(见图)。1C和D)。
花冠筒基部的解剖学
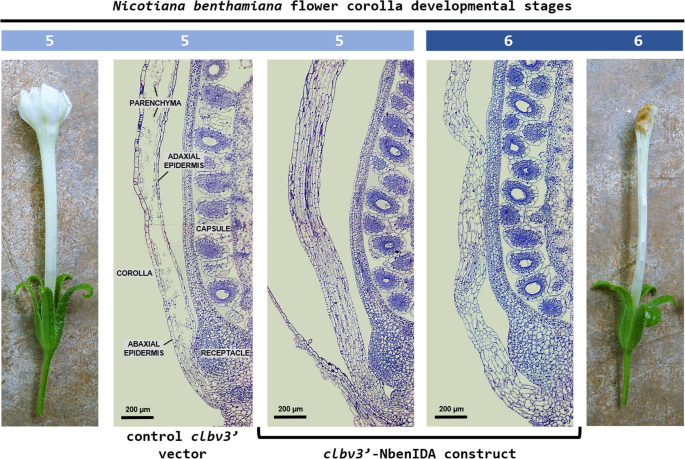
接下来,我们研究了对照和VIGS植株花冠筒基部的组织学变化。对照花在发育第5期的光镜下观察发现,花冠筒基部薄壁组织大面积坍塌,这可能是由于细胞壁水解酶的作用。3.).此外,Corolla的Adaxial和Babaxial表皮的壁显示出结构损伤的迹象表明它们应该在一定程度上受到水解酶活性的影响。
花冠:花的花冠筒基部的解剖结构,其中一对花冠的表达NbenIDA1同源异型体被抑制(植物接种了CLBV3'-Nbenida构造)显示不同方面,从对照花中观察到。在花朵开发阶段5观察到的细胞壁击穿在对照组织的薄壁组织中被完全被捕NbenIDA1沉默的花(无花果。3.). 尽管花冠呈波浪状,但薄壁组织细胞在花发育第6期花冠筒基部仍保持细胞完整性。此外,花冠衰老N. Benthamiana.鲜花的特点是逐渐丧失Turgor(附加文件5),抑制这对NbenIDA1同源日志似乎没有修改这个过程。蒴果的增大有助于衰老花冠筒基部的解体,因此也有助于它从花托上脱落(另文)5).Corolla承受胶囊的扩大的力必须明显与解剖结构的维持和损失细胞壁弹性和细胞Turgor相关。因此,在控制花冠和沉默植物之间记录的CBS的次要差异(见图。2B)可能只与维持花冠筒基部的解剖结构有关。
过表达恩贝尼达降低植株生长,加速花冠衰老和脱落
一个CLBV公司基于表达式向量(clbv3'pr)含有一个额外的sgRNA启动子,用于稳定和高水平的表达[26.用来研究内源性增加的转录物水平的效果恩贝尼达基因上N. Benthamiana.植物(clbv3'pr-Nbenida1构建)以及外国的异源表达偶像拟南芥和柑橘(clbv3'pr-Atida和clbv3'pr-CitIDA3构造)(附加文件2).
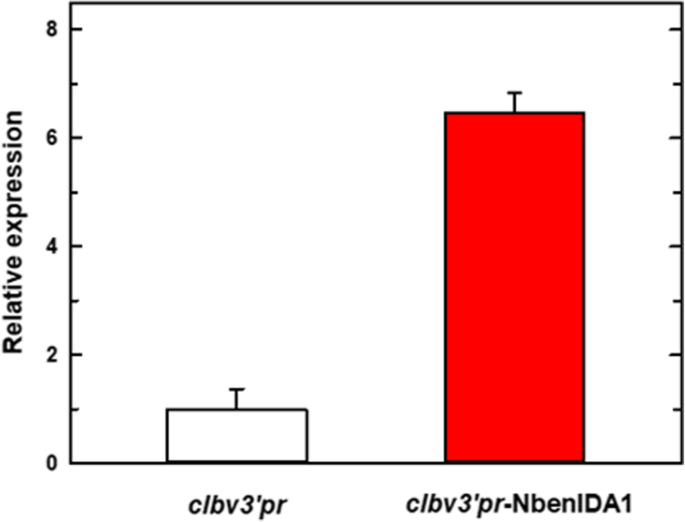
关于接种的植物clbv3'pr-NbenIDA1构造,表达水平恩贝尼达在发育阶段2的花朵的花冠底部比对照花朵高出六倍以上(图。4). 因此,接种了CLBV公司表达载体矢量clbv3'pr-Nbenida1应该与过度积累有关恩贝尼达转录物。
植物接种clbv3'pr-Nbenida1载体表现出与其他种类的植物相关的臭名昭着的表型变化(图。5):
病毒诱导内源性的基因表达恩贝尼达和偶像来自柑橘的基因(花旗3)和拟南芥(阿蒂亚)N. Benthamiana.植物。一个接种的CLBV公司的表达式构造clbv3'pr-Nbenida1与接种对照载体的植物相比,植物引起的生长停止和静置clbv3'pr与clbv3'pr-CitIDA3和clbv3'pr-AtIDA结构。用控制载体接种的植物顶端部分的特写clbv3'pr,(b) 与clbv3'pro.-恩贝尼达1(c),clbv3'pro.-citida3(d), 和clbv3'pro.-ATIDA(e) 结构体。(b至e)显示接种各菌种的植株的花发育阶段CLBV公司表达载体。有趣的是,在(b,d,e)的花发育阶段由1至5或6个,在(c),只有阶段1,2和7的花卉仍然缺少3至6的花朵。这些鲜花显然是较小的并且携带更短的花冠
- 一世)。
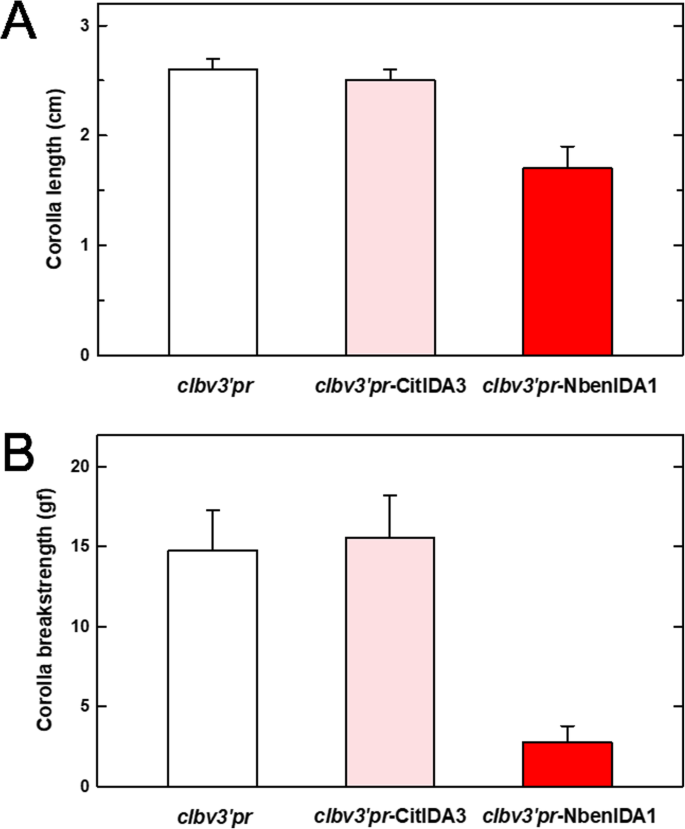
成熟植株表现出影响整个植株结构的矮化表型,包括叶面积和大小、节间和花冠长度、花大小和茎高(图。5一种)。作为内源的过表达的影响的一个例子恩贝尼达基因,测定花冠长度,并与接种对照载体的植株进行比较clbv3'pr和我们在一起clbv3'pr-CitIDA3构造(图。5b和c以及图。6a).很明显,表达载体接种植株对应的花冠长度clbv3'pr-NBENIDA1比对照植物和接种表达的植物的植物短clbv3'pr-CitIDA3建筑。
- II)。
花冠过早衰老,在花发育的第2阶段之后达到完全衰老,因为这些植物在第7阶段直接发育坏死的花,在中间阶段(3到6)没有出现花(图。5C)。
- III)。
花冠脱落也加速(图。6b).因此,提高恩贝尼达结果是去除花冠所需的力显著降低,达到约3 gf的cBS值。应该指出的是,这种影响与在研究中观察到的相反NbenIDA1-沉默植物(见图。2b)。
与接种的植物相反clbv3'pr-NbenIDA1表达载体,植物接种clbv3'pr-Citida3或clbv3'pr-Atida基本上不区分,从被占用空虚的人clbv3'pr因为它们的营养生长是标准的(图。5a)和他们的花朵花冠上升并从正常位置的花容器脱离(图。5B,D和E)。证据CLBV公司病毒粒子结构在接种后系统地传播感染(附加文件2)建议偶像拟南芥和柑橘类的类似基因应该在整个植物中积极表达。
因此,这些结果显示了内源性过表达显示的表型恩贝尼达同源异型图进一步证明了IDA-HAE信号模块调控花冠脱落的观点N本塔米亚纳。
讨论
一种基于的策略柑橘叶片斑点病毒(CLBV公司)Vigs的载体用于表征对对的参与NbenIDA1同源物及其潜力恩本哈COROLLA管底部细胞壁溶解的受体N. Benthamiana.花。沉默构念的接种CLBV3'-NbenIDA和CLBV3'-Nbenhae对植物生长没有产生任何明显的影响,影响主要植物和生殖器官的发育速度或大小(图。1a和c和附加文件3.)但阻止了花冠脱落(图。1b和d和附加文件3.).与对照组相比,接种了这两种沉默结构物的植物的花保留了更多的花冠附着在花上。2a),观察可能与从花容器中除去花冠所需的较大的力(图。2b)。在花冠管的碱基中保存的核糖组织的停留有关,相反,在正常的冠状甘蓝实际上塌陷(图。3.).当表达时,还报告了卡罗拉管底部的薄壁组织的保存BLADE-ON-PETIOLE基因NtBOP2型在栽培烟草植物中使用反义方法抑制[32.]. 烟草基因NtBOP2型与拟南芥分享相似之处BOP2.,与其帕拉洛一起BOP1.,参与花卉器官AZ的发展[33.,34.].因此,功能NtBOP2型与拟南芥相似BOP1/BOP2控制栽培烟草花冠筒基部AZ的形成[32.].对照花冠筒基部的表皮细胞壁N. Benthamiana.与薄壁组织中观察到的细胞破裂相反,花保持完整(图。3.可能与木质素的沉积有关。Serafini-Fracassini和同事[35.]报道了栽培烟草花冠衰老开始于开放花(发育期4)和花冠膨大度明显丧失之间的过渡期,这一时期通常伴随着花冠筒基部出现棕色环(发生在花冠发育期5)N. Benthamiana.; 附加文件5).在这个阶段,表皮细胞壁在花冠管的底部非常自动荧光[32.]表明木质素是植物中最重要的自动荧光分子之一[36.,在衰老过程中沉积在细胞壁中。这使我们可以推测,可能的抵抗水解的表皮细胞壁在基部的花冠筒N. Benthamiana.花与木质素沉积有关,使细胞壁分解为薄壁组织。这种假定的木质素沉积功能可能与最近的证据有关,该证据表明,在水稻花梗中无木质素区域是水稻种子破碎的关键[37.]. 最近也有报道,木质素蜂窝状结构在拟南芥花器官AZs周围的细胞壁上的沉积似乎起到了机械支撑的作用,使细胞壁溶解在这个组织中[38.].
帕特森提出的脱落模型[39.]定义了脱落途径的主要阶段,从AZ的分化到对脱落信号的响应能力,随后激活细胞分离过程,并在分离层表面形成保护层。有两种类型的可用分区:主要可用分区和不定或次级可用分区[40]. 初生AZs的分化与由茎顶端分生组织(SAM)形成的侧器官的发育同时发生。初生AZ的形成只发生在植物体上数量有限的形态部位。相比之下,不定AZs的分化是在侧枝器官发育后开始的,而侧枝器官的发育位置不是由植株的形态决定的。委员会成员BLADE-ON-PETIOLE(防喷器)基因家族在几种植物物种中涉及原发性AZ形成[34.,41.]栽培烟株花冠筒基部不定芽的分化[32.].值得注意的是,通过触发激素肽IDA及其受体HAE和HSL2之间形成的复合物的激活,将差异化的初级AZ保持无活性,直到它们通过触发形成的复合物的激活来响应脱落刺激信号的能力31.,42.,43.,44.]. 然而,这种获得对脱落信号的反应性的过程似乎并不发生在不定AZ中[32.,45.].在原始的az中,比如拟南芥的花器官,偶像和HAESA基因表达持续存在于双突变体的花托中BOP1 BOP2.这在脱落方面完全缺乏[34.].因此,初级AZ分化和脱落的执行可能是功能独立的过程,但脱落的成功取决于功能AZ的预先存在。反义抑制NtBOP2型在栽培的烟草植物中[32.]对花冠管的底座的解剖结构效果相同的效果,作为该对的抑制NbenIDA1家庭和推定nbenhae.1.受体N. Benthamiana.不定芽的形成和薄壁组织破坏的预防。因此,可以推测花冠不定芽的分化和花冠筒基部的脱落是在花冠中进行的烟草鲜花是同时和功能依赖的过程,因为它们导致了相同的解剖结果,预防不定氧化氮形成和保存薄壁组织。
的CLBV3'-Nbenida通过抑制这对的表达来构建被捕的花冠脱落NbenIDA1王室虽然CLBV3'-Nbenhae仅通过抑制表达式对花冠脱落产生相同的效果nbenhae.1.(附加文件4).我们选择了一个沉默的触发序列,以可能影响受体家庭,nbenhae.1.和nbenhae.2.(附加文件2),考虑到沉默触发序列中至少有一段超过21个核苷酸且与目标基因序列100%一致,可能足以在植物中诱导基因沉默[46.,47.].但是,我们不能排除所选择的序列的次级或三级结构,以触发该对沉默的序列恩本哈同源基因可能会导致RNA沉默机制的问题,特别是当碱基配对不完善时nbenhae.2..关于每个受体同源体的潜在功能,花器官的衰老和脱落是授粉后花中同时发生的过程[48.].生理过程涉及有助于组织细胞死亡的反应性氧物种(ROS)[49.,50.]拟南芥和番茄的最近研究将Ida样肽暗示为ROS稳态的潜在调节剂[51.,52.,53.].在拟南芥中,HSL2可以感知成熟的肽IDL1,导致根内的氧化破裂和程序性细胞死亡(PCD),然后导致根冠细胞脱落[51.].在番茄中进行的该研究表明,Slida肽对花药裂开的功能取决于翅膀中ROS的时间图案,但触发该过程的肽受体复合物未被指定[53.].我们的研究N. Benthamiana.表明受体Nbenhae.1参与了花冠脱落的调节,而Nbenhae.2可能参与通过增加ROS或其他尚未描述的机制触发的花冠衰老调节。
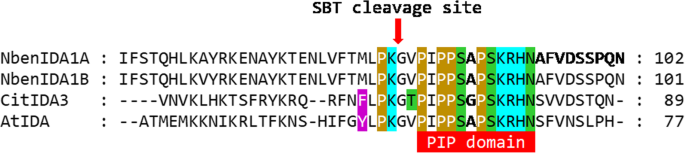
接种的clbv3'pr-Nbenida1构建表达式增加恩贝尼达在花冠筒的基部N. Benthamiana.花(图。4)对接种植株的生长以及花冠衰老和脱落的时间产生不利影响(图。5).这些在植物发育中的干扰类似于内源的异位过表达所产生的干扰偶像外来柑橘基因花旗3拟南芥[10.,44.].相比之下,clbv3r ' pr- citida3和clbv3r ' pr- atida的异位表达结构并没有改变植物的标准表型(图)。5和6).这种失败可能与一种不同的蛋白水解处理机制有关,它需要成熟的ida样前肽N. Benthamiana.,因为蛋白水解裂解是产生具有最佳受体结合长度的功能性IDA肽的必要条件。这种差异的一个可能的候选者是潜伏期酶活性。在拟南芥中,特异的亚纤毛酶(AtSBT5.2、AtSBT4.12和AtSBT4.13)参与了IDA前肽的C端加工,以产生成熟的活性肽[54.]. 这些参与切割PIP结构域上游两个氨基酸的微丝酶必须具有适合与特定氨基酸序列结合的活性位点。事实上,PIP结构域上游的五个氨基酸在IDA和CitIDA3前肽之间高度相似(图。7).这两个前肽的氨基酸序列是由一个具有非极性芳香侧链的氨基酸(IDA中的酪氨酸[Y]和CitIDA3中的苯丙氨酸[F])组成,四个氨基酸的相同核心(亮氨酸[L]-脯氨酸[P]-赖氨酸[K]-甘氨酸[G]),而是具有非极性脂肪族侧链的氨基酸(IDA中缬氨酸[V]和CitIDA3中苏氨酸[T],后者具有极性中性侧链)(图5)。7).因此,这两种系列氨基酸的高度相似的化学性质可能与异源表达的事实有关花旗3在拟南芥中既有表型复制效应,又有内源调控效应偶像过度表达和在挽救细胞脱落缺陷中的作用IDA2.突变体[10.].在N. Benthamiana.,具有非极性芳族侧链的氨基酸在一对Nbenida1通过甲硫氨酸(M),具有非极性脂族侧链的氨基酸(图。7).因此,诸如来自拟南芥和含有非极性芳族链链的氨基酸的偶氮肽的肽可能无法成功结合活性位点N. Benthamiana.参与c末端加工的枯草酶。因此,AtIDA和CitIDA3前肽的酶切无效,没有成熟和活性肽产生,也没有表型。这种方案的可行性需要实验测试。
结论
自Jinn和同事的第一份报告以来[42.]布滕科和同事们[31.]分别显示LRR-RLK的参与HAESA和小信号肽偶像在拟南芥花器官脱落中,大量的实验证据支持信号模块IDA-HAE/HSL2在器官脱落中的调控作用。大量拟南芥的鉴定偶像orthologs及其HAESA家庭受体[9[园艺和水果作物中叶,花和果实脱落期间获得的丰富实验结果[最近的综述,见1-3]强烈建议脱落调节模块IDA-HAE / HSL2在Anviosperms中保守。但是,科学界仍然不愿意将该模块的功能概括为其他植物物种[18.].在这里,我们证明了这对NbenIDA1编码小肽的家庭偶像- 般的家庭和受体nbenhae.1.在花冠筒基部形成的不定体AZ中控制细胞壁溶解,从而使花冠脱落N. Benthamiana.花。除了拟南芥之外,这是第一个例子,声称脱落调节模块IDA-HAE / HSL2在AnuiSperms中保守。
方法
CLBV公司基于构造
本调查中使用的基于CLBV的载体来自传染病CLBV公司克隆PBIN35SRBZ-CLBV(CLBV-IC)[55.],通过引入独特的PMLI.在3'-UTR区域的限制位点产生CLBV3'沉默载体,并引入一个复制的最小CP-sgRNA启动子来恢复PMLI.限制[26.].克隆N. Benthamiana.沉默触发基因片段和编码序列N. Benthamiana.,柑橘和拟南芥基因(附加文件2)在PMII.限制网站的CLBV公司-通过使用标准技术和适当的引物(附加文件)获得载体5).所有构建体都通过测序确认。结果,我们生成了沉默成对的构造NbenIDA1和恩本哈家庭分别命名,CLBV3'-NbenIDA和CLBV3'-Nbenhae,以及过度表达的构建体恩贝尼达家庭和柑橘花旗3和拟南芥阿蒂亚基因,分别命名为,clbv3'pr-nbenida1,clbv3'pr-citida3,和clbv3'pr-AtIDA(附加文件2).然后引入所有结构农杆菌肿瘤术使用标准协议,细胞,菌株Cor 308(由C. M.Mamilton,Corneld Research基金会的C.M.M.Milton博士提供)。
植物生长与接种
N. Benthamiana.种子是从JoséGuerri博士和Centro deProtección·昆虫(Ivia,Moncada,Spain)的Centro deProtecciónCrázqu@quarzquez的博士。种子在营养土壤上发芽,在20/24℃(夜间/天),60%相对湿度和a的植物生长室中,用人工灌封混合物(50%蛭石和50%泥炭苔)单独移植。16/8-H光/黑暗制度。
Vigs构建体是农业接种的N. Benthamiana.如[55.].
花冠断裂体长测量
使用Pesola®弹簧测功机(SCALE:100 G; PCE Iberica S. L.,Tobarra,Spain)测量拉出花冠上拉出花冠(花冠Breakstrength,CBS)所需的力。测力计的夹具被小心地连接到卡罗拉管的顶端部分N. Benthamiana.鲜花,力量施加,直到花冠从花容器中脱离。使用摄像机记录每个花冠拆卸事件。逐帧检查视频以确定应用于分离花冠的力的大小。
花冠解剖学基础
从鲜花N. Benthamiana.植物接种着空的CLBV3'向量和CLBV3'-Nbenida构建体在发育阶段5(具有卡罗拉·肢裂片的边缘卷曲的花冠衰老,向内发作)和6(Corolla Limb完全收缩和褐色和花冠烘干)。
据英国萨里郡沃金市伦敦树脂公司报道,含有花囊和花冠筒底部的样品被固定并嵌入了LR白色树脂中[56.].使用玻璃刀用Leica RM2255 Mictiotome(Leica Microsystems,Wetzlar,德国)用Leica RM2255 Mictotome(Leica Microsystems,Wetzlar,德国)切割纵向部分,并固定到显微镜载玻片。在[中,用甲苯胺蓝澳核(CI 52040; Merck,Darmstadt,德国)染色部分[57.]并用Leica DM La显微镜(Leica Microsystems,Wetzlar,Germany)检查和拍摄和拍摄并拍摄。
RNA提取,RT-PCR检测和QPCR分析
使用来自叶片的新鲜组织和花冠管的底部制备总RNAN. Benthamiana.花,层状脱落带柑橘使用TrizoL方法的叶子和拟南芥花容器[28.].使用Nanodrop分光光度计(Thermo Fisher Scientific,Alcobendas,Spain)检查分离的总RNA的质量并定量。
系统性感染N. Benthamiana.通过使用引物对Ku-17L / Ku7l侧翼的晶体对Ku-17L / Ku7L在18dPI下检测植物。CLBV公司病毒载体(附加文件5).PCR产物被2%琼脂糖凝胶电泳和凝胶染色(Biotium Inc.,Hayward,Ca,U.S.A.)可视化。
使用LiftceCler 2.0仪器(Roche,Basel,瑞士),用LightCycler®FastStartDNAMasterPlus Sybr Green Mirture Sybr Green Mirtrys Sybr Green Mirtrys Sybr Green Mirtryss Sybr Green Culs(Roche,Basel,Switzerland)进行定量PCR分析。恩贝尼达和NbenPP2A公司列入其他文件5.通过LightCycler软件版本4.1获得荧光强度数据。来自控制的三种生物重复clbv3'pr- 使用 - 尼比达1接种植物。使用该转录水平的相对定量归一化NbenPP2A公司基因[58.]反对控制并使用2确定−ΔΔCt方法。
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- AZ:
-
离层区
- 辅助/IAA:
-
生长素/ indole-3-acetic酸
- BOP:
-
BLADE-ON-PETIOLE
- 英国石油公司:
-
短花梗
- CBS:
-
花冠breakstrength
- ERF公司:
-
乙烯反应因子
- GFP:
-
绿色荧光蛋白
- 海:
-
HAESA
- HSL2:
-
HAESA-like 2
- IDA:
-
花序缺乏在脱落
- KNAT1:
-
从拟南芥的打结紫罗兰色1
- 答:
-
polygalacturonase.
- 纤毛运动:
-
编程细胞死亡
- ROS:
-
活性氧
- 山姆:
-
拍摄顶端公司
- SERK:
-
体细胞胚胎发生受体样激酶
- 和:
-
烟草拨浪鼓病毒
- 中收取:
-
病毒诱导的基因沉默
参考
- 1。
Tranbarger TJ,Tadeo FR.肉质果实脱落区的多样性和功能动态。年度设备版本。2020;3:151–214.
- 2。
Patharkar或Walker JC。脱落信号的研究进展。J实验机器人。2018;69:733–40.
- 3.
Shi C,Alling RM,Hammerstad M,Aalen RB。通过进化保守肽信号控制器官脱落和其他细胞分离过程。植物。2019; 8:225。
- 4.
孟X,周J,唐J,李B,de Oliveira MVV,柴J,等.配体诱导的受体样激酶复合物对拟南芥花器官脱落的调控。细胞代表2016;14:1330–8.
- 5。
圣地亚哥J,Brandt B,Wildhagen M,Hohmann U,Hothorn La,Butenko Ma,等。机械洞察培养花器官脱落的肽激素信号络合物。Elife。2016; 5:1-19。
- 6。
Shi C-L, Stenvik G-E, Vie AK, Bones AM, Pautot V, Proveniers M,等。拟南芥I类knotate -like Homeobox蛋白在IDA-HAE/HSL2花脱落信号通路中起下游作用。植物细胞。2011;23:2553 - 67。
- 7。
Butenko Ma,Shi C,Aalen RB。KNAT1,KNAT2和KNAT6在IDA-HA-HSL2信号传导途径下游起作用,以调节花器器官脱落。植物信号表现。2012; 7:135-8。
- 8。
大豆和番茄叶片脱落中ida样基因的表达及其对脱落信号的要求。AoB植物。2012;2012:pls035。
- 9。
støim,orr rjs,fooyontphanich k,金x,knutsen jmb,fischer u等。缓解心培养肽IDA脱落信号肽IDA:具有受体HAE / HSL2受体的基因组重复和增益和丧失。前植物SCI。2015; 6:931。
- 10.
Estornell LH, Wildhagen M, Pérez-Amador MA, Talón M, Tadeo FR, Butenko MA。IDA肽控制拟南芥和柑橘的脱落。植物科学与技术,2015;
- 11.
荔枝,LCID11 ZICIDL1,Zitchi,ZHAO M,Liu X,XIA R,Zhao M,Li J.鉴定和分子表征其异位表达促进拟南芥花器官脱落。SCI批准。2016; 6:37135。
- 12.
Wilmowicz E, Kućko A, Ostrowski M, Panek K. florence DEFICIENT IN separation -like IN xiosis IN Lupinus luteus.(英文)植物生长调节剂。2018;85:91-100。
- 13。
Ventimilla D,Domingo C,González-ibeas d,Talon M,Tadeo Fr。尼古拉植物在花冠脱落,茎生长和水胁迫期间Nicotiana Benthamiana中IDA(散发缺陷的缺陷缺陷的缺陷缺陷)的差异表达。BMC植物BIOL。2020; 20:34。
- 14。
Stenvik G-E,Tandstad NM,Guo Y,Shi C-L,Kristiansen W,Holmgren A等人。脱落的开花缺陷的EPIP肽足以通过受体样激酶HAESA和HAESA样式诱导拟南芥脱落。植物细胞。2008; 20:1805-17。
- 15.
Tranbarger TJ,DomonhédoH,Cazemajor M,Dubreuil C,Fischer U,Morcillo F.脱落缺乏花序缺乏的PiP肽增强了杨树和ElaeisGuineensis果实脱落。植物。2019; 8:143。
- 16。
关键词:荔枝,HAESA-like基因,离体,脱落abstract:Int J Mol Sci. 2019;20:5945。
- 17。
赵明,李聪,马X,夏R,陈J,刘X,等。KNOX蛋白KNAT1通过抑制乙烯合成基因调控荔枝小果脱落。J实验机器人。2020;71:4069–82.
- 18。
Meir S、Philosoph Hadas S、Riov J、Tucker ML、Patterson SE、Roberts JA。对乙烯依赖和非依赖的花器官脱落调控途径的再评价。J实验机器人。2019;70:1461–7.
- 19。
江C-Z,Lu F,Imsabai W,Meir S,Reid MS。沉默的聚半乳糖酸酶表达抑制番茄叶柄脱落。J Exp Bot。2008; 59:973-9。
- 20.
番茄花梗脱落的发育与调控。植物科学与技术,2015;
- 21.
施Z,江Y,韩X,刘X,曹R,祁M,等。SlPIN1调控生长素外流对花脱落过程的影响。Sci代表2017;7:14919.
- 22
富X,shi z,姜y,姜l,qi m,xu t等。来自Solanum Lycopersicum的一种植金缀合物水解酶的家族,并分析了花梗脱落的作用。BMC植物BIOL。2019; 19:1-17。
- 23
高勇,刘聪,李旭,徐宏,梁勇,马恩,等。玫瑰花瓣脱落区转录组分析及一个参与花瓣脱落的aux/IAA家族基因RhiAA16的功能分析。前植物科学。2016;7:1–13.
- 24
高勇,刘勇,梁勇,陆杰,蒋聪,费兹,等。杂交蔷薇RhERF1和RhERF4通过影响果胶降解介导乙烯和生长素调控的花瓣脱落。植物J。2019;99:1159–71.
- 25
Goodin MM, Zaitlin D, Naidu RA, Lommel SA。本氏烟:作为植物-病原体相互作用模型的历史和未来。植物与微生物的相互作用。2008;21:15 - 26。
- 26。
Agüero J,Ruiz Ruiz S,Del Carmen VM,Velázquez K,Navarro L,等.基于柑橘叶斑病毒表达外源蛋白或分析柑橘植物基因功能的病毒载体的开发。植物与微生物相互作用。2012;25:1326–37.
- 27。
Agüero J, Vives MDC, Velázquez K, Pina JA, Navarro L, Moreno P, et al.;基于柑橘叶斑病毒的病毒载体对烟草和柑橘植株的基因沉默效果不同。病毒学。2014;460 - 461:154 - 64。
- 28。
Velázquez K,Agüero J,Vives MC,Aleza P,Pina JA,Moreno P,et al.基于柑橘叶斑病毒的病毒载体诱导的柑橘幼嫩早熟开花:遗传育种的新工具。植物生物技术杂志。2016;14:1976–85.
- 29。
Gómez Muñoz N,Velázquez K,Vives MC,Ruiz Ruiz S,Pina JA,Flores R等。酸橙对柑橘衰退病毒的抗性是通过水杨酸和RNA沉默防御途径介导的。植物病理学。2017;18:1253–66.
- 30.
AgüeroJ,Vives Mc,Velázquezk,ruiz-ruiz s,juárezj,navarro l等。柑橘叶片污渍病毒在尼古利亚娜·宾夕法尼亚州尼加沙亚洲和柑橘侵入了共融资地区。莫尔植物途径。2013; 14:610-6。
- 31.
Butenko Ma,Patterson Se,Griinc Pe,Stenvik G,Amundsen SS,Mandal A等人。脱落的花序缺乏对拟南芥的花卉器官脱落进行了控制,并鉴定了植物中的一种新的推定配体。植物细胞。2003; 15:2296-307。
- 32.
吴X-m,yu y,han l-b,li c-l,王h-y,zhong n-q等。烟草叶片上叶片2基因通过控制纵向细胞膨胀来介导花冠脱落区的分化。植物理性。2012; 159:835-50。
- 33.
Norberg M,Holmlund M,Nilsson O.叶柄基因的刀片迅速控制侧外器官的生长和发展。发展。2005; 132:2203-13。
- 34.
McKim SM,Stenvik G-E,Butenko MA,Kristiansen W,Cho SK,Hepworth SR等。叶片叶柄基因是拟南芥离区形成的关键基因。发展。2008;135:1537–46.
- 35。
Serafini-Fracassini D,Del Duca S,Monti F,Poli F,Sacchetti G,Brogoli Am等。在烟草(尼古利亚塔巴突)花冠中衰老和编程细胞死亡期间的转谷氨酰胺酶活性。细胞死亡有所不同。2002; 9:309-21。
- 36。
植物中的Donaldson L.自发荧光。分子。2020; 25:2393。
- 37。
尹杰,赵L-H,金SL,崔H,高H-J,安G。BEL1型同源异型盒基因SH5通过促进脱落区的发育和抑制木质素的生物合成来诱导种子破碎。植物J。2014;79:717–28.
- 38。
Lee Y,Yoon Th,Lee J,Jeon Sy,Lee Jh,Lee Mk等人。木质素分子支架控制拟南芥表面完整性的细胞壁的精确加工。细胞。2018; 173:1468-80。
- 39。
帕特森。宽松的。拟南芥的脱落与开裂。植物杂志。2001;126:494 - 500。
- 40。
addicott ft。脱落伯克利。加利福尼亚州:加州大学出版社;1982年。
- 41.
库兹古J-M、马格纳K、蒙迪S、科森V、克莱门茨J、拉特P。豆科植物NOOT-BOP-COCH类基因是作物主要农艺性状脱落的保守调控因子。新植物醇。2016;209:228–40.
- 42.
Jinn TL, Stone JM, Walker JC。HAESA是一种富含亮氨酸的重复受体激酶,控制着花器官的脱落。基因Dev。2000;14:108-17。
- 43.
Cho Sk,Larue Ct,Chevalier D,Wang H,Jinn T-L,张S等人。拟南芥的花式器官脱落调节。Proc Natl Acad Sci U S A. 2008; 105:15629-34。
- 44.
Stenvik G-E、Butenko MA、Urbanowicz BR、Rose JKC、Aalen RB。在拟南芥中,缺乏脱落的花序的过度表达激活了残留脱落区的细胞分离。植物细胞。2006;18:1467–76.
- 45.
Estornell LH,GómezMd,Pérez-Amador Ma,TalónM,Tadeo Fr。二次脱落区:了解柑橘触发智镖脱落的分子机制。Acta Hortic。2016; 1119:65-72。
- 46
Thomas Cl,Jones L,BaulCombe DC,Maule Aj。用马铃薯病毒X载体靶向转录后基因沉默和RNA指导甲基化的尺寸约束。工厂J. 2001; 25:417-25。
- 47
Senthil-Kumar M,Hema R,Anand A,Kang L,Udayakumar M,Mysore Ks。当异源基因序列用于病毒诱导的基因沉默时,在尼古特尼沙氨酰胺和其他溶朗物种中确定基因沉默程度的系统研究。新植物。2007; 176:782-91。
- 48
范多恩WG,Stead AD。脱落花和花卉零件。J Exp Bot。1997年; 48:821-37。
- 49
关键词:过氧化氢,辣椒,离体脱落,信号转导植物j . 2008; 56:13-27。
- 50
范多恩WG,狼换了ej。瓣衰老的生理学和分子生物学。J Exp Bot。2008; 59:453-80。
- 51.
Shi C-L,Von Wangenheim D,Herrmann U,Wildhagen M,Kulik I,Kopf A等。拟南芥中的根帽脱落的动态由肽信号传导调节。Nat植物。2018; 4:596-604。
- 52.
Bissoli G,Muñoz-bertomeu J,Bueso E,Sayas E,Vilcara EA,Felipo A等。拟南芥突变体过度表达的亚粒子SBT4.13揭示了氧化应激在细胞内酸化抑制生长中的作用。int j mol sci。2020; 21:1173。
- 53.
王锐,石超,王鑫,李锐,孟y,程玲,等。SlIDA在番茄施肥过程中通过调节活性氧稳态发挥着重要作用。植物j . 2020; 103(6): 2100 - 18。
- 54.
Schardon K, Hohl M, Graff L, Pfannstiel J, Schulze W, Stintzi A等。用枯草杆菌素样丝氨酸蛋白酶加工植物肽激素成熟的前体。科学。2016;354:1594-7。
- 55.
Vives Mc,Martíns,ambróss,Renovellá,纳瓦罗L,Pina Ja,等。柑橘叶片污染病毒和柑橘植物感染的全基因组cDNA克隆的研制。莫尔植物途径。2008; 9:787-97。
- 56.
Tadeo Fr,Tudela D,Primo-Millo E.1-氨基环丙烷-1-羧酸诱导的乙烯刺激柑橘的专体外科植体的Cambial地区的细胞增大愈伤组织。植物SCI。1995年; 110:113-9。
- 57.
奥布莱恩TP,费德N,麦卡利ME。甲苯胺蓝原体对植物细胞壁的多色染色。
- 58.
刘D,Shi L,Han C,Yu J,Li D,Zhang Y.使用定量实时PCR的病毒感染尼古罗尼亚植物中基因表达研究的参考基因验证。Plos一个。2012; 7:E46451。
致谢
Ministio de Ciencia,Innoverioónyenvenciornes(西班牙)低谷授权提供的财政支持#TRI2018-097790-R-100和来自Instituto Valenciano de InvestigaCiones Agrarias(西班牙),通过拨款51915和52002。基金用于设计数据的研究和收集,分析和解释以及撰写手稿,以及在开放式接入付款中。
我们想承认Matilde Sancho和à侏儒雪橇照顾N. Benthamiana.工厂和技术援助。
作者信息
从属关系
贡献
DV、JG、MT和FRT设计了本研究。DV、KV、SRR、JT、MAPA、MCV和FRT进行了研究并分析了数据。DV、MAPA、MT和FRT起草了这篇文章,并由所有作者进行了投稿和修改。所有作者都已经阅读并批准了最终的手稿,并确保这是事实。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
出版许可
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1。
ida样前肽和ha样蛋白激酶的多序列比对。重点介绍了ha -like受体肽结合袋中用于相互作用的IDA-like肽的关键氨基酸残基,以及ha -like受体肽结合袋中的关键二级氨基酸残基。
额外的文件2。
对触发沉默的序列的描述NbenIDA1和恩本哈同源日志生成CLBV公司基于载体。
额外的文件3。
接种沉默构建体clbv3'-NbenIDA和clbv3'-NbenHAE后,植株表现出不脱落花冠的表型。
附加文件4。
通过RNA测序明确鉴定基因沉默NbenIDA1和恩本哈家庭建筑CLBV3'-nbenida1和CLBV3'-NbenHAE位于花冠筒基部。
额外的文件5。
花的形态描述烟草benthamiana以及花冠的寿命的发展阶段。
附加文件6。
在这项工作中使用的底漆。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
文蒂米拉,D., Velázquez, K., Ruiz-Ruiz, S.。等等。偶像(花序缺乏在脱落) - 状肽和豪(HAESA) - 状受体调节Corolla脱落烟草benthamiana花。BMC植物BIOL.21日,226(2021)。https://doi.org/10.1186/s12870-021-02994-8
收到了:
接受:
出版:
关键词
- 离层区
- 离层信号模块
- 细胞分离
- 基因沉默和过度表达
- 激素肽
- LRR-RLKs
- Solanaceae.