- 研究GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
乙烯增强颤杨根系水分运输和水通道蛋白表达(GydF4y2BaPopulus Temuloides.GydF4y2Ba)根部缺氧GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21GydF4y2Ba文章编号:GydF4y2Ba227GydF4y2Ba(GydF4y2Ba2021.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
根系缺氧对大多数植物的生理过程和生长都有不利影响。乙烯可部分缓解缺氧的影响。然而,乙烯介导的植物耐缺氧机制目前尚不清楚。GydF4y2Ba
结果GydF4y2Ba
在这项研究中,我们研究了根缺氧和外源乙烯处理对叶片气体交换,根液态蛋白的叶片气体交换,根液态蛋白的表达水平,以及在颤抖的白杨中(GydF4y2BaPopulus Temuloides.GydF4y2Ba)幼苗。乙烯增强了低氧植物的净光合速率、蒸腾速率和根系水力导度。PIPs的两个亚群(PIP1和PIP2)中,PIP2s的蛋白丰度和转录本丰度GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba在低氧条件下,乙烯处理的颤杨根比未处理的颤杨根高。这些水通道蛋白表达水平的增加可能有助于根系水分运输。乙烯促进根系水分运输可能是低氧植物叶片气体交换增加的原因。GydF4y2Ba
结论GydF4y2Ba
外源乙烯增强的根水运输和表达水平GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba在颤杨缺氧的根部。结果表明,乙烯促进了植物根系缺氧条件下水通道蛋白介导的水分运输。GydF4y2Ba
背景GydF4y2Ba
植物根部需要足够量的oGydF4y2Ba2GydF4y2Ba用于呼吸和生长[GydF4y2Ba1GydF4y2Ba].与缺氧相反,其特征在于完全没有oGydF4y2Ba2GydF4y2Ba在美国,植物的根部通常会经历缺氧期,特别是当OGydF4y2Ba2GydF4y2Ba由于Waterlogging而减少了可用性[GydF4y2Ba2GydF4y2Ba或土壤压实[GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba4GydF4y2Ba].即使在常见的环境中,oGydF4y2Ba2GydF4y2Ba由于代谢率的差异,组织之间存在梯度[GydF4y2Ba5GydF4y2Ba].虽然大多数陆生植物物种无法存活长期ØGydF4y2Ba2GydF4y2Ba缺氧时,一些植物已开发出有效的策略或增加OGydF4y2Ba2GydF4y2Ba交付给根或忍受新陈代谢的短期破坏和所产生的毒性[GydF4y2Ba6GydF4y2Ba].GydF4y2Ba
根缺氧通常改变植物水关系,可能导致威尔登[GydF4y2Ba7GydF4y2Ba,GydF4y2Ba8GydF4y2Ba].这种效果归因于根系结构的变化[GydF4y2Ba9GydF4y2Ba]抑制水上蛋白介导的根水运输,导致根液压导电性的降低[GydF4y2Ba10GydF4y2Ba,GydF4y2Ba11GydF4y2Ba].Aquaporins通过调节水流动阻力,在植物水关系中发挥着核心作用,这对于根的径向途径尤为重要[GydF4y2Ba9GydF4y2Ba].Aquaporin介导的和妊娠水运输彼此相互作用并调节植物水平[GydF4y2Ba7GydF4y2Ba,GydF4y2Ba12GydF4y2Ba].除了水,水通道蛋白还可以运输其他小分子,包括COGydF4y2Ba2GydF4y2Ba[GydF4y2Ba13GydF4y2Ba],NH.GydF4y2Ba3.GydF4y2Ba[GydF4y2Ba14GydF4y2Ba]和O.GydF4y2Ba2GydF4y2Ba[GydF4y2Ba15GydF4y2Ba].植物疗养蛋白在所有检查的物种中显示出超过30种不同同源物的多样性[GydF4y2Ba9GydF4y2Ba].在高等植物中,水通道蛋白已被描述为5个亚科,包括PIPs(质膜固有蛋白)、TIPs(液泡膜固有蛋白)、NIPs (nodulin 26样固有蛋白)、sip(小固有蛋白)和XIPs(未分类固有蛋白)。GydF4y2Ba
Aquaporins介绍响应环境因素的根液压调节[GydF4y2Ba16GydF4y2Ba].Aquaporin表达[GydF4y2Ba15GydF4y2Ba],膜贩运[GydF4y2Ba17GydF4y2Ba]和后期调节[GydF4y2Ba18GydF4y2Ba在应对环境压力时,调控细胞间水的运输。胞内酸中毒导致水通道蛋白关闭[GydF4y2Ba11GydF4y2Ba和能量剥夺[GydF4y2Ba19GydF4y2Ba也被认为是低氧根系吸水能力下降的原因之一。最近,一种依赖钾的OGydF4y2Ba2GydF4y2Ba提出了传感途径GydF4y2Ba拟南芥GydF4y2Ba,它可能调节水通道蛋白的活性[GydF4y2Ba20.GydF4y2Ba].虽然缺氧对根系水力传导能力的抑制是一种常见现象,但它与水分运输水通道蛋白的表达水平并没有明显的相关性,有报道称在缺氧的根系中编码不同PIP2水通道蛋白的基因表达水平会降低或增加[GydF4y2Ba7GydF4y2Ba,GydF4y2Ba21GydF4y2Ba].另一方面,据报道,辊隙和PIP1水通道蛋白的根缺氧的基因表达增加涉及乳酸的运输[GydF4y2Ba22GydF4y2Ba,GydF4y2Ba23GydF4y2Ba)有限公司GydF4y2Ba2GydF4y2Ba[GydF4y2Ba24GydF4y2Ba]和oGydF4y2Ba2GydF4y2Ba[GydF4y2Ba15GydF4y2Ba]在植物中,表明这些水蛋白在缺氧耐受性中可能的作用。GydF4y2Ba
低氧对一些植物根水运输的抑制效果可以通过根暴露于外源乙烯部分逆转[GydF4y2Ba19GydF4y2Ba].植物中的乙烯合成和积累可以通过各种生物和非生物应激诱导,包括干旱[GydF4y2Ba25GydF4y2Ba],[受伤GydF4y2Ba26GydF4y2Ba],和驱应力[GydF4y2Ba27GydF4y2Ba],并通过阳周期产生[GydF4y2Ba28GydF4y2Ba].乙烯的作用是由一组乙烯反应因子(ERFs)的下游转录活性介导的,这些因子在植物暴露于缺氧后会迅速上调[GydF4y2Ba29GydF4y2Ba].乙烯可以通过刺激不定根和通气组织的形成来提高植物的耐缺氧能力[GydF4y2Ba29GydF4y2Ba,GydF4y2Ba30.GydF4y2Ba,GydF4y2Ba31GydF4y2Ba],然而,只有少数研究都集中在乙烯和水通道蛋白介导的水输送之间的关系[GydF4y2Ba31GydF4y2Ba].据报道,水通道蛋白参与了由乙烯调控的葡萄浆果成熟和橡胶树乳胶产量[GydF4y2Ba32GydF4y2Ba,GydF4y2Ba33GydF4y2Ba],最近有报道称细胞内的水分运输GydF4y2Ba拟南芥GydF4y2Ba通过乙烯通过增强的C末端磷酸化而增加GydF4y2Ba在GydF4y2Bapip2; 1 [GydF4y2Ba29GydF4y2Ba].虽然这些发现提供了乙烯和水通道蛋白丰度之间的可能链接以及对水通道蛋白的后期调节,但仍然需要更多信息来综合理解通过乙烯调节的根水运输的过程。GydF4y2Ba
在本研究中,我们研究了根缺氧和外源乙烯应用对颤抖的ASPEN中的气体交换,水运输和ERF和Aquaporin基因的表达的影响(GydF4y2BaP.山杨GydF4y2Ba以进一步阐明OGydF4y2Ba2GydF4y2Ba缺乏和乙烯。假设乙烯在缺氧病症下对根液压的影响涉及变化水上蛋白基因表达。GydF4y2Ba
结果GydF4y2Ba
叶片气体交换和光反应GydF4y2Ba
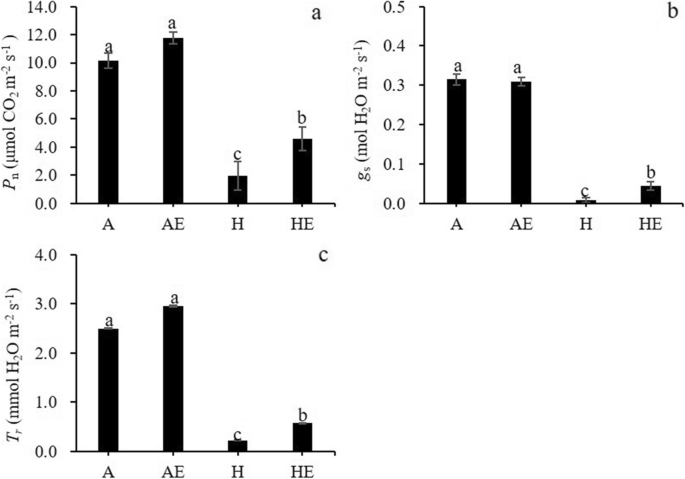
低氧处理显著降低叶片净光合速率(GydF4y2BaPGydF4y2BaNGydF4y2Ba),蒸腾率(GydF4y2BaTGydF4y2BaR.GydF4y2Ba)和气孔导度(GydF4y2BaGGydF4y2BaS.GydF4y2Ba) (桌子GydF4y2BaS1GydF4y2Ba;无花果。GydF4y2Ba1GydF4y2Ba).乙烯处理的植株表现出显著的高GydF4y2BaPGydF4y2BaNGydF4y2Ba,GydF4y2BaGGydF4y2BaS.GydF4y2Ba和GydF4y2BaTGydF4y2BaR.GydF4y2Ba与在缺氧条件下没有乙烯处理的植物相比,但不在曝气条件下(图。GydF4y2Ba1GydF4y2Ba).GydF4y2Ba
为了评估处理在不同光线条件下叶片气体交换的影响,我们确定了光反应GydF4y2BaPGydF4y2BaNGydF4y2Ba和GydF4y2BaGGydF4y2BaS.GydF4y2Ba.低氧处理显著降低了光饱和点(GydF4y2Ba我GydF4y2BamGydF4y2Ba)和水平GydF4y2BaPGydF4y2BaNGydF4y2Ba在光线饱和(GydF4y2BaPGydF4y2BamGydF4y2Ba) (桌子GydF4y2BaS1GydF4y2Ba;无花果。GydF4y2BaS1GydF4y2Baa).乙烯处理显著增加GydF4y2Ba我GydF4y2BamGydF4y2Ba但不是GydF4y2BaPGydF4y2BamGydF4y2Ba在缺氧植物中(表GydF4y2Ba1GydF4y2Ba).当暴露在缺氧环境下时,乙烯处理过的植物表现出明显的更高GydF4y2Ba我GydF4y2BamGydF4y2Ba与未暴露于乙烯的植物相比(表GydF4y2BaS1GydF4y2Ba).光反应GydF4y2BaGGydF4y2BaS.GydF4y2Ba显示,GydF4y2BaGGydF4y2BaS.GydF4y2Ba与曝气条件下增加光强度逐渐增加,但光强度对无影响GydF4y2BaGGydF4y2BaS.GydF4y2Ba在缺氧条件下(图。GydF4y2BaS1GydF4y2Bab)。GydF4y2Ba
根液压电导GydF4y2Ba
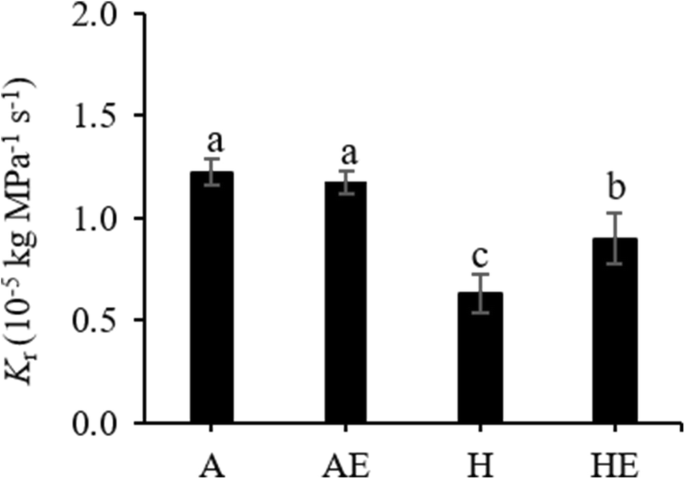
低氧导致根系水力导度急剧下降(GydF4y2BaKGydF4y2BaR.GydF4y2Ba) (桌子GydF4y2BaS1GydF4y2Ba;无花果。GydF4y2Ba2GydF4y2Ba).外源乙烯没有影响GydF4y2BaKGydF4y2BaR.GydF4y2Ba在充气植物中,但在经受缺氧的植物中,乙烯处理显着增加GydF4y2BaKGydF4y2BaR.GydF4y2Ba与未用乙烯处理的缺氧植物相比约20%(图。GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
mRNA表达分析GydF4y2Ba
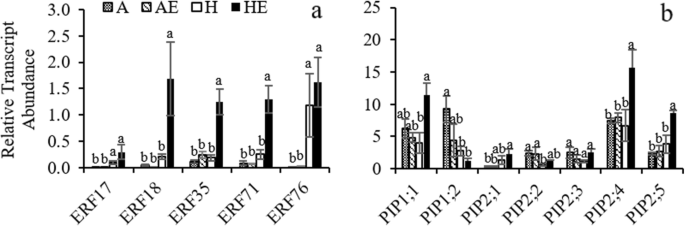
处理1周后,采用qRT-PCR方法进行mRNA表达分析。低氧处理显著影响五个乙烯响应因子的相对转录丰度(GydF4y2BaERF.GydF4y2Ba) (桌子GydF4y2BaS1GydF4y2Ba).检测到乙烯的显着效果GydF4y2BaERF35.GydF4y2Ba和GydF4y2BaERF71GydF4y2Ba,在这两个基因中也检测到缺氧和乙烯处理之间的相互作用(表1)GydF4y2BaS1GydF4y2Ba).乙烯处理显著增加了相对转录丰度GydF4y2BaERF18,ERF35GydF4y2Ba和GydF4y2BaERF71GydF4y2Ba在缺氧条件下,但在曝气条件下则不行(图。GydF4y2Ba3.GydF4y2Baa).相比之下,相对转录本丰度GydF4y2BaERF17GydF4y2Ba和GydF4y2BaERF76GydF4y2Ba与曝气良好的植物相比,低氧植物的叶绿素含量显著升高,但与暴露在低氧和乙烯处理下的植物相比没有变化(图2)。GydF4y2Ba3.GydF4y2Ba一种)。GydF4y2Ba
考虑GydF4y2Ba皮普GydF4y2BaS表达水平,缺氧显著降低GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba2GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba2GydF4y2Ba,但显着增加了相对记录丰度GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba1GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba(表GydF4y2BaS1GydF4y2Ba;无花果。GydF4y2Ba3.GydF4y2Bab).乙烯处理的植株表现出显著升高GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba1GydF4y2Ba,GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba转录物与暴露于缺氧根未处理的植物相比较,但不通气的条件下(表GydF4y2BaS1GydF4y2Ba;无花果。GydF4y2Ba3.GydF4y2Baa、b)。GydF4y2Ba
Immunodetection盈利的GydF4y2Ba
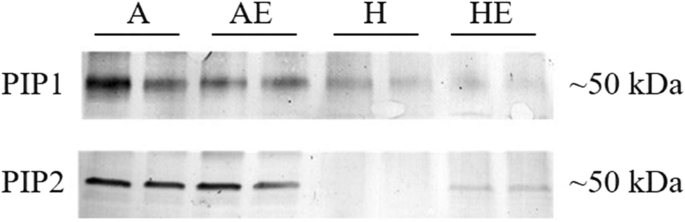
对PIP1和PIP2抗体用于以下SDS-PAGE的PIP的免疫检测。我mmunoreactive bands at ~ 50 kDa were detected (Fig.4GydF4y2Ba;无花果。GydF4y2BaS4GydF4y2Ba).与良好的处理相比,缺氧植物的根部染色的免疫反应带的染色强度较弱。在缺氧下,用抗PIP2抗体检测的免疫反应带显示用乙烯处理的根部的强度增加,但没有检测到乙烯对PIP1的影响(图。GydF4y2Ba4GydF4y2Ba;无花果。GydF4y2BaS4GydF4y2Ba).GydF4y2Ba
质膜固有蛋白的Western-blot分析(GydF4y2Ba皮普GydF4y2Bas)在充气颤抖的白杨(GydF4y2BaP.山杨GydF4y2Ba(A)、曝气良好的乙烯处理植物(AE)、缺氧处理植物(H)和缺氧和乙烯处理植物(HE) 1周。图中显示了每个处理的两个独立的生物重复的结果。抗体GydF4y2Ba玉米GydF4y2Ba免疫检测采用PIP1和PIP2。全长印迹见于补充图。GydF4y2BaS4GydF4y2Ba
讨论GydF4y2Ba
结果表明,外源乙烯在一定程度上缓解了缺氧对根系水力导度和叶片气体交换的影响。乙烯对GydF4y2Ba皮普GydF4y2Ba在缺氧条件下的转录物简谱和蛋白质丰度与根液压传导和叶片蒸腾率的变化平行,表明水上蛋白介导的水运输是乙烯作用的可能靶标。GydF4y2Ba
根尖缺氧导致根尖血氧含量急剧下降GydF4y2BaKGydF4y2BaR.GydF4y2Ba在发抖白杨植物。根水运的O-下的降低GydF4y2Ba2GydF4y2Ba据报不同种类的植物均有缺乏症[GydF4y2Ba11GydF4y2Ba].低氧条件下水分摄取减少可归因于水通道蛋白介导的水运输受损[GydF4y2Ba8GydF4y2Ba].OGydF4y2Ba2GydF4y2Ba缺乏导致从有氧呼吸过渡到发酵引发能量危机并引起细胞酸中的,除了降低蛋白质合成和磷酸化之外,抑制水蛋白栅格[GydF4y2Ba10GydF4y2Ba,GydF4y2Ba11GydF4y2Ba]及跨膜水运输[GydF4y2Ba34GydF4y2Ba].GydF4y2Ba
与早期研究相似[GydF4y2Ba19GydF4y2Ba],在根缺氧下用外源乙烯处理的颤抖的白杨植物显着提高GydF4y2BaKGydF4y2BaR.GydF4y2Ba与没有接受乙烯处理厂相比。在本研究中,根缺氧和乙烯对效果GydF4y2BaKGydF4y2BaR.GydF4y2Ba与Aquaporin丰富的变化有关。几个相对记录性丰度GydF4y2Ba皮普GydF4y2BaS对缺氧和乙烯处理的反应不同。作为关于水蛋白的有限信息GydF4y2BaPopulus Temuloides.GydF4y2Ba,只有几个GydF4y2BaPIP1GydF4y2Ba沙GydF4y2BaPIP2GydF4y2Ba在我们的研究中研究了。这两个GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba2GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba2GydF4y2Ba转录本下调GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba1GydF4y2Ba和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba转录物被缺氧略微上调。基因表达GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba1GydF4y2Ba,GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba,GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba不显着地由缺氧治疗改变的,而是通过在缺氧条件下的乙烯处理,得到显著上调。Western印迹分析确认了缺氧降低两者PIP1s和PIP2s的总蛋白丰度,但乙烯 - 处理的植物显示出更高的表达PIP2s比未接受外源乙烯植物。在先前的研究中,GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba在落叶伴随恢复后显示出醒目的上调GydF4y2BalGydF4y2Ba公关GydF4y2Ba在GydF4y2BaP.山杨GydF4y2Ba证明这个水素在水上运输中起着重要作用[GydF4y2Ba35GydF4y2Ba].还应该指出的是GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba已被证明是杨树中的主要根源蛋白GydF4y2BaP.欧洲山杨GydF4y2Ba×GydF4y2Ba美洲山杨GydF4y2Ba[GydF4y2Ba36GydF4y2Ba] 和GydF4y2Bap . trichocarpaGydF4y2Ba×GydF4y2Ba摘要GydF4y2Ba[GydF4y2Ba37GydF4y2Ba时,渗透率系数较高GydF4y2Ba非洲爪蟾GydF4y2Ba卵母细胞,指向我们研究中乙烯增强表达的功能意义。GydF4y2Ba
乙烯处理增加了表达丰度GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba1GydF4y2Ba,GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4和pip2.GydF4y2Ba;GydF4y2Ba5GydF4y2Ba,蛋白质免疫检测结果仅显示缺氧下的PIP2S的总体强度,表明PIP2可能是乙烯的主要目标。早期的研究表明,乙烯诱导表达GydF4y2Bapip2; 1GydF4y2Ba在GydF4y2BaHevea Brasiliensis.GydF4y2Ba[GydF4y2Ba28GydF4y2Ba],抑制GydF4y2Bapip2; 1GydF4y2Ba表达GydF4y2BaRosa HybridaGydF4y2Ba[GydF4y2Ba32GydF4y2Ba,GydF4y2Ba38GydF4y2Ba].乙烯也可以影响植物的水通道蛋白的转录后调控。据报道,乙烯增加的C末端磷酸化GydF4y2Ba拟南芥GydF4y2BaPIP2; 1蛋白和促进的细胞水运输率[GydF4y2Ba29GydF4y2Ba].鉴于水通道蛋白调节根系水分运输[GydF4y2Ba39GydF4y2Ba], PIP2s是参与水运输的主要水通道蛋白[GydF4y2Ba40.GydF4y2Ba[PIP2的丰度的增加可能在通过乙烯的根液压改善中发挥重要作用。然而,PIP2的丰度的增加也可能影响其他分子的运输,从而不应排除改变对缺氧的反应,因为一些水蛋白也参与了乳酸的运输[GydF4y2Ba23GydF4y2Ba],O.GydF4y2Ba2GydF4y2Ba[GydF4y2Ba15GydF4y2Ba]和co.GydF4y2Ba2GydF4y2Ba[GydF4y2Ba24GydF4y2Ba].GydF4y2Ba
在我们的研究中,根系缺氧导致的上调GydF4y2BaERF.GydF4y2BaS转录本在低氧根中的丰度,表明低氧条件下根中乙烯水平可能增加[GydF4y2Ba41.GydF4y2Ba].然而,我们观察到内源性乙烯合成相关基因的转录丰度没有变化,包括GydF4y2BaACS1GydF4y2Ba,GydF4y2BaACS2GydF4y2Ba和GydF4y2BaACO1GydF4y2Ba,由缺氧和外源乙烯(图。GydF4y2BaS5GydF4y2Ba).据报道,乙烯在植物组织中被停滞的水捕获是其在根中积累的主要因素[GydF4y2Ba30.GydF4y2Ba],这可能部分解释了上调GydF4y2BaERF.GydF4y2Ba即使在没有增加乙烯合成的情况下,低氧也能抑制S。在缺氧条件下,外源乙烯处理增加GydF4y2BaERF18.GydF4y2Ba,GydF4y2BaERF35.GydF4y2Ba和GydF4y2BaERF71GydF4y2Ba转录物丰度与非乙烯处理相比,表明外源性乙烯处理引起了颤动的白杨根的加速乙烯积累。因此,与非乙烯处理的植物相比,通过增加PIP2 Aquaporins的转录物丰度和增强根液压系统来促进具有外源乙烯处理的乙烯积累的增加的乙烯积累。相比之下,乙烯处理没有改变表达水平GydF4y2BaERF.GydF4y2Ba这可能是由于在水培过程中气泵排出溶解的乙烯所致。另一方面,植物中乙烯的生物合成需要游离OGydF4y2Ba2GydF4y2Ba作为基质[GydF4y2Ba28GydF4y2Ba]这可以解释缺氧和乙烯处理之间观察到的相互作用GydF4y2BaERF35.GydF4y2Ba和GydF4y2BaERF71GydF4y2Ba水平。GydF4y2Ba
在本研究中,乙烯处理在缺氧条件下增强了颤抖的白杨幼苗的气体交换参数。对根缺氧的光合反应在植物物种之间不同,并且通常用作缺氧耐受的指标。在缺氧敏感玉米中,净光合作用响应洪水逐渐减少[GydF4y2Ba29GydF4y2Ba,但在耐缺氧物种中几乎保持不变GydF4y2BaMelaleuca cajuputi.GydF4y2Ba[GydF4y2Ba42.GydF4y2Ba].除形成不定根和通气组织外,还可增加OGydF4y2Ba2GydF4y2Ba对于根来说,造成这种遗传多样性的耐受机制仍然知之甚少[GydF4y2Ba43.GydF4y2Ba].在本研究中,GydF4y2BaPGydF4y2BaNGydF4y2Ba,GydF4y2BaGGydF4y2BaS.GydF4y2Ba和GydF4y2BaTGydF4y2BaR.GydF4y2Ba颤抖的白杨表现出对根缺氧的响应急剧下降。然而,乙烯治疗显着增加GydF4y2BaPGydF4y2BaNGydF4y2Ba,GydF4y2BaGGydF4y2BaS.GydF4y2Ba和GydF4y2BaTGydF4y2BaR.GydF4y2Ba在缺氧条件下,根的孔隙度保持不变。众所周知,根水力学在限制水分输送到叶子方面起着重要作用,并与气体交换紧密相连[GydF4y2Ba35GydF4y2Ba,GydF4y2Ba44.GydF4y2Ba].水通道蛋白在根和叶水力学的调节和同步中是必不可少的。部分落叶颤杨表明,在不同时间、不同落叶程度下,根导水率和叶片蒸腾速率的变化伴随着根和叶片中PIP表达的主要动态变化[GydF4y2Ba35GydF4y2Ba].在我们的研究中,由于乙烯处理提高了低氧植物的根水力导度,因此可以合理地假设,通过改变pip的表达来改善水通道蛋白介导的根水力,可能是增加气体交换的一个贡献者。此外,低氧治疗减少GydF4y2BaPGydF4y2BamGydF4y2Ba在颤抖的白杨中,与以前的洪水相似GydF4y2BaGenipa美国GydF4y2Ba苗(GydF4y2Ba45.GydF4y2Ba].然而,乙烯处理显著增加GydF4y2Ba我GydF4y2BamGydF4y2Ba在缺氧植物中,不受影响GydF4y2BaPGydF4y2BamGydF4y2Ba.通常据报道,植物中光饱和点的变化是由于电子传输饱和度,并被叶绿素荧光参数的变化反射[GydF4y2Ba45.GydF4y2Ba].在我们的研究中,检测到的乙烯叶绿素荧光没有影响(数据未示出)。此外,hypoxiatreatment也大大阻碍了GydF4y2BaGGydF4y2BaS.GydF4y2Ba对光线的反应。综上所述,这些结果表明,低氧植物对乙烯光合响应的主要因素是气孔限制,因为叶片水分输送减少。GydF4y2Ba
结论GydF4y2Ba
总之,我们的研究表明,在根缺氧条件下,用外源性乙烯处理水素丰富,根液压和叶片气体交换。结果指出了Aquaporin基因表达,包括GydF4y2Bapip2; 4GydF4y2Ba和GydF4y2Bapip2; 5GydF4y2Ba在低氧条件下,乙烯是颤杨中乙烯作用的目标之一,它增强了水通道蛋白介导的根水运输,进而促进叶气交换。GydF4y2Ba
方法GydF4y2Ba
生长条件和缺氧处理GydF4y2Ba
颤抖的白杨(GydF4y2BaPopulus Temuloides.GydF4y2Ba金樱子。)种子收集和王文清张博士(再生资源,阿尔伯塔大学系)从北萨斯喀彻温河流域(埃德蒙顿,加拿大)标识。授权是不是在这方面需要的种子收集。Seeds were sterilized twice with 1 % (v/v) sodium hypochlorite and germinated in horticultural soil in a controlled growth room with 18 h photoperiod, 22/18O.GydF4y2BaC(昼/夜)温度,400µmol mGydF4y2Ba−2GydF4y2BaS.GydF4y2Ba−1GydF4y2Baphotosynthetic photon flux density and 50 % relative humidity. When five-weeks old, the plants were removed from pots and after rinsing the roots free of soil, they were transferred to 40 L polyethylene containers (60 × 40 × 20 cm) filled with a quarter-strength aerated modified Hoagland’s solution [46.GydF4y2Ba].将24株移栽至1 L的琥珀塑料瓶中。在这些工厂中,随机选取12个进行曝气处理,用气泵冲洗烧瓶中的溶液,以保持溶解的OGydF4y2Ba2GydF4y2Ba浓度约为7.5 mg LGydF4y2Ba−1GydF4y2Ba在整个实验过程。其余12株植物经氮冲水缺氧处理GydF4y2Ba2GydF4y2Ba气体(Praxair, Danbury, CT, USA)通过溶液30分钟,直到达到OGydF4y2Ba2GydF4y2Ba的2毫克的L电平GydF4y2Ba−1GydF4y2Ba.当期望的OGydF4y2Ba2GydF4y2Ba浓度达到后,将植株留在停滞溶液中一个星期。溶解OGydF4y2Ba2GydF4y2Ba在YSI-5000 O的实验过程中监测GydF4y2Ba2GydF4y2Ba电极(YSI公司,Yellow Springs, OH, USA),并在停滞溶液中下降到小于1 mg LGydF4y2Ba−1GydF4y2Ba在一个星期的治疗期间(图。GydF4y2BaS6GydF4y2Ba).所有的植物测量和样品采集都在处理的第7天进行。GydF4y2Ba
乙烯处理GydF4y2Ba
一半的植物经曝气控制及缺氧处理(GydF4y2BaNGydF4y2Ba = 6, respectively) were treated with exogenous ethylene at the beginning of the treatments. Ethylene was supplied to the hydroponic solution from the compressed gas cylinder through a tube stretched to the bottom of plastic bottles [19GydF4y2Ba].用顶空分析方法在乙烯处理的发作时测定溶解的乙烯浓度[GydF4y2Ba47.GydF4y2Ba].简而言之,将5ml水培溶液样品收集到气密空气中。通过用n替换水来制备顶部空间(10%)GydF4y2Ba2GydF4y2Ba,并且真空素在1,400 rpm摇动5分钟。从顶部空间,收集100μl气体样品并注射到瓦尔安430-GC气相色谱仪(Varian,Palo Alto,CA,USA)中,配备有HP Plot-Q柱(30米×0.53mm×40μm,安捷伦,圣克拉拉,加州,美国)。基于亨利的法律计算溶解乙烯的浓度,恒定的4.9×10GydF4y2Ba−3GydF4y2Ba米自动取款机GydF4y2Ba−1GydF4y2Ba用过[GydF4y2Ba47.GydF4y2Ba,GydF4y2Ba48.GydF4y2Ba].乙烯处理后平均溶解乙烯浓度为3.85 mmol LGydF4y2Ba−1GydF4y2Ba.GydF4y2Ba
叶煤气交换GydF4y2Ba
9:00 ~ 12:00,每处理6株,每株随机抽取1片完全伸长的叶片,测定净光合速率(GydF4y2BaPGydF4y2BaNGydF4y2Ba),气孔电导(GydF4y2BaGGydF4y2BaS.GydF4y2Ba)及蒸腾速率(GydF4y2BaTGydF4y2BaR.GydF4y2Ba)using a LI-6400XT Portable Photosynthesis System with a 2 × 3 cm2GydF4y2Ba红 - 蓝光腔室(LI-COR,林肯,NE,USA)。参考COGydF4y2Ba2GydF4y2Ba浓度设为400µmol molGydF4y2Ba−1GydF4y2Ba;流速为200µmol sGydF4y2Ba−1GydF4y2Ba.将叶室温度保持在20℃,PPFd为400μmolmGydF4y2Ba−2GydF4y2BaS.GydF4y2Ba−1GydF4y2Ba红蓝光谱研究不同光照条件下不同处理对叶片气体交换的影响GydF4y2BaPGydF4y2BaNGydF4y2Ba和GydF4y2BaGGydF4y2BaS.GydF4y2Ba通过设定启动光合光子通量密度为1500 mol mGydF4y2Ba−2GydF4y2BaS.GydF4y2Ba−1GydF4y2Ba分别为1200、1000、800、500、300、200、100、50、20和0µmol mGydF4y2Ba−2GydF4y2BaS.GydF4y2Ba−1GydF4y2Ba.参数进行自动登录时GydF4y2BaPGydF4y2BaNGydF4y2Ba达到稳定状态。光饱和GydF4y2BaPGydF4y2BaNGydF4y2Ba(GydF4y2BaPGydF4y2BamGydF4y2Ba)光饱和点(GydF4y2Ba我GydF4y2BamGydF4y2Ba),将数据拟合到修正的矩形夸张模型[GydF4y2Ba49.GydF4y2Ba].GydF4y2Ba
根液压电导GydF4y2Ba
根导水率(GydF4y2BaKGydF4y2BaR.GydF4y2Ba)用高压流量计(HPFM, Dynamax Incorporated, Houston, TX, USA)测量。在测量六种植物在每个处理期间,根保持在各自的处理溶液中。通过对根施加递增压力,得到供油压力与流量之间的线性回归,计算斜率为GydF4y2BaKGydF4y2BaR.GydF4y2Ba[GydF4y2Ba50.GydF4y2Ba].GydF4y2Ba
mRNA表达分析GydF4y2Ba
从每个处理四到六个植物的治疗,初生根的一周(3-5厘米长的远端根段)被转移到-80前收集并保存在液氮中后GydF4y2BaO.GydF4y2BaC冰箱。将样品用砂浆和液氮研磨物研磨。用植物RNEasy提取试剂盒(Qiagen,Valencia,CA,USA)提取总RNA。使用逆转录试剂盒(QIAGEN)从1μg总RNA合成第一链CDNA。使用定量RT-PCR分析RNA表达使用GydF4y2BaJIP1GydF4y2Ba(AJ407583.1)和GydF4y2BaACTIN1GydF4y2Ba(Potri.001G309500)作为内参基因,在所有测试样本中均无显著变化(GydF4y2BaPGydF4y2Ba= 0.36)。转录丰度GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba1GydF4y2Ba(AJ849323.1),GydF4y2BaPIP1GydF4y2Ba;GydF4y2Ba2GydF4y2Ba(AJ849322.1),GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba1GydF4y2Ba(AJ849324.1),GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba2GydF4y2Ba(AJ849325.1),GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba3.GydF4y2Ba(AJ849326.1),GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba4GydF4y2Ba(AJ849327.1)和GydF4y2BaPIP2GydF4y2Ba;GydF4y2Ba5GydF4y2Ba(AJ849328.1)进行了测定。这些画中画已被证明是功能性和杨树植物应激反应[GydF4y2Ba35GydF4y2Ba].五个乙烯响应因子(ERF)的转录性丰度,GydF4y2BaERF17GydF4y2Ba,GydF4y2BaERF18.GydF4y2Ba,GydF4y2BaERF35.GydF4y2Ba,GydF4y2BaERF71GydF4y2Ba和GydF4y2BaERF76GydF4y2Ba据报道,由于这些基因被乙烯诱导了这些基因GydF4y2BaP.欧洲山杨GydF4y2Ba×GydF4y2Ba美洲山杨GydF4y2Ba[GydF4y2Ba41.GydF4y2Ba].相对转录物丰用的是2计算GydF4y2Ba−∆CtGydF4y2Ba方法。颤抖的白杨的底漆GydF4y2Ba皮普GydF4y2BaS [GydF4y2Ba35GydF4y2Ba] 和GydF4y2BaERF.GydF4y2BaS [GydF4y2Ba41.GydF4y2Ba]的设计参考了相应的参考文献(表GydF4y2BaS2GydF4y2Ba).GydF4y2Ba
SDS-PAGE和免疫印迹GydF4y2Ba
进行SDS凝胶电泳,以在治疗一周后从根系中分离蛋白质(10μg)。通过在100V下电荷以100V转移到PVDF膜(Bio-rad,Hercules,CA,USA)中转移到PVDF膜(Bio-rad,Hercules,Ca)中。将膜在TBST缓冲液中(20mM Tris pH 7.5,150mM NaCl和0.1%吐温20)中的1%BSA封闭3小时,然后与抗pip1(1:500)或-pip2(1:1000)温育(1:1000)初级抗体过夜4GydF4y2BaO.GydF4y2BaC.抗PIP1抗体(R-4445)从ZMPIP1施加氨基肽; 5,抗PIP2抗体(R-2493)从ZMPIP2施加氨基肽; 4并显示识别PIP1S和玉米和玉米的pip2sGydF4y2BaLarix LaricinaGydF4y2Ba(由F. Chaumont博士提供)[GydF4y2Ba51.GydF4y2Ba,GydF4y2Ba52.GydF4y2Ba].在兔体内培养抗玉米的PIP抗体(GydF4y2Ba玉米GydF4y2Bapip值。用TBST冲洗膜5次,5分钟,然后在GAR IgG抗体(1:2000)(Sigma-Aldrich, Oakville, ON, Canada)中室温孵育1小时。用TBST冲洗膜5次,5 min后偶联碱性磷酸酶(Bio-Rad)检测信号。GydF4y2Ba
统计分析GydF4y2Ba
的装置和充气植物(A)与乙烯(AE)处理充气植物,植物缺氧(H),并用乙烯处理缺氧植物的标准误差(HE)计算各测量参数。双因素ANOVA用于检查曝气的效果(相对于充气缺氧处理)和乙烯治疗(有或没有乙烯)。不符合分配和方差齐性正常的ANOVA假设该数据与平方根函数转化。Comparisons between different treatment means were conducted using LSD test (α = 0.05).
可用性数据和材料GydF4y2Ba
本研究过程中生成或分析的数据集可由通讯作者根据合理要求提供。GydF4y2Ba
缩写GydF4y2Ba
- 答:GydF4y2Ba
-
气化植物。GydF4y2Ba
- AE:GydF4y2Ba
-
用乙烯处理的曝气植物。GydF4y2Ba
- 小块土地:GydF4y2Ba
-
乙烯反应因子。GydF4y2Ba
- GGydF4y2BaS.GydF4y2Ba:GydF4y2Ba
-
气孔电导。GydF4y2Ba
- H:GydF4y2Ba
-
缺氧植物。GydF4y2Ba
- 他:GydF4y2Ba
-
用乙烯处理低氧植物。GydF4y2Ba
- 我GydF4y2BamGydF4y2Ba:GydF4y2Ba
-
光饱和点。GydF4y2Ba
- KGydF4y2BaR.GydF4y2Ba:GydF4y2Ba
-
根系导。GydF4y2Ba
- 皮普:GydF4y2Ba
-
质膜蛋白质。GydF4y2Ba
- PGydF4y2BamGydF4y2Ba:GydF4y2Ba
-
光饱和净光合率。GydF4y2Ba
- PGydF4y2BaNGydF4y2Ba:GydF4y2Ba
-
净光合速率。GydF4y2Ba
- TGydF4y2BaR.GydF4y2Ba:GydF4y2Ba
-
蒸腾速率。GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
范东恩,李志强。氧敏感信号的研究。植物学报。2015;66:345-67。GydF4y2Ba
- 2.GydF4y2Ba
陈志强,陈志强,陈志强,等。小麦耐水淹机理的研究进展。植物细胞环境。2016;39:1068 - 1086。GydF4y2Ba
- 3.GydF4y2Ba
carvo - polanco M, Zwiazek JJ, Voicu MC.外生菌根对美洲榆树(GydF4y2BaUlmusamericanaGydF4y2Ba)幼苗以盐碱化和土壤压实。土壤植物。2008;308:189 - 200。GydF4y2Ba
- 4.GydF4y2Ba
Pandey BK, Huang G, Bhosale R, Hartman S, Sturrock CJ, Jose L, Martin OC, Karady M, Voesenek LACJ, Ljung K.植物根系通过限制乙烯扩散感受土壤压实。科学。2021;371:276 - 280。GydF4y2Ba
- 5。GydF4y2Ba
Whipple C.定义植物生殖系列 - 性质或培养?科学。2012;337:301-302。GydF4y2Ba
- 6。GydF4y2Ba
张志强,张志强。洪水的适应性研究进展。水土保持学报。新植醇。2015;206:57 - 73。GydF4y2Ba
- 7。GydF4y2Ba
刘敏,谭旭,孙旭,Zwiazek JJ。油菜根系水分运输特性(GydF4y2Ba芸苔属植物显著GydF4y2Ba)在苗期、开花期和结荚期遭受涝渍。土壤植物。2020;454:431 - 445。GydF4y2Ba
- 8。GydF4y2Ba
Tan X,Xu H,Khan S,Equiza Ma,Lee Sh,Vaziriyeganeh M,Zwiazek JJ。植物水运输和水通道蛋白在氧气剥夺的环境中。J植物理性。2018;227:20-30。GydF4y2Ba
- 9。GydF4y2Ba
Maurel C,Nacry P. Root Architecture和液压系统会聚,以便适应改变水可用性。自然植物。2020;6:744-749。GydF4y2Ba
- 10.GydF4y2Ba
王玉兰,王玉兰,王玉兰,王玉兰。植物水通道蛋白闸门的结构机理研究。大自然。2006;439:688 - 694。GydF4y2Ba
- 11.GydF4y2Ba
Tournaire-Roux C,Sutka M,Javot H,Gout E,Gerbeau P,Luu D-T,Bligny R,Maurel C.细胞溶质pH通过水蛋白的浇注调节缺氧胁迫期间的根水运输。自然。2003;425:393。GydF4y2Ba
- 12.GydF4y2Ba
王鹏,王志强,王志强,等。细胞壁扩散屏障完整性监测调节植物中的水分和溶质运输。Sci众议员2019;9:4227。GydF4y2Ba
- 13.GydF4y2Ba
Navarro-RoDenas A, Xu H, Kemppainen M, Pardo AG, Zwiazek JJ。GydF4y2BaLaccaria bicolor.GydF4y2BaAquaporin LBAQP1是颤抖的白杨中的Hartig Net开发所必需的(GydF4y2BaPopulus Temuloides.GydF4y2Ba).植物细胞环境。2015;38:2475-2486。GydF4y2Ba
- 14。GydF4y2Ba
Jahn TP, Møller ALB, Zeuthen T, Holm LM, k ærke DA, Mohsin B, Kühlbrandt W, Schjoerring JK。水通道蛋白同源物在植物和哺乳动物运输氨。2月。2004;574:31-36。GydF4y2Ba
- 15.GydF4y2Ba
Zwiazek JJ,徐辉,陈X,纳瓦罗罗德纳斯A,通过水通道蛋白运输氧的莫提A.意义。SCI REP。2017;7:40411。GydF4y2Ba
- 16。GydF4y2Ba
Maurel C,Boursiac Y,Luu D-T,Santoni V,Shahzad Z,Verdoucq L.植物中的Aquaporins。Physiol Rev. 2015;95:1321-1358。GydF4y2Ba
- 17。GydF4y2Ba
Maurel C,Verdoucq L,Luu Dt,Santoni V.植物水疗法:膜通道,具有多种集成功能。Annu Rev植物Biol。2008;59:595-624。GydF4y2Ba
- 18。GydF4y2Ba
Hachez C, Veljanovski V, Reinhardt H, Guillaumot D, Vanhee C, Chaumont F, Batoko HGydF4y2Ba拟南芥GydF4y2Ba非生物胁迫诱导的TSPO相关蛋白减少了水蛋白皮22的细胞表面表达; 7通过蛋白质 - 蛋白质相互作用和自噬降解。植物细胞。2014;26:4974-4990。GydF4y2Ba
- 19。GydF4y2Ba
Kamaluddin M,Zwiazek JJ。乙烯增强了缺氧白杨中的水运输。植物理性。2002;128:962-969。GydF4y2Ba
- 20.GydF4y2Ba
Shahzad Z,Canut M,Tournaire-Roux C,Martiniere A,Boursiac Y,扬声器O,Maurel C.一种依赖性氧气传感途径调节植物根液压。细胞。2016;167:87-98 E14。GydF4y2Ba
- 21.GydF4y2Ba
Kadam S, Abril A, Dhanapal AP, Koester RP, Vermerris W, Jose S, Fritschi FB。高粱水通道蛋白基因的特性及调控[GydF4y2Ba高粱双色GydF4y2Ba(l)对内涝胁迫的反应。植物学报2017;8:862。GydF4y2Ba
- 22.GydF4y2Ba
Liu F,Vantoai T,Moy LP,Bock G,Linford LD,Quackenbush J.全球转录分析揭示了缺氧反应的全面洞察GydF4y2Ba拟南芥GydF4y2Ba.植物理性。2005;137:1115年至1129年GydF4y2Ba
- 23.GydF4y2Ba
Choi W-G,Roberts DM。GydF4y2Ba拟南芥GydF4y2Banip2;1,通过缺氧胁迫诱导的乳酸的主要内在蛋白质转运蛋白。J Biol Chem。2007;282:24209-24218。GydF4y2Ba
- 24.GydF4y2Ba
uehlein n,sperling h,heckwolf m,Kaldenhoff R.的GydF4y2Ba拟南芥GydF4y2Baapapaporin pip1; 2规则蜂窝coGydF4y2Ba2GydF4y2Ba吸收。植物学报。2012;35:1077 - 1083。GydF4y2Ba
- 25.GydF4y2Ba
Sobeih Wy,Dodd Ic,Bacon Ma,Grierson D,Davies WJ。在番茄中调节气孔电导和叶生长的长距离信号(GydF4y2BaLycopersicon esculentumGydF4y2Ba)经受部分根区干燥的植物。J Exp Bot。2004;55:2353-2363。GydF4y2Ba
- 26。GydF4y2Ba
remond P, Weber H, Damond M, Farmer EE。机械伤害和昆虫捕食反应的差异基因表达GydF4y2Ba拟南芥GydF4y2Ba.植物细胞2000;12:707 - 719GydF4y2Ba
- 27。GydF4y2Ba
Sasidharan R,Hartman S,Liu Z,Martopawiro S,Sajeev N,Van Veen H,Yeung E,Voesenek Lacj。洪水应力期间的信号动态和交互。植物理性。2018; 176:1106-17。GydF4y2Ba
- 28。GydF4y2Ba
杨SF,霍夫曼网站。乙烯生物合成及其在高等植物中的调控。Annu Rev植物理性。1984年;35:155-189。GydF4y2Ba
- 29。GydF4y2Ba
wang WS, Yang Z, Li M, wang WS, Guo G, Liu S, Guo H, Li N. Quantitative and functional phospproteomomation analysis reveals ethylene regulates water transport by C-terminal phosphorylation of aquaporin PIP2;1GydF4y2Ba拟南芥GydF4y2Ba.摩尔。2016;9:158 - 174。GydF4y2Ba
- 30.GydF4y2Ba
Sasidharan R, Voesenek LA。乙烯介导的对淹水胁迫的适应。植物杂志。2015;169:3-12。GydF4y2Ba
- 31.GydF4y2Ba
乙烯敏感性和相对空气湿度对番茄根系水力特性的影响。足底。2017;246:987 - 97。GydF4y2Ba
- 32.GydF4y2Ba
Tungngoen K,Kongsawadworakul P,Viboonjun U,Katsuhara男,布鲁内尔N,萨克尔S,NarangajavanaĴ,HbPIP2的Chrestin H.参与; 1和HbTIP1; 1水通道蛋白在胶乳产率的乙烯通过刺激内LIBER和胶乳之间交换水调节细胞橡胶树。植物理性。2009; 151:843-56。GydF4y2Ba
- 33.GydF4y2Ba
Chervin C, Tira‐umphon A, Terrier N, Zouine M, Severac D, Roustan JP。在成熟阶段,乙烯对葡萄浆果膨胀的刺激和对相关基因转录本的影响。杂志Plantrum。2008;134:534-46。GydF4y2Ba
- 34.GydF4y2Ba
Alleva K,Niemietz CM,Sutka M,Maurel C,Parisi M,Tyerman SD,Amodeo G.β寻呼储存根的血浆膜显示通过细胞质pH调节的高水位沟道活性和双范围的钙浓度。J Exp Bot。2006; 57:609-21。GydF4y2Ba
- 35.GydF4y2Ba
刘杰,马奎扎,纳瓦罗-罗德纳斯,李绍华,Zwiazek JJ。aspen (GydF4y2BaPopulus Temuloides.GydF4y2Ba)落叶后的幼苗涉及根和叶水通道蛋白。足底。2014;240:553 - 64。GydF4y2Ba
- 36.GydF4y2Ba
Marjanoviććž,uehlein n,kaldenhoff r,zwiazek jj,weißm,hampp r,Nehls U.在杨树中的Aquaporins:Symbiont的差异是什么差异!Planta。2005; 222:258-68。GydF4y2Ba
- 37.GydF4y2Ba
Almeida Rodriguez AM, Cooke JEK, Yeh F, Zwiazek JJ。干旱响应水通道蛋白的功能特征GydF4y2BaPopulus BalsamiferaGydF4y2Ba和GydF4y2Ba杨树simoniiGydF4y2Ba×GydF4y2BabalsamiferaGydF4y2Ba具有不同抗旱策略的无性系。杂志Plantrum。2010;140:321-33。GydF4y2Ba
- 38.GydF4y2Ba
马N,薛Ĵ,李Y,刘X,戴女,贾W,罗Y,高J. Rh的PIP2; 1,玫瑰水通道蛋白基因,参与乙烯调节花瓣扩张。植物理性。2008; 148:894-907。GydF4y2Ba
- 39。GydF4y2Ba
Javot H, Lauvergeat V, Santoni V, Martin-Laurent F, Guclu J, Vinh J, Heyes J, Franck KI, Schaffner AR, Bouchez D et al.;单一水通道蛋白亚型在根系吸水中的作用。植物细胞。2003;15:509-22。GydF4y2Ba
- 40。GydF4y2Ba
Li D, rux, Zhang J, Wu Y, Wang X, Li X. Cotton plasma membrane intrinsic protein 2s (PIP2s) are selective interaction to regulate their water channel activities and its required for fibre development. acta physica sinica(物理学报),2017,37(6):758 - 763。新植醇。2013;199.3:695 - 707。GydF4y2Ba
- 41。GydF4y2Ba
VahaLa J,Felten J,Love J,GorzsásA,Gerber L,LamminmäkiA,KangasjärviJ,Sundberg B.杂交类乙烯响应因子(ERF)中的一种基因组型筛网在杂交Aspen茎中识别GydF4y2BaERF.GydF4y2Ba改性茎生长和木质性质的基因。新植物。2013; 200:511-22。GydF4y2Ba
- 42.GydF4y2Ba
Kogawara S,Yamanoshita T,Norisada M,Masumori M,Kojima K.光合作用和根缺氧过程中的光合摩托车运输GydF4y2BaMelaleuca cajuputi.GydF4y2Ba,耐洪水物种,以及GydF4y2Ba桉树camaldulensisGydF4y2Ba,中等抗洪能力的品种。树杂志。2006;26:1413-23。GydF4y2Ba
- 43.GydF4y2Ba
Bailey-Serres J,Voesenek L.洪水压力:适应和遗传多样性。Annu Rev植物Biol。2008; 59:313-39。GydF4y2Ba
- 44.GydF4y2Ba
Rodriguez-Gamir J,Ancillo G,Gonzalez-Mas MC,Primo-Millo E,Iglesias DJ,Forner-Giner Ma。淹水柑橘幼苗气孔闭合的根信令与调制。植物理性生物化学。2011; 49:636-645。GydF4y2Ba
- 45.GydF4y2Ba
米尔克MS,德阿尔梅达A-AF,Gomes的FP,咀MAG,曼戈贝拉PAO。叶片气体交换,叶绿素荧光和生长反应GydF4y2BaGenipa美国GydF4y2Ba秧苗要淹土。环境Exp Bot. 2003;50:221-31。GydF4y2Ba
- 46.GydF4y2Ba
植物的矿物质营养:原理与展望纽约:威利;1972.GydF4y2Ba
- 47.GydF4y2Ba
坎贝尔DH,范德格拉夫特SA。用标准气相色谱技术分析地下水中溶解的甲烷、乙烷和乙烯。色谱学报,1998;36(4):493 - 498。GydF4y2Ba
- 48.GydF4y2Ba
Sander R.亨利的法律常量(版本4.0)的汇编作为溶剂。atmos chem phys。2015; 15:4399-981。GydF4y2Ba
- 49.GydF4y2Ba
你们ZP。建立了一种新的光强和光合速率关系模型GydF4y2Ba奥雅萨苜蓿GydF4y2Ba.Photosynthetica。2007;45:637-40。GydF4y2Ba
- 50。GydF4y2Ba
Xu H, Kemppainen M, El Kayal W, Lee SH, Pardo AG, Cooke JE, Zwiazek JJ。双色蜡蘑水通道蛋白的过度表达GydF4y2BaJQ585595GydF4y2Ba改变外生菌根白云杉(GydF4y2Ba云杉glaucaGydF4y2Ba)幼苗。新植醇。2015;205:757 - 70。GydF4y2Ba
- 51。GydF4y2Ba
Calvo-Polanco M, Señorans J, Zwiazek JJ。不定根在柽柳水分关系中的作用(GydF4y2BaLarix LaricinaGydF4y2Ba)被淹的幼苗。BMC Plant Biol. 2012;12:99。GydF4y2Ba
- 52。GydF4y2Ba
Lopez D,Venisse J-S,Fumanal B,Chaumont F,Guillot E,Daniels MJ,Cochard H,Julien J-L,Gousset-Dupont A. Aquaporins和Lea Lefultics:Poplar Sheds新光。植物细胞生理。2013; 54:1963-75。GydF4y2Ba
致谢GydF4y2Ba
不适用。GydF4y2Ba
资金GydF4y2Ba
该项目由加拿大自然科学与工程研究理事会向JJZ提供的发现研究基金资助。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
所有作者都设计了实验。XT进行实验。所有作者都参与了手稿的撰写。XT和ML对这项工作做出了同样的贡献。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表。S1GydF4y2Ba
.缺氧和乙烯对参数的影响颤抖白杨确定(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba表S2。GydF4y2Ba本研究中使用的QRT-PCR引物列表。GydF4y2Ba图S1GydF4y2Ba.在颤抖白杨净光合和气孔导度的光响应(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba图S2GydF4y2Ba.颤抖的Aspen中的根长度和射击长度(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba图S3GydF4y2Ba.颤抖的Aspen中的根孔隙度(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba图S4GydF4y2Ba.PIP1s (a)和PIP2s (b)在颤杨中的全长原始Western-blot图像(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba图S5GydF4y2Ba.乙烯内酯合成相关基因的转录丰度(GydF4y2BaACO1GydF4y2Ba,GydF4y2BaACS1GydF4y2Ba和GydF4y2BaACS2GydF4y2Ba)在颤抖的白杨(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba图S6GydF4y2Ba.颤杨治疗一周的溶解氧浓度(GydF4y2BaP.山杨GydF4y2Ba).GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
棕褐色,X.,刘,M.,Du,N ..GydF4y2Ba等等。GydF4y2Ba乙烯增强颤杨根系水分运输和水通道蛋白表达(GydF4y2BaPopulus Temuloides.GydF4y2Ba)暴露于根缺氧。GydF4y2BaBMC植物BIOL.GydF4y2Ba21日,GydF4y2Ba227(2021)。https://doi.org/10.1186/s12870-021-02995-7GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
接受GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-02995-7GydF4y2Ba
关键词GydF4y2Ba
- 水通道蛋白GydF4y2Ba
- 乙烯GydF4y2Ba
- 洪水GydF4y2Ba
- 氧气GydF4y2Ba
- 液压电导GydF4y2Ba