抽象的
背景
人参锈根病(GRS)是人参原发病之一。这种疾病导致人参质量严重下降。研究表明,GRS的发生与土壤环境退化有关,可能涉及土壤微生物学和理化性质的变化。
结果
在本研究中,将GRS和健康人参(HG)样品用作转录组和代谢物的比较分析的实验材料。与Hg样品中的那些相比,在患病样品的代谢和转录水平下,949代谢物和9451个基因显着改变。患病组织的代谢模式改变,患病组织中各种有机酸,生物碱,醇和酚的积累显着显着增加。植物激素信号转导的基因表达存在显着差异,苯丙醇丙烷生物合成,过氧化物酶途径和植物 - 病原体相互作用途径。
结论
本研究对GRS和HG样本进行了比较代谢组学和转录组学分析。基于转录和代谢水平的研究结果,建立了人参对GRS的响应机制模型。我们的研究结果为人参对GRS的反应提供了新的见解,这将揭示人参发生GRS的潜在分子机制。
背景
人参(Panax Ginseng.Mayer)是由于其高营养价值和药用潜力,是最重要的食物和草药之一。作为常年植物,人参中的活性成分随着时间的推移积累[1].人参对不断增长的环境和更长的时间的要求具有更高的要求,使其在增长期间易受各种疾病的影响,从而影响其产量和质量。
人参生锈根症状(GRS)是人参栽培和生产中最常见的疾病之一。它在人参根的平坦斑点上产生红褐色斑点,随着时间的推移,斑点可能逐渐扩大,导致人参的商品等级和品质下降。如果遗传是一种传染病或非传染性的生理疾病仍然存在争议,而且中国的一些学者试图回答这个问题[2那3.].以前关于美国人参的研究(Panax Quinquefolius L.)表明,生锈的根部可能是针对某些真菌的侵袭的防御机制,导致酚类化合物生产的刺激[4.那5.].一些研究结果表明,真菌感染是GRS的原因[6.那7.那8.].然而,这种疾病对人参在转录和代谢水平的影响以及人参的响应机制仍然不清楚。
RNA-SEQ是使用深序技术转录组分析方法[9.].该方法可以检测与具有高灵敏度的生理反应相关的几乎所有基因和途径[10].近年来,越来越多的研究利用基于转录组分析的Illumina RNA-eq平台来探索植物对非生物或生物胁迫的响应,并了解其相关的分子机制[11那12那13那14].代谢组学与转录组学类似,是系统生物学的重要组成部分。代谢组学旨在检测和量化生物样本中的所有代谢物[15].该方法逐渐应用于药用植物研究和植物病理学,作为连接基因,代谢物和表型的基本桥。在植物病理学研究领域,这种方法逐渐与其他研究方法相结合,并应用于植物疾病诊断研究[16],植物疾病抵抗[17],植物无排血疾病[18那19]以及显示良好应用前景的其他领域。
在本研究中,选择来自同一人参农场的GR和Hg组织作为实验材料。使用RNA-SEQ和超高效液相色谱 - 串联质谱(UHPLC-MS / MS)进行GRS和HG组织的转录组和代谢物分析,以阐明人参反应对该疾病的机制。这些调查结果不仅提供了对GR的预防和治疗的有价值的信息,而且还提供了进一步了解人参对外部压力的分子机制的重要见解。
结果
RNA-SEQ的质量控制读取
我们进行了RNA-SEQ分析以比较GRS和HG样品之间的转录组,并且主要分析从cDNA文库获得的mRNA累积信息。每种人参样品的测序产生超过1亿读。在过滤出适配器和低质量读取后,我们获得了高质量的清洁读数,占原始读数的96%以上(表S1)。
患病组织的差异表达基因(DEGS)
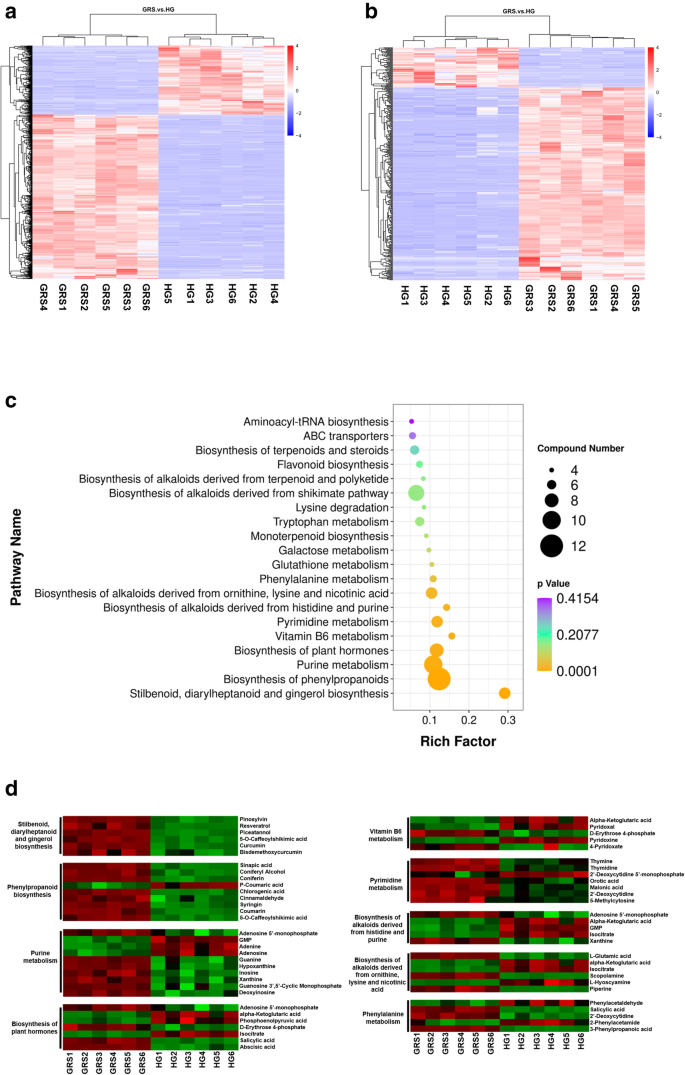
GRS和HG样品之间的段显示在火山图和聚类映射中(图。1A-B)。结果表明,与Hg组相比,上调了GRS基团中4570个基因的表达,下调了4881个基因。
为了找到在人参生锈根部的DEG的基因功能,我们进行了基因本体(GO)和京都基因组(KEGG)途径分析。GO是基因功能的国际标准分类系统。所有DEG可分为三类,包括生物过程(BP),细胞组分(CC)和分子功能(MF)。
在富集的GO术语分类之后绘制的富集直方图如图4所示。2a.根据GO分析转录上调mrna,最显著富集的bp是“碳水化合物代谢过程”、“类固醇生物合成过程”、“氧化还原过程”、“细胞壁组织或生物发生”和“氧化应激反应”,最显著富集的CCs是“细胞壁”和“β -半乳糖苷酶复合物”。最显著的富集MFs是“水解酶活性”、“氧化还原酶活性”和“过氧化物酶活性”。根据转录下调mrna绘制的直方图如图所示。2湾结果表明,最具显着富集的BPS是“氧化还原过程”和“三萜类生物合成过程”,最具显着富集的CCS是“Applast”和“细胞壁”。最具显着富集的MFS是“铁离子结合”,“水解酶活性”和“过氧化物酶活性”。所有富集结果都显示在表格中S2和S3.
对于DEG的Kegg分析,最显着的涉及途径是“代谢途径”,“次级代谢物的生物合成”和“苯丙烷化生物合成”(图。2C)。表格中给出了含有DEG的所有富集的KEGG途径S4.
患病组织的差异累积代谢物
UHPLC-MS /MS测定了人参病变组织和健康组织的代谢物组成,在正离子模式和负离子模式下分别分析了人参根组织的1101和649个化合物(表S5-S6)。提取的最丰富的代谢物包括脂质和脂质样分子,有机酸和衍生物,生物碱和苯丙醇。
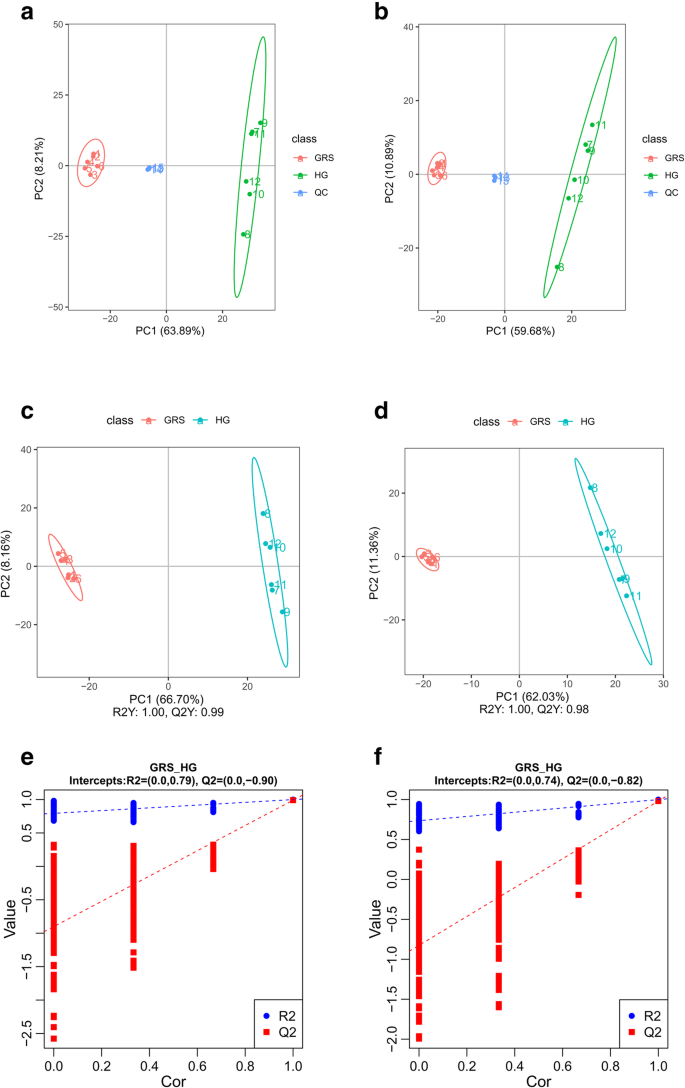
如图1所示。3.对于阳性离子模式和负离子模式,A-B,两种人参组织代谢物基于主成分分析(PCA)聚集在一起。该结果表明两种样品的新陈代谢存在显着差异。我们使用监督的偏最小二乘判别分析(PLS-DA)方法,以基于关键代谢物信息分离样品。PLS-DA得分图显示两组样品之间的显着分离(图。3.光盘)。此外,为了评估模型的可靠性,我们使用200次迭代进行排列测试。交叉验证结果表明,阳性离子模型和负离子模型都没有过度填写(R.2 = 0.79 and Q2R = -0.90,2 = 0.74 and Q2= -0.82)。3.E-F)。
我们从PLS-DA模型的可变重要性图中提取了VIP值,以搜索患病人参组织中的差异累积代谢物。基于三个标准筛选差异累积的代谢物:VIP> 1,P. < 0.05 and fold change > 2. According to the above criteria, 595 and 344 metabolites were selected from the positive ion mode and negative ion mode, respectively. To better understand the chemical differences between diseased and healthy tissues, we plotted the heatmaps of 12 samples in positive and negative ion modes (Fig.4.A-B)。在阳性离子模式下筛选的大多数差分累积代谢物在患病组织中累积较高(419上调和下调176个)。在负离子模式中观察到相同的现象(285上调和下调59个)。通过将这些代谢物与数据库中的那些匹配,我们最终确定了669个差异累积的代谢物,其中508次上调,下调159例(表1)。
两个组织中的差分累积代谢物被映射到KEGG数据库。这些代谢物主要富集多种生物碱生物合成途径,例如“生物合成的生物合成,衍生自组氨酸和嘌呤”和“衍生自鸟氨酸,赖氨酸和烟酸的生物合成的生物合成”。此外,“斯蒂屈甲醛,二芳肽和姜醇生物合成”的极大差异,“苯丙烷生物合成”,“植物激素的生物合成”和“嘌呤代谢”也是值得注意的(图。4.C)。在9种代谢途径中的差异累积代谢物的丰度,以及在Kegg代谢途径中的显着富集的差分累积代谢物和具有化合物数≥5的浓缩代谢物。4.天。
人参对疾病的反应
GO和KEGG富集分析结果显示GRS组织的响应。与HG组织相比,GRS组织中有大量的DEGs参与植物激素信号转导、木质素合成、植物与病原体的相互作用和氧化应激。
我们专注于途径“植物激素信号转导”,涉及135°(图。S1-S2)。几乎所有参与ABA信号转导的基因,例如可溶性ABA受体Pyl / RCAR,蛋白质磷酸酶Type-2C(PP2C)和SNF1相关蛋白激酶(SNRK2.3,SNRK2.10),在GRS组中上调(如图。S1b)。上调涉及JA信号传导的JAR1和冠状内不敏感1(COI1)基因,并且下调茉莉酸齐域(JAZ)基因(图。S1C)。另外,对GR的介质相关基因1(NPR1),TGA因子和病理相关基因PR-1的介质蛋白质非投反压缩体的差异基因表达被发现(图。S1d)。与植物激素信号转导相关的DEG在图2中示出。S2.此外,我们发现亚茉莉酸甲酯(MEJA),脱落酸(ABA)和水杨酸(SA)在患病组织中强烈诱导(图。S1一种)。
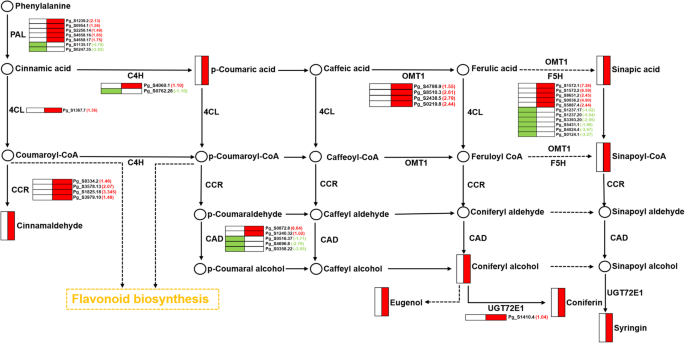
“苯丙烷生物合成”途径有124只次数和9个差异累积的代谢物(表S4和图。4.d)。途径中差分累积的代谢物和egs的详细位置如图2所示。5..在GRS组织中,与木质素和苯酚合成密切相关的酶,例如苯丙氨酸氨 - 裂解酶(PAL),O-甲基转移酶1(OMT1),4-作用:辅酶A连接酶1(4CL1)和肉桂酰辅酶A还原酶(CCR),用高表达水平检测。
我们分析了“过氧化物酶体”途径,其与植物中的氧化胁迫密切相关。如图1所示。S3和图。S4,我们发现59只患者参与了“过氧化物酶体”途径。在GRS组中下调了几种PEX系列基因,例如PEX14,PEX16和PEX19。PXMP2和MPV17涉及反应性氧物质(ROS)代谢,并显示出明显的下调表达。另外,上调了抗氧化系统中的过氧化氢酶(猫)和超氧化物歧化酶(SOD)。
在我们的富集结果中,96个DEGs参与了“植物-病原体互作”途径(表1)S4)。相应的KEGG路径如图2所示。S5.与病原相关分子模式(PAMP)触发免疫(PTI)相关的呼吸爆发氧化酶同源基因(RBOH) RBOHD和RBOHF、鞭毛蛋白传感2 (FLS2)和WRKY家族基因(WRKY33和WRKY22)均有差异表达。效应触发免疫(efftor -triggered immunity, ETI)相关基因RIN4、RPS2、HSP也有差异表达。此外,与防御相关的基因NHO1和PR1表达上调。S6)。
差异累积代谢物和次数的相关分析
我们发现许多Degs和差异累积的代谢物在两种类型的组织中富含相同的Kegg代谢途径。这些途径包括“苯丙烷生物合成”,“苯丙氨酸代谢”,“斯蒂甲醛,二芳肽和姜醇生物合成”和其他途径(图。6.一种)。此外,考虑到菲恩生物合成途径在疾病抵抗和植物中的应力反应中的作用,基于Pearson相关系数(PCC)构建了Degs和差分累积代谢物的相关网络图。如图1所示。6.B,网络中总共36次和8个差异累积的代谢物高度相关(PCC> 0.8)。据推测,这些基因和代谢物可能在人参响应中发挥关键作用。
mRNA表达的实时定量聚合酶链反应(QPCR)验证
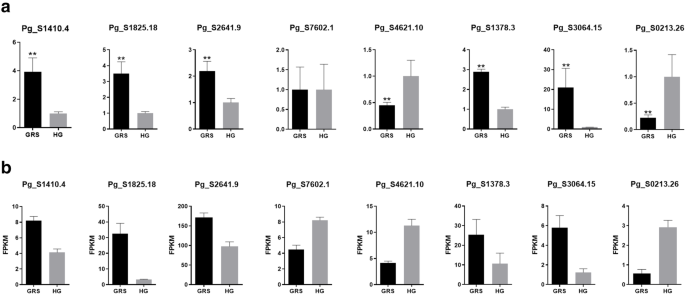
为了验证RNA-SEQ结果的准确性并提供进一步研究的基础,选择来自四种植物抗性途径的一些基因用于QRT-PCR分析。通过QRT-PCR和转录组测序证明了这些基因的表达水平。PG_S1410.4基因PG_S1410.4(UGT72E1),PG_S1825.18(CCR1),PG_S2641.9(CSD1),PG_S7602.1(MPV17),PG_S4621.10(FLS2),PG_S1378.3(HSP90.1),PG_S3064.15(通过QPCR分析RP-1)和PG_S0213.26(JAZ)(图。7.a).通过RNA-seq得到相应mrna的表达水平如图所示。7.湾所有验证结果完全证明了转录组测序数据的可靠性和准确性。
讨论
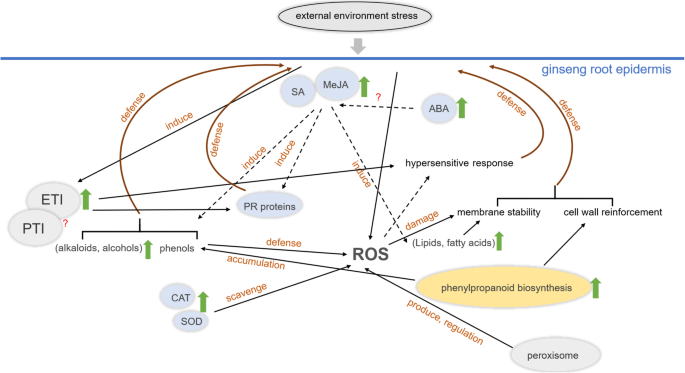
代谢物和总RNA从同一个人参农场种植的相同各种5岁人参中提取(由于其较高的生锈根指数)。样品由健康和患病人参组织制备。目的是确保人参样品在增长过程中经历了相同的现场管理和气候变化[20.].我们对GRS和HG组织进行了UHPLC-MS / MS和RNA-SEQ分析。结果表明,在GRS样品中,939代谢物差异累积,9451个基因显着表达。基于先前的研究和这种代谢组和转录组分析的结果,我们提出了一种模型来解释人参对GRS的反应(图。8.)。
人参对锈根症状的反应机制。”?指未生效;实箭头表示直接作用,虚线箭头表示间接作用。环境应激诱导氧化应激,氧化应激激活ETI系统,刺激人参组织中SA、MeJA和ABA的合成。SA和MeJA诱导酚类、生物碱和酒精代谢产物的积累。SA和MeJA也能诱导脂质和脂肪酸代谢,增强膜的抗胁迫稳定性。CAT、SOD等抗氧化酶的产生以及过氧化物酶体调控影响组织中ROS的积累。同时,人参表皮组织PTI和ETI中的DEGs可能促进PR蛋白的产生和对外界胁迫的超敏反应。苯丙素生物合成途径的激活一方面提高了酚类代谢产物的产量。 It may increase the accumulation of lignin and promote the cell wall's reinforcement on the other hand. The reinforcement of the cell wall and the enhancement of membrane stability together constitute a physical defense in ginseng tissues
患病组织中的激素调节
植物在生长期间产生各种激素。ABA,SA和JA在调解植物防御反应对病原体和非生物胁迫中起重要作用[21那22].在转录水平,ABA受体Pyr / Pyl / RCAR,负调节剂PP2C和阳性调节器SNRK2包括调节系统[23].在GRS组织中,调节ABA信号转导的基因差异表达,并且上调ABF转录因子(图。S1B).在JA刺激条件下,JAR1合成的JA- ile与受体COI1结合,导致抑制蛋白JAZ的降解,从而上调JA靶基因的表达水平(图)。S1C) [24那25].NPR1是SA依赖性PR基因活化的关键调节元件之一,并与GTA因子相互作用以调节PR基因表达[26那27].我们发现是NPR1(BOP2和NPR3)的副产物和多个TGA转录因子基因的差异表达,导致PR-1基因表达的上调(图。S1D).此外,UHPLC-MS/MS检测到3种植物激素及激素相关信号分子(ABA、SA和MeJA)在病变组织中均显著上调(图1)。S1一种)。因此,激素的积累和与患病组织中的激素信号转导相关的基因的差异表达受影响代谢过程,最终导致生长模式的变化以承受环境压力。
患病组织的免疫系统
植物有两层防御病原体,PTI和ETI [28].这里,与Hg组织相比,遗传物组织中的植物 - 病原体相互作用途径有96°。RBOH介导ROS生成,这与PTI和ETI强烈相关[29那30.].RBOHD和RBOHF被认为是植物防御的关键组成部分[31].FLS2是一种模式识别受体(PRR),可以在植物中引发先天免疫,也涉及内吞作用[32].Wrky33作为植物抵抗病原体的转录因子发挥重要作用[33].上述基因的下调和NOA1和MEKK1可以表明在GR期间压抑PTI的一部分。
有趣的是,Eti似乎在GRS样本中被激活。RPS2是植物中的抗性(R)蛋白,而RIN4是天然植物免疫的必要负调节剂,对RPS2进行调节作用[34].HSP90.1是RPS2抗性所必需的,在植物面临生物胁迫时可以迅速诱导[35].SGT1积极调节许多r蛋白产生的抗病抗性[36].在我们的分析中,RIN4被下调,并且PRS2,SGT1和HSP90.1被上调。此外,植物中必不可多普遍抗性基因的NHO1是上调的[37].总体而言,患病组织的免疫系统被激活,间接导致过敏和细胞壁加固。
患病组织中的ROS-清除系统
植物暴露于各种生物和非生物胁迫条件触发反应性氧物种(ROS)生产和间隙的快速变化[38].ROS在调节植物中调节炎症和防御反应的信号传导途径中起重要作用,但它们的积累通常对细胞有害。
过氧化物酶体是具有基本氧化代谢类型的亚细胞细胞器,可能是细胞内ROS的主要产生位点[39那40].KEGG富集分析显示,参与ROS代谢的PXMP2和MPV17均被转录下调(图5)。S2)。PXMP2是一种钙钛矿膜蛋白,其具有允许自由扩散化合物的沟道形成活性,例如H.2O.2[41.].MPV17是涉及ROS的生产的蛋白质[40].差异表达几种PEX系列蛋白基因,包括普克里克蛋白蛋白质进口的PEX13和PEX14,以及参与膜蛋白质的PEX16和PEX19 [42.那43.].此外,猫和分肠基因在患病组织中升高。因此,患病组织可以通过过氧缺体和抗氧化剂系统响应氧化胁迫[44.].
人们通常认为酚类物质的含量与植物组织的总抗氧化能力密切相关[45.].研究表明,类黄酮也是植物中主要的化学防御物质之一,可以减少植物细胞中各种形式的活性氧[46.].在我们的结果中,发现了大量的黄酮类化合物和酚醛化的显着上调。通过Kegg浓缩分析还发现了类黄酮生物合成途径的显着富集(图。4.C)。我们还注意到,多种醇代谢物在患病组织中显示出较高的积累。结果表明,酒精的积累通常在抗氧化应激的斗争中起作用。醇可作为氧化还原反应的中间体,以良好的扫处理能力为自由基和超氧化物[47.那48.].可以推测人参在患病组织中积聚更多醇以应对氧化应激以改善其抗性。总体而言,这些化合物在人参的患病组织中积聚,并且可以共同参与氧化应激反应。
患病组织的物理和化学防御
木质素是苯基丙醇化合物的高度支化聚合物,是植物细胞壁的主要成分[49.].木质素生物合成涉及一个复杂的遗传网络,其中包含许多含酶[50.那51.].上调了几种关键酶,包括PAL,4CL,CCR,OMT和CAD [52.那53.].此外,酚类和黄酮类化合物不仅在植物抗氧化过程中发挥着关键作用,而且也是植物化学防御的必要化合物[54.].我们的分析表明,苯丙醇丙烷生物合成途径中显着富集了两种类型的数据(转录组和代谢物)(图。6.a).考虑到苯丙素生物合成途径与酚类产物、类黄酮代谢和木质素形成密切相关,推测它可能是人参响应GRS的关键代谢途径[55.].因此,基于相关分析结果,我们在该代谢途径中构建了差异累积代谢物和DEG的相关网络(图。6.b)。该网络包括酚类,木质素和黄酮合成的几个上游调节基因,例如PAL(PG_S1239.2,PG_S0954.1和PG_S2256.14),4CL(PG_S1367.7)和C4H(PG_S4060.1),和前体化合物,如Coniferin,SiNapic酸和香豆素。据推测,这些基因的上调和代谢物的积累在人参对GRS的反应中起着至关重要的作用。
脂质是必需的膜组分,并且其组合物的变化可以帮助植物维持细胞分区化和膜完整性[56.].此外,当细胞在压力或损伤过程中,自由基代谢并产生并产生。因此,降低脂质过氧化具有在植物弹性中具有重要作用。在人参患病组织中,含有显着改变的含量的脂质代谢物。例如,磷脂酰胆碱(PE)和磷脂酰乙醇胺(PC)是在细胞膜中大量存在的脂质。据报道,PC / PE比率的增加是膜双层的结构稳定性的标记,以防止膜降解[57.].有趣的是,我们检测到人参患病组织中几个PC水平显著升高,而PE水平显著降低。因此,病变组织可能比健康组织更倾向于维持生物膜的完整性和稳定性。
生物碱的积累是植物响应生物应激的重要防御策略,并且生物碱是植物化学防御中涉及的重要组合物[58.].在患病组织中,我们发现了许多生物碱代谢物的积累的上调。差分累积代谢物的Kegg富集结果也含有许多生物碱生物合成途径(图。2C)。该结果表明,生物碱代谢物对于人参的应力反应至关重要。患有生物碱的外部应激的化学防御可能发生在患病组织中[55.].
结论
目前的研究进行了GRS和HG组织的比较代谢和转录组分析。与植物抗性响应相关的途径的分析表明,激素信号通路,木质素生物合成,过氧化血剂在植物病原体反应期间通过过氧化血剂的变化。另外,患病组织的代谢模式改变,许多次生代谢物的生产和积累可能在遗传馆中起重要作用。最后,提出了一种模型来解释人参对GRS的反应(图。8.)。我们的结果为人参对GRS的反应提供了新的洞察力,揭示了人参在人参中的潜在分子机制。
方法
植物材料和组织收集
所有人参样本(5岁)是从吉林省洪春市的同一个人参农场收集(42.86'n和130.37'e)。在上一项调查中,这是一个人参农场,具有高生锈根指数[59.].
采集GRS病变组织(主根)和HG健康组织标本,立即用液氮冷冻,使用前保存在−80°C。制备独立的生物复制体,每个复制体包含3个或3个以上人参根材料。
RNA提取,文库制备,聚类和测序
构建了六种互补DNA(cDNA)文库,用于GRS组织,以及用于HG组织的三种。Trizol试剂(Invitrogen,Carlsbad,Ca)用于分离每个样品的总RNA。在1%琼脂糖凝胶上监测RNA降解和污染。使用Nanophotometer®分光光度计(Upplen,CA,USA)检查RNA纯度。使用Qubit®RNA测定试剂盒在Qubit®2.0ularometer(Life Technologies,CA,USA)中使用Qubit®RNA测定试剂盒测量RNA浓度。使用RNA纳米6000测定试剂盒和BioAnalyzer 2100系统(Agilent Technologies,CA,USA)评估RNA完整性。
每个样品共3 μg RNA作为RNA样品制备的输入材料。测序文库使用NEBNext®Ultra™RNA Library Prep Kit for Illumina®(NEB, USA),遵循制造商的建议,并将索引代码添加到每个样本的属性序列中。简而言之,用聚t寡聚磁珠从总RNA中纯化mRNA。在NEBNext第一链合成反应缓冲液(5X)中使用高温下的二价阳离子进行碎片化。利用随机六聚体引物和M-MuLV逆转录酶(RNase H-)合成第一链cDNA。随后使用DNA聚合酶I和RNase h合成第二链cDNA,剩余的悬垂部分通过外切酶/聚合酶活性转化为钝端。将DNA片段的3 '端腺苷化后,将带有发夹环结构的NEBNext接头连接,准备杂交。为了优先选择长度为150 ~ 200 bp的cDNA片段,文库片段用AMPure XP系统(Beckman Coulter, Beverly, USA)纯化。然后,使用3 μl USER Enzyme (NEB, USA),大小选择,适配器连接cDNA在37°C下15 min,然后在95°C下5 min, PCR前。PCR采用Phusion高保真DNA聚合酶、通用PCR引物和指数(X)引物进行。 PCR products were purified (AMPure XP system), and library quality was assessed on the Agilent Bioanalyzer 2100 system.
在簇生成后,在Illumina Hiseq PE150平台上测序RNA文库制剂,并产生150bp成对终端读数。RAW RNA-SEQ数据在RACESSION NO下在NCBI数据库中自由使用。prjna684799。
转录组数据分析
FASTQ格式的原始数据(原始读取)首先通过内部Perl脚本进行处理。然后从清洁读取中选择一定的长度范围以执行所有下游分析。
参考基因组和基因模型注释文件直接从基因组网站下载[60.].使用星形构建参考基因组指数,并使用星形(v.2.5.1b)对准与参考基因组的配对结束清洁读数。Star使用最大可映射前缀(MMP)方法来生成结精结读取的精确映射结果。HTSEQ(V.0.6.0)用于计算映射到每个基因的读数数。基于该基因的长度和映射读数计算每个基因的每百万次映射读取(FPKM)的每百万映射读取(FPKM)的每千碱基的碎片数。
使用DESeq2 R包进行两组差异表达分析(v.1.10.1)。由此产生的P.使用Benjamini和Hochberg的方法来控制错误发现率。
去 (http://www.geneontology.org/)采用基于goseq的Wallenius非中心超几何分布对DEGs进行富集分析,纠正了基因长度偏倚[61.].此外,我们使用KOBAS 2.0软件对DEGs进行KEGG富集分析[62.].
代谢分析
首先,我们提取了代谢物。将组织(100mg)与液氮单独研磨,通过涡旋将匀浆重悬于预热的80%甲醇和0.1%甲酸中。将样品在冰上温育5分钟,然后以15,000rpm和4℃离心5分钟。将一些上清液用UHPLC-MS / MS级水稀释至终浓度为53%甲醇。随后将样品转移到新鲜的Eppendorf管中,然后以15000×g和4℃离心10分钟。
然后使用vanquish Uhplc系统(Thermo Fisher,Germany)与orbitrap Q exactive™HF-X质谱仪(Thermo Fisher,Germany)耦合进行UHPLC-MS / MS分析。使用0.2ml / min的流速,使用17分钟的线性梯度将样品注射到百分比粒子(100×2.1mm,1.9μm)上。用于正极性模式的洗脱液是洗脱剂A(水中0.1%Fa)和洗脱液B(甲醇)。负极性模式的洗脱液是洗脱液A(5mM乙酸铵,pH9.0)和洗脱剂B(甲醇)。溶剂梯度设定如下:2%B,1.5分钟;2-100%B,12.0分钟;100%B,14.0分钟;100-2%B,14.1分钟;2%B,17分钟。Q Exactive™HF-X质谱仪以正/负极性模式操作,喷射电压为3.2 kV,毛细管温度为320°C,鞘气流速率为40架,辅助气体流速为10次。
使用复合发现器3.1(CD3.1,Thermo Fisher)处理UHPLC-MS / MS产生的原始数据文件,以对每个代谢物进行峰对准,峰值选择和定量。主要参数如下:保留时间耐受,0.2分钟;实际质量耐受,5 ppm;信号强度耐受性,30%;信号/噪声比3;最小强度,100,000。之后,峰强度被标准化为总光谱强度。标准化的数据用于预测基于添加离子,分子离子峰和片段离子的分子式。然后,峰值与MZCloud,MZVault和MassList数据库匹配,以获得准确的定性和相对定量的结果。
PCA和PLS-DA采用SIMCA-P 14.1 (Umetrics, Umea, Sweden)进行。有VIP > 1,P.-value < 0.05和fold change > 2被认为是差异代谢产物。差异积累代谢物的KEGG富集分析采用KOBAS 2.0软件[62.].
果实和差分累积代谢物的组合分析
将获得的差异累积的代谢物和涂布于Kegg途径进行整合。此外,我们对转录组和代谢组数据进行了相关性分析,以探讨DEGS和代谢物之间的相关性。使用R中的COR函数计算DEGS和差分累积代谢物的PCC。在KEGG途径中的基因和代谢物中的基因和代谢物用于通过Cytoscape软件的相关网络建立相关网络。
定量实时QPCR
使用2×Realstar绿色快速混合物(Genstar,China)对实时PCR系统(LightCeler 96,Roche,瑞士)进行定量PCR。对于每次反应,加入0.5μL正向和反向引物和2μLcDNA模板。本研究中使用的所有引物列于表中S7.根据2计算相对基因表达水平——ΔΔCt方法 [63.].
统计分析
使用SPSS 20.0软件进行统计分析。所有数据都表示为平均值±SEM。P. < 0.05 was considered statistically significant. RT-PCR results were analysed using a Student’sT.-测试。成立了重要意义P. < 0.05.
数据和材料的可用性
所有相关的支持数据集都包含在文章及其补充文件中。
缩写
- GRS:
-
人参生锈根症状
- HG:
-
健康人参
- UHPLC-MS /女士:
-
液相色谱 - 串联质谱法
- Kegg:
-
京都基因和基因组百科全书
- 可见:
-
差异表达基因
- 去:
-
基因本体论
- BP:
-
生物过程
- CC:
-
细胞成分
- MF:
-
分子功能
- PCA:
-
主要成分分析
- OPLS-DA:
-
部分最小二乘判别分析
- Meja:
-
茉莉酸甲酯
- 阿巴:
-
脱盐酸
- SA:
-
水杨酸
- PP2CS:
-
蛋白磷酸酶Type-2C
- SNRK:
-
SNF1相关蛋白激酶
- COI1:
-
冠状素不敏感1
- 杰兹:
-
jasmonate-zim域
- NPR1:
-
蛋白质非抗贲门PR基因1
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- OMT1:
-
O-甲基转移酶1
- 4CL:
-
4-香豆酸盐:辅酶是一个连接酶
- CCR:
-
Cgnamoyl辅酶还原酶
- ROS:
-
反应性氧气
- 猫:
-
催化剂
- 草皮:
-
超氧化物歧化酶
- RBOHS:
-
呼吸爆发氧化酶同源物
- FLS2:
-
鞭毛感测2
- PAMP:
-
病原体相关的分子模式
- PTI:
-
PAMP触发的免疫力
- 指数:
-
Effector-triggered免疫力
- PPC:
-
Pearson相关系数
- QPCR:
-
定量聚合酶链反应
- 互补脱氧核糖核酸:
-
互补DNA
- MMP:
-
最大可映射前缀
- FPKM:
-
每千碱基中的片段每百万次读取
参考
- 1.
Proctor JTA,Bailey WG。人参:工业,植物学和文化。Hortic Rev. 1987; 9:187-236。
- 2.
周y,杨z,gao l,liu w,liu r,zhao j等。白芍中红皮根系中元素累积,酚类代谢和抗氧化酶活性的变化。j ginseng res。2016; 41(3):307-15。https://doi.org/10.1016/j.jgr.2016.06.001.
- 3.
王Q,Sun H,Xu C,Ma L,Li M,Shao C等人。与Panax人参生锈根病相关的根际细菌和真菌社区分析。苹果土壤Ecol。2019; 138:245-52。https://doi.org/10.1016/j.apsoil.2019.03.012.
- 4.
拉哈曼,旁遮普郡ZK。人参根组织的生物化学受生锈根症状的影响。植物理性生物化学。2005; 43(12):1103-14。https://doi.org/10.1016/j.plaphy.2005.09.004.
- 5。
西洋参的锈病是由一种裂尾孢子虫引起的。植物病理学。2006;96(11):1243 - 54。https://doi.org/10.1094/phyto-96-1243.
- 6。
卢晓红,张学明,焦晓丽,郝建军,张学森,罗勇,等。中国人参红皮根真菌复合体的分类。人参;44(3):506-18。https://doi.org/10.1016/j.jgr.2019.01.006.
- 7。
Farh Me,Kim Yj,Kim Yj,Yang DC。Cylindrocarpon Destructans / Ilyonectria Radicicola族复合物:人参根腐病和生锈症状的致病剂。j ginseng res。2018; 42(1):9-15。https://doi.org/10.1016/j.jgr.2017.01.004.
- 8。
刘D,Sun H,MA H.破解微生物组,与Panax人参生锈根系相关,对致拮抗剂对致病性胰岛素的评价。前微生物。2019; 10:1350。https://doi.org/10.3389/fmicb.2019.01350.
- 9。
王铮,王振民,王振民。RNA-Seq:转录组学的革命性工具。李建平。2009;10(1):57-63。https://doi.org/10.1038/nrg2484.
- 10.
Sun L,Wang J,Song K,Sun Y,Qin Q,Xue YJSR。促进镉胁迫的稻米(Oryza Sativa L.)射击的转录组分析。SCI批准。2019; 9(1):1-10。
- 11.
张y,gao x,李杰,贡x,杨p,gao j等。Proso Millet(Panicum Miliaceum L.)叶片转录om的比较分析探讨干旱耐受机制。BMC植物BIOL。2019; 19(1):1-17。
- 12.
李H,Mo Y,Cui Q,Yang X,Guo Y,Wei C,等。转录组和生理分析揭示了耐旱性和-ceplible西瓜基因型中的干旱适应策略。植物SCI。2019; 278:32-43。https://doi.org/10.1016/j.plantsci.2018.10.016.
- 13.
康X,王L,Guo Y,Arifeen Mzu,Cai X,Xue Y等。六倍体小麦对甲孢菌和戈纳蒙西甘油麦玉米氏菌的反应进行比较转录组和蛋白质组学分析,分别和组合。Mol植物微生物。2019; 32(10):1336-47。https://doi.org/10.1094/MPMI-03-19-0066-R.
- 14。
bano a,muqarab rjpb。PGPR对番茄(Solanum Lycopersicum L.)的植物防御植物防御。植物BIOL。2017; 19(3):406-12。https://doi.org/10.1111/plb.12535.
- 15.
4 .郭静,吴勇,王刚,王涛,曹峰。银杏幼叶和成熟叶转录组和代谢组综合分析。作物学报。2020;https://doi.org/10.1016/j.indcrop.2019.111906.
- 16。
Cevallos-cevallos JM,García-Torres R,Etxeberria E,Reyes-De-Corcuera Ji。从商业林石中柑橘黄龙和锌缺陷植物中植物的新空间分析的GC-MS分析。Phytochem肛门。2011; 22(3):236-46。https://doi.org/10.1002/PCA.1271.
- 17。
Hamzehzarghani H,ParaNidharan V,Abu-Nada Y,Kushalappa AC,Mamer O,Somers D.代谢剖面,以区分小麦在染色体2DL染色体的定量特质基因座,对镰刀菌的抗性变化。可以j植物sci。2008; 88(4):789-97。
- 18。
Barding Ga,Bénis,Fukao T,Bailey-Serres J,Laive CK。GC-MS和NMR对浸没胁迫的水稻代谢物分析的比较。J蛋白质组。2013; 12(2):898-909。https://doi.org/10.1021/pr300953k..
- 19。
关键词:甘蓝型油菜,金属离子诱导,代谢产物植物生理学杂志。2008;https://doi.org/10.1016/j.jplph.2008.04.011.
- 20。
Jayakodi M, Lee S, Lee YS, Park H, Kim N, Jang W,等。人参根转录组综合分析。中国生物医学工程学报。2015;15(1):1 - 12。
- 21.
Jones JD,Dangl JL。植物免疫系统。自然。2006; 444(7117):323-9。https://doi.org/10.1038/nature05286.
- 22.
琼斯JD。植物激素在植物防御反应中的作用。植物mol biol。2009; 69(4):473-88。https://doi.org/10.1007/s11103-008-9435-0.
- 23.
Fujii H,Chinnusamy V,Rodrigues A,Rubio S,Antoni R,Park Sy,等。体外重构脱落酸信号通路。自然。2009; 462(7273):660-4。https://doi.org/10.1038/nature08599.
- 24.
Chini A,Fonseca S,Fernandez G,Adie B,Chico J,Lorenzo O,等。jaz家庭的阻遏者是茉莉ats信号传导中缺失的链接。自然。2007; 448(7154):666-71。https://doi.org/10.1038/nature06006.
- 25.
Chico JM,Chini A,Fonseca S,Solano R. jaz压缩机在茉莉酸盐信号中设置节奏。CurrOp植物BIOL。2008; 11(5):486-94。https://doi.org/10.1016/j.pbi.2008.06.003.
- 26.
Canet JV, Dobon A, Roig A, Tornero PJPC。环境。拟南芥npr1等位基因的结构功能分析揭示了其同源基因在水杨酸感知中的作用。植物细胞环境。2010;33(11):11 - 22。https://doi.org/10.1111/j.1365-3040.2010.02194.x.
- 27。
约翰逊C,Boden E,Arias Jjtpc。水杨酸和NPR1诱导在拟南芥中的防御基因启动子转移转移的TGA因子。植物细胞。2003; 15(8):1846-58。https://doi.org/10.1105/tpc.012211.
- 28。
Irieda H,Inoue Y,Mori M,Yamada K,Oshikawa Y,Saitoh H,等。保守的真菌效应器通过靶向植物免疫激酶来抑制PAMP触发的免疫。p natl一个sci。2019; 116(2):496-505。https://doi.org/10.1073/pnas.1807297116.
- 29。
Marino D, Dunand C, Puppo A. Pauly NJTiPS。植物NADPH氧化酶的爆发。植物生态学报,2012;https://doi.org/10.1016/j.tplants.2011.10.001.
- 30.
张j,邵f,李y,cui h,chen l,li h,等。Pseudomonas inringae效应器灭活Mapks以抑制植物中的PAMP诱导的免疫。细胞宿主微生物。2007; 1(3):175-85。https://doi.org/10.1016/j.chom.2007.03.006.
- 31。
托雷斯马,詹姆斯·吉尔,琼斯JDG。Arabidopsis GP91phox同源物ATRBOHD和ATRBOHF是在植物防御反应中积累反应性氧中间体的累积。p natl一个sci。2002; 99(1):517-22。https://doi.org/10.1073/pnas.012452499.
- 32。
Robatzek S,Chinchilla D,Boller TJG。发展。配体诱导拟南芥模式识别受体FLS2的内吞作用。基因开发。2006; 20(5):537-42。https://doi.org/10.1101/gad.366506.
- 33.
郑卓,卡马尔,陈卓,孟杰。拟南芥WRKY33转录因子是抵抗坏死性真菌病原体所必需的。植物j . 2006; 48(4): 592 - 605。https://doi.org/10.1111/j.1365-313x.2006.02901.x.
- 34.
刘家,Elmore JM,Coaker GJPS。行为。研究植物先天免疫应答期间RIN4蛋白复合物的功能。植物信号表现。2009; 4(12):1107-10。https://doi.org/10.4161/psb.4.12.9944.
- 35.
Takahashi A,Casais C,Ichimura K,Shirasu K.HSP90与RAR1和SGT1相互作用,对于RPS2介导的拟南芥抗性至关重要。p natl一个sci。2003; 100(20):11777-82。https://doi.org/10.1073/pnas.2033934100.
- 36.
Azevedo C,Betsuyaku S,Peart Jr,Takahashi A,Noel Ld,Sadanandom A等。SGT1在植物免疫抗性蛋白质积累中的作用。2006年EMBO J. 2006; 25(9):2007-16。https://doi.org/10.1038/sj.emboj.7601084.
- 37.
康L,Li J,Zhao T,Xiao F,Tang X,Thilmony R等。拟南芥非体性抗性基因NHO1与细菌毒力相互作用。p natl一个sci。2003; 100(6):3519-24。
- 38.
卡尔平斯基是敌是友?活性氧在植物逆境响应中的产生、清除和信号转导。自由基生物医学。2018;122:4-20。https://doi.org/10.1016/j.freeradbiomed.2018.01.011.
- 39。
鳃SS,Tuteja N.作物植物中非生物胁迫耐受性耐受性氧气和抗氧化机械。植物理性生物化学。2010; 48(12):909-30。https://doi.org/10.1016/j.plaphy.2010.08.016.
- 40。
Corpas FJ,Barroso JB,Rio La。过氧化物作为植物细胞中活性氧物质和一氧化氮信号分子的源。趋势植物SCI。2001; 6(4):145-50。https://doi.org/10.1016/s1360-1385(01)01898-2.
- 41。
利斯蒙集团C,Koster J,Provost S,Baes M,Van Veldhoven PP,Waterham HR等。解密PXMP2和PEX11B在过氧甲虫膜中过氧化氢渗透的潜在累及揭示了Pex11b在蛋白质分选中的作用。Biochim Biophys Acta Biomembr。2019; 1861(10):182991。https://doi.org/10.1016/j.bbamem.2019.05.013.
- 42。
李我,啜饮者r jr,zou z,sirasanagandla s,wei y,mishra p等人。过氧化合物蛋白质PEX13在选择性自噬中起作用。Embo Rep。2017; 18(1):48-60。https://doi.org/10.15252/mbr.201642443.
- 43。
十字LL,EBEED HT,Baker A.过氧化物组体生物发生,蛋白质靶向机制和植物中的PEX基因功能。Biochim Biophys Acta。2016; 1863(5):850-62。https://doi.org/10.1016/j.bbamcr.2015.09.027.
- 44。
Mittler R.氧化应激,抗氧化剂和应力耐受性。趋势植物SCI。2002; 7(9):405-10。https://doi.org/10.1016/s1360-1385(02)02312-9.
- 45.
Mwamba T,Islam F,Ali B,Lwalaba J,Gill R,Zhang F等人。低镉累积基因型的比较代谢响应显示甘蓝型油菜中的镉自适应机制。化学层面。2020; 250:126308。https://doi.org/10.1016/j.chemole.2020.126308.
- 46.
Chen J,Ullah C,Reichelt M,Gershenzon J,Hammerbacher A. Sclerotinia Sclerotiorum通过分解黄酮糖苷和糖苷酮来避免黄酮防御。植物理性。2019年; 180(4):1975-87。https://doi.org/10.1104/pp.19.00461.
- 47.
van deneden W,Valluru R.蔗糖,绥科糖糖糖,氧化胁迫:清除和救助?J Exp Bot。2008; 60(1):9-18。https://doi.org/10.1093/jxb/297.
- 48.
Keunen E,Peshev D,Vangronsveld J,Van denedew,Cuypers A.植物糖是非生物压力期间氧化挑战中的关键球员:延长了传统概念。植物细胞环境。2013; 36(7):1242-55。https://doi.org/10.1111/pce.12061.
- 49.
Moura JCMS,Bonine Cav,Viana Jdof,等。非生物和生物应力和木质素含量的变化和植物中的组成。J Intent Plant Biol。2010; 52(4):360-76。https://doi.org/10.1111/j.1744-7909.2010.00892.x.
- 50。
植物生长发育过程中木质素沉积的遗传控制。新植醇。2004;164(1):相当于17 - 30。https://doi.org/10.1111/j.1469-8137.2004.01143.x.
- 51。
Rastogi S, Dwivedi UN。与o -甲基转移酶特别相关的植物中木质素的操纵。Plnat Sci。2008;174(3):264 - 77。https://doi.org/10.1016/j.plantsci.2007.11.014.
- 52。
Lauvergeat v,Lacomme C,Lacombe e,Lasserre e,Roby d,Grima-pettenati J.两种肉桂酰-CoA还原酶(CCR)拟南芥在发育过程中差异表达,并响应于致病细菌感染。植物化学。2001; 57(7):1187-95。https://doi.org/10.1016/s0031-9422(01)00053-x.
- 53。
anterola am,lewis ng。木质素改性的趋势:综合分析遗传操作/突变对木质化和血管完整性的综合分析。植物化学。2002; 61(3):221-94。https://doi.org/10.1016/s0031-9422(02)00211-x..
- 54。
Gomaa Nh,Hassan Mo,Fahmy Gm,Gonzálezl,哈德卡o,Atteya Am。响应于Sonchus Oleraceus L. Acta Bot Bras的化感康胁迫的一些豆类的黄酮类化分析和瘤。2015; 29(4):553-60。https://doi.org/10.1590/0102-33062015abb0153.
- 55。
Zaynab M, Fatima M, Abbas S, Sharif Y, Umair M, Zafar MH等。次生代谢物在植物防御病原菌中的作用。活细胞Pathog。2018;124:198 - 202。https://doi.org/10.1016/j.micath.2018.08.034.
- 56。
Gigon A,Matos A-R,Laffray D等人。干旱胁迫对拟南芥叶片脂质代谢的影响(生态型肠果)。安乐伦敦。2004; 94(3):345-51。https://doi.org/10.1093/aob/mch150.
- 57.
Toumi I,Gargouri M,Nouairi I,Moschou P,Salem-Fnayou AB,Mliki A等人。水应激诱导具有不同干旱耐受性的四种葡萄基因型的叶脂组合物的变化。BIOL植物。2008; 52(1):161-4。https://doi.org/10.1007/S10535-008-0035-2.
- 58.
Mithöfera,maffei me。植物防御和植物毒素的一般机制;2016. p。1-22。
- 59.
卞X,肖思,赵y,徐y,杨h,张l。生锈和健康人参根中根际土壤理化特征和微生物社区的比较分析。SCI代表2020; 10(1):15756。https://doi.org/10.1038/s41598-020-71024-8.
- 60.
Jayakodi M,Choi B-S,Lee S-C,Kim N-H,Park Jy,Jang W等人。人参基因组数据库:Panax Ginseng的基因组学的开放式接入平台。BMC植物BIOL。2018; 18(1):62。https://doi.org/10.1186/s12870-018-1282-9.
- 61。
年轻的医学博士,韦克菲尔德·MJ,史密斯GK,奥斯拉克AJGB。RNA-seq的基因本体论分析:考虑选择偏差。基因组医学杂志。2010;11(2):1 - 12。
- 62。
毛X,Cai T,Olyarchuk JG,Wei LJB。使用Kegg orthology(Ko)作为受控词汇的自动基因组注释和路径识别。生物信息学。2005; 21(19):3787-93。https://doi.org/10.1093/bioinformatics/bti430.
- 63。
陈宝强,陈宝强,陈宝强。验证2-DeltaDeltaCt计算作为BCR-ABL P210转录本定量PCR数据分析的替代方法。诊断与病理。2006;15(1):56-61。https://doi.org/10.1097 / 00019606-200603000-00009.
致谢
不适用。
资金
本研究部分由国家重点研发计划(授予2017YFC1702100)和吉林省重大科技特别项目(授予20200504003yy)的补助金。资助者帮助设计了本研究的实验。
作者信息
从属关系
贡献
l.z设计了实验;x.b和s.x对样品进行分析;Y.Z.、H.Y.和Y.H.对数据进行了分析;X.B.写了手稿的初稿。所有作者都已阅读并批准了最终的陵墓手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
RNA-SEQ数据摘要和mRNA的映射读数。
附加文件2:表S2。
GRS组织中上调MRNA的所有富集术语的基因本体结果。
附加文件3:表S3。
GRS组织中下调MRNA的所有富集术语的基因本体结果。
附加文件4:表S4。
基于KEGG浓缩分析的所有途径与DEGS相关联。
附加文件5:表S5。
正离子模式下UHPLC-MS /MS分析结果。
附加文件6:表S6。
负离子模式下UHPLC-MS / MS分析的结果。
附加文件7:表S7。
QPCR验证基因的引物序列。
附加文件8:图S1。
植物激素含量及其热图。
附加文件9:图S2。
植物激素信号转导途径。
附加文件10:图S3。
与过氧化物组合合成有关的DEGS的热爱。
附加文件11:图S4。
过氧化物血清途径。
附加文件12:图S5。
植物病原体相互作用途径。
附加文件13:图S6。
与植物 - 病原体相互作用有关的DEGS的热爱。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Bian,X.,Zhao,Y.,Xiao,S。et al。代谢物和转录组分析揭示了人参曲线的分子谱对生锈的根症状的反应。BMC植物BIOL.21日,215(2021)。https://doi.org/10.1186/s12870-021-03001
已收到:
公认:
发表:
关键字
- Panax Ginseng.
- 生锈的根
- 代谢物
- 转录组
- 环境压力