抽象的
背景
基本螺旋-环-螺旋(bHLH)转录因子(TFs)在调节植物生长发育中起着重要作用,通常通过与其他TFs相互作用参与生物过程。辣椒素和辣椒素只有在辣椒,具有高营养和经济价值。然而,BHLH家族基因是否调节胶囊素和辣椒化合物生物合成,并通过与其他TFS相互作用仍然未知,参与这些过程。
结果
在这项研究中,总共鉴定了总共107个CABHLHSCapsicum Annuum.基因组。系统发育树分析表明,这些CabHLH蛋白可分为15个类群拟南芥BHLH蛋白。分析表明表达轮廓CABHLH009那卡布勒H032那CABHLH048那CABHLH095和CabHLH100在簇C1,C2和C3中发现类似于胡萝卜素,包括玉米蛋白,叶黄素和胶囊素的类胡萝卜素生物合成的概况,而表达曲线CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086在簇L5,L6和L9中发现与胎盘中的辣椒素积累的轮廓一致。而且,CABHLH007那CABHLH009那CabHLH026型和CABHLH086也可能参与温度介导的辣椒素生物合成。酵母双杂交(Y2H)试验表明CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086可以与MyB31相互作用,辣椒蛋白生物合成的主调节剂。
结论
CABHLH TFS的全面和系统分析提供了有助于进一步调查类胡萝卜素和辣椒素生物合成的CABHLH。
背景
胡椒 (辣椒仕达屋优先计划.)甜椒和辣椒是世界上重要的经济作物[1].五家驯化辣椒物种,即,Capsicum Annuum.那Capsicum Baccatum.那辣椒那辣椒和Capsicum pubescens.,相当于总共3810万吨辣椒,由世界上四分之三的人口消耗(粮农组织,见www.fao.org) [1].Capsorubin和Capsanthin可以描述为类胡萝卜素,并且在辣椒中完全生物合成。辣椒有益于预防各种疾病,如眼部疾病,心血管疾病和某些癌症[2那3.那4.]提供优良的天然着色剂[5.].类胡萝卜素颜料的积累导致成熟辣椒果实的颜色变化。Carotenoids生物合成途径目前已知(图S1一种) [6.那7.].辣椒素或辣椒素在植物合酶(PSY),植物去脱硫酶(Pds),番茄红素β-环酶(LCYB)等一系列酶促反应中,在一系列酶促反应中转化。[6.那7.]. 此外,辣椒素类生物碱辣椒,负责辛辣。辣椒素产生于辣椒的果实胎盘中[8.]. 辣椒素类化合物主要包括辣椒素、二氢辣椒素和几种类似物[9.那10].辣椒素和二氢淀粉蛋白包含大约91%的总衣壳含量辣椒物种[11]. 大量研究表明,辣椒素是在苯丙氨酸缩合后和脂肪酸链生物合成途径中产生的(图1)S1b)[1那12那13].
bHLH家族是植物中最大的转录因子(TFs)之一,对植物的生长发育具有重要作用[14那15]. bHLH蛋白最初是在真核生物中发现的[14],并包含一个基本区域和一个螺旋-环-螺旋(HLH)区域。这两个区域具有dna结合和蛋白质相互作用的能力[16].基本区域含有N-末端结构域中的13-17个基本氨基酸,并提供DNA结合区域以结合共有己核苷酸E-BOX(Canntg)[17那18],而HLH区域在C末端结构域中包含大约40个氨基酸,其具有通过可变长度的环路分离的两个α螺旋[16那19].此外,HLH区域促进与其他BHLH蛋白质的相互作用以及偶发二聚体和异二聚体复合物的形成[18].除了两个保守区域外,BHLH蛋白质序列是不同的,揭示蛋白质的进化[20.].
BHLH TFS已在大多数植物中识别,包括拟南芥米饭和马铃薯[15那21那22那23那24那25那26那27那28那29那30.].佩皮克斯系统地分析WRKY,NAC和APETALA2 /乙烯响应因子(AP2 / ERF)TF系列[31那32那33那34].BHLH TFS与植物的主要和专业代谢物密切相关。植物色度相互作用因子3(PIF 3),BHLH TF,通过激活花青素生物合成基因的转录来呈正调节花青素生物合成拟南芥[35]. SlAN1和SlPIF1a调节番茄花青素和类胡萝卜素的生物合成,而SlPRE2则负调控果实色素的积累[36那37那38]. bHLH蛋白通常通过与TFs如MYB、WD40重复序列(WDR)和乙烯反应因子(ERF)相互作用来调节次级代谢产物的生物合成[39那40那41那42那43].BHLH TFS与MYB蛋白物理相互作用,并促进他们对植物中的花青素生物合成的调节。Pacmyba通过激活启动子,用几种与甜樱桃中的花青素生物合成的多种花青素生物合成进行了物理相互作用PacDFR公司那PacANS和包装[39].AtTT8与MYB蛋白PRODUCTION OF ANTHOCYANIN PIGMENT1/PRODUCTION OF ANTHOCYANIN色素(PAP1/PAP)和TRANSPARENT TESTA2 (TT2)相互作用,调节花青素和原花青素的生物合成拟南芥[44那45].Rosea1 (ROS1, MYB型)和Delila (DEL, bHLH型)共同调控番茄花青素的生物合成[46].在辣椒中,CaMYC与CaMYB和CaWD40结合,通过调节一个合成基因的转录调控花青素的生物合成[40].MyB和BHLH TFS之间的物理相互作用和调节协同作用由MYB蛋白的R3结构域和BHLH蛋白中的N-末端区域介导[45那47那48那49].此外,BHLH介导的ERF TFS调节生物碱的合成,例如Terpenoid Indoles生物碱[42]、糖苷生物碱[41]和尼古丁[43].Capsorubin和辣椒素是严格的生物合成的辣椒,它具有高经济和营养价值。我们以前的研究证实,MyB31,MyB108和MyB48参与衣壳生物合成[1那12那50那51].具体而言,主控调控子MYB31启动子的自然变异可以影响不同类型辣椒素的含量辣椒物种[1那50].然而,是否将辣椒素和辣椒素化生物合成,并通过与MYB的相互作用或其他TFS进行协调胶囊化生物合成的调节。
在本研究中,bHLH家族基因在Capsicum Annuum.基因组。参考基因组C一年生植物测序(2n = 2倍 = 经19mer分析,其基因组大小为3.48gb[52]. 为了更好地了解候选bHLH-TFs在调控辣椒种特异性代谢产物生物合成中的潜在生物学功能,对bHLH家族成员进行了系统的特征分析。辣椒素的生物合成受到环境因素的影响,如水、温度和光照[53].较高的温度有利于总衣壳的积累[53].BHLH TFS响应温度山茶[26] 和拟南芥[54].因此,还响应于不同的温度研究候选BHLH TFS。此外,通过Y2H分析了BHLH TFS和MYB31之间的相互作用。本研究为辣椒类类动物骨膜和辣椒生物合成途径提供候选BHLH TFS。
结果
鉴定和染色体定位bHLHs公司在胡椒里
排除冗余序列后,共鉴定出107个bHLH蛋白C一年生植物利用隐马尔可夫模型(HMM)分析HLH结构域(PF00010)。如表所示S1,均鉴定出CabHLH蛋白编码190-940个氨基酸残基。这些蛋白的分子量(Mw)在21.61 ~ 106.70 kDa之间,理论pI在4.60 ~ 9.91之间。
107.CabHLHs被更名为CABHLH001来CabHLH107并根据染色体位置将其映射到辣椒染色体上(图S2). 它们分布在12条染色体上。01号染色体含有最多的Cabhlh.会员(18)。染色体05和09包括三个Cabhlh.成员,分别。然而,基因来自CABHLH092来CabHLH107没有位于任何染色体上。由于测序和组装技术限制,位于某些支架中的基因未组装成染色体。
BHLH结构域的保守氨基酸残基
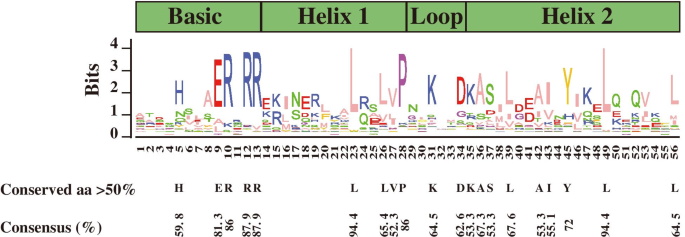
BHLH结构域的氨基酸序列用于进行多个对准分析(图S3).结果表明,BHLH家族蛋白具有保守的BHLH域,其中包含基本,第一螺旋,环路和第二螺旋区域。如图1所示。1,将20个氨基酸残基保守,共有比例大于50%,并且在保守的BHLH结构域中的共有比75%的共有比例保守了六个氨基酸残基。在基本地区保存了五个残基(他-5,Glu-9,Arg-10,Arg-12)。在第一个螺旋地区保存了四个残基(Leu-23,Leu-26,Val-27和Pro-28)。Lys-31和Asp-34在环形区域和九个残基(Lys-35,Ala-36,Ser-37,Leu-39,Ala-42,Ile-43,Tyr-45,Leu-49和Leu-49和Leu-56)在第二个螺旋地区保守。辣椒中107个BHLH蛋白质中的残留物Leu-23和Leu-49极为保守。
BHLH家族蛋白的系统发育分析
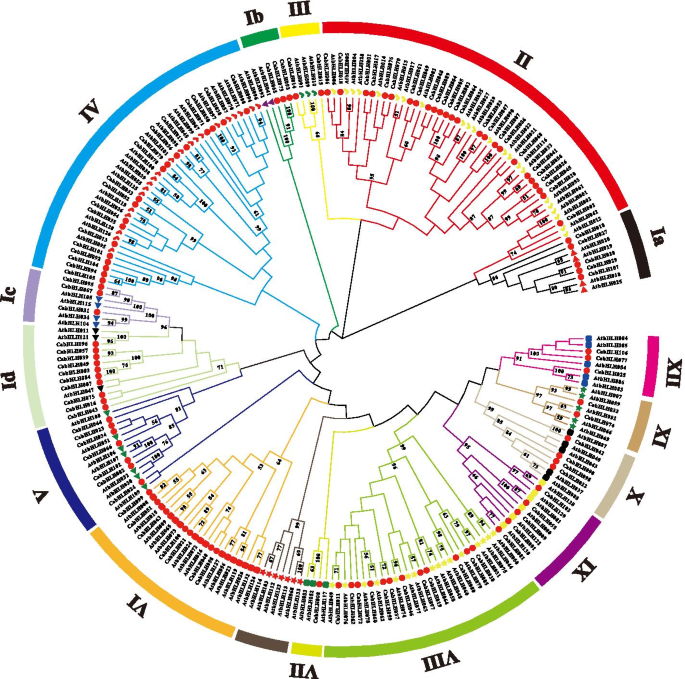
为了对CabHLH蛋白进行分类,建立了一棵系统发育树,该树包含了辣椒中所有已鉴定的bHLH蛋白序列拟南芥用邻近加入方法构建(图。2).根据前一项研究中的Atbhlhs的分类[21], CabHLH蛋白分为15个亚家族,命名为I ~ XII族。组II中CabHLH蛋白最多(25个),AtbHLHs蛋白最多(13个),而组VII中CabHLH蛋白最多(1个),AtbHLH蛋白最多(3个)。同一类群中CabHLHs和AtbHLHs蛋白数量的不同,可能是由于在植物进化过程中bHLH家族的复制不均等造成的。
研究了bHLH家族成员的系统发育树辣椒和拟南芥.不同颜色的分支表示不同的子组。红色圆圈代表了cabhlh蛋白。不同的颜色和形状代表了先前研究中鉴定的不同的atbhlh蛋白组[21]. 棕色的分支表明没有CabHLH蛋白
同一群体的成员可能具有相似的生物学功能。为了对CabHLHs的生物学功能进行初步推测,我们利用中所有bHLH蛋白构建了另一种邻域连接系统发生树拟南芥,西红柿,米饭和胡椒(图S4).AtbHLHs和SlbHLHs的功能特征已在文献中报道和总结,并将这些功能特征用于评价同一组CabHLH的潜在功能(TableS2). 第六组SlPIF1a对番茄类胡萝卜素的合成具有光依赖性调控作用[38]. SlPIF1a映射到CABHLH051在辣椒,也被分为六世组。这些结果表明,VI组的成员可能参与类胡萝卜素生物合成。
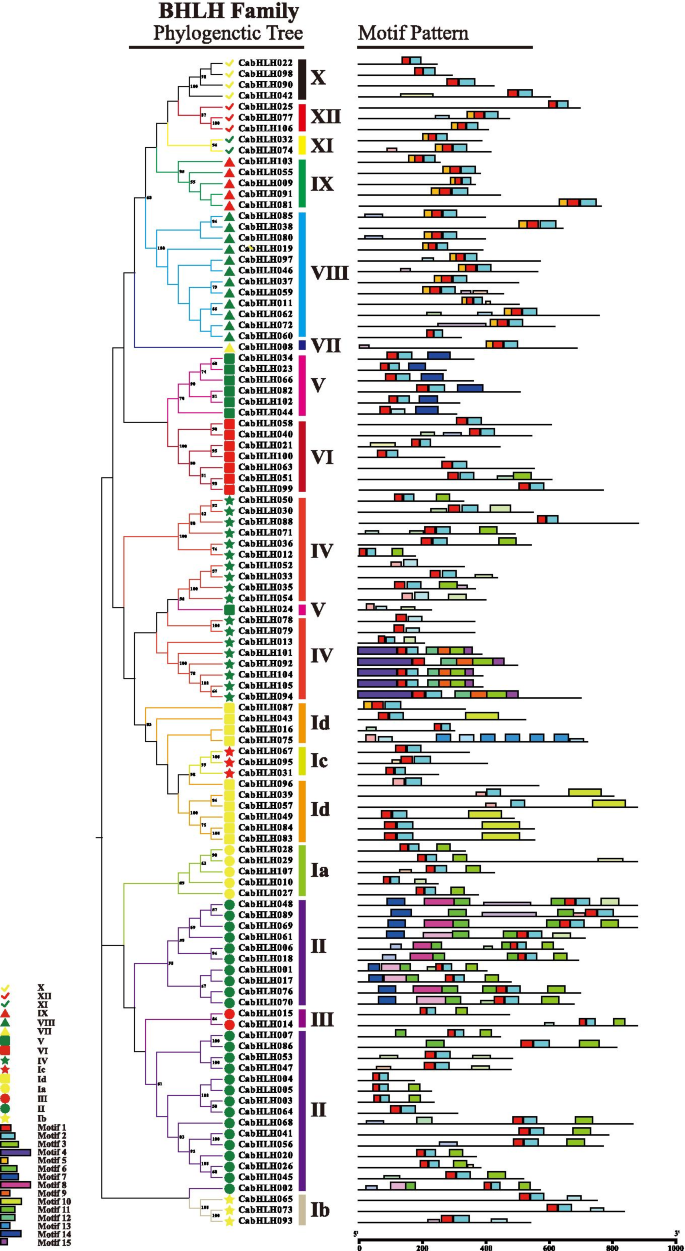
CABHLH蛋白保守基序分析
为了研究CabHLH蛋白的结构特征,我们使用多重EM for Motif Elicitation (MEME)组件对其保守的氨基酸基序进行了分析和鉴定。motif 1 ~ 15共发现15个包含21 ~ 100个残基的保守motif。主题信息见表S3. 基序1和基序2位于bHLH结构域区域,出现在所有蛋白质中。基序3~15分布于bHLH结构域外。基序6、7、8和11主要局限于第二组。第四组中有9、12和15个基序,第二组中有10和13个基序,第五组中有14个基序。一般来说,同一组的大多数蛋白质在排列和位置上具有共同的基序(图。3.).
的表达谱CabHLHs在果皮和胎盘的不同发育阶段
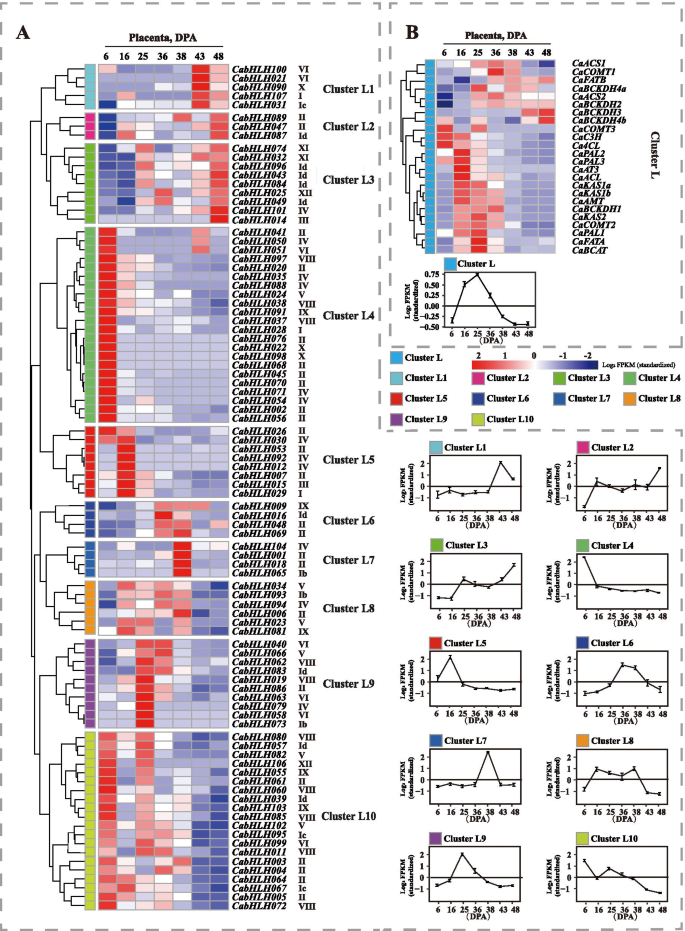
辣椒果实中含有辣椒素和辣椒素,与发育阶段生物合成基因的转录水平密切相关。为了进一步了解CabHLHs在辣椒素和辣椒素生物合成过程中的潜在功能,研究了CabHLHs的表达谱CabHLHs在不同的发育中,研究了Pericarp和胎盘。从Kim等人获得RNA-SEQ原始数据。[52[3,16,25,36,38,43和48天,后波动后(DPA)阶段(图。4.和5.). 所有原始读取都被拼接并重新映射到C一年生植物基因组。
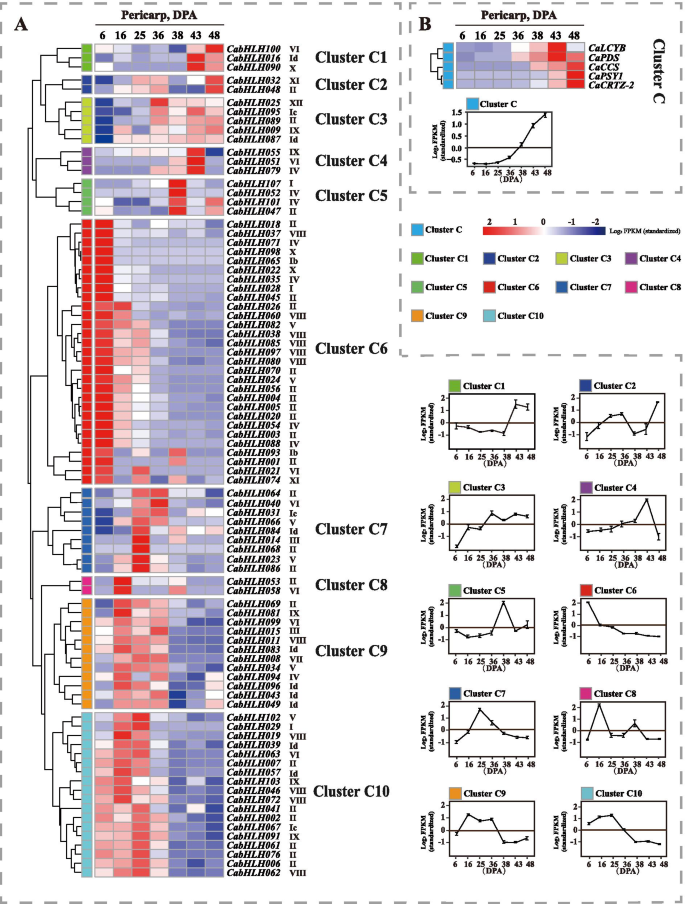
如图1所示。4.B,胶囊素生物合成基因的表达水平在36dPa逐渐增加,这与钙霉素组织中辣椒素的累积曲线一致。共有20个表达Cabhlh.基因检测不到。这些基因可能在果皮发育的不同阶段转录水平较低。根据表达谱的相似性,所有Cabhlh.不同发育终端阶段的表达分布在分层聚集并分为10个簇(图。4.a) 是的。表达谱CabHLHs在簇C1至C4中,与辣椒素生物合成基因的表达谱保持良好的一致性。簇C1至C4的成员可能与辣椒素生物合成相关。
在胎盘的发育阶段中,辣椒素含量从13至25dPa大量产生,并且在该阶段期间辣椒化合物生物合成基因的表达水平高(图。5.b)。基于表达谱的相似性,将不同发育胎盘阶段的所有CABHLH的表达分层聚集成10个簇(图。5.a) 是的。在无法检测到的低水平中表达了总共16个基因。表达概况CabHLHs簇L5、L6、L8和L9与辣椒素生物合成基因的表达谱相似。因此,这些结果表明簇L5、L6、L8和L9的成员可能与辣椒素的生物合成有关。
此外,辣椒素和辣椒素主要产生于辣椒的果皮和胎盘组织。确认是否CabHLHs在果皮和胎盘组织中特异性表达,研究了所有已鉴定的CabHLHs在不同组织(包括叶、根、茎、果皮和胎盘)中的表达谱。然而,Kim等人上传的RNA-Seq原始数据并不包含辣椒的叶、根或茎组织[52].这些组织的RPKM值,映射到1.5版C一年生植物基因组,直接在线发表。热图表示CabHLHs在某些组织中没有特别表达(图S5).据推测,除调节胶囊素和辣椒素生物合成外,这些TFS策划了功能。
参与胶囊素和辣椒化合物生物合成的候选BHLH基因的验证
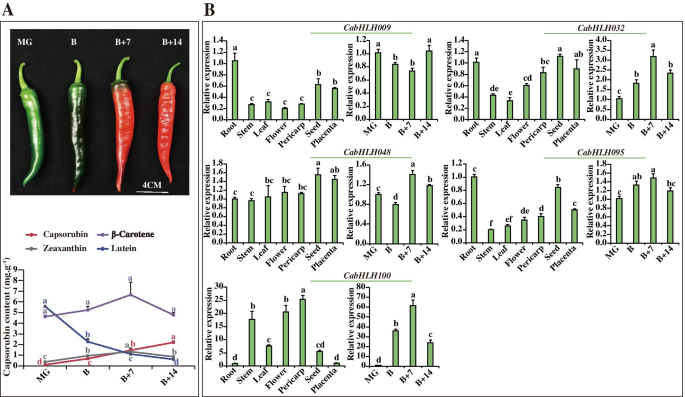
的表达式配置文件进一步验证CabHLHs在果皮和胎盘中,有10个CabHLHs从可能与辣椒素和辣椒碱生物合成相关的候选簇进行QRT-PCR分析。所选基因在不同的发育果皮或胎盘组织中相对高度表达。如图1所示。6.a,玉米蛋白和胶囊素的含量从果皮组织中的mg阶段增加,而非合成胶囊素分支的叶黄素含量降低。在不同的发育终端组织中未注意到β-胡萝卜素含量的显着差异。卡布勒H032那CABHLH048那CABHLH095和CabHLH100类胡萝卜素(玉米黄质和capsorubin)在果皮中的表达与积累谱一致CABHLH009叶黄素在果皮中的表达与积累规律相似。然而,这些基因在其他组织(根、花、茎、胎盘、叶和种子)中也有高表达。6.b) 是的。因此,C1、C2和C3簇的成员很可能与capsorubin生物合成有关,但在其他组织中也具有其他特定功能。
5种表达谱CabHLHs在不同的组织和果皮的发育阶段。一种.β-胡萝卜素、玉米黄质的表型及含量。果皮发育的四个阶段,即成熟绿期(MG)、破碎期(B)、破碎加7d期(B + 7)和破碎加14d期(B + 14) [34].B..五个表达CabHLHs不同组织(茎、根、种子、花、叶、果皮(B)和胎座(16 DPA))和4个不同的果皮阶段。数字中不同的字母表示显著不同的数值(P. < 0.05, Tukey’s test). Three biological replicates of all tissues and developmental pericarp stages were performed with three technical replicates of each biological replicate
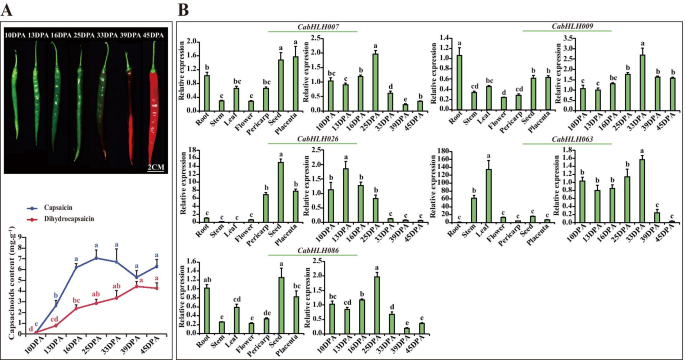
辣椒素和二氢胶囊最初在10dPa下产生,在胎盘组织中达到25dPa,然后逐渐降低(图。7.a) 是的。CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086辣椒素在胎盘不同发育阶段的表达与积累谱相似。的高表达水平CabHLH026型在果皮、种子和胎盘组织中均有高表达CABHLH063在茎和叶中很明显。CABHLH007那CABHLH009和CABHLH086在某些组织中高度表达(图。7.b)。所以,CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086L5、L6和L9可能与辣椒素的生物合成有关。
表达五CabHLHs在不同的组织和不同的发育胎盘阶段。一种.7个胎盘发育阶段(DPA 10、13、16、25、33、39、45)的表型(上升)和辣椒素、二氢辣椒素含量(下降)[34].B..五个表达CabHLHs在不同的组织中(根,茎,叶,花,种子,胎盘(16dPa)和Pericarp(16dPa))和七种不同的发育胎盘阶段。图中不同的小写字母表示值显着不同(P. < 0.05, Tukey’s test). Three biological replicates of all tissues and developmental placental stages were performed with three technical replicates of each biological replicate
候选人的表达CabHLHs与辣椒化合物生物合成相关,响应于不同的温度
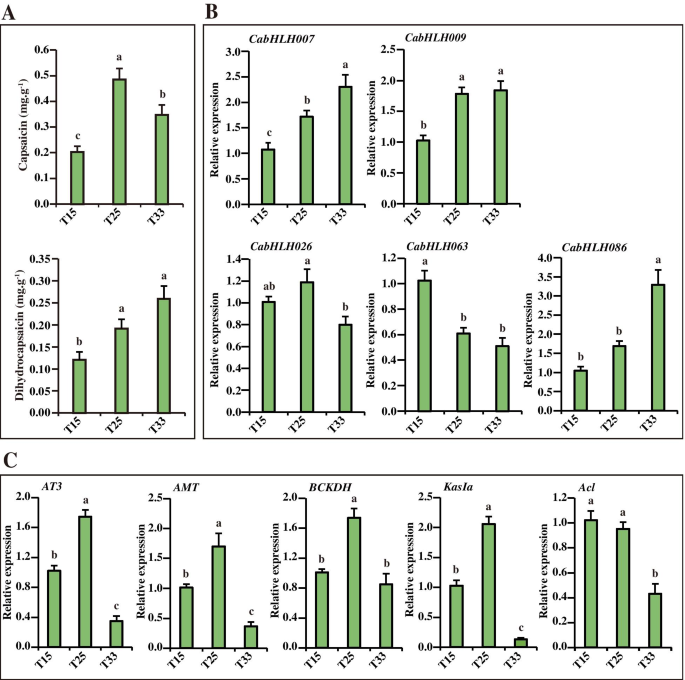
初步了解辣椒素生物合成是否受到监管Cabhlh.基因响应不同的温度,五个候选人的表达CabHLHs并测量不同温度下的五种重要胶囊化生物合成基因。如图1所示。8.A,辣椒素和二氢淀粉蛋白含量随着从T15至T25的升高而增加而增加。与T33治疗的辣椒相比,胎盘衣膜蛋白含量显着增加。CABHLH007那CABHLH009和CABHLH086表达随着温度的增加而增加,其类似于二氢普苷的积累(图。8.b)。CabHLH026型在T25高表达,这与辣椒素的积累和辣椒素类生物合成基因的表达一致(AT3那AMT那BCKDH和KasIa)(图。8.Bc) 是的。相反,CABHLH063表达随着温度的增加而降低,与胶囊化生物合成基因的表达谱保持一致ACL.(图。8.B;C)。因此,CABHLH007那CABHLH009和CABHLH086表达与二氢辣椒素含量和温度的增加呈正相关。CABHLH063表达与辣椒素含量和温度的增加呈负相关,而CabHLH026型表达与这些因素呈正相关。这些候选基因可能通过调节胶囊化生物合成基因的转录来响应不同温度的辣椒素生物合成。
辣椒素含量(辣椒素和二氢胶囊)和基因表达响应于不同的温度。一种.辣椒素和二氢皮淀蛋白响应不同温度的含量[34].B..五个表达Cabhlh.S响应于不同的温度。C.胶囊化生物合成基因对不同温度的表达。图中不同的小写字母表示值显着不同(P. < 0.05, Tukey’s test). Three biological replicates of all developmental placental stages were performed with three technical replicates of each biological replicate. T15 = 15℃, T25 = 25℃, and T33 = 33℃
候选CABHLHS和MYB31在酵母中的相互作用,鉴定的BHLH结合位点
bHLH蛋白通常与基因启动子的E-box结合位点结合并调控转录。为了研究bHLH转录因子与途径生物合成基因的潜在关联,我们选取了capsorubin和辣椒素生物合成基因起始密码子(ATG)上游的1500个碱基对核苷酸序列,包括CCS那ps那β-CH.那β-lcy.那ACL.那AMT那AT3那Bact,Bckdh.那COMTA.那法塔和KasIa使用PlantCARE数据库进行分析[55].如表所示S7,除了用于的胶囊素和辣椒素生物合成基因的启动子中,检测到多个BHLH DNA结合位点,除了CCS那β-CH.和KasIa.
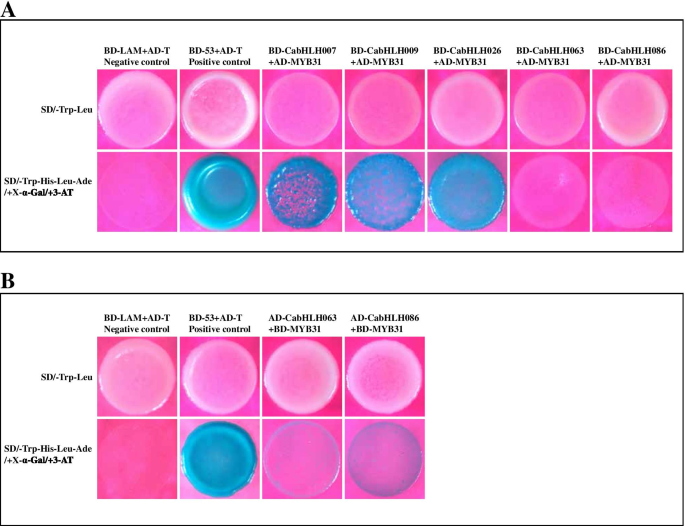
BHLH蛋白始终通过与其他TFS交互来执行功能,例如MYB。我们执行了Y2H测定以验证候选CABHLHS和CAMYB31之间的相互作用。结果表明,这些BHLH以基因依赖性方式与MyB31相互作用。CABHLH007,CABHLH009,CABHLH026,CABHLH063和CABHLH086可以在异源系统中与MYB31相互作用。CABHLH026在酵母中强烈相互作用,而仅在CABHLH063-CAMYB31和CABHLH086-CAMYB31组中观察到弱相互作用(图。9.).因此,CabHLH可能通过与CaMYB31相互作用来调控辣椒素的生物合成。
讨论
Bhlh家族已成为植物中第二大TF家族[48].该家庭已成功识别并在许多植物中调查,包括Solanum Tuberosum L.(124)[24],茶树(l)o . Ktze。(120) (26],茄属植物lycopersicum(159)[30.],Zea Mays.L..(208)[28],Brassica Rapa pekinensis.(230) (27],拟南芥(147)[15],大豆(L.)莫尔.(319) [56],Malus Pumila.(188) (57] 和栽培稻L..(167)[22].在本研究中,在辣椒基因组中鉴定了107个CabhlH基因。保守的BHLH域包括基本,第一螺旋,环和第二螺旋区域,其包含大约60个氨基酸[22]; 在辣椒中也观察到了这种结构(图1)S3).用20%的共分比例保守20个氨基酸残基(图。1),与前一项研究一致[21]. Glu-9、Arg-12和Arg-13的保守率大于80%,而Leu-23和Leu-49在107个CabHLH蛋白中极为保守(图。1). 先前的研究证实Glu-13和Arg-16/Arg-17(对应于本研究中的Glu-9和Arg-12/Arg-13;图。1)在DNA结合中发挥了重要作用[58].Leu-27和Leu-61(对应于本研究的Leu-23和Leu-49;无花果。1)对于二元化是必要的[23].Glu-13和Arg-16(本研究对应Glu-9和Arg-12;无花果。1)recognize the E-box (5’-CANNTG-3’), whereas the His/Lys-9, Glu-13 and Arg-17 (corresponding to His-5, Glu-9 and Arg-13 in this study; Fig.1)被绑定G-Box(5'-cacgtg-3')所需的[19那59].
根据前一项研究[21[phylo到期树分为15个亚组(图。2),类似于马铃薯的分类[24]. 位于bHLH结构域的基序1和基序2包含在所有CabHLH蛋白中(图。3.),与观察MDBHLH蛋白的观察一致[57].含有一些保守氨基残基的图案1和2在DNA结合和蛋白质二聚化中起重要作用[23那58].3 ~ 15个基序分布在bHLH结构域外,随机排列在CabHLH蛋白中(图1)。3.).结果表明,同一类群的成员在多数情况下具有相同的基序排列。
同源基因在植物生长发育过程中具有相似的功能[60.]. 在功能上确定了II组和VI组中的一些SLBHLH和ATBHLH(表S2).Myc2与MyB TFS相互作用以调节硫代葡萄糖生物合成[61.并对脱落酸产生反应[62.]、茉莉酸[63.]和光信号[64.在拟南芥.透明Testa8(TT8),Glabra3(EGL3)的Glabra3(Gl3)和增强剂与MyB和WDR TFS联合可以调节花青素生物合成和培养拟南芥[65.那66.那67.].这些蛋白质在第II族(图S4).II组中的一些SLBHLH也参与了花青素生物合成[36]毛发发育[68.]并反应冷,渗透和盐胁迫[69.].此外,Myc2与ERF TFS相互作用,以调节生物碱的生物合成,例如甾体甘油脂碱[41]萜类吲哚生物碱[42]和尼古丁生物合成[43].对辣椒MYC2的同源基因进行了定位CABHLH006和CabHLH018型,所有的蛋白质被归类为II类(图S4).这些结果表明,II组可能与植物中的次级代谢物,发育和信号响应过程有关。此外,PIF 3与Bzip TF组合可以调节花青素生物合成[35].PIFS作为蜂窝信令集线器,通过集成多个信号来调节植物生长和发展期间的转录网络[70].SLPIF1A包含在番茄中的VI组和规范的类胡萝卜素生物合成中[38].这些PIF的同源基因被映射到CABHLH063和CABHLH051在辣椒中,CabHLH蛋白位于第六组,第二组和第六组CabHLH蛋白可能通过与其它TFs相互作用来调控次生代谢产物的合成。
表达概况CabHLHs在簇C1,C2,C3和C4中与胶囊素生物合成基因的表达保持良好的一致性(图。4.).表达概况CABHLH009那卡布勒H032那CABHLH048那CABHLH095和CabHLH100从这些簇与胡萝卜素,包括玉米蛋白,叶黄素和辣椒素,包括胃癌,在Pericarp中对齐(图。6.).因此,这些簇的成员可能与capsorubin的生物合成有关。表达概况CabHLHs在簇L5,L6,L8和L9中类似于胶囊化生物合成基因的表达谱(图。5.).CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086表达谱与胎盘中辣椒素的积累谱一致。7.).这些结果表明,簇L5,L6和L9的成员可能调节胶囊蛋白生物合成。此外,基因的类似转录物水平表明它们在某些情况下它们可能在某些情况下进行类似的功能。Camyc与Camyb和Cawd40结合调节花青素生物合成[40]并被映射到CabHLH0016在簇C1中(图。4.).众多研究报道了MyC2通常通过与ERF TFS相互作用来调节生物碱性生物合成[41那42那43]和ERF-TFs与辣椒素的生物合成有关辣椒[34那71.].MYC2定位于两个同源基因CabHLH006和CabHLH018,分别划分为L8和L7簇。L8簇的表达谱与辣椒素生物合成谱保持良好的一致性。SlPIF1a与番茄类胡萝卜素的生物合成有关[38],并映射到CABHLH051在胡椒中,被归类为C4簇。在本研究中,C4簇成员是类胡萝卜素生物合成的候选调控因子。聚类C1、C2、C3、C4、L5、L6、L8和L9成员可能与类胡萝卜素和辣椒素的生物合成有关。
环境因素对次生代谢物的生物合成至关重要。以前的研究表明bHLH TFs对热响应山茶和拟南芥[26那72.].PIFs作为信号中心,整合多种信号来调节植物的生长和发育,包括高温和光[70]. PIF同源基因CabHLH063的表达及意义ACL.随着温度的增加而降低。表达CabHLH026型和四种胶囊化生物合成基因(即,AT3那AMT那BCKDH和KasIa)在T25中达到峰值,其类似于辣椒素累积(图。8.C)。这些结果表明,簇L5,L6和L9的成员可能在调节胶囊素生物合成时具有不同的功能,以应对不同的温度。此外,通过与其他TFS相互作用,BHLH蛋白通常涉及植物代谢途径[39那41那42那43那44那45那46].MYB TFS在辣椒化生物合成中发挥了关键作用,如先前的研究所证明的[1那12那50那51].Y2H测定显示CabhlH007,CabHLH009,CabHLH026,CabHLH063和CabHLH086可以在异源系统中与MyB31相互作用。这些结果暗示CABHLH007,CABHLH009,CABHLH026,CABHLH063和CABHLH086可以通过与MYB31相互作用来参与辣椒蛋白生物合成。
结论
在辣椒中鉴定出107个CabHLH蛋白。根据蛋白质的分类将这些蛋白质分为15组拟南芥.所有CABHLHS中出现了包含基序1和2的BHLH保守域。表达曲线显示,簇C1,C2,C3,C4,L5,L6,L8和L9是用于调节类胡萝卜素和辣椒化合物生物合成的候选者。CABHLH009那卡布勒H032那CABHLH048那CABHLH095那CabHLH100那CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086从候选簇中选择,因为它们可能有助于类胡萝卜素和辣椒素的生物合成。CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086可能对不同的温度响应于介导辣椒蛋白生物合成。CABHLH007,CABHLH009,CABHLH026,CABHLH063和CABHLH086可能通过与MYB31相互作用来控制胶囊化生物合成。然而,进一步的研究表明这些候选BHLHS如何调节类胡萝卜素和辣椒碱生物合成。
方法
的识别bHLH辣椒及其染色体位置
从中检索了BHLH蛋白质序列C一年生植物“CM334”基因组(73.]使用从PFAM数据库获得的HLH域(PF00010)的HMM概要[74.].使用HMMER软件对冗余序列进行过滤[75.],智能数据库[76.]及NCBI保存域名检索服务(光碟检索)[77.].Expasy Server [78.]预测蛋白质的氨基酸序列全长、分子量(MW)、PI和不稳定性指数。对应信息如表所示S1. 基因座的染色体位置是从辣椒基因组2.0版获得的。根据染色体位置,所有的Cabhlh.连续更名。
多次对准和系统发育分析
利用辣椒、水稻、番茄和番茄4种植物bHLH结构域的保守序列进行多序列比对拟南芥.使用带有默认参数的ClustalX 2.1执行对齐。bHLH蛋白序列拟南芥(131)来自拟南芥信息资源(TAIR)数据库[79.],而水稻(144)和番茄(145)中的BHLH蛋白序列是从工厂获得TF数据库版本4.0 [80].所有这些BHLH蛋白质序列都在表中重命名并列出S4.邻域连接系统发生树是用MEGA X生成的,bootstrap复制1000次[81.]并使用EvolView v3可视化[82.].
蛋白质主题分析
利用模因分析工具对保守和功能基序进行分析[83.根据Song等人的参数[34].
RNA序列数据和表达谱Cabhlh.S.
候选cabHLH的FPKM值来自胡椒RNA序列原始数据(GenBank:AYRZ00000000)[84.那85.].用R语言绘制了7个不同发育性胎盘和果皮组织(6 ~ 48个DPA)的基因表达谱热图。
植物材料和温度处理
59近交线(Capsicum Annuum.)被建军雷教授验证(华南农业大学园艺学院)用于实验[1]. 这个品种的品种权属于我们实验室。如果有人需要这个自交系,他们可以从相应的作者那里获得。本研究所用的植物材料均由华南农业大学提供。根据机构、国家和国际准则,这些样本不需要特定的研究许可。以泥炭、珍珠岩、椰壳为混合基质,在35℃/23℃(昼/夜)的环境条件下,在塑料大棚内播种;12h/12h(光/暗循环),300-1000μmol·m-2·年代-1光合光子磁通密度(PPFD)在上午12:00。根据我们之前研究的方法收集用于RNA提取的样品[34].
使用如上所述的混合物底物也培养用于温度处理实验的辣椒。如前所述进行温度处理和样品收集[34].所有样品均用三种生物学重复进行,每种生物复制一次进行一种技术复制。
实时定量PCR(qRT-PCR)分析
根据Song等人进行总RNA和RNA逆转录的分离和提取。[34].使用底漆5.0设计QPCR的引物(表S5).策略(A)结合蛋白(CA00g52140)和泛素延伸蛋白(CA12g20490型)转录组研究表明,它们的转录水平在不同组织和植物的不同发育阶段是相当稳定的辣椒[52].根据Wang等人进行QRT-PCR。[86.]. 它们的相对表达式Cabhlh.使用2−ΔΔCt方法[87.].每个生物重复进行3次技术重复,所有样本均进行3次生物重复。Dunnett的T.-采用spss22统计软件对结果进行显著性检验。
酵母2台混合动力分析
的全长cdnaCABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086被克隆到PMD19-T Vector(6013,Takara,中国)。放大的全长碎片CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086使用一步克隆(C112,Vazyme,China)分别连接到PGADT7和PGBKT7载体中。将含有不同CabhlH的阴性和阳性质粒和质粒转化为AH109酵母菌菌株(YC1010,Weidi Biotechnology,中国)。根据制造商的指示(CLONTECH)进行Y2H测定。使用Adobe Illustrator CS2020执行图像处理。所有引物都列于表中S6.
发起人CIS.有效的发现
BHLH蛋白的基区可以与E-Box(Canntg)结合。在辣椒素生物合成基因的起始密码子上游一千五百个基对核苷酸序列(CCS那ps那β-CH.那β-lcy.)和辣椒素(ACL.那AMT那AT3那Bact,Bckdh.那通信那法塔和KasIa)从C一年生植物基因组并应用于电子箱发现。这CIS.- 通过使用PlantCare数据库来识别 -http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
数据和材料的可用性
本研究中产生或分析的大多数数据都包含在本文及其补充文件中。本研究中使用和分析的测序数据(GenBank:ayrz0000000)可在NCBI数据库(doi:10.1038/ng.2877)中获得。
缩写
- TFs公司:
-
转录因素
- 颜色:
-
染色体
- FPKM:
-
每千碱基中的片段每百万次读取
- bHLH:
-
基本螺旋循环螺旋
- HLH:
-
螺旋-环-螺旋
- 模因:
-
多重EM主题启发
- 隐马尔可夫模型:
-
隐马尔可夫模型
- GGPP公司:
-
焦磷酸甘油烷基
- Psy:
-
植物合成酶
- PD:
-
植物去脱离酶
- LCYB公司:
-
番茄红素β-环酶
- 朋友:
-
苯丙氨酸解氨酶
- COMT:
-
咖啡酸O-甲基转移酶
- AT3:
-
推定的酰基转移酶
- CCS:
-
辣椒红/辣椒红素合酶
- CS:
-
辣椒素合成酶
- ZDS:
-
ζ - 胡萝卜素去饱和酶
- Crtiso:
-
类胡萝卜素异构酶
- LCYE公司:
-
番茄红素ε环化酶
- CRTZ-2:
-
β-胡萝卜素羟化酶-2
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- C4h:
-
肉桂醛4-羟化酶
- 4CL:
-
4-香豆酰基CoA连接酶
- HCT:
-
Hydroxycinnamoyl转移酶
- C3H型:
-
p-coumaroyl shikimate / quate 3-羟化酶
- 通信:
-
Caffeoyl-CoA 3-O-methyltransferase
- 六氯环己烷:
-
Hydroxycinnamoyl-CoA水合酶裂解酶
- AMT:
-
转氨酶
- BCAT公司:
-
支链氨基酸氨基转移酶
- 卡斯:
-
Ketoacyl-ACP合成酶
- ACL:
-
酰基载体蛋白
- FatA:
-
酰基ACP硫酯酶
- 分区:
-
黄色假期
- MG:
-
成熟的绿色舞台
- B:
-
断路器
- B + 7:
-
断路器加7天
- B + 14:
-
断路器加14天
- 世界发展报告》:
-
WD40-repeat
- ERF:
-
乙烯响应因子
- PAP1 / PAP:
-
生产花青素颜料1 /生产花青素颜料
- TT2:
-
透明testa2
- AP2 / ERF:
-
Apetala2 /乙烯反应的因素
- PIF3:
-
光敏相互作用因子3
- TT8型:
-
透明testa8
- GL3:
-
glabra3.
- 埃及文3:
-
增强剂的glabra3
- 第二年:
-
酵母双杂交分析
- PPFD公司:
-
光合光子磁通密度
参考文献
- 1
关键词:MYB, MYB,转录因子,自然变异myb31确定极端刺激性辣椒的演变。新植物。2019; 223(2):922-38。
- 2
Sharma SK,Vij As,Sharma M.辣椒素的机制和临床用途。EUR J Pharmacol。2013; 720(1-3):55-62。
- 3.
Spiller F,Alves MK,Vieira Sm,Carvalho Ta,Leite Ce,Lunardelli A,Poloni Ja,Cunha FQ,De Oliveira Jr。红辣椒的抗炎作用(Capsicum Baccatum.)在角叉菜胶和抗原诱导的炎症上。J pharm pharmacolol。2008; 60(4):473-8。
- 4.
Melendez-Martinez AJ。农业食品、营养、健康和疾病中的类胡萝卜素、类伪胡萝卜素和维生素A概述。Mol Nutr Food Res. 2019;63(15):e1801045。
- 5.
戈麦斯LM、佩蒂托N、科斯塔VG、法尔考DQ、德利马AK。红椒色素与β-环糊精包合物的制备、表征及在酸奶中的应用。食品化学。2014;148:428–36.
- 6.
Berry HM、Rickett DV、Baxter CJ、Enfissi E、Fraser PD。红辣椒果实中类胡萝卜素的合成与积累及其对色泽性状的影响。J Eep机器人。2019;70(10):2637–50.
- 7.
Guzman I,Hamby S,Romero J,Bosland PW,O'Connell MA。橙色色素类生物合成的变异性辣椒SPP。植物SCI。2010; 179(1-2):49-59。
- 8.
富士武H,铃木T,IWAI K.辣椒素的细胞内定位及其类似物辣椒水果II。作为原生质体中辣椒素内岩体累积部位的液泡辣椒水果。植物细胞生理。2006; 21(6):1023-30。
- 9.
里夫斯G,博斯兰PW,库恩D.'特立尼达莫鲁加蝎子辣椒是世界上最热的辣椒,超过200万斯科维尔热量单位。钟表技术。2012;22(4):534–8.
- 10
Carle R,Schieber A,Schweigget U。辣椒荚中主要和次要辣椒素及其相关化合物的表征(辣椒高效液相色谱/大气压化学电离质谱法。肛交行为。2006;557(1/2):236–44.
- 11
CJ Stewart BC Kang K Liu M Mazourek SL Moore EY Yoo BD Kim I Paran MM Jahn 2005 ThePUN1.辣椒辣味基因编码一种可能的酰基转移酶植物j425688
- 12
孙乙、朱兹、陈丙、陈庚、曹乙、陈丙、雷杰。茉莉酸诱导的R2R3-MYB转录因子调控辣椒素合成和雄蕊发育辣椒.农业化学学报。2019;67(39):10891-903。
- 13
崔H,Yu Y,Jo Yd,Ahn Hk,Park B,Yeam I,Kim K,Park J,Choi Yd,Park M.辣椒的基因组序列为扭矩的演变提供了洞察力辣椒物种。纳特·吉内特。2014;46(3):270–8.
- 14
Ledent V,Vervoort M。基本螺旋-环-螺旋蛋白家族:比较基因组学和系统发育分析。基因组研究,2001年;11(5):754–70.
- 15
Toledo-Ortiz G, Huq E, Quail PH. The拟南芥基本/ Helix-Loop-Helix转录因子系列。植物细胞。2003; 15(8):1749-70。
- 16
Murre C,McCaw PS,巴尔的摩D。免疫球蛋白增强子结合、无子、MyoD和myc蛋白中的一个新的DNA结合和二聚基序。牢房。1989;56(5):777–83.
- 17
Atchley WR,Terhalle W,衣服A.在BHLH蛋白质结构域中的位置依赖性,群体和预测基序。J Mol Evol。1999; 48(5):501-16。
- 18
Massari Me,Murre C. Helix-Loop-Helix蛋白质:核心化生物中的转录调节器。Mol细胞Biol。2000; 20(2):429-40。
- 19
Ferre-d'amare Ar,Pognonec P,Roeder Rg,Burley Sk。USF的B / HLH / Z结构域的结构和功能。Embo J. 1994; 13(1):180-9。
- 20.
Morgenstern B,休息室。BHLH转录因子的演变:域洗片的模块化演变?mol Biol Evol。1999; 16(12):1654-63。
- 21
Heim Ma,Jakoby M,Werber M,Martin C,Weisshaar B,Bailey PC。植物中基本螺旋环 - 螺旋转录因子家族:蛋白质结构和功能多样性的基因组研究。mol Biol Evol。2003; 20(5):735-47。
- 22
关键词:水稻,基本/螺旋-环-螺旋,转录因子,全基因组分析拟南芥.植物理性。2006; 141(4):1167-84。
- 23
cartero - paulet L, Galstyan A, rog - villanova I, Martinez-Garcia JF, Bilbao-Castro JR, Robertson DL。转录因子家族的全基因组分类与进化分析拟南芥杨树、水稻、苔藓和藻类。植物生理学。2010;153(3):1398–412.
- 24
王R,赵P,孔N,Lu R,Pei Y,Huang C,Ma H,Chen Q.基因组 - 覆盖马铃薯BHLH转录因子家族的鉴定与表征。基因。2018; 9(1):54。
- 25
王平,苏力,高H,江X,吴X,李Y,张Q,王Y,任F。葡萄bHLH基因的全基因组特征及其与非生物胁迫耐性和次生代谢产物合成的潜在相关性分析。前植物科学。2018;9:64.
- 26
崔X,王YX,刘ZW,王WL,李H,Zhuang J.转录组型识别和表达谱分析BHLH家族基因山茶.Funct综合基因组学。2018; 18(5):489-503。
- 27
宋晓明,黄锌,段武,任杰,刘天凯,李毅,侯晓丽。大白菜bHLH转录因子家族的全基因组分析(Brassica Rapa.ssp.pekinensis.). 分子遗传学。2014;289(1):77–91.
- 28
张T,LV W,张H,MA L,Li P,Ge L,Li G.基因组 - 玉米基本螺旋环螺旋(BHLH)转录因子家庭的基因组。BMC植物BIOL。2018; 18(1):235。
- 29
王J,Hu Z,Zhao T,Yang Y,Chen T,Yang M,Yu W,张B.番茄黄叶卷发病毒感染的基因组宽分析与番茄黄叶病毒感染(茄属植物lycopersicum).BMC基因组学。2015; 16(1):39。
- 30.
太阳H,风扇HJ,凌总。番茄中BHLH基因家族的基因组鉴定与表征。BMC基因组学。2015; 16(1):9。
- 31
刁W,斯奈德JC,王S,刘杰,潘B,郭G,葛W,达伍德M。辣椒NAC转录因子基因家族的全基因组分析(Capsicum Annuum.L..):染色体定位、系统发育、结构、表达谱、启动子中的顺式元件及相互作用网络。国际分子科学杂志。2018;19(4):1048-61。
- 32
金杰,王米,张hx,汗啊,魏茉莉,罗德克,锣恩。辣椒中AP2 / ERF转录因子家庭的基因组鉴定(Capsicum Annuum.L..).基因组。2018; 61(9):663-74。
- 33
程艳,姚志平,阮美美,叶庆军,王荣强,周国珍,罗军。辣椒WRKY基因超家族的硅质鉴定与鉴定(Capsicum Annuum.L..). Genet Mol Res.2016年;15(3):1–12.
- 34
宋j,陈c,张某,王继,黄z,陈m,曹b,zhu z,雷J.辣椒ERF转录因子家族:鉴定参与物种特异性代谢物调控的调控因子。BMC基因组学。2020;21(1):573.
- 35
Shin J, Park E, Choi G. PIF3以hy5依赖的方式调控花青素生物合成,这两种因子直接结合花青素生物合成基因启动子拟南芥.工厂J. 2007; 49(6):981-94。
- 36
Park J,Nou I,Kim H,Afrin Ks,Kang S,Rahim Ma,Jung H. Zhocyanin生物合成相关基因的表达反映了紫色番茄中的果皮。Hortic Environ Biote。2018; 59(3):435-45。
- 37
朱Z,陈G,郭X,尹W,于X,胡J,胡Z。过表达SlPRE2一种非典型bHLH转录因子影响番茄植株形态和果实色素积累。Sci代表2017;7(1):5786.
- 38
Llorente B,D'Andrea L,Ruiz-Sola Ma,Botterweg E,Purido P,andilla J,Loza-Alvarez P,Rodriguez-Concepcion M.番茄果类胡萝卜素生物合成通过依赖性机制调节至实际成熟的进展。工厂J. 2016; 85(1):107-19。
- 39
沉X,赵k,刘l,张k,袁h,廖x,王q,郭x,李f,李t。紫杉醇在红彩甜樱桃cv中ABA调节的花青素生物合成中的作用。洪邓(甜樱桃L..).植物生理学杂志。2014;55(5):862-80。
- 40
鲁B,Cheng G,Zhang Z,Sun J,Ali M,Jia Q,Luo D,Gong Z,Li D. Camyc,一种新的转录因子,调节色素叶辣椒中的花青素生物合成(Capsicum Annuum.L..).J工厂增长调节。2019; 38(2):574-85。
- 41
Cardenas PD,Sonawane PD,Pollier J,Vanden Br,Dewangan V,Weithorn E,Tal L,Meir S,Rogachev I,Malitsky S. Game9调节植物甲戊二醇盐途径中甾体生物碱和上游异戊二烯的生物合成。NAT Communce。2016; 7:10654。
- 42
张H,Hedhili S,Montiel G,Zhang Y,Chatel G,Pre M,Gantet P,Memelink J.基本Helix-Loop-Helix转录因子CRMYC2控制了己酸酯响应的表达虎鲸调节植物生物碱生物合成的基因Catharanthus Roseus..工厂J1111; 67(1):61-71。
- 43
De Boer K,Tilleman S,Pauwels L,Vanden Br,De Sutter V,Vanderhaeghen R,Hilson P,Hamill JD,Goossens A. Apetala2 /乙烯反应因子和基本螺旋环 - 螺旋烟草转录因子协同介导茉莉蛋白酶引发的尼古丁生物合成。工厂J1111; 66(6):1053-65。
- 44
Baudry A,Heim Ma,DubReucq B,Caboche M,Weisshaar B,Lepiniec L. TT2,TT8和TTG1协同指定了表达班义和原花青素的生物合成拟南芥.植物j . 2004; 39(3): 366 - 80。
- 45
Zimmermann Im,Heim Ma,Weisshaar B,Uhrig JF。全面识别拟南芥与R / B样BHLH蛋白相互作用的MYB转录因子。工厂J. 2004; 40(1):22-34。
- 46
Butelli E,Titta L,Giorgio M,Mock HP,Matros A,Peterek S,Schijlen Eg,Hall Rd,Bovy Ag,罗J.通过表达选择转录因子来促进番茄果实的富集。NAT BIOTECHNOL。2008; 26(11):1301-8。
- 47
Grotewold E, Sainz MB, Tagliani L, Hernandez JM, Bowen B, Chandler VL。关键词:玉米,Myb结构域,bHLH,辅助因子
- 48
Feller A, Machemer K, Braun EL, Grotewold E.植物MYB和bHLH转录因子的进化和比较分析。植物j . 2011; 66(1): 94 - 116。
- 49
Goff sa,锥kc,chandler vl。玉米B基因编码的转录活化剂的功能分析:两类调控蛋白的直接功能相互作用的证据。基因开发。1992年; 6(5):864-75。
- 50
一种R2R3-MYB转录因子调节辣椒素的生物合成。植物杂志。2017;174(3):1359 - 70。
- 51
Sun B,周X,Chen C,Chen C,Chen K,Chen M,Liu S,Chen G,Cao B,Cao F,Lei J.CoExpress网络分析显示辣椒中辣椒生物合成中的MYB转录活化剂。Hortic Res-England。2020; 7(162):1-14。
- 52
Kim S,Park M,Yeom Si,Kim Ym,Lee Jm,Lee Ha,Seo E,Choi J,Cheong K,Kim Kt,Jung K,Lee Gw,Oh Sk,Bae C,Kim Sb,Lee Hy,Kim Sy那Kim MS, Kang BC, Jo YD, Yang HB, Jeong HJ, Kang WH, Kwon JK, Shin C, Lim JY, Park JH, Huh JH, Kim JS, Kim BD, Cohen O, Paran I, Suh MC, Lee SB, Kim YK, Shin Y, Noh SJ, Park J, Seo YS, Kwon SY, Kim HA, Park JM, Kim HJ, Choi SB, Bosland PW, Reeves G, Jo SH, Lee BW, Cho HT, Choi HS, Lee MS, Yu Y, Do Choi Y, Park BS, van Deynze A, Ashrafi H, Hill T, Kim WT, Pai HS, Ahn HK, Yeam I, Giovannoni JJ, Rose JK, Sørensen I, Lee SJ, Kim RW, Choi IY, Choi BS, Lim JS, Lee YH, Choi D. Genome sequence of the hot pepper provides insights into the evolution of pungency in辣椒物种。纳特·吉内特。2014;46(3):270–8.
- 53
Naves Er,De Avila SL,Sulpice R,Araujo WL,Nunes-Nesi A,佩雷斯L,Zsogon A.辣椒:血型超越辣椒.趋势植物SCI。2019; 24(2):109-20。
- 54
董X,严Y,江B,史Y,贾Y,程J,史Y,康J,李H,张D,齐L,韩R,张S,周Y,王X,太沙基W,顾H,康D,杨S,李J。冷响应调节器CBF1拟南芥环境温度下的下胚轴生长。Embo J. 2020; 39(13):E103630。
- 55
Lescot M、Dehais P、Thijs G、Marchal K、Moreau Y、Van de Peer Y、Rouze P、Rombauts S。PlantCARE是一个植物顺式作用调控元件的数据库,也是一个启动子序列电子分析工具的入口。2002年核酸研究;30(1):325–7.
- 56
哈德逊卡,哈德逊我。大豆碱性螺旋-环-螺旋转录因子的分类。国际基因组学杂志。2015;2015(3):603182.
- 57
关键词:苹果,bHLH,转录因子,干旱,盐胁迫植物科学与技术,2017;
- 58
阿奇利,惠誉。基本螺旋-环-螺旋类转录因子的自然分类。美国国家科学院学报。1997;94(10):5172–6.
- 59
清水T、头本A、一原K、清水M、京谷Y、小川N、大岛Y、客岛T。PHO4-bHLH结构域DNA复合物的晶体结构:侧翼碱基识别。EMBO J。1997;16(15):4689–97.
- 60.
yue h,wang m,liu s,du x,song w,nie x. arrky转录因子家庭在武装转录因子家里的转录组识别和表达轮廓(粟穗。).BMC基因组学。2016; 17:343。
- 61.
Frerigmann H,Berger B,Gigolashvili T.BHLH05是MyB51的相互作用伙伴和葡萄糖苷生物合成的新型调节器拟南芥.植物理性。2014; 166(1):349-69。
- 62.
Abe H,Urao T,Ito T,Seki M,Shinozaki K,Yamaguchi Shinozaki K。拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。植物细胞。2003;15(1):63 - 78。
- 63.
Lorenzo O,Chico JM,Sanchez Serrano JJ,Solano R。茉莉酸不敏感1编码一种MYC转录因子,该转录因子对区分不同茉莉酸调节的机体防御反应至关重要拟南芥.植物细胞。2004; 16(7):1938-50。
- 64.
一种基本的螺旋-环-螺旋转录因子拟南芥,Myc2,充当蓝光介导的光学生长的阻遏物。植物细胞。2005; 17(7):1953-66。
- 65.
Nesi N,Debeaujon I,Jond C,Pelletier G,Caboche M,Lepiniec L.该TT8该基因编码一种基本的螺旋-环-螺旋结构域蛋白,表达DFR.和禁止基因拟南芥长角果。植物细胞。2000;12(10):1863 - 78。
- 66.
Payne CT,张F,Lloyd Am。GL3编码调节毛毛细血管的BHLH蛋白质拟南芥通过与GL1和TTG1的互动。遗传学。2000; 156(3):1349-62。
- 67.
Bernhardt C,Lee MM,Gonzalez A,Zhang F,Lloyd A,Schiefelbein J。bHLH基因格拉布拉3(GL3)和Glabra3的增强剂(EGL3)指定表皮细胞的命运拟南芥根。发展。2003;130(26):6431 - 9。
- 68.
徐杰,van Herwijnen Zo,Drager DB,Sui C,Haring Ma,Schuurink RC。SLMYC1在番茄腺细胞中调节型vi腺滴毛组形成和萜烯生物合成。植物细胞。2018; 30(12):2988-3005。
- 69.
冯海林,马乃恩,孟x,张森,王建军,柴森,孟QW. [10]一个新的番茄myc型ice1样转录因子SlICE1a在转基因烟草中具有耐冷、耐渗透和耐盐的特性。植物生理学杂志,2013;
- 70
leivar p,鹌鹑pH。PIFS:蜂窝信号传导毂中的枢轴分量。趋势植物SCI。2011; 16(1):19-28。
- 71.
凯哈尼内贾德N,咖喱J,罗梅罗J,奥康奈尔MA。苹果果实辣椒素积累和结构调控基因转录的特异性变异辣椒水果。植物科学。2014;215–216:59–68.
- 72.
Koini Ma,Alvey L,Allen T,Tilley Ca,Harberd NP,Whitelam GC,Franklin Ka。植物结构中的高温介导的适应需要BHLH转录因子PIF4。Curr Biol。2009; 19(5):408-13。
- 73.
秦C,于C,沈Y,方X,陈L,闵J,程J,赵S,徐M,罗Y,杨Y,吴Z,毛L,吴H,令狐C,周H,林H,冈萨雷斯·莫拉莱斯S,特雷霍·萨维德拉DL,田H,唐X,赵M,黄Z,周A,姚X,崔J,李W,陈Z,冯Y,牛Y,毕S,杨X,李W,蔡H,罗X,蒙特斯·埃尔南德斯S,莱瓦·冈萨雷斯·马,熊Z,何X,白L,Tan S,Tang X,Liu D,Liu J,Zhang S,Chen M,Zhang L,Zhang L,Zhang Y,Liao W,Zhang Y,Wang M,Lv X,Wen B,Liu H,Luan H,Zhang Y,Yang S,Wang X,Xu J,Li X,Li S,Wang J,Palloix A,Bosland PW,Li Y,Krogh A,Rivera Bustamante RF,Herrera Estrella L,Yin Y,Yu J,Hu K,Zhang。栽培辣椒和野生辣椒的全基因组测序提供了对辣椒驯化和专业化。Proc Natl Acad Sci U S A. 2014; 111(14):5135-40。
- 74.
El-Gebali S, Mistry J, Bateman A, Eddy SR, Luciani A, Potter SC, Qureshi M, Richardson LJ, Salazar GA, Smart A, Sonnhammer E, Hirsh L, Paladin L, Piovesan D, Tosatto S, Finn R. fam蛋白家族数据库于2019年建立。核酸图谱2019;47(D1): D427-32。
- 75.
HMMER web服务器:2018更新。核酸图谱2018;46(W1): W200-4。
- 76.
Leatunic I,Bork P. 20年的智能蛋白质域注释资源。核酸RES。2018; 46(D1):D493-6。
- 77.
Lu S、Wang J、Chitsaz F、Derbyshire MK、Geer RC、Gonzales NR、Gwadz M、Hurwitz DI、Marchler GH、Song JS、Thanki N、Yamashita RA、Yang MZ、Zhang DC、Zheng CJ、Lanczycki CJ、Marchler Bauer A。CDD/SPARCLE:2020年的保守域数据库,《核酸研究》,2020;48(D1):D265–8。
- 78.
Gasteiger E,Gattiker A,Hoogland C,Ivanyi I,Appel Rd,Bairoch A. Expasy:用于深入蛋白质的蛋白质组织的知识和分析。核酸RES。2003; 31(13):3784-8。
- 79.
Lamesch P、Berardini TZ、Li D、Swarbreck D、Wilks C、Sasidharan R、Muller R、Dreher K、Alexander DL、Garcia Hernandez M、Karthikeyan AS、Lee CH、Nelson WD、Ploetz L、Singh S、Wensel A、Hula E。拟南芥信息资源:改进的基因注释和新的工具。核酸研究,2012年;40(D1):D1202–10。
- 80
acta botanica botanica(云南植物研究),2011,30(5):689 - 693。核酸研究2020;48(D1): D1104-13。
- 81.
陈建平,李建平,李建平。基于遗传算法的分子进化遗传分析。中国生物医学工程学报,2017,33(3):457 - 464。《生物学报》2018;35(6):1547-9。
- 82.
Subramanian B、Gao S、Lercher MJ、Hu S、Chen WH。Evolview v3:一个用于可视化、注释和管理系统发育树的web服务器。核酸研究,2019年;47(W1):W270–5。
- 83.
作者简介:Bailey TL, Boden M, Buske FA, Frith M, Grant CE, Clementi L, Ren J, Li WW, Noble WS。MEME SUITE:用于主题发现和搜索的工具。核酸研究2009;37(Web服务器版):W202-8。
- 84.
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,Salzberg SL,Wold BJ,RNA-SEQ的成绩单组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。
- 85.
Trapnell C,Pachter L,Salzberg SL。Tophat:发现带RNA-SEQ的接头连接点。生物信息学。2009; 25(9):1105-11。
- 86.
王勇,陈G,雷J,曹B,陈C。一个LEA样基因的鉴定和特性分析,CaMF5,特别是在男性肥沃的花香中表达Capsicum Annuum..园艺工厂J. 2020; 6(1):39-48。
- 87.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR和2(-Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
致谢
作者感谢Lab成员提供帮助。
资金
中国自然科学基金(3207331,3207180173和32072580),中国博士生科学基金(2020M682733)和国家重点研发计划(2018YFD1000800),得到了这项工作的支持。融资组织在研究和收集,分析和对数据的诠释的设计中没有发挥作用,并在写作稿件。
作者信息
隶属关系
贡献
JJL、BHC和ZSZ构想并监督了这项研究。RJL和JLS进行了大部分实验并撰写了手稿。SLZ和JTW分析了数据。SQL、CMC和YHX为本研究提供了一些有用的建议。所有作者都已阅读并批准了最后的手稿。
相应的作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
类胡萝卜素(A)和衣壳霉素(B)生物合成途径。图S2。染色体本地化Cabhlh.年代。图S3。辣椒BHLH蛋白中BHLH结构域的多重对准分析。图S4。Bhlh家族的系统发育树Capsicum Annuum.那拟南芥西红柿和米饭。图S5。不同组织中CABHLH基因的表达谱。图S6。酵母双杂交试验示意图
附加文件2:表S1。
相应的信息为107Cabhlh.年代。表S2。来自番茄的功能表征部分BHLH蛋白拟南芥蒂利亚纳。表S3。Cabhlh蛋白质图案的特点。表S4。水稻、番茄和小麦bHLH基因的研究拟南芥蒂利亚纳。表S5。实时定量PCR引物列表。表S6。酵母双杂交测定的引物列表。表S7。推定CIS.-辣椒素和辣椒素生物合成基因启动子元件。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
刘,R.,歌曲,J.,刘,S。等等。范围内识别辣椒BHLH转录因子家族:发现涉及物种特异性生物活性代谢物调节的候选调节因子。BMC植物杂志21,262 (2021). https://doi.org/10.1186/s12870-021-03004-7
收到了:
公认:
出版:
关键词
- Bhlh.
- 辣椒
- 类胡萝卜素
- 辣椒蛋白
- 温度
- 酵母双杂交分析