- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 出版:gydF4y2Ba
显微镜和化学分析显示黄酮类羊毛纤维从微米大小的孔中挤出的腺毛gydF4y2Ba绦虫酒神gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba, 文章编号:gydF4y2Ba258.gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
绦虫酒神gydF4y2Ba春报科的一种小型垫状山地常绿植物,具有巨大的表面覆盖着长长的丝状纤维,形成了特有的“羊毛状”粉质。这与一些相关的gydF4y2Ba樱草属植物gydF4y2Ba相反,形成细粉末。Farina由专业的细胞工厂,一种腺体滴毛组成,但纤维的精确组成以及其退出细胞的精确组成是较差的。这里,使用细胞生物学(电子和光学和显微镜)和分析化学技术的组合,我们介绍了羊毛的主要化学成分及其从腺体滴毛组的出口机制。gydF4y2Ba
结果gydF4y2Ba
我们展示了绵状淀粉由微米直径的纤维组成,由黄酮和取代黄酮衍生物的混合物。这与几乎全部由黄酮组成的粉状粉相反。毛茸茸的淀粉gydF4y2BaD. Tapetodes.gydF4y2Ba通过特异性位点挤出滴毛腺体头细胞表面的特异性位点,其特征在于血浆膜,细胞壁和角质池中的小完全间隙,并在纤维和孔之间形成紧密密封。数据与从细胞内发生的形成和螺纹伸长率一致。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明gydF4y2BaD. Tapetodes.gydF4y2Ba粉粒的形成是羊毛而不是粉末,这与依赖分子间h键的线程完整性模型一致。腺毛通过在头细胞皮层的特定部位集中并保持其挤压来产生多种羊毛纤维。由于羊毛在植物中分布广泛,在高海拔地区生活可能会产生相关的选择压力。gydF4y2Ba
背景gydF4y2Ba
属gydF4y2Ba狄奥尼岛gydF4y2Ba包含55种,分布在中亚。它们与gydF4y2Ba樱草属植物gydF4y2Ba一些物种历史上在这两个属之间来回移动[gydF4y2Ba1gydF4y2Ba].根据被子植物系统发育计划,gydF4y2Ba狄奥尼岛gydF4y2Ba已经被归入gydF4y2Ba樱草属植物gydF4y2Ba(gydF4y2Bahttps://www.mobot.orggydF4y2Ba).然而,目前的密苏里/基尤“植物列表”,一个所有植物物种的工作列表,仍然承认gydF4y2Ba狄奥尼岛gydF4y2Ba作为自己的权利(gydF4y2Bahttp://www.theplantlist.orggydF4y2Ba).种gydF4y2Ba狄奥尼岛gydF4y2Ba是矮灌木或多年生木本植物,具有顶生花序,形成松散到密集的垫子。它们生长在高海拔的山区,通常生长在石灰石悬崖上,虽然也有花岗岩、砂岩和白云岩的记录,并在阴影或半阴影条件下被发现。gydF4y2Ba绦虫酒神gydF4y2Ba[gydF4y2Ba2gydF4y2Ba是分布最广泛的gydF4y2Ba狄奥尼岛gydF4y2Ba从Kopet Dagh到伊朗东北部(呼罗珊省的山脉)到阿富汗的山脉[gydF4y2Ba3.gydF4y2Ba].这种广泛的范围有助于解释物种内部的变异。它们形成大而扁平的垫子,上面开着野生和栽培的黄花[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
对于某些种类的gydF4y2Ba樱草属植物gydF4y2Ba和gydF4y2Ba狄奥尼岛gydF4y2Ba,发现Farina(拉丁语“或”面粉“)的Meally押金被发现涵盖植物的所有或一部分。易于观察到例如在叶片表面上,作为粉末,或者在一些物种中,作为通常被称为“羊毛法律”的长细纹(或羊毛)的长细纹(或羊毛)。毛茸茸的Farina是常见的gydF4y2Ba狄奥尼岛gydF4y2Ba但相对较少gydF4y2Ba樱草属植物gydF4y2Ba[gydF4y2Ba1gydF4y2Ba].对于Persa,Farinose和Efarinose形式可以存在于相同的物种中,并且后一种变体的基本原因并不顺利地理解并且可能是无关的。粉状法兰纳gydF4y2Ba樱草属植物gydF4y2Ba主要由2-苯基-4h-铬-4-一,更常见的黄酮组成[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].溶剂冲洗植物器官的化学分析揭示了越来越多的额外取代黄酮,特别是羟基和甲氧基衍生物。不同的黄酮类型的数量可以广泛,它们的存在/不存在可以在密切相关的物种之间变化[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba].鉴于这些黄酮分配代表了总表面提取的黄酮,包括不同的组织/细胞类型和粘树脂毛状体,尚不清楚究竟是哪一种取代黄酮实际上构成了给定物种的粉粒。gydF4y2Ba
淀粉的生物合成发生在特殊的腺状毛状体中,这些毛状体通常包括一个附在一个称为腺头的圆形细胞上的柄[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].在亚细胞水平上,观察到平滑的内质网的增殖,这表明内质网是一些生物合成中间体的合成和运输场所[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba]. 黄酮类化合物生物合成途径的一部分是已知的,但对于更复杂衍生物的合成却不太清楚[gydF4y2Ba16.gydF4y2Ba].Chalcone合成酶(CHS)代表FavAvoNoid生物合成途径和Farinose酶的免疫循环化的第一步gydF4y2BaPrimula Kewensis.gydF4y2Ba在腺体头单元中显示高信号(但不在gydF4y2BaefarinosegydF4y2Ba突变体),表明该细胞中存在完整的黄酮淀粉生物合成机制[gydF4y2Ba17.gydF4y2Ba].此外,免疫偶数标记显示了细胞质中的球体中的CHS富集。随着黄酮Farina生物合成的延续,中间体和最终产品的亚细胞位置尚不清楚。通常,可溶性的黄酮糖苷可以在液泡中积聚[gydF4y2Ba18.gydF4y2Ba]但是,对于法里纳生产厂,不溶性苷元的储存位置是未知的。这些黄酮类和黄酮类苷元需要运输出细胞,并通过细胞壁和角质层沉积在毛细胞表面。据推测,这对于毛茸茸的法里纳来说变得更为复杂,因为它需要将黄酮构建块集中到一个单一的出口位置,以产生一种伸长的纤维。gydF4y2Ba
我们在这里展示了我们的结果,显示了绒毛状的淀粉组成和腺毛状头细胞的亚细胞组织,这是淀粉合成的位置gydF4y2BaD. Tapetodes.gydF4y2Ba.我们认为羊毛是一种含有黄酮和羟基黄酮的混合物,从头细胞中产生,并穿过细胞壁和角质层的明显缝隙。讨论了羊毛的形成机理。gydF4y2Ba
结果gydF4y2Ba
毛状的淀粉纤维gydF4y2Ba绦虫酒神gydF4y2Ba对粉状粉有明显的表面沟槽和成分不同吗gydF4y2Ba
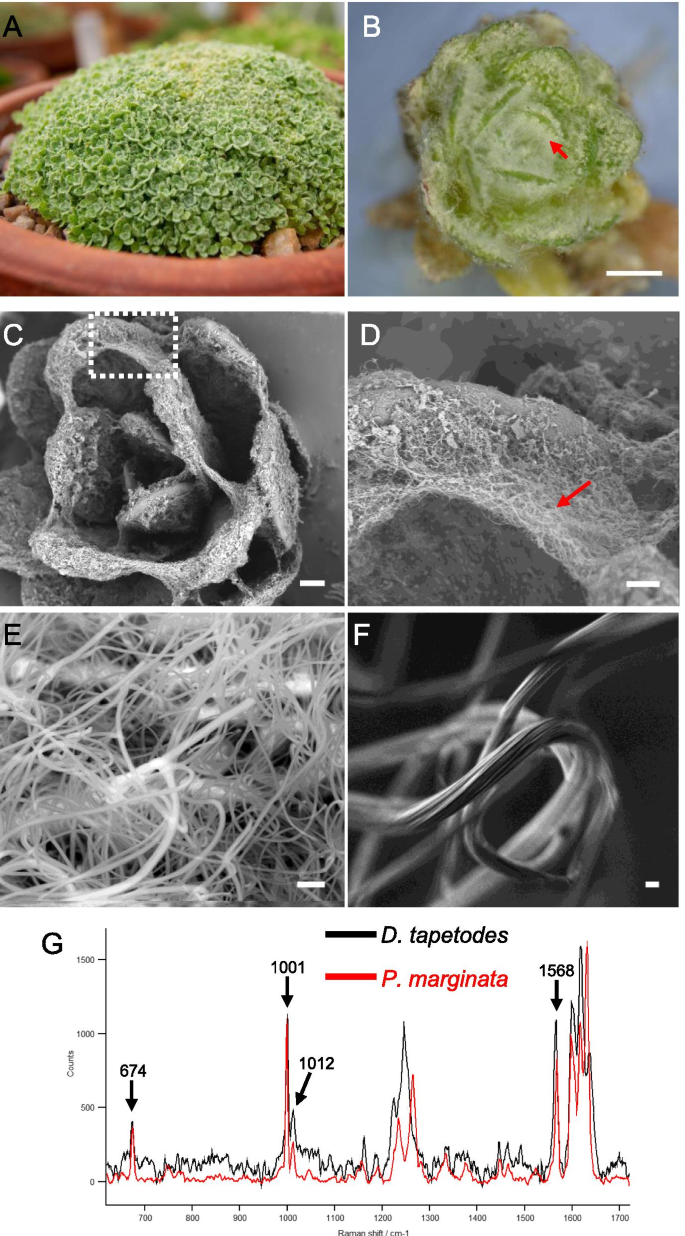
D. Tapetodes.gydF4y2Ba生长为密集的垫子(图。gydF4y2Ba1gydF4y2Baa)在具有大量的“羊毛”纤维上观察到的纤维,在轴承和轴向表面上观察到gydF4y2BaD. Tapetodes.gydF4y2Ba叶(无花果。gydF4y2Ba1gydF4y2Bab)。羊毛地区生产可能发生在整个叶片生长中,因为它存在于两只幼叶(发现在玫瑰华饰的中心)和较旧的叶子(位于玫瑰花莲的外侧)。在生长的早期阶段的Farina生产与通过扫描电子显微镜(SEM)透露的相邻叶片之间观察到的纤维缠结(图。gydF4y2Ba1gydF4y2Bac、d)。羊毛本身由纤维组成(图)。gydF4y2Ba1gydF4y2Bae)。各个羊毛纤维的宽度范围为0.9至2.1微米,平均宽度为1.6微米(gydF4y2BangydF4y2Ba= 51)。未涂层纤维的高倍低千伏扫描电镜显示其表面有细小的凹槽,形成一系列纵向排列的脊(图。gydF4y2Ba1gydF4y2BaF)。为了了解如何形成和维护这些纤维,我们比较了羊毛法律的拉曼光谱gydF4y2BaD. Tapetodes.gydF4y2Ba在叶缘附近发现的粉状粉gydF4y2Ba樱草属Marginata.gydF4y2Ba. 数字gydF4y2Ba1gydF4y2BaG示出了来自Farina类型的光谱的叠加。粉末谱gydF4y2BaP. Marginata.gydF4y2Ba与纯黄酮相匹配(光谱相关细节见材料和方法),表明黄酮构成了该物种粉粒的全部或绝大部分。的光谱gydF4y2BaD. Tapetodes.gydF4y2Ba然而,绵粉只与黄酮粉有一些相同的峰gydF4y2BaP. Marginata.gydF4y2Ba; 在674、1001、1012和1568厘米处gydF4y2Ba−1gydF4y2Ba.这表明黄酮的替代和/或混合物包含毛状粉gydF4y2BaD. Tapetodes.gydF4y2Ba.利用光谱搜索和相关软件根据获得的拉曼光谱确定候选官能团(材料和方法),并与含有部分黄酮衍生物的参考数据库进行比对。而gydF4y2BaP. Marginata.gydF4y2Bafarina与未被取代的黄酮类化合物高度相关(100个最大值中的命中质量指数97),gydF4y2BaD. Tapetodes.gydF4y2BaWoolly farina没有找到匹配的。然而,最佳的命中(命中质量指数70-80)是单一和二羟基和甲氧基取代的黄酮的各种组合。这表明羊毛纤维中可能存在羟基和/或甲氧基官能团与黄酮共存。进一步证明混合(替代)黄酮和纤维存在相关性的证据来自于拉曼光谱,该光谱分析了一种苏格兰分离物的冬叶毛状体周围非典型短纤维gydF4y2BaPrimula Bullata.gydF4y2BavargydF4y2Ba布拉塔gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba).拉曼谱的gydF4y2BaPgydF4y2Ba.gydF4y2Ba布拉塔gydF4y2BaFarina与黄酮粉的粉末不同gydF4y2BaP. Marginata.gydF4y2Ba它与来自欧洲的长纤维的光谱非常相似(但不完全相同)gydF4y2BaD. Tapetodes.gydF4y2Ba(见附加文件中的光谱覆盖)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
Farina羊毛观察叶子gydF4y2BaDionysia Tapetodes。gydF4y2Ba一个gydF4y2Ba密实、垫成型概述gydF4y2BaD. Tapetodes.gydF4y2Ba.gydF4y2BabgydF4y2Ba叶上白色绵状粉(箭头)的立体显微镜图象gydF4y2BaD. Tapetodes。gydF4y2Ba秤杆= 1毫米。gydF4y2BacgydF4y2Ba扫描电子显微镜(SEM)的Farina涂层叶片。秤杆=300μm。盒装区域进一步放大(gydF4y2BadgydF4y2Ba)在叶子(红色箭头)之间可以观察到羊毛纤维。秤栏=100μm。gydF4y2BaegydF4y2Ba用扫描电子显微镜检测羊毛纤维的背散射电子。比例尺 = 5微米。gydF4y2BafgydF4y2Ba高倍率,低千伏扫描电镜图像的淀粉纤维显示沟槽表面结构。比例尺= 1 μm。gydF4y2BaggydF4y2Ba新疆粉煤灰指纹图谱区域的拉曼显微镜研究gydF4y2Ba绦虫酒神gydF4y2Ba(黑色)与粉状粉相比较gydF4y2Ba樱草属Marginata.gydF4y2Ba(红色)。峰值分配原则(cmgydF4y2Ba−1gydF4y2Ba)是两种类型的淀粉的共同特征gydF4y2Ba
的毛茸茸的粉状物gydF4y2BaD. Tapetodes.gydF4y2Ba主要由黄酮和取代黄酮混合而成gydF4y2Ba
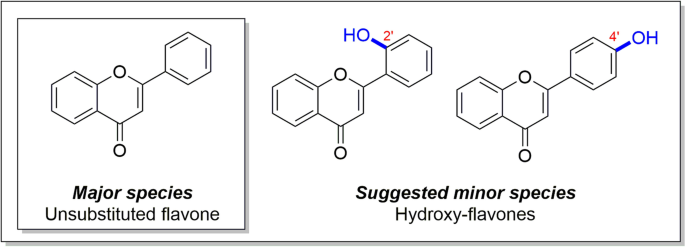
来自羊毛法律的样本gydF4y2BaD. Tapetodes.gydF4y2Ba采用高效液相色谱(HPLC)、液相色谱-质谱(LCMS)、高分辨质谱(HRMS)和核磁共振(NMR)光谱分析。所有数据均在附加文件中附上详细解释gydF4y2Ba2gydF4y2Ba另外包括图1和图2。S1-S7和表S1。该分析表明,羊毛幻如说,主要由未取代的黄酮(> 90%通过分析HPLC,图1中的结构A组成。gydF4y2Ba2gydF4y2Ba).从一个商业来源的纯黄酮样品中获得了相同的分析数据gydF4y2Ba2gydF4y2Ba,图。S4)。HPLC,LCMS和HRMS数据表明,羊毛法利纳样品中存在其他取代的黄酮物种;究竟还有多少种物种尚不清楚。HPLC分析仅给出一个,而LCMS数据表明存在多种其他类黄酮类化合物。在对应于对应于羟基和甲氧基取代的黄酮的LCMS中观察到质子离子(附加档案gydF4y2Ba2gydF4y2Ba,无花果。S1和S2)。为了提供更多的信息,我们进行了2D NMR,得到了对应于2 ' -羟基黄酮和4 ' -羟基黄酮的候选结构(图。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba,图S7)。gydF4y2Ba
形成毛状粉质的候选分子种的分子结构gydF4y2BaD. Tapetodes.gydF4y2Ba.结构是从化学分析,显示在完整的附加文件gydF4y2Ba2gydF4y2Ba
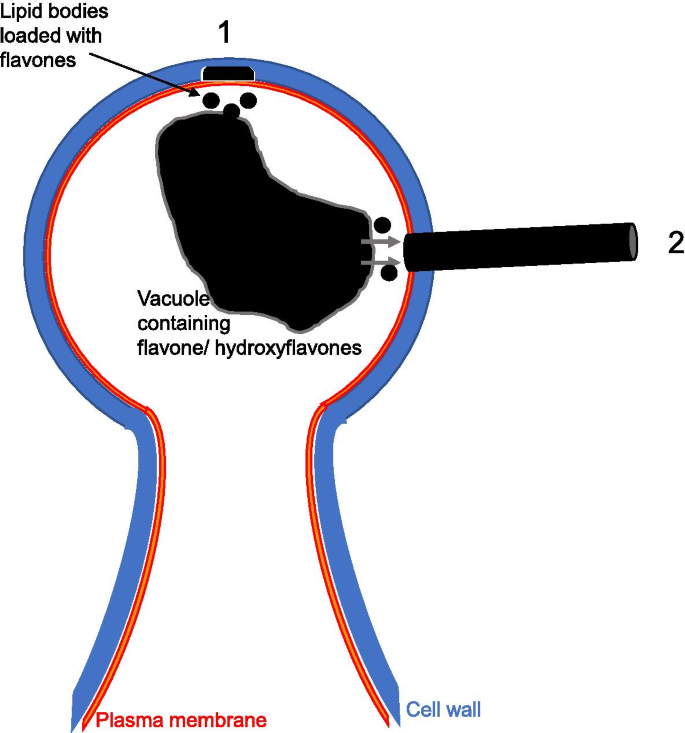
羊毛纤维从腺体滴毛瘤头部细胞的细胞壁中的不同孔中出现,并且靠近芳瓦的致密材料gydF4y2Ba
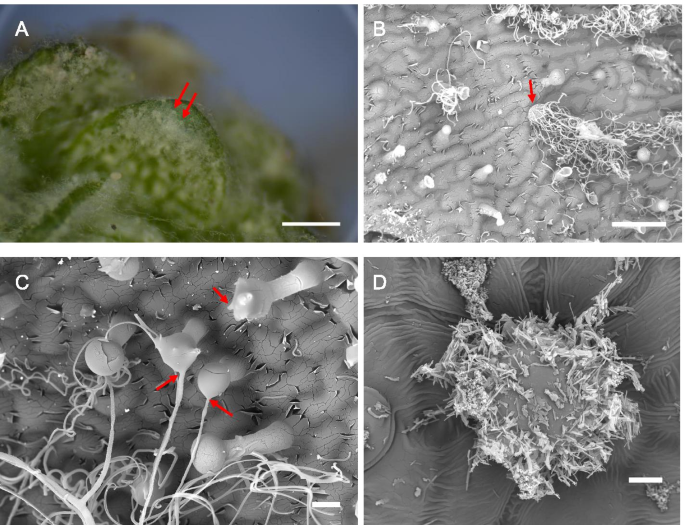
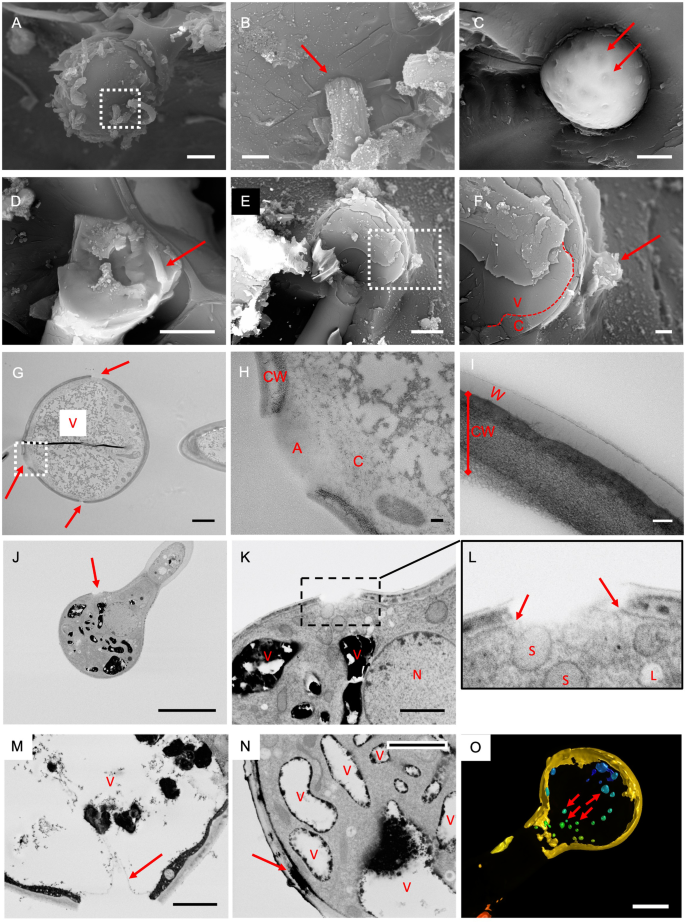
焦点代表起源的许多纤维可以看到在gydF4y2BaD. Tapetodes.gydF4y2Ba叶表面(图。gydF4y2Ba3.gydF4y2Baa)对应于成熟扁平的腺状毛状体(图。gydF4y2Ba3.gydF4y2Bab)。这些位置之间的散布是许多较小且延伸的毛状体,其具有较少,单个或没有从头部细胞出现的羊毛纤维,并且可能代表不同成熟水平的腺毛状体和非羊毛形成脂肪酸骨细胞(图。gydF4y2Ba3.gydF4y2Bab和c)。很明显,当观察较小的毛状体时,farina从腺头细胞上的几个离散位置出现,随着细胞年龄的增长,其数量可能会增加。这似乎与gydF4y2BaP. Marginata.gydF4y2Ba,较小的晶体完全覆盖头部电池的圆周(图。gydF4y2Ba3.gydF4y2Bad)。这些数据显示,为gydF4y2BaD. Tapetodes.gydF4y2Ba,黄酮掺入和挤压需要维持在(头)细胞表面的同一位置。我们使用低温扫描电镜近距离观察了羊毛纤维与细胞之间的连接(图1)。gydF4y2Ba4gydF4y2BaA, b)纤维似乎从细胞壁出来。我们通过叶片产生了随机的冷冻裂缝,其中可能包括一个腺头细胞,然而,断裂刀与羊毛的相互作用导致了毛状体从叶子上脱落,以及更多的细胞碎片在骨折部位。我们发现用70% v/v的乙醇进行5秒的清洗,可以去除表面的毛刺,并产生更好的低温裂缝和更少的碎片。洗涤后可见毛纤维挤压的部位,在细胞表面以小“坑”表示。gydF4y2Ba4gydF4y2Bac).包括腺头细胞任何部分的冷冻骨折是非常罕见的。一次骨折切除了大部分头部细胞,留下一部分头部和一些细胞质完整(图。gydF4y2Ba4gydF4y2Bad)。乙醇洗涤已经从样品中取出外羊毛纤维,然而,在从溶剂中保护的细胞内观察到单纤维(图3中的红色箭头。gydF4y2Ba4gydF4y2Ba这表明羊毛是在细胞内部形成的,然后以某种方式穿过了细胞壁上的一个缺口。第二次骨折是通过腺体毛细胞的中心(图。gydF4y2Ba4gydF4y2Bae)和羊毛出口部位可以靠近裂缝平面观察。在该位置,液泡似乎接近表面,少量细胞质之间(图。gydF4y2Ba4gydF4y2Baf).鉴于我们无法通过细胞壁中羊毛挤压部位获得骨折,我们对固定的腺毛的染色后切片进行透射电镜(TEM)观察。透射电镜处理完全去除了所有的淀粉毛,然而,观察到细胞壁完全的间隙(图。gydF4y2Ba4gydF4y2Bag),并且靠近稠密的颗粒,基于FE-SEM成像,下面描述,代表液泡的内容。这些间隙不是透射电镜掩盖或不均匀染色造成的假象,因为在光镜下,除了密集的空泡外,还能观察到它们(图像见附加文件gydF4y2Ba3.gydF4y2Ba).致密颗粒与细胞壁间隙之间可见少量细胞质和无定形染色区。gydF4y2Ba4gydF4y2Bah) 是的。放大的透射电子显微镜显示了一个网状结构,具有不同密度的层,可能代表多糖成分,包括纤维素(图。gydF4y2Ba4gydF4y2Ba一世)。存在低密度外层,其与有切割蜡加上顶部的薄啃层一致(图。gydF4y2Ba4gydF4y2Ba一世)。通过相关的荧光寿命成像和拉曼显微镜来证实,显示六个拉曼峰(1062,1132,1294,1416,1438,1465cmgydF4y2Ba−1gydF4y2Ba),对应于高粱表皮蜡的主要峰值[gydF4y2Ba19.gydF4y2Ba]. 这些蜡峰是腺体毛细胞外表面特有的,与黄酮类信号一起被发现(见附加文件中的寿命拉曼数据)gydF4y2Ba4gydF4y2Ba).同时还发现了黄酮在细胞内的贮藏。gydF4y2Ba
在单细胞层面形成Farina。gydF4y2Ba一个gydF4y2Ba立体显微镜图象显示羊毛出口点(红色箭头)的例子在叶子的表面上gydF4y2BaD. Tapetodes.gydF4y2Ba. 比例尺 = 500μm。gydF4y2BabgydF4y2Ba腺毛状体的SEM图像,包括产生大量羊毛法拉(红色箭头)的成熟腺滴毛组的一个例子。秤条=50μm。gydF4y2BacgydF4y2Ba扫描电镜图像显示,从腺毛法里纳羊毛出口点(红色箭头)。比例尺 = 10μm。gydF4y2BadgydF4y2Ba扫描电镜图像显示腺毛gydF4y2BaP. Marginata.gydF4y2Ba覆盖着粉状黄酮Farina。秤杆=10μmgydF4y2Ba
从腺毛状体的Farina羊毛出口点。gydF4y2Ba一个gydF4y2Ba扫描电镜图像显示羊毛从一个腺毛细胞的表面出来。框装区域的放大视图显示在(gydF4y2BabgydF4y2Ba).细胞表面-粉质界面用红色箭头标记。沙洲= 5 μm (gydF4y2Ba一个gydF4y2Ba)及1 μm (gydF4y2BabgydF4y2Ba).gydF4y2BacgydF4y2Ba乙醇洗涤后腺体滴毛瘤细胞表面去除八种糖材料。羊毛出口点的例子由红色箭头标记。棒=5μm。gydF4y2BadgydF4y2Ba冷冻后的扫描电镜显示毛细胞表面部分的内表面。一块法里纳羊毛被发现完整地存在于细胞内(红色箭头)。酒吧 = 5微米。gydF4y2BaegydF4y2Ba冷冻后揭示细胞内容物的SEM。棒=5μm。盒装区域的放大视图显示在(gydF4y2BafgydF4y2Ba)观察羊毛出口(红色箭头)。虚线表示调色剂的位置。V =芳氢,C =细胞质。液泡被视为靠近羊毛出口部位。条=1μm。gydF4y2BaggydF4y2Ba透射电镜(TEM)图像的部分通过腺毛。羊毛出口处用红色箭头标记,并定义为细胞壁上的间隙。与液泡内容物[V]一致的电子致密物质,就在这些位置附近。中间的暗线是剖面褶皱中的人造物。酒吧 = 2μm。gydF4y2BahgydF4y2Ba羊毛出口位点(盒子区域)的放大视图,显示细胞壁[CW]和非晶区域(gydF4y2Ba一个gydF4y2Ba)。在无定形区域下面可见少量细胞质(gydF4y2BacgydF4y2Ba).酒吧= 200 nm。gydF4y2Ba我gydF4y2Ba由蜡状低密度层(W)覆盖的完整细胞壁[CW]部分的TEM图像。酒吧= 100 nm。gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba,gydF4y2BalgydF4y2BaFe-SEM块脸部成像显示羊毛出口位点(箭头gydF4y2BajgydF4y2Ba)标尺= 10 μm。出口地盘的放大图载于(gydF4y2BakgydF4y2Ba)与电子致密真空[V]和核[N]杆=2μm。进一步放大(gydF4y2BalgydF4y2Ba)显示等离子体膜不穿过间隙(箭头)。拟合球体和白膜(L)的描述的细胞器可以在间隙以下观察到。gydF4y2Ba米gydF4y2BaFe-SEM块面成像显示出延伸到液泡的出口部位。Bar = 2 μm。gydF4y2BangydF4y2Ba在细胞壁的空隙中(箭头所指)聚集了一种电子致密物质。液泡[V]含有类似的电子密度物质在很近的地方被发现。Bar = 2 μm。gydF4y2BaogydF4y2Ba表面呈现3d去卷积的腺细胞的一个碎片头细胞的共聚焦堆的渲染的呈现尼罗红色正面染色的隔室(箭头指示的例子)。酒吧=5μmgydF4y2Ba
为了确定细胞壁上的孔的产生是如何与黄酮的定向沉积结合形成线的,我们使用了一种高通量的方法对大量腺毛进行成像。包括不同发育阶段叶片在内的完整花环被染色、包埋和切片。用背散射电子场发射扫描电子显微镜(FE-SEM)观察了这些大面积截面,为观察薄膜提供了良好的对比度。在检查的11个间隙中,由于染色强烈,液泡很容易与其他细胞器区分,6个间隙位于其最近液泡室的1μm范围内,距离在0-2.6μm之间(平均1.1μm,中位数0.72μm)。FE-SEM显示细胞壁和角质层的缝隙也包括质膜(图。gydF4y2Ba4gydF4y2Baj-l,);FE-SEM观察到的15/15间隙中没有穿过间隙的质膜。这些部位的质膜缺乏不太可能是由于固定和加工造成的膜破坏,因为发育中的幼毛和其他叶细胞始终有完整的膜(见附加文件中的图像)gydF4y2Ba5gydF4y2Ba).对于一个腺体头,我们观察到间隙进一步延伸在细胞内部,只要芳瓦(图。gydF4y2Ba4gydF4y2Bam)。我们观察到完全形成的胎儿,其中在宽度为1.15μm的细胞壁内的空隙中看到致密染色与形成羊毛螺纹的尺寸一致(图。gydF4y2Ba4gydF4y2Ban)并暗示壁消解与黄酮和衍生物的沉积之间的仔细耦合。虽然出口位点的芳氢附近,但在螺纹地层中表达了一些作用,但真空腔的典型亲水环境与在储存黄酮膜的作用不一致。亲脂性隔室可能更适合作为一些最终运输车辆或商店。在植物中,脂质/油体或液滴具有不同的形态和尺寸,有时被称为膜结合细胞器的球囊体和用于膜的膜涂覆液滴的膜状膜[gydF4y2Ba20.gydF4y2Ba].含脂细胞器一般为球形或卵形,在EM制备材料中呈电子透明或略不透明的非颗粒状[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba].推定的球体/脱杆可以在图2中的电池壁间隙下方看出。gydF4y2Ba4gydF4y2Ba但在图中这个区域不容易观察到。gydF4y2Ba4gydF4y2Bam。将腺体与附近的叶片叶片细胞进行比较确实表明这些细胞器在后面的细胞类型中富集,以及一些也可见的电子密集液滴(附加文件gydF4y2Ba6gydF4y2Ba). 此外,用亲脂染料尼罗红染色的毛状体的共聚焦显微镜显示头细胞内细胞内阳性染色室的证据(图。gydF4y2Ba4gydF4y2Bao,附加文件gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
D. Tapetodes.gydF4y2Ba叶子周围覆盖着毛茸茸的粉质。人们还不完全了解淀粉的用途,然而,人们曾提到过淀粉对冰冻的耐受性和对高紫外线的阻隔[gydF4y2Ba23.gydF4y2Ba,gydF4y2Ba24.gydF4y2Ba].与后者一致,存在于甲腺苷gydF4y2BaD. Tapetodes.gydF4y2Ba剑桥大学植物园和与这种植物密切合作的园艺师报告说,与粉糖品种相比,它在阳光下更容易烤焦。另外(或另外)富含黄酮的粉质可能具有有效的抗真菌活性[gydF4y2Ba25.gydF4y2Ba].gydF4y2Ba
绒毛状的粉质纤维由分布在叶表皮上的成熟毛状腺头细胞向四面八方辐射。除了生物合成,这些头细胞似乎是羊毛的锚点,可以延伸到相邻的叶子之间。gydF4y2Ba
羊毛法律形成研究gydF4y2BaD. Tapetodes.gydF4y2Ba由羊毛本身的物理和化学特征挑战。低温物给出了羊毛和蜂窝结构的良好保存,但尽管多种随机的低温骨折,但从未获得过通过细胞壁间隙离开电池的螺纹的图像。嵌入式和切片材料的高分辨率光和电子显微镜具有羊毛出口和周围亚细胞隔室的最佳图像,然而,除了可以看到羊毛纤维的加工(尽管可能归因于黄酮前体的储存的致密真空染色)。在加工之前观察角质层,细胞壁,血浆膜和细胞质内的间隙,在加工之前,为我们提供了如何制造羊毛的线索;我们推测壁中的小空隙,通过消化壁成分而产生的,从面向电池的壁侧开始(图。gydF4y2Ba5gydF4y2Ba).黄酮(苷元)物质可能从液泡中储存(作为部分可溶的糖元前体)转运到脂质体中并沉积到这个空腔中。包括角质层在内的消化完成后,黄酮聚集在细胞外挤压形成羊毛,同时与孔的边缘形成完美的密封(图。gydF4y2Ba5gydF4y2Ba),在大量表皮蜡的帮助下。对于线的伸长,黄酮不断地沉积到细胞质(伸长)端,线可以向细胞深处伸出,并逐渐向外挤压,可能是由于细胞的膨胀。可以想象,膨胀驱动的线程排出可能导致液泡位移到出口位置与观察到的液泡接近一致。gydF4y2Ba
还有一个问题是,在其他黄酮类粉煤灰形成粉末的地方,粉煤灰的羊毛纤维是如何形成和稳定维持的。我们的成分分析表明gydF4y2BaD. Tapetodes.gydF4y2Ba羊毛主要与2'-和4'-羟基氟拉拉维酮加上少量其他未识别的取代黄酮混合。三种鉴定的黄酮不是本物种的独特之处,因为它们是在粉末状物种中被发现的,其中它们被称为弹性类黄酮[gydF4y2Ba26.gydF4y2Ba].然而,有数据支持2 '和4 ' -羟基位置的强分子间氢键,而6-羟基位置的弱氢键和gydF4y2Ba内外gydF4y2Ba5-羟基硫酮中的分子键[gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba].这些2 '和4 ' -羟基黄酮之间的分子间相互作用以及与整体黄酮的相互作用可能足以维持羊毛线的完整性。我们的拉曼数据gydF4y2BaP. Marginata.gydF4y2Ba粉末显示出与黄酮的匹配,没有像这样的混合物的证据gydF4y2BaD. Tapetodes.gydF4y2Ba因此,在前一种物种中促进粉末而不是后者看到的羊毛挤出。尽管具有这种观察结果,但渗出物黄酮类化学分析表明了大量的黄酮和2'-羟基氟酮gydF4y2BaP. Marginata.gydF4y2Ba[gydF4y2Ba10.gydF4y2Ba].我们提出了一个假设,虽然形成粉状和绵状淀粉的物种中保留了多种替代黄酮,但只有绵状淀粉物种才能正确地将这些黄酮混合并在一个合成位置上合成并稳定长而连续的纤维。在产生细粉、粗粉、短纤维或长纤维的混合物中,精确的差别可能很细微,但足以构成花粉形态的巨大差异。粉状、毛状和粉状糖的选择压力还不清楚,然而,羊毛似乎能更好地覆盖整个植物,而我们推测,细松散的粉末,虽然更多的局部和更容易去除,可以产生更密集的涂层。据报道,黄酮类化合物具有抵御紫外线和冰冻事件的能力gydF4y2BaD. Tapetodes.gydF4y2Ba对于长线程黄酮可能提供另一个进化步骤,向以前描述的旱形适应干旱在属gydF4y2Ba狄奥尼岛gydF4y2Ba[gydF4y2Ba29.gydF4y2Ba].事实上,黄酮的这种特定空间沉积似乎从一个生产点(腺毛状体)提供了更多的叶片覆盖,这可能限制了叶片表面的空气运动,从而限制了水分的流失。gydF4y2Ba
结论gydF4y2Ba
绵状粉是通过锁定黄酮和羟基黄酮的混合物,在腺毛头细胞内排出孔而形成的。我们建议纤维完整性涉及分子间h键,综合来看,我们的数据允许进一步评估这些纤维作为潜在的新生物材料。gydF4y2Ba
方法gydF4y2Ba
植物繁殖和收获gydF4y2Ba
我们曾经gydF4y2Ba绦虫酒神gydF4y2Ba加入20,140,435,收到的皇家植物园爱丁堡(加入19,822,508),包括由T.F教授收集的野生材料。1969年至1971年之间的Hewer(1164号)。gydF4y2BaD. Tapetodes.gydF4y2Ba在剑桥大学植物园(英国剑桥,英国山桥)在一个高山房子里陷入困境,以防止根冷却器和更稳定的温度。灌封堆肥包括50%基于壤土的堆肥,30%1-9毫米砂砾,10%尖砂,10%血清和少量缓慢释放肥料。堆肥是顶部穿着砂砾,仔细工作在植物的衣领下,以减少基底腐烂的风险。鉴于gydF4y2Ba狄奥尼岛gydF4y2Ba易于从过度曝光到阳光燃烧的玫瑰花,从3月中旬放置在集合上,在太阳强度下降后,在本赛季晚些时候删除。旧鲜花被小心地去除,以防止任何僵尸植物感染从死的花朵移动到生物材料中。浇水遵守严格的政权:幼株通过水浴从下面浇水,一旦他们通过一岁,然后浇水开销而不会弄湿垫子表面。水谨慎地在冬季施用,一旦植物处于活跃的生长,就会增加。gydF4y2Ba樱草属Marginata.gydF4y2Ba(195844928)从剑桥大学植物园的山地温室中提取植物标本。gydF4y2BaPrimula Bullata.gydF4y2BavargydF4y2Ba布拉塔gydF4y2Ba冬假是英国爱丁堡大学教授大卫·兰金赠送的礼物。gydF4y2Ba
低温扫描电子显微镜(cryoSEM)和低温骨折gydF4y2Ba
5-8片叶子的莲座被裱起来,冷冻在氮泥中,镀铂,如前所述断裂[gydF4y2Ba30.gydF4y2Ba].为了容纳更好的裂缝而不移位毛状体,将一些样品浸入70%v / v乙醇中以除去羊毛,然后在冷冻之前空气干燥。使用具有背散射电子检测器和25kV加速电压的Zeiss EVO HD SEM来观看冷冻制备的样品。gydF4y2Ba
羊毛纤维的扫描电镜成像gydF4y2Ba
高放大、低kV成像,丛生的裸羊毛纤维被放置在一个粘性碳标签和安装在蔡司的SEM存根EVO高清扫描电镜在高真空和1 kV加速电压用SE探测器快速扫描帧平均防止羊毛运动。在25 kV加速电压下,采用BSD检测器对羊毛进行了背散射电子成像。gydF4y2Ba
利用透射电子显微镜(TEM)和荧光显微镜(light (fluorescence))对毛状体进行包埋、切片和成像gydF4y2Ba
除去叶片(或叶芽)的尖端以确保有效的固定渗透,然后立即如[gydF4y2Ba31.gydF4y2Ba]用于固定、脱水和包埋步骤。对于荧光显微镜,半薄切片。用Histo Jumbo 8毫米金刚石刀(硅藻刀)用Leica EM UC7超微切片器获得全叶芽(1 μm),并将其置于无菌水滴上(未涂覆)玻璃显微镜载玻片上。为了避免在水干燥过程中出现折痕,载玻片在设置为55°C(徕卡)的热板上干燥。最后,将载玻片置于含有钙氟作为细胞壁复染剂的AF1氟Citifluor抗凝剂与PBS的1:1溶液中,并用共聚焦显微镜(Zeiss LSM700)成像。gydF4y2Ba
对于TEM观察,使用Ultra 45°金刚石刀(Diatom族)用Leica EM UC7超微族获得100nm薄部分,并在200-300μm网状覆盖器涂覆的镍网。gydF4y2Ba
样品用雷诺德柠檬酸铅(3min)加醋酸铀酰(3min)后染色。在200 keV,20μm物镜孔径的Tecnai G20电子显微镜下观察薄切片。图像由DEBEN软件控制的AMT相机拍摄。gydF4y2Ba
叶片截面的场发射扫描电子显微镜(Fe-SEM)gydF4y2Ba
整个莲座用刀片切开,去除叶尖,然后按上文[gydF4y2Ba32.gydF4y2Ba]. 解剖后,立即将样品浸入固定剂(2%甲醛,2%戊二醛,2.0 mM氯化钙,0.05 M cacodylate缓冲液,pH 7.40)中,在室温下真空过夜。在去离子水(DIW)中洗涤5次后,样品被渗透(1%OsO)gydF4y2Ba4gydF4y2Ba,1.5%钾gydF4y2Ba3.gydF4y2Ba铁(CN)gydF4y2Ba6gydF4y2Ba在0.05 M碳酸钠缓冲液中,pH7.4), 4°C保存3天。样品5 × DIW洗涤,0.1% (w/v)硫代氨基脲在DIW中室温避光处理20 min。在DIW中洗涤5 ×后,在室温下用2%的二氧化硅重复渗透1 hgydF4y2Ba4gydF4y2Ba然后在DIW中进行5个清洗步骤。然后样品用醋酸铀酰块染色(2%醋酸铀酰在0.05 M马来酸缓冲液中,pH 5.5),持续3天,4℃。样本进行了进一步5洗DIW然后在一系列分级脱水乙醇(50% > 70% > 95% > 100% > 100%干),然后100%丙酮干燥干乙腈100%,3×最低5分钟。样品进行了渗透在每一个50/50的100%干乙腈/ Quetol树脂、- BDMA,一夜之间,3天使用100% Quetol(减去BDMA), 5天使用100% Quetol树脂加BDMA,每24小时更换一次树脂。Quetol树脂混合物由12 g Quetol 651、5.7 g MNA、15.7 g NSA、0.5 g BDMA组成。样品置于包埋模内,60℃固化3天。半薄教派。用Histo-Jumbo 8 mm金刚石刀(DiATOME),用Leica EM UC7超微切片器获得全叶芽(1 μm),然后将无菌水滴置于(未涂覆的)玻璃显微镜载玻片上。载玻片在55°C(徕卡)的热板上干燥,以避免在干燥过程中出现褶皱。然后用玻璃刀将载玻片修整,然后用导电碳片将其安装在铝扫描电子显微镜(SEM)存根上,载玻片的边缘涂上导电银漆。 Samples were coated with 30 nm carbon using a Quorum Q150 TE carbon sputter coater. Samples were imaged in a FEI/Thermofisher Verios 460 SEM at 4 kV accelerating voltage, 0.2 nA probe current using a concentric backscatter detector (CBS) in immersion mode with a working distance of 3.5–4 mm; 1536 × 1024 pixel resolution, 3 μs dwell time, 4 line integrated. Stitching of adjacent image areas was carried out using the FEI MAPS software and default stitching settings and a 10% overlap.
羊毛纤维直径测量gydF4y2Ba
羊毛纤维的图像,附在一个孤立的叶子上gydF4y2BaD. Tapetodes.gydF4y2Ba用Keyence VHX-7000显微镜在2500倍放大下拍摄,用全场同轴光照射。2D深度上升模式用于焦点获取。使用Keyence软件中的点对点测量工具进行纤维宽度测量。gydF4y2Ba
Farina的拉曼显微镜gydF4y2Ba
拉曼显微镜在配有785nm激光的雷尼锯的Invia仪器上进行。gydF4y2BaD. Tapetodes.gydF4y2BaFarina羊毛或gydF4y2BaP. Marginata.gydF4y2Ba粉末小心地放置在石英幻灯片上,并带来焦点50×干物镜。拉曼采集使用1200升/毫米光栅,1200厘米gydF4y2Ba−1gydF4y2Ba中心,785 nm激光在10%功率,规则共聚焦模式和4 s曝光3积累。为了提高信噪比,每个样本至少平均3个光谱。为了找到与参考拉曼光谱的接近匹配,将实验光谱作为搜索输入,在KnowItAll软件(Bio-Rad公司)中使用“SearchIT”工具,然后通过眼睛可视化候选光谱以消除假阳性。使用默认和欧几里德距离搜索设置。匹配将根据其命中质量指数(最多100个)进行排名。gydF4y2BaP. Marginata.gydF4y2Bafarina与黄酮类化合物非常接近(97/100)。gydF4y2Bad挂笔gydF4y2Ba对包括7,2′-二甲氧基黄酮在内的羟基和甲氧基黄酮衍生物的参考光谱没有给出接近的匹配,但得到了良好的相关性(70-80/100);3,7-二甲氧基黄酮和6-,7-,或8-羟基衍生物。用于浸泡在水中的叶子的fastFLIM-Raman相关成像(附加文件gydF4y2Ba4gydF4y2Ba)共焦拉曼显微镜,载于[gydF4y2Ba33.gydF4y2Ba]使用以下设置:25×0.95 NA水浸物镜,FLIM 440 nm脉冲激光器(20 MHz),探测器窗口在448到511nm和80次迭代之间。拉曼:1200升/毫米光栅,1200厘米gydF4y2Ba−1gydF4y2Ba中心,785 nm激光,50%的功率,15次曝光,2个累积,用于相交的线扫描模式。gydF4y2Ba
尼罗红染色和成像gydF4y2Ba
新鲜收获的树叶gydF4y2BaD. Tapetodes.gydF4y2Ba置于含有0.1 μg/ml尼罗红(0.0001 1%丙酮)的试管中(尼罗红原液为1 mg/ml w/v, 100%丙酮)。三维成像在蔡司LSM700共聚焦显微镜上进行,使用555 nm激光和575-625 nm发射滤光片。利用Huygens软件(Scientific Volume Imaging, Netherlands)对z -叠进行反褶积和表面绘制。gydF4y2Ba
化学分析试剂,溶剂和样品制备gydF4y2Ba
纯黄酮购自Alfa Aesar,为白色固体,纯度为99% (CAS号)。525-82-6,目录。A13627)和使用没有进一步的净化。所有溶剂都是无水的,使用时无需进一步纯化。黄酮羊毛是从羊毛中提取的gydF4y2BaD. Tapetodes.gydF4y2Ba使用细镊子叶面并放入微量离心管中。将羊毛样品(约0.5mg)溶于50μl乙腈/水(1:1)中,几滴二甲基磺氧化砜(DMSO)以帮助溶解性。以这种方式进行样品制备用于分析HPLC,LCMS和HRMS分析。gydF4y2Ba
分析高效液相色谱(HPLC)gydF4y2Ba
使用Supelcosil Abz +加上柱(150mm×4.6mm,3μm)用线性梯度系统(溶剂A:0.05%(v / v)三氟乙酸(TFA)在H中的三氟乙酸(TFA)的溶剂+加上柱(150mm×4.6mm,3μm)上进行分析HPLC。gydF4y2Ba2gydF4y2BaO,溶剂B:乙腈(MECN)中的0.05%(v / v)TFA)以1ml / min的流速超过15分钟。gydF4y2Ba
液相色谱-质谱(LCMS)gydF4y2Ba
用ESCI多模电离液SQ检测器2光谱仪(LC系统:溶剂A:2mm乙酸铵(95:5);溶剂B:100%Mecn;柱子:Aquity UPLC C18,2.1 * 50 mm,1.7μm,130;梯度:63 5-95%B超过3分钟,恒定的0.1%甲酸)。gydF4y2Ba
高分辨率质谱(HRMS)gydF4y2Ba
HRMS在Waters LCT Premier飞行时间的大众光谱仪上进行。ESI是指电喷雾电离技术。gydF4y2Ba
核磁共振波谱gydF4y2Ba
核磁共振波谱分析如文献[gydF4y2Ba34.gydF4y2Ba],经过以下修改:所有脉冲序列都是用于控制采集的上旋3.2pl7软件的默认值(DEPT135除外)。所需的分析gydF4y2Ba1gydF4y2BaH,gydF4y2Ba13.gydF4y2BaC, DEPT135, DFQ-COSY, Heteronuclear Single Quantum Coherence (HSQC, DEPT135 editing) and Heteronuclear Multiple Bond Correlation Spectroscopy (HMBC)。所有必要的形状和解耦脉冲都由软件计算,使用定义的90度脉冲。gydF4y2Ba
1gydF4y2BaH核磁共振gydF4y2Ba
使用内部氘锁记录质子磁共振光谱(除非另有说明,否则在Bruker DPX(400 MHz)上)。gydF4y2Ba1gydF4y2BaH -gydF4y2Ba13.gydF4y2BaC DUL探头),Bruker Avance III HD (400 MHz;智能探头)、Bruker Avance III HD (500 MHz;智能探头)和Bruker Avance III HD 62 (500 MHz;DCH冷冻器)光谱仪。脉冲序列采用zg30 - PLW1 = 14 W, P1 = 10.5 μs, SW = 20 ppm, TD = 64 K, AQ = 3.28 s, D1 = 1 s, NS = 16。支持质子分配gydF4y2Ba1gydF4y2BaH -gydF4y2Ba1gydF4y2BaH Cozy,gydF4y2Ba1gydF4y2BaH -gydF4y2Ba13.gydF4y2BaC HSQC或gydF4y2Ba1gydF4y2BaH -gydF4y2Ba13.gydF4y2BaC HMBC光谱,或者类推。化学位移(δH)以ppm为单位引用到最接近的0.01 ppm,并参照剩余的非氘化溶剂峰。相互耦合质子的可识别耦合常数被报道为以赫兹为单位的测量值,四舍五入到最近的0.1赫兹。数据报告如下:化学位移,多样性(br,广义;年代,单线态;d,紧身上衣;t,三个一组;问,四方;米,多重态;或两者的组合)、原子核数、耦合常数和赋值。gydF4y2Ba
13.gydF4y2BaC NMRgydF4y2Ba
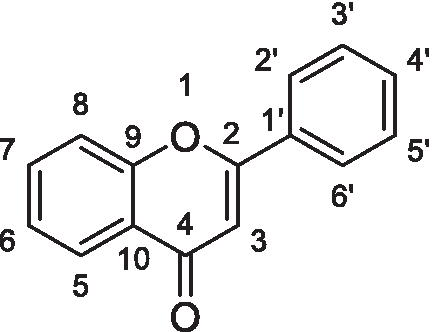
在Bruker-DPX(101mhz)、Bruker-Avance-III-HD(101mhz)和Bruker-Avance-III-HD(126mhz)光谱仪上使用内部氘锁(298k,除非另有说明)记录碳磁共振谱。采用脉冲序列zgpg30′采集1024次扫描(NS),waltz16-1H去耦。90度13C脉冲设置为21 W(PLW1),持续9.5μs(P1)。209786个点(TD)在3.02 s(AQ)内数字化,松弛延迟设置为2 s(D1)。扫描宽度为276ppm(SW),辐照频率为110ppm(O1P)。碳光谱指定由部门编辑支持,gydF4y2Ba1gydF4y2BaH -gydF4y2Ba13.gydF4y2BaC HSQC或gydF4y2Ba1gydF4y2BaH -gydF4y2Ba13.gydF4y2BaC HMBC光谱,或者类推。将化学变换(ΔC)以PPM引用至最接近的0.1ppm,并参考氘代溶剂峰。数据报告为:化学换档,核数,多重,耦合常数和分配。使用TOPSPIN(BRUKER)处理磁共振光谱。当信号不能通过任何方式区分信号时,给出了芳基,第四节或两个或更多可能的任务。遵循标准的Flavone编号。gydF4y2Ba
部门135gydF4y2Ba
脉冲序列dept135sp -这是一个微调的DEPT序列,以优化光谱基线,并使用绝热形状的180度碳脉冲。碳脉冲功率为gydF4y2Ba13.gydF4y2BaC以上实验,SW = 236.7 ppm,标准偏差 = 65536,澳大利亚 = 1.10秒,D1 = 2秒,O1 = 100 ppm,纳秒 = 64.华尔兹16。gydF4y2Ba
DFQCOSY公司gydF4y2Ba
这是一个双量子滤波实验;使用梯度选择;cosygpmfqf脉冲序列。非均匀采样;使用Poisson-gap加权调度获得了512次增量中的37.5%,每次扫描2次(SWF2 = 13.37 ppm, TD = 4 k, AQ = 0.31 s, D1 = 2 s)。质子脉冲功率如上所示。处理到2k x2k点使用正弦函数(SSB = 2.5)。gydF4y2Ba
HMBCgydF4y2Ba
本实验是相位敏感的;使用Echo/Antiecho梯度选择,使用三倍低通j滤波器抑制单键相关性;脉冲程序“hmbcetgpl3nd”。在相位敏感模式下,采用Echo/Antiecho-TPPI梯度选择,采用3步低通j滤波器抑制1键相关性。远距离J-JCH参数设置为10hz。非均匀采样;采用泊松间隙加权计划获得768个增量中的37.5%;每个扫描2次(SWF1 = 250, SWF2 = 12.02 ppm, TD = 4096, AQ = 0.34 s, D1 = 2 s)。使用正弦函数(F2和F1的SSB = 4 & 2)处理到2048 × 2048,然后在F2中转换为幅值模式。(上旋命令“xf2m”)。gydF4y2Ba
HSQCgydF4y2Ba
HSQC采用Bruker Avance III HD 500Mhz,配备双13C/1H冷冻探针;使用3.2 pl7上旋球。它是在“非均匀采样”模式下获得的,并使用“泊松间隙”调度对1024个增量采样25%。在Topspin 3.5pl7(在你的电脑上)中,使用默认的压缩感知(CS)方法将数据处理为2048 × 2048数据点。这个实验使用hsqcedetgpsp,使-CH2基团与-CH和-CH3基团处于相反的相。3脉冲序列。采用相位敏感模式,采用回波/反回波- tppi梯度选择,在选择步骤中采用形状绝热脉冲编辑多重性。非均匀采样;采用泊松间隙加权调度获得1024个增量中的25%;每个扫描2次(SWF1 = 190 ppm, SWF2 = 12.99 ppm, TD = 1816, AQ = 0.14 s, D1 = 0.8 s)。使用qsin函数(SSB = 2)处理到2048 × 2028个点。gydF4y2Ba
标准Flavone编号:gydF4y2Ba
数据和材料的可用性gydF4y2Ba
FE-SEM大面积瓷砖扫描gydF4y2BaD. Tapetodes.gydF4y2Ba叶片和羊毛纤维的数字显微镜测量已经沉积在gydF4y2Bahttps://dx.doi.org/10.17632/tk534bkb85.1gydF4y2Ba.本研究中使用和/或分析的其他数据集可根据合理要求从通讯作者处获得。植物材料的申请应直接向剑桥大学植物园提出。gydF4y2Ba
缩写gydF4y2Ba
- BDMA:gydF4y2Ba
-
BenzyldimethylaminegydF4y2Ba
- BSD:gydF4y2Ba
-
后向散射电子探测器gydF4y2Ba
- CBD:gydF4y2Ba
-
同心后向散射探测器gydF4y2Ba
- CS:gydF4y2Ba
-
压缩传感gydF4y2Ba
- 部:gydF4y2Ba
-
偏振转移无失真增强gydF4y2Ba
- DFQCOSY:gydF4y2Ba
-
双滤网(量子)相关光谱gydF4y2Ba
- DIW:gydF4y2Ba
-
去离子水gydF4y2Ba
- DMSO:gydF4y2Ba
-
二甲基亚砜gydF4y2Ba
- 新兴市场:gydF4y2Ba
-
电子显微镜gydF4y2Ba
- ESI:gydF4y2Ba
-
电喷雾电离gydF4y2Ba
- FE-SEM:gydF4y2Ba
-
场发射扫描电镜gydF4y2Ba
- 这部电影:gydF4y2Ba
-
荧光寿命成像gydF4y2Ba
- HMBC:gydF4y2Ba
-
异核多键相关gydF4y2Ba
- 高效液相色谱法:gydF4y2Ba
-
高效液相色谱法gydF4y2Ba
- HRMS:gydF4y2Ba
-
高分辨率质谱gydF4y2Ba
- JCH:gydF4y2Ba
-
C-H键的J耦合常数gydF4y2Ba
- LCMS:gydF4y2Ba
-
液相色谱质谱法gydF4y2Ba
- MW:gydF4y2Ba
-
分子量gydF4y2Ba
- 核磁共振:gydF4y2Ba
-
核磁共振gydF4y2Ba
- PBS公司:gydF4y2Ba
-
磷酸盐缓冲溶液gydF4y2Ba
- PPM:gydF4y2Ba
-
百万分之gydF4y2Ba
- SE:gydF4y2Ba
-
二次电子gydF4y2Ba
- 扫描电镜:gydF4y2Ba
-
扫描电子显微镜/显微镜gydF4y2Ba
- 透射电镜:gydF4y2Ba
-
透射电子显微镜gydF4y2Ba
- TFA:gydF4y2Ba
-
三氟乙酸gydF4y2Ba
- TPPI:gydF4y2Ba
-
时间比例相位增量gydF4y2Ba
- 紫外线:gydF4y2Ba
-
超紫色gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
Lidén M.报春花属(报春花科),一个概述和5新种。Willdenowia。2007;37:37。gydF4y2Ba
- 2。gydF4y2Ba
BA, der Gattung A, Fenzl D. Bull l 'Académie impériale des Sci St Pétersbg。1871; 16:547 - 63。gydF4y2Ba
- 3.gydF4y2Ba
格雷-威尔逊C.酒神属。高山花园社会;1989gydF4y2Ba
- 4.gydF4y2Ba
Beckett KA,Grey Wilson C。阿尔卑斯花园协会(英国)。阿尔卑斯山百科全书:AGS出版物;1993gydF4y2Ba
- 5.gydF4y2Ba
米勒H。XCVI.—报春花中的黄酮类物质。化学社会学报。1915;107:872–8.gydF4y2Ba
- 6.gydF4y2Ba
Blasdale WC。小齿报春花固体分泌物的组成。J Am Chem Soc. 1945;gydF4y2Ba
- 7.gydF4y2Ba
Hinterdobler W,Valant Vetschera KM,Brecker L。从部分酒神属植物(报春科)分泌物中提取的新报春花型黄酮。自然生产公社。2017;12:1673–6.gydF4y2Ba
- 8.gydF4y2Ba
Bhutia TD,Valant-Vetschera Km,Brecker L.汉山黄酮类药物和来自瓜U拉的二羟基葡萄酒。Nat Prod Communce。2013; 8:1081-4。gydF4y2Ba
- 9.gydF4y2Ba
valant-vetschera km,bhutia td,Wollenweber E. Dionysia渗出异味的化学大学(Primulaceae):比较研究。植物化学。2010; 71:937-47。gydF4y2Ba
- 10。gydF4y2Ba
报春花渗出黄酮类化合物:结构和生物遗传化学多样性。Nat Prod commen . 2009; 4:365-70。gydF4y2Ba
- 11.gydF4y2Ba
Vitalini S、Flamini G、Valaguzza A、Rodond G、Iriti M、Fico G。月见草。地上部分:形态,挥发性化合物和类黄酮。植物化学。2011;72:1371–8.gydF4y2Ba
- 12.gydF4y2Ba
Bhutia TD, Valant-Vetschera KM。4 .报春花分泌物类黄酮的多样性研究。自然科学进展,2012;gydF4y2Bahttps://doi.org/10.1177/1934578x1200700509gydF4y2Ba.gydF4y2Ba
- 13。gydF4y2Ba
关键词:报春花,植物化学,形态分析,植物多样性植物化学,2007;68:1683 - 91。gydF4y2Ba
- 14。gydF4y2Ba
炮击贝斯,驾驶MW。植物细胞生物学:结构与功能。琼斯和巴特利特出版社;1996gydF4y2Ba
- 15.gydF4y2Ba
Wollenweber E,Schnepf E. Vergleichende UntersuchungenÜberdie flavonoiden exkrete von“mehl” - und“Öl”-drüsenbei mafelnund die feinstruktur derdrüsenzellen。z pflanzenphysiol。1970年; 62:216-27。gydF4y2Ba
- 16.gydF4y2Ba
江口,Doseff Ai,Grotewold E.Flavones:从生物合成到健康益处。植物(巴塞尔,瑞士)。2016; 5(2):27。gydF4y2Ba
- 17.gydF4y2Ba
肖普克H、克奈塞尔M、比尔胡斯L、罗伯内克H、维尔曼R。开文报春腺体苯丙氨酸解氨酶和查尔酮合酶的研究。Wats):免疫荧光和免疫金定位。足底。1995;196:712–9.gydF4y2Ba
- 18.gydF4y2Ba
在大麦初生叶中,类黄酮的合成需要液泡的存在,并控制液泡中类黄酮运输的活性。植物杂志。2007;144:432-44。gydF4y2Ba
- 19.gydF4y2Ba
Farber C,Li J,Hager E,Chemelewski R,Mullet J,Rogachev AY,等。拉曼光谱和红外光谱在植物表皮蜡结构表征中的互补性。ACS欧米茄。2019;4:3700–7.gydF4y2Ba
- 20。gydF4y2Ba
Lersten NR, Czlapinski AR, Curtis JD, Freckmann R, Horner HT。被子植物叶肉细胞中的油体:综述和一项选定的调查。Am J Bot, 2006; 93:1731-9。gydF4y2Ba
- 21。gydF4y2Ba
Freyre CAC、Rauher PC、Ejsing CS、Klemm RW。MIGA2连接线粒体、内质网和脂滴,促进脂肪细胞新生脂肪生成。摩尔细胞。2019;76(811–825):e14。gydF4y2Ba
- 22。gydF4y2Ba
黄阿赫。植物脂滴及其相关蛋白:快速发展的潜力。植物生理学。2018;176:1894.gydF4y2Ba
- 23。gydF4y2Ba
Sisa M,Bonnet S1,Ferreira D,Van der Westhuizen JH。黄酮类化合物的光化学。分子。2010; 15:5196-245。gydF4y2Ba
- 24。gydF4y2Ba
太阳紫外线照射与高等植物的生长发育。光生理Curr Top. 1971;6:131。gydF4y2Ba
- 25。gydF4y2Ba
WeidenbörnerM,JHA HC。黄酮和黄酮的抗真菌光谱对34种不同的真菌进行测试。Mycol Res。1997年; 101:733-6。gydF4y2Ba
- 26。gydF4y2Ba
acta optica sinica, 2010, 32(1): 1 - 5 .科伦坡,Flamini G, Christodoulou MS, Rodondi G, Vitalini S, Passarella D等。高山报春花属:植物化学和形态调查。植物化学。2014;98:151-9。gydF4y2Ba
- 27.gydF4y2Ba
GUEPLER JH,Hanneman WW,Kagal SA,Dappen Ji,Edman Jr。羟基黄酮的物理和化学性质。IV。含有5-羟基的二羟基黄酮的红外吸收光谱。J HOLEDOCYCL CHEM。1966年; 3:55-60。gydF4y2Ba
- 28.gydF4y2Ba
jh,hanneman ww。羟基黄酮的物理和化学性质。I.单羟基黄酮的红外吸收光谱及其O-甲基和O-乙酰基衍生物1,2。JORG CHEM。1962年; 27:381-9。gydF4y2Ba
- 29.gydF4y2Ba
Wendelbo P.在狄奥尼鸠属(Primulaceae)中的Xeromorphic适应。安德·纳库尔斯托里臣馆维也纳博物馆。1971; 75:249-54。gydF4y2Ba
- 30gydF4y2Ba
高山植物虎耳虎鳞(Saxifraga scardica)的叶缘组织和产硅钙石渗水器的存在。植物。2018;241:27-34。gydF4y2Ba
- 31。gydF4y2Ba
Alonso-Serra J,Shi X,阳糊A,Rastas P,Bourdon M,Immanen J等人。桦树树中的垂直丙灭虫响应需要Eimbäki轨迹。Curr Biol。2020; 30:589-99。gydF4y2Ba
- 32。gydF4y2Ba
Kunz D,Wang A,Chan Cu,Pritchard Rh,Wang W,Gallo F,等。超开放式张力下调控制禽胚胎的体轴形成。生物XIV。2021; 1:1。gydF4y2Ba
- 33。gydF4y2Ba
Wightman R、Busse Wicher M、Dupree P。相关FLIM共焦拉曼光谱在植物木质素组分和自荧光研究中的应用。微米。2019;126:102733.gydF4y2Ba
- 34。gydF4y2Ba
cyclo加成策略用于合成多种杂环螺旋环,用于基于片段的药物发现。欧洲J Org Chem. 2019;2019:5219 - 29。gydF4y2Ba
确认gydF4y2Ba
我们感谢Trevor Groves借助低kV kV SEM成像的未涂层纤维和Beverley Glover教授进行批判性阅读。我们很感激有机会进入gydF4y2Ba绦虫酒神gydF4y2Ba和gydF4y2Ba樱草属Marginata.gydF4y2Ba剑桥大学植物园。感谢David Rankin教授提供的gydF4y2BaPrimula Bullata.gydF4y2Ba.TEM和FE-SEM使用剑桥大学剑桥高级成像中心(CAIC)的EM设备进行。gydF4y2Ba
资金gydF4y2Ba
显微镜核心设施由盖茨比慈善基金会资助。Spring实验室感谢EPSRC、BBSRC和皇家学会的支持。JG感谢BBSRC博士培训计划和阿斯利康的资助。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
RW, SW和PA在MB和DS的帮助下设计了这个项目。SW和PA繁殖和准备所有的植物材料。MB进行组织学、荧光和光镜、透射电镜和FE-SEM检查。KM帮助TEM和FE-SEM样品制备和成像。JG在DS的监督下进行化学分析。RW采用Raman显微镜、FLIM和cryoSEM。GE进行了数字显微镜和纤维直径测量。所有作者对手稿的写作都有贡献。作者阅读并批准了最终稿件。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
绦虫酒神gydF4y2Ba和gydF4y2Ba樱草属Marginata.gydF4y2Ba从培养的植物中取样,允许剑桥大学植物园的许可。gydF4y2BaPrimula Bullata.gydF4y2BavargydF4y2Ba布拉塔gydF4y2Ba在栽培植物的所有者大卫·兰金教授的许可下进行了取样和使用。不需要伦理审批。gydF4y2Ba
同意出版gydF4y2Ba
不适用于稿件不包含任何单独的识别数据。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件7。gydF4y2Ba用亲脂性染料尼罗红处理后,通过D.绒毡绦虫腺毛的单一解卷积共聚焦z -堆栈的电影进展。gydF4y2Ba
附加文件1。gydF4y2Ba
大泡报春花的花粉由非常短的纤维组成。叶粉线的扫描电镜图像如(A)所示。红色箭头表示短螺纹。毛线直径平均值及范围见(B)。P。(C)中显示了泡状体、泡状体和边缘报春。箭头表示样本之间共享的峰值。gydF4y2Ba
附加文件2。gydF4y2Ba
所有的数据和解释加上注释的HLPC, LCMS, HRMS和核磁共振化学分析。gydF4y2Ba
附加文件3。gydF4y2Ba
钙荧光染色的腺体毛细胞切片的共聚焦透射图像(A, C)和细胞壁荧光(B, D)。羊毛出口孔,在荧光图像中观察到离散的间隙(箭头),靠近密集的液泡(V)。gydF4y2Ba
附加文件4。gydF4y2Ba
腺毛的荧光寿命成像(FLIM)与拉曼光谱沿着一条线获得的毛细胞。FLIM数据(中左图像)代表了自体荧光的寿命。含粉质物质的毛和毛状细胞边缘寿命短(青色和蓝色),信号高;细胞内部寿命短(蓝色),信号低(绿色)。沿直线精确位置的拉曼测量确定了在细胞边缘存在黄酮类物质,并具有与植物表皮蜡相同的强峰(上光谱,分配给突出的峰)。注意FLIM图像中强烈的青色标记,与绵状粉(白色盒状区域)寿命相似。在细胞内的近端位置,没有蜡相关峰和强黄酮峰(低光谱)。两处均检测到类胡萝卜素。细胞内的另一个位置产生强烈的黄酮峰(中心光谱),可能代表了细胞内的黄酮存储。gydF4y2Ba
附加文件5。gydF4y2Ba
FE-SEM图像显示来自幼苗和叶细胞的完整和连续膜。注意这些图像是从与图1所示的Farina产生腺毛状体的相同部分中取出。gydF4y2Ba4gydF4y2Baj-n。gydF4y2Ba
额外的文件6。gydF4y2Ba
用FE-SEM大面积扫描D。绦虫。高分辨率的瓷砖图像使细胞器得以解决。放大的例子腺头细胞和附近的叶肉细胞显示。红色箭头指出了可能是脂滴的候选电子透明细胞器。黄色箭头表示大小相似的电子密集液滴。大小为35172 x 46156像素的全分辨率平铺图像以http://dx.doi.org/10.17632/tk534bkb85.1.gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Bourdon,M.,Gaynord,J.,Müller,K.H。gydF4y2Baet al。gydF4y2Ba显微镜和化学分析显示黄酮类羊毛纤维从微米大小的孔中挤出的腺毛gydF4y2Ba绦虫酒神gydF4y2Ba.gydF4y2BaBMC植物杂志gydF4y2Ba21,gydF4y2Ba258(2021)。https://doi.org/10.1186/s12870-021-03010-9gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03010-9gydF4y2Ba
关键字gydF4y2Ba
- 细胞壁gydF4y2Ba
- 狄奥尼岛gydF4y2Ba
- 法里纳gydF4y2Ba
- 黄酮gydF4y2Ba
- 腺毛gydF4y2Ba
- 羟基硫酮gydF4y2Ba
- 液泡gydF4y2Ba
- 羊毛gydF4y2Ba