摘要
背景
磷(P)是核酸、细胞膜和酶的基本成分之一,是多种细胞过程如光合作用/碳水化合物代谢、能量生产、氧化还原稳态和信号传递等不可或缺的物质。缺磷严重影响作物产量;为了应对缺磷,植物进化出了几种策略。一些水稻基因型与低效磷相容,而另一些则对缺磷敏感。然而,低磷耐受性的分子机制在很大程度上仍未被探索。
结果
针对水稻苗期缺磷反应的研究有很多,但针对生长后期缺磷的分子方面/反应的研究很少。为了阐明耐低磷的分子机制,一对对照水稻(栽培稻l .)基因型(即.Pusa-44(缺磷敏感)及其近等基因系(NIL-23,耐磷磷吸收1(Pup1) QTL来自an来自使用了landrace Kasalath]。形态学、生理学和生化分析的比较证实了一些众所周知的发现。对45日龄的水稻植株在磷充足(16 ppm Pi)或磷缺乏(0 ppm Pi)培养基下水培生长的茎和根组织的转录组分析显示,磷饥饿胁迫会导致全球转录重编程,影响多个转录因子、信号通路和其他调控基因。我们可以发现,在Pi-饥饿条件下,il -23根系中有几个显著上调的基因可能与耐Pi饥饿有关。途径富集分析表明,某些磷酸酶、转运蛋白、转录因子、碳水化合物代谢、激素信号和表观遗传过程在提高il -23的p -饥饿胁迫耐受性方面起着重要作用。
结论
我们报告了重要的候选机制,Pi的获取/增溶、回收、重组/转运、传感/信号传导、遗传/表观遗传调控和细胞壁结构变化,这些机制都与il -23的耐磷性有关。本研究为提高水稻品种磷利用效率提供了一些新的信息。
背景
磷(P)是包括植物在内的生物体所必需的最重要的宏量营养素之一。它是DNA、RNA和细胞膜等生物大分子的重要组成部分,是酶、ATP和NADPH等分子正常运作的必要条件,也是植物生长发育的基本要求[1].磷主要以H的形式被根系吸收2阿宝4−或HPO4−2从土壤中。虽然充足数量的磷素在土壤中的存在,其可用性在正磷酸盐/无机磷酸盐(π)形式往往是阻碍由于溶解度低,静止和高高P植物由于吸附、沉淀、和/或转换有机形式(2,3.,4].缺磷导致植物生长减少、叶片卷曲、侧根多毛、叶片紫色色素沉着和/或分蘖减少,从而导致严重的产量损失[5].据估计,世界上30 - 40%的可耕地的作物生产力有限,主要是因为Pi含量低[6].在印度,旱地土壤中磷的有效性很低,而且大多数印度土壤的利用率正在恶化。7].事实上,土壤缺磷正成为一个全球性问题;因此,在土壤中施用磷肥已成为确保更好生产力的必要条件。这就是全球在作物畜牧业中大量使用磷肥的原因。相反,作物植物的磷利用效率已下降至< 20% [8].但是,持续/广泛使用磷肥在经济和生态上都是不可持续的,因为磷肥的成本较高。磷矿粉的有限储量[9],作物施用磷肥的利用率较低,过量施用磷肥导致环境破坏[10].因此,提高作物植物对磷的利用效率,探索利用土壤中天然有效磷的可能性是当今的需要。磷获取指的是通过根系吸收磷,而磷利用效率指的是细胞内磷的有效调动/内部利用[11].
根系的长度、数量和分枝、侧根/根毛密度和长度(根系形态)以及根角(根系几何形状),通常用根系构型(RSA)表示,在从土壤中吸收磷方面起着重要作用[12].植物通过调节其RSA来增加根表面积以获得更好的磷。在一些植物中观察到根系簇的形成是对土壤中低磷的响应,根系簇分泌有机酸,酸化/释放根系周围的螯合离子,从而更好地利用磷和其他微量营养素[13,14,15].植物释放磷酸酶和RNase以提高磷的利用率和采收率[16,17].植物具有特殊的转运蛋白和其他分子机制,可以将磷在细胞内分隔室中转移,磷可能以有机(植酸)的形式储存在这些分隔室中。因此,人们正努力理解控制植物中磷吸收/内稳态的机制,以提高磷利用效率[18,19,20.].
人们还试图分析不同植物(包括水稻)不同组织的转录组数据,以确定与磷缺乏性耐受相关的候选基因/机制。这些植物在不同条件下生长,直到不同发育阶段。然而,大多数研究都是在苗期进行的[20.,21,22,23,24,25].只有为数不多的研究使用了处于发展晚期的不同植物品种[19,20.,21].大米(栽培稻L.)是最重要的谷物之一,是全球一半以上人口的主食[26].一个来自以Kasalath为研究对象,鉴定了一个耐磷性状QTL (QTL)。Pup1)映射到第12号染色体的较长臂上[27].之前试图将Kasalath等位基因联系在Pup1已知的p摄取相关机制表明Pup1近等基因系(NILs)的磷吸收效率提高了3倍[28].的Pup1QTL,一般在粳稻而且籼稻水稻(现代)品种,已报道携带耐磷酸盐饥饿1(PSTOL1)基因编码一种激酶以增强对磷的获取。然而,潜在的机制的功能Pup1仍然是神秘的29,30.].虽然,没有发现明显的p摄取基因定位Pup1, QTL对缺磷耐受性的影响较大[31].预测的68个基因模型Pup1,其中大部分与转座子具有序列相似性,而另一些则无法准确注释。一些基因编码假定的脂肪酸加氧酶、直接蛋白样蛋白、天冬氨酸蛋白酶、假定的蛋白质和假定的蛋白激酶[31].
p饥饿胁迫下的转录组分析已经在许多植物中进行,包括拟南芥、水稻、小麦和玉米[22,24,25,32,33,34,35,36,37].大多数研究报道的基因差异表达主要涉及P转运、磷酸酶、转录过程、碳代谢/光合作用、脂质代谢、细胞壁重塑等。这些转录组研究中,许多只对短时间p -应激进行了研究[20.,22,25,33,34,35,36].拟南芥中有9个磷转运蛋白1 (PHT1)家族基因[38]和大多数的PHT1据报道,基因在根的不同部位表达。在大米、13PHT1据报道,高亲和力P转运蛋白基因表达[39,40],其中包括OsPHT1; 1,OsPHT1; 2,OsPHT1; 3,OsPHT1; 6,OsPHT1; 8已被功能表征[19,41,42,43].最近的一项研究表明OsPHT1; 3在极低磷环境中调节Pi的吸收、转运和再动员[19),而OsPHT1; 11早前曾报道可被菌根共生特异性激活[40].没有明显的诱导OsPHT1; 1基因在极低磷浓度的水稻中被发现[42].最近,一种类似sultr的磷分布转运体(SPDT)被报道在水稻中Pi的分布中发挥同样重要的作用[44].
为了应对缺磷胁迫,植物进化出了一定的适应性反应。磷转运蛋白和相关的转运蛋白如磷饥饿反应(如磷饥饿反应)。PHR1), SPX(磷酸依赖性抑制剂PHR1)等在缺磷应激下发挥重要作用。OsPHR2(参与p饥饿信号通路)正调控p饥饿诱导基因的表达,如OsPHTs.据报道,其他一些基因在磷饥饿下也有表达,其中包括高亲和力磷转运蛋白(PHT1; 6)[41],SPX[45]和单半乳糖二酰基甘油合酶(MGD)参与半乳糖合成[46].此外,据报道,植物特异性WRKY家族转录因子可调节非生物胁迫下的转录过程[47,48].的表达PHT1由于启动子中顺式作用元件的存在,基因被转录因子调控[49,50].WRKY与含有TFs的C2H2锌指结构域共同调控靶基因的转录[51].MYB2在非生物胁迫下作为aba依赖/ aba独立基因的转录激活子,在p -饥饿的拟南芥中也激活miR-399f的转录[52].据报道,miR-399和miR-827可正向调控磷转运和利用相关基因的表达[53].
植物激素如生长素、细胞分裂素、乙烯和ABA参与了p饥饿反应基因的转录调控[54].有报道称aba信号通路会影响根的发育、根构型、根毛密度和根冠生物量比[55].据报道,在缺磷条件下,最佳水平的赤霉素(GA)对根毛生长是必要的。胁迫降低生物活性GA水平,从而导致DELLAs积累,并引发拟南芥根构型改变、芽生长减少和花青素积累等反应[56].据报道,p饥饿上调了GA生物合成基因GA3-ox2在myb1水稻突变体,导致GA水平提高和侧根长度增加[18].这表明MYB1介导营养信号通路和植物激素信号通路之间的相互作用。也有研究报道茉莉酸生物合成和信号基因在拟南芥和高粱中的表达增强[25,57].
在本研究中,对比基因型Pusa-44 (p -饥饿敏感)和nil23 (p -饥饿耐)在充足或饥饿条件下水培生长的45日龄(营养/分蘖期)植株的茎和根组织的转录组比较分析揭示了一些与耐胁迫相关的候选基因/机制。为了应对缺磷,植物进化出了许多策略,包括形态变化,如增加侧根的长度和密度,形成更密更长的根毛,从而更好地觅食土壤。生化变化如酸性磷酸酶的增加和有机酸的分泌,分子变化如基因表达的动态调节,代谢变化如碳水化合物和脂类代谢的重编程,以帮助提高植物的磷利用效率。因此,本研究为提高水稻耐磷性提供了与磷转运、信号转导、磷酸酶合成、转录因子编码、核心组蛋白结构域蛋白和富含甘氨酸的细胞壁结构蛋白相关的差异表达基因。研究发现的耐磷基因/耐磷机制可用于水稻在缺磷土壤中的增产。
结果
磷胁迫下植物形态发育的变化
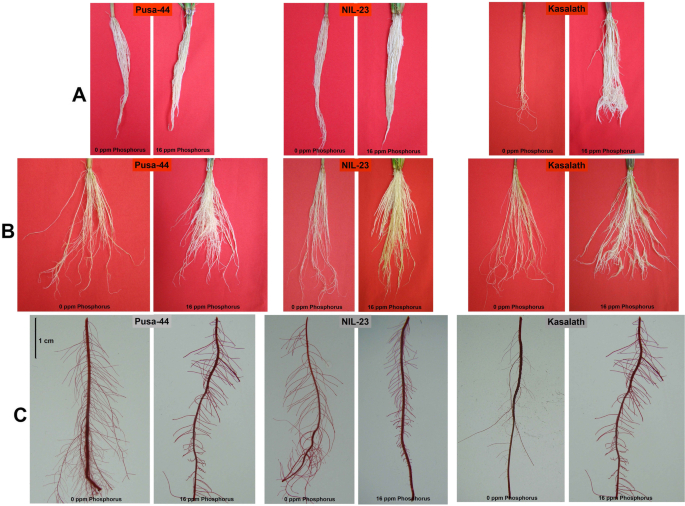
对比水稻(Pusa-44和nil23)基因型在添加/不添加磷的培养基中水培栽培至营养/分蘖(45天)期。我们观察到,即使在植株幼苗期(20日龄),由于磷的缺乏,根系的生长也发生了显著的变化(补充图S1).在含有不同浓度(0 ~ 40ppm) Pi的水培培养基中生长的植株的芽形态比较表明,较高浓度(20 ~ 40ppm)的Pi对植株的芽形态没有明显影响。然而,较低的Pi浓度(0 - 12ppm)与最佳的(16ppm) Pi含量相比,显著降低了幼苗的芽生长(补充图S2).由于磷饥饿胁迫,在植物营养期(45日龄)观察到芽和根的生长明显下降(补充图S .)3.).p饥饿胁迫对植株的高度/生物量有相当大的影响(图1)。1,补充表S1).缺磷/缺磷导致生长发育不良,分蘖减少,叶片变短直立(补充图S4).在营养生长阶段,由于水培条件下的磷饥饿,根系的生长在数量和扩散方面显著减少(图1)。2A, B)。此外,在水稻基因型中,由于磷饥饿胁迫,第三根/根毛的大小显著增加(图1)。2C)。
根冠生物量比的影响
对不同基因型水稻在磷饥饿胁迫下根系和茎部生物量的比较分析表明,磷饥饿胁迫对根系和茎部生物量有显著影响。但胁迫对茎部生物量的影响较根部更为显著。由于磷饥饿胁迫,梢生物量显著减少(63%)。更重要的是,与茎部相比,根系生物量减少较少(缺磷敏感型减少50%,耐缺磷基因型减少36 - 41%)。此外,在胁迫胁迫下,胁迫敏感型和耐胁迫型水稻的根冠生物量比均显著增加(补充表S1).NIL-23基因型的根冠生物量比(0.5)高于Pusa-44基因型的根冠生物量比(0.286)。
缺磷对叶片形态和叶绿素含量的影响
在磷饥饿胁迫下,水稻基因型叶片的大小和面积显著减小。缺磷敏感基因型(Pusa-44)的叶片长度减少了50%以上,叶片宽度减少了72%,而耐磷基因型(nil23和Kasalath)的叶片长度减少了41 - 44%,叶片宽度减少了54 - 60%(补充图S5).在水培介质中,叶片总叶绿素含量随着磷有效度的降低而显著降低。然而,当圆周率不存在时,下降幅度要高得多。与il -23(耐磷)基因型相比,Pusa-44(缺磷敏感型)对磷饥饿胁迫的反应更为显著(补充图S6).
内在和分泌酸性磷酸酶活性的变化
在磷饥饿胁迫下,根系中磷酸酶活性明显高于茎部。耐磷水稻基因型根系中酶活性的增加最为显著。随着缺磷程度的增加,酶活性显著升高,在耐磷基因型中表现尤为明显。在水培培养基中,随着磷的缺乏,磷酸酶活性也会增加(补充图S7).
在缺磷胁迫下,三种基因型水稻根系分泌的磷酸酶均增加。随着水培培养基中磷缺乏的增加,apase的分泌显著增加,在耐磷基因型水稻中尤为明显。然而,当植物在p饱和胁迫下生长时,根系记录的APase分泌相对较少(补充图S8).当介质中存在Pi时,介质的pH值显著降低。介质pH值的下降随介质中Pi浓度的增加而增加(补充表S2).
磷在植物组织中的动员
在水培介质中,磷含量随着缺磷量的增加而显著降低。根系获得的大部分磷通过磷转运体被动员到嫩枝,特别是在耐磷基因型的情况下。因此,观察到茎部的磷含量比根部高(1.6 ~ 2.3倍)(补充图S9).耐磷基因型(nil23和Kasalath)获得和积累磷的能力较好。同样,磷从根到茎的动员被观察到更好,特别是在耐受基因型的情况下。
转录组文库的建立、参考基因组的测序和定位
为了全面了解水稻耐磷胁迫的机制,对水稻对缺磷胁迫反应的基因型进行了对比研究。在两个复制中成功制备了两种基因型的根和茎组织文库,用于全转录组分析,这些文库来自两种基因型在充足或缺乏pi条件下生长到分蘖期的水稻。共产生3.95亿次阅读,平均每个样本产生2500万次阅读。利用HiSat2和Stringtie对水稻参考基因组(TIGR v7)的RNA-seq数据进行了基于参考的映射,结果显示约87%的唯一映射reads1).
不同基因型水稻的差异表达基因
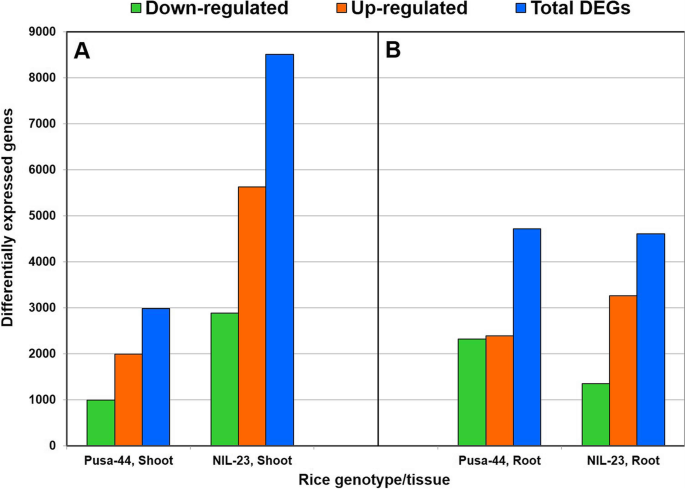
为了破译水稻耐磷胁迫的基因/机制,对根和茎的转录组数据进行了比较分析,并基于日志识别差异表达基因(DEGs)的上调或下调2-FC (fold change)和错误发现率(FDR) p < 0.05。由于本研究使用了在含有0 ppm或16 ppm Pi的培养基中水培生长的对照水稻基因型,因此将其分为4个对比组,用于分析与耐磷性有关的DEGs:(i) Pusa-44(胁迫敏感基因型)的根系完全生长(16 ppm Pi,对照)vs 0 (0 ppm Pi,处理)。结果鉴定出4716个DEGs,其中2393个基因在胁迫下上调,2323个基因下调。(ii)耐胁迫基因型NIL-23的根在全Pi(对照)和零Pi(处理)条件下生长,鉴定出4611个DEGs,其中3259个基因在胁迫下上调,1352个基因下调。(iii) Pusa-44的幼苗生长完全而非零Pi,显示出2985个DEGs,包括1992个上调基因和993个下调基因。同样,(iv)比较完全生长与零生长的NIL-23的嫩枝,在p-饥饿胁迫下发现8515个DEGs,其中5627个上调基因和2888个下调基因(图4)。3.).
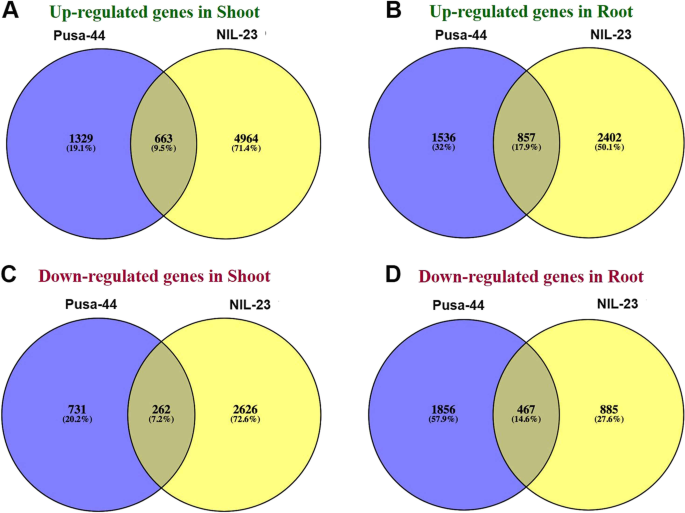
在耐胁迫水稻基因型(il -23)的根系中,2402个(50.1%的DEGs)基因被观察到专门上调,而在胁迫敏感基因型(Pusa-44)的根系中,只有1536个(32%)基因被观察到上调,而在胁迫下对照基因型中,共有857个(17.9%)基因被观察到上调(图4)。4A).在下调基因中,胁迫敏感基因型(Pusa-44)的根中下调基因有1856个,而在Pusa-44中,只有885个基因被下调,其中467个(14.6%)基因在胁迫下在两种基因型中普遍下调(图4)。4B).然而,由于磷饥饿胁迫,对比基因型的幼苗中普遍下调了262个(7.2%)基因。
同样,在对照水稻基因型的幼苗中,耐胁迫基因型中仅有4964个(71.4%)基因上调,而胁迫敏感基因型中仅有1329个(19.1%)基因上调,胁迫下两种基因型中共有663个(9.5%)基因上调(图4)。4C).在嫩枝下调基因中,胁迫敏感基因型的根下调基因有2626个(72.6%),而胁迫敏感基因型的根下调基因只有731个(20.2%),胁迫下两种基因型普遍下调的基因有262个(7.2%)(图2)。4D).在p-饥饿胁迫下,耐胁迫基因型(nil23)的茎和根中表达的DEGs数量最多(50 ~ 71%)。
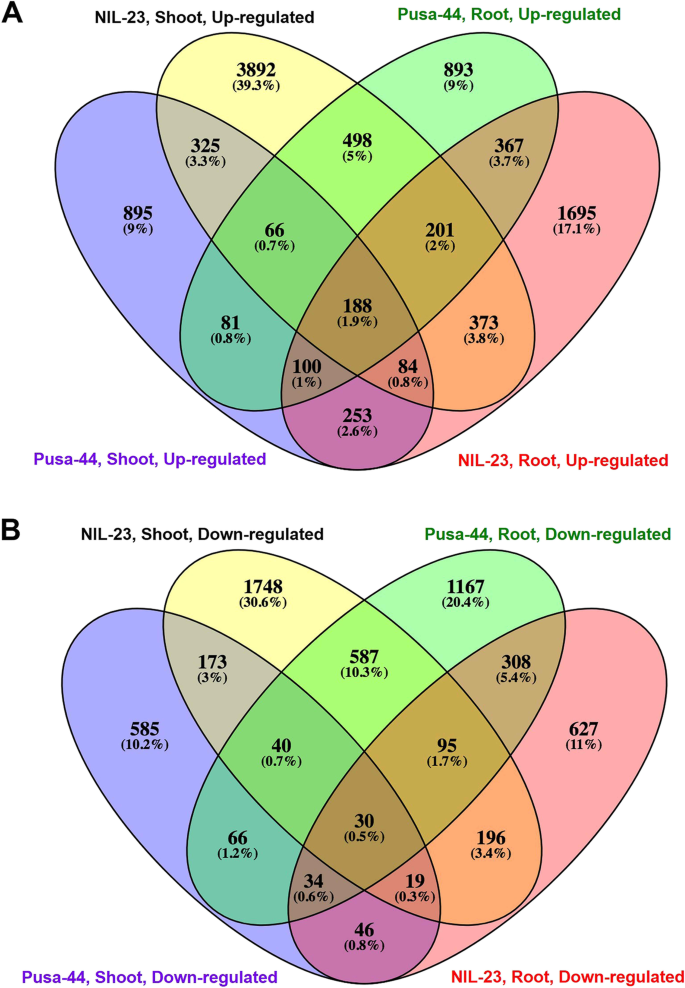
基因表达的上调在抗逆性中起着重要作用,尤其是在根系中。nil23根中有1695个(17.1%)基因特异上调,而Pusa-44根中仅有893个(9%)基因上调。同样,在il -23枝条中有3892个(39.3%)基因特异上调,而在Pusa-44枝条中仅有895个(9%)基因上调。此外,两种基因型的根和梢分别只有367个(3.7%)和325个(3.3%)基因普遍上调(图4)。5一个)。
基因下调在管理NIL-23芽的耐胁迫能力中起着重要作用。NIL-23植株中有1748个(30.6%)基因被特异性下调,而Pusa-44植株中仅有585个(10.2%)基因被特异性下调。同样,nil23根中有627个(11%)基因特异下调,而Pusa-44根中仅有4467个(20.4%)基因下调。此外,两种基因型的茎和根中分别只有173个(3%)和308个(5.4%)基因普遍下调(图4)。5B)。
关键磷响应基因的差异表达
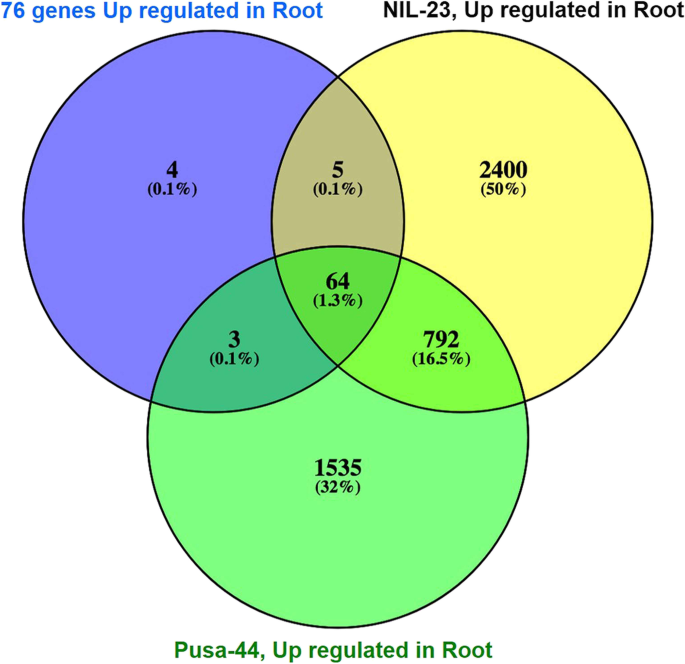
为了评估磷饥饿胁迫的施加,我们检测了先前报道的某些磷饥饿诱导基因的表达水平。我们的转录组数据表明,在il -23的根中,69个p饥饿诱导基因上调,而在胁迫敏感基因(Pusa-44)的根中,67个基因上调(补充表S3.).一些已知的pi饥饿诱导基因,即磷酸乙醇胺/磷酸胆碱磷酸酶(LOC_Os01g52230)、紫酸磷酸酶(LOC_Os08g17784)、糖基转移酶1组结构域蛋白(LOC_Os01g04920)、磷酸酯酶家族蛋白(LOC_Os11g38050)、SPX2结构域蛋白(LOC_Os03g29250)、丝氨酸/苏氨酸蛋白磷酸酶家族蛋白(LOC_Os07g01540)和无机磷酸盐转运蛋白(LOC_Os06g21950),在胁迫下,>在NIL-23的根中表达上调8倍。在已知的76个pi饥饿诱导基因中[33],其中5个基因仅在il -23的根中表达,而64个基因在两种基因型中共同表达(图5)。6).
其他基因如可溶性无机焦磷酸酶(LOC_Os05g02310)和糖基水解酶家族16 (LOC_Os06g48200)在胁迫下在il -23的根中表达显著上调。此外,6个丝氨酸/苏氨酸蛋白磷酸酶家族蛋白基因(LOC_Os07g01540、LOC_Os11g05400、LOC_Os12g44020、LOC_Os11g34710、LOC_Os03g13540和LOC_Os07g04210)在胁迫过程中在il -23的根中表达上调(补充表S3.).此外,我们观察到,在胁迫下,il -23根中含有核糖核酸酶T2家族结构域的LOC_Os08g33710和LOC_Os01g67190基因分别上调了6.3倍和2.4倍的表达。
p -饥饿过程中p转运蛋白表达的动态变化
磷转运蛋白在水稻中的表达(OsPHTS)在基因型和组织间呈动态变化。6的表达PHT1基因(OsPHT1; 6,OsPHT1; 10;OsPHT1; 4,OsPHT1; 5,OsPHT1; 2,OsPHT1; 8)在p-饥饿条件下在根部高度上调,而OsPHT1; 7表达下调(补充表S4).有趣的是,折叠变化的表达式OsPHTs与Pusa-44相比,il -23的根系中含有更多的磷。OsPHT1; 6在根中表达量最高(12.65倍)。更重要的是,OsPHT1; 9在il -23的根中有排他表达(上调3.52倍)。此外,OsPHT1; 12与根相比,水稻基因型的新梢表达明显上调(补充表S4),表明它在动员Pi从根到芽的作用。
转录因子的差异表达
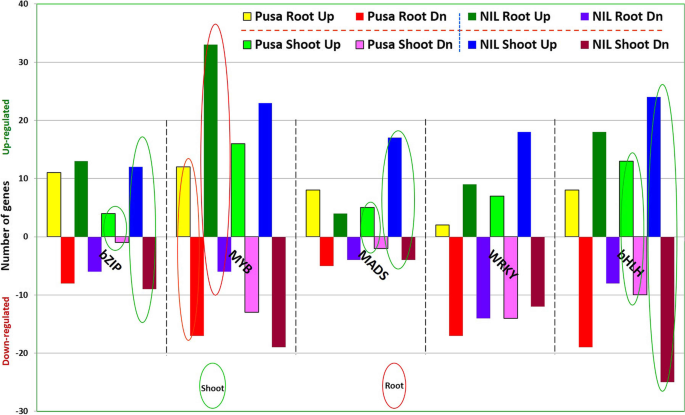
水稻基因型在磷饥饿胁迫下根和茎转录因子的表达分析表明,在nil23的根中,转录因子(转录因子)在275个基因型中有210个表达上调。同样,在nil23的幼苗中,更多的tf(389个中有277个)被观察到上调。在差异表达的转录因子中,一些已知的在胁迫下il -23表达显著上调的转录因子包括bZIP,MYB,WRKY,bHLH(无花果。7).更有趣的是,在il -23中,一个含有LOC_Os03g51690蛋白的同源结构域(LOC_Os03g51690)在根中显著上调(8.03倍),在茎中显著下调(−5.09倍),但在Pusa-44中未检测到其表达。同样,另一种同源体结构域蛋白(LOC_Os06g36680)、生长素响应因子(LOC_Os07g08520)和AP2结构域蛋白(LOC_Os03g15660)在il -23的根和茎中表达上调。同时,同型盒蛋白knot -1 (LOC_Os03g51710)在il -23根中特异性表达(上调6.28倍)。同样,GRAS家族转录因子含蛋白(LOC_Os11g04570)、组蛋白样转录因子(LOC_Os01g39850)、AP2结构域含蛋白(LOC_Os04g46410)和hsf型dna结合结构域含蛋白(LOC_Os06g36930)在il -23的根中单独表达(>上调2.5倍)(补充表S5).
差异表达基因GO分析
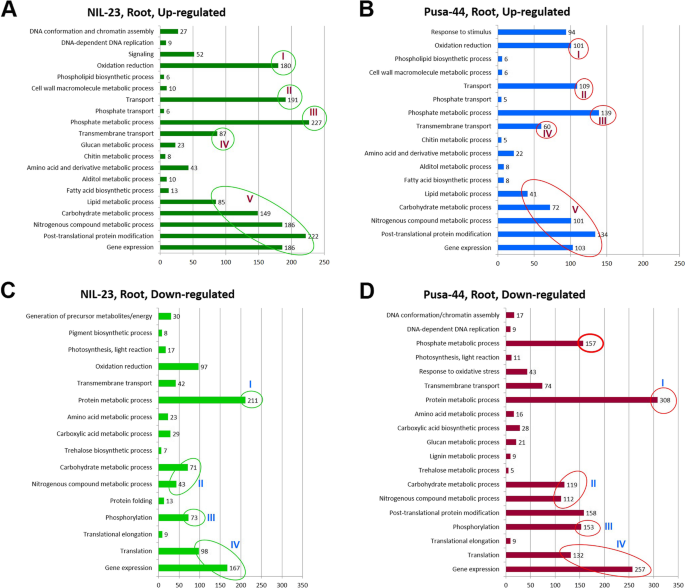
为了深入了解不同水稻基因型在不同胁迫条件下的差异基因,采用基因本体论(GO)方法分析了差异基因在不同生物/细胞/分子过程中的作用。对il -23根的GO分析表明,其表达上调的基因数量较多(229个),表达下调的基因数量较少(134个)。对il -23茎段GO分析表明,上调基因与131个GO项相关,下调基因与199个GO项相关。另一方面,Pusa-44芽中上调和下调基因分别与212和84个GO项相关。
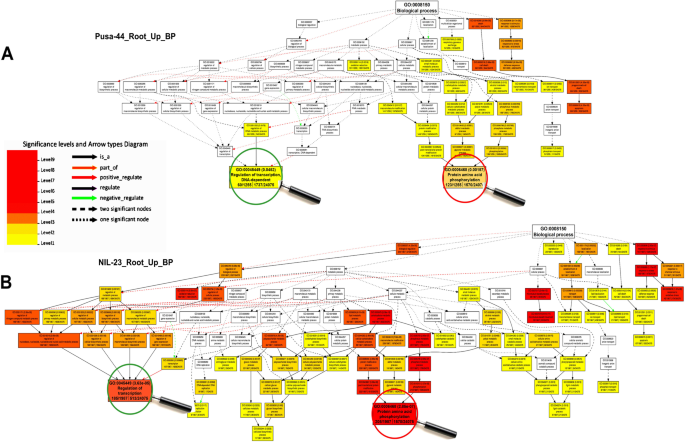
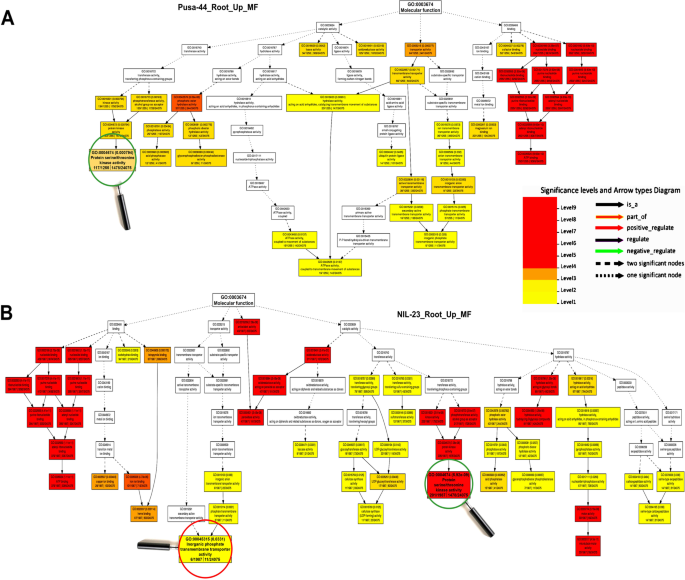
在p -饥饿胁迫下,显著富集的GO项属于分子函数,表明分子函数在抗p -饥饿胁迫中起着最重要的作用。此外,基因表达调控、对非生物胁迫的响应、抗氧化活性、转运体活性、核酸结合TF活性、催化活性和染色质结构等生物过程在胁迫下均受到显著影响(图1)。8).对DEGs的GO深入分析揭示了分子功能的动态调节,如磷酸盐稳态、DNA复制、转录/转录后基因调控、氧化还原稳态,以提高胁迫耐受性(图1)。9).此外,参与碳水化合物和脂质代谢、氮代谢过程和光合作用的基因也被观察到受胁迫的调节。基因表达的表观遗传调控和翻译后蛋白修饰是GO的其他重要术语。
细胞壁相关基因的差异表达
通过对DEGs的深入分析表明,在p饥饿胁迫下,有一组基因参与了细胞壁和相关活动。这些基因包括富含甘氨酸的细胞壁结构蛋白和扩展蛋白,在逆境中,这些基因在NIL-23的根中表达显著上调(补充表S6).胁迫导致il -23根系中富含甘氨酸的细胞壁结构蛋白基因(LOC_Os10g31540)表达上调(约7倍),而Pusa-44根系中表达下调(约3倍)。扩增素前体基因LOC_Os10g40730在il -23根中表达上调(约3.8倍),而在Pusa-44根中表达下调(约2.5倍)。同样,cesa7 -纤维素合成酶(LOC_Os10g32980)在NIL的根中表达上调(约4.6倍),而在Pusa-44的根中表达下调(约1.4倍)。此外,其他一些基因,包括葡聚糖内参-1,3- β -葡萄糖苷酶前体(LOC_Os07g35520)、微管相关蛋白(LOC_Os01g49200)、超大g蛋白相关蛋白(LOC_Os02g15820)和四菊素家族蛋白(LOC_Os06g44310)在il -23的根中表达上调,而在Pusa-44的根中表达下调。
一些ltpl蛋白酶抑制剂家族蛋白(如LTPL143, LOC_Os10g40480;LTPL139, LOC_Os10g40430)在il -23的根中显著上调(4 ~ 8倍),而在p-饥饿胁迫下Pusa-44的根中则下调(2 ~ 8倍)。此外,水通道蛋白(LOC_Os03g05290)和ABC转运蛋白、atp结合蛋白(LOC_Os05g04610)在胁迫下在il -23的根系中表达上调,而在Pusa-44的根系中表达下调(补充表S6).
植物激素和信号转导基因的差异表达
生长素反应蛋白(LOC_Os05g48270)表达上调(∼5.82倍),而下调(∼p -饥饿胁迫下Pusa-44的2.13倍)。同样,生长生长素诱导的蛋白5NG4 (LOC_Os01g36580)在il -23的根中被高度上调(5.69倍),而在Pusa-44的根中被下调。其他生长素响应家族基因(如LOC_Os12g40900, LOC_Os12g40890, LOC_Os02g05050, LOC_Os02g13520)在胁迫下也在il -23的根系中上调,而在Pusa-44中下调(补充表S7).此外,生长素外排载体基因(如LOC_Os06g44970, LOC_Os02g50960)在il -23的根中表达上调,而在Pusa-44的根中表达下调。
参与合成或响应其他植物激素的基因,如茉莉酸诱导蛋白(LOC_Os04g22900)和赤霉素2-β-双加氧酶(LOC_Os05g48700)的表达也被观察到上调。∼5.98和∼p -饥饿胁迫下,phusa -44的根系表达下调(补充表S7).
碳水化合物和脂质代谢相关基因的差异表达
不同基因型的水稻根系中碳水化合物和脂质代谢相关基因的表达存在差异。与细胞壁组织相关的甘油磷酸二酯磷酸二酯酶(LOC_Os03g40670)基因在磷饥饿胁迫下表达上调,尤其是在il -23中。其他基因如糖基水解酶(LOC_Os05g15770)、乳酸/苹果酸脱氢酶(LOC_Os08g33720)、烯醇化酶(LOC_Os03g14450)、磷酸烯醇式丙酮酸羧化酶(LOC_Os08g27840)、丙酮酸激酶(LOC_Os11g05110)、甘油醛-3-磷酸脱氢酶(LOC_Os08g03290)在胁迫下也被观察到上调。然而,在胁迫条件下,对照基因型水稻根系中海藻糖-6-磷酸合酶(LOC_Os09g20990)、蔗糖合酶(LOC_Os06g09450)和天冬氨酸氨基转移酶(LOC_Os09g28050)基因表达下调(补充表S8).
光合作用相关基因的差异表达
光系统II (44 KDa)反应中心基因(LOC_Os04g16874)在两种水稻基因型的根系中表达量均出现下调,特别是在p -饥饿胁迫下,il -23(- 5.95倍)表达量下调。同样,在水稻基因型的根系中,氧进化增强蛋白1 (LOC_Os01g31690)、细胞色素b6 (LOC_Os10g21324)和ATP合酶亚基α (LOC_Os04g16740)在胁迫下也被观察到下调。光合作用机制的其他组成基因,如nadph依赖性氧化还原酶(LOC_Os10g21418)、叶绿素A- b结合蛋白(LOC_Os06g21590)和光系统II P680叶绿素A载脂蛋白(LOC_Os10g21310)在两种水稻基因型的根组织中也被显著下调。(补充表9).另一方面,光合系统II P680叶绿素A载脂蛋白(LOC_Os10g21310)和细胞色素b6 (LOC_Os10g21324)基因在胁迫下表达上调。
参与表观遗传调控的基因差异表达
许多参与基因表达表观遗传学调控的基因被观察到表达差异。参与组蛋白修饰的一些重要基因包括核心组蛋白H2A/H2B/H3/H4结构域蛋白(LOC_Os10g28230, LOC_Os03g06670, LOC_Os03g02780)在p-饥饿胁迫下在il -23(耐胁迫基因型)根中上调,在Pusa-44(胁迫敏感基因型)根中下调(补充表S10).此外,参与组蛋白去甲基化的jmjC结构域蛋白(LOC_Os02g58210)基因在胁迫下在il -23的根系中上调了1.44倍,而在Pusa-44基因型中下调了−1.74倍。C-5胞嘧啶特异性DNA甲基化酶(LOC_Os10g01570)表达上调(∼在胁迫下NI-23根中表达为3.33倍,而在Pusa-44根中表达为2.48倍。此外,在耐胁迫水稻基因型中,甲基- cpg结合域蛋白(LOC_Os12g42550)基因表达下调。有趣的是,在热冲击或其他环境胁迫下产生的低分子量(20 kDa)蛋白——hsp20-α-晶体蛋白家族蛋白(LOC_Os03g06170, LOC_Os10g07210, LOC_Os10g07200)在il -23的根中被观察到在胁迫下上调(2.8 ~ 5.5倍),而在Pusa-44的根中下调(2.9 ~ 3.9倍)(补充表S10).
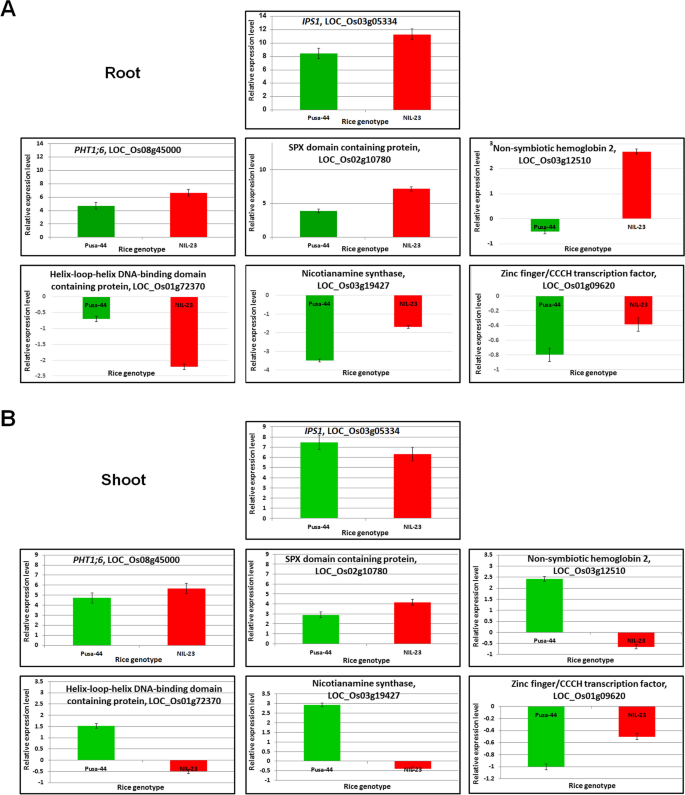
通过实时PCR分析验证转录组数据
采用RT-qPCR方法,对7个随机选择的基因在根系和茎部对p -饥饿胁迫响应的表达水平进行了验证。结果与RNA-seq检测的基因表达模式一致。(无花果。10).因此,RT-qPCR结果证实了我们从RNA-seq中获得的数据是可信的。
讨论
无机磷往往是植物生长、发育和生产力的限制因素。然而,植物采取适应性措施,如改变根系生长/结构以进入更大体积的土壤中寻找磷,排泄有机酸/磷酸酶/核酸酶以溶解有机来源的磷和/或循环利用内部的磷[2来减轻压力的影响。虽然植物缺磷信号的一些成分已经被发现,但主要的信号通路仍未被探索。PSTOL1,编码为Pup1-特异性蛋白激酶[29],被鉴定为在现代敏感水稻品种和耐受(Kasalath)基因型之间传递磷缺乏性的变异。植物抗磷能力的研究多在苗期进行[20.,21,22,23,24,25,58因为林分的建立是提高作物生产力的第一步,也是重要的一步。一旦幼苗形成,植物的生长发育(营养生长)对磷的需求同样重要。营养期植株生长迅速,磷的需要量明显高于苗期。因此,植物采用多种生化、生理和分子策略来满足需求[59].
因此,我们旨在研究水稻植株在苗期以后应对磷的有限有效性所采取的策略/机制。当植物生长在缺磷土壤中,从萌芽到分蘖,直到成熟,都面临着持续的胁迫。因此,水稻从发芽开始就在磷胁迫下生长。此外,在水培培养基中,与提供的Pi浓度(16 ppm)相比,零Pi提供了最反差的条件,据报道,这是PusaRicH培养基中对大量水培水稻基因型生长的最佳Pi浓度[60].因此,我们在水培介质中使用无/零(0 ppm) Pi进行应力处理。
植物形态生理生化适应
在充足磷和缺磷条件下生长的水稻植株形态对比分析表明,在幼苗期(20日龄),由于磷的缺乏,植株根系数量显著减少,但植株长度显著增加。然而,耐受性基因型的根长增加更多(50 - 60%)(补充图S1),这与早期对不同植物种类的研究结果一致[11,25,28,35,61].这可以通过增加根系表面积在胁迫下吸收磷来获得更好的磷。根据一项中试实验,表明当培养基中Pi浓度高于16ppm时,植物形态没有显著改善(补充图S2),确定了水培介质中Pi的上限。因此,在PusaRicH培养基中使用16 ppm的Pi在对照条件下种植水稻植株。此外,在所有三种基因型中都观察到磷饥饿对根和茎发育的显著影响(补充图S3.).
由于磷是生物有机体的基本营养物质之一,是核酸和磷脂生物合成、酶活性、信号转导、ATP形式的能量运输和其他几种代谢过程所必需的,磷缺乏在减少生物量方面极大地影响了根和芽的生长。分蘖期(45日龄植株),在磷饥饿(0 ppm Pi)胁迫下,Pusa-44植株的高度比对照条件下降低了71%。记录到的nil23和Kasalath植株的高度分别只有47和51%。1,补充图S4).叶片是植物生长发育最重要的部分之一,磷饥饿导致叶片尺寸和表面积显著减小(胁迫敏感基因型减小51%,耐胁迫基因型减小41 - 44%)(胁迫敏感基因型减小84%,耐胁迫基因型减小68 - 70%)(补充图S5).正如预期的那样,我们观察到叶绿素含量随着水栽介质中磷有效度的降低而显著降低。然而,当Pi不存在于介质中时,还原率要高得多(补充图S6).据报道,缺磷会影响叶片叶绿素含量[62].考虑到叶绿素的重要性一个提出了利用荧光分析法检测田间土壤缺磷的方法[63].
为了更全面地了解磷胁迫对根、梢生长和根冠生物量比的影响。这揭示了磷饥饿对根系生长(数量/生物量、扩展和分枝/第三根/根毛)的显著影响,特别是在Pusa-44中(图4)。2,补充表S1).植物采用多种策略获取磷,重点是从土壤中探索和吸收磷[64].这通常是通过增加根的生长来实现的,这导致根和茎的生物量比增加。然而,根系生长的增加需要大量的日光合产物,这可能会由于Pi[的有限供应而进一步受到限制。64].我们的发现与Péret等人的发现一致。[65].据报道,番茄、洋葱玉米和高粱的根冠生物量比增加[24,25,65,66].此外,我们对根长和第三根/根毛增加的观察证实了早期的发现[25,28].然而,由于磷饥饿胁迫,可以观察到根系扩展的显著减少(图1)。2B).第三根/根毛长度因应力显著增加(图5)。2C),这有助于提高植物对磷的吸收。阮和斯坦古里斯[61]提出RSA的变化可以作为小麦耐缺磷能力的指标。在某些植物种类中,也有关于磷缺乏反应的根簇(类蛋白根)形成的报道。这种特化的根系分泌有机酸,使土壤酸化并螯合根部周围的金属离子[13].这可能是观察到水培介质pH值下降的原因之一(补充表S2).
根系中酸性磷酸酶的产量显著增加(补充图S7)和它们在土壤中的分泌,有助于以固定形式的磷的动员。磷酸酶、核糖核酸酶和有机酸从根际有机/无机化合物中释放磷。磷饥饿下磷酸胆碱磷酸酶(Os01g52230)和丝氨酸/苏氨酸磷酸酶(Os10g02750)基因表达上调与Mehra等人的研究结果一致。[11].根系中磷酸酶活性升高,且随水培介质中磷含量的降低而升高。Yugandhar等人早前报道了APase活性的增加。[67在缺磷胁迫下的水稻中。在缺磷胁迫下,编码负责有机酸合成和分泌的酶/蛋白质的基因表达上调已有报道[68,69,70].此外,观察到的糖酵解相关基因表达上调是增加有机酸合成所需碳供应的必要条件。我们观察到LOC_Os08g33710和LOC_Os01g67190(含有蛋白质的核糖核酸酶T2家族结构域)分别上调> 6.3倍和> 2.4倍表达,这与Gho等人的发现一致。[17].有机酸和释放磷的酶如rna酶和紫酸磷酸酶(PAPs)的排泄增加导致根际吸收磷的池变大。增加的根/根毛增加了植物的孔隙度和氧气释放,导致铁的氧化和质子的释放,这导致根际酸度增加,以溶解土壤磷。早先也有报道称,在拟南芥和拟南芥中,紫色酸性磷酸酶(PAPs)的分泌有助于释放Pi和有机磷,如ADP、甘油-3-P、dNTPs菜豆[71].此外,过度的WRKY1从海岛棉据报道,在拟南芥中增加酸性磷酸酶的积累、侧根的数量和根中磷的含量[72].
观察到植物组织中的磷含量随着水栽介质中磷的有效性的增加而增加(补充图S9).茎部磷含量高于根部,且基质中磷含量随Pi的增加而增加,这与Yugandhar等的研究结果一致。65在大米。我们观察到,即使在水培培养基中磷含量较低,耐胁迫基因型的根系对磷的吸收也较好。这导致耐胁迫基因型nil23和Kasalath根和茎中磷含量高于胁迫敏感基因型Pusa-44。因此,这些形态生理和生化性状受环境影响,并受各种分子调控因子控制,它们协同作用以增加磷的获取[73].例如,我们的分子数据清楚地表明,参与糖酵解旁路的关键基因在il -23中显著上调;因此,即使在p饥饿压力下,与其他协同策略相结合,也有助于非常有效地管理Pi的需求。
p饥饿下的分子适应
除了形态、生理和生化的适应外,植物还通过调控基因表达的分子途径来应对缺磷胁迫。对照基因型水稻根系和茎部组织对磷饥饿胁迫响应的DEGs分析表明,基因表达上调在抗磷能力中起着重要作用。耐磷基因型(NIL-23)的茎和根中上调的基因数量都相对较高(图2)。3.).在总deg数量相近的情况下,与Pusa-44相比,il -23根中上调基因数量显著增加,下调基因数量显著减少,这可能是导致il -23耐磷能力增强的原因。此外,在幼苗中大量增加il -23上调和下调基因的数量有助于管理植物在磷饥饿胁迫下的生长。nil23根中唯一上调的2402基因是Pusa-44根的1.6倍。同样,NIL-23植株中唯一上调的4964个基因是Pusa-44植株的约3.7倍。更重要的是,il -23茎段中唯一下调的基因(2626)是Pusa-44茎段的约3.6倍(图4)。4).nil23根中特异上调基因(1695)约为Pusa-44根的1.9倍。同样,NIL-23茎段中唯一上调的(3892)基因是Pusa-44茎段的约4.3倍(图1)。5A). NIL-23芽中特异下调基因(1743)是Pusa-44芽中特异下调基因的3倍。5B).有趣的是,在早期的拟南芥和水稻研究中发现的76个磷响应标记基因中[33],在胁迫下,il -23根中上调了69个基因(耐胁迫基因型为67个),验证了实验设置以及数据/分析的质量/保真度(图1)。6,补充表S3.).
转录组数据显示,一些RSA基因如糖基转移酶、扩展蛋白和木糖葡聚糖半乳糖转移酶在il -23的根中表达上调(补充表S11).据报道,高亲和磷转运蛋白在磷饥饿过程中活性的增加在植物对磷的获取中起着重要作用[74].在p饥饿条件下,磷酸转运蛋白1 (PHT1)高亲和力磷转运蛋白的组基因被诱导以增加根系从土壤中获取磷并在植物内部动员磷的能力[75].在本研究中,13OsPHT1s在p -饥饿胁迫下,对照基因型的根/梢产量(补充表S4).的表达OsPHT1; 2(一种低亲和力的pi转运蛋白)据报道在缺磷胁迫下增加[41,表明它在从根到嫩枝的运输中起作用。同样的,OsPHT1; 6(一种高亲和力的磷转运蛋白)据报道在从土壤中获取磷方面起作用[41].我们观察到OsPHT1; 6p -饥饿条件下,根系中以il -23最高(12.65倍);因此,我们的观察证实了Ai等人的发现。41我们观察到根特异性表达OsPHT1; 3,OsPHT1; 5而且OsPHT1; 9,这表明它们在从土壤中获取Pi的功能。OsPHT1; 4,编码一个质膜定位的Pi转运蛋白,据报道在水稻的根和叶中表达,用于Pi的获取和运输(内稳态)[76,77].我们的发现与早先的报道相吻合。的上调表达(9.02倍)OsPHT1; 13NIL-23在茎部的表达可能主要负责将Pi从根部向茎部的调动,而在Pusa-44中对土壤中P的获取起主要作用(胁迫下根系表达上调10.62倍)。此外,OsPHT1; 12与根相比,两种基因型茎部表达量均上调(补充表S4),这可能有助于动员派从根到根。在植物生长的营养和繁殖阶段,植物体内的Pi的重新调动被报道过[63].一些P转运蛋白的基因PHT1; 3,PHT1; 8,PHT1; 10,PHT1; 13均被报道为由硝酸盐有效性引起[78].
转录因子是基因表达过程的重要调控因子,在植物对各种非生物胁迫的耐受中起着重要作用。含有同型盒结构域的蛋白质已被报道与DNA结合并调节基因的转录[79].在本研究中,il -23根中同源体结构域蛋白和同源体结构域蛋白knot -1的表达上调,这与之前的研究结果相一致[79].同样,本研究的结果还表明,生长素响应因子、AP2结构域含蛋白、GRAS家族转录因子含蛋白、组蛋白样转录因子、hsf型dna结合结构域含蛋白在il -23的根中独家表达(>上调2.5倍)(补充表S5),与较早的研究结果一致[33,34].早前有报道称,在拟南芥中p -饥饿条件下,一个p -缺失响应型MYB TF过表达[80],证实了我们的发现。类似地,其他p -缺乏症反应型TF家族,如NAC、AP2、锌指和WRKY [34,81,82]在p -饥饿条件下的对照基因型中也有差异表达(补充表S5).虽然bZIP、MADS和bHLH TF家族基因在NIL-23的芽中起着重要作用,但MYB家族基因的差异表达在NIL-23的根中起着更重要的作用(图1)。7).另一方面,WRKY家族基因在耐磷性的芽和根中发挥着同样重要的作用。多种转录因子包括MYB、ERF/AP2、WRKY、CCAAT‐binding、锌指、bHLH和NAC已被报道在缺磷胁迫下过表达[32,83].据报道,bHLH转录因子通过改善水稻的RSA在提供对磷饥饿的耐受性方面发挥作用[82].
氧化石墨烯的分析进一步揭示了缺磷胁迫的耐受机制,揭示了不同生物/细胞/分子过程在耐磷胁迫下的作用。对il -23根的GO分析显示,大量上调的基因属于229个(更多)GO项,而Pusa-44根中只有175个(更少)GO项(图4)。8).在这些氧化石墨烯术语中,转录调控、蛋白质/氨基酸磷酸化(生物过程)、丝氨酸/苏氨酸激酶活性、无机磷酸盐转运体活性(分子功能)在il -23的应激耐受中起着重要作用(图。8,9).根中相关基因表达上调(At1g64160)和叶(At2g21100)已在缺磷的拟南芥中报道过[83,这与我们的发现一致。丝氨酸/苏氨酸蛋白磷酸酶家族蛋白通过(去)磷酸化修饰其他蛋白,调节细胞功能、信号转导以及对生物和非生物胁迫的响应[84].一些细胞成分如整体膜成分被过度表达(补充图S12),而其他如氧进化复合体等则表现不足(补充图S13)。对NIL-23芽的氧化石墨烯分析表明,转录过程、氨基酸磷酸化等一些生物学过程独占性过表达(补充图S14),以及丝氨酸/苏氨酸激酶活性等分子功能(补充图S16),磷酸果糖激酶复合物等细胞成分被观察到在Pusa-44的芽中独家富集(补充图S18).同样,对il -23茎段的GO分析表明,更多的下调基因属于199个GO项(补充图。年代15,年代17,年代19).
与碳水化合物、脂质和氮代谢相关的氧化石墨烯含量增加,以改善营养状况、能量供应和细胞保护,特别是在il -23中。11).在p饥饿状态下,细胞通过不依赖于pi的途径绕过ATP或依赖于pi的糖代谢酶促反应。研究发现,在p饥饿胁迫下,参与糖酵解旁路的基因受到了调节,特别是在il -23的根中,这与[11].第一个旁路,由焦磷酸依赖的磷酸果糖激酶(PPi-PFK)催化,将果糖-6磷酸转化为1,6-二磷酸果糖,而不使用ATP。PPi-PFK基因(Os02g48360)在il -23中上调,而在Pusa-44中下调。第二个旁路使用NADP-GAPDH最小化NADP-GAPDH生成1,3-二磷酸甘油酸所需的Pi。nadp依赖性醛脱氢酶编码基因(Os12g12590)在il -23根中表达上调。第三个旁路在糖酵解下游运行,使用磷酸烯醇式丙酮酸羧化酶(PEPC)和苹果酸脱氢酶(MDH)取代丙酮酸激酶,这需要Pi。PEPC (Os09g14670)和MDH编码基因(Os08g33720)被p饥饿诱导(补充表S11).磷素代谢过程、跨膜转运和氧化还原的GO项在il -23根系中显著富集。此外,基因表达的表观遗传调控和翻译后蛋白修饰的GO术语/基因在NIL-23的根/茎中也有差异表达(补充表S10).
细胞壁不仅为植物提供刚性,而且控制细胞的膨胀。因此,细胞通常通过削弱细胞壁结构,维持膨压/细胞完整性来实现生长[85].在il -23中,负责细胞壁组织和相关活动的基因在p-饥饿过程中表达上调(补充表S6).其中,编码扩展蛋白、ltpl -蛋白酶抑制剂家族蛋白和富含甘氨酸细胞壁蛋白等基因是在磷饥饿胁迫下根系动态变化的重要基因。已知膨胀蛋白和ltpl蛋白酶抑制剂家族蛋白在膨胀/增殖细胞的细胞壁松动、蜡/角质沉积中起重要作用。植物利用信号机制来感知发育和环境信号,并调节细胞壁结构。许多参与细胞壁生物合成和松动的生长素反应基因被报道在siz1与野生型植株在p -饥饿条件下的突变相比[86].我们对生长素响应/诱导基因表达上调的观察支持植物激素在磷饥饿胁迫下调节il -23根系细胞壁结构的作用(补充表S7).
据报道,参与膜脂重塑的基因是由缺磷引起的[87].脂质转移蛋白(LTPs)通常位于质膜外的细胞外空间,在蜡和脂质屏障聚合物的沉积/粘附中起着重要作用。对非生物/生物胁迫的信号转导和耐受性与ltp相关[88].在本研究中,几种脂质转移蛋白(LTP)家族基因在il -23中p -饥饿胁迫下的表达被动态调节。与Pusa-44相比,nil23中膜脂重塑基因如磷脂酶C、磷脂酶D和甘油磷酸二酯磷酸二酯酶在胁迫下显著上调。用膜内的亚砜脂和半乳糖脂代替磷脂,也可以保存细胞的Pi池[89].磷脂是生物膜的重要组成部分,磷缺乏的植物为了减少对磷的依赖,会用不含磷的半乳糖脂、磺基喹啉酰二酰基甘油(SQDG)和双半乳糖酰二酰基甘油(DGDG)取代部分磷脂。11,90,91].我们观察到单半乳糖二酰基甘油合酶(MGDG)表达上调(Os08g20420),特别是il -23,这与Mehra等的研究结果一致。[11因此,缺磷会因硫(S)的吸收增加而减少,硫转运体活性的增加明确表明了这一点。已知参与膜脂改变的基因在缺磷时被激活[87].差异表达的SQD1而且SQD2据报道,在拟南芥和水稻中p -饥饿可诱导一个负责亚砜生物合成的基因[83,92].在本研究中,il -23细胞壁重组、磷脂重塑和相关活性相关基因在p饥饿胁迫下表达上调。因此,p饥饿诱导的脂质重塑、MGDG和DGDG的积累表明,细胞脂质重组是il -23耐p饥饿的适应性策略之一,这与早期的报道一致[93,94].
代谢过程的调节,特别是糖和脂类代谢,已被报道对适应缺磷应激至关重要。据报道,胁迫下拟南芥、大豆、大麦、菠菜和大豆叶片中的蔗糖生物合成增加[95].胁迫下与葡萄糖、丙酮酸、蔗糖、淀粉和叶绿素相关的多种代谢过程也有改变的报道[11,96].据报道,在胁迫下,由于Pi/果糖激酶/己糖激酶的有效性/活性降低,叶片和根部的磷酸化糖减少[97,98].在缺磷研究中,海藻糖- 6 -磷酸合酶表达下调[81,83],这与我们的研究结果相印证。据报道,Pi还参与调节淀粉合成(在叶绿体中)和蔗糖合成的磷酸三糖转移(在细胞质中)之间固定碳的分布[99].据报道,缺磷还会增加碳水化合物通过韧皮部向根系的转运,有利于根系生长,以便更好地从土壤中获取磷[One hundred.].因此,与Pusa-44相比,il -23更有效的代谢调节是其在p -饥饿胁迫下更好存活的原因。据报道,在胁迫下,茎和根之间的磷稳态是通过调节转运体、磷酸酶、rna酶和参与代谢过程的酶的表达来维持的[17,69,70,83].
据报道,光合过程在缺磷条件下受到抑制,主要是因为Pi对叶绿体中ATP合成、Rubisco活化和RuBP再生的限制作用[6,101,102].缺磷通过减少Rubisco的数量和活性抑制卡尔文循环的活性[103核酮糖-1,5-二磷酸的再生[102].此外,磷在光合作用、能量节约和碳代谢等方面发挥着重要的结构和调节作用[104].在缺磷胁迫下,合成代谢和分解代谢之间的平衡被破坏。光系统(PS) I、PSII、Rubisco小亚基、卡尔文循环酶和叶绿素A/ b结合蛋白的基因表达已被报道因缺磷而受到抑制[105,106].与此同时,参与糖酵解、淀粉和蔗糖合成的基因(葡萄糖- 6 -磷酸脱氢酶、磷酸果糖激酶、果糖- 1,6 -二磷酸醛缩酶、磷酸烯醇式丙酮酸羧化酶、甘油醛- 3 -磷酸脱氢酶和蔗糖转运体)被报道上调[68,69],这与我们的研究结果相印证。在缺磷的情况下,这些变化是必要的,以绕过对ATP-和pi依赖酶的依赖,并调节产生能量和碳骨架所需的代谢过程[107,108].
光合作用是能量转换中最重要的光化学汇,缺磷介导的CO抑制2同化导致过度的光/激发能量对光合作用装置的破坏。缺磷会抑制光磷酸化过程,并限制ATP/NADPH的可用性,从而影响代谢过程。我们观察到在il -23中p -饥饿下光系统II反应中心的一个基因(LOC_Os04g16874)的表达下调了6倍(补充表S9),这有助于保护植物免受过度激发能量的影响。过高的激发能增加了活性氧(ROS)的产生;因此,据报道,水稻缺磷时会增加ROS的非光化学猝灭[21].我们关于胁迫下参与光合作用的基因表达差异的发现与Secco等人的报道一致。[33].在胁迫下,水稻基因型的根系中也观察到光合相关基因的调节,这与Li等的研究结果一致。[22和王等人。[36].
已知植物激素如生长素、脱落酸、细胞分裂素和赤霉素在根系发育中发挥作用[109].生长素在侧根的发育中起着重要作用,有助于磷的获取。在拟南芥中,侧根的细胞周期受生长素调控,缺磷影响细胞周期基因的表达CDKA、E2Fa Dp-E2F而且CyCD3.因此,根结构的修饰与磷饥饿通过植物激素有关。生长素转运蛋白PIN7和APSR1之间存在连锁反应,因为缺少ASPR1会降低APSR1的表达PIN7在P-starvation [110].此外,p饥饿降低赤霉素(GA)含量,导致DELLA蛋白增加[111],这导致在胁迫下,il -23的根毛长度增加。
染色质结构是真核生物基因表达的关键决定因素。据报道,在拟南芥缺磷胁迫下,某些染色质相关成分在根毛生长中发挥作用。据报道,一种组蛋白去乙酰化酶(HDA19)在拟南芥缺磷条件下被诱导并增加根毛生长[112].Zahraeifard等人[113报告了全基因组H2A的改变。水稻p -饥饿引起的Z分布。张等人。[114]表明核小体重塑因子在调节缺磷胁迫下核小体占用和差异基因表达中的作用。由于观察到含有蛋白质的jmjC结构域、含有蛋白质的核心组蛋白H2A/H2B/H3/H4结构域、C-5胞嘧啶特异性DNA甲基化酶和含有蛋白质的甲基- cpg结合结构域的差异表达,可以预期在胁迫下染色质结构可能发生调节。Yong-Villalobos等人报道了拟南芥在缺磷胁迫下全局DNA甲基化的广泛重塑。[115Yong-Villalobos等人报道了拟南芥中p饥饿条件下TF结合位点附近DNA的低甲基化和高甲基化。[116我们对耐胁迫基因型在胁迫下DNA甲基化酶上调和含有蛋白质的甲基- cpg结合域下调的观察(补充表S10)与上述调查结果相符。类似地,在拟南芥中p饥饿反应蛋白如组蛋白伴侣蛋白(在我们的例子中是hsp20)和核小体组装蛋白的差异表达也被报道过[91].
在水稻不同染色体上检测到几个磷吸收的qtlPup1是最主要的。虽然异位表达PSTOL1研究发现,在缺磷敏感水稻品种中,施磷能促进早期根系生长,使植物获得更多的磷和其他营养物质,并在缺磷土壤中提高粮食产量[29的作用Pup1还不清楚。我们观察到在p-饥饿胁迫下,il -23根中脂肪酸加氧酶、dient蛋白、天冬氨酸蛋白酶和蛋白激酶基因的表达上调11).因为基因在Pup1QTL不编码一个已知的P吸收相关蛋白的作用模式Pup1尚不清楚。然而,OsPupK20,OsPupK29,OsPupK46(蛋白激酶基因)已被报道为与根特异性功能相关的候选基因[34,117].
结论
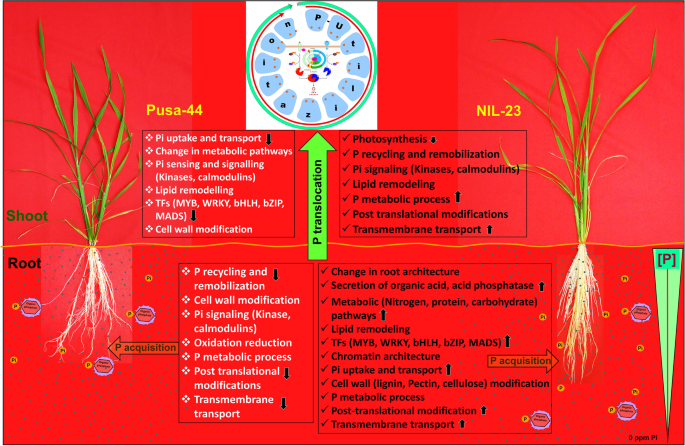
磷是植物生长发育的第二大宏量营养素,遗憾的是,植物对磷的吸收、运输和利用效率的许多方面还没有完全了解。一些研究为磷的分布、转运体的功能特征和磷缺乏性耐受相关基因的差异表达提供了见解。本研究揭示了转运蛋白(OsPHT1;6, OsPHT1; 10),信号分子,如茉莉酸/生长素诱导蛋白(LOC_Os04g22900, LOC_Os01g36580),生长素响应蛋白(LOC_Os05g48270), ltpl蛋白酶抑制剂家族蛋白(LOC_Os10g40430, LOC_Os10g40480),甘油磷酰二酯磷酸二酯酶家族蛋白(LOC_Os03g40670),磷酸酶(LOC_Os01g52230, LOC_Os08g17784, LOC_Os11g38050, LOC_Os07g01540, LOC_Os05g02310),在水稻中提供耐磷胁迫能力的同位盒结构域蛋白(LOC_Os03g51690)、MYB家族转录因子(LOC_Os03g62100、LOC_Os02g22020)和AP2结构域蛋白(LOC_Os08g36920、LOC_Os10g11580)、核心组蛋白结构域蛋白(LOC_Os10g28230)和富含甘氨酸的细胞壁结构蛋白(LOC_Os10g31530、LOC_Os10g31540)等转录因子。NIL-23的磷利用效率较高,对Pi的需求较低,这主要是由于NIL-23的渗透Pup1在Pusa-44基因背景下,即使在p -饥饿胁迫下,nil23植株也能更好地生长和存活到营养期。本研究为水稻缺磷胁迫的功能解剖提供了丰富的分子信息/候选机制,这可能有助于进一步了解调控网络,通过整合生物化学、生理、遗传和分子机制来提高作物植物的磷利用效率,以应对土壤中磷的有限有效性(图5)。12),特别是由于环境条件的变化。因此,根系结构的调节、磷的获取、磷的内部迁移、能量守恒等机制可能有助于通过遗传和表观遗传方法提高水稻磷利用效率,从而提高现代品种在缺磷土壤中的生产力。
方法
植物材料、生长条件和磷饥饿胁迫施加
本研究使用了两种对比的水稻基因型[Pusa-44(磷缺乏敏感)和NIL-23(磷缺乏耐受性)],这些基因型来自新德里的icar -印度农业研究所遗传司。对照基因型水稻的成熟种子[与原始的Pup1QTL供体(Kasalath)来自新德里icar -印度农业研究所遗传学部],用于在磷充足(16 ppm Pi)、磷缺乏(1或4 ppm)或磷饥饿(0 ppm Pi)条件下水培育苗/植物。水稻基因型的更多细节(补充图。年代20.,年代21)、生长条件(补充图S22)和p -饥饿胁迫补充的方法.从45日龄植物(营养/分蘖期)中采集的茎和根组织用于各种分析。
估算APase活性、根-梢生物量比、叶绿素和磷含量
测定了茎和根组织中酸性磷酸酶(APase)活性、根系分泌的APase和根-茎生物量比。采用二甲基亚砜法测定叶片叶绿素含量。用钒酸盐-钼酸盐法测定茎和根组织总磷含量。上述分析的详细程序如下补充的方法.
RNA分离,文库制备和数据分析
为分析磷饥饿胁迫对对照水稻基因型茎和根基因表达的影响,共制备了16个文库,并在Illumina平台上用PE 2 × 150bp化学方法进行了商业化测序。原始序列数据被提交到NCBI序列读取档案(SRA)数据库,生物项目ID为PRJNA667189。利用水稻参考基因组(TIGR v7),在Hisat2和Stringtie包的帮助下,对RNA-seq数据进行了基于参考的定位。计算每个基因的映射干净读数并归一化为每千克碱基每百万读数(RPKM)值。分别通过功能分类和京都基因与基因组路径图谱对差异表达基因(DEGs)进行本体术语和关键通路的标注。比较了对照与处理间及基因型间的差异。基因与日志2折叠改变> 1(即折叠改变> 2)和p< 0.05为差异表达。RNA分离、文库制备、数据分析等详细步骤见补充的方法.
RT-qPCR对差异表达基因的验证
为了确认RNA-seq的结果,根据MIQE指南随机选择7个deg(4个上调3个下调)进行定量(RT-qPCR)分析。用熔融曲线对数据进行分析,以检验PCR扩增的特异性。相对基因表达量由2−ΔΔCt方法。肌动蛋白和微管蛋白基因作为内参/管家基因。RT-qPCR验证的更多细节在补充的方法,所用引物见补充表S12.
这证实了目前研究工作所使用的所有材料和方法都符合相关的机构、国家和国际指导方针和立法。
数据和材料的可用性
本研究过程中产生/分析的形态生理和生化数据包含在补充文件中。rna测序(转录组)原始读取数据可在NCBI序列读取档案(SRA)数据库(https://www.ncbi.nlm.nih.gov/sra),生物项目ID: PRJNA667189。
缩写
- APase:
-
酸性磷酸酶
- 度:
-
差异表达基因
- 舰队指挥官:
-
褶皱变化
- 罗斯福:
-
错误发现率
- 遗传算法:
-
赤霉酸
- DGDG:
-
Digalactosyl甘油二酯
- 走:
-
基因本体论
- LTP:
-
脂质转运蛋白
- MGDG:
-
Monogalactosyl甘油二酯
- MGDGS:
-
Monogalactosyl甘油二酯合成酶
- 零:
-
Near-isogenic线
- PHT1:
-
磷转运蛋白1
- 病人:
-
磷
- Pi:
-
无机磷
- ppm:
-
百分率
- PS:
-
光系统
- Pup1:
-
磷吸收1
- QTL:
-
数量性状位点
- RSA:
-
根系统架构
- RuBP:
-
核酮糖1 5 5-bisphosphate,
- SQDG:
-
磺基-6-脱氧葡糖基二脂酰甘油
- TF:
-
转录因子
参考文献
- 1.
Secco D,王超,Shou H, Schultz MD, Chiarenza S, Naussaume L,等。应激诱导的基因表达驱动邻近重复元件的瞬时DNA甲基化变化。eLife。2015;doi:https://doi.org/10.7554/eLife.09343.001
- 2.
张文华,张文华。拟南芥中磷酸盐的转运和体内平衡研究。拟南芥卷1。2002: e0024。doi:https://doi.org/10.1199/tab.0024
- 3.
Schröder JJ, Smit AL, Cordell D, Rosemarin a .提高农业磷利用效率:可持续利用的关键要求。臭氧层。2011;84:822-31。
- 4.
吴萍,寿红,徐刚,连旭。在了解磷信号和体内平衡的基础上水稻磷效率的提高。植物生物学,2013;16:205-12。
- 5.
Aluwihare YC, Ishan M, Chamikara MDM, Weebadde CK, Sirisena DN, Samarasinghe WLG, Sooriyapathirana SDSS。斯里兰卡耐磷水稻基因型的鉴定与筛选。水稻科学。2016;23:184 - 95。
- 6.
Wissuwa M, Gamat G, Ismail AM。缺磷条件下根系生长是否受源库限制的影响?J Exp Bot。2005;56:43 - 50。
- 7.
Sanyal SK, Dwivedi BS, Singh VK, Majumdar K, Datta SC, Pattanayak SK. Annapurna K与印度优势种植序列的磷:化学、肥力关系和管理选择。咕咕叫科学。2015;108:1262 - 70。
- 8.
李志军,谢勇,戴爱,刘丽芙,李志成。水稻根、梢性状对缺磷的响应及其苗期QTL分析。中华基因学报2009;36:173-83。
- 9.
李勇,顾敏,张,张军,范宏,李鹏,李铮,徐刚烟草缺磷实时监测的视觉跟踪灵敏报告系统工程。植物工程学报(英文版)2014;
- 10.
Elser JJ。磷:人类的限制性营养素?生物技术,2012;23:833-8。https://doi.org/10.1016/j.copbio.2012.03.001.
- 11.
比较形态生理分析和分子谱分析揭示了一个传统水稻基因型的pi高效策略。植物科学进展2016;6:1184。https://doi.org/10.3389/fpls.2015.01184.
- 12.
王云云,杨士林,马吉德。春小麦基因型根系和根毛性状对溶液培养磷缺乏的差异响应。植物土壤环境,2016;62:540-6。
- 13.
沙赫特曼DP,里德RJ,艾林SM。植物对磷的吸收:从土壤到细胞。植物杂志。1998;116:447-53。
- 14.
白露簇根的分泌活性影响细菌的丰度、功能和群落结构。土壤植物。2005;268:181 - 94。https://doi.org/10.1007/s11104-004-0264-x.
- 15.
Holz M, Zarebanadkouki M, Kuzyakov Y, Pausch J, Carminati A.根毛增加根际延伸和土壤碳输入。安机器人。2018;121:61-9。https://doi.org/10.1093/aob/mcx127.
- 16.
田杰,王超,张强,何旭,惠兰娇,寿华OsPAP10一种根系相关的酸性磷酸酶,增加了水稻细胞外有机磷的利用率。植物学报,2012;54:631-9。
- 17.
高玉生、崔浩、文硕、宋爱梅、朴赫、金德衡、河世衡、郑克衡。水稻中可诱导的S-like RNase基因通过RNA衰变参与了磷酸盐源的循环利用。植物科学通报2020;11:585561。https://doi.org/10.3389/fpls.2020.585561.
- 18.
顾明,张军,李浩,孟D,李锐,戴X,等。水稻体内磷酸盐平衡的维持和根系发育是由一种r2r3型MYB转录因子MYB1协调调控的。J Exp Bot. 2017; 68:3603-15。
- 19.
常MX,顾明,夏勇,戴旭,戴晨,张杰,等。OsPHT13在极低磷水平下介导磷酸盐的吸收、易位和再动员。植物杂志。2019;179:656 - 70。
- 20.
El Mazlouzi M, Morel C, Robert T, Yan B, Mollier A.灌浆期不同磷供给对不同生物量分配的硬粒小麦磷素吸收和分配的影响。土壤植物。2020;449:179 - 92。https://doi.org/10.1007/s11104-020-04444-0.
- 21.
徐海霞,翁晓勇,杨莹。缺磷对水稻光合特性的影响。植物生理学报2007;54:741-8。
- 22.
李丽,刘晨,连晓。低磷胁迫下水稻根系基因表达谱。植物生物学杂志2010;72:423-32。
- 23.
邢东,吴勇。缺磷对三种攀缘植物光合无机碳同化的影响。机器人钉。2014;55:60。
- 24.
孙燕,穆超,陈燕,孔晓,徐燕,郑辉,等。玉米自交系对长期缺磷胁迫响应的转录本比较分析。植物生理生物化学,2016;109:467-81。
- 25.
张军,蒋峰,沈勇,詹强,白斌,陈伟,迟勇。高粱耐磷性相关候选基因的转录组分析。植物生物学2019;19:306。https://doi.org/10.1186/s12870-019-1914-8.
- 26.
Khush GS。到2030年,养活50亿大米消费者需要多少钱。植物分子生物学杂志2005;59:1-6。doi:https://doi.org/10.1007/s11103-005-2159-5
- 27.
王晓燕,王晓燕,王晓燕。水稻耐磷性的qtl定位(栽培稻l .)。应用理论。1998;97:777-783。
- 28.
胡夫纳格尔,德索萨,阿西斯,等。复制与征服:耐磷性的多重同源基因1增强了高粱在低磷土壤上的磷吸收和表现。植物杂志。2014;166:659 - 767。
- 29.
甘木耀R,陈海杰,田中JP,佩萨雷西P, Catausan S, Dalid C,等。的蛋白激酶Pstol1传统水稻对磷缺乏具有耐受性。大自然。2012;488:535-41。https://doi.org/10.1038/nature11346.
- 30.
Neelam K、Thakur S、Neha、Yadav IS、Kumar K、Dhaliwal、SS、Singh K耐磷饥饿1基因新等位基因(PSTOL1)选用高产稻具有较高的磷吸收效率。植物科学进展2017;8:509。doi:https://doi.org/10.3389/fpls.2017.00509
- 31.
许爱山,吕旭,陈建华,田中太平,金森华,松本泰,等。主要数量性状位点吸磷序列比较分析1 (Pup1)揭示了复杂的遗传结构。植物生物技术学报2009;7:456-7。
- 32.
Hammond JP, Bennett MJ, Bowen HC, Broadley MR, Eastwood DC,等。拟南芥幼苗在磷酸盐饥饿过程中基因表达的变化及培育智能植株的潜力。植物杂志。2003;132:578 - 96。
- 33.
张晓燕,张晓燕,张晓燕,张晓燕,等。水稻根系和枝条对磷素饥饿和恢复响应的时空转录分析。植物细胞。2013;25:4285 - 304。
- 34.
邓启伟,罗旭东,陈艳玲,周燕,张富发,胡斌林,谢建奎。东乡野生稻幼苗磷胁迫响应性的转录组分析(选用高产稻女孩)。生物研究2018;51:7。doi:https://doi.org/10.1186/s40659-018-0155-x
- 35.
任鹏,孟Y,李波,马晓,斯娥,赖勇,等。大麦适应磷饥饿和恢复的分子机制(大麦芽l .)。植物科学,2018;9:500。doi:https://doi.org/10.3389/fpls.2018.00500
- 36.
王静,秦强,潘杰,孙亮,孙燕,薛燕,宋凯。小麦幼苗根系和叶片对低磷胁迫响应的转录组分析。Sci众议员2019;9:19802。https://doi.org/10.1038/s41598-019-56451-6.
- 37.
王刚,吴德华,王刚。水稻幼苗细胞壁重塑网络中低磷酸盐染色质动力学的预测。植物杂志。2020;182:1494 - 509。
- 38.
Mudge SR, Rae AL, Diatloff E, Smith FW。表达分析表明,拟南芥中磷酸转运蛋白PHT1家族成员具有新的作用。植物j . 2002; 31:341-53。
- 39.
高夫,李志刚,李志刚,等。水稻基因组序列草图(栽培稻l . ssp粳稻)。科学。2020;296:92 - 100。
- 40.
Paszkowski U, Kroken S, Roux C, Briggs SP.水稻磷酸盐转运蛋白包括一个在丛枝菌根共生中特异激活的进化发散基因。美国国家科学研究院。2002; 99:13324-9。
- 41.
艾萍,孙松,赵静,范晓,辛晓,郭强,等。水稻磷酸盐转运蛋白OsPht1;2和OsPht1;6在吸收和转运过程中具有不同的功能和动力学特性。植物j . 2009; 57:798 - 809。
- 42.
孙松,顾明,曹勇,黄霞,张霞,艾萍,等。本构表达的磷酸盐转运蛋白OsPht1; 1调节饱磷水稻的磷酸盐吸收和转运。植物杂志。2012;159:1571 - 81。
- 43.
贾辉,张松,王磊,杨勇,张辉,崔辉,等。OsPht18是一种磷酸盐转运蛋白,参与水稻的生长素和磷酸盐饥饿反应。J Exp Bot. 2017; 68:5057-68。
- 44.
山次N,竹本Y,宫次T,三谷上野N,吉田KT,马俊夫。减少水稻籽粒中磷的积累,节点中的转运蛋白受损。大自然。2017;5(541):92 - 5。
- 45.
王铮,胡辉,黄辉,段凯,吴铮,吴萍。OsSPX1和OsSPX3对水稻OsSPX结构域基因表达和pi饥饿信号的调控。植物生物学杂志,2009;51:663-74。
- 46.
Kobayashi K, Awai K, Nakamura M, Nagatani A, Masuda T, Ohta H. b型单半乳糖二酰基甘油合成酶参与了磷酸盐饥饿诱导的脂质重塑,对低磷酸盐适应至关重要。植物j . 2009; 57:322-31。
- 47.
WRKY蛋白:非生物胁迫反应中的信号转导和表达调控。科学通报2015;807560。
- 48.
Phukan UJ, Jeena GS, Shukla RK。WRKY转录因子:植物的分子调控与胁迫响应。植物科学,2016;7:760。
- 49.
王辉,徐强,孔永华,陈勇,段建勇,陈永飞,等。拟南芥WRKY45转录因子激活phosptortransporter1;1表达,以应对磷酸盐饥饿。植物杂志。2014;164:2020-9。https://doi.org/10.1104/pp.113.235077.
- 50.
白东,全海杰,尹金杰,金春春。植物磷酸盐饥饿与其他环境胁迫信号通路的交叉分析。摩尔细胞。2017;40:697 - 770。
- 51.
邱廷杰,林思。植物磷素有效性的信号网络研究。植物学报,2011;62:185-206。
- 52.
白丹,金mc,千浩杰,姜硕,朴慧聪,申庚,等。AtMYB2调控miR399f转录影响拟南芥的磷酸盐饥饿反应。植物杂志。2013;161:362 - 73。
- 53.
钱培生,蒋长昌,王铮,邱廷杰。微rna介导的信号转导与营养物质运输与利用的调控。植物生物学杂志2017;39:73-9。https://doi.org/10.1016/j.pbi.2017.06.007.
- 54.
Ribot C, Wang Y, Poirier Y.对AtPHO1家族三个成员的表达分析揭示了磷酸盐缺乏信号通路与生长素、细胞分裂素和脱落酸反应之间的差异相互作用。足底。2008;227:1025-36。
- 55.
Trull MC, Guiltinan MJ, Lynch JP, Deikman J.野生型和ABA突变体的反应拟南芥thaiiana植物对磷缺乏。植物细胞环境,1997;20:85-92。
- 56.
姜春,高旭,廖琳,Harberd NP,付旭。拟南芥中磷素饥饿根系构型和花青素积累响应受赤外光- della信号通路的调控。植物杂志。2007;145:1460 - 70。
- 57.
Khan GA, Vogiatzaki E, Glauser G, Poirier Y.磷酸盐缺乏诱导茉莉酸途径,增强对昆虫食草性的抗性。植物杂志。2016;171:632-44。
- 58.
魏锐,王旭,张伟,沈杰,张宏,高原,等。表达ppk的转基因水稻提高了磷的利用率,降低了磷的消耗。田间作物Res. 2020;248:107715。
- 59.
袁宏,刘东。植物对磷酸盐饥饿反应的信号元件。植物生物学杂志,2008;50:849-59。
- 60.
沙玛S,波拉P,米纳MK,宾德拉班P,潘迪R.水稻幼苗在优化水培培养基下生长的基因型变异评价。印度医学杂志。2018;78:292-301。
- 61.
两种基因型小麦根系结构和形态的变化是其耐磷性的预测因子。植物学报,2019;41:109。
- 62.
Filstrup CT, Downing JA。富营养湖叶绿素与磷、氮的关系。内陆水域。2017;7:385 - 400。https://doi.org/10.1080/20442041.2017.1375176.
- 63.
Carstensen A, Szameitat AE, Frydenvang J, Husted S.叶绿素A荧光分析可以检测田间条件下的缺磷,是防止春大麦籽粒减产的有效工具(大麦芽l .)。植物土壤434:79 2019;91年。
- 64.
Vance CP, Uhde-Stone C, Allan DL。磷的获取和利用:植物为确保不可再生资源而进行的关键适应。新植醇。2003;157:423-47。
- 65.
Péret B, Clement M, Nussaume L, Desnos T.根系对磷酸盐饥饿的发育适应:安全比遗憾好。植物科学进展2011;16:442-50。https://doi.org/10.1016/j.tplants.
- 66.
Fohse D, Claasse N, Jungk A.植物的缺磷现象I.不同植物对磷的内外需氧量和磷吸收效率。土壤植物。1988;110:101 - 109。
- 67.
Yugandhar P, Nallamothu V, Panigrahy M, Tipireddy S, Bhadana VP, Voleti SR,等。对田间低磷耐受或敏感的突变体Nagina 22在水培和盆栽条件下对双磷反应明显不同。土壤学报,2018;34(4):447 - 447。
- 68.
胡德-斯通C,柯津,Ramirez-Yáñez M,李A,万斯CP,艾伦DL。尼龙过滤器阵列揭示了白露蛋白根对磷缺乏反应的差异基因表达。植物杂志。2003;131:1064 - 79。
- 69.
Morcuende R, Bari R, Gibon Y, Zheng W, Pant BD, Bläsing O,等。拟南芥对磷的代谢和调控网络的全基因组重编程。植物细胞环境学报2007;30:85-112。
- 70.
Calderon-Vazquez C, Ibarra-Laclette E, Caballero-Perez J. Herrera-Estrella L转录谱分析玉米根揭示了在植物和物种特异性水平上对磷酸盐缺乏的基因反应。J Exp Bot 2008; 59:2479-524。
- 71.
梁超,王杰,赵杰,田杰,廖浩。基因调控对作物体内磷平衡的控制。植物生物学杂志2014;21:59-66。
- 72.
许亮,金亮,龙亮,刘亮,何旭,高伟,朱亮,张旭GbWRKY1通过改变生长素敏感性正向调控拟南芥的磷饥饿反应。植物细胞杂志2012;31:2177-88。
- 73.
约克LM,诺德EA,林奇JP。土壤资源获取中根系苯的整合。植物科学进展2013;4:355。https://doi.org/10.3389/fpls.2013.00355.
- 74.
Shin H, Shin HS, Dewbre GR, Harrison MJ。拟南芥中的磷酸盐转运:Pht1;1和Pht1;4在低磷酸盐和高磷酸盐环境中的磷酸盐获取中都起主要作用。植物j . 2004; 39:629-42。
- 75.
Mudge SR, Smith FW, Richardson AE。在磷酸盐转运子启动子的控制下,根特异性和磷酸盐调节的植酸酶表达使拟南芥能够在植酸盐作为唯一的磷来源上生长。植物科学。2003;165:871-8。
- 76.
叶燕,袁静,常旭,杨梅,张亮,陆凯,等。磷酸转运体基因OsPht1;4参与水稻的磷酸盐稳态。PLoS ONE。2015; 10: e0126186。https://doi.org/10.1371/journal.pone.0126186.
- 77.
张飞,孙勇,裴伟,Jain A,孙锐,曹勇,等。OsPht1;4参与了磷酸盐的获取和动员,促进了水稻胚胎的发育。植物j . 2015; 82:556 - 69。
- 78.
胡斌,蒋铮,王伟,邱勇,张铮,刘勇,等。硝酸盐- nrt1.1 - spx4级联整合了植物氮磷信号网络。Nat植物。2019;doi:https://doi.org/10.1038/s41477-019-0384-1
- 79.
Bürglin TR, Afolter M.同源结构域蛋白:更新。Chromosoma。2016;125:497。
- 80.
Devaiah BN, Madhuvanthi R, Karthikeyan AS, Raghothama KG。拟南芥的磷酸盐饥饿反应和赤霉素的生物合成受MYB62转录因子的调控。摩尔。2009;2:43-58。
- 81.
尼尔森L, Müller R,尼尔森TH。解剖植物转录组及其对磷酸盐缺乏的调控反应。杂志。2010;139:129-43。https://doi.org/10.1111/j.1399-3054.2010.01356.x.
- 82.
迪亚X,王燕,张文华。OsWRKY74是WRKY转录因子,调节水稻对磷酸盐饥饿的耐受性。J Exp Bot. 2016; 67:947-60。
- 83.
Misson J, Raghothama KG, Jain A, Jouhet J, Block MA, Bligny R,等。全基因组转录分析使用拟南芥Affymetrix基因芯片测定了植物对磷酸盐缺乏的反应。美国国家科学研究院。2005; 102:11934-9。
- 84.
陈永利,洪明明,褚丕培,晁钛,蔡明明,陈丽娟,等。蛋白磷酸酶5通过与amp活化蛋白激酶的相互作用促进肝癌的发生。生物化学杂志。2017;138:49-60。
- 85.
Voxeur A, Höfte H.植物细胞壁完整性信号:“生长还是不生长,这是一个问题。”糖生物学。2016;26:950-60。
- 86.
三浦凯,李俊,龚强,马硕,金金杰,刘春春,等。SIZ1对磷酸盐饥饿诱导的根构型重塑的调控涉及到对生长素积累的控制。植物杂志。2011;155:1000-12。
- 87.
Nakamura Y, Koizumi R, Shui G, Shimojima M, Wenk MR, Ito T, Ohta H.拟南芥脂质蛋白介导脂质代谢的真核途径,并对磷酸盐饥饿有重要作用。美国国家科学研究院。2009; 106:20978 - 83。
- 88.
艾德奎斯特J, Blomqvist K, Nieuwland J, Salminen TA。植物脂质转移蛋白:我们终于接近这些神秘的蛋白质的作用。J .血脂杂志2018;59:1374-82。
- 89.
冈崎Y,大月H,成泽T,小林M,佐井S,神出Y,等。一种新的植物脂类是防止磷消耗所必需的。Nat Commun。2013;4:1510。https://doi.org/10.1038/ncomms2512.
- 90.
Gaude N, Nakamura Y, Scheible WR, Ohta H, Dörmann P.磷脂酶C5 (NPC5)参与拟南芥叶片磷酸限制过程中半乳糖的积累。植物j . 2008; 56:28-39。
- 91.
Bhardwaj D, Medici A, Gojon A, Lacombe B, Tuteja N.根系对外界线索反应的新见解:营养感知的范式转移。植物信号行为学报2015;10:e104979。
- 92.
王晓明,易克坤,陶勇,王峰,吴志成,江达,等。细胞分裂素通过提高细胞内磷酸盐水平抑制磷酸饥饿反应。植物细胞环境学报2006;29:1924-35。
- 93.
Andersson MX, Stridh MH, Larsson KE, Liljenberg C, Sandelius AS。缺乏磷酸盐的燕麦用半乳糖双半乳糖双酰基甘油取代质膜磷脂的主要部分。2月。2003;537:128-32。https://doi.org/10.1016/s0014 - 5793 (03) 00109 - 1.
- 94.
下岛M, Watanabe T, Madoka Y,小泉R,山本MP,增田K,等。两种单半乳糖二酰基甘油合酶在芝麻植物膜脂重塑中的差异调控。植物科学,2013;4:469。https://doi.org/10.3389/fpls.2013.00469.
- 95.
哈蒙德JP,怀特PJ。蔗糖在韧皮部的转运:综合根系对磷饥饿的反应。J Exp Bot 2008; 59:93-109。
- 96.
Park MR, Baek SH, de Los Reyes BG, Yun SJ, Hasenstein KH。转录组分析揭示了磷酸盐缺乏对水稻叶片碳水化合物代谢的影响。植物生理学报,2012;39(4):447 - 447。https://doi.org/10.1016/j.jplph.2011.09.002.
- 97.
磷缺乏对大豆根系碳水化合物代谢的影响。杂志。1994;91:383-8。
- 98.
Wanke M, Ciereszko I, Podbielkowska M, Rychter AM。对大豆缺磷的响应(菜豆l .)的根源。豆根细胞的呼吸代谢、糖定位及超微结构变化。安机器人。1998;82:809 - 819。
- 99.
霍德HW,乔恩CJ,马隆德D.正磷酸盐和其他因素在调节叶片和离体叶绿体淀粉形成中的作用。植物杂志。1977;59:1146-55。
- One hundred.
贺曼斯,哈蒙德,怀特,韦布鲁根。植物如何通过生物量分配来应对养分短缺?植物科学进展2006;11:610-7。
- 101.
王晓燕,王晓燕,王晓燕。磷营养对植物光合作用的影响大豆植物学报1990;181:399-405。
- 102.
Pieters AJ, Paul MJ, Lawlor DW。低蓄水池需求限制了缺磷条件下的光合作用。实验学报2001;52:1083-91。
- 103.
Lauer MJ, Pallardy SG, Belvins DG, Randall DD.缺磷大豆全叶碳交换特性(大豆L.),植物物理学报1989;91:848-854。
- 104.
Abel S, Ticconi CA, Delatorre CA.高等植物的磷酸盐传感。杂志。2002;115:1-8。
- 105.
Jacob J, Lawlor DW。缺磷向日葵、玉米和小麦光合作用的气孔和叶肉限制。J Exp Bot 1991; 42:1003-11。
- 106.
邱毅,以色列DW。磷营养变化对大豆碳水化合物积累和利用的影响。杂志。1994;90:722-8。
- 107.
植物磷酸盐饥饿反应的代谢方面。正确的做法:Lerner HR,编辑。植物对环境胁迫的响应:从植物激素到基因组重组。纽约:马塞尔·德克尔;1999.p . 349 - 72。
- 108.
Amtmann A, Hammond JP, Armengaud P, White PJ。植物的养分感应和信号:钾和磷。Adv Bot Res. 2005; 43:209-57。
- 109.
Benkova E, Michniewicz M, Sauer M, Teichmann T, Seifertova D, Jurgens G,等。局部、外排依赖的生长素梯度是植物器官形成的共同模块。细胞。2003;115:591 - 602。https://doi.org/10.1016/s0092 - 8674 (03) 00924 - 3.
- 110.
Gonzalez-Mendoza V, Zurita-Silva A, Sanchez Calderon L, Sanchez- sandoval ME, Oropeza-Aburto A,等。分生组织维持所需的新基因APSR1受低磷利用率的负调控。植物科学。2013;205:2-12。
- 111.
Floss DS, Levy JG, Levesque-Tremblay V, Pumplin N, Harrison MJ。DELLA蛋白调节丛枝菌根共生中的丛枝形成。美国国家科学研究院。2013; 110:5025-34。
- 112.
组蛋白去乙酰化酶HDA19控制拟南芥根细胞伸长和调节一个亚群的磷酸盐饥饿反应。Sci众议员2015;5:15708。
- 113.
Zahraeifard S, Foroozani M, Sepehri A, Oh D-H, Wang G, Mangu V, Chen B, Baisakh N, Dassanayake M, Smith AP Rice H2A。Z负向调节营养饥饿应答基因,但促进关键家务管理基因的表达。J Exp Bot. 2018; 69:4907-4919。
- 114.
张强,Oh D-H, DiTusa SF, RamanaRao MV, Baisakh N, Dassanayake M. Smith APBMC基因组学。2018;19:97。
- 115.
Yong-VillalobosL, Gonzalez-Morales SI, Wrobel K, Gutierrez-Alanis D, Cervantes-Perez SA, Hayano-Kanashiro C,等。甲基组分析揭示了表观遗传变化在拟南芥对磷酸盐饥饿反应调控中的重要作用。美国国家科学研究院。2015; 112: E7293−302。
- 116.
Yong-Villalobos L, Cervantes-Pérez SA, Gutiérrez-Alanis D, Gonzáles Morales S, Martínez O, Herrera-Estrella L.磷酸盐饥饿诱导顺式作用元件附近的DNA甲基化,已知该元件调节磷酸盐响应基因的表达。植物信号行为学报2016;11:1173300。https://doi.org/10.1080/15592324.2016.1173300.
- 117.
Chin JH, Gamuyao R, Dalid C, Bustamam M, Prasetiyono J, Moe-ljopawiro S,等。磷胁迫下高产水稻的应用:Pup1序列。植物杂志。2011;156:1202-16。
确认
SK感谢来自印度新德里印度农业研究委员会作物科学部的校外研究补助金的资助。
资金
该研究得到了印度新德里政府印度农业研究委员会的院外研究补助金[18(3)/2018-O&P]的财政支持。
作者信息
从属关系
贡献
SK和TM构思并设计了实验;SK监督实验、数据收集和分析;Pallavi和CC进行了形态学、生理和生化实验;KS进行分子分析;KKV开发了近等基因系,并对其进行了评价,为实验提供了最佳性能;SK2对数据进行生物信息学分析。SK, SK2,准备手稿,SK, SK2, KKV和TM对手稿进行了修改,所有作者都批准了定稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。SK2他就职于新德里的Decode Genomics Private Limited,在进行这项研究时,没有任何可能被视为潜在利益冲突的商业或金融关系。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:补充表S1至S2。
对照基因型水稻与供体亲本根梢生物量比的比较分析,根分泌酸性磷酸酶对水培培养基pH的影响。
附加文件2:补充表S3至S11。
磷饥饿诱导基因、13个磷转运蛋白的表达水平、差异表达的转录因子、对照水稻基因型根系细胞壁相关基因、植物激素编码基因、碳水化合物和脂质代谢相关基因、光合作用相关基因、基因表达表观调控相关基因、在磷饥饿胁迫下,对照水稻基因型中检测到的表达基因的主数据表。
补充文件3:补充表S12。
随机选择对比水稻(Pusa-44,缺磷胁迫敏感;耐磷)基因型。
附加文件4:补充方法。
详细的实验方法。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
库马尔,S,帕拉维,丘格,C。et al。对比水稻的性状(栽培稻L.)基因型揭示了pi对耐磷能力的有效模式。BMC植物杂志21,282(2021)。https://doi.org/10.1186/s12870-021-03015-4
收到了:
接受:
发表:
关键字
- 大米
- 磷饥饿
- 抗压力能力
- 转录组分析
- 磷酸酶
- 转运体
- 转录因子
- 根发展