抽象的
背景
Cinnamomum migao.是一种濒临灭绝的常青木本植物物种对中国的物种。它的水果被中国苗族的苗族用作传统医学,商业价值高。然而,它的种子萌发率在天然和人工条件下极低。作为植物繁殖的基础,种子萌发涉及一系列生理,细胞和分子变化;但是,分子事件和系统改变发生c·米高种子萌发尚不清楚。
结果
本研究结合生理指标和转录水平的变化,揭示了种子萌发过程中细胞结构、贮藏物质和抗氧化能力的调控特征。电镜分析表明,种子子叶中存在大量光滑饱满的油体。随着种子萌发,油体等物质逐渐降解以供给能量;这与贮藏物质的含量一致。转录组分析表明,80 - 90%的差异表达基因(DEGs)在种子吸胀后出现,反映了重要的发育和生理变化。参与物质代谢(甘油脂代谢、脂肪酸降解、淀粉和蔗糖代谢)和能量供应途径(戊糖磷酸途径、糖酵解途径、丙酮酸代谢、三羧酸循环和氧化磷酸化)的unigenes在四个萌发阶段均有差异表达。其中,萌发初期能量供应通路中的少数基因维持了高水平的表达,以维持种子的活力和萌发能力。在LK(种皮裂)期,参与脂类代谢的基因首先被大规模激活,然后参与碳水化合物(CHO)代谢的基因被激活,这些基因具有各自的种特异性。
结论
我们的研究揭示了种子萌发过程中基因的转录水平及其相应代谢途径的序列。细胞结构和生理指标的变化也证实了这些变化。我们的发现为确定种子萌发的分子机制提供了基础。
背景
Cinnamomum migao.李皓月是樟科最重要的常绿药用树种之一。作为一种原生植物,主要分布于中国西南部[1]被中国濒危植物的红纸被定义为濒临灭绝的物种。此外,由于其对血管内膜病和胃痛的特殊疗效,c·米高已被称为贵州省着名和真正的药材。但是,过度利用野生资源和低萌发率c·米高导致自然环境中的个体罕见再生。此外,之前的研究和之前的研究现场调查发现,物种的数量减少了[2,3.].
种子萌发被认为是植物形成幼苗的先决条件,是物种生命周期中的关键阶段[4,5].种子萌发的过程以成熟的干种子吸水开始,以胚根突出结束。这一过程由几个复杂的生理、生化和分子过程的协调调控[6],包括动员存放的储备,能量产生,信号转导和转录激活[7].通常,有三个重要阶段的种子必须经历从静态成熟状态完成最终发芽。在初始快速摄取(I相)后,将水吸收到细胞中促进了干燥种子的快速膨胀。接下来,种子的生理和代谢过程开始,触发内部储能物质的动员,例如蛋白质,脂质和淀粉[8].随后,种子进入相对平坦的阶段(II期),其中其内酯进一步活化,导致大量线粒体的合成[9],修理和德诺维DNA的合成,储存蛋白的动员和降解,以及储存mRNA的翻译[10.].随着胚轴的伸长和胚根的生长,种子萌发进入第三阶段(Phase III),通常称为萌发后阶段[11.,12.].在种子萌发过程中,能量产生和呼吸起着至关重要的作用[13.],产生的初始能量主要通过无氧呼吸提供。随后,呼吸活动随着吸氧和水分吸收过程中二氧化碳释放加速而增加[14.].种子萌发的生理过程需要相当大的能量[15.].细胞代谢的主要能量来源是葡萄糖,葡萄糖通过糖酵解和三羧酸(TCA)循环分解,最后通过氧化磷酸化生成ATP。
种子萌发率与幼苗的存活率和随后的幼苗生长和发育的高相关性,这直接影响了幼苗的质量[16.].生理生化研究是种子萌发初步研究的主要关切[17.];这些研究使我们能够获得对种子萌发过程中发生的主要生理变化和重新激活的基本了解[5,18.].转录测序是了解复杂的分子调节机制的有效工具,以及为种子萌发提供新的见解。在几种植物的种子萌发期间已经进行了该技术,包括大麦芽,芸苔栗鸟,Suaeda Aralocaspica, 和花椒属植物dissitum[19.,20.,21.,22.];然而,木质植物种子萌发的潜在的分子机制仍然难以难以捉摸,特别是药物植物的种子[23.].因此,RNA-SEQ技术是用于研究分子过程的技术c·米高Lauraceae在药用植物中提供有价值的洞察力。
结果
形态学和扫描电子显微镜观察c·米高种子发芽
在四个发芽阶段c·米高种子(图。1),在扫描电子显微镜下在子叶细胞中观察到结构变化(图。2).在细胞中含有含有油体的细胞中的胞外细胞的直径为52-72μm。在干燥的种子阶段,在子叶细胞中存在直径为3-12μm的光滑和丰满的球形油体。球状颗粒,例如油体,被非晶酶覆盖(图。2A、B).随着种子萌发,在酶的作用下,细胞内的油体和其他贮藏物质的微观结构发生了明显的变化。种子吸水后,油体被活化的无定形酶完全包裹,光滑油体的结构消失(图2)。2C和D),在油体上观察到一些沉淀物,使其表面粗糙。从种子开裂到发芽阶段,油体的表面是中空的,并且细胞中的油体显着消耗(图。2E-H)。
种子萌发的生理特性
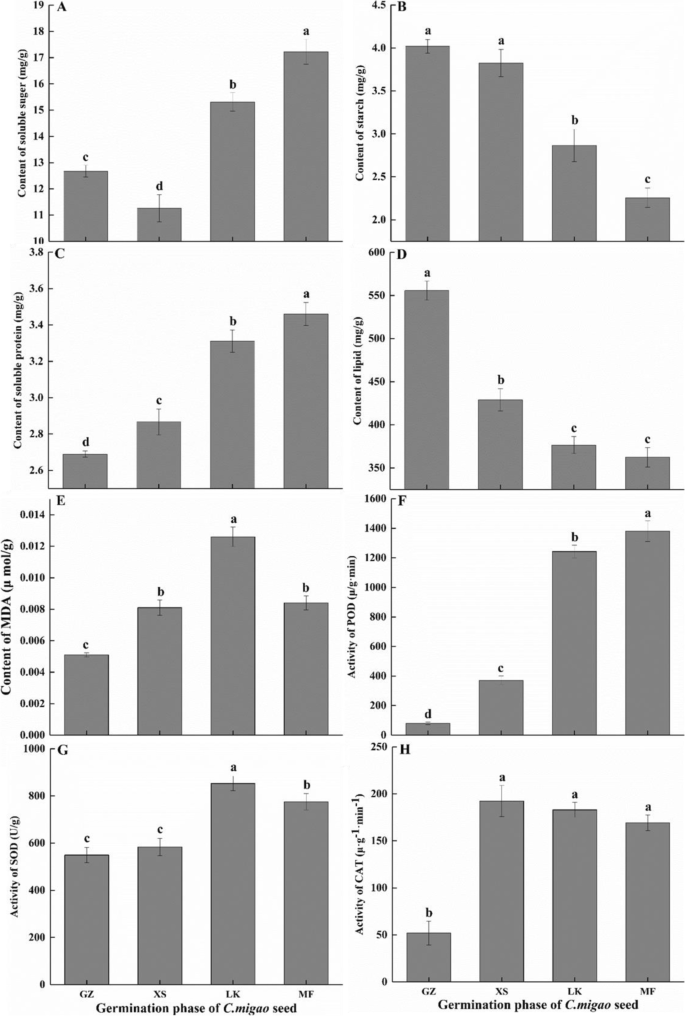
与干燥种子相比,单位重量种子的可溶性糖含量(SSC)和淀粉和脂质含量随着水的快速进入而显着降低,分别下降了11.06%,4.87%和32.25%;相反,可溶性蛋白质含量明显增加6.59%。与干燥的种子相比,SSC和可溶性蛋白质含量在裂开和发芽阶段的种子中不断增加,分别增加35.88%和28.66%;储存材料的淀粉和脂质含量在种子萌发期间减少28.69和43.86%和32.25和34.79%(图。3.).
转录组功能注释和表达分析
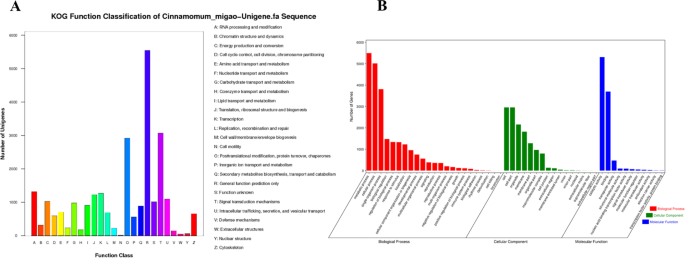
旨在调查转录景观c·米高种子萌发,我们进行了RNA-SEQ,分析了萌发的四个阶段的转录水平的变化(每个阶段样品含有三个重复)。从12个cDNA文库中过滤原料数据,所有样品的Q30> 95%(表S1).装配测序数据导致鉴定总共78,832个unigenes;N50的长度为1,560 bp。为了获得有关组装的转录om的综合信息,使用对NR,Swissprot,Kog,Kegg和Go数据库的相似性搜索,使用≤10的显着阈值e-value来注释非更余序列- 5和BLAST算法。此外,78,832个未分布于每个数据库,31,313名(总数的39.72%),17,047%(21.62%)为Kog,19,363(24.56%)为Kegg的12,305(15.61%),9,284调查(11.78%)进行调查(图。4).不幸的是,47,302个未成年人(60.0%)在目前的研究中无法在功能上注释,这可能由于在极具特殊的物种中存在独特的基因c·米高.
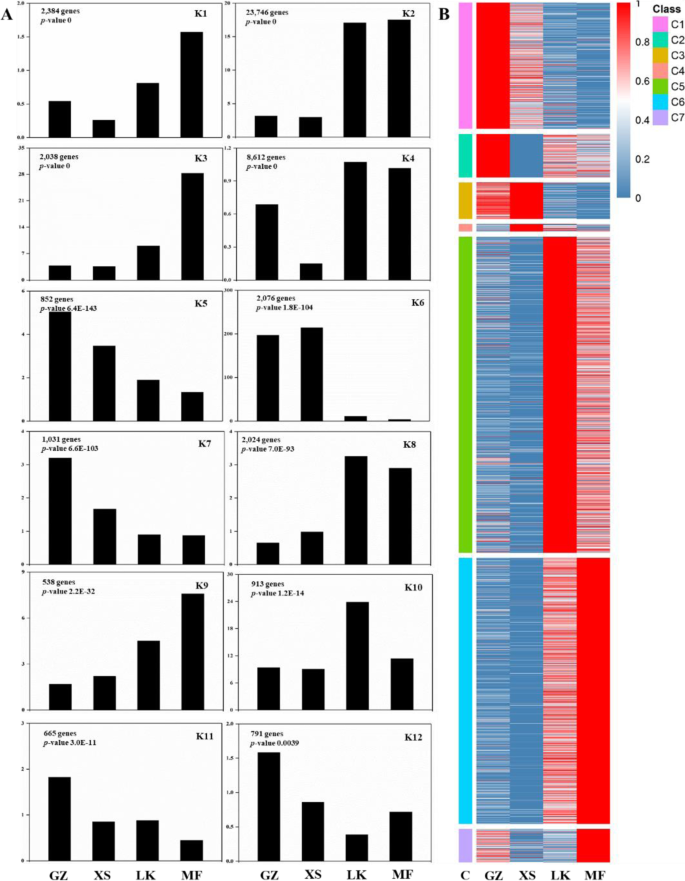
为了获得种子萌发过程中的转录动态表达模式,我们使用STEM软件对不同萌发阶段(GZ、SX、LK和MF)的差异表达基因(DEGs)进行分类。同时,共获得26个表达谱,其中12个不同的表达谱(K1-K12,P< 0.01)极显著(图。5一种)。使用分层聚类,我们将DEG分为七个共体类(C1-C7),每个类别包含具有高相似表达模式的基因(图。5b)。12表达谱的表达式模式与7个共抑制类的表达式一致。GZ阶段C1和C2的基因表达水平高,包括与糖体蛋白质组合物,氧化磷酸化和RNA转运有关的基因。在C3和C4中,在XS阶段上调少量基因的表达水平,而C5中大量基因的表达水平在LK和MF阶段中连续上调。在C6和C7中,在LK和MF阶段上调有涉及物质和能量代谢的基因的表达水平,并在MF阶段达到峰;这些结果与种子萌发过程中的生理变化一致(图。3.).
Degs和基因本体和Kegg Enclement
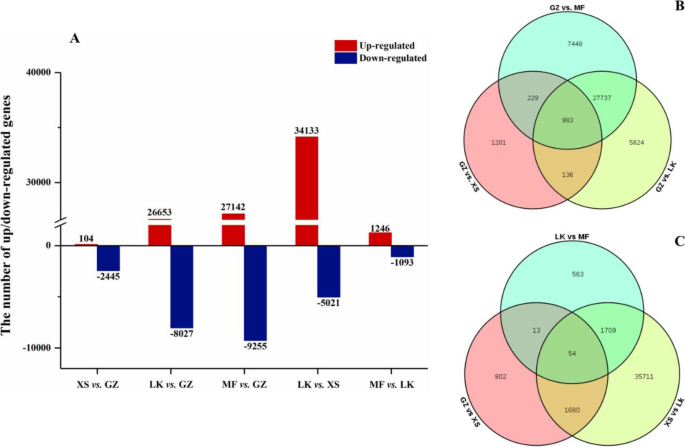
我们对四个样品中未成肢的转录水平进行了差异表达分析,以鉴定参与种子萌发的潜在调节基因。The DEGs were compared in two main ways: (1) using GZ as the reference point, i.e., the fixed reference system (FFS), and (2) by selecting each previous adjacent time point in turn as the reference point, i.e., the continuous comparison system (CCS). In the FFS and CCS groups ofc·米高种子中分别获得了43,558和40,532个DEGs。6一种)。转录物水平的26,653个基因显着增加,而8,027个基因的基因在LK阶段下降(LK与GZ);相比之下,34,133个基因的转录物水平显着增加,而5,021个基因的基因在LK阶段下降(LK与Xs)(图。6一种)。在两个比较系统(FFS和CCS)中,MF与GZ和LK的次数分别占两组总数的83.6和96.6%;其中,我们分别确定了983和54个共享的DEG(图。6结果表明,GZ期和MF期种子的组织差异最大,而在整个萌发过程中,大多数DEGs开始于XS期;差异在XS ~ LK阶段最为显著。对这些基因在种子萌发过程中转录表达水平的分析表明,这些基因在种子萌发过程中广泛表达。
在CCS种子萌发中,观察到一致或相反的转录性调控特性。在FFS组中,获得了4,352个上调的DEG和578张MAPAMAN垃圾箱的4,352个MAPMAN箱;上调基因占所有参数的88.28%。大多数Degs陷入了27个箱,包括RNA,运输,脂质代谢,蛋白质,碳水化合物,氨基酸代谢,细胞和细胞壁(图。7).上调的基因主要参与RNA/蛋白质的生物合成、脂质代谢、细胞呼吸、碳水化合物和营养物质的吸收(图1)。7一个);下调基因主要参与RNA生物合成、蛋白质生物合成和溶质转运(图1)。7b)。在CCS组中,获得了4,296个上调的DEG和481个MAPMAN垃圾箱的4,296个MAPMAN箱;同时,CCS系统中DEG的分类结果与FFS组的分类结果类似(图。7C和D)。
因为MAPMAN生成的功能分类仅限于具有推定的基因拟南芥我们在功能性上的同源物也使用了Go和Kegg注释,以提供进一步的证据c·米高功能专业化。由于FFS和CC之间的相似性,因此在CCS组中主要进行了Go和Keggs的富集分析。For GO enrichment, the DEGs in the CCS of XS versus GZ, LK versus XS, and LK versus MF stages were significantly enriched into 48, 81, and 137 GO terms, respectively, which belong to three major functional categories: cell component (C.C.), molecular function (M.F.), and biological process (B.P.). In the LK versus XS stages, the functional categories of the upregulated genes in the LK stage were remarkably enriched in 22 B.P. groups, including cellular process (GO:0009987) and biological regulation (GO:0065007); significantly concentrated in 16 C.C. groups, including cell (GO:0005623), cell part (GO:0044464), and organelle (GO:0043226); and mainly enriched in 11 M.F. groups, including catalytic activity (GO:0003824) and transporter activity (GO:0005215) (Figure S1).
对于Kegg浓缩,XS与GZ,LK与Xs和LK与MF级分别分别为86,132和114个代谢途径的DEG。XS阶段(XS与GZ)中的上调基因在内质网和半胱氨酸和甲硫氨酸代谢中浓缩蛋白质加工中(图S2一个);XS阶段中的下调基因富含核糖体,脂肪酸伸长率和植物病原体相互作用(图S2b)。LK阶段(LK与XS)中的上调基因主要集中在甘油代谢,氨基酸的生物合成,磷酸磷酸盐途径(PPP)和TCA(图S2C);LK阶段中的下调基因浓缩成内质网蛋白加工,ABC转运蛋白和植物激素(图S2d)。MF阶段(MF与LK)中的上调基因主要富含甘油酯代谢,淀粉和蔗糖代谢,以及糖酵解/葡糖生成(图S2E);MF期下调基因集中于脂肪酸生物合成和次级代谢产物生物合成(图S)2F)。这些结果表明,若干类别在不同的发芽阶段具有某些特征。我们的数据提供了与材料和能量新陈代谢相关的基因表达的独特全局视图c·米高种子发芽。
三酰基甘油(标签)种子萌发中的代谢
含油量随种子萌发而变化,其中干性种子含油量最高。3.D). KEGG注释显示97个注释与种子萌发过程中的甘油脂代谢相关(ko00561), 160个注释与脂肪酸代谢相关;(图S3.A和S.3.b),63注释为脂肪酸降解(KO00071)(图S3.c)在Xs与LK中。
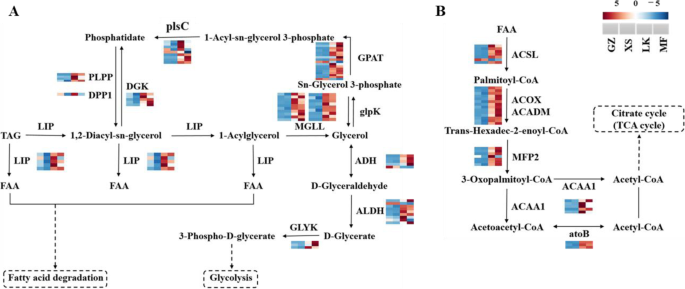
注释为三酰基甘油(油)分解,编码三酰基甘油脂肪酶(唇),酰基甘油脂肪酶(MgLL),甘油-3-磷酸o-酰基转移酶(GPAT),1-酰基-Sn-甘油-3-磷酸酰基转移酶的乙酰甘油-3-甘油-3-磷酸酰基转移酶(PLSC),磷酸酯磷酸酶,磷酸酯磷酸酶,醇脱氢酶(ADH)和醛脱氢酶(ALDH)在LK和MF籽中更高度表达(图S4).此外,在接受脂肪酸降解的DEG中,与GZ和XS种子的LK和MF种子相比,在LK和MF种子中明显上调了编码长链酰基-CoA合成酶(ACSL),ACOX,ACCOM,MPF2,ACAA1和ATOB的ungenes(图。8一种)。因此,表达了MGLL,ACSL., 和ACOX上调≥10倍。
种子萌发中的淀粉和蔗糖新陈代谢
在发芽过程中,淀粉含量c·米高显示下降趋势,而SSC的趋势呈现逆(图。3.).在向淀粉和蔗糖代谢(KO00500)注释的135℃中,大多数基因在LK与XS阶段中差异表达,并且这些DEG在LK和MF阶段保持更高的表达水平(图S4).
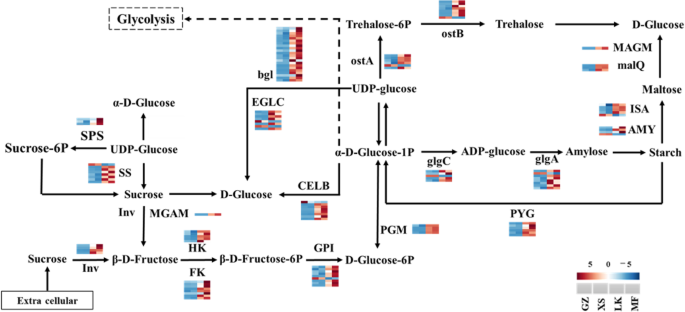
编码异淀粉酶(ISA)、α-淀粉酶(AMY)、麦芽糖-葡萄糖淀粉酶(maltase- glucamylase)、4-α-葡萄糖基转移酶(4-α-glucosyltransferase)、转化酶(Inv)、己糖激酶(HK)、果糖激酶(FK)、葡萄糖-6-磷酸异构酶(GPI)、糖原磷酸化酶(PYG)和磷酸葡萄糖合成酶(PGM)的unigenes表达水平在LK和MF期显著上调。在LK和MF阶段,上调表达可能会加速淀粉、麦芽糖和蔗糖的分解。在LK和MF阶段,仍有一些淀粉和蔗糖代谢的关键基因上调,包括编码蔗糖合酶(SS)、蔗糖磷酸合酶(SPS)、内切葡聚糖酶(endoglucanase, SS)、β-葡萄糖苷酶(β-glucosidase, β- glucanendo1,3 -β-D-glucosidase, glgC)、淀粉合酶、葡萄糖-1-磷酸腺苷转移酶(starch synthase, glgC)的unigenes。海藻糖6-磷酸合成酶和海藻糖6-磷酸磷酸酶。其中,表达水平isa.,GPI.,SS., 和FK.增加7-至16倍,并且在MF阶段的这些基因的表达水平高于LK平均值(图。9).
种子萌发过程中的能量供应
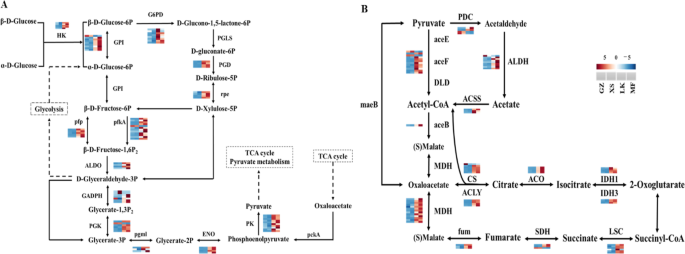
种子中的脂质,淀粉和糖通过种子的发芽逐渐分解,然后通过PPP(KO00030),糖酵解途径(EMP)(KO00010),丙酮酸代谢(KO00620),TCA循环(KO00020)和氧化磷酸化(KO00190),但它们没有完全分解。种子中的大分子物质的分解产物通过改变这些代谢途径中的关键基因的表达水平来提供种子萌发的能量(图。10.广告)。
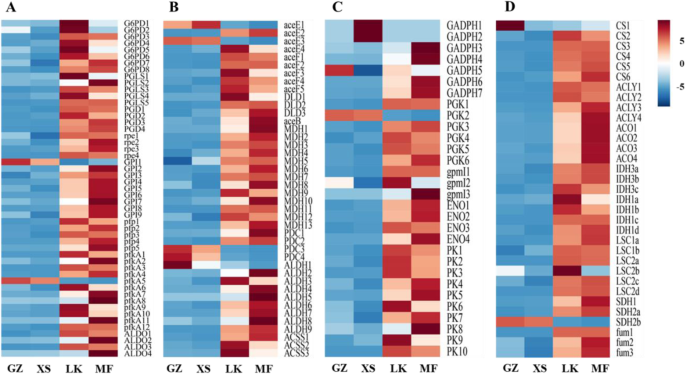
葡萄糖在EMP中经历分解成D-甘油醛-3P和β-D-果糖-6P。将49次注释为PPP,编码葡萄糖-6-磷酸脱氢酶(G6PD),荧光葡聚糖酰胺酶(PGD),6-磷光葡萄糖酰胺脱氢酶(PGD),核苷酸磷酸三术酶,GPI,二磷酸二磷酸依赖性荧光体FruceOkinase(PFP)的未成粒子,在LK和MF阶段显着上调,6-磷蛋白酶1(PFKA)和果糖二磷酸醛糖酶(ALDO)(图。10.一种)。unigenes的表达G6PD.,pgl和亲在LK阶段比XS阶段中的LK平台高8-至10倍(图。11.A).上述基因表达的变化可能会加速LK期种子中葡萄糖的分解。在EMP注释的32个DEGs中,编码甘油醛3-磷酸脱氢酶(GADPH)、磷酸甘油酸激酶(PGK)、磷酸甘油酸诱变酶(pgmI)、烯醇化酶和丙酮酸激酶(PK)的unigenes在LK期表达上调GADPH.,pgmI, PK增加了9 ~ 14倍,有利于d -甘油醛- 3p的分解(图3)。11.一种)。
在向丙酮酸代谢途径注释的37次中,编码丙酮酸脱氢酶E1,E2(Acee,Acef),二氢酚酰胺脱氢酶(DLD),丙酸盐合酶,苹果酸脱氢酶(MDH),丙酮酸脱氢酶(PDC),乙醛脱氢酶的植物(ALDH)和乙酰-CoA合成酶(ACS)在LK阶段上调,以及表达式MDH,Maeb., 和阿尔罕增加了8到13倍(图10.C)。将26℃注释为TCA循环,编码柠檬酸合酶(Cs),ATP柠檬酸酯(PRO-S) - 丙酸盐(丙基),琥珀酸脱氢酶(IDH),琥珀酰基 - COA合成酶(LSC),琥珀酸脱氢酶(SDH)和富马酸氢酶(FUM)在LK阶段上调(图。10.d)。此外,Acee / F,CS和IDH在整个过程中是限速酶。表达水平ac,ACO.,CS,idh.,LSC, 和福烟路和MF阶段增加了6至10倍,这可能增加代谢产物的合成和分解在每一个环节,增加循环反应的速度,加快了调整ATP和NADH浓度在路阶段,并确保所需的能源供应c·米高种子萌发(无花果。11.b)。
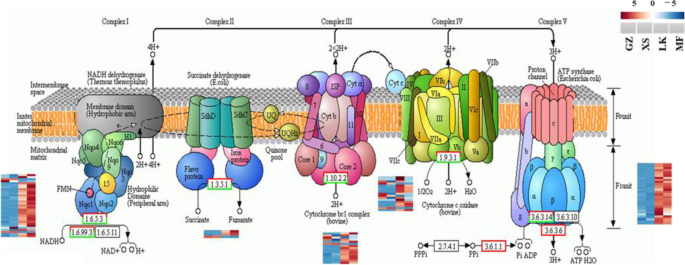
在氧化磷酸化注释的92次上(图S5)、编码NADH脱氢酶(NDUF、NDHA、NDHB和NDHF)、琥珀酸脱氨酶、细胞色素c还原酶、细胞色素c氧化酶和转运atp酶的unigenes在LK期上调,可能导致H+在LK和MF阶段,种子能产生足够的能量供种子萌发(图2)。12.).
抗氧化能力c·米高种子在发芽期间
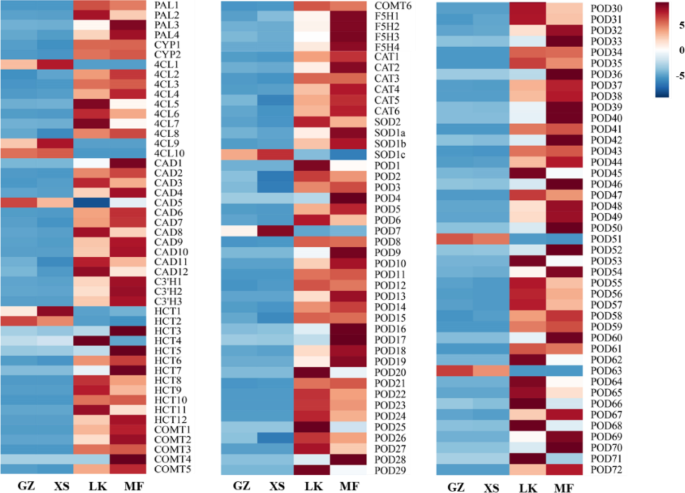
种子可以在发芽期间对生物和非生物胁迫的反应激活他们的防御机制。Degs的注释表明,清除大分子反应性氧(ROS)的酶(SOD,CAT和POD)主要由过氧化物体(KOO 4146)和苯丙醇生物合成(KO00940)合成。在种子萌发期间,在LK阶段上调了编码猫和SOD的九个未成语。111℃的未成熟,其注释为苯丙烷化生物合成素(图。13.)编码的苯丙氨酸氨酶(PAL),反式肉桂酸酯4-单氧基酶(CYP),4-香豆酸酯 - COA连接酶(4CL),糖醇脱氢酶,咖啡酸3-O-甲基转移酶(COMT),FERULE-5-羟化酶(F5H)和豆荚。应该指出的是表达的荚LK期增加17倍,其他基因增加6-13.8倍;然而,的表达朋友,HCT,COMT.和荚而编码POD的12个ungenes的表达上调了6.2倍,这与萌发过程中抗氧化酶活性的变化是一致的(图2)。3.F)。
代谢途径网络分析
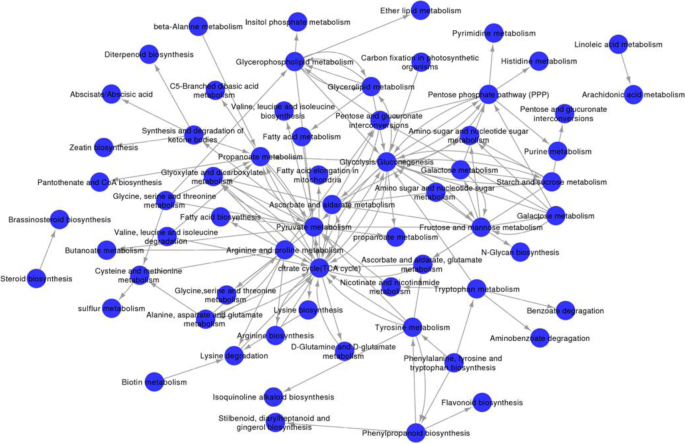
根据Degs在种子中的Kegg富集途径之间的相互作用c·米高(表S.2),建立代谢途径网络,阐明了重要途径之间的相互作用,确定了途径之间的激活状态(图)。14.).基于种子的程度,测定能量代谢相关途径,TCA,糖酵解/葡糖生成和丙酮酸代谢是网络的中心(图。14.).网络中的最高程度归因于TAC,在TCA循环期间31个unigenes的表达水平在LK阶段上调,在提供种子萌发能量方面发挥了关键作用。糖酵解/葡糖生成的程度是第二高,在LK阶段上调22个unigenes的表达。丙酮酸作为代谢网络中的重要中间产品发挥了连接作用;因此,丙酮酸代谢途径对于种子萌发至关重要,其参与脂质生物合成,TCA循环和其他靶标代谢途径,通过将丙酮酸转化为乙酰基 - 辅酶和草酸乙酸盐;同时,在LK阶段上调了38个unigenes(图。11.同时,在LK和MF阶段,PPP中的49个unigenes上调(图2)。11.b),其可能促进糖溶解途径中葡萄糖分解成D-甘油醛-3P和β-D-果糖-6P。储存材料的代谢(甘油脂,蔗糖,淀粉代谢等);氨基酸新陈代谢(酪氨酸代谢,精氨酸和脯氨酸代谢,赖氨酸降解等);和中间体和能量供应途径(糖酵解,TCA循环,PPP等)被系统地触发c·米高种子发芽。
讨论
种子萌发过程中的代谢和调节储存物质
支持种子萌发的复杂生理过程所需的能量和储存物质的代谢是激活种子萌发的关键[24.].碳水化合物,蛋白质和脂质是大多数种子的主要储存物质[25.],为种子萌发提供依据,在种子萌发中起着举足轻重的作用[26.].已经证明,在种子萌发期间动员和最多使用了含量最高的储存物质。例如,在高粱种子的萌发过程中糖的含量逐渐增加,而主要储存材料脂肪和淀粉的内容显着下降[27.].种子萌发向日葵也主要动员和利用种子中的油类物质,发芽时含油量急剧下降[28.].目前的研究表明,石油和淀粉含量在此期间显着下降c·米高种子萌发(无花果。8),胚胎细胞微结构中存在丰富的油体(TAG)(图。2);这些结果表明,油和淀粉是动员和使用的主要储存材料。在种子进入XS阶段后,标签被唇部调动,油体逐渐和酶促水解成FAA,最终转化为糖,例如糖,用作能源[29.].脂肪酶将TAG分解为游离FAA和甘油;游离FAA经β-氧化转化为乙醛体,再转化为乙酰辅酶a。最后,TAG通过乙醛酸循环和糖酵解或糖异生作用转化为糖[30.].唇,MGLL,GPAT.,PLSC.,ADH., 和阿尔罕在甘油脂代谢的中c·米高种子在LK和MF阶段上升高(图。8),从而加速TAG分解。随后,ACSL.,ACOX,MPF2,ACAA1.等脂肪酸降解相关基因在LK期也上调,大部分基因在MF期达到峰值(图)。8).经过一系列反应后,标签的分解产物被运输到萌发和生长区域。
淀粉和蔗糖在种子萌发中发挥关键作用,并且它们分解的最终目的是为种子萌发提供能量[31.].淀粉在大麦种子的萌发过程中逐渐分解,导致其内容下降[32.];这种趋势在种子萌发过程中也能观察到c·米高(图。3.).淀粉水解依赖于ISA, AMY和β-淀粉酶(BMY)。值得注意的是,只有一个isa.和一个勃在GZ和XS阶段高度表达c·米高,而大部分isa.和艾米在LK和MF阶段显著上调(图2)。9).在发芽期间Cyclobalnopsis Gilva.种子,BMY的活性和mRNA表达水平很高;但是,艾米的活动和表达水平没有明显的关系[13.];这些结果与c·米高(图。9)和XS期小麦种子[33.].另一种淀粉分解途径依赖于PYG,它将淀粉分解为葡萄糖-1-磷酸,然后转移到糖酵解途径为种子提供能量。值得注意的是,种子c·米高在LK和MF阶段通过上调表达水平加速淀粉分解侏儒(图。9);这些结果与生理指标获得的结果一致(图。3.).然而,具有高淀粉含量的小麦种子在表达水平中显示出上调侏儒在XS阶段[33.].这些结果表明,不同物种的淀粉水解途径和淀粉酶种类不同,淀粉水解酶基因的表达水平也与物种的贮藏物质成分有关。
可在萌发过程中直接使用的可溶性糖,如蔗糖和葡萄糖[34.],储存在胚胎或胚乳中或从油和淀粉转化[35.].在发芽期间高粱二色的种子,SSC不断增加;但是,SSC在胚胎中c·米高直到种子完全被水吸收后才增加。3.).XS阶段中每单位重量的SSC减少可能由于种子早期吸收水(图。3.);这些结果与野生草原物种种子萌发的结果一致[27.].值得注意的是,inv,sps,ss,gpi和glgc在蔗糖生物合成和新陈代谢中发挥关键作用。它们将蔗糖转化为果糖和葡萄糖进行糖酵解,从而为种子萌发提供能量[36.].表达水平挪威,SS.,SPS, 和glgc.在淀粉种子的萌发过程中仍然很高[37.];但是,只有SS.,GPI., 和glgc.在GZ和XS阶段上上调,而其他关键基因的那些在LK和MF阶段上调(图。9);然而,这些结果与淀粉含量高的物种不同。由于含油量高c·米高在GZ期和XS期,籽粒中降解淀粉、蔗糖和油脂的少数unigenes表达上调。进入LK和MF阶段后,TAG和脂质代谢ungenes的表达水平开始迅速增加(图2)。8).此外,碳水化合物分解基因的表达水平开始于LK阶段上调,但在MF阶段更大明显;标签和脂质代谢基因的表达水平高于淀粉代谢基因的表达水平(图。8).从上述生理学,生化和转录结果,拟议种子c·米高在长期发芽周期中有自己的代谢法。
种子萌发期间的新陈代谢和能量调节
种子萌发过程需要大量的能量来进行生理活动。尽管如此,由于缺乏矿物吸收系统和光合装置,发芽种子依靠储备材料的动员以获得必要的能量[34.].此外,种子萌发的早期阶段的氧含量不足,糖酵解和醇发酵是早期XS阶段的一次能源[33.].值得注意的是,不可逆酶HK、PK和pfkA是EMP的关键限制酶,因此,编码这些酶的ungenes的表达水平直接决定了种子萌发早期代谢途径的速度和方向。在GZ和XS阶段c·米高在种子萌发过程中,只有一个编码pfkA的基因表达上调;然而,在LK和MF阶段,编码HK、PK和fkA的26个ungenes显著上调(fig。9和10.).在…的中间阶段c·米高种子萌发、能量消耗增加,糖酵解途径关键基因表达上调,说明XS后能量需求显著增加,直至萌发完成;这些结果与玉米种子萌发的结果相似[38.].在大多数粮食种子中,能量供给主要是通过增加表达PK.和其他基因,其催化从磷酸丙酯的磷酸盐溶剂化的产生,然后进入丙酮酸循环[39.].此外,在XS阶段之后,上调糖酵解参与的关键基因的表达被上调c·米高种子(图。10.).值得注意的是,丙酮酸起着中间产物的作用,通过PDC、ALDH、ACSS或ACEE、ACEF、DLD转化为乙酰辅酶a [40].的高表达水平PDC和阿尔罕促进水稻种子萌发过程中乙酰辅酶a的形成[33.].值得注意的是,在XS阶段之后上调丙酮酸代谢的大多数关键基因,并且乙酰-CoA主要由上调产生PDC,阿尔罕, 和ACS在LK阶段王牌,环保联合会, 和DLD.在MF阶段(图。10.),从而成为线粒体电子传输链中ATP生成的能源[31.,41].此外,PPP是葡萄糖氧化分解的另一个重要途径,其活化是种子萌发的关键途径,导致d -甘油醛- 3p和β- d -果糖- 6p的生成,进入糖酵解途径。与PPP相关的关键基因在种子萌发过程中被激活燕麦属fatua种子[42];这一结果与本研究结果一致。表达水平G6PDH,PGD., 和Aldo.在PPP中显著上调(图。11.),在LK期达到高峰(图。11.),为种子萌发提供足够的中间材料和能量。当通过厌氧呼吸提供的能量不足时,TCA循环为种子萌发的有氧条件下提供能量[33.].玉米种子萌发的结果显示,与TCA循环和线粒体电子传输有关的基因在干燥的种子中升高,在早期阶段升高,以满足吸收后快速生长的需求[38.].MDH,CS,ACO., 和idh.参与TCA循环在LK和MF阶段显著上调c·米高种子萌发(无花果。11.);这一结果与大麦种子萌发过程中观察到的结果相似[43].此外,氧化磷酸化过程中通过电子转移产生的ATP为种子萌发提供能量,其中NADH脱氢酶(complex I)提供了长期的高能量需求拟南芥种子萌发及幼苗生长[44].氧化磷酸化途径中ATP合酶mRNA表达水平的升高可促进ATP的形成;这在Kandelia candel种子萌发[45].在LK和MF阶段显着上调编码氧化磷酸化途径中复合物的几种未成矿(图。12.),表明这一途径主要用于提供能量c·米高种子在晚期发芽阶段。
在种子萌发过程中防御能力的激活
种子萌发不仅与储存物质的转化和用途有关,而且还与在该过程中通过各种酶(抗氧化酶)的不同反应的激活[46].酶解蛋白质为种子萌发提供氮营养;蛋白质是酶的组成部分,在种子萌发和植物中起着重要的作用[47].可溶性蛋白质含量增加并达到了MF阶段的峰值c·米高种子萌发(无花果。3.);这不仅增加了种子内部生理活动的激活,而且维持了保护酶的合成和代谢。这就保证了种子从休眠到萌发这一周期的顺利完成[47].种子的呼吸代谢随萌发过程而增加;这就导致了大量ROS的产生,而ROS的产生又导致了超氧阴离子(O2−)、过氧化氢(H2O2)和羟基自由基(哦-).这最终导致脂质过氧化和细胞结构的氧化损伤,以及MDA含量的增加[48,49].在苹果种子自吸萌发过程中,ROS以细胞信使或有毒分子的形式破坏细胞脂质,增加MDA含量[50,并激活抗氧化防御系统,对多种生物和非生物压力作出反应[51].
以往的研究表明,SOD与O不成比例2-到H.2O2和O2通过快速歧化反应毒性较小[52].CAT和POD的协同作用可进一步去除H2O2从而有效地减少和消除了细胞膜上自由基引起的损伤[53].在…的初始阶段c·米高种子萌发,MDA的含量增加;此外,保护酶SOD,POD和猫的活性迅速增加,并且保持在相对较高的水平(图。3.).尽管对细胞结构进行氧化应激,但自由基的及时清除确保了有利的种子萌发。此外,POD活性的增加可以加速细胞分裂和新的细胞壁形成,并促进木质素,软木层和羟脯氨酸糖蛋白的生物合成[54].值得注意的是,POD活动水平的变化是最重要的c·米高种子萌发,其结果与观测结果相似Cyclobalanopsis chungii.在种子休眠释放和萌发过程中[55].苯丙醇丙烷代谢是防御机制之一[56],其中111个ungenes在LK和MF期上调。在这些unigenes中,表达水平为68荚基因显着增加(17倍)(图。13.).上述结果表明,POD在种子的ROS清除过程中发挥着重要作用。尽管如此,豆荚已经被证明对种子萌发产生积极影响[54].
结论
在本研究中,RNA-SEQ用于序列的种子c·米高首次揭示了种子萌发过程中的基因表达模式。此外,转录水平和序列的变化在转录水平c·米高测定萌发过程中的种子。根据变化,可以确定在不同萌发阶段的转录水平上发生的生物事件。脂质代谢是最初激活的主要代谢过程,并在种子萌发中发挥重大作用。接下来,激活与淀粉和蔗糖代谢和能量供应途径有关的基因。同时,与抗氧化途径相关的基因的表达增加,其保持了合适的发芽状态。值得注意的是,通过评估细胞结构,生理指标和转录表达水平,结合QRT-PCR分析,进一步证实种子的独特代谢序列。这些调查结果提供了有关条例机制的有价值的信息c·米高种子发芽。在未来的研究中,我们计划进一步探索转录层面可能的监管程序。
方法
植物材料
药用植物的新鲜成熟的果实c·米高2018年10月中旬,在中国西南部贵州省罗甸(北纬25°26′,东经106°31′)收获。本研究使用的植物材料由贵州大学刘纪明教授进行正式鉴定,该材料的凭证标本(编号20181015 - 1,L.D.)已保存在贵州大学生态实验室。去皮去肉后,先用蒸馏水冲洗种子5-6次,去除可见的漂浮颗粒,然后在阴凉干燥通风条件下保存1周。干燥的种子用0.1%的HgCl再灭菌25分钟,用无菌蒸馏水冲洗6-7次(每次1分钟)。然后,将种子在10℃/ 20℃下在种子萌发中孵育。在发芽过程中,研究了四次发芽时期,即阶段I(种子而不吸收水,GZ),阶段(种子吸收水72小时,以全脂吸收,XS),阶段III(吸收后种子涂层裂缝24天,LK)和第IV阶段[胚源突出籽涂层(4 mm),在吸收31天后,MF](图。1).四个阶段的样品在去除种皮后立即在液氮中冷冻,然后在−80°C下保存,待进一步分析。对所有样品进行3个独立的生物学重复,每个重复包含100个种子进行生理指标和转录组测序。
种子微观结构观察与生理指标的测定
从四个阶段的种子用2.5%戊二醛在磷酸盐缓冲液(0.1M,pH7.4)中固定,使用浓度系列乙醇(30%,50%,70%,80%,85%,90%,95,脱水 %, 100 %, and 100 % v/v) for 15 min, and then incubated with isoamyl acetate. The samples were treated with vacuum after air drying and were coated with gold in a vacuum evaporator (Quorum). The specimens were viewed and photographed under a HITACHI SU8100 scanning electron microscope. Seeds from the four stages described above were sampled to quantify the physiological parameters; three biological replicates were performed for the four stages. In brief, the soluble sugar content (SSC) and starch in seeds were determined using the anthrone method [57].可溶性蛋白含量测定采用考马斯亮蓝G250染色法[58].用于自动脂肪分析仪c·米高脂质测定。使用Hodges等报道,使用硫碱脲酸法估算MDA含量。[59,稍作修改。用Lacan和Baccou所描述的硝基蓝四唑氯法分析SOD活性[60,稍作修改。愈合方法确定豆荚活性[61,稍作修改。使用紫外分光光度法测定过氧化氢酶活性[62,稍作修改。
转录组测序和德诺维集会
使用Omega植物RNA试剂盒(No.R6827,Omega Bio-Tek Inc.,USA)分别从四种萌发阶段的种子中分离出总RNA。使用NanoDrop 2000分光光度计和Qubit荧光计(Life Technologies)测定所有样品的RNA纯度和浓度。使用Agilent 2100 BioAnalyzer(Agilent Technologies)测定RNA完整性。使用具有RNA完整性> 8和足够量的高质量RNA来构建测序文库。RNA样品用于聚(a)+选择使用低聚(dT)磁珠。接下来,使用Illumina HiSeq™4000平台(Illumina, San Diego, CA, USA)对文库进行测序,该平台位于中国广州Gene Denovo科技有限公司。收集RNA-Seq的原始数据,通过去除适配器、未知核苷酸和低质量(q值≤10)碱基获得干净数据。同时计算干净数据的Q20、Q30、GC含量和序列重复水平。高质量的清洁数据用于下游分析。随后收集了干净的读数德诺维使用Trinity软件(trinityrnaseq-2.0.6, E-value≤0.05)[63].
功能注释和差异表达分析
为了预测基因的可能功能和生物途径,Unigene序列与NR,Kog,Swiss-Prot,Go和Kegg数据库对齐。使用KEGG自动注释服务器进行unigenes的Kegg路线映射[64].根据NR注释的结果,BLAST2GO软件(E-VALUE≤0.05)[65用来获得unigenes的Go注释信息。获得Go注释后,Wego软件(E-alergul≤0.05)[66]对所有unigenes的GO功能进行分类和计数。基于该基因的长度和标记到该基因的读计数,计算每个基因每百万碱基对测序的转录本序列每千碱基的预期片段数。采用DESeq R包(1.18.0)对两组进行差异表达分析[67].错误的发现率(FDR)用于确定阈值p-在多个测试中值[68].FDR < 0.05和fold change≥2被认为是确定表达意义的临界值。
转录组表达分析和功能分类
Mapman用于确定种子萌发的基因功能富集[69],功能类别名称为“未分配和未知”的注释条目被排除在本研究之外。短时间序列表达式矿工(STEM,http://www.cs.cmu.edu/~jernster/sem.)对unigenes在四个萌发阶段的表达模式进行聚类分析。最大数量的模型配置文件:26。其他参数:默认值。利用层次聚类方法,根据基因间表达谱的皮尔森相关系数,将四个萌发阶段的功能单基因分为共表达模块[38.].使用聚类评估显着规定基因的簇[70],兆电子伏[71.]和TreeView [72.].
定量rt - pcr验证(q)
从三个独立的生物复制的种子的四个萌发阶段提取RNA。随机选取12条与淀粉和脂类代谢相关的mRNA序列,通过real-time qRT-PCR对不同表达模式的基因进行验证。三个c·米高肌动蛋白基因被用作参考基因以使表达数据标准化。底漆序列列于表S中3..qRT-PCR验证系统使用PowerUp™SYBR Green Master Mix (ThermoFisher, Chongqing, China),体积为10µL,其中包含5µL SYBR Green Master Mix, 200 ng cDNA模板,正反引物各0.4µM。qRT-PCR扩增条件为:95℃30 s, 95℃5 s和60℃30 s循环40次(Bio-Rad Laboratories, CA, USA)。用2−ΔΔCT方法 [73.].所有验证均在三个生物学和技术重复中进行。
统计分析
使用SPSS 21.0统计包(Chicago,IL,USA)使用Duncan的测试分析所有数据。所有数据都表示为至少五次重复的平均值和标准偏差。这些图形是使用原点9.0(Origin Lab,Northampton,Ma,USA)构建的。
数据和材料的可用性
本研究中的原始序列数据已存放在公开访问的NCBI序列读取存档(SRA)数据库中作为登录号PRJNA724866存放。支持本文结论的数据集包含在文章及其附加文件中。在本研究期间使用和/或分析的数据集可从作者提供合理的请求(小孔Huang,Guidah365 @ 126.com; Jiming Liu,Karst0623@163.com)。
缩写
- NR:
-
非还原蛋白序列
- COG:
-
同源组的蛋白质簇
- 瑞士科:
-
Swiss-prot蛋白质数据库
- 去:
-
基因本体论
- KEGG:
-
基因和基因组学的京都百科全书
参考
- 1。
张旭,周涛,郭玲,黄玲,姜伟,杨志,马超。苗族草本植物果实挥发油含量与地理分布格局的关系Cinnamomi..生态学报。2011;31:5299-306。
- 2。
赵某,李海,邱德,刘泽,刘恩。Cinnamomum migao.资源与生态调查:贵州、桂北及湘黔桂接壤地区。贵阳中医杂志1991;03:59-61。https://doi.org/10.16588/j.cnki.issn1002-1108.1991.03.030.
- 3.
李L,刘继,黄X,罗c,xiong x,刘j,李继,邓米遗传多样性Cinnamomum migao.使用ISSR标记的群体。J Northwest A F U. 2018; 46(7):15-22。https://doi.org/10.13207/j.cnki.jnwafu.2018.07.003.
- 4.
王志强,王志强,王志强,王志强。种子萌发与活力的关系。植物学报2012;63:507-33。https://doi.org/10.1146/annurev-arplant-042811-105550..
- 5.
Zaynab M,Kanwal S,Furqan M,Islam W,尼诺A,Ali Gm,Rehman N,Zafar S,Sughra K,Jahanzab M.蛋白质组学方法,解决Cyclobalnopsis Gilva中低种子萌发。Biotechnol Lett。2017; 39(10):1441-51。https://doi.org/10.1007/S10529-017-2393-3.
- 6.
Bewley JD。种子萌发和休眠。植物细胞。1997; 9:1055-66。https://doi.org/10.1105/tpc.9.7.1055.
- 7。
汉C,杨P.种子萌发分子机制的研究。蛋白质组学2015,15。https://doi.org/10.1002/pmic.201400375.
- 8。
Mangrauthia S, Surekha A, Sailaja B, Neelamraju S, Voleti S.转录组分析奥雅萨苜蓿(水稻)高温种子萌发显示与激素信号传导和非生物应激途径相关的基因组表达的动态。Trop Plant Biol 2016,9.https://doi.org/10.1007/s12042-016-9170-7.
- 9。
ortiz-espínam,iglesias-fernándezr,calderóna,constracero p,sevilla f,jiméneza。线粒体attro1由Atbzip9和Atazf2转录,并影响盐水条件下的种子萌发。j exp bot 2017,68。https://doi.org/10.1093/JXB/ERX012.
- 10.
发芽——仍然是一个谜。植物科学。2010;179:574 - 81。https://doi.org/10.1016/j.plantsci.2010.02.010.
- 11.
壬垣蕙犬种子休眠和发芽 - 萌发机制和新假设。前植物SCI。2014; 5:233。https://doi.org/10.3389/fpls.2014.00233.
- 12.
Rabelo DB, Gamosa E, Ribeiro E, Costa E, Oliveira A, Venancio T.转录组分析揭示了大豆胚轴在萌发过程中的关键调控和代谢方面。Sci众议员2016;6(1):36009。https://doi.org/10.1038/srep36009.
- 13。
陈卫东,陈伟。转录组学方法在水稻种子发芽率研究中的应用Cyclobalnopsis Gilva.种子。S AFR J BOT。2018; 119:286-94。https://doi.org/10.1016/j.sajb.2018.09.024.
- 14.
杂草种子萌发过程中能量代谢和抗氧化防御系统的变化番薯trilobaL.以及对等化化学的反应。J Chem Ecol。2011; 37:500-13。https://doi.org/10.1007/s10886-011-9945-0.
- 15.
宝益,姚z,曹x,彭j,徐y,陈m,赵某转录组分析phelipanche aegyptiaca氟立酮、tis108和gr24刺激种子萌发的机制。《公共科学图书馆•综合》。2017;12 (11):e187539。https://doi.org/10.1371/journal.pone.0187539.
- 16.
诺曼A,Ali S,Naheed F,Ali Q,Farid M,Rizwan M,Irshad MK。抗坏血酸的叶面应用增强了玉米的生理和生化属性(玉米L.)在干旱胁迫下的品种。Arch Agron土壤SCI。2015; 61(12):1659-72。https://doi.org/10.1080/03650340.2015.1028379.
- 17.
陈志强。种子萌发和幼苗生长过程中蛋白质和核酸的合成。1982: 559 - 591。https://doi.org/10.1007/978-3-642-68237-7_16.
- 18。
杨志刚,王志刚,王志刚,王志刚。水杨酸对大鼠血清白蛋白的影响。蛋白质组学研究拟南芥种子萌发及早期防御机制的建立。植物杂志。2006;141(3):910 - 23所示。
- 19。
王玲,王浩,尹玲,田超Suaeda Aralocaspica揭示萌发期间二晶种子之间的明显的时间基因/ miRNA改变。BMC基因组。2017,18。https://doi.org/10.1186/s12864-017-4209-1.
- 20.
Lie Lc,Narsai R,Wang Y,Berkowitz O,Whelan J,Lewsey Mg。在大麦的转录om的时间组织特异性调节(大麦芽)种子萌发。植物杂志。2020; 101(3):700-15。https://doi.org/10.1111/tpj.14574.
- 21.
朱L,赵X,徐y,王q,王h,吴d,姜l。萌发潜力对油菜早产籽种子储存脂质和转录体变化的影响(芸苔栗鸟L.)。Al Appl Genet。2020; 133(10):2839-52。https://doi.org/10.1007/s00122-020-03636-7.
- 22。
Sun J,Wang P,Zhou T,Rong J,Jia H,Liu Z.转录组族分析壳脱离和外源性胃肠杆菌对萌发的影响花椒属植物种子。Sci Rep 2017, 7。https://doi.org/10.1038/s41598-017-07424-0.
- 23。
舒克,刘X,谢Q,他Z.一种种子的两张脸:休眠和发芽的荷尔蒙调节。莫尔植物。2016; 9(1):34-45。https://doi.org/10.1016/j.molp.2015.08.010.
- 24。
Kazmi Rh,Willems Laj,Joosen RVL,Khan N,Ligterink W,Hilhorst HWM。番茄种子萌发的代谢组分分析。代谢组学。2017; 13(12):145。https://doi.org/10.1007/s11306-017-1284-x.
- 25。
Alencar N,Innecco R,Gomes-Filho E,Gallao M,Alvarez-Pizarro J,Prisco JT,De Oliveira A.种子储备组成和动员在萌发和早期幼苗建立期间Cereus Jamacaru.D.C.SSP。Jamacaru.(仙人掌)。Acad BrasCiênc。2012; 84:823-32。https://doi.org/10.1590/S0001-37652012000300024.
- 26。
杨Q,桑,陈y,魏Z,王p。的作用拟南芥肌醇多磷酸激酶ATIPK2β在种子萌发和幼苗发育中的葡萄糖抑制。植物细胞生理。2017; 59(2):343-54。https://doi.org/10.1093/pcp/pcx186.
- 27。
杨R,王P,Elbaloula M,Gu Z.萌发对高粱种子的主要生理学和生物化学新陈代谢的影响。Biosci J. 2016; 32:378-83。https://doi.org/10.14393/bj-v32n2a2016-30895.
- 28。
Erbaşs,anlıA.调动种子储备在发芽期间和两种向日葵品种的早期幼苗生长。J Appl机器人食物Qual。2016; 89:217。https://doi.org/10.5073/JABFQ.2016.089.028.
- 29。
Bewley JD,Bradford K,Hilhorst H,Nonogaki H.种子:发育的生理学,萌发和休眠,第3版;2013年。https://doi.org/10.1007/978-1-4614-4693-4.
- 30。
Eastmond P.糖依赖性1编码粉底域三酰基甘油脂肪酶,在发芽中引发储存油崩溃拟南芥种子。植物细胞。2006; 18:665 - 75。https://doi.org/10.1105/tpc.105.040543.
- 31。
首先:种子发芽早。J Exp Bot. 2011; 62:3289-309。https://doi.org/10.1093/jxb/Err030.
- 32.
Quek WP, Yu W, Tao K, Fox GP, Gilbert RG。淀粉的结构-性质关系是大麦萌发时间的函数。Int J Biol Macromol. 2019; 136:1125-32。https://doi.org/10.1016/j.ijbiomac.2019.06.149..
- 33.
于宇,郭刚,吕东,胡颖,李军,闫燕。小麦品种吉麦20种子萌发过程中的转录组分析。BMC Plant Biol. 2014;14:20。https://doi.org/10.1186/1471-2229-14-20.
- 34.
赵米,张H,闫H,邱L,菠菜C.六种野草种子种子萌发过程中的淀粉,蛋白质和脂肪储备的动员和作用。前植物SCI 2018,9。https://doi.org/10.3389/fpls.2018.00234.
- 35。
不同贮藏条件下发芽大豆种子脂质和碳水化合物组成的变化。植物科学学报,2003,21(6):591 - 598。https://doi.org/10.3923/ajps.2007.502.507.
- 36。
Miransari M,Smith DL。植物激素和种子萌发。Environ Exp Bot。2014; 99:110-21。https://doi.org/10.1016/j.envexpbot.2013.11.005.
- 37。
刘波,张宁,文艳,金霞,杨静,司华,王东东。马铃薯块茎休眠释放过程中转录组的变化。生物科技J》。2015;198:17-30。https://doi.org/10.1016/j.jbiotec.2015.01.019.
- 38。
刘伟,常勇,陈世成,陆超,吴勇,陆明杰,陈东,施ac, Sheue C,黄辉。玉米胚叶在种子萌发过程中的解剖和转录动态。中国科学(d辑:地球科学),2013,40(10):3979-84。https://doi.org/10.1073/pnas.1301009110.
- 39.
杨P,李X,王X,陈H,陈F,沉S.稻米蛋白质组学分析(奥雅萨苜蓿)萌发过程中的种子。蛋白质组学。2007; 7(18):3358-68。https://doi.org/10.1002/PMIC.200700207..
- 40。
Gass N,Glagotskaia T,Mellema S,Stuurman J,Barone M,Mandel T,Roessner-Tunali U,Kuhlemeier C.丙酮酸脱羧酶在佩特尼亚提供了竞争优势的生长花粉管。植物细胞。2005; 17(8):2355-68。https://doi.org/10.1105/tpc.105.033290.
- 41.
关键词:紫娟茶,花青素,转录组,积累机制茶树var。Asssamica(大师)kitamura)叶子。植物生长调节。2017; 81(1):51-61。https://doi.org/10.1007/S10725-016-0183-X..
- 42.
张志刚,张志刚,张志刚,等。玉米颖果后熟和赤霉酸处理对ppp参与增加的响应燕麦属fatua.Can J Bot. 2011; 49:1833-40。https://doi.org/10.1139/B71-258.
- 43.
Sreenivasulu n,Usadel Bor,冬天A,Radchuk v,Scholz U,Stein N,Weschke W,Strickert M,Close TJ,Stitt M.大麦籽粒成熟和萌发:新的Mapman / Pageman突出的代谢途径和监管网络共同点和差异分析工具。植物理性。2008,146:1738-58。https://doi.org/10.1104/pp.107.111781.
- 44.
黄志强,王志强,王志强,等。种子萌发过程中初级代谢的激活与调控。中国种子科学(英文版)2014;24:1-15。https://doi.org/10.1017/S0960258513000391.
- 45.
潘东,王磊,陈胜,吕昕,吕胜,程超,谭飞,陈伟。蛋白质乙酰化对秋茄日常淹水的适应机制。树杂志。2018;38:895 - 910。https://doi.org/10.1093/treephys/tpx162.
- 46。
徐磊,王鹏,阿里波,杨宁,陈勇,吴芳,徐欣。发芽adlay种子中酚类化合物及抗氧化活性的变化。食品科学。2017;97(12):4227-34。https://doi.org/10.1002/jsfa.8298.
- 47。
郝t,丁xt,张hm,金hj,yu jz,zhu yl。不同葫芦作物在高根区温度应激中的生长和生理反应。植物Physiol J. 2014; 50:433-8。https://doi.org/10.13592/j.cnki.ppj.2013.0427.
- 48。
Wojtyla A,Lechowska K,Kubala S,Garnczarska M.种子萌发过程中的过氧化氢作用不同模式。前植物SCI 2016,7。https://doi.org/10.3389/fpls.2016.00066.
- 49。
黄烨,林C,李Z,关益,胡Q,胡锦涛通过参与植物激素相互作用,提高了甜玉米的种子萌发,H2O2和相关基因表达。BMC植物BIOL。2017; 17(1):1。https://doi.org/10.1186/s12870-016-0951-9..
- 50.
Ciacka K,Krasuska U,Otulak K,Gniazdowska A.冷分层的休眠去除增加了苹果种子中的谷胱甘肽和S-亚硝基葡萄牙含量。植物理性生物生物。2019,138。https://doi.org/10.1016/j.plaphy.2019.02.026.
- 51.
Worarad K,Suzuki T,Ishii K,Kozaki T,Iigo M,Yamane K.在装饰桃子中漂洗和冷却后种子休眠的转录组分析(Prunus Persica(l)蟠桃。BMC基因组学。2016;17:575。https://doi.org/10.1186/s12864-016-2973-y.
- 52。
Amooaghaie R. ROS,ABA和GA在休眠缓解之间的三角相互作用Bunium persicum通过冷分层种子。Russ J植物Physl。2017; 64:588-99。https://doi.org/10.1134/S1021443717040021..
- 53。
Marta B,Szafrańskak,Posmyk M.外源褪黑激素改善黄瓜种子的抗氧化防御(Cucumis巨大成功L.)在寒冷的压力下发芽。前植物SCI 2016,7。https://doi.org/10.3389/fpls.2016.00575.
- 54。
张W,风扇J,谭问,赵M,周T,曹f .外源性激素对生根的影响过程和关键酶的活动Malus hupehensis.茎扦插。Plos一个。2017; 12:E172320。https://doi.org/10.1371/journal.pone.0172320.
- 55。
黄人,庄k,吴PF,马XQ,莱XL,唐威姆。种子萌发和生长特征Cyclobalanopsis chungii..Chin J ECOL。2017; 5(36):1251-8。https://doi.org/10.13292/j.1000-4890.201705.031.
- 56.
唐q,ma x,莫c,威尔逊我,歌,赵h,杨y,富力,秋d。一种有效的寻找方法Siraitia Grosvenorii三萜生物合成基因的RNA-seq和数字基因表达分析。BMC基因组学。2011;12:343。https://doi.org/10.1186/1471-2164-12-343.
- 57.
Qu J,Shutu X,Tian X,Li T,Wang L,Zhong Y,Xue J,Guo D.比较转录组织揭示了玉米与不同直淀粉含量的早期胚乳发育的差异。peerj。2019; 7:E7528。https://doi.org/10.7717/PEERJ.7528.
- 58.
布拉德福德mm。利用蛋白质染料结合原理定量微克数量蛋白质的快速敏感方法。肛门生物化学。1976; 72(1):248-54。https://doi.org/10.1016/0003 - 2697 (76) 90527 - 3.
- 59。
霍奇斯DM,德隆JM,福尼CF,普朗奇RK。改进硫代巴比丘酸反应物质测定法,用于估算植物组织中含有花青素和其他干扰物的脂质过氧化。足底。1999;207(4):604 - 11所示。https://doi.org/10.1007/S004250050524..
- 60。
Lacan D,Baccou JC。高水平的抗氧化酶与无限肌肉蛋克罗尔水果中的延迟衰老相关。Planta 1998(204):377-82。https://doi.org/10.1007/S004250050269..
- 61。
Venisse J,Malnoy M,Faize M,Paulin J,Brisset M.防御反应的调制马吕斯SPP。在与Erwinia Amylovora相容和不相容的相互作用期间。莫尔植物微生物。2002,15(12):1204-12。https://doi.org/10.1094/mpmi.2002.15.12.1204.
- 62。
Cakmak I,Marschner H.镁缺乏和高光强度增强过超氧化物歧化酶,抗坏血酸过氧化物酶和豆瓣谷胱甘肽还原酶的活性。植物理性。1992; 98(4):1222-7。
- 63。
Grabherr Mg,Haas BJ,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q.镁缺乏和高光强度增强过超氧化物歧化酶,抗坏血酸过氧化物酶和谷胱甘肽还原酶在豆类中的谷胱甘肽树叶。植物理性。1992; 98(4):1222-7。
- 64。
Kanehisa M,Goto S. Kegg:Kyoto Encyclopedia基因和基因组。核酸RES。2000; 28(1):27-30。https://doi.org/10.1093/nar/28.1.27.
- 65.
Blast2GO:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学。2005;21:3674-6。https://doi.org/10.1093/bioinformatics/bti610.
- 66.
贾y,林F,郑香港,张义,陈继,张祖,静脉,李斯特,李雷克,Lars B等。Wego:用于绘制GO注释的Web工具。核酸RES。2006; 34(Web服务器问题):W293-7。https://doi.org/10.1093/nar/gkl031.
- 67.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12(1):323。https://doi.org/10.1186/1471-2105-12-323.
- 68.
控制错误发现率——一种实用而强大的多重测试方法。J Royal Statist Soc Series B. 1995; 57:289-300。https://doi.org/10.2307/2346101.
- 69.
Schwacke R, Ponce-Soto GY, Krause K, Bolger AM, Arsova B, Hallab A, Gruden K, Stitt M, Bolger ME, Usadel B. Mapman4:一种适用于多组数据分析的精细蛋白质分类和注释框架。摩尔。2019;12(6):879 - 92。https://doi.org/10.1016/j.molp.2019.01.003.
- 70。
棕色P,Botstein D,eisen BM,Spellman P.集群分析与基因组表达式的展示。Proc Natl Acad Sci U S A. 1998; 95:12930-3。https://doi.org/10.1073/pnas.96.19.10943-C..
- 71.
引用本文:王志强,王志强,王志强,等。生物信息学。2011;27(22):3209 - 10。https://doi.org/10.1093/bioinformatics/btr490.
- 72.
Saldanha AJ。Java TreeView-微阵列数据的可扩展可视化。生物信息学。2004; 20(17):3246-8。https://doi.org/10.1093/bioinformatics/bth349.
- 73.
Schmittgen T,Livak K.通过比较分析实时PCR数据CT方法。NAT PROTOC。2008; 3:1101-8。https://doi.org/10.1038/nprot.2008.73.
致谢
我们感谢所有作者对这项研究的贡献。我们要感谢Editage对英语的修改。
资金
本研究得到了贵州科技计划的支持“源筛查和腐败苗育种技术Cinnamomum migao.“(Qiankehe支持[2019] 2774)。融资组织为研究项目提供了财政支持,但没有参与研究的设计,数据收集,数据分析或写作稿件的设计。
作者信息
从属关系
贡献
X.L.H.,T.T.和J.M.L.构思和设计实验;X.L.H.,J.Z.C.,D.W.和B.L.T.收集样品并进行了现场调查;X.L.H.,J.Z.C.和T.T.执行了实验;X.L.H.和t.t.分析了数据并写了稿件;J.M.L.提供编辑建议。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
实验没有使用转基因技术。本研究中使用的种子样品来自野生植物,并通过机构和立法获取根据并批准的实验材料。它不需要特定许可。
同意出版物
不适用。
CMPETING兴趣
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1
图S1GO分类中差异表达基因的连续比较系统Cinnamomum.米高种子发芽。Theabscissa表示注释中基因数的功能分类和纵坐标。
附加文件2
图S2Kegg富集CCS比较组中的DEGSCinnamomum migao.种子发芽。
附加文件3.
图S3不同萌发阶段脂质代谢途径相关差异表达基因的聚类分析Cinnamomum migao.种子,B.与甘油代谢途径相关的差异表达基因的聚类分析。C.差异表达基因与脂肪酸降解途径的聚类分析。
附加文件4.
图S4差异表达基因相关的颗粒分析与淀粉和蔗糖代谢途径相关的四种萌发阶段Cinnamomum migao.种子。
附加文件5.
图S5在四个萌发阶段中聚类与氧化磷酸化途径相关的多样化基因Cinnamomum.米高种子。
附加文件6.
表S1统计不同发芽期的测序数据Cinnamomum migao.种子。a.过滤前读取数,b.过滤后高质量读取数,c.过滤干净数据库,d.过滤后高质量干净数据库。
附加文件7.
表S2路径网的源路径和目标路径Cinnamomumumigao.种子发芽。程度意味着单鳃杆与其他途径的关系的数量,程度的值代表其关联。Indemege是目标途径,狼人是源路径。
附加文件8.
表S3用于QRT-PCR的预料序列。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
黄,X.,Tian,T.,Chen,J.等等。转录组分析Cinnamomum migao.西南药用植物种子萌发。BMC植物杂志21,270(2021)。https://doi.org/10.1186/s12870-021-03020-021-03020-7
收到了:
接受:
发表:
关键词
- 种子萌发
- 转录组
- 材料代谢
- 代谢网络