抽象的
背景
花生黑穗病是一种由真菌引起的疾病Thecaphora freziiCarranza & Lindquist在南美洲的大多数商业品种是高度敏感的。它是导致产量严重下降的原因,而且至今没有有效的化学处理方法。然而,在野生环境中已经发现了对黑穗病的抗性arachis.物种并进一步转移到花生精英品种。为了鉴定赋予四倍体遗传背景内的污染抗性的基因组区域,这项研究评估了群体{易感落花生hypogaea无性系种群。hypogaea(JS17304-7-B) × 抗性合成双二倍体(JS1806)[答:correntina(k 11905)× A.卡德纳西(KSSc 36015)]×答:batizocoi9484 (K)4×}隔离特性。
结果
利用1819个标记构建了花生20条染色体21个连锁群的单核苷酸多态性遗传图谱,遗传距离为2531.81 厘米。鉴定出两个一致的数量性状位点qSmIA08型和qSmIA02 / B02,位于染色体A08和A02 / B02上。QTL.qSmIA08型在15.20cm / 5.03 mbp中,占表型方差的17.53%,而qSmIA02 / B02在4.0cm / 3.56 mbp下解释了9.06%的表型方差。QTL的合并基因型效应将黑烟入射率降低57%,并在3年的评估中稳定。含有QTL的基因组区域富含编码植物防御的蛋白质的基因,为花生粉碎抗性的遗传建筑提供新的见解。
结论
本研究鉴定了一个主效QTL和一个小效QTL,为花生抗黑穗病遗传结构研究提供了新的思路,为选育抗黑穗病新品种提供了参考。
背景
栽培花生(花生L.)是源于南美洲的重要同种异体四倍体(AABB)[1那2那3.].这种豆类作物在100多个国家种植,全球产量为47.10亿吨[4.].它是一种富含油脂、蛋白质、维生素和其他微量元素的行作物[5.],在全球范围内消耗坚果,糖果,花生酱油。在过去的十年中,花生制作和工业化在阿根廷受到威胁,通过新的土壤疾病,花生粉碎,由此引起的Thecaphora frezii.这种病引起荚果组织肥大,用冬孢子定植的种子呈黑斑块状外观[6.那7.那8.]. 商业地块病害发生率高达52%,产量损失高达35%[9.那10].文化管理策略和化学治疗尚未有效,目前阿根廷花生生产面积患病的患病率达到了100%[11].
真菌T. Frezii.最初是在野外描述的答:kuhlmaniiKrapov。& 厕所。格雷戈里[12源自巴西马托格罗索州的阿基达瓦纳[13],以及最近在玻利维亚的其他野生物种中发现的,如A. Kempff-MercadoiKrapov。那W.C. Greg. & C.E. Simpson [14].真菌的初始分类是基于疾病症状和焦子孢子形态的形态,最近使用诸如28s rdNA序列的分子工具进行证实[15]其促滤序序列[16].由于玻利维亚,巴西和阿根廷收集的野生物种的种子被送到世界的主要种质岸边,花生·斯特队对世界各地的花生产业构成威胁。
而中度结果与高剂量的杀菌剂T. Frezii.最近有报道[17],发展抗黑穗病品种似乎是在花生生产中控制黑穗病最有效、可持续和环境友好的方法。在一些老花生地方品种和野生近缘中发现的抗黑穗病的天然来源可用于提高花生在高病势下的表现[18].抗黑穗病基因在优良花生系中的渗透及地方品种的预选育材料[19那20.]和野生arachis.物种(21最近被我们的研究小组报道了。在布雷萨诺等人[19],重组自交系(RILs)涉及3个感病花生优良品种(花生属植物.hypogaea)还有两个地方品种(花生属植物.快餐沃尔德隆)。在de blas等人。[21[], RIL群体由一个合成双二倍体(AAKK)与一个敏感试验品系的杂交衍生而来A. hypogaea..两项研究均显示该性状具有显著的表型变异和较高的广义遗传力,表明其抗黑穗病能力受少数主要遗传位点控制。然而,该性状的遗传结构尚不清楚,数量性状位点(qtl)尚未确定。
对于遗传结构未知的性状,常规抗病新品种的选育面临着巨大的挑战[22].在这种情况下,必须鉴定QTL和链接标志物,用于粉碎抗性,这可以部署在基因组学辅助育种(GAB)中以加速育种过程[23那24].分子育种已经证明其强度加速改善了包括疾病性抗性特征的花生靶性状的改善[24].公共数据库中参考基因组的可用性(https://peanutbase.org)花生[2及其二倍体前体[25那26[增强序列分析,注释,候选基因发现和标记发育的潜力。此外,重组自交系的群体是用于产生多年表型数据的有价值的工具,以阐明对目标性状的环境影响。
在这项研究中,F七章ril映射群体来自于之间的交叉A. hypogaea.和合成的amphidiploid [(答:correntina×A.卡德纳西)× 答:batizocoi]4×[21]用于1)鉴定四倍体遗传背景中具有黑穗病抗性的基因组区域;2)了解该性状的遗传结构。通过遗传图谱的构建和QTL分析,可以检测到两个从野生中渐渗的基因组区域arachis.四倍体背景的种,主要控制花生黑穗病。这两个qtl的基因组位置都富含与植物防御有关的蛋白质编码基因,为理解花生抗黑穗病遗传结构提供了新的见解。
结果
黑烟抗性的表型变化
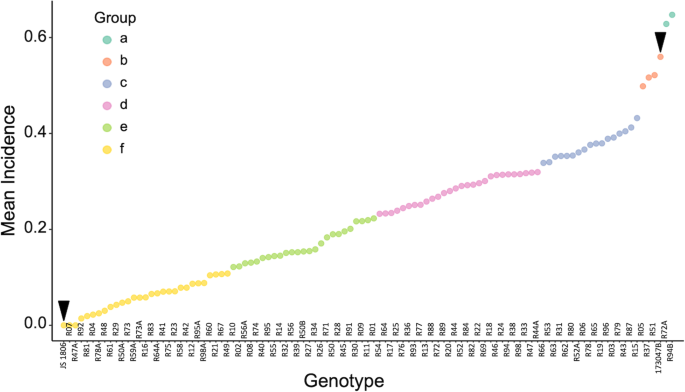
F区疾病发病率七章RIL人口显示出统计上显着的差异(P. < 0.01) between years, with average incidence of 0.17, 0.23, and 0.27 for 2016, 2017, and 2018, respectively. The genetic variance component was larger than the genotype × year interaction [56.2% (P.< 0.01) vs. 5.2% (P.= 0.0017)的发生率]。尽管各年份在统计上有显著差异,但线间的相对发生率值保持不变。感病亲本的平均发病率为56%,而双二倍体的平均发病率为0%。Scott和Knott检验的两两均数比较将RILs分为六组(图1)。1). 由29条线组成的簇具有关联值< 0.11,与二倍体和野生种(抗性对照系)无显著差异。这些线的平均发病率为0.06,范围在0.00到0.11之间。在抗性品系组中,有6株(R04、R07、R47A、R78A、R81、R92)表现为高抗性,平均发病率为1.5%< 0.01. 在图的另一端,三条线表示关联分数 > 0.5,与感病亲本JS173047-B无显著差异。两个品系(94B和72A)出现超亲分离现象,发生率显著高于感病亲本,占后代的1.9%。广义遗传力(H2)统计学意义,综合征0.95。
基因分型,遗传映射和单标分析
103个ril、亲本和二倍体祖细胞的基因分型 K'Axiom_Arachis2'单核苷酸多态性阵列共检索到7496个多态性单核苷酸多态性标记(15.62%),其中3662个属于a亚基因组,3834个属于B/K亚基因组。对二倍体的二倍体祖先发现了不同数量的种特异性标记:99个单核苷酸多态性答:correntina(一个基因组),98岁A.卡德纳西(一个基因组),1139答:batizocoi(K基因组)。此外,总共3456个SNPS标记特定于A. hypogaea.,1268 A-SubGenome和2158 B-亚基组特异性标记(E值<1E-20)。除了209个SNP之外,大多数SNP被遗传为二种性偏析,除了209个SNP,呈现了基因型图显示的基因型图展示更加兼容,与TETRASOMIC继承相兼容。27].五十六个标记显示分离扭曲P. < 0.001. They were distributed in few discrete clusters on linkage groups (LGs) A04, A05, A07, B03, and B04 (Additional file1).这些簇被认为是分离变形区域(SDR),因为至少四个偏移标记物彼此聚集在一起LG。
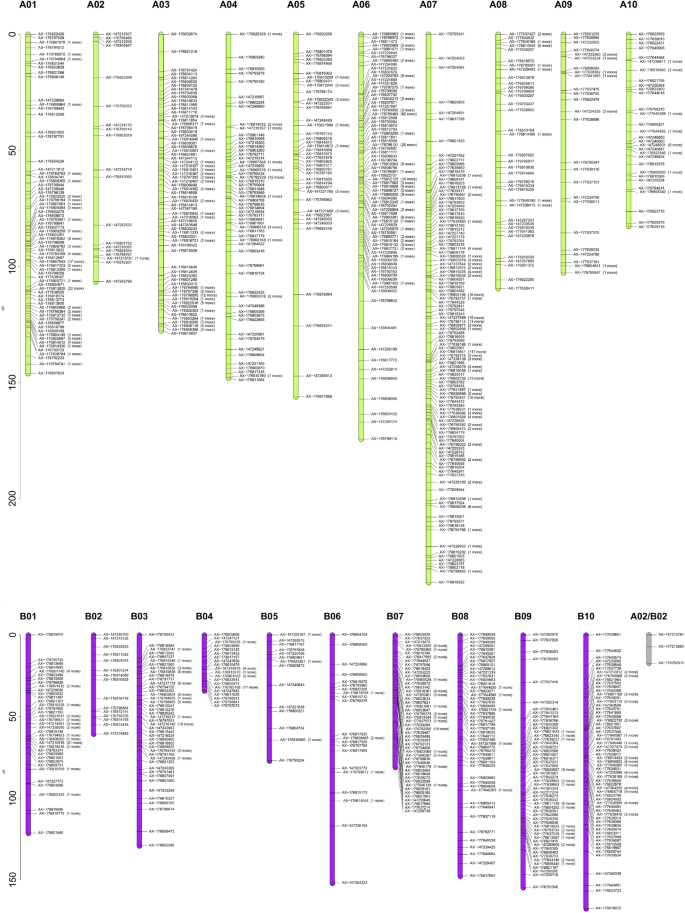
该连锁图谱分两步构建。首先,利用918帧标记,经过非畸变和非共定位标记过滤后选择,并利用。第二步,在不改变标记原始顺序和标记映射距离的前提下,强制889个共定位和扭曲标记(分离比高达4:1)整合到连锁群中。利用BLASTn工具根据参考序列确定a -基因组和b -基因组标记的物理位置A. hypogaea.简历。Tifrunner [2](https://peanutbase.org).该连锁图谱由分配在20条花生染色体上的1819个SNP标记组成。所测SNP标记的遗传距离为2531.81 cM1; 图。2). 连锁图谱分为21个LG,其中20个LG被分配到一个特定的亚基因组(a或B)和一个短LG,属于同源组2,作为一个独立片段保留,没有分配到a或B亚基因组。该片段被命名为LG A02/B02,保留为图谱的一部分,因为它包含两个与花生黑穗病发病率显著相关的snp。LGs的大小从17.28 厘米(长A02/B02)至236.22 厘米(LG A07)。相邻标记间的平均距离为1.41 cM,范围为0.66 cM(LG A07)至6.08 厘米(LG B06)。每个连锁群的标记数目在15(LG B02)到357(LG A07)之间。连锁群的名称是根据SNPs对基于序列的假性分子的分配来分配的(https://peanutbase.org).唯一的例外是LG A02 / B02,具有3个SNP和17.29厘米,无法分配给特定的亚基组。因此,QTL使用两个基因组名称命名。
构建了103个RIL群体的遗传连锁图谱A. hypogaea.JS17304-7-B ×合成双二倍体JS1806。右侧为21个连锁群的1819个SNP标记,括号中为共定位标记的数量。每个标记用由48k ' Axiom_Arachis2 ' SNP阵列提供的探针名称表示[28]. A-亚基因组LGs用绿色表示,B-亚基因组LGs用紫色表示,没有基因组分配的LG用灰色表示。y轴上的条表示遗传距离,单位为cM
对花生黑穗病发病率相关的SNPs进行单标记分析后,发现236个SNPs具有统计学意义(P <0.01)在LGS A01,A03,A07,A08,A02 / B02,B02,B03和B09中(附加文件2).
评估遗传图谱
定位在遗传图中的标记显示出相对强烈的共同性,并通过Bertioli等人报道的物理位置。[2]对于四倍体A. hypogaea.简历。Tifrunner参考基因组(https://peanutbase.org).共有1819个基因座锚定A. hypogaea.位点间的平均物理距离为1.39 Mbp,总物理距离为2527.56 Mbp。平均重组率为3.59 cM/Mbp,最高为17.16 cM/Mbp (A07)。LGs A10、B03、B04、B05和B06的重组率最低,分别为0.21、0.9、0.14、0.84、0.01 cM/Mbp。在大多数情况下,位点沿染色体均匀分布,但在另一些情况下,分析显示染色体臂远端标记密度较高,重组率增加,而在着丝粒周围区域标记密度较低,重组频率较低。大部分连接基团与伪分子具有良好的一致性。唯一的例外是位于染色体A05的一段(76-88 cM)的一组标记,它们相对于连锁群(附加文件中的A05)中的其他标记呈弧形3.).这一弧线是由于标记相对于物理地图的相反方向而形成的(附加文件3.),证明了一种倒置。标记成对重组分数与LOD分数(附加文件4.)反映了每对标记之间的强连锁关系,除了在LGs A03/B03和LGs A04/B04之间紧密相关的标记。
花生黑穗病抗性QTL研究
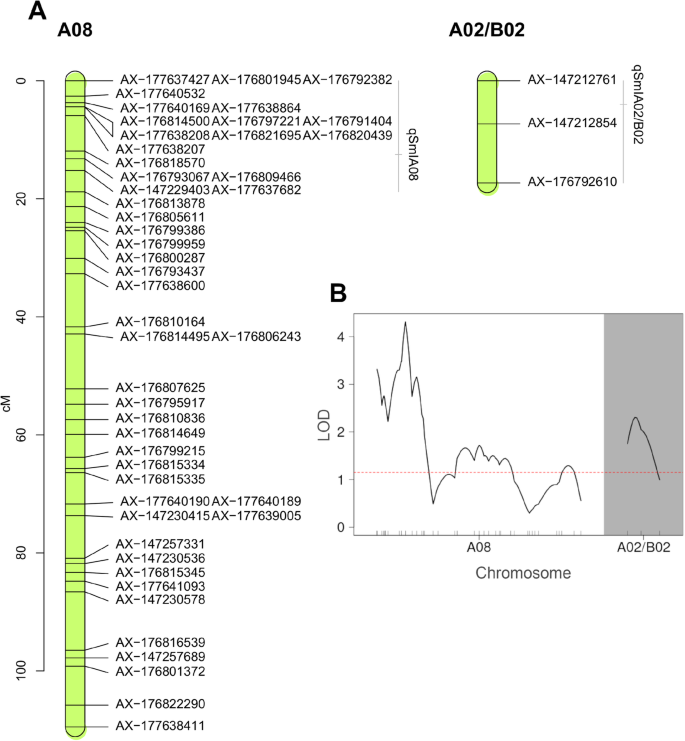
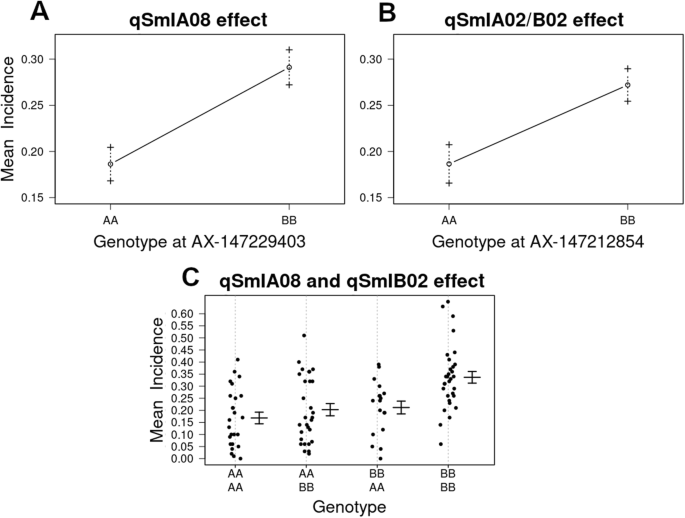
QTL分析鉴定了与染色体A01,A07,B02,B03和B09上的粉状疾病发病率相关的SNP,在3年的疾病评估中的至少两个中有显着的LOD分数。然而,只有两个染色体区域(A08,A02 / B02)与在现场评估的3年的发病率显着相关(附加文件5.;附加文件6.).QTL的近似物理位置由最近的遗传标记定义。QTL.qSmIA08型15.20 cM (AX-147229403, 5.03 Mbp) (MAF = 0.5),qSmIA02 / B02从LG A02 / B02的开头(AX-147212854,3.56MBp)(MAF = 0.48),在四厘米处被发现。两个QTL都显示出在经验阈值之上的LOD分数P.-value = 0.01(表2; 图。3.).带有事后TukeyHSD测试和Bonferroni修正的单向方差分析(P. = 在AX-147229403和AX-147212854位点,不同基因型花生黑粉病发生率差异有统计学意义(p0.05)。单倍型分析表明这些标记位置的qtl是独立的。对与花生抗黑穗病qtl紧密连锁的标记的表型效应分析表明,大多数(86%)具有双二倍体等位基因的ril表现出最低的表型平均分,而所有携带双二倍体等位基因的ril表现出最低的表型平均分A. hypogaea.等位基因的发生率显著高于其他基因。单个qtl和两个qtl合并后的发病率在统计学上的显著降低如图所示。4..各QTL检测到的加性效应值(表2)表明,这些基因组段有助于将花生粉末分别减少40.87和32.07%。评估的两个QTL的分析表明,当RILS携带来自amphidiploid的两种等位基因时(即,qSmIA08型AA和qSmIA02 / B02AA)疾病发病率降低(56.15%,P.< 0.001)(图4.、表3.).此外,统计上的显著差异(P. < 0.05) were observed between phenotypes carrying the allele AA atqSmIA08型和bb at.qSmIA02 / B02,反之亦然。
花生抗黑穗病候选基因的鉴定
这两个qtl均位于水稻抗病和防御应答基因的热点区域内答:hypogaea简历。Tifrunner参考基因组(https://peanutbase.org).在qSmIA08型,七个基因模型在抗病方面具有潜在的功能。这些基因包括核苷酸结合位点富亮氨酸重复序列(NBS-LRR)基因、NAM(无根尖分生组织)、ATAF1、ATAF2和CUC2 (NAC)转录因子以及三个抗霉位点(MLO)基因(附加文件)7.).在qSmIA02 / B02共有31个基因在B基因组中被注释,其中包括6个抗病蛋白(TIR-NBS-LRR类)、23个LRR/NB-ARC结构域抗病蛋白和2个未被鉴定的抗病蛋白基因。区域qSmIA02 / B02在A基因组中检索到7个注释基因,包括两个LRR和NB-ARC结构域抗病蛋白和5个抗病蛋白基因模型(附加文件7.).
讨论
栽培花生的野生近缘已被证明是对多种害虫和病原体的抗性来源[29,包括新的土传疾病,花生黑穗病[18].在先前的工作中,我们报告了在A和K基因组的野生物种中存在的抗性的成功转移到栽培花生的精英线[21].在该报告中,它也被证明是高度遗传的抗性,并提出它可能是由少数基因组区域控制。然而,抗性的性质和遗传结构是未知的。在这里,我们使用先进的世代(F七章)De Blas等人报告的RIL人口。[21],分析赋予四倍体背景中耐药性的基因组区域。这项工作的目的是提供一种了解造型框架,了解抗遮挡抗性的遗传结构和未来的标记的发展,以帮助选择持续的花生育种计划中的抗性材料。通过开发高密度SNPS遗传图谱和在RIL群体上测量的表型数据,我们能够检测一个主要的QTL和次要QTL,用于花生粉碎抗性,其中一个在LG A02 / B02上,具有标记狭窄的标记来自父母的父母。
黑穗病抗性评价
本研究的表型评价结果证实了我们之前的研究结果,即不同ril在极高接种压力下生长时对黑穗病具有较高的抗稳定性[21].从野生二倍体中有效渗透抗性arachis.物种(2N = 2.X= 20)进入四倍体环境(2N = 4.X= 40)的RILs的发病率明显低于栽培亲本(87%)。这一数值甚至高于之前在前几代评估的同一群体中数量较少的ril的报告[21].抵抗力的高遗传性证明了特性的大型遗传组分。这种人群适合该特征的遗传解剖,作为了解花生粉碎抗性在商业品种推进中具有抗性疾病的遗传造型的遗传建筑。
基因分型和遗传映射
103 rils的基因分型检索了A和B / K子瘤的相同比例的多态性SNP标记,因为它预计48K'Axiom_arachis2'SNP阵列中的表示[27那30.].对于双二倍体的二倍体前体所观察到的物种特异性标记数量的差异,可以在每个野生物种基因组彼此之间以及与栽培花生亚基因组之间的相似性程度的背景下进行解释。即检测到少量的种特异性标记(99个特异性SNPs)答:correntina第98页A.卡德纳西)这可能是因为二倍体A基因组物种之间以及与栽培花生A亚基因组之间具有高度的序列相似性[30.].相比之下,被检测到的物种特异性标记数量是之前的10倍(1139)答:batizocoi(K基因组)比在A基因组野生物种中检测到的低,这可以解释为K基因组与其他基因组的相似性较低。K基因组,虽然更类似于B基因组物种(和栽培花生的B亚基因组)而不是A基因组物种[31],其与花生b亚基因组的序列相似性低于报道的野生物种a基因组与花生a亚基因组的序列相似性。此外,虽然报道了B和K基因组的重组[32]在三种间隙BK杂种中观察到的平均二价的数目明显减少了[33]. 在这种情况下,尽管B-K重组率可能较低,但通过重组引入B基因组的K基因组中的更多标记可被检测为物种特异性标记,而不是A基因组物种引入的标记。这一理由还得到以下事实的支持:从总共3456A. hypogaea.特异性标记物,1268个标记在A-SubGenome(具有E值<1E-20)上击中2158位(E值<1E-20)。大多数SNP标记被遗传到原始偏析的预期,但是以与同源重组和四元族遗传相容的基因型模式观察到其他(2.8%)[27那34].在RIL群体中观察到的百分比与之前报告的类似类型和尺寸的百分比相似[34];其发生是在花生是一系列分段allopolyploid的提案下解释了[34].另一个较高比例的标记(主要集中在lgg A04、A05、A07、B03和B04上)表现出扭曲的分离和偏倚A. hypogaea..这种扭曲的分离揭示了对Amphidiploid等位基因的强烈选择。有趣的是,在五种不同的染色体上确定了6种这些标记的簇,表明存在隔离变形区域(SDR)。SDR已被证明存在于植物中的特异性或宽十字路口中[35那36那37]其特点是含有配子体竞争的遗传选择因子[38].在人口中(特别提款权范围内),所有与导致隔离扭曲和隔离的基因密切相关的基因或标记也将倾向于表现出扭曲的比率[39那40,这可能会显著影响植物育种的成功。虽然本研究中检测到的qtl均不在SDR范围内,但仍需进一步研究arachis.更好地定义分离失真的方向和比率,以及在特别考虑范围内起作用的遗传因素。
在arachis.如在其他植物遗传系统中,偏析畸变的分子机制仍然不清楚,并且显示偏析变形的标记通常被丢弃用于地图结构[41那42].然而,不同的研究表明,具有隔离失真的标记可以增加地图上的标记的密度,增加地图的基因组覆盖,并有助于改进QTL的检测[38那43那44那45].这些报道表明,扭曲标记可用于QTL定位,且对结果无不良影响,如果使用得当,可以获得较好的QTL定位效果,其遗传方差相对较高。此外,这些报告中使用扭曲标记有助于提高QTL的检测,对QTL分析的位置或效应估计没有显著影响[44].在这项工作中,我们通过添加889个扭曲(最多4:1)或共同定位的标记来增加地图的密度。这种添加没有改变lgg的大小和标记的位置,也不影响QTL的检测。结果表明,该图谱共扩增了1819个位点,覆盖面积达2531.81 cM,在前人为其他居群构建的图谱的密度和基因组覆盖范围内arachis.[35那46那47那48].在大多数情况下,SNP的遗传位置与假散毛上的物理位置有助于一致A. hypogaea.简历。Tifrunner基因组(2那28].LGs A02和B02的构建是一个挑战,因为当使用整组SNP标记作为输入数据时,它们非常不稳定。对SNP数据进行分组后,这些lgg均得到了改善答:duranensis(Aradu.A02)和答:ipaensis(Araip.B02)染色体28].这种方法增强了映射标记的分布和数量。LG A02/B02作为图谱的一部分被保留,因为它拥有两个显著相关的SNPs (P. < 0.01)回归到性状。虽然LG A02/B02可以被分配到同源组2,但是基因组分配是不可能的。首先,这个短片段不能链接到LG A02或LG B02[即使使用较低的P.-value (1e-4 ~ 1e-6),确定属于同一连锁组的标记];其次,3个SNPs中只有一个先前被映射到arahy上。28];第三,LG A02/B02的其他两个SNPs在参考序列上显示模糊命中A. hypogaea.简历。Tifrunner [2](https://peanutbase.org).LGs A03/B03与A04/B04之间的紧密关联可以通过四体基因组区域内的同源重组来解释,特别是在染色体A03/B03的远端[2].联系地图与之一致A. hypogaea.pseudomolecules [2],并且如之前报道的那样,仅在A5染色体上出现了一个大的倒置[25那49].与其在四倍体基因组中的物理位置相比,标记分布在基因组上,并且该覆盖率适用于QT1鉴定。
花生黑穗病抗性QTL研究
作为本研究的主要目的,在四倍体上下文中解剖到从二倍体野生物种中引入精英花生线的花生稀检的遗传建筑。控制花生粉碎抗性的两个基因组区域解释了17.52%(qSmIA08型)及9.06% (qSmIA02 / B02)的特征方差。虽然qSmIA02 / B02显示PVE低于10%,这被认为是QTL [50时,花生对黑穗病的抗性差异不显著qSmIA08型AA在AX-147229403和qSmIA02 / B02AX-147212854是BB,反之亦然。结果表明,这些QTL是水稻抗病性的主要遗传基础,每个QTL检测到的加性效应也证实了这一点。结果表明,2个qtl均与双二倍体亲本的qtl存在统计学差异,发病率下降57%,且在3年的评估中保持稳定。表型分析表明,该抗黑穗病基因已成功从双二倍体转入优质花生系。内标记AX-147229403qSmIA08型从野生二倍体A基因组物种之一渐渗。然而,由于该标记不是种特异性的,因此不可能确定野生染色体片段是否来自渐渗答:correntina或A.卡德纳西.标记AX-147212854内qSmIA02 / B02间期也从一个用来发展双二倍体的野生种中渗入,但是这种抗性的来源还不能确定。首先,由于SNP等位基因不具有基因组特异性;其次,由于三个野生物种的SNP侧翼序列高度相似,无论是A基因组还是K基因组。最后,将该单核苷酸多态性分配到B基因组答:ipaensis在数组的第一个版本中27],但到了一个基因组答:duranensis在48 k'Axiom_arachis2'SNP阵列的第二版本中[28].此外,qSmIA02 / B02被定位到基因组中显示四体重组的区域[27].在Arahy染色体远端A和B基因组之间的明确遗传交换。12由Bertioli等人(2019)报道。因此,同源重组可能增加了从野生物种中追踪抗性等位基因的不确定性。毫无疑问,需要更多的标记来确定野生的抗性来源。本研究的结果进一步证实了我们之前的研究结果,即优良花生系对黑穗病的抗性来自野生二倍体品种[21].
QTL位置的精度可能受到人口大小和遗传性的影响[51],受标记间距的影响较小,除了标记间距不规则的稀疏地图。在我们的研究中,虽然群体大小是次优的,但遗传力较高。两个QTL在单倍型和SNP位点上的独立性增加了对检测到的QTL精度的信心。
虽然在本研究中考虑了跨越3年的评估的稳定性QTL,但在LG B09(9.35MBp - 10.97 MBP)中发现的具有重要关联的区域进一步关注染色体Arahy.19上的457 kB块.19一种与抗花生粉碎的潜在区域[20.].多种遗传抗性来源的存在,对培育更持久的抗黑穗病品种具有重要意义。
本研究中检测到的QTL的物理位置是与不同抗病抗性相关的QTL尤其丰富的区域。用于花生抗病的几个QTL,QSMIA08间隔(1.23 MBP - 6.04 MBP)识别或重叠,包括TSWV和ELS [30.那52,和qSmIA02 / B02间隔(3.43-4.29 MBP),包括TSWV,ELS和LLS [30.那52].野生渐渗染色体片段进入四倍体环境的其他性状的贡献关系有待于未来的研究。
花生抗黑穗病候选基因的鉴定
基于Clevenger等人的转录物密度。[53]表示阻力基因模型(R-Genes)内qSmIA08型和qSmIA02 / B02间隔在生殖组织(除外)中表达A. hypogaea.简历。主要在花瓣和果板1物候期[53].这是相关的,因为它被证明感染了T. Frezii.在锁定期间开始[8.],即雌蕊柄进入土壤的过程。这些结果支持了在qtl置信区间内发现的r基因簇是参与花生黑穗病抗性的主要候选基因的假说。
花生抗黑穗病的机制目前尚不清楚。然而,本研究在QTLs区间内发现的候选基因提示了一些需要进一步研究的途径。尽管如此,每个QTL的一个基因可能会产生抗性[54]的研究表明,控制植物抗病性的基因经常在基因组中聚类,这些R基因大多编码核苷酸结合位点(NBS)和富亮氨酸重复序列(LRR)结构域。在花生和其他作物中,抗病热点(r基因簇)已被报道为抗多种疾病[25那55那56].在这里,我们鉴定了QTLS间隔内的NBS-LRR和TIR-NBS-LRR类基因,特别是对抗遮挡抗性的进一步调查特别感兴趣,因为它们参与植物防御响应[57那58那59].
结论
因此,我们构建了一个新的RIL群体的遗传连锁图谱,为花生抗黑穗病性状的遗传解剖提供了可能。一个效应大的QTL和一个效应小的QTL均来自野生二倍体arachis.物种代表着不同的抗性来源,这对培育具有空间和时间稳定性的品种具有重要意义。两个qtl都位于含有多个r基因的抗病热点地区(https://peanutbase.org),这些基因在果实发育的第一个阶段,即黑穗病发生时表现出高转录水平,这对正在进行的了解黑穗病抗性机制的研究构成了重大进展。本研究检测到的主效qtl和小效qtl为该性状的遗传结构研究提供了新的思路,为该性状的精细定位、基因鉴定和基因组学辅助育种开发可靠的标记提供了有价值的工具。
方法
植物材料
这项研究使用了先进的一代(F七章), de Blas等人报告的103例RIL人群。[21].它们来自易感高油酸之间的交叉A. hypogaea.实验优良系JS17304-7-B(雌性),以下称栽培亲本;合成双二倍体JS1806(雄性),以下称双二倍体[21].双二倍体的野生祖先是A.卡德纳西Krapov。& 厕所。格雷格(KSSC 36,015),答:correntina(伯克特)克拉波夫W.C.Greg(K 11905)和答:batizocoiKrapov。& W.C. Greg (k9484)属于A和K基因组[60.那61.].
本研究中使用的野生二倍体植物的种子来自于阿根廷国家农业研究所Tecnología, Estación Experimental Agropecuaria (INTA) Manfredi, Córdoba。原始藏品的标本保存在阿根廷科连特斯(CTES) Botánica del Nordeste研究所植物标本室。所有野生材料均为1958 - 1977年阿根廷和玻利维亚在《生物多样性公约》(CBD 1992)生效前收集的。https://treaties.un.org),并存入国内和国际种子银行。种子的A. hypogaea.实验精英线JS17304-7-B和Amphidiploid JS1806由Criaddero El Carmen S.A(Peanut托儿所位于Cabrera,Córdoba,阿根廷的花生苗圃提供)提供。所有现场测定均按照本地立法(第9164号法令第9164号法令132/05)进行。
黑穗病抗性评价
如前所述评估了污渍抗性[21].简单地说,我们在永久小区中评估了用于双倍体发育的3个二倍体物种,而每年种植的是四倍体亲本(双倍体和栽培)和103个ril。单行、2.5 m长(25株)的田块采用完全随机区组设计,3个重复T. Frezii.侵染的土壤,平均为1.6×104.冬孢子g−1(是耕地最高记录值的3.5倍)。如de Blas等人所述,施用于土壤的接种物是从整个花生产区收集的冬孢子池[21].所有实验均在阿根廷科克拉(Cacrera)General Cabrera的Criaddo El Carmen Nursery(32°49'40.8“S 63°52'14.0”W)在2016到2018年。由Smut造成的Pod损坏被评分为100的样本每个情节的豆荚。将空白发病率(入射)计算为患者对样本中豆荚总数的影响[21].
统计分析
使用Shapiro-Wilk的方法完成了表型数据的正常试验。为了在每年的103个rils和控制中测试全球发病差异,非参数kruskal-wallis单向分析的差异分析为5%的意义(P. < 0.05) using the “Stats” R package [62.].采用Box-Cox误差项正态分布(平方根)的一般线性模型对103个RILs的完整表型数据集进行发病率分析。一般线性模型以基因型、年份和基因型×年份作为固定效应。方差成分分析是通过拟合线性混合模型从lme4 R包[63.].使用Scott和Knott程序进行比较转换的发病率值(α= 0.05) (64.]在“Scottknott”R包中实现了[65.].广义遗传力的估计公式为:
哪里\({\sigma}\u g^2\)是rils中的遗传方差分量,\({\ sigma} _ {g \ times e} ^ 2 \)是RIL吗 × 环境相互作用方差分量,以及\({\σ}_e ^ 2 \)是剩余分量,N是年数和R.是复制数[66.].
以SNP标记为自变量,发病率为因变量,进行简单线性回归,对抗病性与SNP标记之间的相关性进行先验分析。那些带R的snp2P. < 0.05 were considered as significantly associated to the trait. A one-way ANOVA with a post-hoc TukeyHSD test and Bonferroni’s correction (P.= 0.05),在检测到的qtl峰值SNP标记位置,检测不同基因型组间的花生黑穗病发病率差异有统计学意义。
基因分型
根据制造商说明,使用DNeasy PowerPlant Pro Kit (Qiagen, Germantown, MD)从所有基因型的幼叶和种子中提取总基因组DNA。用DeNovix DS-11 FX+分光光度计/荧光计(DeNovix Inc., Wilmington, DE)对DNA进行定量,并用48 K ' Axiom_Arachis2 ' SNP阵列对样本进行基因分型[28].采用Axiom Analysis Suite 5.0.1.38软件(https://www.thermofisher.com).为了分析和筛选输出,使用了自定义Unix脚本(附加文件8.).首先,使用二倍体和伸展剂的面板从SNP呼叫中提取基因分型测定结果。过滤该组标记以显示特异于三个父母种类和Amphidiploid特异的SNP标记,如下:
•答:correntina/ amphidiploid-specific标记:答:correntina = 双二倍体≠ (A.卡德纳西=答:batizocoi).
•A.卡德纳西/ amphidiploid-specific标记:A.卡德纳西 = 双二倍体≠ (答:correntina=答:batizocoi).
•答:batizocoi/ amphidiploid-specific标记:答:batizocoi = 双二倍体≠ (答:correntina=A.卡德纳西).
其次,将第一步发现的3组信息丰富的SNP标记与构建的四倍体基因型(栽培亲本、双二倍体和103个RIL群体)的板进行比对,只保留与栽培亲本、双二倍体之间存在差异的标记。栽培亲本特异性标记(A. hypogaea.)也被记录下来。所有通过筛选步骤的snp都被考虑用于进一步的分析,无论它们是否被映射A. hypogaea.简历。Tifrunner Genome版本[2那28].
遗传地图建设
使用“ASMap”R package version 2.0-0构建RIL群体连锁图谱[67.].使用自定义R脚本,如果SNP标记和个体包含超过10%的缺失数据,则会被过滤掉。标记偏离预期的1:1分离比是通过卡方检验,加上多重检验的Bonferroni校正来确定的。所有标记的期望分离比(1:1,P <选择最小缺失数据百分比(10%)作为框架标记。这些框架标记被认为是构建地图的高度可靠。任何同一位置的标记或分隔失真(P.< 0.05)被排除在第一次图谱构建之外,但他们被进一步强迫回到使用初始框架标记构建的连锁群中,以使图谱更加致密,具有更多的snp。根据“ASMap”地图构建管道的建议,使用a计算一个简单的阈值机制来确定标记是否属于同一个连锁组P.- 1E-6的值和相邻标记之间的地图距离<35cm [67.].用Kosambi函数估计cM [68.].由于构建2号染色体lgg的困难,在二倍体和四倍体参考基因组中,只有定位于2号染色体的snp [2那25]。使用Linkage MapView 2.1.2 R包对遗传图谱进行可视化[69.].两者之间的一致性A. hypogaea.简历。Tifrunner参考基因组(https://peanutbase.org)通过将每个SNP标记的遗传距离(CM)和物理位置(MBP)进行比较,使用R包MARAYMAP [70].通过BLASTn搜索确定各SNP标记的物理位置A. hypogaea.[2](https://peanutbase.org).计算赔率(LOD)评分和重组级分的成对对数以使用该分数可视化遗传图谱的热图功能。
QTL分析
用R / QTL R包进行QTL映射和添加剂效果的估计[71.那72.].从RILS和祖细胞的SNP数据衍生的等位基因码被记录如下:如在AmphidiPloid = A中纯合,如培养的父母= B.每条线的平均表型数据(发病)总体而每年估计并用于QTL分析。考虑到观察到的标记数据,有条件基因型概率被计算,概率误差= 0.001。在执行伪标记功能后,使用1.0cm窗口尺寸用于基因组扫描。扫描Haley-Knott(H-K)回归以评估每个基因组位置与感兴趣的特征的关联。使用1000个排列的每种染色体估计阈值LOD评分(α=0.01), and a QTL was declared if the LOD score was over the empirical threshold [73.].95%的贝叶斯置信区间计算出来贝依森特功能和LOD支持间隔lodint.每个QTL的表型方差解释百分率(PVE)用该函数计算fitqtl.如R / QTL所实施的[71.]通过对每个检测到的QTL拟合一个线性模型,并根据QTL位置上基因型类间发病率的差异计算黑穗病发病率的降低百分比。此外,我们还进行了两次QTL扫描,以评估基因座间的相互作用addint.qtl按照传统命名法以首字母命名问:其次是特质名称(被命名重度为黑穗病发生率)和LG。
QTL区间内候选基因的鉴定
QTL间隔被定义在使用该置信区间末端识别的标记物理位置之间的定义lod_intR / QTL2包中的功能[74.].物理位置按参考顺序排列A. hypogaea.简历。Tifrunner [2](https://peanutbase.org).为了确定可能调控花生黑穗病抗性的候选基因,我们利用Intermine在线平台(https://mines.legumeinfo.org/peanutmine/begin.do).对qtl区间内检测到的每个基因模型的基因表达量进行评估A. hypogaea.简历。Tifrunner参考转录组[29](https://peanutbase.org).
数据和材料的可用性
本研究期间生成和/或分析的数据集包含在本公布的文章(及其补充信息文件)中,或通过AG数据公共(国家农业图书馆,美国农业资源研究服务)提供:https://doi.org/10.15482/USDA.ADC/1522387.
缩写
- cM:
-
Centimorgan.
- LOD:
-
赔率的对数
- Mbp:
-
Megabase一对
- QTLS:
-
定量特质基因座
- RIL:
-
重组自交系
- SNP:
-
单核苷酸多态性
- 加:
-
轻微的等位基因频率
参考
- 1.
Seijo G, Lavia GI, Fernández A, Krapovickas A, Ducasse DA, Bertioli DJ等。栽培花生(花生那豆科植物)以及它的近亲双吉什透露。我是J Bot。2007;94(12):1963–71.https://doi.org/10.3732/AJB.94.12.1963.
- 2.
Bertioli DJ,Jenkins J,Clevenger J,Dudchenko O,Gao D,Seijo G,等。节段性同种异体四倍体花生的基因组序列花生. 纳特·吉内特。2019;51(5):877–84.https://doi.org/10.1038/s41588-019-0405-z.
- 3.
Bertioli DJ,Abernathy B,Seijo G,Clevenger J,Cannon SB。评估两种不同模型的花生起源。NAT Genet。2020; 52(6):557-9。https://doi.org/10.1038/s41588-020-0626-1.
- 4.
FAOSTAT统计数据库。粮农组织罗马。http://faostat3.fao.org.2020年6月25日通过。
- 5.
Settaluri VS,Kandala CV,Puppala N,Sundaram J.花生及其营养方面 - 评论。食品Nutr Sci。2012; 12(12):1644-50。https://doi.org/10.4236/fns.2012.312215.
- 6。
Astiz Gassó MM, Marinelli A.离体萌发生物学Thecaphora frezii(西班牙语)。见:第二十八Jornada Nacional de Maní程序。科尔多瓦、阿根廷;国际商标。第45 - 46页。http://www.ciacabrera.com.ar/jornada_del_mani/28_jornada_del_mani.html..
- 7。
3月GJ,Marinelli A.疾病和生产性系统(以西班牙语)。Enfermedades deManíen阿根廷。FundaciónManíAgrentino。2005; 2:1-11。
- 8。
花生黑穗病:组织病理学、发病率和严重程度。(西班牙语)。见:第二十八Jornada Nacional del Maní论文集。科尔多瓦:落脚;2013.26 - 7页。http://www.ciacabrera.com.ar/jornada_del_mani/28_jornada_del_mani.html..
- 9。
pardes, j.a., L.I. Cazón, A. Osella, V. Peralta, M. Alcalde, M.I. Kearney等。花生黑穗病区域调查及病害造成的损失估计。(西班牙语)见:Jornada Nacional de Maní论文集。科尔多瓦;国际商标。2017; p。41-42。http://www.ciacabrera.com.ar/jornada_del_mani/31_jornada_del_mani.html..
- 10.
Rago AM, Cazon LI, Paredes JA, Molina JP, Conforto EC, Bisonard EM等。花生黑穗病:从一种新出现的疾病到对阿根廷花生生产的实际威胁。工厂说。2017;101(3):400 - 8。https://doi.org/10.1094/PDIS-09-16-1248-FE.
- 11.
Cazón LI, Paredes JA, Rago AM。的生物学Thecaphora frezii黑穗病及其对阿根廷花生生产的影响。作者:Kimatu JN,编辑。植物病理学进展。伦敦:IntechOpen有限公司。;2018年。31–46.https://doi.org/10.5772/intechopen.75837.
- 12.
Krapovickas A, Gregory WC。Taxonomia del generoarachis.(豆科植物)。Bonplandia。1994年; 8:1-86。
- 13.
Carranza JM,Lindquist JC。thecaphora frezii n。sp。,parásitadearachis.sp.Bol Soc银色机器人。1962;10:11–8.https://botanicaargentina.org.ar/thecaphora-frezii-n-sp-parasita-de-arachis-sp.
- 14.
Soave J,Bianco C,Burgoa R,MontañoR,rago a,cazóni等。PrimeraDeteccióndeCarbóndelManí(Thecaphora frezii)在玻利维亚。: 3°阿根廷大会Fitopatología。Tucumán: Asociación Argentina de Fitopatólogos proceedings;2014.p。211。
- 15.
Conforto C, Cazón I, Fernández FD, Marinelli A, Oddino C, Rago AM。分子序列数据Thecaphora frezii影响阿根廷的花生作物。EUR J植物途径。2013; 137(4):663-6。https://doi.org/10.1007/s10658-013-0296-2.
- 16.
Arias Rs,Cazon Li,Massa An,Scheffler,SoboLev VS,Lamb Mc,等。促滤膜和核编码的杀菌剂 - 靶基因Thecaphora frezii花生黑穗病的致病因子。真菌基因组。2019;160:1-8。
- 17。
Paredes JA, Cazon LI, Oddino C, Monguillot JH, Rago AM, Molina JE。杀真菌剂对阿根廷花生黑穗病的防治效果。作物保护。2020;140:105403。https://doi.org/10.1016/j.cropro.2020.105403.
- 18。
奇数Cm,Soave Ja,Soave SJ等。花生野生特种和玻利维亚地区粉碎抗性的来源。Córdoba:通过基因组学和生物技术诉讼程序在植物中进展;2017. p。8。
- 19。
Bressano M,Massa AN,Arias RS,de Blas F,Oddino C,Faustinelli PC等.花生地方品种对优良花生品种抗黑穗病的导入(花生l .)。Plos一个。2019; 14(2):E0211920。https://doi.org/10.1371/journal.pone.0211920.
- 20.
马萨An,Bressano M,Soave Jh,Buteler Mi,Seijo G,SoboLev Vs等。基因分型工具和资源评估花生种质:抗污水塑料作为案例研究。peerj。2021; 9:E10581。https://doi.org/10.7717/peerj.10581.
- 21。
de Blas FJ、Bressano M、Teich I、Balzarini MG、Arias RS、Manifesto MM等。野生稻黑穗病抗性鉴定arachis.品种及其在花生优良品系中的渗透。作物科学。2019;59(4):1657 - 65。https://doi.org/10.2135/cropsci2018.10.0656.
- 22。
江y,王x,yu x,zhao x,luo n,pei z等。与干旱耐受相关的定量特质基因座Broachypodium distachyon..前植物SCI。2017; 8:811。https://doi.org/10.3389/fpls.2017.00811.
- 23。
Pasupuleti J,Pandey Mk,Manohar SS,Variath Mt,Nallathambi P,Nadaf HL等。叶面真菌抗病患者血液凝血线(落花生hypogaea L。)在多地点试验中获得较高的荚果和茎产量。植物品种。2016;135(3):355 - 66。https://doi.org/10.1111/pbr.12358.
- 24。
Varshney RK,Pandey MK,Janila P,Nigam SN,Sudini H,Gowda MV等.标记辅助导入一个QTL区域以提高花生三个优良和流行品种的抗锈性(花生l .)。Al Appl Genet。2014; 127:1771-81。https://doi.org/10.1007/s00122-014-2338-3.
- 25
Bertioli DJ, Cannon SB, Froenicke L, Huang G, Farmer AD, Cannon EK等。基因组序列落花生duranensis和落花生ipaensis栽培花生的二倍体祖先。纳特·吉内特。2016;48(4):438–46.https://doi.org/10.1038/ng.3517.
- 26
陈X,Lu Q,刘H,张j,hong y,lan h等。栽培花生的测序,花生,让我们对基因组进化和石油改良有了更深入的了解。摩尔。2019;12(7):920 - 34。https://doi.org/10.1016/j.molp.2019.03.005.
- 27
Clevenger J,Chu Y,Chavarro C,Agarwal G,Bertioli DJ,Leal Bertioli SC等。全基因组SNP基因分型解决了花生选择和四体重组的特征。摩尔植物。2017;10(2):309–22.https://doi.org/10.1016/j.molp.2016.11.015.
- 28
关键词:多倍体,单倍型,基因分型植物科学与技术,2018;https://doi.org/10.3389/fpls.2018.00564.
- 29
李建平,李建平。花生的生物学特性、物种形成与利用。植物学报,1999,30(3):457 - 464。正确答案:《跟踪者HT》,《威尔森RF》,《编辑》。花生的遗传、加工与利用。波士顿:家出版社;2016.27 - 66页。https://doi.org/10.1016/C2015-0-00075-2.
- 30.
Pandey Mk,Wang H,Khera P,Vishwakarma Mk,Kale Sm,Culbreath Ak等。新型QTL抗叶片斑块和番茄斑点枯萎病毒在花生中的遗传解剖(花生l .)。植物科学与技术,2017;https://doi.org/10.3389/fpls.2017.00025.
- 31.
Leal-Bertioli SC, Santos SP, Dantas KM, Inglis PW, Nielen S, Araujo AC等。arachis batizocoi.:与栽培花生关系的研究(A. hypogaea.),以及利用诱导异源四倍体将野生基因导入花生作物的潜力。安机器人。2015;115(2):237 - 49。https://doi.org/10.1093/aob/mcu237.
- 32.
Nguepjop JR,Tossim Ha,Bell Jm,Rami JF,Sharma S,Courtois B等人。新综合异丙醇杂交种子在花生杂交中的基因组交换基因组交换的证据。前植物SCI。2016; 7:1635。https://doi.org/10.3389/fpls.2016.01635.
- 33.
缠扰者HT,迪尔米JS,Parry DC。对B基因组种类的分析arachis batizocoi.(Fabaceae)。PLS SYS EVOL。1991年; 174(3-4):159-69。https://doi.org/10.1007/BF00940337.
- 34.
Leal-Bertioli S,Shirasawa K,Abernathy B,Moretzsohn M,Chavarro C,Clevenger J等人。异形重组令人惊讶的是在同种异体中均频繁频繁arachis..遗传学。2015;199(4):1093 - 105。https://doi.org/10.1534/genetics.115.174607.
- 35.
Ballén-taborda C,Chu Y,Ozias-Akins P,Timper P,Holbrook CC,Jackson Sa等。一种新的根结线路源来自落花生stenosperma掺入Allotetraploid花生(花生).SCI批准。2019; 9(1):17702。https://doi.org/10.1038/s41598-019-541831..
- 36.
Ting NC, Jansen J, Mayes S, Massawe F, Sambanthamurthi R, Ooi LC,等。两个独立油棕杂交种的高密度SNP和ssr基因图谱。BMC基因组学,2014;15(1):309。https://doi.org/10.1186/1471-2164-15-309.
- 37.
王刚,何qq,徐正坤,宋仁涛。玉米B73 ×大刍草杂交组合的高偏析畸变。中国生物医学工程学报(英文版);2012;https://doi.org/10.4238/2012.March.19.3.
- 38.
张颖,王玲,辛红,李丹,马超,丁鑫,等。基于特定长度扩增片段(SLAF)大规模标记开发构建芝麻高密度遗传图谱。植物生物学学报。2013;13(1):141。https://doi.org/10.1186/1471-2229-13-141.
- 39.
Manrique-Carpintero NC, Coombs JJ, Veilleux RE, Buell CR, Douches DS。马铃薯三个二倍体群体中畸变分离区域的比较分析。G3。2016; 6:2617-28。https://doi.org/10.1534/g3.116.030031.
- 40.
植物核基因的不平等分离。机器人Gaz。1986;147(3):355 - 8。https://doi.org/10.1086/337602.
- 41.
韩S,元M,克利曼jp,李c,海鸥A,张X等。基于SNP的连杆地图显示了QTL用于花生的早期和晚期叶斑病患者(花生l .)。植物科学与技术,2018;https://doi.org/10.3389/fpls.2018.01012.
- 42.
Shirasawa K,Bhat Rs,Khedikar YP,Sujay V,Kolekar RM,Yeri Sb等。遗传基因座的抗性抵抗遗传座和锈病(花生l .)。正面。植物SCI。2018; 9:1727。https://doi.org/10.3389/fpls.2018.01727.
- 43.
胡晓红,张淑珍,苗海荣,崔芳芳,沈颖,杨文清,等。利用SLAF-seq和ssr构建花生油酸和亚油酸的高密度遗传图谱并鉴定qtl。Sci众议员2018;8(1):5479。https://doi.org/10.1038/s41598-018-23873-7.
- 44.
张立,王某,李h,邓q,郑安,李思等。缺失的标记和隔离失真对F 2群体QTL映射的影响。您施用的遗传赛。2010; 121(6):1071-82。https://doi.org/10.1007/s00122-010-1372-z.
- 45。
徐S,Hu Z.使用扭曲的标记绘制定量特质基因座。int j植物基因组学。2009; 410825:1-11。https://doi.org/10.1155/2009/410825.
- 46。
Bertioli DJ, Ozias-Akins P, Chu Y, Dantas KM, Santos SP, Gouvea E等。SNP标记在二倍体和四倍体花生连锁定位中的应用。G3。2014; 4:89 - 96。https://doi.org/10.1534/g3.113.007617.
- 47。
Chavarro C、Chu Y、Holbrook C、Isleib T、Bertioli D、Hovav R等。Pod和种子性状QTL鉴定,以协助花生市场偏好育种。G3。2020;10:2297–315.https://doi.org/10.1534/g3.120.401147.
- 48。
刘宁,陈浩,怀丹,夏芳,黄磊,陈伟,等。花生饱和脂肪酸含量的4个主要稳定QTL (花生l .)。摩尔品种。2019;39:23。https://doi.org/10.1007/s11032-019-0934-2.
- 49
王Z,淮维,张Z,程克,康y,wan l等。基于特异性长度扩增片段测序的高密度遗传图谱及其在栽培花生中产量相关性状定量性状分析中的应用。前植物SCI。2018; 9:827。https://doi.org/10.3389/fpls.2018.00827.
- 50.
科拉德BC, Jahufer MZ, Brouwer JB, Pang EC。作物改良的分子标记、QTL定位和分子标记辅助选择的基本概念。Euphytica。2005;142(2):169 - 96。https://doi.org/10.1007/s10681-005-1681-5.
- 51.
Charmet G. QTL检测的功率和准确性:单QTL模型的仿真研究。农艺知。2000; 20(3):309-23。https://doi.org/10.1051/agro:2000129.
- 52.
Agarwal G, Clevenger J, Pandey MK, Wang H, Shasidhar Y, Chu Y,等。利用全基因组重测序建立高密度遗传图谱并发现花生抗病候选基因。植物保护学报(英文版);2018;https://doi.org/10.1111/pbi.12930.
- 53.
Clevenger J,Chu Y,Scheffler B,Ozias-Akins P. Allotetroploid的发育转录组Map花生. 前植物科学。2016;7:1446.https://doi.org/10.3389/fpls.2016.01446.
- 54.
Michelmore RW,Meyers Bc。植物中抗性基因的簇通过分歧选择和出生和死亡过程而发展。Genome Res。1998年; 8(11):1113-30。https://doi.org/10.1101/gr.8.11.1113.
- 55.
马萨·安,曼里克·卡比罗·NC,库姆斯·JJ,扎尔卡·DG,Boone-AE,Kirk-WW,等。栽培四倍体马铃薯重要经济性状的遗传连锁图谱(Solanum Tuberosum.l .)。G3。2015; 5:2357-64。https://doi.org/10.1534/g3.115.019646.
- 56.
Nagy-ED,Chu-Y,Guo-Y,Khanal-S,Tang-S,Li-Y等。花生抗根结线虫显性基因Rma的外源导入抑制了重组。摩尔品种。2010;26(2):357–70.https://doi.org/10.1007/S11032-010-9430-4.
- 57.
Belkhadir Y,Subramaniam R,Dangl JL。植物抗病蛋白信号:NBS–LRR蛋白及其伙伴。植物生物学。2004;7(4):391–9.https://doi.org/10.1016/j.pbi.2004.05.009.
- 58.
Hammond-Kosack Ke,Parker Je。破译植物 - 病原体通信:用于分子抗性育种的新透视。CurrOgin Biotechnol。2003; 14(2):177-93。https://doi.org/10.1016/S0958-1669(03)00035-1.
- 59.
Pedley KF, Martin GB。丝裂原活化蛋白激酶在植物免疫中的作用。植物生物学杂志。2005;8(5):541-7。https://doi.org/10.1016/j.pbi.2005.07.006.
- 60。
Robledo G, Lavia GI, Seijo G.野生物种关系arachis.用RDNA基因座和异铬胺检测的鱼类测绘揭示的基因组。Al Appl Genet。2009; 118(7):1295-307。https://doi.org/10.1007/S00122-009-0981-X..
- 61。
Robledo G,Seijo G.物种关系中的野生B基因组arachis.物种(部分arachis.)基于rDNA位点FISH定位和异染色质检测:基因组排列的新建议。理论应用基因。2010;121(6):1033–46.https://doi.org/10.1007/s00122-010-1369-7.
- 62。
R开发核心团队。R:统计计算语言和环境R维也纳:统计计算基础;2019.
- 63。
关键词:线性混合效应模型,线性混合效应,lme4统计软件。2015;67(1):1 - 58。https://doi.org/10.18637/jss.v067.i01.
- 64.
Scott AJ,Knott M.用于分析方差分析中的集群分析方法。生物识别技术。1974; 1(3):507-12。https://doi.org/10.2307/2529204.
- 65.
Jelihovschi EG, Faria JC, Allaman IB ScottKnott:。a package for performing the Scott-Knott clustering algorithm in R. TEMA (São Carlos) 2014; 15:3-17。doi:https://doi.org/10.5540/tema.2014.015.01.00031。
- 66.
Hallauer Ar,Carena Mj,Miranda Filho JD。玉米育种的定量遗传学。纽约,纽约:Springer;2010年。https://doi.org/10.1007/978-1-4419-0766-0.
- 67.
Taylor J,Butler D. R包装Asmap:高效的遗传联系地图建设和诊断。j stat softw。2017年; 79(6):1-29。https://doi.org/10.18637/jss.v079.i06..
- 68.
地图距离的估计。安优生学。1943;12(1):172 - 5。https://doi.org/10.1111/j.1469-1809.1943.tb02321.x.
- 69。
Ouellette LA, Reid RW, Blanchard SG, Brouwer CR. linkagemapview绘制高分辨率连锁图谱和QTL图谱。生物信息学。2018;34(2):306 - 7。https://doi.org/10.1093/bioinformatics/btx576.
- 70.
Rezvoy C,Charif D,GuéguenL,Marais Ga。MARAYMAP:基于R基工具,具有图形界面,用于估计重组率。生物信息学。2007; 23(16):2188-9。https://doi.org/10.1093/bioinformatics/btm315.
- 71.
Broman Kw,吴H,Senś,丘吉尔乔治。R / QTL:实验交叉中的QTL映射。生物信息学。2003; 19(7):889-90。https://doi.org/10.1093/bioinformatics/btg112.
- 72.
利用R/ QTL进行QTL定位。纽约:施普林格;2009.https://doi.org/10.1007/978-0-387-92125-9.
- 73.
邱吉尔GA,多尔吉RW。数量性状定位的经验阈值。遗传学。1994;138(3):963–71.https://doi.org/10.1093/genetics/138.3.963.
- 74.
Broman Kw,Gatti Dm,Simecek P,Furlotte Na,Prins P,Senś,等。R / QTL2:用于使用高维数据和多种群体绘制定量特征基因座的软件。遗传学。2019; 211(2):495-02。https://doi.org/10.1534/genetics.118.301595.
致谢
我们要感谢MSC。Federico Agostini,Instituto deBotánicadel Nordeste(Conicet-Unne),NacienceDelnemony del Nordeste,用于生物信息学支持;The Laboratorio deBiotecnología,Facultad de Ciencias Agropecuarias国立大学Córdoba,科多巴,阿根廷;和USDA-ARS-国家花生研究实验室,道森,GA。提及专有产品或公司,包括读者方便,并不意味着USDA-ARS的任何认可或优先待遇。
资金
这项工作部分得到了CriadeLo El Carmen(托儿所El Carmen)的支持,提供现场实验空间和绘图维护。USDA-ARS项目NP301 6044-21000-005-00-D和NP303 6044-42000-011-00D仅限于金融支持。Ministerio de Ciencia YTecnologíadaveniadeCórdoba,Argentina,通过“2018年和2019年的特殊项目”为现场评估和旅行费用提供资金。Agencia Nacional DePromociónCientíficaYTecnológica(anpcyt),阿根廷为Argentina的DNA提取步骤提供了DNA提取步骤的资金,Argentina为Argentina提供了资金,提供了与项目PI 19-002项目PI的实地评估和实验室数据分析的资金。F. de Blas从Conicet获得了奖学金(Exp.n 003449/15 Res.n°3902)。融资机构对实验设计,数据分析和解释或写作的撰写没有影响。
作者信息
隶属关系
贡献
FJDB,ANM,JGS和MIB构思和设计了实验;FJDB和CIB进行了QTL检测和统计分析;FJDB,CO,MB,MR,SJ,JHS进行了现场实验;FJDB和BDPC策划了数据;FJDB,CBT和EM分析了数据;ANM和RSA贡献了试剂,材料和/或分析工具;FJDB,ANM和JGS起草并编写了稿件。所有作者批准了最终版本。
通讯作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1:
56个扭曲标记列表,最多4:1分离比例在LGS A04,A05,A07,B03和B04上的几个离散簇中分布。
额外的文件2:
236个具有统计学意义的SNPs一览表(P.=0.01) resulting of a single marker-phenotype association between disease resistance trait and SNP markers.
额外的文件3:
所有连锁群与基因组序列的共线性分析。x轴根据参考序列对标记的物理位置进行缩放。y轴代表各标记在柑橘中的遗传距离。
额外的文件4:
估计重组级分(上方对角线)和LOD分数的曲线图R.= 1/2(对角线以下)为连锁图谱中的所有标记对。黄色表示联动,蓝色表示未联动。
额外的文件5:
QTL在年度检测到抵抗花生群体的抗性群体arachis.基于哈雷-诺特基因组扫描QTL检测模型。对花生黑穗病的抗性是根据平方根转化黑穗病的发生率来估计的;一种性状的田间评价年份。B.联动组。C每个LG的Kosambi CM的地图位置。D.QTL峰值处的LOD值。
额外的文件6:
每年对A08和B02染色体进行QTL检测,获得LOD值。橙色线:2015,绿色线:2016,紫色线:2017。红色虚线表示经验LOD评分阈值为P.- value <0.05。
额外的文件7:
基于CV的两种QSMIA08(1.23MBP - 6.04 MBP)和QSMIA02 / B02(3.43-4.29 MBP)的物理间隔内基因含量分析。tifrunner转录组信息[27](https://peanutbase.org).一种来自GeneDB数据库的一个基因标识符;基因家族的描述和蛋白质功能标识符www.ebi.ac.uk/Interpro/;加利福尼亚州脊柱hypogaea染色体ID;D.点表示生殖组织中的基因表达;E.点表示PEG底碱基和果实板1之间的酚类时段中的基因表达。
额外的文件8:
自定义UNIX脚本,用于过滤本研究中生成的基因分型数据。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
德布拉斯,F.J.,布鲁诺,C.I.,阿里亚斯,R.S。等等。花生抗黑穗病的遗传定位及QTL分析。BMC植物杂志21,312(2021)。https://doi.org/10.1186/s12870-021-03023-4
收到了:
公认:
发表:
关键词
- arachis.
- 抗病性
- 迟滞
- 花生
- 花生
- QTL
- 花生污迹
- RIL种群