- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发布:GydF4y2Ba
柑桔幼苗形态和生理特征的差异与Mg从亲本向分支器官的转运有关GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba21.GydF4y2Ba文章编号:GydF4y2Ba239.GydF4y2Ba(GydF4y2Ba2021.GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
在这项研究中,我们旨在测试柑橘植物中重新化的假设由Mg供给调节,有助于母体和分支器官的生长差异。柑橘幼苗在Mg缺陷下在沙子中生长(0mmol mgGydF4y2Ba2+GydF4y2BaL.GydF4y2Ba-1GydF4y2Ba-Mg)和充足Mg (2 mmol MgGydF4y2Ba2+GydF4y2BaL.GydF4y2Ba-1GydF4y2Ba, + Mg)条件。研究了不同器官对生物量、Mg吸收与转运、气体交换、叶绿素荧光以及相关形态和生理参数的影响。GydF4y2Ba
结果GydF4y2Ba
缺镁显著降低了植株生物量,总生物量降低39.6%,分枝器官的生物量比母本器官减少了2倍以上。光合能力下降是由于色素水平下降和光合电子传递链中断,从而影响非结构性碳水化合物积累和植物生长。但枝条叶片对缺镁的适应反应大于亲本叶片。镁缺乏抑制了植物对镁的吸收,但促进了镁从亲本向分支器官的转移,从而改变了相关的生长变量和生理参数,包括蛋白质合成和抗氧化酶活性。主成分分析表明,在不同Mg处理条件下,这些变化在上、下亲本叶片中均高度聚类,而在枝叶中高度分离。GydF4y2Ba
结论GydF4y2Ba
Mg缺乏抑制柑橘植物的父母和分支器官的生长,具有高Mg流动性,有助于生理代谢的差异。这些研究结果表明,MG管理应针对可持续的柑橘生产进行优化。GydF4y2Ba
背景GydF4y2Ba
镁(Mg)是植物生长和发育所需的必要因素,在许多生理和生化过程中起重要作用,包括叶绿素和蛋白质合成,吸收的生产和运输和酶活性[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba].据报道,植物中总镁的35%是叶绿素分子的结合,其中Mg是中央原子,并确定其结构和功能,进一步影响光合作用,碳水化合物积累,能量代谢和应力阻力[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba].虽然Mg是许多代谢反应中的中间体,但Mg缺乏是一种强化农业生产的常见现象,严重影响各种作物的产量和质量,包括谷物,蔬菜和水果[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba].膳食镁摄入量与人类健康密切相关[GydF4y2Ba7.GydF4y2Ba从食物中摄入较少的镁会直接或间接导致一系列人类疾病,如高血压、糖尿病和心肌梗死。因此,全面了解镁的需求特征及其对缺镁的响应,对于制定有针对性的镁肥料管理策略,提高粮食产量、作物镁营养质量和人类健康具有重要意义[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].GydF4y2Ba
植物中的Mg是高度移动的,Mg缺乏症状优先在较低的或旧叶子中显示为静脉之间的氯鱼阳(泛黄)[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].虽然镁缺乏对植物生长和营养功能的影响已被广泛研究,但结果并不总是一致的。Hermans等[GydF4y2Ba10.GydF4y2Ba]报道,在Mg缺乏导致Mg浓度降低的同时,糖含量随着叶位的升高而升高,且Mg浓度与糖含量呈明显的负相关关系。相比之下,陈和范[GydF4y2Ba11.GydF4y2Ba[据报道,镁缺乏症在上层或幼叶中更为标记,而不是在香蕉植物的下叶片中。此外,中间叶中检测到最明显的损伤,其呈现边际坏死和萎。在大豆植物中报道了类似的结果,表明Mg流动性与其生理和生化特征有关[GydF4y2Ba2GydF4y2Ba].然而,与甜菜等其他植物相比,GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba)、小麦(GydF4y2Ba13.GydF4y2Ba[GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba15.GydF4y2Ba],缺镁对木本植物特别是柑橘类植物从亲本向分支器官转移镁的影响尚不清楚[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba16.GydF4y2Ba].GydF4y2Ba
柑橘(GydF4y2Ba柑橘类reticulata.GydF4y2Ba白杨(Blanco)是一种生长在热带和亚热带地区的常绿木本果树,对许多国家的经济和水果生产作出了重要贡献[GydF4y2Ba17.GydF4y2Ba].中国柑橘生产[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba)、巴西(GydF4y2Ba21.GydF4y2Ba], 印度 [GydF4y2Ba22.GydF4y2Ba],以及新西兰[GydF4y2Ba23.GydF4y2Ba],通常是由于严重的土壤酸化、土壤质量低下和过量或不平衡的肥料使用造成的镁缺乏。此外,镁的水化半径较大GydF4y2Ba2+GydF4y2Ba土壤胶体的弱吸附加剧了通过浸出来损失mg [GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba].以前的研究表明,柑橘植物对MG的需求很高,尽管在生产中通常被忽略这种特性。Mattos Jr.等。[GydF4y2Ba24.GydF4y2Ba据报道,一棵6岁的甜橙树的MG要求是8.7公斤GydF4y2Ba-1GydF4y2Ba,这与磷(磷,8.3公斤公顷)的需求相当GydF4y2Ba-1GydF4y2Ba).在营养吸收评估中,大约43公斤Mg HAGydF4y2Ba-1GydF4y2BaMg的年吸收平衡明显较高(12.6 kg haGydF4y2Ba-1GydF4y2Ba),磷(8.6 kg ha .GydF4y2Ba-1GydF4y2Ba)[GydF4y2Ba25.GydF4y2Ba].这些结果表明,Mg管理可能有助于提高柑橘生产的植物生长以及果实产量和品质[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba21.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba].在柑橘幼苗中也观察到类似的结果,与上叶上的叶片相比,Mg缺乏造成的效果更大。这些发现表明,植物缺乏症的效果与Mg流动性变化引起的Mg浓度的差异有关[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].因此,了解柑橘植株亲本器官和分支器官对缺镁反应的镁转运机制,对于高产优质集约农业生产具有重要的理论和实践意义。GydF4y2Ba
研究了缺镁对柑橘幼苗生物量、Mg吸收、气体交换、叶绿素荧光瞬态及相关形态和生理参数的影响。我们还关注了镁缺乏对Mg从亲本向分支器官运输能力的影响。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
柑橘植物'Xuegan'(GydF4y2Ba柑橘sinensis.GydF4y2Ba(l)本研究以福建省林业科学研究院鲜果为材料,以Osbeck为原料。参照Cai等报道的实验条件设计了控制和缺镁的实验条件。GydF4y2Ba28.GydF4y2Ba和Ye等人[GydF4y2Ba9.GydF4y2Ba].简单地说,在中国福州市自然光周期温室条件下(年平均日照1700 - 1980 h,年平均温度20ºC - 25ºC)栽培柑橘幼苗。种子萌发、育苗盘育苗后,将2株相似的幼苗移栽到6 L(上径26 cm ×下径16 cm ×高22 cm)装5 kg净沙的陶瓷盆上,每处理20个重复。幼苗培养至平均三片叶(鲜重1克,高10厘米)的阶段。用改良的霍格兰营养液处理幼苗,提供Mg缺乏症(0 mmol LGydF4y2Ba-1GydF4y2Ba毫克(不GydF4y2Ba3.GydF4y2Ba)GydF4y2Ba2GydF4y2Ba-Mg)和充足Mg (2 mmol LGydF4y2Ba-1GydF4y2Ba毫克(不GydF4y2Ba3.GydF4y2Ba)GydF4y2Ba2GydF4y2Ba+毫克)。其他营养成分组成如下:5 Ca(NOGydF4y2Ba3.GydF4y2Ba)GydF4y2Ba2GydF4y2Ba, 2 KGydF4y2Ba2GydF4y2Ba所以GydF4y2Ba4.GydF4y2Ba1 KHGydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba,1 kno.GydF4y2Ba3.GydF4y2Ba在大量营养素(mmol LGydF4y2Ba-1GydF4y2Ba)和20 Fe-EDTA,2毫克GydF4y2Ba2GydF4y2Bah·4GydF4y2Ba2GydF4y2Bao,0.5 cusoGydF4y2Ba4.GydF4y2Bah·5GydF4y2Ba2GydF4y2Ba啊,2 ZnSOGydF4y2Ba4.GydF4y2Bah·7GydF4y2Ba2GydF4y2Bao,10小时GydF4y2Ba3.GydF4y2Ba博GydF4y2Ba3.GydF4y2Ba,0.065(nhGydF4y2Ba4.GydF4y2Ba)GydF4y2Ba6.GydF4y2Ba莫GydF4y2Ba7.GydF4y2BaO.GydF4y2Ba24.GydF4y2Bah·4GydF4y2Ba2GydF4y2Bao在微量营养素中(μmollGydF4y2Ba-1GydF4y2Ba).缺镁处理组的N含量可通过添加NH来补偿GydF4y2Ba4.GydF4y2Ba不GydF4y2Ba3.GydF4y2Ba.每2天用营养液浇灌幼苗,pH调节在6.50±0.05。间歇式滴灌0.5 L自来水含1.7 mg LGydF4y2Ba-1GydF4y2Ba米GydF4y2Ba2+GydF4y2Ba施加到砂表面以避免干燥。从2018年5月到2019年5月至2019年4月的11个月后,收集植物样品并确定了形态学和生理特性,其中燃气交换和荧光瞬变的参数在生物植物(2019年3月)中测量。GydF4y2Ba
抽样和生物质测量GydF4y2Ba
为了了解Mg对枝条生长的影响以及Mg从亲本到枝条的运输能力,我们在晴天收获柑橘幼苗,每个盆栽一株用于生物量测定,另一株用于其他测定。为了测量植物生物量,将柑橘幼苗分为根、茎和叶器官。根系进一步分为主根(MR)和侧根(LR),茎分为枝茎(BS)和亲本茎(PS)。PS分为上茎(US)和下茎(LS)。叶片分为分枝叶(BL)和亲本叶(PL)。PL分为上叶(UL)和下叶(LL)。US和UL或LS和LL根据1/2株高定义,MR和LR分别定义为> 1 mm和< 1 mm根径。选取部分柑橘幼苗进行新鲜样品采集。取茎、枝的中间叶(株高2/5和4/5,枝长1/2)和白色活性根(离根尖0.5-1.0 cm)进行生理生化测定。在晴天10:00和12:00采集新鲜样品,在液体N中冷冻GydF4y2Ba2GydF4y2Ba然后储存在-80°C。GydF4y2Ba
在105°C下干燥30分钟,在70°C下储存约2天,直到达到恒定的重量后,测量生物量干重。根/茎,茎横面积(πrGydF4y2Ba2GydF4y2Ba,其中r = 1/2茎基直径),计算生物质分布(器官或器官或部分生物质/全植物生物质×100%)。植物高度,植物叶数,第一分支高度,分支,分支长度和分支叶的数量。GydF4y2Ba
叶片生长特征和根系形态测量GydF4y2Ba
叶生长的特点,包括鲜重,干重,含水量([鲜体重干重] /鲜重×100%),叶面积,特定叶重(SLW,叶干重/叶面积)和特定叶片根据Chen等人描述的方法计算面积(SLA,叶面积/叶片干重)。[GydF4y2Ba29.GydF4y2Ba].采用DR-6030C扫描仪(佳能,中国北京)和Image-Pro Plus 6.0软件(Media Cybernetics, Silver Spring, MD, USA)联合应用确定叶片面积。GydF4y2Ba
计算根系长度、表面积、平均直径、根体积和根尖数量等形态参数。将沙子从新鲜的根中洗掉后,使用Epson Expression 10000XL数字扫描仪(Epson, San Jose, CA, USA)拍摄图像,并使用WinRHIZO软件(Version 2009b, Regent Instruments, Montreal, QC, Canada)进行分析。用四唑氯(TTC)染色法测定根的活性。GydF4y2Ba
镁的浓度、积累和分布测定GydF4y2Ba
为了测定柑橘幼苗不同器官中Mg的含量,将干燥和研磨后的样品用HNO完全消化GydF4y2Ba3.GydF4y2Ba-HClOGydF4y2Ba4.GydF4y2Ba在250ºC-300ºC下,通过电感耦合等离子体 - 光发射光谱(ICP-OES; Optima 7300 DV,PerkinElmer,Ma,USA)以285.2nm测量吸光度。将植物中的总Mg累积计算为器官中的Mg积聚之和(Mg浓度×不同器官中的干重)。不同器官或零件中的Mg分布计算为:(在不同器官中的Mg累积/植物中总Mg累积的总和)×100%。GydF4y2Ba
可溶性糖和淀粉测量GydF4y2Ba
根据Ribeiro等人描述的方法,提取并测量根和叶中的可溶性糖和淀粉。[GydF4y2Ba30.GydF4y2Ba].将干燥的研磨样品(0.1g)与10mL 630g L混合GydF4y2Ba-1GydF4y2Ba乙醇并煮沸30分钟,然后冷却并离心5分钟。收集上清液并重复该提取过程两次。蒸发上清液中的乙醇,将提取物还原至3ml以进行可溶性糖分析。通过加入2ml蒸馏水并沸腾15分钟进一步提取剩余的残余物。添加2ml 9.2 mol l后GydF4y2Ba-1GydF4y2BaHCLO.GydF4y2Ba4.GydF4y2Ba和冷却15分钟,混合物是离心10分钟。这个提取过程重复两次,浮在表面的淀粉醋酸anthrone-ethyl比色法分析的方法收集在630海里使用紫外-可见分光光度计测量吸光度(天秤座S22 Biochrom有限公司、剑桥、英国)。非结构性碳水化合物(NSC)含量计算为各器官可溶性糖和淀粉的总和。GydF4y2Ba
叶色素和气体交换的测量GydF4y2Ba
柑橘幼苗在温室条件下栽培。在收获幼苗(2019年3月)之前,使用便携式光合系统(CIARS-2,PP Systems,Herts,UK)在阳光灿烂的日子在9:00至11:00之间连续测量叶片的气体交换。根据该方法[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba],在光合光子通量密度(PPFD)为1000 μmol m的条件下,将叶片温度控制在27±0.5℃,相对湿度保持在45±1%GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba.最后,净光合速率(GydF4y2BaP.GydF4y2BaNGydF4y2Ba),气孔电导(GydF4y2BaGGydF4y2BaS.GydF4y2Ba),细胞间有限公司GydF4y2Ba2GydF4y2Ba专注 (GydF4y2BaCGydF4y2Ba一世GydF4y2Ba),蒸腾率(GydF4y2BaT.GydF4y2BaR.GydF4y2Ba)、光合水分利用效率(PWUE =GydF4y2BaP.GydF4y2BaNGydF4y2Ba/GydF4y2BaT.GydF4y2BaR.GydF4y2Ba)被测量。GydF4y2Ba
叶片叶绿素(CHL)A,CHL B和类胡萝卜素(汽车)从具有80%(v / v)丙酮的新鲜样品中提取,并按Lichtenthaler和Wellburn所述测量[GydF4y2Ba32.GydF4y2Ba].采用SPAD-502 Plus叶绿素仪(Minolta Camera, Osaka, Japan)测定叶片相对叶绿素含量,测定叶绿素指数(SPAD)。GydF4y2Ba
叶片Chl a荧光瞬变(OJIP)及相关参数测定GydF4y2Ba
在测量了气体交换后,柑橘幼苗在同一天适应了大约3小时的黑暗环境,并用Handy植物效率分析仪(Handy PEA, Hansatech Instruments Limited, Norfolk, UK)测量了叶片Chl a荧光瞬变(OJIP)和相关参数。PPFD (3000 μmol mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)由三个发光二极管(650nm)的阵列提供。基于MG供给组的植物上叶作为参考,我们计算了以下CHL荧光瞬态曲线:VGydF4y2BatGydF4y2Ba[GydF4y2BaV.GydF4y2BatGydF4y2Ba= (GydF4y2BaFGydF4y2BatGydF4y2Ba-GydF4y2BaFGydF4y2BaO.GydF4y2Ba)/ (GydF4y2BaFGydF4y2BamGydF4y2Ba-GydF4y2BaFGydF4y2BaO.GydF4y2Ba),相对可变荧光在t之间GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BamGydF4y2Ba), WGydF4y2BaK.GydF4y2Ba[GydF4y2BaW.GydF4y2BaK.GydF4y2Ba= (GydF4y2BaFGydF4y2BatGydF4y2Ba-GydF4y2BaFGydF4y2BaO.GydF4y2Ba)/ (GydF4y2BaFGydF4y2Ba300μs.GydF4y2Ba-GydF4y2BaFGydF4y2BaO.GydF4y2Ba),相对可变荧光在t之间GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2Ba300μs.GydF4y2Ba],以及ΔVGydF4y2BatGydF4y2Ba(相对可变荧光在t点的差异GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BamGydF4y2Ba参考控制处理)和ΔWGydF4y2BaK.GydF4y2Ba(相对可变荧光在t点的差异GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2Ba300μs.GydF4y2Ba参考控制治疗)。参数包括ΔK (t = 300 μs参比对照处理的相对可变荧光差异)、ΔJ (t = 2 ms参比对照处理的相对可变荧光差异)、ΔI (t = 30 ms参比对照处理的相对可变荧光差异)、进一步分析相对可变荧光在t = 150 μs对照处理下的差异。此外,我们计算了以下荧光参数:GydF4y2BaFGydF4y2BaO.GydF4y2Ba(T =20μs的最小荧光),GydF4y2BaFGydF4y2BamGydF4y2Ba(P-step处荧光最大),GydF4y2BaFGydF4y2BavGydF4y2Ba(可变荧光),GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BaO.GydF4y2Ba(PSII光化学的最大初级产率),GydF4y2BaFGydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba(GydF4y2Ba迪GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφDGydF4y2BaO.GydF4y2Ba,在T = 0的量子产量用于耗能),GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba(GydF4y2BaTRGydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφPGydF4y2BaO.GydF4y2Ba, t = 0时初级光化学的最大量子产额),GydF4y2Ba米ydF4y2BaO.GydF4y2Ba(近似荧光瞬态的初始斜率GydF4y2BaV.GydF4y2Ba = FGydF4y2BatGydF4y2Ba),GydF4y2BaABS.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba(每个反应中心吸收通量),GydF4y2Ba迪GydF4y2BaO.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba(t = 0时每个反应中心耗散的能量通量),GydF4y2BaφEGydF4y2BaO.GydF4y2Ba(GydF4y2Ba等GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba,T = 0的电子传输量子产量),GydF4y2BaφRGydF4y2BaO.GydF4y2Ba(GydF4y2Ba关于GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba,量子产率为每光子吸收的PSI最终受体的屈服率),和GydF4y2BaPI.GydF4y2BaABS,总计GydF4y2Ba(总性能指标,衡量PSI端电子受体的性能)[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].GydF4y2Ba
测定游离氨基酸(FAA)、可溶性蛋白和丙二醛(MDA)含量GydF4y2Ba
用10%冰醋酸从鲜根和鲜叶中提取可溶性蛋白,考马斯亮蓝法测定可溶性蛋白含量。采用Li等人描述的茚三酮法测定根和叶的总FAA含量[GydF4y2Ba27.GydF4y2Ba]和陈等人。[GydF4y2Ba29.GydF4y2Ba].用80%乙醇提取后,采用硫代巴比妥酸盐(TBA)法测定根和叶的丙二醛(MDA)含量。GydF4y2Ba
抗氧化酶测定GydF4y2Ba
冰冻的根和叶样品用于酶的测定。经50 mmol LGydF4y2Ba-1GydF4y2Bakh.GydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4.GydF4y2Ba-KOH (pH 7.5)含0.1 mmol LGydF4y2Ba-1GydF4y2Ba乙烯二胺四乙酸二钠盐(EDTA), 0.3% (w/v) Triton X-100和4% (w/v)不溶性聚乙烯醇聚吡啶烷酮(PVPP),抗氧化酶过氧化氢酶(CAT),过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性被测定[GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].GydF4y2Ba
统计分析GydF4y2Ba
所有数据采用SAS 9.3 (SAS Institute, Cary, NC, USA)进行单因素方差分析(ANOVA)。用最小显著性差异(LSD)检验比较平均值,设置统计显著性阈值为GydF4y2BaP.GydF4y2Ba< 0.05。采用SPSS 22 (IBM, Armonk, NY, USA)软件进行主成分分析(PCA),评价Mg处理组间枝条、上、下叶生长和生理特性的差异。GydF4y2Ba
结果GydF4y2Ba
Mg缺乏抑制父母和侧向植物生长GydF4y2Ba
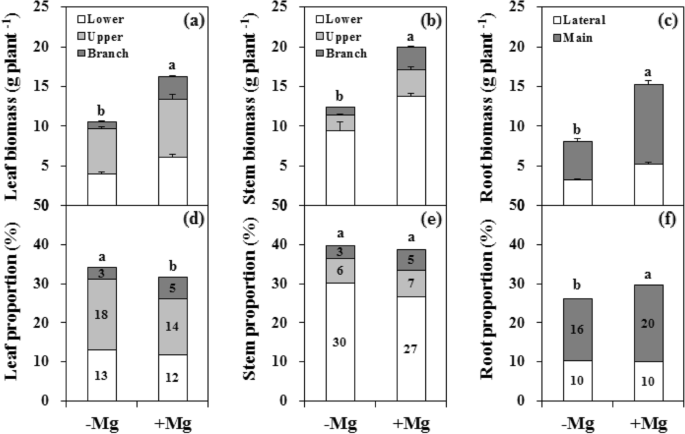
与Mg的充分相比,Mg缺乏症明显抑制柑橘植物生长,含有L1中静脉之间的氯化症状的典型症状(图。GydF4y2Ba1GydF4y2Ba;额外的文件GydF4y2Ba1GydF4y2Ba:图。S1)。根生物量减少(46.8%)大于茎(37.9%)和叶(34.9%)。父母和分支叶的生物质分别降低28.3%和66.2%,而茎生物质分别降低了31.5%和64.5%。生物质的减少大于LR的生物质。此外,Mg缺乏症改变了器官之间的生物质分布,叶片中的比例增加并在根中减少。然而,两组之间的茎的生物量没有差异。GydF4y2Ba
Biomass dry weight (a-c) and distribution (d-f) in leaf (a, d), stem (b, e), and root (c, f) organs of citrus seedlings grown under conditions of Mg deficiency (-Mg) and sufficiency (+ Mg). Leaf and stem biomasses were divided into the branch, upper and lower parts. Root biomass was divided into the main and lateral parts. Data are presented as mean ± standard deviation (NGydF4y2Ba= 5)。不同的字母代表MG治疗组之间的显着差异GydF4y2BaP.GydF4y2Ba< 0.05GydF4y2Ba
在植株生长特性方面,缺镁组的株高、PL数、分枝数、分枝长度和BL数分别降低了4.8%、9.0%、24.4%、37.1%和24.8%,第1枝高提高了47.3%GydF4y2Ba1GydF4y2Ba:图S2)。GydF4y2Ba
Mg缺乏症改变了叶特征和减少的根系形态发生GydF4y2Ba
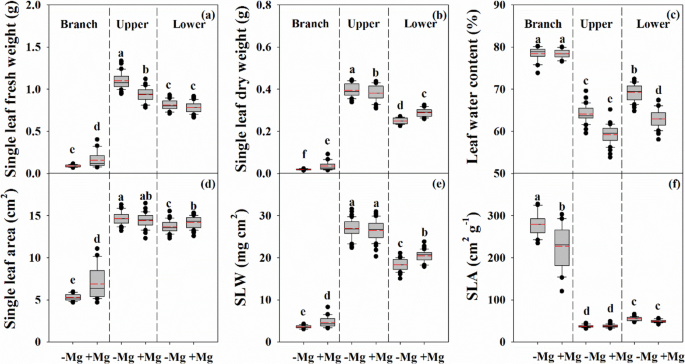
与充足Mg组相比,缺乏Mg组的UL单叶鲜重、干重和含水量均有所增加(图2)。GydF4y2Ba2GydF4y2Ba).相比之下,低叶油菜的单叶干重、叶面积和叶干重降低,叶片含水量增加。而缺镁组的单叶鲜重、干重、面积和叶重均低于缺镁组,而叶重增加。GydF4y2Ba
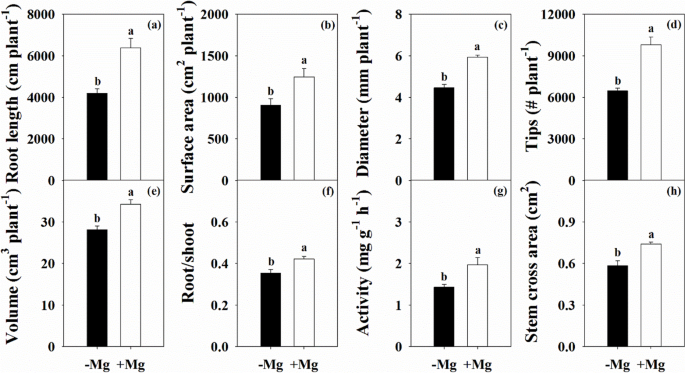
在叶片生长变量的变化之后,Mg缺乏也显着影响根形态参数,包括长度,表面积,平均直径,根尖尖端数和体积减少34.3%,27.2%,24.6%,34.0%,分别为18.0%(图。GydF4y2Ba3.GydF4y2Ba).此外,根/芽比,根系活性和茎交叉面积分别降低了16.0%,27.3%和21.2%。GydF4y2Ba
镁缺乏减少了镁的摄取,改变了镁的分布GydF4y2Ba
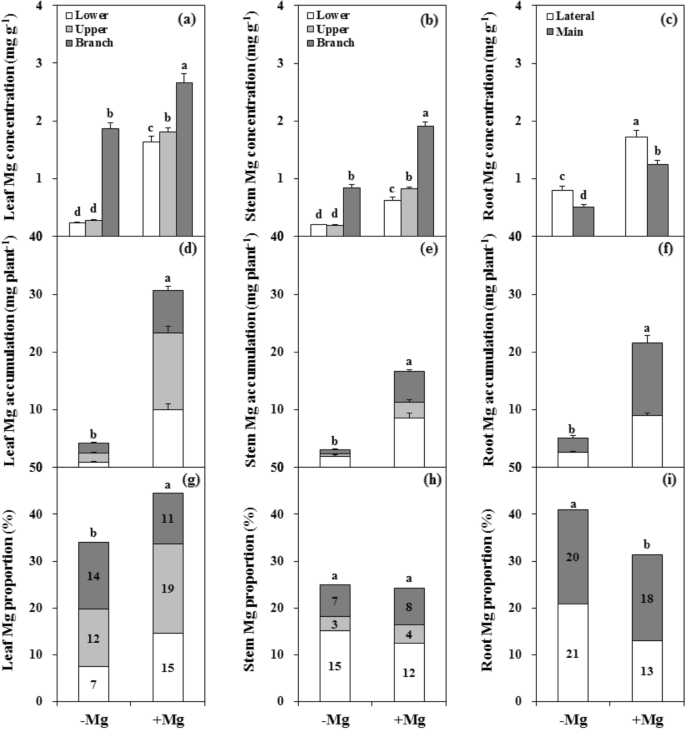
Mg缺乏的条件显着降低了柑橘植物不同组织中的Mg浓度(图。GydF4y2Ba4.GydF4y2Baa - c)。在亲本组织中,叶片和茎中Mg浓度分别降低了85.5%和72.5%。分枝组织中,叶片和茎中Mg浓度分别降低29.7%和55.7%。此外,MR(59.1%)和LR(53.5%)中Mg浓度均降低50%以上。然而,无论Mg处理条件如何,枝条组织的叶和茎中Mg浓度均显著高于亲本组织,且LR中Mg浓度始终高于MR中Mg浓度。GydF4y2Ba
在Mg缺乏条件下,植物中的总Mg累积减少了82.0%(图。GydF4y2Ba4.GydF4y2Bad-f)。根、茎、叶各器官Mg含量分别降低76.4%、81.5%和86.3%,其中分支组织(79.6%)的降低幅度小于亲本组织(86.4%)。镁在根中的分布比例增加,在叶中的分布比例减少,而在茎中的分布比例与镁充足条件下生长的植株无显著差异。Mg在PL中的比例降低和增加了LR(图。GydF4y2Ba4.GydF4y2Ba胃肠道)。GydF4y2Ba
MG缺乏抑制叶片光合作用容量GydF4y2Ba
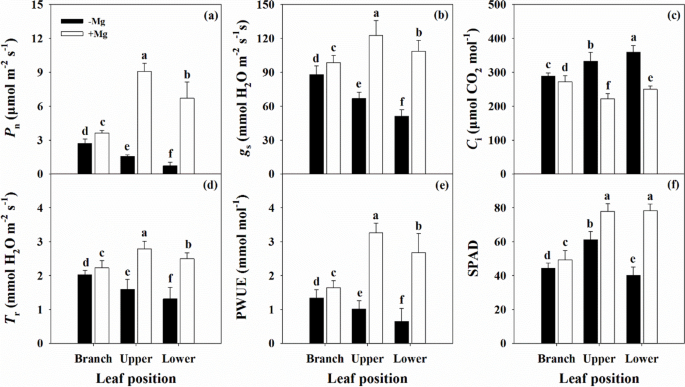
的参数GydF4y2BaP.GydF4y2BaNGydF4y2Ba那GydF4y2BaGGydF4y2BaS.GydF4y2Ba那GydF4y2BaT.GydF4y2BaR.GydF4y2Ba,而PWUE则因Mg缺乏而降低GydF4y2BaCGydF4y2Ba一世GydF4y2Ba叶片位置越低,其变化越剧烈。GydF4y2Ba5.GydF4y2Ba).对于叶绿素颜料的壳(附加文件)观察到类似的趋势(附加文件GydF4y2Ba1GydF4y2Ba:图。S3)。在Mg缺乏的叶子位置减少了CHL A,CHL B,CHL A + B和汽车内容物,在BL和UL中增加了CHL /轿厢,但在LL中减少了CHL / CAR。GydF4y2Ba
叶片净光合速率特征(GydF4y2BaP.GydF4y2BaNGydF4y2Ba,气孔导电(GydF4y2BaGGydF4y2BaS.GydF4y2Ba,b),细胞间有限公司GydF4y2Ba2GydF4y2Ba专注 (GydF4y2BaCGydF4y2Ba一世GydF4y2Ba,c),蒸腾率(GydF4y2BaT.GydF4y2BaR.GydF4y2Ba, d)、光合水分利用效率(PWUE, e)和SPAD值(f,GydF4y2BaNGydF4y2Ba = 40) in citrus seedlings grown under conditions of Mg deficiency (-Mg) and sufficiency (+ Mg). Data are presented as mean ± standard deviation (NGydF4y2Ba = 13). Different letters represent significant differences among organs between the Mg treatment groups atP.GydF4y2Ba< 0.05GydF4y2Ba
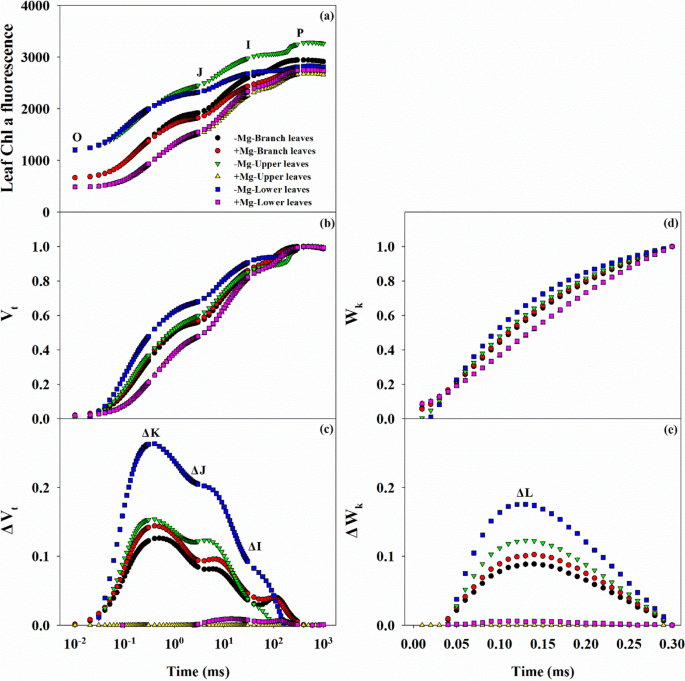
叶CHL的变化荧光瞬变可能有助于气体交换中的改变(图。GydF4y2Ba6.GydF4y2Ba).通常,有三种类型的Ojip曲线,在PL下观察到的最高水平,在Mg缺乏下,然后在MG处理条件下进行BL,并且PL的最低水平在Mg充足下(图。GydF4y2Ba6.GydF4y2Ba一种)。在V的曲线中也观察到类似的趋势GydF4y2BatGydF4y2Ba(或ΔV.GydF4y2BaT)GydF4y2Ba和W.GydF4y2BaK.GydF4y2Ba(或ΔWGydF4y2BaK.GydF4y2Ba),在缺镁的情况下,叶片的ΔK-, ΔJ-, ΔI-和ΔL-bands呈阳性,特别是LL(图2)。GydF4y2Ba6.GydF4y2Ba罪犯)。GydF4y2Ba
14个荧光参数的分析表明GydF4y2BaFGydF4y2BaO.GydF4y2Ba那GydF4y2BaFGydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba那GydF4y2Ba米ydF4y2BaO.GydF4y2Ba那GydF4y2BaABS.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba,GydF4y2Ba迪GydF4y2BaO.GydF4y2Ba/ RCGydF4y2Ba随着叶片位置降低的缺陷缺乏,而观察到相反的趋势GydF4y2BaFGydF4y2BavGydF4y2Ba那GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BaO.GydF4y2Ba那GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba那GydF4y2BaφEGydF4y2BaO.GydF4y2Ba,GydF4y2BaφRGydF4y2BaO.GydF4y2Ba(附加文件GydF4y2Ba1GydF4y2Ba:图。S4)。但是,除了GydF4y2BaFGydF4y2BavGydF4y2Ba,MG处理之间的BL中的任何参数都没有显着差异。最后,在mg缺乏的条件下,GydF4y2BaPI.GydF4y2BaABS,总计GydF4y2Ba在叶片位置上降低,其中PL的降低幅度大于BL。GydF4y2Ba
镁缺乏改变了相关的生理参数GydF4y2Ba
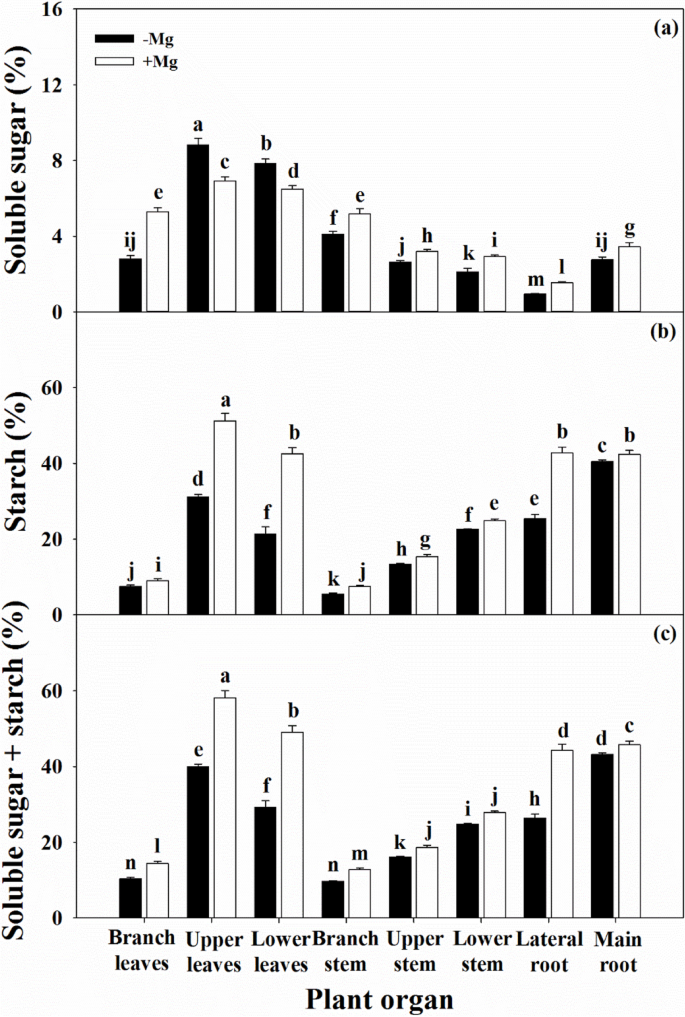
在缺镁条件下,叶片光合性能的降低将不可避免地导致同化物生产和向各器官运输的变化。GydF4y2Ba7.GydF4y2Ba).除PL中可溶性糖含量外,缺镁条件下各组织中可溶性糖和淀粉含量均显著低于缺镁条件下,导致NSC含量降低。GydF4y2Ba
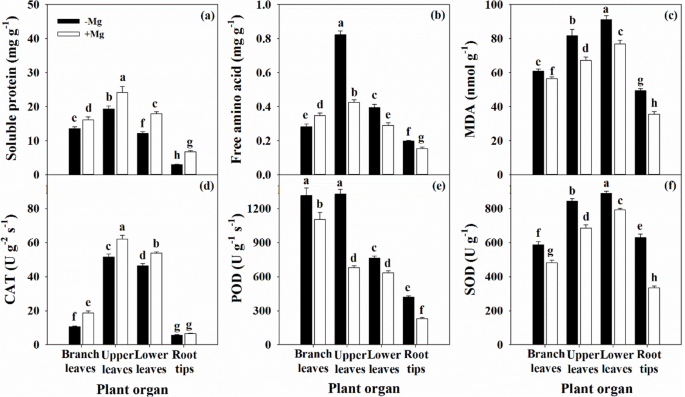
Mg缺乏症中可溶性蛋白质的生物合成显着降低(图。GydF4y2Ba8.GydF4y2Baa),与BL中的对FAA含量的影响相反(图。GydF4y2Ba8.GydF4y2Bab)。此外,Mg缺乏诱导的膜脂质的过氧化,其与叶片和根器官中MDA的显着积累有关(图。GydF4y2Ba8.GydF4y2BaC)。在Mg缺乏症下也增加了豆荚和SOD活性,而猫活性降低(图。GydF4y2Ba8.GydF4y2Bad-f)。GydF4y2Ba
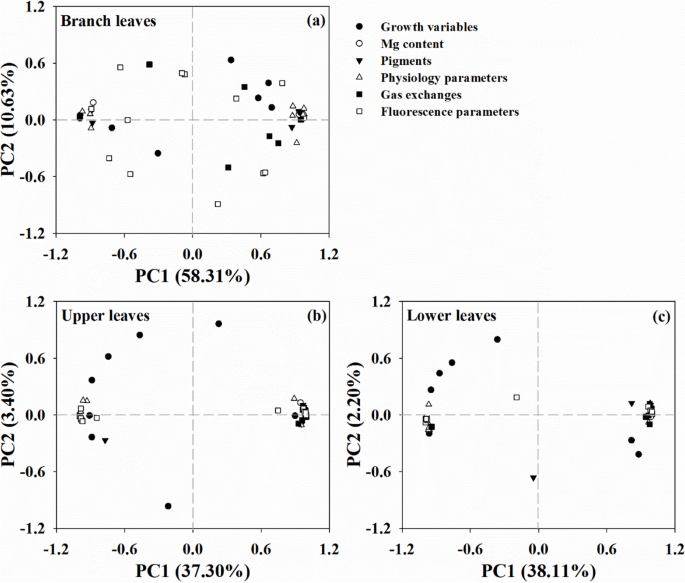
此外,MG处理基团之间的差异的PCA显示,在BL中,总变化高度分离,但在PL中高度聚集(图。GydF4y2Ba9.GydF4y2Ba).前两个组件占68.9%(PC1和PC2的5.3%58.3%),40.7%(PC1的37.3%,PC2 3.4%),40.3%(PC1和PC2的38.1%)分别对BL,UL和LL的总变化,并在PL中解释了BL的显着更高的变化。GydF4y2Ba
讨论GydF4y2Ba
MG缺乏抑制植物生长,并诱导形态和生物质分区的变化GydF4y2Ba
柑橘类植物的特点是对Mg的敏感性低,对Mg的需求高[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba25.GydF4y2Ba那GydF4y2Ba27.GydF4y2Ba].Mg缺乏可以影响生理和生化过程,从而最终影响植物生长,产量和果实质量[GydF4y2Ba19.GydF4y2Ba那GydF4y2Ba22.GydF4y2Ba那GydF4y2Ba26.GydF4y2Ba].我们的研究表明,柑橘植物生物质抑制了Mg缺乏,具有比芽更大的根抑制(图。GydF4y2Ba1GydF4y2Ba;额外的文件GydF4y2Ba1GydF4y2Ba:图S1),导致根/茎比降低(图S1)。GydF4y2Ba3.GydF4y2BaF)。这种变化反映了柑橘植物在应力条件下的生物质分配和适应性[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba].在缺乏镁对根/茎比的影响方面,以往的研究得出了不一致的结果,据报道香蕉根/茎比降低了[GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba]和柑橘[GydF4y2Ba35.GydF4y2Ba],而据报道,大米[GydF4y2Ba36.GydF4y2Ba)、玉米(GydF4y2Ba37.GydF4y2Ba,甜菜[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba),而GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba33.GydF4y2Ba].Hauer-jákli和Tränkner的荟萃分析[GydF4y2Ba5.GydF4y2Ba[揭示MG缺乏对根/芽比没有影响,而MG的充分对根生物质的效果比拍摄生物质的效果更积极。MG缺乏对本研究观察到的柑橘植物的根/芽比的影响与之前的报告不一致[GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba[米中还观察到根/芽中的动态变化[GydF4y2Ba39.GydF4y2Ba].这些结果表明,植物种类、预处理、Mg用量、培养时间和生长环境等因素可能影响生物量分配对缺镁的适应性策略[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba11.GydF4y2Ba那GydF4y2Ba39.GydF4y2Ba].此外,我们的结果表明,Mg缺乏对分支组织生长的抑制作用大于对亲本组织的抑制作用(图。GydF4y2Ba1GydF4y2Ba),突出了木质植物中MG营养的生理功能。GydF4y2Ba
根系是植物吸收养分和水分的主要器官,其形态和功能特征反映了植物对包括养分胁迫在内的环境胁迫的耐受性[GydF4y2Ba33.GydF4y2Ba].我们的结果表明,MG缺乏诱导柑橘植物中所有根形态参数的减少(图。GydF4y2Ba3.GydF4y2Ba).特别地,与LR的MR的生物质中存在更大的下降(图。GydF4y2Ba1GydF4y2Ba),这将不可避免地影响芽的属性,并抑制分枝生长(附加文件GydF4y2Ba1GydF4y2Ba:图S2)。在叶中,减少的干重与减少面积相关,导致下部SLW(图。GydF4y2Ba2GydF4y2Ba).有趣的是,Mg缺乏症下的叶片含水量高于父母在父母中的含量下的含水量,而对分支没有影响(图。GydF4y2Ba2GydF4y2Ba).这些发现表明,镁缺乏调节了柑橘植株的水循环特性,这是PWUE较低的原因(图。GydF4y2Ba5.GydF4y2Bae)。Tränkner等人报道了MG供应和水摄取之间的关系。[GydF4y2Ba40GydF4y2Ba研究发现,Mg缺乏降低了大麦植株的总生物量和地上部WUE,但提高了叶片WUE。这些结果解释了在缺镁条件下,亲本和分支组织不同器官的生物量减少,并改变了其分配。这些变化进一步反映了缺镁对柑橘类植物生理生态功能的负面影响。GydF4y2Ba
镁缺乏会降低植物对镁的吸收,但会促进镁从老器官向新器官的运输GydF4y2Ba
以前的研究表明,植物生长和MG摄取受许多植物中MG供应的影响,包括谷物[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba37.GydF4y2Ba], 蔬菜 [GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba41.GydF4y2Ba)、水果(GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba33.GydF4y2Ba和其他植物[GydF4y2Ba42.GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba];然而,镁在植物体内的转运和分配机制尚不清楚,特别是在柑橘植株的亲本和分支组织中。在本研究中,与充足Mg条件下生长的柑橘植株相比,缺镁条件下柑橘植株各器官中Mg浓度和累积量明显降低,叶片中Mg比例增加,根系中Mg比例降低,但对茎没有影响(图2)。GydF4y2Ba4.GydF4y2Ba).令人惊讶的是,无论Mg条件如何,分支组织的叶片和茎干中的Mg浓度显着高于母体中的叶片,而Mg浓度在LR中比MR中的浓度高于Mg(图。GydF4y2Ba4.GydF4y2Ba).这些结果表明,Mg在柑橘植株中从亲本迁移到枝条的能力更强,枝条和LR中较高的Mg浓度可能与维持其生理功能有关。GydF4y2Ba
普遍认为,植物的Mg反弹能力决定了对MG缺乏的适应响应[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba44.GydF4y2Ba].Ye等人[GydF4y2Ba9.GydF4y2Ba[据报道,在Mg缺乏条件下柑橘植物中的叶绿血中叶绿血增长降低,叶Mg浓度降低,Li等人报告了类似的观察结果。[GydF4y2Ba27.GydF4y2Ba].与充足Mg相比,缺乏Mg时分支器官相对于母体器官的Mg浓度有所提高(图2)。GydF4y2Ba4.GydF4y2Ba).这些结果进一步说明了柑橘植株的高镁转运能力,在缺乏镁的情况下,镁从亲本转移到分支器官的能力增强。据此,他等人[GydF4y2Ba33.GydF4y2Ba]报道,缺镁降低了香蕉植株各组织的Mg浓度,且随着栽培时间的延长,老叶向新叶的Mg转运能力增加。然而,我们的研究结果强调了从亲本到分支组织镁运输能力对柑橘植株镁缺乏反应的影响。这一现象解释了不同亲本和分支器官组织镁缺乏引起的光合作用及相关生理参数的变化。GydF4y2Ba
MG缺乏损害光合系统并诱导相对代谢障碍GydF4y2Ba
光合作用负责植物的物质和能量的生产。这种生理过程对环境因素高度敏感,如Mg状态[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba].通常,Mg缺乏限制光合作用并有助于降低植物生长,主要是通过其影响CO的能力GydF4y2Ba2GydF4y2Ba固定,运输和照片同化的分布。这与我们的结果一致,表明气体交换参数,包括GydF4y2BaP.GydF4y2BaNGydF4y2Ba那GydF4y2BaGGydF4y2BaS.GydF4y2Ba,GydF4y2BaT.GydF4y2BaR.GydF4y2Ba,被显着降低,而GydF4y2BaCGydF4y2Ba一世GydF4y2Ba增加,特别是在亲本叶片(图。GydF4y2Ba5.GydF4y2Ba).在蚕豆中也有类似的结果[GydF4y2Ba41.GydF4y2Ba,表示较低GydF4y2BaP.GydF4y2BaNGydF4y2BaMg缺乏叶可能会受到气孔因素的影响。相比之下,赫尔曼等人。[GydF4y2Ba12.GydF4y2Ba[易缺陷通过减少CHL A和B含量,MG缺陷改变了PSI和PSII的生理功能。这也得到了杨等人的支持。[GydF4y2Ba31.GydF4y2Ba和Ye等人[GydF4y2Ba9.GydF4y2Ba]据报道,MG缺乏症在柑橘叶中光合电子传输能力的改变。这些结果表明叶子有效减少了GydF4y2Ba2GydF4y2BaMg缺乏症引起的同化与气孔和非气孔因素有关。我们的结果表明,MG缺陷降低了CHL含量并改变了叶组织中的CHL荧光参数(图。GydF4y2Ba6.GydF4y2Ba;额外的文件GydF4y2Ba1GydF4y2Ba:图。S3和S4),其指示PSII的较低能量交换和转移或高能量激发,以及PSI中的电子传输受体的减少[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].镁缺乏导致GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BamGydF4y2Ba并减少GydF4y2BaFGydF4y2BavGydF4y2Ba,导致减少GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba比率(附加文件GydF4y2Ba1GydF4y2Ba:图。S4)。这些发现表明,Mg缺乏损失了紫胶素结构,同时诱导光抑制和光氧化损伤。简而言之,来自PSII供体侧的整个光合电子传输链对PSI的受体侧可能负责CO的下降GydF4y2Ba2GydF4y2Ba在缺镁叶中的同化[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba],对枝叶的影响很小。但是,Tränkner和Jaghdani [GydF4y2Ba45.GydF4y2Ba[据报道,生物质和产率形成所需的临界Mg浓度高于小麦和向日葵植物的光合过程所需的临界Mg浓度,并揭示了Mg缺乏率通过限制Co诱导光氧化应力GydF4y2Ba2GydF4y2Ba同化但不是限制光合光线利用[GydF4y2Ba46.GydF4y2Ba].GydF4y2Ba
Mg缺乏减少光合作用产品的生物合成,同时诱导NSC在许多植物的叶片中的积累,例如甜菜[GydF4y2Ba10.GydF4y2Ba], 咖啡 [GydF4y2Ba43.GydF4y2Ba)、小麦(GydF4y2Ba13.GydF4y2Ba]和香蕉[GydF4y2Ba33.GydF4y2Ba,从而解释了镁缺乏限制同化物从源向库运输的能力。此外,高可溶性糖含量的叶片也可能通过反馈机制抑制光合作用[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba12.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba].在本研究中,除PL的可溶性糖含量增加外,Mg缺乏降低了不同器官可溶性糖和淀粉的NSC含量(图2)。GydF4y2Ba7.GydF4y2Ba).这些结果解释了长期缺镁对柑橘次生器官生长的综合影响。在缺乏镁的柑橘园也有类似的结果[GydF4y2Ba18.GydF4y2Ba].相比之下,在糖甜菜中的Mg缺乏下,在根中含有较低的NSC含量的植物叶片中的较高的NSC积聚也始终观察到[GydF4y2Ba10.GydF4y2Ba),柑橘类(GydF4y2Ba27.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba]和香蕉[GydF4y2Ba34.GydF4y2Ba植物。然而,Mg营养状况与光合作用或碳水化合物运输之间的关系存在争议,Hermans等[GydF4y2Ba10.GydF4y2Ba结果表明,Mg缺乏可增强其表达GydF4y2BaBvSUT1GydF4y2Ba编码蔗糖/H伴侣的基因GydF4y2Ba+GydF4y2Ba叙述者,但没有影响蔗糖加载到韧皮中,导致叶片中的蔗糖积聚。此外,解剖学研究表明,Mg缺乏诱导血管挂钩和叶子海绵状实质中的细胞壁瘫痪,从而影响柑橘植物中的叶片同化运输[GydF4y2Ba38.GydF4y2Ba].GydF4y2Ba
除枝叶FAA含量外,各器官可溶性蛋白含量均降低,FAA含量均升高(图2)。GydF4y2Ba8.GydF4y2Baa、b)。Jin等人也观察到了类似的结果[GydF4y2Ba47.GydF4y2Ba研究发现,在Mg缺乏条件下,叶片中可溶性蛋白显著降低,而根中则没有。李等人[GydF4y2Ba27.GydF4y2Ba研究表明,Mg缺乏降低了叶片中可溶性蛋白和FAA含量,特别是在弱Mg胁迫下。根和叶中氮代谢所需的NR、GS和GOGAT酶活性均受到抑制;这一发现也得到了Ding等人的支持[GydF4y2Ba36.GydF4y2Ba].Ye等人[GydF4y2Ba9.GydF4y2Ba结果表明,在缺镁条件下,随着叶龄的增加,叶片中N含量降低,而叶脉中N含量没有降低。相反,Jezek等人[GydF4y2Ba37.GydF4y2Ba]发现GS介导的Grutamine合成来自FAA和叶片中的谷氨酰胺合成不会受到Mg缺乏的损害,表明在这些条件下,蛋白质含量的降低是不可避免的。这些结果表明,Mg缺乏损失柑橘植物中的N吸收和代谢,并通过柠檬树中观察到的N和MG之间的阳性相互作用来支持[GydF4y2Ba16.GydF4y2Ba]和饲用植物[GydF4y2Ba48.GydF4y2Ba].此外,Mg支持大豆吸收氮的机制已被证实[GydF4y2Ba49.GydF4y2Ba].Huang et al. [GydF4y2Ba38.GydF4y2Ba和Ye等人[GydF4y2Ba9.GydF4y2Ba据报道,MG缺陷改变了柑橘植物中其他营养物的浓度。GydF4y2Ba
值得一提的是GydF4y2BaP.GydF4y2BaNGydF4y2Ba随着叶中的MDA含量增加而降低(图。GydF4y2Ba8.GydF4y2Bac),表明叶绿体膜脂质的变化可能与降低的CO相关有关GydF4y2Ba2GydF4y2BaMg缺乏诱导的同化[GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].此外,Root中较高的MDA含量反映了生理功能的降低,例如根系活性(图。GydF4y2Ba3.GydF4y2Ba有趣的是,在本研究中,抗氧化系统并不总是在Mg缺乏下受损,我们观察到叶片和根器官中抗氧化酶POD和SOD活性升高,而CAT活性降低(图2)。GydF4y2Ba8.GydF4y2Bad-f)。Tang等人。[GydF4y2Ba18.GydF4y2Ba据报道,柑橘植物中的Mg缺乏叶具有适应性能力,以避免通过抗氧化代谢的上调造成光氧化损伤;Cakmak和Kirkby也支持这一发现[GydF4y2Ba3.GydF4y2Ba和Farhat等[GydF4y2Ba4.GydF4y2Ba].Shang和Feierabend [GydF4y2Ba50.GydF4y2Ba据报道,猫对照片灭活敏感,导致叶绿体光利用能力有限造成的氧化损伤。该过程可以诱导或加剧Mg缺乏[GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba那GydF4y2Ba42.GydF4y2Ba].此外,结合MG缺乏对光合电子传输的无源效果(图。GydF4y2Ba6.GydF4y2Ba;额外的文件GydF4y2Ba1GydF4y2Ba:图S4),这一现象表明,抗氧化系统无法应对镁缺乏引起的光氧化损伤。这些结果进一步支持了缺镁会破坏柑橘类植物抗氧化系统的观点[GydF4y2Ba18.GydF4y2Ba那GydF4y2Ba28.GydF4y2Ba那GydF4y2Ba31.GydF4y2Ba].类似的结果在其他植物中也有报道,如桑树[GydF4y2Ba42.GydF4y2Ba,以及咖啡[GydF4y2Ba43.GydF4y2Ba].GydF4y2Ba
综合分析还揭示了不同位置叶片形态学和生理参数的变化。发现父母和分支叶之间的变化显着分离,在分支叶中具有比父叶中的细菌程度更高的聚类(图。GydF4y2Ba9.GydF4y2Ba).Ye等人也观察到了类似的结果[GydF4y2Ba9.GydF4y2Ba他发现,在缺镁柑橘植株中,光合参数的变化随着叶龄的增加而聚集。这些结果表明,枝条叶片的高度分离可能与Mg浓度的差异有关,进一步说明从亲本向枝条转移的高Mg浓度导致了叶片位置的差异。随着研究的进展,柑桔类植物对镁缺乏反应的分子机制逐渐被揭示。Jin等人利用cDNA-AFLP方法[GydF4y2Ba47.GydF4y2Ba]报道Mg缺乏分别诱导根和叶中71和70个基因的差异表达,Yang等[GydF4y2Ba35.GydF4y2Ba]利用RNA-Seq方法在缺镁叶片中共鉴定了4864个差异表达基因。梁等人[GydF4y2Ba51.GydF4y2Ba]在Mg缺乏的根组织中报道了170个差异表达的微小RNA(101调节和69个下调),而在叶组织中发现146(上调和71个下调)[GydF4y2Ba52.GydF4y2Ba].彭等人[GydF4y2Ba53.GydF4y2Ba在Mg缺乏条件下,还在叶片组织中鉴定了90个差异表达的蛋白质(59调节和31个下调),而在根组织中鉴定了31例(1999℃下调和12个下调)。这些差异表达的基因,MicroRNA和蛋白质主要在碳水化合物和能量代谢,蛋白质代谢,细胞壁和细胞骨架代谢,核酸代谢,脂质代谢,细胞输送,应力反应和抗氧化系统[GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba47.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba那GydF4y2Ba53.GydF4y2Ba].代谢组学进一步揭示了MG缺乏增加了脂质和脂质样分子的丰度,但柑橘叶中的苯丙醇和聚酮化合物的丰度降低了[GydF4y2Ba54.GydF4y2Ba].此外,赫尔曼等人。[GydF4y2Ba55.GydF4y2Ba]确定了Mg缺乏和叶子昼夜时钟之间的关系,而Li等人则。[GydF4y2Ba15.GydF4y2Ba]揭示了这个过程和基础机制GydF4y2Baosmgt3.GydF4y2Ba转运蛋白受叶绿体中的Mg波动并有助于水稻的光合作用。GydF4y2Ba
结论GydF4y2Ba
在本研究中,我们首次报道了缺镁对柑橘幼苗枝条生长的影响。缺镁直接抑制了柑橘植株对Mg的吸收,改变了Mg从亲本向枝条的运输和迁移。然后通过降低叶片色素水平和削弱光合电子传递链来降低光合生产力。此外,镁缺乏还间接引起了相关的生理紊乱,最终破坏了亲本和分支组织之间的平衡。主成分分析还表明,分枝叶变异具有较高的分离度,亲本叶变异具有较高的聚类度。这些发现为镁供应状态通过调节镁的吸收和生理代谢影响柑橘植株生长的概念提供了支持。综上所述,研究结果表明,Mg的迁移与柑橘侧枝器官的生长呈正相关关系,有助于制定提高柑橘产量的Mg管理策略。GydF4y2Ba
可用性数据和材料GydF4y2Ba
所有数据维持该研究的结果都包含在本文中及其补充信息文件中。在该研究期间生成或分析的其他数据集可在相应作者(Jiuxin Guo)的合理请求上获得。GydF4y2Ba
缩写GydF4y2Ba
- Mg:GydF4y2Ba
-
镁GydF4y2Ba
- -mg:GydF4y2Ba
-
Mg不足GydF4y2Ba
- + Mg:GydF4y2Ba
-
MG充足GydF4y2Ba
- 先生:GydF4y2Ba
-
主要根源GydF4y2Ba
- LR:GydF4y2Ba
-
侧根GydF4y2Ba
- PS:GydF4y2Ba
-
父母词条GydF4y2Ba
- 我们:GydF4y2Ba
-
上阀杆GydF4y2Ba
- LS:GydF4y2Ba
-
下茎在PS中GydF4y2Ba
- BS:GydF4y2Ba
-
分支杆GydF4y2Ba
- PL:GydF4y2Ba
-
父母离开GydF4y2Ba
- UL:GydF4y2Ba
-
上部叶子在plGydF4y2Ba
- 二:GydF4y2Ba
-
较低的叶子在PL中GydF4y2Ba
- BL:GydF4y2Ba
-
分支叶子GydF4y2Ba
- SLW:GydF4y2Ba
-
特定叶重量GydF4y2Ba
- SLA:GydF4y2Ba
-
比叶面积GydF4y2Ba
- NSC:GydF4y2Ba
-
非结构性碳水化合物GydF4y2Ba
- 排名:GydF4y2Ba
-
叶绿素GydF4y2Ba
- 汽车:GydF4y2Ba
-
类胡萝卜素GydF4y2Ba
- Spad:GydF4y2Ba
-
相对叶绿素含量GydF4y2Ba
- PPFD:GydF4y2Ba
-
光合光子通量密度GydF4y2Ba
- P.GydF4y2BaNGydF4y2Ba:GydF4y2Ba
-
净光合速率GydF4y2Ba
- GGydF4y2BaS.GydF4y2Ba:GydF4y2Ba
-
气孔电导GydF4y2Ba
- CGydF4y2Ba一世GydF4y2Ba:GydF4y2Ba
-
外细胞CO.GydF4y2Ba2GydF4y2Ba专注GydF4y2Ba
- T.GydF4y2BaR.GydF4y2Ba:GydF4y2Ba
-
蒸腾率GydF4y2Ba
- PWUE:GydF4y2Ba
-
光合作用中水回用效率GydF4y2Ba
- Ojip:GydF4y2Ba
-
叶绿素荧光瞬态的暗适应GydF4y2Ba
- V.GydF4y2BatGydF4y2Ba:GydF4y2Ba
-
t之间的相对变量荧光GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BamGydF4y2Ba
- W.GydF4y2BaK.GydF4y2Ba:GydF4y2Ba
-
t之间的相对变量荧光GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2Ba300μ.GydF4y2BaS.GydF4y2Ba
- ΔVGydF4y2BatGydF4y2Ba:GydF4y2Ba
-
相对可变荧光在t点的差异GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2BamGydF4y2Ba参考控制治疗GydF4y2Ba
- ΔWGydF4y2BaK.GydF4y2Ba:GydF4y2Ba
-
相对可变荧光在t点的差异GydF4y2BaFGydF4y2BaO.GydF4y2Ba和GydF4y2BaFGydF4y2Ba300μ.GydF4y2BaS.GydF4y2Ba参考控制治疗GydF4y2Ba
- Δ凯西:GydF4y2Ba
-
相对可变荧光在t = 300 μs对照处理下的差异GydF4y2Ba
- Δ珍:GydF4y2Ba
-
相对可变荧光在t = 2ms对照处理中的差异GydF4y2Ba
- Δ我:GydF4y2Ba
-
相对可变荧光在t = 30 ms对照处理中的差异GydF4y2Ba
- ΔL:GydF4y2Ba
-
相对可变荧光在t = 150 μs对照处理下的差异GydF4y2Ba
- FGydF4y2BaO.GydF4y2Ba:GydF4y2Ba
-
T =20μs的最小荧光GydF4y2Ba
- FGydF4y2BamGydF4y2Ba:GydF4y2Ba
-
P-Step的最大荧光GydF4y2Ba
- FGydF4y2BavGydF4y2Ba:GydF4y2Ba
-
可变荧光GydF4y2Ba
- FGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BaO.GydF4y2Ba:GydF4y2Ba
-
PSII光化学的最大产量GydF4y2Ba
- FGydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba:GydF4y2Ba
-
迪GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφDGydF4y2BaO.GydF4y2Ba,T = 0的量子产量用于耗能GydF4y2Ba
- FGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba:GydF4y2Ba
-
TRGydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφPGydF4y2BaO.GydF4y2Ba, t = 0 .时初级光化学的最大量子产额GydF4y2Ba
- 米ydF4y2BaO.GydF4y2Ba:GydF4y2Ba
-
荧光瞬态V =的近似初始斜率V = FGydF4y2BatGydF4y2Ba
- ABS.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba:GydF4y2Ba
-
每个反应中心的吸收通量GydF4y2Ba
- 迪GydF4y2BaO.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba:GydF4y2Ba
-
在T = 0时,每个反应中心耗散能量通量GydF4y2Ba
- φEGydF4y2BaO.GydF4y2Ba:GydF4y2Ba
-
等GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba,在T = 0时电子传输量子产率GydF4y2Ba
- φRGydF4y2BaO.GydF4y2Ba:GydF4y2Ba
-
关于GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba,量子产量为每光子吸收的PSI最终受体的屈服GydF4y2Ba
- PI.GydF4y2BaABS,总计GydF4y2Ba:GydF4y2Ba
-
总性能指标,测量PSI最终电子受体的性能GydF4y2Ba
- FAA:GydF4y2Ba
-
自由氨基酸GydF4y2Ba
- MDA:GydF4y2Ba
-
丙二醛GydF4y2Ba
- 猫:GydF4y2Ba
-
过氧化氢酶GydF4y2Ba
- 荚:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- 草皮:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
- PCA:GydF4y2Ba
-
主成分分析GydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Verbruggen N,弗尔曼C.对植物中镁营养不平衡的生理和分子反应。植物土壤。2013; 368:87-99。GydF4y2Ba
- 2。GydF4y2Ba
陈ZC,彭Wt,李继,廖H。植物中镁的功能性解剖和运输机制。Semin Cell Dev Biol。2018; 74:142-52。GydF4y2Ba
- 3。GydF4y2Ba
Cakmak I,Kirkby Ea。镁在碳分区和减轻光氧化损伤中的作用。physiol platararum。2008; 133:692-704。GydF4y2Ba
- 4.GydF4y2Ba
王志强,王志强,王志强,等。缺镁对水稻光合作用和碳水化合物分配的影响。植物学报,2016;38:145。GydF4y2Ba
- 5。GydF4y2Ba
叶镁临界阈值和镁对植物生长和光氧化防御的影响:来自70年研究的系统综述和meta分析。植物学报。2019;10:766。GydF4y2Ba
- 6。GydF4y2Ba
王志强,张峰,李雪梅,张峰,李雪梅。施用镁对作物产量影响的meta分析。Front Plant Sci. 2020;10:1727。GydF4y2Ba
- 7.GydF4y2Ba
White PJ, Broadley先生用人类饮食中经常缺乏的七种矿物质元素——铁、锌、铜、钙、镁、硒和碘——对作物进行生物强化。新植醇。2009;182:48 - 82。GydF4y2Ba
- 8.GydF4y2Ba
王志强,王志强,王志强,等。镁在农业中的作用:植物-土壤连续体。作物生态学报2015;66:1219-29。GydF4y2Ba
- 9.GydF4y2Ba
ye x,陈xf,deng cl,yang lt,lai nw,guo jx,chen ls。缺乏对颜料,光合作用和叶片光合电子传输的缺乏影响,以及叶片和静脉的养分GydF4y2Ba柑橘sinensis.GydF4y2Ba幼苗。植物。2019; 8:389。GydF4y2Ba
- 10.GydF4y2Ba
缺镁改变了甜菜幼叶中糖的分配和韧皮部的负荷。足底。2005;220:541-9。GydF4y2Ba
- 11.GydF4y2Ba
Chen Hb,风扇XL。镁复合和分配对香蕉植物生长的影响。J植物Nutr。2018; 41:1312-20。GydF4y2Ba
- 12.GydF4y2Ba
Hermans C,Johnson Gn,Strasser RJ,韦尔伯邦N.甘蔗镁缺乏的生理特征:对低镁的适应性影响光系统I和II。Planta。2004; 220:344-55。GydF4y2Ba
- 13。GydF4y2Ba
在小麦生长培养基和叶片上施镁可影响淀粉分布,增加籽粒大小,促进种子萌发。土壤植物。2016;406:145-56。GydF4y2Ba
- 14。GydF4y2Ba
张磊,彭勇,李军,田旭,陈志强。GydF4y2Baosmgt1.GydF4y2Ba通过增强米饭中的镁的进口来赋予镁缺乏缺乏症的抗性。int j mol sci。2019; 20:207。GydF4y2Ba
- 15.GydF4y2Ba
李吉,横须世k,刘某,曹操,玉马n,朱克,廖h,ma jf,陈血管。叶绿体中的Diel镁波动有助于水稻中的光合作用。Nat植物。2020; 6:848-59。GydF4y2Ba
- 16。GydF4y2Ba
Baaretto RM,Hippler FWR,Ferreira Ga,Azevedo Ra,Quaggio Ja,Mattos-JR D.额外镁和氮气供应的可能作用,以减轻柠檬树中高辐射和温度引起的应力。植物土壤。2020; 457:57-70。GydF4y2Ba
- 17。GydF4y2Ba
Liu Y,Heying E,Tanumihardjo SA。柑橘水果的历史,全球分布和营养重要性。Crome Rev Food Sci Food Saf。2012; 11:530-45。GydF4y2Ba
- 18.GydF4y2Ba
唐宁,李勇,陈林林。缺镁对结果期叶片光合作用的影响GydF4y2Ba柑橘网?GydF4y2Ba树木伴随着抗氧化代谢的上调,以避免光氧化损伤。J植物Nutr土壤SCI。2012; 175:784-93。GydF4y2Ba
- 19.GydF4y2Ba
李勇,韩美梅,林飞,十勇,林杰,朱德辉,郭鹏,翁玉波,陈林林。闽南地区土壤化学性质、关西密优柚叶矿质营养状况及果实品质中国土壤与植物营养学报。2015;15:615-28。GydF4y2Ba
- 20。GydF4y2Ba
郭军,杨军,张丽,陈辉,贾勇,王智,王东,廖伟,陈林生,李勇。南方酸性红壤丘陵区柚园土壤化学质量较低。土壤学报。2019;19:2752-63。GydF4y2Ba
- 21。GydF4y2Ba
Quaggio JA, Sobrinho JT, Dechen AR.镁对兰普尔酸橙“瓦伦西亚”甜橙产量和品质的影响。中国科学(d辑:生命科学)1992;GydF4y2Ba
- 22。GydF4y2Ba
湿润的热带印度柑橘园营养限制的诊断。植物营养学报。2006;29:1061-76。GydF4y2Ba
- 23。GydF4y2Ba
Morton Ar,Trolove Sn,Kerekhoffs LJH。在新西兰的吉斯伯勒区种植的柑橘的镁缺乏。新的热情J裁剪座位。2008; 36:199-214。GydF4y2Ba
- 24。GydF4y2Ba
Mattos D JR,Quaggio Ja,Cantarella H,Alva Ak。哈姆林甜橙树的生物质组分的营养含量。SCI农业。2003; 60:155-60。GydF4y2Ba
- 25。GydF4y2Ba
Roccuzzo G, Zanotelli D, Allegra M, Giuffrida A, Torrisi BF, Leonardi A, Quiñones A,耐特利olo F, Tagliavini M.评估田间种植的橘子树的营养吸收。Eur J Agron. 2012; 41:73-80。GydF4y2Ba
- 26。GydF4y2Ba
周颖,何伟,郑伟,谭强,谢忠,郑超,胡晨。6个柑橘品种果实中果糖和有机酸对Mg的影响显著。食品化学。2018;259:278 - 85。GydF4y2Ba
- 27.GydF4y2Ba
李翠萍,齐艳萍,张健,杨丽萍,王德辉,叶鑫,赖宁西,谭丽丽,林丹,陈林林。镁缺乏对根、上、下叶气体交换、主要代谢产物和关键酶的影响存在差异GydF4y2Ba柑橘sinensis.GydF4y2Ba幼苗。树生理。2017; 37:1564-81。GydF4y2Ba
- 28.GydF4y2Ba
蔡永涛,张辉,齐艳萍,叶霞,黄志荣,郭建新,陈林生,杨少强。不同根、上下叶活性氧和甲基乙二醛代谢对缺镁的响应差异很大GydF4y2Ba柑橘sinensis.GydF4y2Ba.BMC植物BIOL。2019; 19:76。GydF4y2Ba
- 29.GydF4y2Ba
陈辉,贾勇,徐辉,王勇,周勇,黄智,杨玲,李勇,陈林生,郭军。铵态氮对柑橘幼苗生长和氮素吸收的影响。Sci Hortic。2020;272:109526。GydF4y2Ba
- 30.GydF4y2Ba
Ribeiro RV, Machado EC, Habermann G, Santos MG, Oliveira RF。柑桔树光合作用与叶片碳水化合物关系的季节效应acta botanica botanica(云南植物研究). 2012;39:471-80。GydF4y2Ba
- 31.GydF4y2Ba
杨g,杨,姜hx,李啊,王p,陈ls。镁缺乏的生理影响GydF4y2Ba柑橘类GydF4y2Ba幼苗:光合作用、抗氧化系统和碳水化合物。树结构功能。2012;26:1237-50。GydF4y2Ba
- 32.GydF4y2Ba
Lichtenthaler HK,Wellburn Ar。不同溶剂中叶提取物的总类胡萝卜素和叶绿素A和B的测定。Biochem Soc Trans。1983; 11:591-2。GydF4y2Ba
- 33.GydF4y2Ba
植物如何通过生物量分配来应对养分短缺?植物学报,2006;11:610-7。GydF4y2Ba
- 34.GydF4y2Ba
关键词:缺镁香蕉,生物量分配,组织营养,碳水化合物,叶面施镁Sci Hortic。2020;268:109377。GydF4y2Ba
- 35.GydF4y2Ba
杨,周yf,王yy,吴ym,ye x,guo jx。Chen LS镁缺乏诱导全球转录组变化GydF4y2Ba柑橘sinensis.GydF4y2BaRNA-SEQ揭示的叶子。int j mol sci。2019; 20:3129。GydF4y2Ba
- 36。GydF4y2Ba
丁颖,罗伟,徐刚。水稻镁营养特征及镁钾互作研究。Ann Appl Biol. 2006; 149:111-23。GydF4y2Ba
- 37。GydF4y2Ba
Jezek M,Geilfus Cm,Mhling Kh。谷氨酰胺合成酶活性在叶子中GydF4y2BaZea Mays.GydF4y2BaL.受镁状况的影响。Planta。2015; 242:1309-19。GydF4y2Ba
- 38。GydF4y2Ba
黄杰,徐茹,叶X,罗泰,任lh,风扇gc,qi yp,li q,ferrarezi r,chen ls。镁缺乏影响血管系统的二次瘫痪GydF4y2Ba柑橘sinensis.GydF4y2Ba幼苗。树木结构功能。2019; 33:171-82。GydF4y2Ba
- 39。GydF4y2Ba
丁Y,徐G.低镁,高钾供应,在水稻叶片的可见镁缺乏之前改变糖分配和根生长模式(GydF4y2Ba奥雅萨苜蓿GydF4y2BaL.)。am j植物sci。2011; 2:601-8。GydF4y2Ba
- 40。GydF4y2Ba
Tränkner M, Jákli B, Tavakol E, Geilfus CM, Cakmak I, Dittert K, Senbayram M.缺镁降低了大麦植株生物量水分利用效率,增加了叶片水分利用效率和氧化胁迫。土壤植物。2016;406:409-23。GydF4y2Ba
- 41。GydF4y2Ba
Hariadi Y, Shabala S.筛选蚕豆(GydF4y2Ba维亚比亚法瓦GydF4y2Ba)来治疗镁缺乏。2光合作用和叶片的生物电反应。植物学报2004;31:539-49。GydF4y2Ba
- 42。GydF4y2Ba
Tewari PK, Kumar P, Sharma PN。镁缺乏诱导桑树植物的氧化应激和抗氧化反应。Sci Hortic。2006;108:7-14。GydF4y2Ba
- 43。GydF4y2Ba
Silva DM, Brandão IR, Alves JD, Santos MO, Souza KRD, Silveira HRO。缺镁对两种咖啡品种生理生化的影响。土壤植物。2014;382:133-50。GydF4y2Ba
- 44。GydF4y2Ba
何曼思C,康涅狄格州SJ,陈J,小Q,维尔布鲁根n .更新在镁在植物体内平衡机制。Metallomics。2013;5:1170 - 83。GydF4y2Ba
- 45。GydF4y2Ba
TränknerM,Jaghdani SJ。小麦和向日葵幼苗光合效率的最低镁浓度。植物理性生物化学。2019; 144:234-43。GydF4y2Ba
- 46。GydF4y2Ba
Jaghdani SJ,Jahns P,TränknerM.MG缺乏症主要通过限制CO的主要诱导光氧化应力GydF4y2Ba2GydF4y2Ba同化而不是限制光合光线利用。植物SCI。2021; 302:110751。GydF4y2Ba
- 47。GydF4y2Ba
金xl,ma cl,yang lt,chen ls。由于长期缺钙导致的生理和基因表达的改变在叶子和根部之间不同GydF4y2Ba柑橘网?GydF4y2Ba.acta botanica yunnanica(云南植物研究),2016;GydF4y2Ba
- 48。GydF4y2Ba
孙旭,陈杰,刘丽,Rosanoff A,熊兴,张勇,裴涛。施用镁对牧草粗蛋白质含量的影响。农业食品化学。2018;66:1743-50GydF4y2Ba
- 49。GydF4y2Ba
彭WT,齐WL,聂mm,萧yb,廖h,陈血。镁通过调节支持氮气吸收GydF4y2BaNRT2.1 / 2.2GydF4y2Ba在大豆。土壤植物。2020;457:97 - 111。GydF4y2Ba
- 50。GydF4y2Ba
尚W,Feierabend J.过氧化氢酶Photointivation在Rye中的依赖性叶片在红光中叶绿体介导的灭活的光强度和质量和表征。Photosynth Res。1999年; 59:201-13。GydF4y2Ba
- 51.GydF4y2Ba
梁ww,huang jh,li cp,yang lt,ye x,lin d,chen ls。microRNA介导对长期缺镁的反应GydF4y2Ba柑橘sinensis.GydF4y2Baillumina测序透露的根源。BMC基因组学。2017; 18:657。GydF4y2Ba
- 52.GydF4y2Ba
马春林,齐亚平,梁文伟,杨立涛,卢彦波,郭鹏,叶鑫,陈林林。MicroRNA的调控机制GydF4y2Ba柑橘sinensis.GydF4y2Ba镁缺乏的叶子。植物学报。2016;7:201。GydF4y2Ba
- 53.GydF4y2Ba
彭海英,祁艳萍,李军,杨丽萍,郭鹏,蒋海霞,陈林林。蛋白质组学分析GydF4y2Ba柑橘sinensis.GydF4y2Ba根和叶对长期镁缺乏的反应。BMC基因组学。2005;16:253。GydF4y2Ba
- 54.GydF4y2Ba
黄志荣,张辉,叶旭,赖宁西,杨丽玲,郭建新,陈林林。基于UHPLC-Q-TOF/ ms的代谢组学研究揭示了镁缺乏症叶片代谢谱的改变GydF4y2Ba柑橘sinensis.GydF4y2Ba.SCI Hortic。2021; 278:109870。GydF4y2Ba
- 55.GydF4y2Ba
陈志强,陈志强,陈志强,等。长期缺镁和恢复的系统分析GydF4y2Ba拟南芥GydF4y2Ba.新植物。2010; 187:132-44。GydF4y2Ba
确认GydF4y2Ba
作者感谢安徽科技大学彝族博士教授非常有价值的意见和建议。作者感谢张立孙张和法乌的Ziwei Luo在实验室的帮助下。GydF4y2Ba
资金GydF4y2Ba
国家自然科学基金项目(no . 31801947);福建省自然科学基金项目(no . 2018J01708);农业部镁合金研究计划项目(no . CARS-26-01A);资助方不参与研究的设计、数据的收集、分析和解释;在撰写手稿和决定发表结果的过程中。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
YJ和HX进行了大部分实验,分析了数据,并起草了稿件;YW,XY,NL,ZH和LY参与了矿物分析,叶片气体交换和数据分析的测量;YL和LC参加了本研究的方向;JG设计并定向了该研究并修改了稿件。所有作者都已经阅读并赞成最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
没有必要具体许可。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。作者陈立松,《BMC植物生物学》副主编。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
在mg缺乏(-mg)和充足的条件下生长的柑橘幼苗的生长特征和症状(-mg)和充足(+ mg)。GydF4y2Ba图S2。GydF4y2Ba植物高度(a)的特征,植物叶片(b),第一分支高度(c),分支数(d),分支长度(e)和柑橘幼苗中的分支长度(f)在条件下种植的柑橘幼苗Mg缺乏(-mg)和充足(+ mg)。数据显示为平均值±标准偏差(GydF4y2BaNGydF4y2Ba= 25)。不同的字母代表MG治疗组之间的器官之间的显着差异GydF4y2BaP.GydF4y2Ba<0.05。GydF4y2Ba图S3。GydF4y2Ba缺镁(-Mg)和充足镁(+Mg)条件下柑橘幼苗叶片Chl a (a)、Chl b (b)、Car (c)、Chl a+b (d)、Chl a/b (e)和Chl/Car (f)的特征。数据显示为平均值±标准偏差(GydF4y2BaNGydF4y2Ba= 10)。不同的字母代表MG治疗组之间的器官之间的显着差异GydF4y2BaP.GydF4y2Ba<0.05。GydF4y2Ba图S4。GydF4y2Ba叶绿素荧光瞬态参数的变化特征GydF4y2BaFGydF4y2BaO.GydF4y2Ba(一种),GydF4y2BaFGydF4y2BamGydF4y2Ba(b),GydF4y2BaFGydF4y2BavGydF4y2Ba(c),GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BaO.GydF4y2Ba(d),GydF4y2BaFGydF4y2BaO.GydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba(GydF4y2Ba迪GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφDGydF4y2BaO.GydF4y2Bae),GydF4y2BaFGydF4y2BavGydF4y2Ba/GydF4y2BaFGydF4y2BamGydF4y2Ba(GydF4y2BaTRGydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba或GydF4y2BaφPGydF4y2BaO.GydF4y2Bae),GydF4y2Ba米ydF4y2BaO.GydF4y2Ba(G),GydF4y2BaABS.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba(H),GydF4y2Ba迪GydF4y2BaO.GydF4y2Ba/GydF4y2Barc.GydF4y2Ba(一世),GydF4y2BaφEGydF4y2BaO.GydF4y2Ba(GydF4y2Ba等GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba, j),GydF4y2BaφRGydF4y2BaO.GydF4y2Ba(GydF4y2Ba关于GydF4y2BaO.GydF4y2Ba/GydF4y2BaABS.GydF4y2Ba,k),和GydF4y2BaPI.GydF4y2BaABS,总计GydF4y2Ba(l)在柑橘幼苗在Mg缺乏(-mg)和充足的条件下生长(+ mg)。数据显示为平均值±标准偏差(GydF4y2BaNGydF4y2Ba= 14)。不同的字母代表MG治疗组之间的器官之间的显着差异GydF4y2BaP.GydF4y2Ba<0.05。GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
贾勇,徐海峰。GydF4y2Baet al。GydF4y2Ba柑橘幼苗的形态学和生理特征的差异与来自父母到分支器官的Mg输送有关。GydF4y2BaBMC植物BIOL.GydF4y2Ba21,GydF4y2Ba239(2021)。https://doi.org/10.1186/s12870-021-03028-zGydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-021-03028-zGydF4y2Ba
关键字GydF4y2Ba
- Mg不足GydF4y2Ba
- 柑橘类的植物GydF4y2Ba
- MG吸收GydF4y2Ba
- 父和分支属性GydF4y2Ba
- 形态生理特性GydF4y2Ba