抽象的
背景
芸苔属植物显著L.(2N = 38,AACC)是全世界动物饲料中最重要的石油作物和蛋白质来源之一。木质素是一种大分子芳族聚合物和主要的细胞壁组分。然而,种皮层中的木质素可降低可用性并限制油菜蛋糕的发展。因此,减少种子涂层的木质素含量至关重要。这里,从群体群体中选择高木质素(H-lignin)和低木质素(L-lignin)含量重组自交系(rils)进行分析。
结果
横切面结果表明,h -木质素系种皮较l -木质素系厚,尤其是栅栏层厚。对开花后35 d、40 d和46 d的种皮和胚进行RNA测序(RNA- seq)BNPAL.和BNC4H.H-Lignin种子涂层的基因家族显着高于L-lignin种子涂层。这Bn4CL基因家族也表现出这种趋势。此外,在与植物激素合成有关的基因中,BnaC02g01710D调节,bnaa07g11700d和BNAC09G00190D.在h -木质素系中表达下调。部分转录因子上调,如BnNAC080,BnNAC083,BnMYB9,BnMYB9-1,BnMYB60和BnMYB60-1,而BNMYB91在H-lignin线下下调。此外,大多数类黄酮途径的基因,如BNCHS.和BNDFR.,在H-Lignin See See涂层中强烈表达。
结论
本研究鉴定了与木质素和类黄酮生物合成相关的激素合成基因、转录因子和mirna等关键基因。监管模式B. Napus.提出了种皮木质素。这些结果为木质素和类黄酮的生物合成提供了新的思路B. Napus..
背景
油菜籽(芸苔属植物显著L.)广泛用于生产植物油和生物燃料的生产,并在油萃取后获得的油菜饼也用作动物育种的高质量饲料[1].作为畜牧业的蛋白质饲料的主要供应,油菜蛋糕富含营养和蛋白质[2].饲料中适量的纤维可促进动物消化,增加经济效益。然而,饲料中纤维含量过高会影响动物的消化和吸收[3.限制油菜籽饼的开发和供应。
木质素是一种复杂的生物大分子聚合物,通常包围植物细胞壁的多糖成分,为细胞提供足够的抗压强度,使外壁疏水和防水[4,5,6].木质素存在于植物的各种组织中,如茎、根、叶柄、荚和种皮。木质素主要有三种类型,即:p- 羟基苯基木质素(H型木质素),霉菌木质素(S型木质素)和Guaiacyl木质素(G型木质素),所有这些都是通过三种单体的聚合形成的,p-香樟醇、辛烷醇和松柏醇[7].血管植物中的木质素主要由G型和S型木质素组成,而在裸子植物中的主要是G型木质素[8].
近年来,大量研究人员克隆了木质素合成关键酶的基因,并对其进行了功能研究,最终目的是改变植物木质素的含量或组成。结果表明,l -苯丙氨酸解氨酶(PAL)活性降低导致木质素含量降低[9].Sewalt等人[10.[揭示当在转基因烟草线中改变PAL和肉桂化4-羟化酶(C4H)的表达时,Lignin的含量和组成改变(烟草).转基因杨树(Populus Temuloides.Michx)和拟南芥当4-作用:下调COA连接酶(4CL)表达时,减少了线,并且还减少了G-和S型木质素单体比[11.,12.,13.].据一些研究报道,基因编码酶,包括香豆酸3-羟化酶(C3.)[14.,15.],羟基氨基酰基 - COA Shikimate / Quinate转移酶(HCT.)[16.]、咖啡酰辅酶A o -甲基转移酶(CCoA-OMT)[17.]、肉桂酰辅酶a还原酶(CCR.)[18.,19.],发射5-羟基化酶(F5H)[20.],咖啡酸O- 甲基转移酶(COMT.)[17.]和肉桂醇脱氢酶(CAD.)[18.,21.,在木质素的生物合成中起着关键作用。漆酶(LAC)和过氧化物酶(PER)对木质素单体生成木质素聚合物具有重要的催化作用[22.,23.,24.].此外,NAC转录因子家族的NST1、NST2和NST3调控了转录因子的形成拟南芥二次墙,上游调节因子直接影响下游AtMYB46和atmyb83,而过表达NSTs则导致异位木质素化[25.,26.,27.].除F5H外,在合成木质素单体中编码关键酶的大多数基因由AtmyB58通过交流元素直接调节[28.].虽然已经进行了许多相关课题的研究,但由于基因组的复杂性,该表型的分子机制仍不清楚B. Napus.以及其他因素对油菜籽种类的影响[29.,30.].
减少种子外壳中的木质素含量是油菜育种的重要目标之一。以前的研究已经为种子涂层木质素含量进行映射候选基因。刘等。[31.通过使用高密度SNP遗传图,检测到五个和三个QTL占纤维素和半纤维素的表型变化的4.7%至21.9%和7.3%至16.9%,并且通过Wang等人支持该结果。[32.通过基因范围 - 范围协会研究(GWA)观察到A05,A09和C05上的三个重要关联。迄今为止,没有关于种子涂层的转录组织信息,特别是对于线B. Napus.种子木质素含量差异很大。本研究通过筛选不同木质素含量高和低的品系,利用高通量测序技术鉴定了木质素合成的关键基因B. Napus..
结果
H-和l -木质素品系的筛选及品质性状分析
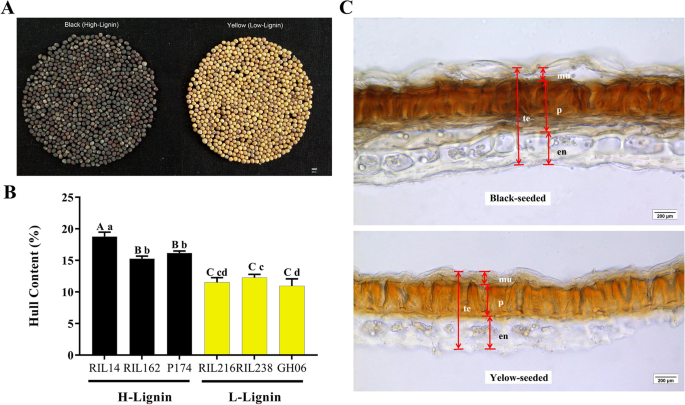
172个rils的种子B. Napus.2014年5月和2015年5月收获,并由近红外快速质量分析仪扫描。L-木质素线和H-Lignin系中的ADL含量分别为0.97%至1.34%,分别为2.49%至4.70%。L-lignin系GH06,RIL134,RIL215,RIL216和RIL238以及H-LIGNIN系P174,RIL4,RIL14,RIL103和RIL162用于随后的比较(表1).L-lignin系列中的变黄程度为116.58至144.71,而H-lignin系列为47.45至67.35(表1).在自然光下,H-Lignin系中成熟种子的涂层出现灰黑色,而L-lignin系的那些出现了姜黄(图。1A). 2014年,H-木质素系和l -木质素系的平均含油量分别为36.70%和37.60%。H-木质素系和l -木质素系2015年的平均含油量分别为40.99%和42.63%,较2014年提高了4% ~ 5%。2014年,H-木质素系和l -木质素系的平均蛋白质含量分别为28.25%和30.89%。相比之下,蛋白质含量低于2015年,H-木质素株系和l -木质素株系的平均蛋白质含量分别为25.58%和27.80%(表1)1).选择三种H-lignin(RIL14,RIL162和P174)和L-LIGNIN(RIL216,RIL238和GH06)系以比较船体速率。结果表明,H-Lignin种子的船体率为15.26%〜18.76%,而L-lignin系列为10.94%〜12.26%(图。1b)。H-lignin种子的船体率明显高于L-lignin系列(表S.1).
H-和L-Lignin线厚度的微观观察
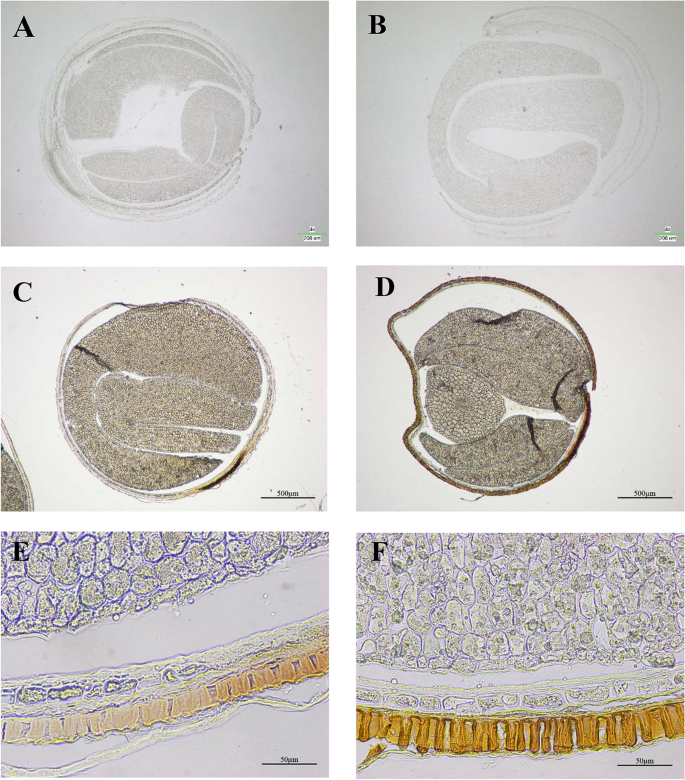
为了研究木质素含量是否与种皮厚度有关,我们获得了H-和l -木质素系(P174/GH06)种皮的横切面进行显微分析。结果表明,h -木质素系的栅栏(p)比l -木质素系的栅栏(p)粗;另外,粘液表皮层(mu)和内皮层(en)在l -木质素系和h -木质素系之间没有显著差异(图3)。1C).结果表明,h -木质素系种皮较l -木质素系厚主要是栅栏层的差异造成的。进一步分析表明,木质素主要分布在种皮的栅栏内,在内皮中也有少量分布。2).h -木质素系种皮的木质素染色非常强(图。2B, D和F),而l -木质素系种皮染色后仍然很轻(图。2由于种皮中木质素含量相对较低(相对于茎、根等其他组织),且种皮栅栏呈染色状,很难观察染色。
H-和l -木质素种皮和胚的转录组分析
共获得干净数据98.58 Gb, 12个样本的Q30≥91.33%(表S2),验证了转录组测序数据的质量。将获得的12个干净数据样本与B. Napus.参考基因组,种子涂层和胚胎的平均比较效率分别为71.60%和77.52%(表S.3.).共筛选到15,030个DEG (DEG的数量为每个DEG集的总和)(表S4).随着种子的发育,种皮中上调和下调基因的数量增加(图S1),表明可能会发生复杂的变化。
GO和TopGO富集分析
三种种子开发阶段的上调和下调的H-和L-lignin系数用GO数据库注释。在35个DAF中,为“LC1 vs HC1”注释1698次,富含80%的DEGS富含细胞和细胞部件。超过60%的上调的可富含细胞器,代谢过程和细胞过程;超过60%的下调的Degs富含细胞器和代谢过程(图S2A).在40 DAF中,共有1839个deg被注释为“LC2 vs HC2”,超过80%的deg在细胞和细胞部分中富集。超过60%的上调基因在细胞器、代谢过程和细胞过程中富集,超过40%的DEGs在催化活性、结合和对刺激的响应中富集(图S)2B).在46 DAF中,有2093个DEGs被注释为“LC3 vs HC3”,上调的基因主要富集在细胞、细胞部分、细胞器、催化活性和代谢过程中;下调基因主要富集在细胞、细胞部分、细胞器和催化活性中(图S2C)。
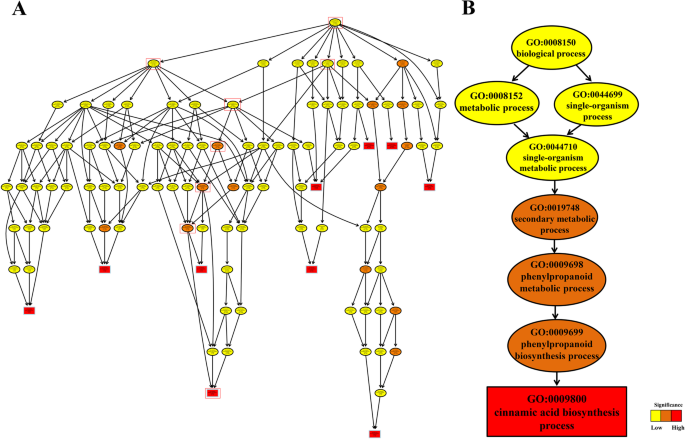
进行TOPGO分析以进一步探索H-和L-lignin系中种子发育的三个阶段的富集。基于KS意义,筛选与木质素生物合成相关的术语,阈值为Ks <0.01。在种子展开期间,在“LC2 VS HC2”和“LC3 VS HC3”中显着富集与“细胞壁”和“次级代谢过程”相关的DEGs(表2).此外,肉桂酸生物合成过程、液泡、苯丙氨酸解氨酶和反式肉桂酸4-单加氧酶活性显著增强,表明这些生物代谢过程与木质素的合成密切相关。GO初级分类中的“生物过程”(GO: 0008150)包括可能参与木质素合成的9个生物过程,即代谢过程(GO: 0008152)、细胞过程(GO: 0009987)、发育过程(GO: 0032502)、免疫系统过程(GO: 002376)、单个生物过程(GO: 002376)。多细胞生物过程(GO: 0032501)、对刺激的响应(GO: 0050896)、定位(GO: 0051179)和生物调节(GO: 0065007)(图4)3.一种)。肉桂酸生物合成过程是显着富集的,特异性富集的次要GO术语是代谢过程/单生物过程,单生物代谢过程,二次代谢过程,苯丙替糖代谢过程,苯丙醇化生物合成过程和肉桂酸生物合成过程(图.3.B).肉桂酸生物合成过程明显富集,说明参与此过程的部分基因可能促进种皮木质素的生物合成。
Kegg代谢途径浓缩分析
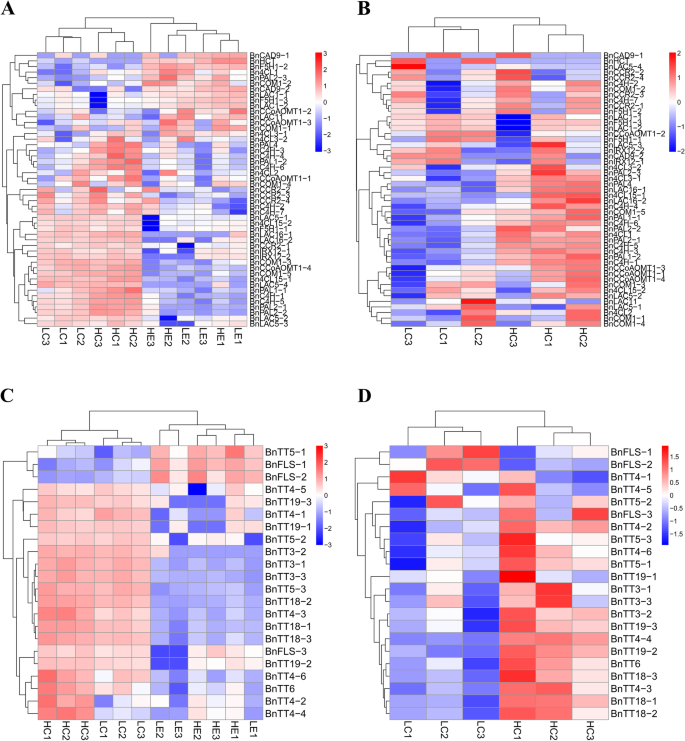
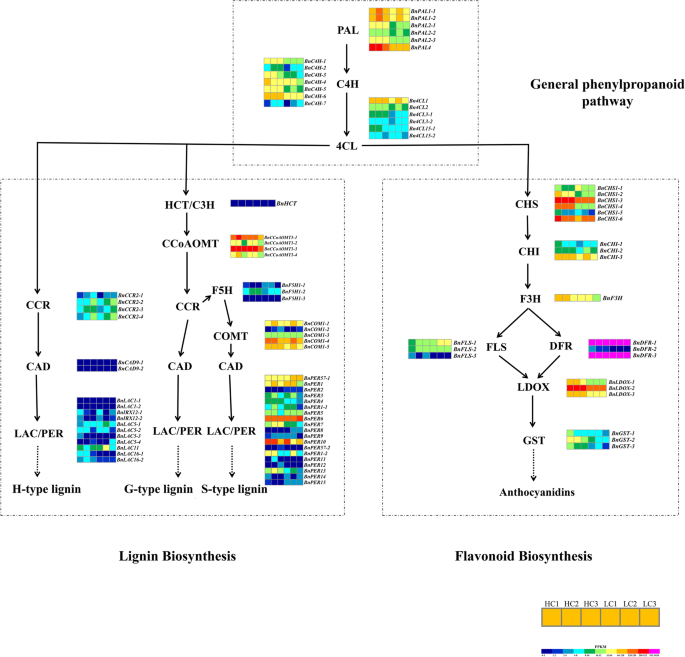
为了探索DEGs富集的代谢途径,对12个样本中的相关DEGs进行KEGG (Kyoto Encyclopedia of Genes and Genomes)代谢途径富集分析。KEGG代谢通路被划分为五个功能区域,分别是生物系统、代谢、遗传信息处理、环境信息处理和细胞过程。在“LC1 vs HC1”中,大多数DEGs富集于氨基酸的生物合成、淀粉和蔗糖代谢、碳代谢等方面(图S3.A).大多数deg富集于核糖体、氨基酸生物合成、淀粉和蔗糖代谢以及内质网蛋白质加工中。在“LC2 vs HC2”(图S3.B)在“LC3 vs HC3”中,大多数DEGs富集于核糖体、淀粉和蔗糖代谢、苯丙素生物合成和氨基酸生物合成中。(无花果。3.C)。该结果表明,许多氨基酸,淀粉和蔗糖的合成促进了苯基丙烷化合物的形成,从而进一步促进木质素生物合成。此外,在种子发育的三个阶段,苯丙氨酸代谢的显着富集苯丙氨酸代谢,生物合成和黄酮类生物合成(图。4).正如预期的那样,对苯丙素-木质素合成途径和类黄酮合成途径的聚类分析显示,相关基因在种皮中上调,在胚中下调(图2)。4H-lignin系(HCl,HC 2和HC 3)中的表达水平明显高于L-lignin系(LC1,LC2和LC3)的表达水平(图。4B, D)。
对于DEG分析,在苯丙烷途径中编码PAL,C4H和4CL的基因高度表达并在H-Lignin系中上调(图。5).BnPAL4在H-lignin系的种子涂层中高度表达,分别在“LC1 Vs HC1”和“LC2 VS HC2”中的差异表达折叠变化分别为2.98-和4.35倍(图S4B).在木质素合成的特定途径中BnCCoAOMT和BnCOMT基因家族在种皮中强烈表达(图。5).我们还观察到编码类黄酮通路关键酶的基因高度表达,特别是CHS和DFR家族基因。大多数基因在h -木质素株系中的表达量高于l -木质素株系(图2)。5).在35 40和46 DAF,所有成员BNPAL.基因家族和BNC4H.基因家族在h -木质素种皮中的表达显著高于在l -木质素种皮中的表达(图S5B, C),大多数成员Bn4CL也表现出相同的现象(图S5D)。BnPAL1-1,BnPAL1-2,BnPAL4,BNC4H-1,BNC4H-2和BNC4H-5h -木质素系种皮中40 DAF表达量最高,46 DAF表达量下降;在l -木质素系中,BnPAL1-1,BnPAL1-2,BNPAL2-1,BNPAL2-2,BNC4H-1,BNC4H-3,BNC4H-4,BNC4H-5,BNC4H-6和Bn4CL1在40 DAF时表达最高,在46 DAF时表达降低(图S5故选B、C、D。
苯丙烷-木质素-类黄酮生物合成途径关键酶的表达分析。朋友,苯丙氨酸ammonia-lyase;C4H,肉桂酸4-hydroxylase;4CL, 4-香豆酸:辅酶a连接酶;羟肉桂酰辅酶a莽草酸酯/喹酸转移酶;摘要:,coumarate 3-hydroxylase;CCoAOMT caffeoyl-CoA -O甲基转移酶;CCR:桂皮酰辅酶a还原酶;F5H, ferulate 5-hydroxylase;COMT,咖啡酸O甲基转移酶;肉桂醇脱氢酶;每过氧化物酶;漆,漆酶。CHS、查耳酮合酶;气,查耳酮异构酶;F3H,黄烷酮3-hydroxylase;FLS的黄酮醇合成酶;LDOX, leucoanthocyanidin加双氧酶;DFR, dihydroflavonol 4-reductase; GST, glutathione S-transferase. The colours indicate the expression levels (FPKM) of the DEGs in HCl, HC2, HC3, LC1, LC2, and LC3. The expression levels (FPKM) corresponding to the different colours are 0–16, 16–32, 32–64, 64–128, 128–256, 256–512, and 512–1024
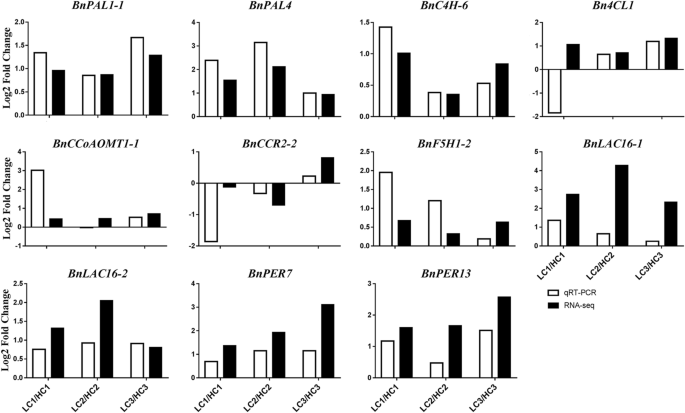
进一步验证与木质素生物合成相关的这些关键基因的表达在种子涂层中B. Napus.选择22个基因,包括20个上调和两个下调基因,用于QRT-PCR分析(表S.5).基因表达水平(日志2qRT-PCR结果与RNA-Seq结果一致(图3)。6,S.6),确认RNA-SEQ提供的数据的可靠性。
转录因子和植物激素分析
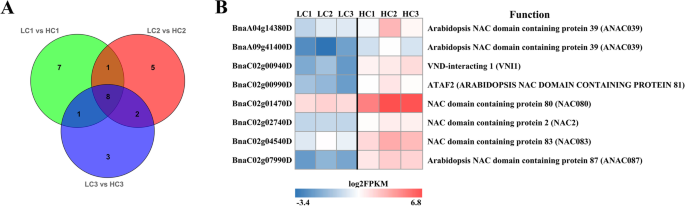
在“LC1 vs HC1”中,NAC、bZIP和ERF家族是表达差异最大的三个转录因子家族,分别有17个(12个上调,5个下调)、11个(2个上调,9个下调)和10个(4个上调,6个下调)DEGs(图S)7A).在“LC2 vs HC2”中,表达差异最大的三个转录因子家族是16个NACs(12个上调,4个下调),13个bzip(3个上调,10个下调)和10个MYBs(6个上调,4个下调)(图S)7B).“LC3 vs HC3”中表达最高的4个转录因子包括13个bZIPs(4个上调,9个下调),11个bHLHs(4个上调,7个下调),11个MYBs(9个上调,2个下调)和11个上调的NACs(图S)7C)。有趣的是,上调的NAC转录因子数量大于种子发育三个阶段的下调转录因子的数量。NAC转录因子家族的八个成员在种子发育的所有三个阶段显示出不同的表达,并且所有这些都上调了所有的阶段(图。7一种)。具体来说,BnNAC080(NAC结构域蛋白80)和BnNAC083(NAC结构域蛋白83)差异表达倍数变化最高(图2)。7b)。他们的上调表达可能调节木质素合成的下游结构基因。根据差异表达式折叠变化(日志2(FC)和表达水平(FPKM),筛选5个MYB转录因子,包括BnMYB9(BnaA03g06190D),BnMYB60(BnaA08g26750D),BnMYB60-1(BnaCnng06440D),BnMYB9-1(BnaC09g41070D),表达上调BNMYB91(BNAC03G20830D)下调(表S7).BnMYB9,BnMYB60,BnMYB60-1和BNMYB91在40和46个DAF的H-和L-lignin系中差异表达,而BnMYB9-1H-和l -木质素系在35和46 DAF处有差异表达。在分析差异表达倍数变化和表达模式的基础上,筛选出植物激素合成的关键基因。BnaC02g01710D和BNAC09G00190D.在H-lignin线的三个阶段分别上调,分别是下调的,而bnaa07g11700d在H-Lignin线路中仅在35和46个DAF上上调(表S.1).
根据MiRNA的预测,BNPAL.,BNC4H.,Bn4CL基因分别由25,12和24 miRNA调节(图S8一种)。BNA-MiR172C,BNA-MIR396A和BNA-MIR172B调节最多的基因;BNA-MiR172C负调节BNC4H-3,BNC4H-5,Bn4CL1和Bn4CL5,BNA-mir396a负面调节BnPAL1-1,BnPAL1-2和Bn4CL5, bna-miR172b负调控BNC4H-3,BNC4H-5,Bn4CL1,Bn4CL5,BnPAL4和BNC4H-2仅被BNA-MiR6034和BNA-MiR6033调节(图S8b)。
通过组合GWA和RNA测序鉴定候选基因
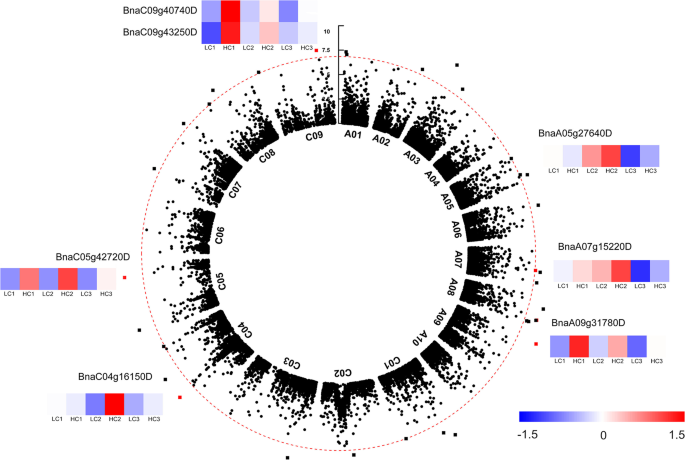
为了筛选与种皮木质素含量相关的候选基因,我们系统地研究了H-和l -木质素系之间的基因差异表达。共鉴定出4270个显著的deg(图S)9).对于种皮壳木质素含量,GWAS在之前的一份报告中检测到了123个候选基因[32.].在候选基因中,七个基因,bnaa05g27640d.,bnaa07g15220d.,bnaa09g31780d.,BNAC04G16150D,BnaC05g42720D,BNAC09G40740D,BnaC09g43250D,经RNA测序分析证实(图。8).
可能网络衣服木质素B. Napus.
监管网络B. Napus.种子涂层木质素被目前的转录组数据的组合绘制,从之前的研究中绘制[33.,34.].结果如图2所示。9.NAC结构域转录因子在调控次级壁中起“主开关”作用,并通过SND3和NST1进一步调控下游的MYB9、MYB60和MYB91,而MYB结构域转录因子则是一个“次级开关”。MYB9和MYB60正调控下游木质素特异性合成的结构基因,MYB91负调控下游木质素特异性合成的结构基因。此外,MYB91还可调节其他转录因子。NAC结构域转录因子也可能受到赤霉素和茉莉酸的积极影响,而受到生长素的消极影响。此外,赤霉素、茉莉酸和生长素也可能直接作用于MYB结构域转录因子。
讨论
木质素含量和种皮厚度
黄色种子的种皮B. Napus.线薄,胚胎占据的比例很大,从而增加了同一遗传背景中的油和蛋白质的含量[35.].籽粒木质素含量与籽粒含油量呈显著负相关[36.].船体率是黄色和黑色的B. Napus.在不同的发展阶段不同。在这项研究中,H-lignin系的船体率明显高于L-lignin系的速率,这与Wang等人的结果一致。[32.].用显微镜观察种皮的横切面,观察种皮的厚度。结果表明,成熟油菜种皮由外到内大致分为黏液表皮细胞层、栅栏和内皮层三层。h -木质素系种皮明显厚于l -木质素系种皮,这主要取决于栅栏层厚度的差异。以往的研究表明,种皮的栅栏层是由种子的内皮层发展而来的[37.],色素在栅栏层积累,黑色种子色素明显多于黄色种子色素。我们认为木质素在栅栏细胞中沉积,增加了细胞壁的厚度,从而增加了栅栏层的总厚度。
转录因子对木质涂层的影响
相关报告表明转录因子在植物二楼中发挥着重要作用[33.,34.].在这项研究中,三个阶段的度种子发展注释到植物转录因子数据库,到120年,135年和136年度筛选和匹配,28日,34岁的转录因子和34岁的家庭“LC1 vs用盐酸”,“LC2 vs HC2”和“LC3 vs HC3”比较,分别。与木质素生物合成相关的MYB和NAC转录因子数量较多,且上调的NAC转录因子数量大于下调的转录因子数量。NAC转录因子家族的NST1、NST2和NST3调控细胞的形成拟南芥次壁,上游调节因素直接影响下游AtMYB46和atmyb83,NST的过度表达导致异位瘫痪[25.].Miao等人[38.[MyB46显示用四个靶基因,MYB83,CCR1,4CL1和PAL1相互作用。在这项研究中,八种NAC转录因子显示出上调的表达。特别是,BnNAC080和BnNAC083显示出高差异表达倍数变化,其上调表达可能调控木质素生物合成的结构基因。Zhou等(2009)观察到AtMYB58通过ac作用元件调控木质素单体合成关键酶的大部分基因[28.].在这项研究中,筛选了与木质素合成相关的五种MYB转录因子。在H-lignin线,BnMYB9、BnMYB60 BnMYB60-1和BnMYB9-1调节,而BNMYB91表达下调。
激素调节对种皮木质素的影响
在本研究中,植物激素数据库中注释了编码植物激素的DEGs,与生长素、油菜素内酯、细胞分裂素、乙烯、赤霉素和茉莉酸相关,表明这些激素参与了种皮木质素的调控。差异表达倍数的变化和表达模式分析表明BnaC02g01710D和bnaa07g11700d可能促进种皮木质素的合成,而下调B. Napus.生长素途径可能对木质素的调控有抑制作用。Cecchetti et al.(2013)研究表明,外源施用生长素可降低番茄红素的表达水平AtMYB26并抑制二次壁沉积,表明养肝剂是木质素生物调节的负调节剂[39.],这与我们研究的结果一致。
赤霉素20氧化酶(Gibberellin 20-oxidase, GA20ox)是植物中赤霉素合成代谢的关键酶[40].的上调表达BnaC02g01710D可能会增加种皮中赤霉素的含量,促进木质素的形成。在木质部的柯伊斯布卢美,GA3和低浓度的IAA促进S型木质素含量的增加[41.].茉莉酸在转录水平上影响木质素生物合成AtMYB61[42.,43.,44.].在本研究中,上调表达bnaa07g11700d可能促进木质素的生物合成。
种子木质素与类黄酮生物合成的关系
在植物中,由于木质素单体来自类黄酮生物合成的同一来源,木质素和类黄酮的生物合成共同受到上游苯丙氨酸合成代谢的影响[9].在拟南芥,沉默ARHCT.导致生物量减少,这对植物的生长有重大影响。在hct沉默的植物中,通过查尔酮合成酶活性的代谢通量逆转,抑制木质素合成导致黄酮类化合物的转化[45.].在本研究中,在普通苯基丙醇途径中,在H-Lignin系的种子涂层中,编码酶Pal,C4h和4cl的egs的表达水平较高而不是L-lignin系的种子涂层。江等人发现了类似的结果。(2019),这表明大多数Degs都在黄色种子中下调B. Napus.[46.,这些结果与黄酮类化合物和木质素含量下降相一致。4CL催化生成p -Coumaroyl-CoA byp-香豆酸,它是木质素和类黄酮生物合成的前体。在h -木质素株系中,PAL、C4H和4CL编码基因的表达量显著高于l -木质素株系。在木质素合成的特定途径中,CCoA-OMT催化咖啡酰辅酶a转化为阿铁酰辅酶a,这是第一个甲基转移反应,主要参与g型木质素单体的合成。此外,表示COMT.推测种皮中木质素主要由g型和s型木质素单体组成。Qu et al.(2013)发现黄酮类化合物在种皮中的含量B. Napus.授粉后的42 d是最高的,黑色的播种B. Napus.木素含量显著高于黄籽B. Napus.[47.],这与本研究的转录组数据一致。在黄酮合成途径中,编码H-木质素线中大多数酶的℃的上调表达表明,这些酶具有更高的活性,因此有助于这些线中的高黄酮含量。刘等。[31.]构建了一个高密度遗传联系地图B. Napus.使用基因组的单一核苷酸多态性标记物,通过60k芯片测定的四种不同环境线的基因组型单核苷酸多态性标记物B. Napus..通过对细胞壁纤维成分ADL、纤维素和半纤维素的QTL分析,共检测到11个QTL的种子颜色和纤维性状。ADL性状的SNP位点主要位于A09和C05染色体上。类似的结果也被发现了,例如,Bna。CCR1是定位在硅附近的一个相应的种子纤维QTL的峰值[48.].此外,Wang等人。[32.]进行了种子ADL含量的GWAS分析B. Napus.在A05、A09和C05上检测到显著的SNPs,并提出了关键基因bnaa.pal4.,BnaA。cad 2/BnaA。cad 3和bnac.cr1.用于木质素生物合成[32.].GWA的比较和我们的转录组结果显示BnPAL4由QRT-PCR验证的,是线素含量差异之间的关键基因。
结论
综上所述,本研究揭示了木质素生物合成的关键基因芸苔属植物显著种子涂层。首先,H-Lignin系的种子涂层比L-lignin线的种子厚,特别是关于拨平板层。然后,Kegg和GO分析表明,在H-Lignin系中显着富集了苯丙醇和黄酮类生物合成。基因BNPAL.,BNC4H.和Bn4CL木质素生物合成途径,BNCHS.和BNDFR.类黄酮生物合成途径,BnaC02g01710D,bnaa07g11700d和BNAC09G00190D.植物激素合成途径和一些转录因子BnNAC080,BnNAC083,BnMYB9,BnMYB9-1,BnMYB60,BnMYB60-1和BNMYB91在目前的研究中被筛选。最后,通过综合分析RNA-SEQ和报告的数据,一个模型B. Napus.提出了种皮木质素。
方法
植物材料
我们的实验室观察了两排GH06和P174的种子。172个rils的人口来自f的单种子血统来自f2中国半冬油菜亲本GH06(低木质素黄籽)与P174(高木质素黑籽)杂交的后代[31.].共172岁B. Napus.在中国重庆西南大学试验农场(2013年9月- 2014年5月和2014年9月- 2015年5月)自然生长条件下,采用3个重复培养重组自交系。
选择5个h -木质素系和5个l -木质素系于2016年9月在西南大学(中国重庆)试验场播种,在自然生长条件下种植。采用随机完全区组设计,试验重复3次。每行种植两行,每行10株,行距30cm,株间距离20cm。分别在开花后35、40和46 d采集5个含H-木质素和l -木质素品系的种子,重复3次,分离种皮和胚。样品立即在液氮中冷冻,并保存在-80°C的RNA-Seq。LC1、LC2和LC3分别代表35、40和46 DAF处的低木质素种皮;HC1、HC2和HC3分别代表35、40和46 DAF时的高木质素种皮;LE1、LE2和LE3表示35、40和46 DAF的低木质素胚;HE1、HE2和HE3分别代表35、40和46 DAF时的高木质素胚胎。
数据分析
通过SPSS 17.0进行三种单独实验的方法和Duncan的多个范围测试的显着差异的分析。意义程度(α)设定为0.01和0.05。
木质素,脂肪酸和蛋白质含量的测定
根据Dimov等人的方法,使用近红外快速质量分析仪(NIR System 6500, FOSS, Sweden)测定种子性状。[49.].仪器在扫描前至少预热50分钟。利用种子品质近红外模型测定种子品质性状,包括酸性洗涤木质素(ADL)、酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)、脂肪和蛋白质含量以及种子黄变程度。
确定船体率
将H-和L-LIGNIN系的种子在电热恒温器控制的冲洗干燥烘箱中在80±2℃下干燥72小时并称重,记录种子的总干重(W)(g)。每个种子样品约为3.00g,使用3个重复。将称重的种子浸入无菌水中,持续24小时,直到完全吸收,并通过使用原子针分离种子涂层和胚胎。将种子涂层在电热恒温器喷砂烘箱中在80±2℃下干燥48小时,记录籽涂(W1)(G)的干重。公式如下:
油菜籽种皮厚度及染色的显微观察
在40 DAF时,用成熟种子观察种皮厚度,参照Zhou et al. [28.].使用低温恒温器(CM1850UV徕卡)进行紫外线消毒,使用前将机箱温度降至-20℃。包埋切片:滴加包埋剂,直至油菜籽完全被覆盖,包埋剂颜色由透明变为白色。将cryostat柜的温度从-20°C调至-10°C,持续30分钟以上。将样品架固定在切片机上的样品头上,将切片厚度调至1 μm。将干净的载玻片平放于切开的组织片上方,将组织贴于载玻片上,将准备好的切片置于尼康SMZ1500显微镜下观察。按照Zhou等人的描述,40 DAF的种子和成熟种子的切片用间苯三酚- hcl染色。28.].将切片转移到玻片上,加入1%间苯三酚溶液1ml,静置5min,再加入浓盐酸溶液1ml。取4 ×、10 ×、20 ×、40 ×、100 ×物镜在尼康ECLIPSE E600显微镜下观察,并拍摄高分辨率照片。
RNA测序和分析
利用EZ-10 RNA Miniprep试剂盒(Sangon Biotech Co., Ltd, Shanghai, China)从5个品系35、40和46 DAF的油菜皮和胚胎中提取总RNA。使用安捷伦生物分析仪2100系统(美国安捷伦技术公司,CA,美国)评估RNA完整性。Biomarker Technologies Co., Ltd (Beijing, China)从三个样本中获得高质量的RNA,用于RNA测序和分析。参考基因组采用TopHat2软件(芸苔属植物显著v4.1)映射。
每百万片段的每千碱基映射(FPKM)值的每千碱基碎片用于表示基因表达的水平。EBSEQ R包用于分析差异表达的基因(DEG),具有假发现速率(FDR)<0.01和log2(折叠变化)|≥1。使用“A VS B”方法进行比较两种样品,其中使用“A”样品作为对照。如果样品“B”中的DEG的表达水平高于“A”,则上调该曲面;否则,它是下调的。我们使用了Goseq R包[50.]使用KOBAS软件进行评估对DEG的富集分析,并评估KEGG途径的富富集[51.].在本研究中,三组比较(“LC1 vs HC1”,“LC2 vs HC2”,“LC3 vs HC3”)的DEGs在植物转录因子数据库v4.0中进行了注释[52.),拟南芥激素数据库2.0 [53.].原始RNA-Seq数据已上传到NCBI,登录号为PRJNA597958。
mirna靶向性的预测BNPAL.,BNC4H.和Bn4CL基因
的基因组序列BNPAL.,BNC4H.和Bn4CL作为候选基因提交家族基因,用于通过针对可用的搜索来预测潜在的MicroRNA(MiRNA)B. Napus.利用植物小RNA靶标分析服务器(psRNATarget)参考miRNA序列[54.].利用Cytoscape软件分析mirna与相应靶基因之间的相互作用。
RNA-Seq数据验证
进行定量逆转录PCR(QRT-PCR)实验以验证RNA-SEQ根据Zhao等人测量的差异表达水平。[55.]张等人。[56.].引物使用底漆总理5设计,并由Sangon Biotech(上海)有限公司(中国上海)合成。Primer Premier 5.0软件用于为定量RT-PCR设计特异性引物(表S.5),使用Sybr®GreenPCRSuperMix(加利福尼亚州,美国)使用Bio-Rad CFX96实时系统进行QPCR。每种反应含有10μlSYBR超混合物,每次底漆(10μm),7.2μlH2o和2μlcDNA的最终体积为20μl。每次反应使用三种技术复制。以下步骤用于QRT-PCR:98℃,30s,其次为10 s和60℃的40℃,30秒。这Bnactin7.基因用作对照。为了验证RNA-SEQ检测的表达水平,将RNA-SEQ数据与通过QRT-PCR获得的数据进行比较。
数据和材料的可用性
在本研究期间生成和分析的数据集可从相应的作者获得合理的请求。所有排序数据都已存入SRA(www.ncbi.nlm.nih.gov sra).登录号为PRJNA597958,网址为https://www.ncbi.nlm.nih.gov/sra/.
缩写
- H-lignin:
-
High-lignin
- L-lignin:
-
低木质素
- DAF):
-
几天后开花
- RNA-SEQ:
-
RNA测序
- 屏蔽木质素:
-
p- 羟基苯基木质素
- S型木质素:
-
Syringyl木质素
- g字木质素:
-
愈创木基木质素
- 朋友:
-
L-苯丙氨酸氨酶
- C4H:
-
肉桂酸4-hydroxylase
- 4 cl:
-
4-Coumarate:辅酶a连接酶
- 摘要::
-
香豆素3-羟化酶
- HCT:
-
Hydroxycinnamoyl-CoA shikimate /奎尼酸转移酶
- CCoA-OMT:
-
咖啡酰辅酶A O-甲基转移酶
- CCR:
-
肉桂糖CoA还原酶
- F5H:
-
Ferulate 5-hydroxylase
- COMT的:
-
咖啡酸O-甲基转移酶
- CAD:
-
肉桂醇脱氢酶
- LAC:
-
漆粉
- /:
-
过氧化物酶
- GWAS:
-
全基因组关联研究
- KEGG:
-
Kyoto基因和基因组的百科全书
- Ga0ox:
-
赤霉素(GA) 20-oxidase
- 瑞来斯:
-
重组自交系
- 分布:
-
酸性洗涤木质素
- ADF:
-
酸性洗涤纤维
- NDF:
-
中性洗涤剂纤维
- FPKM:
-
每百万片碎片每千碱基映射的碎片
- 可见:
-
差异表达基因
- 罗斯福:
-
错误发现率
- 存在:
-
定量逆转录聚合酶链反应
参考文献
- 1。
Wittkop B,Snowdon RJ,Friedt W。欧洲油籽作物产量和质量育种的现状和展望。Euphytica。2009; 170:131-40。
- 2。
Joseph Simbaya,Bogdan A. Slominski,Gerhard Rakow,Lloyd D. Campbell,R. Keith Downey,Bell JM。黄色芸苔种子膳食的质量特征:蛋白质,碳水化合物和膳食纤维组分。JAgric Food Chem。1995年; 43:2062-6。
- 3.
植物纤维在动物饲养中的营养价值。《世界Rev Nutr Diet》1981;37:177-228。
- 4.
钟克,李c,叶zh。转录网络调节二次细胞壁生物合成的进化守恒。趋势植物SCI。2010; 15:625-32。
- 5。
木质素:一种线性低聚物。Biomacromol。2011;12:3928-35。
- 6。
魏磊,简洪,陆坤,尹宁,王军,段旭,等。木质素和倒伏相关性状的遗传和转录组分析芸苔属植物显著.Al Appl Genet。2017; 130:1961-73。
- 7。
王志强,王志强,王志强,等。木质素生物合成与结构研究进展。植物杂志。2010;153:895 - 905。
- 8。
Ambavaram MM,Krishnan A,Trijatmiko KR,Pereira A.协调激活水稻中木质素生物合成途径的纤维素和镇压。植物理性。2011; 155:916-31。
- 9。
胡D,刘XB,She Hz,高Z,Ruan Rw,Wu DQ等。木质素合成相关基因和Fagopyrum Esculentum的封闭性抗性。BIOL植物。2017; 61:138-46。
- 10.
等。烟草l -苯丙氨酸解氨酶和肉桂酸4-羟化酶的表达下调。植物杂志。1997;115:41-50。
- 11.
Lee D,Meyer K,Chapple C,Douglas CJ。反义抑制4-香豆素:亚居族酶酶活性导致木质素亚基组合物改变。植物细胞。1997年; 9:1985-98。
- 12.
Hu Wj,Harding Sa,Lung J,Popko JL,Ralph J,Stokke DD等。木质素生物合成的抑制促进转基因树脂的纤维素积累和生长。NAT BIOTECHNOL。1999年; 17:808-12。
- 13。
Li L,周Y,Cheng X,Sun J,Marita JM,Ralph J等人。通过多烯烯烯晶体形成多种木质素特征的组合改性。Proc Natl Acad Sci USA。2003; 100:4939-44。
- 14。
frank R, Humphreys JM, Hemm MR, Denault JW, Ruegger MO, Cusumano JC,等。拟南芥的ref8.基因编码苯丙代谢的3-羟化酶。植物j . 2002; 30:33-45。
- 15.
Ralph J, Akiyama T, Coleman HD, Mansfield SD。香豆酸3-羟化酶下调对杨树木质素结构的影响。生物能源研究》2012;5:1009-19。
- 16。
引用本文:李晓东,李晓东,李晓东,等。羟基肉桂酰辅酶A shikimate/quinate羟基肉桂酰转移酶的沉默影响苯丙类生物合成。植物细胞。2004;16:1446 - 65。
- 17。
郭丹丹,陈飞,惠勒,等。木质素o -甲基转移酶基因调控提高苜蓿草料瘤胃消化率的研究。转基因研究》2001;10:457 - 64。
- 18。
王志强,王志强,王志强,等。同时下调烟草肉桂酰辅酶a还原酶(CCR)和肉桂醇脱氢酶(CAD),可导致烟草木质素含量大幅下降,但不影响植株发育。植物j . 2001; 28:257 - 70。
- 19。
陈志强,陈志强,陈志强,等。下调的AtCCR1基因拟南芥:对表型、木质素和细胞壁降解率的影响。足底。2003;217:218-28。
- 20。
烟草和杨树植物过度表达编码5-羟基化酶的拟南芥基因。工厂J. 2000; 22:223-34。
- 21。
Ralph J, MacKay JJ, Hatfield RD, O’malley DM, Whetten RW, Sederoff RR。火炬松突变体木质素异常。科学。1997;277:235-9。
- 22。
Quiroga M,Guerrero C,Botella Ma,Barcelo A,Amaya I,Medina Mi,等。番茄过氧化物酶参与了木质素和Suberin的合成。植物理性。2000; 122:1119-27。
- 23。
Berthet S,Demont-Caulet N,Pollet B,Bidzinski P,Cezard L,Le Bris P等人。扰乱LACCASE4.和17.导致木质素化的组织特异性改变拟南芥茎。植物细胞。2011;23:1124-37。
- 24。
赵强,中岛建,陈飞,尹勇,付超,云建,等。漆粉是否有必要和非冗余过氧化物酶血管发育过程中的木质素聚合拟南芥.植物细胞。2013; 25:3976-87。
- 25。
钟克,魔法,叶zh。SND1,NAC结构域转录因子,是纤维中二壁合成的关键调节器拟南芥.植物细胞。2006; 18:3158-70。
- 26。
Zhongardson ea,ye z。MYB46转录因子是SND1的直接目标,并调节二级墙体生物合成拟南芥.植物细胞。2007;19:2776 - 92。
- 27.
麦卡锡,钟河,叶zh。myb83是一个直接的目标SND1和多余的myb46.在拟南芥中次级细胞壁生物合成的调节中。植物细胞生理。2009; 50:1950-64。
- 28.
周俊,李晨,钟锐,叶振华。MYB58和MYB63是植物次生细胞壁形成过程中木质素生物合成途径的转录激活因子拟南芥.植物细胞。2009; 21:248-66。
- 29.
Rogers LA, Dubos C, Cullis IF, Surman C, Poole M, Willment J,等。光、生物钟和糖感知在木质素生物合成的控制。J Exp Bot. 2005; 56:1651-63。
- 30.
Pan Y,Michael TP,Hudson Me,Kay Sa,Chory J,Schuler Ma。细胞色素p450单氧基酶作为昼夜调节途径的记者。植物理性。2009; 150:858-78。
- 31.
刘L,曲c,wittkop b,yi b,xiao y,他y等。高密度SNP地图,用于精确映射种子光纤QTL芸苔属植物显著L. Plos一个。2013; 8:E83052。
- 32.
王j,jian h,wei l,qu c,xu x,lu k等。基因组分析种子酸性洗涤剂木质素(ADL)和油菜籽中的壳含量(芸苔属植物显著l .)。《公共科学图书馆•综合》。2015;10:e0145045。
- 33.
赵强,Dixon RA。木质素生物合成的转录网络:比我们想象的更复杂?植物学报。2011;16:227-33。
- 34.
Carocha v,soler m,hefer c,cassan-wang h,fevereiro p,myburg aa等。桉树祖母木质素工具箱的基因组分析。新植物。2015; 206:1297-313。
- 35。
姜军,邵颖,李爱华,陆超,张颖,王艳。黄、黑种子发育过程中酚类成分分析及基因表达芸苔属植物显著.acta botanica yunnanica(云南植物研究). 2013;55:537-51。
- 36。
Miao L,Chao H,Chen L,Wang H,Zhao W,Li B,等。稳定和新的QTL识别和新的见解,进入影响种子纤维性状的基因网络芸苔属植物显著.Al Appl Genet。2019年; 132:1761-75。
- 37。
Moïse JA, Han S, Gudynaitę-Savitch L, Johnson DA, Miki BLA种皮:结构、发育、组成和生物技术。体外细胞与发育生物学-植物。2005;41:62 - 44。
- 38。
Miao L,张L,Raboanatahiry N,Lu G,Zhang X,Xiang J等。茎的转录组分析与其他组织的全球比较芸苔属植物显著.前植物SCI。2016; 7:1403。
- 39。
Cecchetti V,Altamura MM,Brunetti P,Petrocelli V,Falasca G,Ljung K,等。通过调节内皮钙化和茉莉酸生物合成来控制拟南芥花药裂开。植物J. 2013; 74:411-22。
- 40。
Plackett AR,Powers SJ,Fernandez-Garcia N,Urbanova T,TakeBayashi Y,Seo M,等。分析的发展作用拟南芥赤霉素20氧化酶证明了这一点GA20Ox1- -2,3.是主要的伞菌。植物细胞。2012; 24:941-60。
- 41。
Aloni R,Tollier Mt,Monties B.养羊酸和胃肠杆菌蛋白在原发性韧皮纤维和木质中控制木质素形成的作用柯伊斯布卢美茎。植物理性。1990; 94:1743-7。
- 42。
Ellis C,Karafyllidis I,Wasternack C,Turner JG。拟南芥突变体CEV1.将细胞壁信号与茉莉酸和乙烯反应联系起来。植物细胞。2002;14:1557 - 66。
- 43。
Brux A,Liu Ty,Krebs M,Stierhof Yd,Lohmann Ju,Miersch O,等。转基因网络中的V-ATP酶活性降低导致奥克西蛋白依赖性缺口生长抑制拟南芥.植物细胞。2008;20:1088 - 100。
- 44。
林志强,石井,田松永,富永,黑森,和田,等。甘油磷酸二酯类磷酸二酯酶蛋白SHV3及其同源物在细胞壁组织中起重要作用。植物生理学报。2008;49:1522-35。
- 45。
黄酮类化合物在植物中的积累拟南芥在木质素合成中抑制了影响促进的运输和植物生长。植物细胞。2007; 19:148-62。
- 46。
江j,朱思,袁y,王y,zeng l,batley j等。黄色和黑色种子种子的转录组比较芸苔属植物显著揭示基因影响种子质量。BMC植物BIOL。2019; 19:203。
- 47。
曲超,傅芳,卢凯,张凯,王锐,徐旭,等。黑籽和黄籽酚类化合物的差异积累及相关基因的表达芸苔属植物显著.J Exp Bot。2013; 64:2885-98。
- 48。
刘立军,刘立军,王立军,等。对甘蓝型油菜种子颜色和纤维含量的主要QTL进行解剖,发现与苯丙类生物合成和类黄酮沉积的候选基因共定位。植物育种。2013;132:382-9。
- 49。
DiMov Z,Suprianto E,Hermann F,MöllersC.欧洲冬季油菜籽(Brassica Napus L.)集中种子壳体和纤维含量的遗传变异和NIRS校准的发展。植物育种。2012; 131:361-8。
- 50.
年轻MD,Wakefield MJ,Smyth GK,Oshlack A. RNA-SEQ的基因本体分析:选择偏差。基因组Biol。2010; 11:R14。
- 51.
基于KEGG Orthology (KO)的自动化基因组注释和路径识别。生物信息学。2005;21:3787 - 93。
- 52.
金军,田芳,杨大川,孔亮,罗杰等。PlantTFDB 4.0:植物转录因子和调控相互作用的中心枢纽核酸Res. 2017;45:D1040-D5。
- 53.
蒋志强,刘旭,彭志强,万勇,季勇,何伟等。AHD2.0:植物系统研究拟南芥激素数据库的更新版本。核酸学报2011;39:D1123-9。
- 54.
戴旭,赵PX。psRNATarget:植物小RNA目标分析服务器。核酸学报2011;39:W155-9。
- 55.
赵伟,赵华,张丽,塔宁,赵颖,李斌等。整合QTL定位和基因打捞技术分析油菜多主茎性状(芸苔属植物显著l .)。植物学报。2019;10:1152。
- 56.
张丽丽,邹军,李树华,王斌,李敏。水稻三倍体杂交种miRNAs的表达谱芸苔属植物显著和芸苔属植物拉伯.BMC基因组学。2019;20:649。
确认
不适用。
资金
国家自然科学基金项目(no . 31771830, no . 31971902, no . 31701335);国家重点研发计划项目(no . 2018YFD0100500);“111”项目(no . B12006);资助机构没有参与研究的设计、分析、数据解释和手稿的撰写。
作者信息
隶属关系
贡献
LZL设计了实验。植物材料由JNL提供。YRD、SZY、JW和CMQ进行了实验工作,并进行了数据分析。原稿由YRD, SZY和MTL撰写。YRD, MTL和LZL对手稿进行了修改。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者宣称没有利益冲突。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1:
表S1。船体木质素含量的方差分析B. Napus.湖“*”重大P < 0.05.表S2。测序数据的质量。表S3。排序数据的对齐效率统计。表S4。度的数量。表S5。用于实时定量PCR的引物。表S6。每对样品之间与植物激素合成相关的关键基因。表S7。每个样本对之间编码MYB TFs的关键DEGs。
附加文件2:图S1。
H-和L-lignin线的种子涂层发育三个阶段的DEG数量。红色,上调;黑色,下调。
附加文件3:图。S2。
在三次套装中进行富集分析:(a)LC1与HC1,(B)LC2 Vs HC2和(C)LC3与HC3。
附加文件4:图S3。
DEG集的KEGG分析:(a)LC1 VS HC1,(B)LC2 VS HC2和(C)LC3 VS HC3。
附加文件5:图。S4。
(A) LC1 vs HC1, (B) LC2 vs HC2, (C) LC3 vs HC3,三组中DEGs显著富集的KEGG项前20名。
附加文件6:图S5。
在种皮涂层三个阶段的苯基丙醇丙烷途径中的DEGS编码PAL,C4h和4CL的表达。(a)次数的次数BNPAL.,BNC4H.,Bn4CL基因家族。(B)的表达式(FPKM)BNPAL., (C)BNC4H.和(D)Bn4CLH-和l -木质素种皮三个发育阶段的基因家族。
附加文件7:图S6。
QRT-PCR验证与木质素生物合成相关的TFS和激素。
附加文件8:图S7。
在H-和L-Lignin系中编码TFS的DEGS数量。(a)LC1与HC1(B)LC2 VS HC2(C)LC3 VS HC3。
附加文件9:图S8。
BNPAL,BNC4H和BN4CL基因家族的相关miRNA。(a)整个mirnasBNPAL.,BNC4H.和Bn4CL基因家族。(B)调控基因数量最多的mirna。
附加文件10:图S9。
种皮转录组中的重叠DEGs和之前的GWAS研究。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
丁,Y.,Yu,S.,王,J.et al。对木质素含量高和低的种皮进行转录组比较分析,揭示了木质素和类黄酮的生物合成芸苔属植物显著.BMC植物BIOL.21,246(2021)。https://doi.org/10.1186/s12870-021-03030-5.
收到了:
接受:
发表:
关键字
- 芸苔属植物显著L.
- 种皮
- 木质素
- 类黄酮
- RNA-SEQ.