摘要
背景
花生作为一种重要的经济作物,其产量受到土壤酸化和病原菌侵染的影响。受体样蛋白激酶在植物生长发育和胁迫反应中起着重要作用。然而,目前对花生中RLKs的数量、位置、结构、分子系统发育及表达情况知之甚少,对花生铝胁迫反应中RLKs的研究尚无全面报道。
结果
总共1311个AhRLK从花生基因组中鉴定出S。AhLRR-RLKs和AhLecRLKs进一步分为24个亚家族和35个亚家族。的AhRLKS随机分布在花生中的所有20染色体上。在这些当中AhRLKS中,9.53%和61.78%分别来自串联重复和片段重复。串联重复基因对的ka/ks比值为96.97%(96/99),片段重复基因对的ka/ks比值为98.78%(646/654)。在被测串联重复集群中,共有28个基因转换事件。通过挖掘转录组数据,共鉴定了90个Al-responsive AhRLKs,并将其分为7组。大多数聚集在一起的Al-responsive AhRLKs具有相似的主题和进化上保守的结构。进一步分析了这些基因在不同组织中的表达模式,并分析了组织特异性表达的基因,包括14个根特异性al响应基因AhRLK年代被发现。此外,所有90 al响应AhRLKs在亚属的亚属中不均匀分布AhRLK在铝胁迫下,两种花生品种(铝敏感和铝耐受性)的表达模式不同。
结论
在本研究中,我们分析了花生基因组中的RLK基因家族。节段性重复事件是AhRLK进化,最多AhRLKS受到净化选择。共鉴定出90个Al-responsive AhRLKs基因,并对其分类、保守基序、结构、组织表达模式和预测功能进行了分析AhRLKS被进一步分析和讨论,揭示它们假定的作用。本研究提供了更好的理解结构和功能AhRLK年代和Al-responsiveAhRLKs。
背景
铝(Al)是酸性土壤中植物生长最有害的因素之一,根据作物的不同,铝会造成25%到80%的产量损失[1,2].Al信号传导诱导植物细胞中的一系列生理事件。Al毒性最明显的现象是抑制顶端区域中细胞伸长的抑制和编程细胞死亡(PCD)的诱导[3.,4,5].PCD是一种活跃的、有序的、受基因控制的细胞死亡形式,发生在植物的整个发育过程和对环境应激的反应中[6].早期的研究发现,铝处理可以提高铁2+-诱导的烟草细胞脂质过氧化和PCD [7].数十年来,al诱导的PCD已被证明存在于许多植物中,包括大豆(大豆)[8),玉米玉米)[9),大麦(大麦芽)[10)、西红柿(番茄)[11)和花生(落花生hypogaea)[12].al诱导的PCD是通过两种细胞信号转导途径介导的:线粒体依赖途径和核显性线粒体独立途径[5].然而,Al信号信息及其跨膜转导是未知的。途径使用血浆膜和/或细胞壁局部化受体感测环境刺激并有效地在细胞之间进行诱导的信号,其感知和转换信号以调节基因表达和/或酶活性以及运动[13]. 受体样蛋白激酶(Receptor like protein kinase,RLK)在细胞信号转导过程中起着重要作用,参与植物自交不亲和等多种生理过程[14]、环境信号处理[15,器官形状和分生组织活性[16],激素信号转导[17金刚石(),18,以及对氧化应激的耐受性[19].RLKs通过蛋白质相互作用和磷酸化来感知和转导信号[20.].根据胞外结构域的结构,RLKs被分为几个家族,如S-RLKs、LRR-RLKs、EGF-RLKs、LecRLKs、TNFR-RLKs和PR5K-RLKs [21]当发现了许多涉及环境压力反应的许多rlks,据报道,据报道很少有rlks参与Al压力反应。WAK1,介导细胞壁和细胞质之间的相互作用,并可参与细胞伸长和形态发生[22],是第一个被发现参与铝应激反应的RLK。过度表达WAK1据报道可以增强拟南芥的Al耐受性[23]. 结果表明RLK公司在Al-诱导的PCD中发挥着重要作用,但是RLK公司铝诱导PCD的调控机制尚不清楚。
花生是世界上重要的油料作物。在酸性土壤中,依赖铝的生长抑制导致花生产量下降。目前对花生RLK基因家族还没有全面的分析。在本研究中,最近公布的花生全基因组序列数据(http://peanutgr.fafu.edu.cn/index.php)对花生RLK基因家族进行了分析。总共1311个AhRLK已经确定了。LRR-RLK和Decrlks进一步基于系统发育分析分别分别分为24和35个亚毛利。进化和共同性AhRLK进行调查。通过对花生中RLK基因重复事件的研究,探讨了RLK基因家族的进化模式。此外,90年AhRLK通过转录组学分析,鉴定了Al胁迫下s的表达谱AhRLK综合测定不同铝处理时间点的s。这些研究结果将为进一步研究黄酮的进化和生理功能提供基础AhRLK花生对铝压力的反应。
结果
花生中AhRLKs的鉴定
要识别花生中AHRLK的成员,我们下载了公开的花生基因组序列数据,并使用拟南芥RLK序列作为查询,以执行基因组广泛的相似性搜索。过滤序列后,最初鉴定了总共1311AHRLK,其中包含至少一种激酶结构域,包括548LRR-RLK,274个命令,富含83个半胱氨酸,76个EGF RLK,49脯氨酸富rlks,46 s-域rlks,22 tmk-rlks,2 tnfr-rlks,1个富有的RLK,28 rlck-rlks,24 lysm-rlks和158没有明显的域名(附加文件1和2).我们考虑进一步分析LRR-RLKs和LecRLKs。
花生LRR-RLKs和LecRLKs的系统发育分析
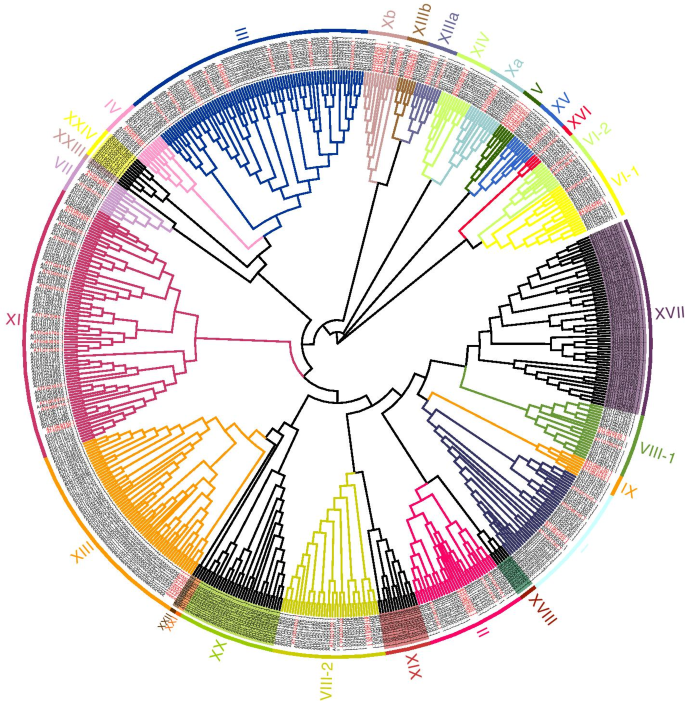
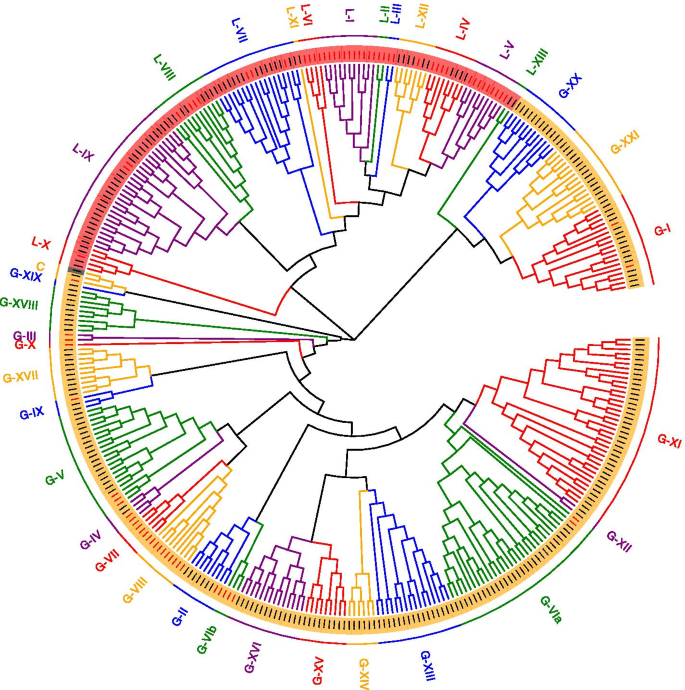
为了探讨AhRLK类的系统发育关系,我们分别对LRR-RLKs和LecRLKs的全长氨基酸序列进行了分析。AhLRR-RLKs和AhLecRLKs分别与AtLRR-RLKs(209)和AtLecRLKs(76)聚类。通过拟南芥RLK的分类,分析花生RLKs的系统发育关系。在ML树中,AhLRR-RLKs被划分为24个亚分支。1).最大的Subclade LRR-XI包含74个成员,而最小的Subclade LRR-V仅包含1个成员。遵循Marcella的分类标准[24和克拉斯[25],花生LecRLKs被划分为35个亚科,再分为3类:c型LecRLKs (C-LecRLKs)、l型LecRLKs (L-LecRLKs)和G-LecRLKs (G-LecRLKs)。2).最大的两个亚分支G-LecRLKs-XI和L-LecRLKs-IX分别包含37个和28个成员,而在花生中没有发现G-LecRLKs-VIb、G-LecRLKs-VIII、G-LecRLKs-VII、G-LecRLKs-X、G-LecRLKs-III、L-LecRLKs-VI、L-LecRLKs-I、L-LecRLKs-II、L-LecRLKs-III和L-LecRLKs-V的成员。
染色体定位和基因复制AhRLK年代
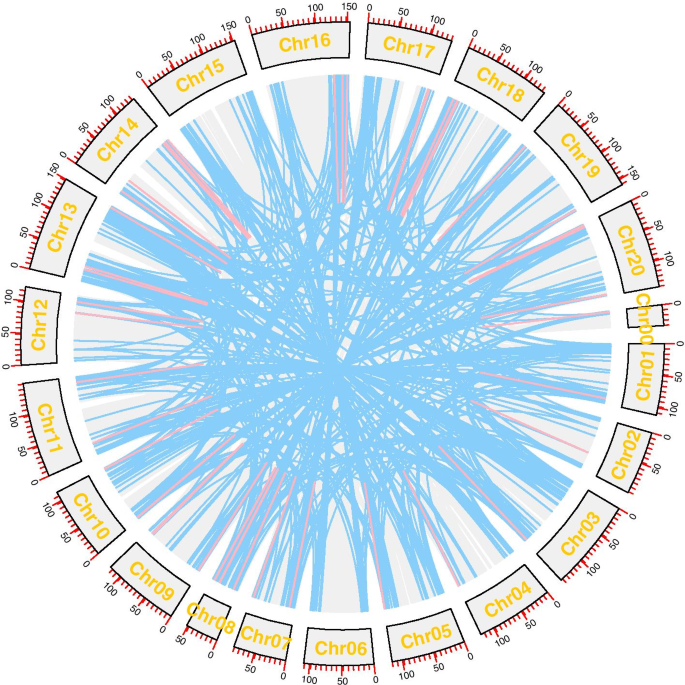
物理位置的AhRLK“花生基因组资源”(http://peanutgr.fafu.edu.cn/)[26用来将它们映射到花生染色体上。染色体地点信息表明所有的AhRLKS不均匀地分布在花生的20染色体中,1.14%(15/1311)没有显示装配信息(图。3.).许多AhRLKS分别位于14号染色体(111,8.47%)和13号染色体(106,8.09%)上,仅位于31号染色体(2.36%)上。AhRLKS位于第6染色体上。对于LRR-RLKs, LRR-XI和LRR-III亚家族存在于所有染色体上,其他亚家族仅存在于部分染色体上。大多数LRR-RLKs和LecRLKs位于chr 3、13、8和18(附加文件3.),特别是G-LecRLKs-XVII和G-LecRLKs-VIa亚家族的所有成员在第8章和第18章被分发(附加文件4, 图。4).
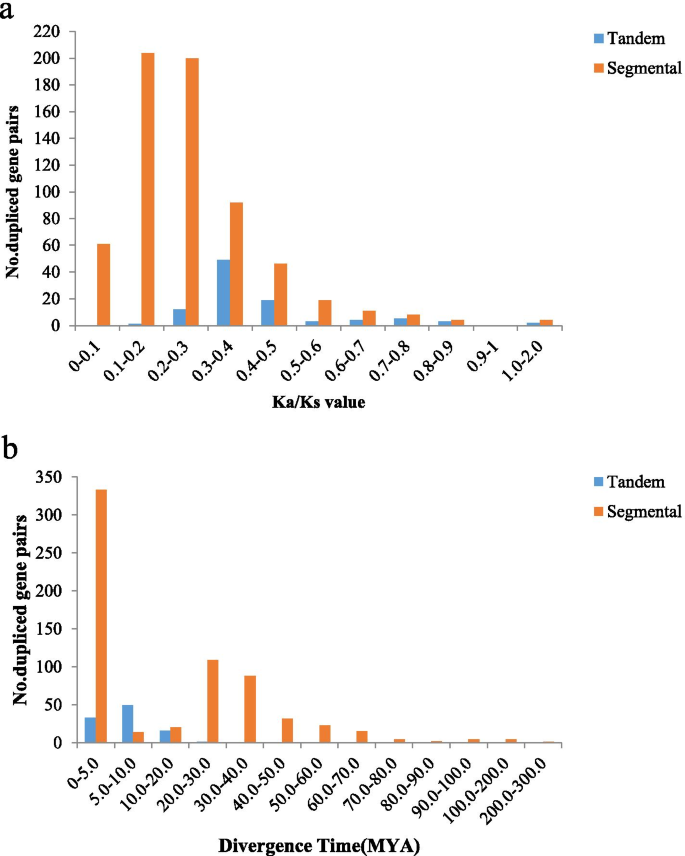
基因复制事件在蛋白质新功能的进化和基因组的扩展中起着重要的作用。片段重复和串联重复是植物基因家族扩增的主要原因[27].两个或两个以上的位置AhRLK100kb内的S被认为是串联重复群集。结果表明,约9.53%(125/1311)的基因位于串联重复区,构成52个基因簇5).其中,5.66%(31/548)的AhLRR-RLKs基因和17.51%(48/274)的AhLecRLKs基因位于串联重复区。最大的串联重复集群包含5个基因,而最小的集群只包含2个。810/1311基因中约61.78%(810/1311)位于重复区段。66.60%(365/548)的AhLRR-RLKs和37.96%(104/274)的AhLecRLKs位于片段重复区域。研究作用于个体的选择力AhRLKs,计算非同义取代率与同义取代率之比(Ka/Ks)。99对串联重复基因对中,96.97%(96/99)的Ka/Ks比值小于1,2.02%(2/99)的Ka/Ks比值大于1。一个串联重复基因对不能计算出Ka/Ks值。654对重复基因中,Ka/Ks比值小于1的有646对(98.78%),大于1的有4对(0.61%)。对于4个片段重复基因对,无法计算出Ka/Ks值。5).另外,我们用公式T = Ks/2r计算发散时间,其中r为植物核基因的发散率。双子叶植物的r按Koch方法每年每个地点取1.5*10^-8同义替换[28]. 结果表明82.82% (82/99) of tandem duplication events occurred 0–10 MYA, and 72.78% (476/654) of segmental duplication events occurred from 0–30 MYA (Additional file6).基因转换在重复基因的共同作用中发挥着重要作用。在52个串联复制簇中,19(36.54%)簇显示出统计学上显着的基因转化赛(P <0.05)。总共28个基因转化事件发生在52个串联复制簇中。基因转换的道长度范围为16到1771年的BP(附加文件7).
Al反应型AhRLKs的系统发育分析
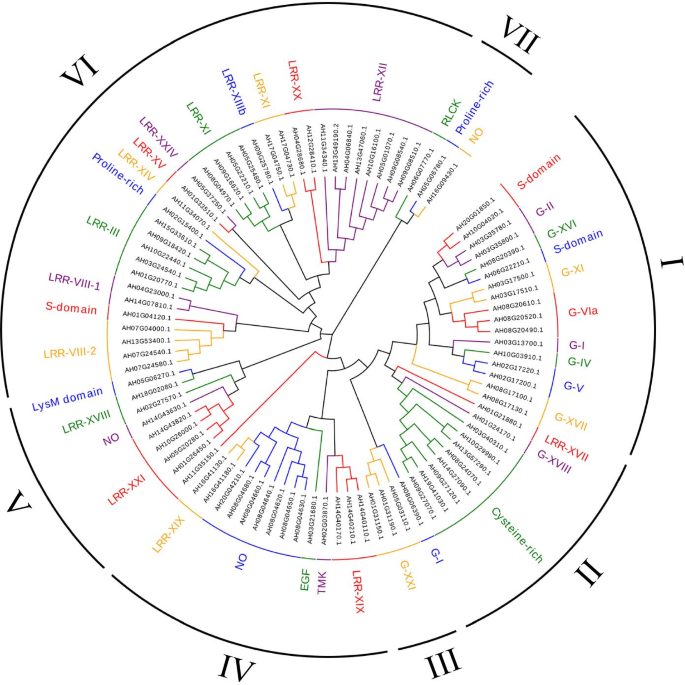
在之前的一项研究中,我们进行了转录组分析,以确定铝胁迫下两个花生品种之间的差异表达基因(DEGs)和通路[29].在这项研究中,我们仔细审查了转录组数据以检测参与AL响应的AHLLK。具有LOG2转化比率的基因大于1或小于-1的FPKM值被定义为差异表达基因。总共90个抗响应AHRLK,包括44 LRR-RLK,19个LECRLK,8个半胱氨酸富rlk,1 egf-rlk,富含脯氨酸的rlks,4 s域rlk,1 tmk rlk,1 rlck rlk,1Lysm域RLK,9个没有明显的域名(附加文件2).为了揭示这些蛋白的进化关系,我们使用ML方法构建了系统发育树(图1)。6).系统发育分析显示,Al-responsive AhRLKs进一步分为7类,分别为48.9%的LRR-RLKs、21.1%的LecRLKs和8.9%的CRKs。系统进化树显示,这些基因大部分属于LRR-RLKs和LecRLKs,覆盖了LRR-RLKs和LecRLKs的主要亚家族。有趣的是,这些Al-responsive AhRLKs在LecRLK家族中分布均匀,但在LRR-RLK家族中分布不均匀,主要集中在LRR-III、LRR-XI、LRR-XII、LRR-VIII-1和LRR-VIII-2。
铝胁迫相关的氨基酸序列和基因结构的鉴定AhRLK年代
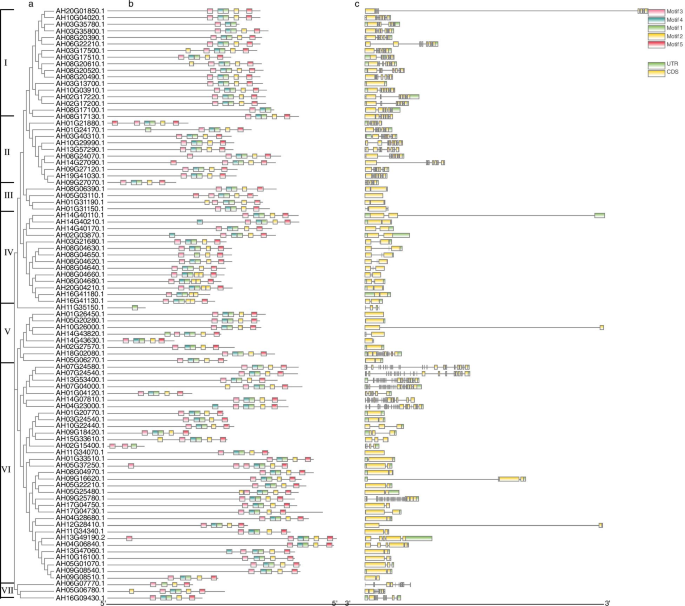
如图所示。7, 90例Al应力相关AhRLKs分为7组。据报道,外显子/内含子的多样化是某些基因家族进化的一个重要原因[30.].的外显子/内含子的分布AhRLKS被进一步分析。结果表明,7.8%的铝应力相关AhRLKS(7/90)没有内含子。30%(27/90)、15.6%(14/90)和1.1%(1/90)的Al胁迫相关基因中分别发现1、2和3个内含子AhRLK分别。同时,45.6%(41/90)的基因具有超过三个内含子。亚组中的所有基因I,II和VII含有超过三个内含子。在这30个基因中,只有一个是亚组II中的LRR-RLK基因,而15亚组I和II中的LECRLK(图。6,附加文件2).的majority of genes in subgroups III, IV and VI contained one or two introns, of which 70.6% (36/51) were LRR-RLKs, and 7.8% (4/51) were LecRLKs. This result was similar to the study in which most LRR-RLKs in Arabidopsis had fewer than three introns [31].此外,为了分析与应激相关的AHRLK的多样性,MEME工具用于预测这些蛋白质的推定基序。在AL压力相关的AHRLK中检测到共有5个不同的图案,并命名为TOT 1至5(附加文件8).亚组I的基因I.82.4%(14/17),亚组II中的70%(7/10)基因,亚组III亚组III中的50%基因,亚组IV中的基因42.9%(6/14),88.9%(8/ 9)亚组V,75.8%(25/33)亚组VI中的基因,以及亚组VII中的33.3%(1/3)基因,其含有与基序3-motif 4-基序的相同的基序组合物MOTIF 1-MOTIF 2-MOTIF 5。
Al-responsive表达谱AhRLK不同组织中的S
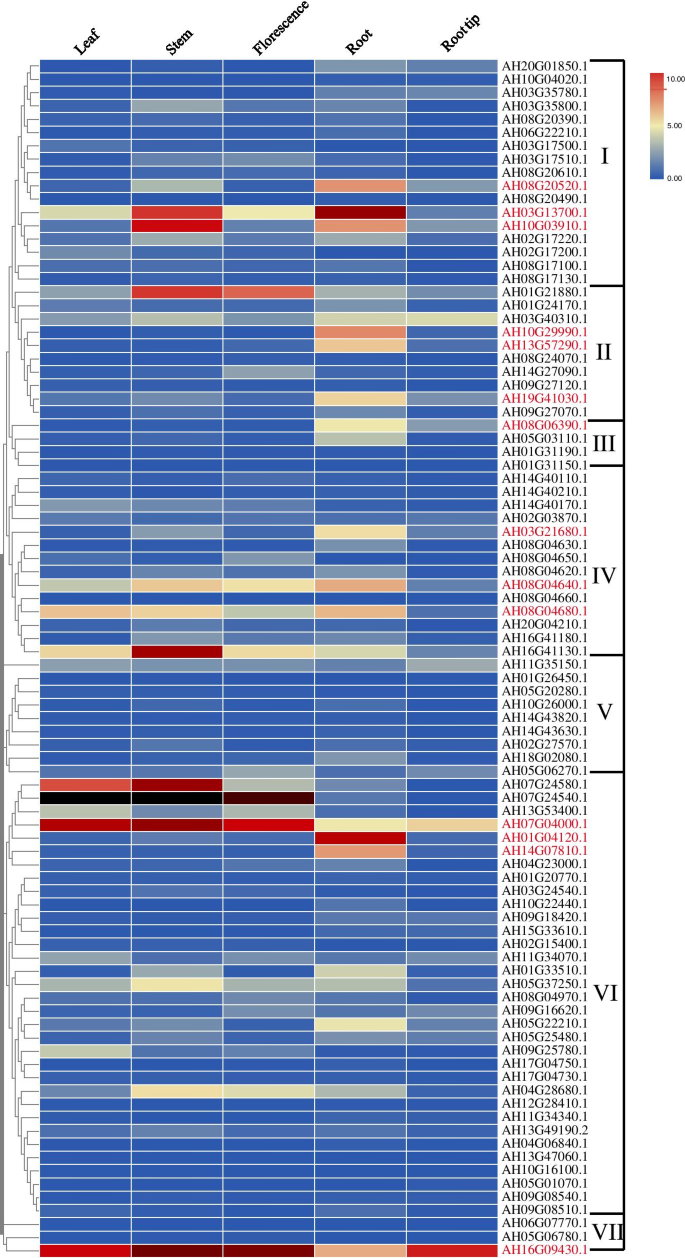
进一步了解al-enveryive的作用AhRLK在花生生长发育过程中,Al-responsive的表达谱AhRLK对不同器官,包括叶、茎、花期、根和根尖的S进行了测定。答:hypogaeaL.)利用转录组数据(图。8).在这些Al-responsiveAhRLKS在所有检测器官中表达最多(78/90,86.7%)。六个基因(6.7%AH16G41130.1,AH07G04000.1,AH07G24540.1,AH07G24580.1,AH08G04680.1,和AH16G09430.1), 12个基因在叶片中均有高水平表达(值> 5),占13.3%AH05G37250.1,AH04G28680.1,AH16G41130.1,AH01G21880.1.,AH07G04000.1,AH07G24540.1,AH07G24580.1,AH03G13700.1.,AH10G03910.1,AH08G04680.1,AH08G04640.1,和AH16G09430.1), 6个基因(6.7%,AH16G41130.1,AH01G21880.1.,AH07G04000.1,AH07G24540.1,AH08G04640.1,和AH16G09430), 14个基因(15.6%,AH07G04000.1,AH03G13700.1.,AH10G03910.1,AH08G04680.1,AH08G04640.1,AH16G09430.1,AH14G07810.1,AH03G21680.1 AH19G41030.1,AH13G57290.1,AH10G2990.1型,AH08G20520.1.,AH08G06390.1,和AH01G04120.1)在根或根尖。
Al-responsive的表达模式AhRLKs在Al压力下
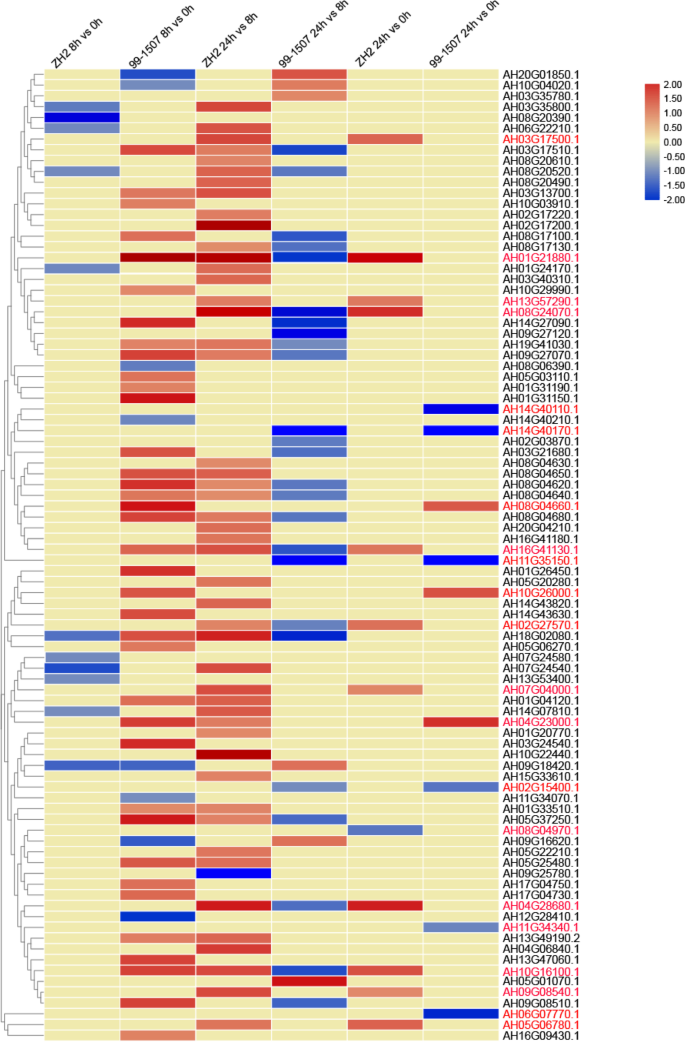
目的:进一步探讨Al-responsive的功能AhRLKS,从不同Al处理时间点产生的RNA-SEQ数据集用于揭示在Al胁迫下这些基因的表达谱。al-encooctive的表达谱AhRLKs以直方图表示(图。9).如图所示。9, 41.1% (37/90)AhRLK在99-1507中,Al胁迫8 h时,s的>呈两倍的上调。共12.2%(11/90)和8.9% (8/90)AhRLK在Al胁迫8 h下,ZH2和99-1507的>含量分别下降了2倍。在AhRLK在24 h和0 h铝处理比较中,3.3%(3/90)和12.2%(11/90)表现出>双倍调控,6.7%(6/90)和1.1%(1/90)。AhRLK展出的 > ZH2和99–1507分别在24小时和0小时铝处理中的双重下调比较(补充文件9).
讨论
片段重复事件在AhRLK家族进化中起着重要作用
RLKs参与多种植物生理过程和各种非生物和生物胁迫反应[32,33].在这项研究中,共1311例AHRLK,包括548 LRR-RLK,274个富集,83个半胱氨酸的RLK,76个EGF-RLK,49个脯氨酸的RLK,46秒域RLK年代,22TMK-RLK年代,2TNFR-RLK从花生全基因组序列中鉴定出1个RRO-RICH RLK、28个RLCK-RLKs、24个lym -RLKs和158个无明显结构域RLKs1).
将548 LRR-RLK分为24个亚壳(I至XXIV),基于与拟南芥的系统发育关系,这是拟南芥数量的2倍(图。1).通常,除了LRR-XII,LRR-XIV,LRR-XV和LRR-XVI之外,PEANUT中大多数亚属的LRR-RLK的数量是拟南芥的LRR-RLK数量的两倍。拟南芥成员人数的三倍。只有一个亚家族,LRR-V,成员比拟南芥更少。LECRLK的数量超过3倍的ATLECLK(图。2).花生中的l - lecrlks - vii、L-LecRLKs-IX和G-LecRLKs-VIa等亚家族远大于拟南芥的亚家族,而一些亚家族包括G-LecRLKs-VIb、G-LecRLKs-VIII、G-LecRLKs-VII、G-LecRLKs-X、G-LecRLKs-III、L-LecRLKs-VI、L-LecRLKs-I、L-LecRLKs-II、L-LecRLKs-III和L-LecRLKs-V,在花生中没有发现(表1和2).多倍性可能导致花生基因组基因数量的增加。在最近的研究中,共鉴定出309个、379个、467,531个和543个LRR-RLKs [34,二倍体杨树[35,四倍体大豆[36],异源六倍体小麦[37]和四倍体棉花[38]表明多倍体植物中存在较大的基因家族。其他因素,包括串联重复,片段重复,外显子重复和洗牌,也有助于扩大基因家族。
基因复制是进化事件的主要机制[39].基因复制结果显示9.53% (125/1311)AhRLKS位于串联重复区域,61.78%(810/1311)位于片段重复区域,表明片段重复在进化中起主要作用AhRLK(额外的文件5).在AhLRR-RLKs中,位于串联重复区和片段重复区分别占5.66%(31/548)和66.60%(365/548)。这一发现与大豆中片段复制可能是LRR-RLK扩增的主要机制的研究工作相一致[36]. 此外,ka/ks比值为94.9%(1290/1360)AhRLKS < 1,表示最多AhRLK选择s进行纯化(图。5).AH16G29500.1与AH16G29530.1、AH16G29500.1与AH16G29560.1、AH08G17100.1与AH18G07640.1、AH03G13490.1与AH13G15990.1、AH08G05340.1与AH17G29130.1与AH14G36690.1与AH14G43630.1这6对基因对的ka/ks比值均大于1,说明这些基因在花生中处于正向选择状态。进化迅速,可能对花生的进化非常重要。我们还计算了发散时间,结果显示,在相对较近的0-10年关键时期,出现了许多串联重复事件,在0-30年期间出现了许多节段重复事件(图1)。5b;附加文件6),说明这些AhRLK它们是由最近的基因复制事件产生的落花生hypogaeaL.此外,在52个串联复制簇的基因中检测到28个基因转化事件,并参与至少一种基因转化事件的44个基因,这表明在重复之间发生了基因转换事件AhRLKs.基因转换涉及到多基因家族的协同进化,这有助于基因进化,允许更多的重复基因获得可选择的差异[40,41].由于表达模式的变化是导致基因获得可选区别的重要因素[40,42],研究这些基因的时空表达模式将是很有意义的。
Al胁迫下AhRLKs的守恒
本研究共鉴定出90个与Al胁迫相关的AhRLKs基因,将其分为7组(图1)。7).大多数亚群表现出一定的外显子-内含子结构规律性。例如,亚组I、II和VII中的所有基因都包含三个以上的内含子。属于同一亚群的成员具有相似的外显子/内含子结构。此外,在这些AhRLKs中鉴定出5个保守的基序,亚群间的基序组成与系统发育分类一致。这些结果表明,亚群成员在进化过程中更加保守。
Al-responsive的多样性角色AhRLKS在不同的子群中
进一步了解al-enveryiveAhRLK在花生中,我们调查了各亚组的潜在功能(表3.).在亚组I,PERK1据报道,可调节ABA信号通路,调节根系生长过程中细胞伸长和ABA信号通路相关基因的表达[43],暗示亚组中的基因对植物信号传导和生长至关重要。已知对根伸长率的抑制是Al毒性的主要症状,并且亚组I的成员可以通过影响细胞伸长来参与Al反应。据报道,在亚组II中发挥作用的基因在植物信号转导,植物生长和生物应力反应中起作用,PXC1和Crck1.在信号转导中起作用[44,45],PRK1是花粉减数分裂后发育的关键[46],FLS2参与抵抗细菌感染的侵入前免疫[47),而RCH1对半生物营养真菌病原体的抗性至关重要吗Colletotrichum higginsinaum[48].在亚组III中,AXUR1 / AXUR2.参与控制受精过程中花粉管破裂和调节信号转导[49].费力尼亚是营养生长过程中细胞伸长所必需的[50],表明亚群III的基因可能在植物形态中起着重要作用。在第四组,TMK1是细菌DNA合成所必需的酶[51],表明IV亚组基因可能在细胞增殖和增殖调控中起着关键作用。亚群V基因RLK1型据报道增加了对盐度,重金属胁迫,和Botrytis cinerea感染(52],表明V亚群基因与生物和非生物胁迫应答有关。在第六小组,CRK5据报道是对干旱和盐胁迫的反应[53),而CRK45是幼苗早期生长中ABA信号的潜在正调控因子[54]气孔运动[55],表明VI亚群基因在非生物胁迫响应中起着关键作用,并与植物形态有关。在亚群VII中报道的基因,如GsSRK,被证明是植物耐受胁迫的正调节因子[56),而SD1-29提高植物对细菌的抵抗力[57],表明亚群VII基因在生物和非生物胁迫应答中起着关键作用。一般来说,Al-responsiveAhRLK在不同的亚组中,在不同的途径方面参与Al反应。亚组I和II与信号转导相关,亚组II涉及在生物应激反应中,亚组III和VI在植物形态中发挥重要作用,亚组IV在细胞膨胀和增殖调节中起着关键作用,以及亚组V和VII对生物应激和非生物应激反应至关重要(表3.).
的AtRLK基因家族在植物生长发育过程中起作用[63].如图直方图所示。8,响应的表达模式AhRLKS表现出组织特异性,约2.2% (2/90,AH07G04000.1和AH16G09430.1) Al-responsiveAhRLKS在所有四个测试的器官中表达,花生中具有高表达水平(值> 5),这意味着这些基因可能在植物生长和发育中起重要作用。大约2.2%(2/90,AH16G41130.1和AH07G24540.1) Al-responsiveAhRLKS特别表达,在空中器官的高水平下表达。约8.8%(8/90,ah13g57290.1、ah10g29990.1、ah08g20520.1、ah08g06390.1、和AH01G04120.1) Al-responsiveAhRLKS在根或根尖中特异性表达,且表达量高。这些al反应的组织特异性AhRLKS表示其在组织开发或组织功能中的关键作用。另外,6种组织非特异性基因(AH07G04000.1,AH03G13700.1.,AH10G03910.1,AH08G04680.1,AH08G04640.1,和AH16G09430.1),特别是在根中高水平表达的,也值得考虑。如图直方图所示。9,大多数al响应RLK公司在99-1507中,Al处理8 h后s表达上调,而部分对Al敏感的细胞中只有中度变化RLK公司在ZH2,这表明al响应RLK公司耐铝品种对铝胁迫反应迅速。虽然不同品种Al胁迫下基因表达谱不同,但12个基因(AH04G28680.1,AH16G41130.1,AH01G21880.1.,AH10G16100.1.,AH08G24070.1,AH02G27570.1,AH07G04000.1,AH09G08540.1,AH13G57290.1,AH03G17500.1,AH05G06780.1,和AH08G04970.1.)及9个基因(AH04G23000.1,ah11g34340.1,AH06G07770.1,AH14G40110.1,AH10G26000.1,AH02G15400.1,AH11G35150.1,AH14G40170.1,AH08G04660.1型),在24 h和0 h铝处理比较中达到峰值,说明在Al胁迫反应中起重要作用。其中,AH01G21880.1.和AH04G28680.1在茎中高水平表达,表明它们可能在调控茎的生长中发挥作用。AH13G57290.1在根中有高水平的特异性表达,表明它在介导花生对铝的反应中起着重要作用。AH07G04000.1在4个供试器官中均有高表达,可能在Al胁迫下的植物生长发育中发挥重要作用。综合起来,我们的结果显示,13个基因(AH11G35150.1,AH08G24070.1,AH13G57290.1,AH02G27570.1,AH05G06780.1,AH02G15400.1,AH01G35150.1,AH14G27090.1,AH05G37250.1 AH10G03910.1,AH19G41030.1.,AH10G29990.1,和AH10G26000.1)其同系物参与了水稻幼苗早期生长调控、早期花原基和雄蕊发育、侧根出苗、非生物胁迫反应和植物防御信号等拟南芥,是重要的铝反应基因,可能是解释花生铝反应机制的合适候选基因。
结论
本研究在花生基因组中共鉴定出1311个RLKs,是拟南芥RLKs数量的2倍,其中LRR-RLKs 548个,LecRLKs 274个。LRR-RLK是植物中发现的最大的RLK基因家族。这些AhRLKS不均匀地分布在花生20染色体中。与串联重复相比,分段重复可能在某些情况下发挥更重要的作用AhRLK此外,我们确定了总共90 Al-responsiveAhRLKs通过挖掘转录组数据库。在同一组或亚组中的成员之间,外显子/内含子组合物和基序布置受到显着保守。转录组数据分析显示了90抗响应的组织表达模式AhRLK和组织特异性表达基因。其中,根系特异性基因可能在花生铝的传感和反应中起着关键作用。Al-responsive AhRLKs与同一亚群中的特征AhRLKs的密切系统发育关系,为进一步了解其功能提供了依据。总之,该系统分析为了解铝胁迫下花生AhRLK基因的生物学功能提供了有价值的信息。
方法
花生AhRLKs的资源
拟南芥RLK全长氨基酸序列均从UniProt (https://www.uniprot.org/),这些序列被用作查询,对其执行BLASTP搜索A.硬脑膜RLKs由NCBI (https://www.ncbi.nlm.nih.gov/).这些序列被用作新的查询,在花生基因组资源(http://peanutgr.fafu.edu.cn/),以避免遗漏潜在成员。冗余条目被手动删除。然后用SMART (http://smart.embl-heidelberg.de)[65]和NCBI的保守域数据库(CDD;http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)确保在新认定的成员中存在RLK域。只有含有至少一个激酶结构域的蛋白质被认为是推定的ahRLK,最终获得1311 AHRLK。氨基酸残基碱和分子量用扩展的Protparam工具预测(https://web.expasy.org/protparam/).根据花生基因组资源(http://peanutgr.fafu.edu.cn/).
基因的多重序列比对和系统发育树的构建AhRLK年代
在上一节中定义的LRR-AHRLK,LRR-AHRLK,LECRLK和90 an响应AHRLK的全长氨基酸序列在MEGA 7中使用Clustalx对齐,默认参数[66].基于花生LRR-RLKs多序列比对的系统发育树(图。1),Lecrlks(图。2)和90 AHRLK响应Al应激(图。6)是由《MEGA 7》创造的。泊松修正模型被用来解释多重替换,而对齐间隙被部分删除。统计强度是通过使用1000个重复的自助重新抽样估计的。基于多序列比对和以前报道的分类拟南芥,花生RLK公司S被划分为不同的亚科和亚群[24,67].
花生的染色体位置和复制分析RLK公司年代
的物理位置AhRLK花生基因组资源数据库(http://peanutgr.fafu.edu.cn/).的所有成员AhRLK利用mapgene 2染色体v2 (MG2C:http://mg2c.iask.in/mg2c_v2.0/).从包含花生基因组注释信息的GFF文件中提取花生染色体定位信息。采用BLASTP技术寻找潜在的同源基因对(e值< 1e−5在基因组)。同源对的信息被MCScanX作为输入来识别共tenic链[68].此外,McScanx还用于识别串联和节段性重复AhRLK基因家族。RLK公司根据其他植物的标准,在100 KB内聚集的S基因被认为是串联重复的基因。图是由TBtools [69].非同义词(KA)和同义词(KS)替换比是通过TBTOOLS中的简单KA / KS钙质计算的。用公式T = Ks / 2R计算分歧时间,双子叶植物r为每年每年的1.5×10 ^ -8个同义代表[70].我们使用带有默认参数的Geneconv程序来寻找串联重复簇基因转换的证据(http://www.math.wustl.edu/~sawyer/geneconv/)[71].由于GENECONV需要至少三个序列来检测基因转换事件,因此可以检测到至少包含3个基因的串联重复簇。对于这个程序,使用群集对齐(CDS)作为输入。Geneconv可以检测到基因对间定向基因转换的候选片段(允许错配)。当P< 0.05。
基因结构与基序分析AhRLK对Al压力的反应
根据90个花生Al-responsive AhRLKs的编码序列比对和各自的基因组序列确定其外显子-内含子结构,图表由在线程序Gene Structure Display Server提供,默认参数为(http://gsds.cbi.pku.edu.cn/)[72].为了识别AL反应AHRLK的保守的主题,MEME(METIF ELICITITE)工具用于预测这些蛋白质的推定基序(http://meme-suite.org/)[73]. 利用TBtools生成系统发育树、基因和蛋白质结构的组合。
Al-responsive的表达模式分析AhRLK年代
通过仔细检查现有的转录组数据,Al-responsive的表达谱AhRLK分析了正常条件下不同花生组织和铝胁迫下不同花生品种根尖中s的含量。叶片、茎、花期、根和根尖等5个组织的rna序列可在花生基因组资源(http://peanutgr.fafu.edu.cn/).ZH2(中华市NO.2,AL敏感)和99-1507(AL耐受)的RNA-SEQ数据在加入号PRJNA525247下的国家生物技术信息(NCBI)的数据库中沉积了Al治疗的数据库中(https://www.ncbi.nlm.nih.gov/sra/prjna525247). 铝合金FPKM值与基因FPKM值Log2转化率的热图AhRLK使用TBTOOLS可视化不同品种或组织的S.
可用性数据和材料
本研究中生成并分析的数据集可从通讯作者处获得。两个花生品种,用于生成RNA-seq Bo-shou教授提供的数据与Al治疗请廖从油料作物研究所、中国农业科学院(CAAS),他们经常在农场种植的广西大学在南宁,广西,中国,教授发现了他。详细情况,中华2号(ZH2)(85-007,中国花生数据中心,http://www.peanutdata.cn/variety/index.htm)已广泛用于农业实践,而99-1507未获批准用于商业用途。Al处理下的ZH2和99-1507的RNA-seq数据已保存在国家生物技术信息中心(NCBI)数据库中,注册号为PRJNA525247 (https://www.ncbi.nlm.nih.gov/sra/prjna525247).原始rna序列在不同的组织中读取AhRLKS序列可在花生基因组资源(http://peanutgr.fafu.edu.cn/).
缩写
- 啊:
-
arachis.hypogaea..L
- 艾尔:
-
铝
- 在:
-
拟南芥
- EGF-RLK:
-
表皮生长因子如RLK
- LecRLK:
-
Lectin-like RLK
- LRR-RLK:
-
富亮氨酸重复RLK
- 纤毛运动:
-
程序性细胞死亡
- PR5K-RLK:
-
发病机制相关蛋白5样受体激酶RLK
- 模因:
-
多重Em主题启发
- ml:
-
Maxinum火险隐患
- RLK公司:
-
受体蛋白激酶
- S-RLK:
-
S域RLK
- TNFR-RLK:
-
肿瘤坏死因子受体样RLK
- WAK1:
-
细胞壁相关受体激酶1
参考文献
- 1.
Uexküll HRV,Mutert E。酸性土壤的全球范围、发展和经济影响。种植土壤。1995;171(1):1–15.
- 2.
Sade H、Meriga B、Surapu V、Gadi J、Sunita MSL、Suravajhala P、Kishor PBK。植物对铝的毒性和耐受性:使植物适应酸性土壤。生物金属。2016;29(2):187–210.
- 3.
根尖铝毒性的恢复过程。可能与氧化应激有关。植物科学。2012;185 - 186:1 8。
- 4.
姚森,黄伟,潘超,詹杰,何峰峰。caspase样蛋白酶调控铝诱导的花生程序性细胞死亡。植物细胞组织器官邪教。2016;127(3):1-13。
- 5.
他,顾m-h,他l-f。高等植物中铝诱导的编程细胞死亡的信号通路。in:Panda Sk,Baluškaf,编辑。植物中的铝力适应。Cham:Springer International Publishing;2015. p。63-80。
- 6.
陈建平,陈建平。细胞程序性死亡在植物生长发育中的作用。Cell Dev Biol. 2016;32(1): 111315-24915。
- 7.
Yamamoto Yhamh。通过铝和铁的组合对膜的氧化损伤。植物细胞生理。1997年; 38(12):1333-9。
- 8.
Rath I,Barz W。脂质过氧化在大豆细胞悬浮培养铝毒性中的作用。生物科学杂志。2000;55(11–12):957–64.
- 9.
Boscolo PRS、Menossi M、Jorge RA。铝诱导的玉米氧化胁迫。植物化学。2003;62(2):181–9.
- 10.
TamásL,Budíkovás,HuttováJ,Mistríki,Šimonovičovám,Širokáb.铝诱导的大麦根边界细胞的细胞死亡与过氧化物酶和草酸盐氧化酶介导的过氧化氢产生相关。植物细胞代表2005; 24(3):189-94。
- 11.
Yakimova ET, Kapchinatoteva VM, Woltering EJ。铝诱导番茄悬浮细胞死亡的信号转导事件。植物生理学杂志。2007;164(6):702-8。
- 12.
Jie Z,寇RJ,庄震李,胡毅河,龙飞啊,大学G.南宁:铝对花生根尖线粒体膜生理特性的影响。Acta Agron Sin。2009; 35(6):1059-67。
- 13.
摘要/ abstract Yuan N, Rai KM, Balasubramanian VK, Upadhyay SK, Luo H, Mendu V.全基因组的鉴定和鉴定揭示了SIF亚家族在棉花(Gossypium hirsutum)中的功能保护。中国生物医学工程学报。2018;18(1):185。
- 14.
吉兰顿JLDCCJ。芸薹属植物的整合膜S位点受体激酶在膜环境中具有丝氨酸苏氨酸激酶活性,在植物体内自发形成寡聚体。美国国家科学院学报,2000年;7(97):3759–64.
- 15.
关键词:光抑制受体蛋白激酶,光调控,拟南芥足底。1997;202(4):479 - 86。
- 16.
Clark Se Wrme,Clark Se,Williams Rw,Meyerowitz Em。Clavata1基因编码了一种推定的受体激酶,其控制拟南芥中的芽和花卉分发尺寸。细胞。1997年; 89:575-85。
- 17.
Kline KGCMJ公司。植物激素脱落酸诱导的植物体内蛋白质磷酸化的变化。美国自然科学院,2010;107(36):15986–91.
- 18.
陈克德尔茨。拟南芥中病原体诱导的受体样蛋白激酶对防御反应的敏化和程序性细胞死亡的激活。植物分子生物学。2003;53:61–74.
- 19.
RLK7是一种富含亮氨酸的重复受体样激酶,在拟南芥中具有良好的发芽速度和抗氧化能力。足底。2010;232(6):1339 - 53年。
- 20.
冯燕,朱崇信,庞鹏飞。植物受体样蛋白激酶的研究进展。西北植物学报,2009;4:851-8。
- 21.
Stone JM, Walker JC。植物蛋白激酶家族及其信号转导。植物杂志。1995;108(2):451 - 7。
- 22.
张丽丽,唐海燕,何志华。反义表达的细胞壁相关蛋白激酶,WAK4,抑制细胞伸长和改变形态。植物细胞。2001;13(6):1317 - 31所示。
- 23.
拟南芥细胞壁相关受体激酶(cell wall-associated receptor kinase)基因表达及蛋白定位。植物杂志。2003;132(4):2256 - 66。
- 24。
拟南芥和番茄g型凝集素受体激酶的分类和系统发育分析。BMC基因组学。2018;19(1):239。
- 25。
拟南芥l型凝集素受体激酶的研究进展。实验机器人。2009;60(15):4383-96。
- 26。
庄W,Chen H,Yang M,Al E.栽培花生基因组提供了深入的植物核型,多倍体演化和作物驯化。NAT Genet。2019; 5(51):865-76。
- 27。
植物抗病基因进化中的串联和片段复制与重组。趋势麝猫。2004;20(3):116 - 22所示。
- 28。
陈晓霞,王永红,王永红,等。拟南芥中查尔酮合成酶和乙醇脱氢酶基因座的进化分析。植物分类学报,2011,30(5):657 - 664。鼹鼠Biol Evol。2000; 17(10):1483-98。
- 29.
董晓,夏玲,云义。转录组分析表明,铝胁迫下两种花生品种的基因表达及其通路存在显著差异。基因。2021;781:145535。
- 30
Yu J WJLW。水稻基因组:水稻基因组:复制的历史。公共科学图书馆杂志。2005;2(3):266 - 81。
- 31
姜梅,彭伟,张少玲,王菊优。富亮氨酸重复受体样蛋白激酶(LRR-RLK)基因家族的全基因组特征、进化和表达分析。BMC基因组学。2017;18(1):763。
- 32.
请K,英厄姆E,沃克·JC。理解RLK功能的挑战。植物生物学杂志。1998;1(5):388 - 392。
- 33.
Sun X.Xa26,赋予Xanthomonas oryzae PV抵抗的基因。在水稻中柚子编码LRR受体激酶样蛋白。工厂J. 2004; 37(4):517-27。
- 34.
李新利,王国良。水稻lrr激酶的全基因组鉴定、特性分析及系统发育分析。《公共科学图书馆•综合》。2011;6 (3):e16079。
- 35.
王英杰。杨树富含亮氨酸重复序列受体样蛋白激酶基因的全基因组鉴定、鉴定和表达分析。BMC基因组学。2013;318(14):318.
- 36.
关键词:大豆,亮氨酸,重复受体样蛋白激酶,全基因组鉴定植物生物学学报。2016;16(1):58。
- 37.
结果表明,小麦中富含亮氨酸的重复受体样激酶(TaLRRKs)存在功能差异。植物科学与技术,2016;
- 38.
在棉花(Gossypium hirsutum)中,LRR-RLKs基因的全基因组鉴定揭示了SIF亚家族的功能保护。植物生物学学报。2018;18(1):185。
- 39.
guo yl。绿色植物的基因家族演变,重点是拟南芥基因的起源和演化。植物J细胞鼹鼠Biol。2012; 73(6):941-51。
- 40.
沃尔什简森-巴顿。重复的基因多长时间进化出新的功能?遗传学。1995;139(1):421 - 8。
- 41.
Hanikenne M, Kroymann J, Trampczynska A, Bernal M, Motte P, Clemens S, Krämer U. Hard selective sweep and ectopic gene conversion in A gene cluster afforder environmental adaptation.研究表明,在一种具有环境适应能力的基因簇中,Hard selective sweep和ectopic gene conversion具有选择性。公共科学图书馆麝猫。2013;9 (8):e1003707。
- 42.
Rourke I J EPD。Helicoverpa Armigera(Lepidoptera:Noctuidae)串联重复细胞质肌动蛋白基因之间基因转化的证据。j mole evol。1997年; 44(2):169-77。
- 43.
这种富含脯氨酸的伸展蛋白样受体激酶-1 (PERK1)基因可在受伤时迅速诱导。中国生物医学工程学报,2002;
- 44.
拟南芥LRR-RLK, PXC1是一个与TDIF-PXY/TDR-WOX4信号通路相关的次生壁形成调控因子。植物生物学学报。2013;13(1):94。
- 45.
杨涛,乔杜里,杨磊,陈勇,普瓦雅。钙/钙调素上调植物胞质受体样激酶。生物化学杂志。2004;279(41):42552-9。
- 46.
Lee HS,Karunanandaa B,McCubbin A,Gilroy S,Kao Th。PRK1,一种受体样激酶佩妮inflata,对Pollen的后生物发育至关重要。工厂J. 2003; 9(5):613-24。
- 47.
关键词:植物免疫,fls2相关激酶,BIK1, NADPH氧化酶,RbohD细胞宿主微生物。2014;15(3):329-38。
- 48。
Narusaka Y,Narusaka M,Park P,Kubo Y,Hirayama T,Seki M,Shiraishi T,Ishida J,Nakashima M,Enju A. RCH1,拟南芥的基因座,赋予血管性真菌病原体Collectrichum Higginsianum的抵抗力。鼹鼠植物微生物相互作用。2004; 17(7):749-62。
- 49。
DU S,曲LJ,Xiao J.Crrlk1L受体样激酶的细胞外结构域的晶体结构Anxur1和Axur2。蛋白质SCI。2018; 27(4):886-92。
- 50
杨云清,王永明,王永明。FERONIA受体样激酶的激酶死亡版本对莲座形态和ralf1介导的气孔运动具有剂量依赖性的影响。2月。2018;592(20):3429 - 37。
- 51
Martínez-Botella G, Loch JT, Green OM, Kawatkar SP, Olivier NB, Boriack-Sjodin PA, Keating TA。磺酰哌啶类药物作为革兰氏阳性胸苷酸激酶(TMK)的新型抗菌抑制剂。2013;23(1): 169-73。
- 52
YarivBrotman USJL。lysm受体样激酶lysm RLK1是激活拟南芥中真菌几丁质酶过度表达诱导的防御和非生物胁迫反应所必需的。摩尔。2012;5:1113-24。
- 53
卢凯,梁松,吴忠,毕超,于永涛,马勇,王新飞,张培培。拟南芥中富含半胱氨酸受体样蛋白激酶CRK5的过表达增强了脱落酸的敏感性,并赋予了耐旱性。实验机器人。2016;67(17):5009-27。
- 54
张X,杨G,Shi R,Han X,Qi L,王R,Xiong L,Li G.拟南芥富含富含性的受体样激酶45在反应对脱钙酸和非生物胁迫的反应中的作用。植物理性生物化学。2013; 67(67C):189-98。
- 55
关键词:拟南芥,半胱氨酸受体样激酶45,脱落酸,非生物胁迫植物生理学杂志。2013;67:189-98。
- 56.
太阳XL,Yu qy,唐ll,ji w,白x,cai h,刘xf,丁xd,zhu ym。GSSRK,G型凝集素S-受体样丝氨酸/苏氨酸蛋白激酶是对盐胁迫的植物耐受性的正调节因子。J植物理性。2013; 170(5):505-15。
- 57.
Huard-Chauveau C, Perchepied L, Debieu M, Rivas S, Kroj T, Kars I, Bergelson J, Roux F, Roby D, McDowell JM。平衡选择下的非典型激酶使拟南芥具有广谱抗病能力。公共科学图书馆麝猫。2013;9 (9):e1003766。
- 58.
Takahashi T, Mu J, Gasch A, Chua N.拟南芥花中受体样蛋白激酶的PCR鉴定。植物生物学杂志。1998;37(4):587-96。
- 59.
Gómezgómez L,Boller T。FLS2:一种LRR受体样激酶,参与拟南芥中细菌激发子鞭毛蛋白的感受。摩尔细胞。2000;5(6):1003–11.
- 60。
李佳,刘尼,舒斯特拉,鸟居,华杰。信号转导中的丝氨酸/苏氨酸受体蛋白激酶:拟南芥直立受体样激酶的分析。新植醇。2010;151(1):133 - 43。
- 61。
Jung CG, Hwang S, Park YC, Park HM, Kim DS, Park DH, Jang CS。低温和热诱导拟南芥PXL1基因的分子特性及其在温度波动下转导途径中的潜在作用植物生理学杂志。2015;176 - 138。
- 62。
王X,侯S,吴Q,林M,Acharya BR,吴D,张W。IDL6-HAE/HSL2对拟南芥叶片果胶降解及对丁香假单胞菌pv番茄DC3000抗性的影响。植物J。2017;89(2):250–63.
- 63。
周烨,谭乙,罗梅,李烨,刘丙,陈丙,于丙,杨S,董S,阮杰。组蛋白脱乙酰酶19与HSL1相互作用并参与抑制拟南芥幼苗种子成熟基因。植物细胞。2013;25(1):134–48.
- 64.
拟南芥凝集素S结构域受体激酶介导脂多糖传感的研究进展Nat Immunol。2015;16(4):426 - 33所示。
- 65.
Leatunic I,Deerks T,Bork P. Smart:2015年最近的更新,新的发展和地位。核酸Res。2015; 43(D1):D257-60。
- 66.
Sudhir K, Glen S, Koichiro T. MEGA7:针对更大数据集的分子进化遗传学分析7.0版。中国生物医学工程学报。2016;33(7):1870-4。
- 67.
Magalh Es DM, Scholte LLS, Silva NV, Oliveira GC, Zipfel C, Takita MA, De Souza AA。两个柑橘属的LRR-RLK家族:全基因组鉴定和进化研究。BMC基因组学。2016;17(1):623。
- 68.
W Yupeng W, Haibao T, DJ D, Xu T, Jingping L, Xiyin W, Tae-ho L, Huizhe J, Barry M, Hui G, et al. .MCScanX:一个用于基因共线性和共线性检测和进化分析的工具包。核酸研究。2012;40(7):e49。
- 69.
Chen C,陈H,Zhang Y,Thomas HR,夏R.TBTOOLS:为大生物数据的互动分析开发了一种综合工具包。莫尔植物。2020; 13(8):1194-202。
- 70。
陈晓霞,王永红,王永红,等。拟南芥中查尔酮合成酶和乙醇脱氢酶基因座的进化分析。植物分类学报,2011,30(5):657 - 664。鼹鼠生物进化2000;10:10。
- 71。
索耶股份有限公司。检测基因转化的统计检验。分子生物学。1989;6(5):526–38.
- 72。
胡b,金j,guo ay,张h,高g. gsds 2.0:升级的基因功能可视化服务器。生物信息学。2014; 31(8):1296。
- 73。
BT L, Mikael B, Buske A F, F Martin, Grant C E, Luca C, Jingyuan R, Li W W, Noble S W. MEME套件:motif发现和搜索工具。纳尼亚。2009;37 (suppl2): W202-8。
致谢
我们感谢夏丽小姐和李伟小姐为转录组测序开发了生物学实验。
资金
国家自然科学基金资助项目(No. 31701356, No. 31860334)。关键词:岩石力学,数值模拟,数值模拟除了提供资金支持,资助机构不参与研究设计、数据分析、结果解释或手稿准备。
作者信息
从属关系
贡献
DX和LFH构思了实验。DX和XW设计了实验。XW,MHW和RLH进行了数据分析,XW,DX撰写了手稿。DX,XW,LFH,AQW和jz修改了这个手稿。所有作者都阅读并批准了最后的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
王晓,吴明华,肖德明。等等。花生铝胁迫应答中RLKs基因的全基因组鉴定与进化分析BMC植物杂志21,281(2021)。https://doi.org/10.1186/s12870-021-03031-4
收到了:
接受:
发表:
关键词
- 花生
- RLK公司
- 基因家族
- 全基因组分析
- al胁迫