摘要
背景
香气是水果最重要的内在品质属性之一。“瑞雪”苹果是由“粉红小姐”与“富士”杂交选育而成。然而,关于“瑞雪”苹果香气成分的含量和组成,以及“瑞雪”及其亲本的遗传性状,人们知之甚少。此外,人们对香气挥发物和香气相关基因的生物合成代谢途径仍知之甚少。
结果
使用气相色谱 - 质谱(GC-MS)鉴定挥发性芳香化合物。我们的研究结果表明,挥发性化合物的轮廓随成熟而变化。醛是早期果实发育中的主要挥发性化合物,醇和酯在成熟过程中急剧增加。基于热爱制造树枝形图,这些香气化合物聚集成七组。在成熟的水果中,酯和三萜类化合物是在“粉红女士”和'富士'苹果的成熟果实中的主要香气挥发物,它们包括2-甲基丁酯的丁基;丙酸己酯;丙酸己酯;己酸己酯;乙酸己基酯和(Z, E)-α-法尼烯。有趣的是,醛和三萜类化合物是“瑞灵”成熟果实中的主要挥发性芳香化合物,主要包括己醛; 2-hexenal; octanal; (E)-2-octenal; nonanal and (Z, E)-α-farnesene. By comparing the transcriptome profiles of ‘Ruixue’ and its parents fruits during development, we identified a large number of aroma-related genes related to the fatty acid, isoleucine and sesquiterpenoid metabolism pathways and transcription factors that may volatile regulate biosynthesis.
结论
我们的初步研究有助于更好地了解影响水果味的挥发性化合物以及“瑞灵”与其父母之间的味道差异的机制。
背景
水果的品质主要取决于其外观、质地、风味和营养特性[1]. 水果风味是最重要的内在品质属性之一,由糖、有机酸和香气决定[2].果香浓郁,可以直接反映其风味特征,是影响消费者接受度和市场竞争力的关键因素[3.]. 与水果香气相关的大约2000种挥发性化合物高度复杂多样。到目前为止,苹果中大约有350种挥发性化合物被鉴定和定量[2],主要是鉴定为酯,醇,醛,酚,醚,萜烯,酮和一些硫化合物。其中只有少数少数贡献到果子香气[2,4].
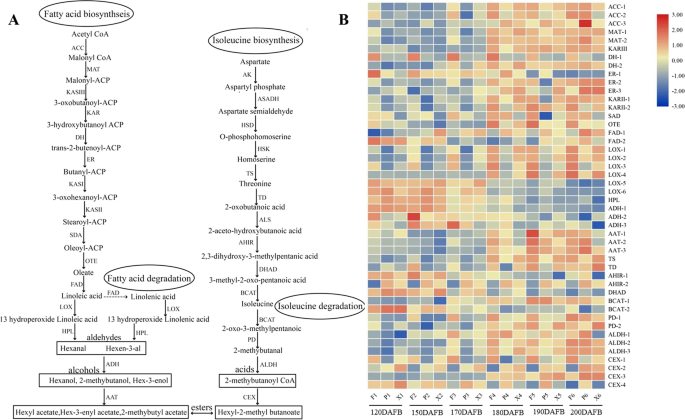
挥发性芳香化合物通过四种初级代谢途径制备,包括脂肪酸,异亮氨酸,甲羟戊酯和苯丙砜途径[5].醛、醇和酯(直链)由脂肪酸代谢途径通过β氧化和脂氧合酶活性(LOX)合成。脂氧合酶(LOX)途径包括脂氧合酶(LOX)、过氧化氢酶(HPL)、酒精脱氢酶(ADH)和酒精酰基转移酶(AATs) [6].脂氧合酶(LOX)是脂肪酸降解(亚油酸和亚麻酸)过程中酯(直链)生物合成的第一步。在苹果中,总共有23个潜在的功能性脂氧合酶(LOX)基因已被假定鉴定出来[7]. 基因表达分析和QTL定位实验表明mdlox1a.和MdLOX5e在分子育种方法中涉及到水果香气挥发物的产生[7].醇酰基转移酶(AAT)参与最后步骤和限速酯生物合成[8].酒精酰基转移酶1 (MpAAT1公司)已被隔离从“皇家佳拉”苹果,催化初级酯的合成[9].MpAAT1公司已经与酯QTLS(LG2)(LG2)和转基因苹果(AAT1敲低线)共同定位,表现出总酯浓度的显着降低,特别是在乙酸2-甲基丁基丁基丙酯中[10].此外,酒精酰基转移酶2 (MdAAT2)在“青霉苹果”中高度表达,并与酯产量显著相关[11].据报道,AAT基因家族成员在不同苹果品种中的表达存在差异[12]. AAT酶的不同植物基因型和底物特异性是导致酯挥发物产生的品种差异的重要因素[6,13].Terpenes由细胞质中的甲戊酯(MVA)途径产生[5].萜烯合成酶(TPS)是合成挥发性萜烯的关键酶。在苹果中,总共确定了55个公认的苹果TPS家族成员,功能分析发现只有10个TPS基因预计有功能,合成了“皇家Gala”苹果中产生的大部分萜烯挥发物,如D-germacrene、芳樟醇和a-蒎烯[14].值得注意的是,TPS酶的α-法尼烯合成酶(MdAFS1)及其氧化产物被认为是导致表面烫伤(一种采后生理紊乱)的关键因素[15].
不同品种果实中香气化合物的含量和组成的差异,会产生不同的风味。在“金鲜”苹果中,总共有65种挥发性香气化合物(自由和束缚形式)已被假定鉴定和定量。其中,酯类和醇类占总挥发物的90%以上,乙酸丁酯(156.70ug/kg)、2-甲基-1-丙醇(126.72ug/kg)和正丁醇(473.28ug/kg)是主要化合物[16].在“富士”苹果中,共有64种挥发性香气化合物已经鉴定和量化。其中,已经稳定地鉴定为主要化合物,第二种是酯化合物,其中2-甲基-1-丁醇(368.05 kg),正丁醇(776.40g / kg)和丁酯(71.52ug /kg)最丰富的[16].据推测,在“粉红小姐”苹果中共检出63种挥发性化合物,主要是正丁醇,其次是2-甲基-1-丁醇,1-己醇,乙酸丁酯[16,17].最近,我们利用气相色谱-嗅觉分析(GC-O)和香气提取液稀释分析(AEDA)对“蜜脆”苹果的特征香气进行了初步鉴定和定量[4].己基丁酸甲酯、己基2-丁酸甲酯、α-法尼烯和(E)-2-己烯醛是“蜜脆”苹果香气的主要贡献者。
瑞雪苹果是从晚熟黄苹果品种“粉红女士”和“富士”杂交而成。本实验室对瑞雪果的品质进行了初步研究,感官分析表明,瑞雪果果肉脆、多汁、甜,与亲本相比具有明显的香味[18].然而,关于“瑞雪”苹果香气成分的含量和组成,以及“瑞雪”及其亲本的遗传性状,人们知之甚少。此外,人们对香气挥发物和香气相关基因的生物合成代谢途径仍知之甚少。采用气相色谱-质谱联用技术(GC-MS)对‘瑞雪’、‘粉红小姐’和‘富士’三个品种果实发育过程中的挥发性香气成分进行了初步鉴定和定量,并进行了比较。利用RNA测序(RNA-seq)转录组数据和定量逆转录- pcr技术,对“瑞雪”、“粉红小姐”和“富士”苹果果实发育过程中脂肪酸、异亮氨酸和倍半萜代谢途径中与香气合成相关的候选结构基因和潜在交易因子进行鉴定。本研究旨在阐明“瑞雪”及其亲本之间的挥发性香气成分差异对这3个品种风味的影响机制。
结果
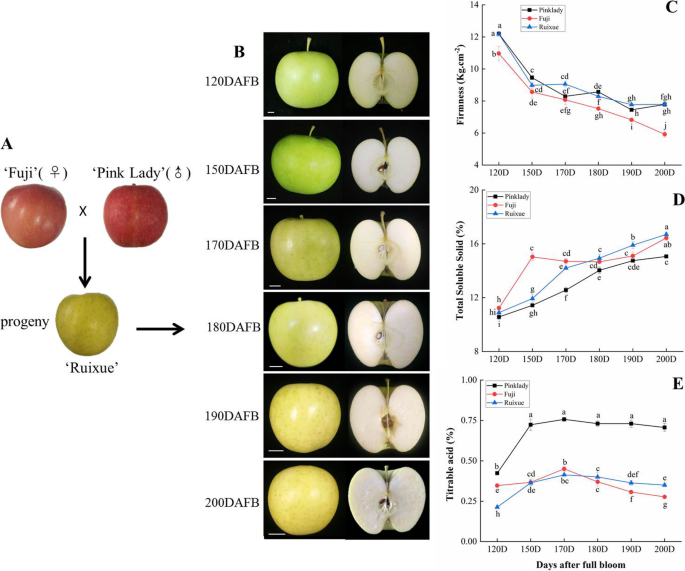
水果开发期间“瑞夏”及其父母苹果的生理特征
“瑞雪”苹果是由“粉红小姐”和“富士”杂交而成的黄色品种。1a).从120个DAFB到成熟期共收集了6个发育阶段。“瑞雪”苹果皮的颜色由绿色变为黄色,果肉的颜色由绿色变为乳白色。1b)。果实坚固,可溶性固体和可滴定酸度是果实质量的关键因素。三种品种的果实坚固性显示出150例DAFB之前的急剧下降(图。1C),然后在随后的发展中缓慢下降。在果实成熟期200 DAFB,“瑞雪”和“粉红小姐”的果实硬度无显著差异。但在成熟期200 DAFB时,“瑞雪”果实硬度较大,约为富士的1.3倍。3个品种的可溶性固形物在果实发育过程中均显著增加。(无花果。1d) 是的。瑞雪的可溶性固形物总量在170dafb到200dafb之间大于粉红女士,在150dafb时也显著低于富士。三个品种的可滴定酸度在170dafb前均表现为先升高,170dafb后“粉红女郎”和“瑞雪”的可滴定酸度维持在稳定水平(图1)。1e) 是的。然而,富士苹果的可滴定酸度在170 DAFB后下降。果实发育过程中,瑞雪的可滴定酸度显著低于粉红女士。瑞雪苹果和富士苹果经120次DAFB后的可滴定酸度没有差异。瑞雪苹果在果实发育过程中,其果实硬度、可溶性固形物总量和可滴定酸度与亲本有较大差异。
瑞雪及其亲本苹果果实发育过程中挥发物的变化
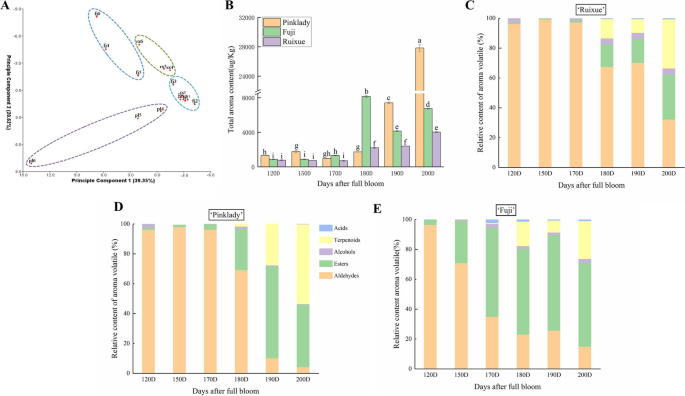
对瑞雪及其亲本苹果果实不同发育阶段的挥发性成分及其含量变化进行了初步鉴定。对‘瑞雪’、‘富士’和‘粉红女士’果实发育过程中的54种挥发物进行了监测(补充表)S1)其中酯类35种,醛类9种,醇类5种,萜类4种,酸类1种“瑞雪”含有40种挥发物:酯类25种,醛类8种,醇类3种,萜类3种,酸类1种富士’含有46种香气挥发物:29种酯类、9种醛类、4种醇类、3种萜类和1种酸“粉红女士”只含有32种挥发物:22种酯类、4种醛类、3种醇类、2种萜类和1种酸。
采用主成分分析法(PCA)对苹果品种瑞雪及其亲本果实发育过程中的挥发性成分进行了研究。在PCA图中(图。2a),前两个组分可以解释挥发性剖面的59.97%、39.35%(主成分1,PC1)和20.62%(主成分2,PC2)。在170 DAFB之前,“瑞雪”与其亲本性状无显著差异,但在发育后期(170-200 DAFB),“瑞雪”与其亲本性状存在显著差异。‘瑞雪’及其亲本苹果总挥发性物质含量在120 ~ 150 DAFB时增长缓慢,在150 ~ 200 DAFB时增长迅速。与‘富士’(180DAFB)相比,‘瑞雪’和‘粉娘子’的总挥发分含量在200 DAFB时达到最高(图1)。2b).果实挥发物(酯类、醛类、醇类、萜类、酸类)的相对含量在果实发育过程中呈动态变化。2“瑞雪”果实挥发物中,醛类为主要挥发物,在170 DFAB(未成熟果实)之前占总挥发物的96%以上,在200 DAFB(成熟果实)时醛类挥发物占总挥发物的32.19%。酯类在170 DAFB后开始积累,在200 DAFB时达到最大值(29.91%)。同样,在170 DAFB后,萜类相对含量显著增加,在200 DAFB时达到最大(32.91%),成为最显著的香气挥发性基团(图1)。2c) 是的。在果实发育过程中检测到少量的醇和酸,粉红女士和富士的结果相似。对于‘粉红女士’,醛类是主要挥发物,在170dfab(未成熟果实)之前占总挥发物的90%以上,然后在200dafb时迅速下降到最低(4.28%)。相反,萜类化合物在170 DAFB后开始积累,在200 DAFB时达到最大值(53.37%)(图。2d) 是的。富士果实发育过程中醛类相对含量持续下降,200dafb时最低(14.95%);然而,酯的相对含量在190 DAFB时上升到最高水平(63.92%),然后下降(图。2e) 是的。
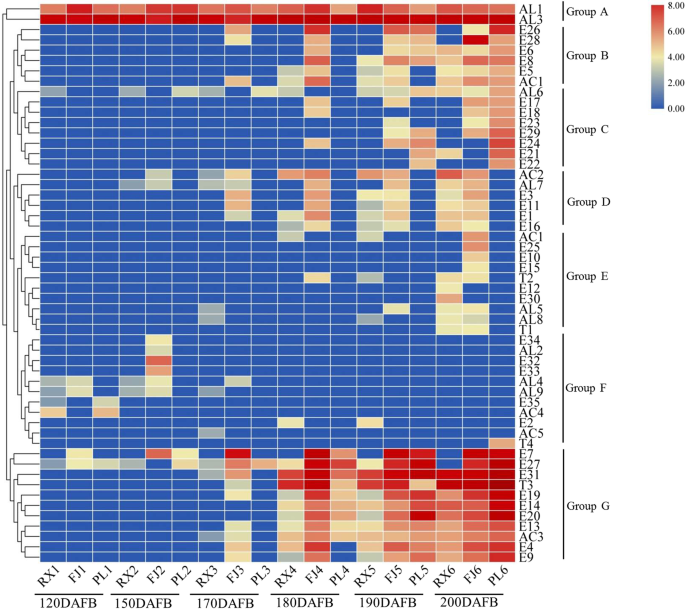
为了观察苹果果芳族挥发物概况,分析了水果开发期间,“瑞灿”,“富士”和“粉红色女士”的挥发物进行分级集群。如图1所示。3.,在水果开发期间在“瑞夏”,'富士'和“粉红色女士”中持有的挥发物,聚集成七组(a,b,c,d,e,f和g)中的七组(a,b,c,d,e,f和g)。A组,由两种化合物Al1(己醛)和Al3(2-六甲酸)组成,表现出趋势的增加,在水果发育过程中保持了三种品种的高含量水平。与父母相比,“瑞灵”的Al1和Al3的内容差异。B组,由六种化合物E26(乙酸,丁酯),E28(乙酸,戊烯酯),E6(六丙酸,2-甲丁基酯),E8(丙酸,丁酯),E5(丁酸,2-methyl-, pentyl ester) and AC1 (Butanoic acid, 2-methyl-), showed an increasing trend in three cultivars after 180DAFB, and was more abundant in ‘Pink Lady’ fruit. Group C, consisting of eight compounds AL6 (2-Heptenal, (Z)-), E17 (Heptanoic acid, butyl ester), E18 (Hexanoic acid, propyl ester), E23 (2-Methylbutyl octanoate), E29 (Propanoic acid, 2-methyl-, hexyl ester), E24 (Butyl caprylate), E21 (Hexanoic acid, pentyl ester) and E22 (Octanoic acid, hexyl ester) showed low content in three cultivars during fruit development, and content was lowest in ‘Ruixue’ compared to its parents. Group D, consisting of six compounds AC2 (1-Butanol, 2-methyl-), AL7 (Nonanal), E3 (Butanoic acid, 2-methyl-, propyl ester), E11 (Propanoic acid, pentyl ester), E1 (2-Methylbutyl 2-methylbutyrate) and E16 (Butanoic acid, 2-methylbutyl ester), showed an increasing trend in three cultivars during fruit development, and was more abundant in ‘Ruixue’ fruit. Group E, consisting of ten compounds AC1 (1-Butanol), E25 (Acetic acid propyl ester), E10 (Propanoic acid, propyl ester), E15 (Butanoic acid, ethyl ester), T2 (5-Hepten-2-one, 6-methyl-), E12 (Butanoic acid, propyl ester), E30 (Propanoic acid, 2-methyl-, pentyl ester), AL5 (Octanal), AL8 (2-Octenal, (E)-) and T1 (1-Octen-3-one), showed low content in three cultivars during fruit development, and was more abundant in ‘Ruixue’ fruit. Group F, consisting of eleven compounds E34 (2-Hexen-1-ol, acetate, (Z)-), AL2 (4-Pentenal, 2-methyl-), E32 (2-Methylbut-2-en-1-yl acetate), E33 (3-Hexen-1-ol, acetate, (E)-), AL4 (3-Hexenal), AL9 (2,4-Hexadienal, (E,E)-), E35 (Methyl salicylate), AC5((5-Methyltetrahydro-2-Furanyl)Methanol) and T4 (Isocaryophillene), showed an decreasing trend in three cultivars during fruit development. Group G, consisting of eleven compounds E7 (1-Butanol, 2-methyl-, acetate), E27 (Acetic acid, hexyl ester), E31 (Butanoic acid, 2-methyl-, hexyl ester), T3 ((Z,E)-α-Farnesene), E19 (Hexanoic acid, butyl ester), E14 (Butanoic acid, hexyl ester), E20 (Hexanoic acid, hexyl ester), E13 (Butanoic acid, butyl ester), AC3(1-Hexanol), E4 (Butyl 2-methylbutanoate) and E9 (Propanoic acid, hexyl ester), showed an increasing trend and maintained high content level in three cultivars during fruit development.
在200例DAFB(果实成熟时期)中,在“瑞灵”苹果果中共有29个挥发物,包括17个酯,6只醛,2醇,3萜类化合物和1酸。对于“粉红色女士”,共鉴定了28种香气挥发物,包括21个酯,3只醛,1醇,2萜件和1酸。在'Fuji'苹果中,鉴定了31种香气挥发物,包括22个酯,5只醛,2醇,1萜烯醇和1酸。Interestingly, in ‘Ruixue’ apples, aldehydes (hexanal, 2-hexenal and (E)-2-octenal), esters (butanoic acid, propyl ester, butanoic acid, 2-methylbutyl ester, propanoic acid, 2-methyl-, pentyl ester), alcohols (alcohol) and terpenoids (5-hepten-2-one, 6-methyl-) were significantly higher than in ‘Fuji’ and ‘Pink Lady’. Conversely, esters (butyl 2-methylbutanoate, propanoic acid, hexyl ester, butanoic acid, butyl ester, heptanoic acid, butyl ester, hexanoic acid, butyl ester and hexanoic acid, and hexyl ester) were significantly lower than in ‘Fuji’ and ‘Pink Lady’. In summary, there were differences in aroma volatile composition and content in different apple cultivars.
‘瑞雪’及其亲本在果实发育过程中的转录组分析
为了进一步探讨“瑞雪”果实与亲本果实风味差异的分子机制,采用rna测序(RNA-Seq)方法,获得了“瑞雪”果实发育过程中全基因组的基因表达谱,并与亲本进行挥发性化合物分析。对54个样品(3个品种× 6个发育阶段× 3个生物学重复)进行RNA-seq分析,以鉴定3个品种挥发性化合物生物合成和转录调控相关基因的差异表达。经过过滤,“瑞雪”水果共获得1073,298,706条干净reads,“富士”水果共获得979,721018条干净reads,“粉红小姐”水果共获得1,015,631,116条干净reads。共采集到460.76 GB核苷酸,GC含量为47.28%。Q30 %(错误率低于0.1%)超过90%(补充表S2).
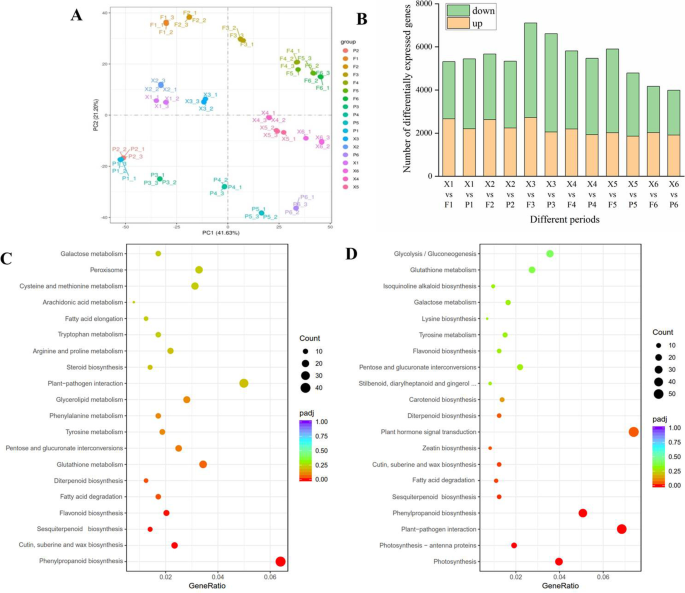
主成分分析基于54个样本的转录组图谱。前两个主成分分别解释了样本间41.63%(PC1)和21.20%(PC2)的方差。苹果转录组间的相似性和差异性主要受果实发育阶段的影响。此外,“瑞雪”、“富士”和“粉红女士”品种在PC2上分离(图。4a).在果实发育过程中,差异表达基因(DEGs)的数量呈现先增加后减少的趋势。4b).与F (150-170 DAFB)相比,X发育中后期的deg数量最多。
转录组概要分析。A.“瑞雪”及其亲本54个苹果果实发育过程中转录组的主成分分析B‘瑞雪’及其亲本在果实发育过程中的差异表达基因(DEGs)C'瑞雪'和'富士'在170 DAFB的KEGG通路分析。DKegg Luxue'和'Pink Lady'at 170 Dafb。“F1、F2、F3、F4、F5、F6”分别代表‘富士’开花后120、150、170、180、190、200 DAFB(开花后天数);“P1、P2、P3、P4、P5、P6”分别代表“粉红女郎”开花后120、150、170、180、190、200 DAFB(开花后天数)时的1;“x1,x2,x3,x4,x5和x6”分别代表在120,150,170,180,190和200和300之后的盛开之后的天数)的'ruixue'
KEGG途径分析被用来确定代谢途径在调节水果香气挥发物合成中的潜在参与。由于大多数挥发性香气化合物的合成,以及DEGS的数量最丰富,在果实发育的中期和后期,我们选择X3与F3和X3与P3(Ruix','富士'和'粉红女郎'水果在170 DAFB)比较KEGG途径分析(补充表)1; 图。4b) 是的。在X3和F3的两两比较中,DEG映射到110 KEGG途径,其中映射到苯丙烷生物合成的DEG数量最多(mdm00940)(图。4c) 是的。挥发性香气化合物的合成途径包括倍半萜和三萜的生物合成,KEGG中脂肪酸的降解也明显富集。DEGs的比较(X3与P3)确定了114条KEGG途径,其中显著的富集途径被认为是植物-病原相互作用(mdm04626)、苯丙素生物合成(mdm00940)以及倍半萜和三萜生物合成(mdm00909)(图。4d).总体而言,KEGG富集分析表明,脂肪酸代谢、苯丙素代谢和倍半萜代谢在‘瑞雪’、‘富士’和‘粉红女士’果实香气挥发物的合成中起关键作用。
脂肪酸、异亮氨酸和倍半萜代谢途径中挥发性化合物相关基因的表达变化
酯类(直链和支链酯)是苹果果实中含量最丰富的挥发性化合物之一。直链酯是通过脂肪酸代谢途径产生的,支链酯是通过异亮氨酸代谢途径产生的。5a和补充表S3).在果实发育过程中,许多基因的表达量显著增加,但在不同品种中表达量有所不同。5b) 是的。DH-1(3-羟酰基ACP脱水酶)在果实发育过程中的表达水平极低,显著低于富士。有趣的是,ER-1和ER-2(2,3-反式烯醇基ACP还原酶)的表达模式相反。脂氧合酶(Lipoxygenases,LOX)参与脂肪酸降解过程中酯生物合成的初始步骤,包括六个基因(LOX-1到LOX-6)。四种脂氧合酶(LOX-1到LOX-4)在果实发育过程中显著增加,在‘瑞雪’中转录水平较高,而在‘粉红女士’中转录水平较低。然而,LOX-5和LOX-6在170dafb之前表现出高表达水平,然后迅速下降。过氧化氢酶(HPL)是醛(己醛)生物合成的最后一步,其表达水平先升高后降低。醇脱氢酶将脂肪酸和异亮氨酸降解途径中的醛类还原为醇。在果实发育过程中,ADH-1、ADH-2和ADH-3的转录丰度持续下降。醇酰基转移酶(AAT)是酯生物合成的限速酶。AAT-1、AAT-2和AAT-3的转录物丰度在果实发育过程中不断增加。值得注意的是,“瑞雪”的AAT转录本丰度低于“富士”和“粉红女郎”。乙醛脱氢酶(ALDH-1~ALDH-3)和羧酸酯酶(CXE-1~CXE-2)是异亮氨酸代谢途径中支链酯生物合成的重要酶,在果实发育过程中有差异表达。
果实发育过程中脂肪酸和异亮氨酸途径相关挥发性挥发性基因的表达谱。A.酯的生物合成途径包括脂肪酸途径和异亮氨酸途径。B挥发性相关基因的表达谱酯生物合成。ACC:乙酰-CoA羧化酶;垫:丙二酰基CoA ACP蛋白酶;Kasiii:3-酮酰基ACP合成酶III;KAR:3-酮酰基ACP还原酶;DH:3-羟基乙基ACP脱水酶;ER:2,3-反式烯丙基ACP还原酶;KASI:3-酮酰基ACP合成酶I;Kasii:3-酮酰基ACP合成酶II;悲伤:刺激ACP去饱和酶; OTE: Oleate-ACP thioesterase; FAD: Oleate and linoleate desaturase; AK: Aspartate kinase; ASADH: Aspartate semialdehyde dehydrogenase; HSD: Homoserine dehydrogenase; HSK: Homoserine kinase; TS: Threonine synthase; TD: Threonine deaminase; ALS: Acetolactic synthetase; AHIR: Acetohydroacid isomeroreductase; DHAD: Dihydroxy acid dehydratase; BCAT: Branched chain aminotransferase; LOX: Lipoxygenase; HPL: Hydroperoxide lyase; PD: Pyruvate decarboxylase; ADH: Alcohol dehydrogenase; ALDH: Aldehyde dehydrogenase; AAT: Alcohol acyl transferase; CXE: Carboxylesterase
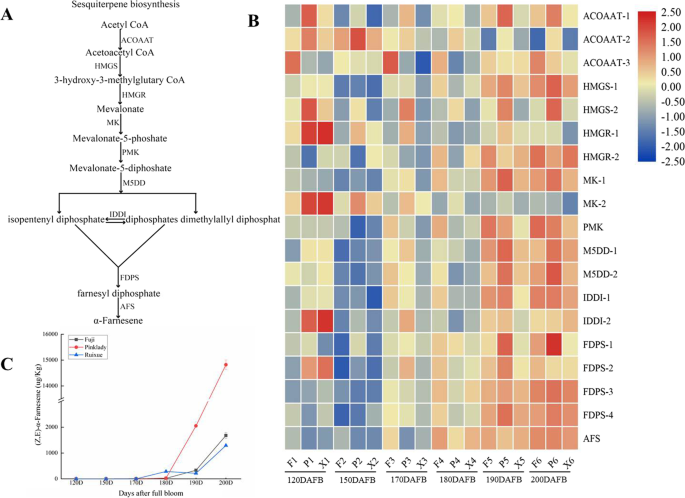
倍半萜是苹果中最主要的萜类化合物。积累的倍半萜主要是(Z, E)-α-法尼烯,是所有香气挥发性化合物中含量最丰富的(补充表)S1). 倍半萜是由甲羟戊酸(MVA)途径在细胞质中通过九个酶促步骤产生的(图。6a) 是的。在果实发育过程中,许多基因的表达水平显著增加。不同品种果实发育过程中倍半萜生物合成基因的表达存在差异。值得注意的是,α-法尼烯合酶(AFS)的表达水平急剧增加,粉红女士的表达水平高于富士和瑞雪。6b).同样,α-法尼烯在果实发育过程中表现出与AFS相同的快速表达模式(图1)。6C)。
调节挥发性合成的潜在转录因子的表达变化
转录因子在调节香气挥发物合成中起着至关重要的作用。为了明确可能参与挥发性物质生物合成的转录因子,我们进一步分析了MYC2、ERF、WRKY、MYB、BZIP和MADS-box等转录因子在果实发育过程中的表达模式。在果实发育过程中,许多转录因子的表达模式都有所增加,但在不同的品种中表达不同。S1和表S3).
定量逆转录酶-PCR验证转录组数据
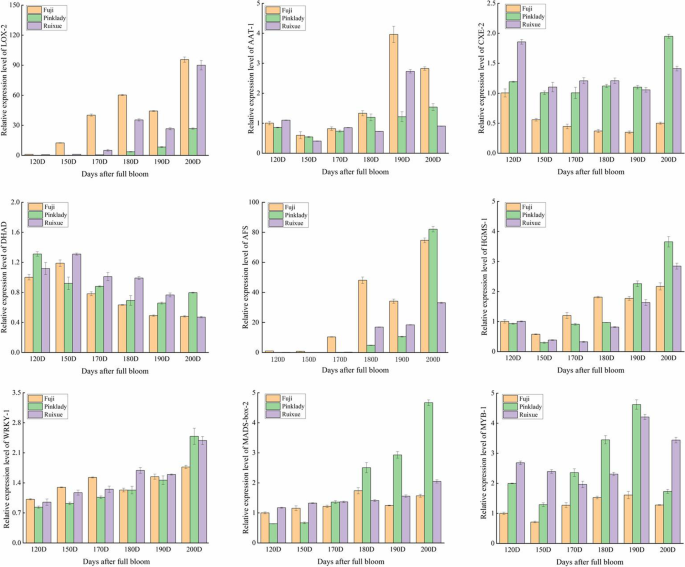
为验证转录组数据的可靠性和重复性,选取6个芳香生物合成基因和3个转录因子基因,采用qRT-PCR对其表达水平进行分析。本分析中使用的基因特异性引物见补充表S4.使用qPCR生成的9个候选基因的表达谱与RNA-Seq结果(RPKM值)非常相似,具有较高的Pearson相关系数(R2 > 0.9). 这些结果表明转录组数据是准确和可重复的(图。7).
水果发育中“瑞灵”挥发物,生物合成基因及转录因子的相关分析
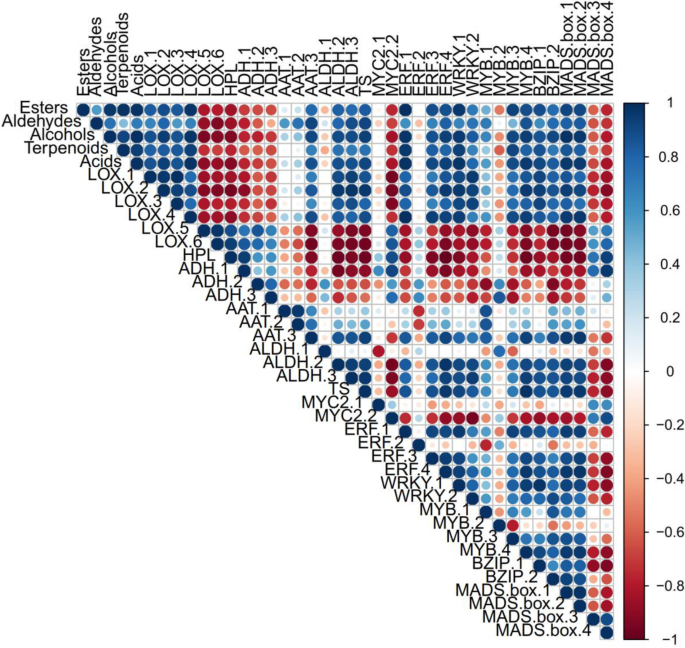
为了了解转录组与挥发物之间的相关网络,我们对参与脂氧合酶(LOX)、甲戊酸(MVA)通路的挥发物生物合成基因与候选转录因子进行了相关分析(图1)。8).在分析中,使用挥发性化合物组(酯类、醛类、醇类、萜类和酸类)的平均含量和表达转录本的平均表达水平进行相关性检验(Spearman秩相关检验)。在生物合成基因中,LOX-1、LOX-2、LOX-3和LOX-4的表达模式与酯类、醛类和醇类、萜类和酸类总含量呈正相关,其中LOX-1的相关系数最高。而HPL、ADH-、ADH-2和ADH-3的表达谱与酯类、醛类和醇类、萜类和酸类总含量呈负相关。在候选转录因子中,相关系数最高的基因(RERF-1是乙烯反应因子,其次是WRKY-1。综上所述,LOX途径和甲戊酸盐(MVA)在瑞雪果实发育过程中部分参与了挥发性物质的代谢。
讨论
‘瑞雪’及其亲本苹果果实发育过程中挥发性化合物谱的动态变化
挥发性化合物是水果风味的一个重要指标,用于区分水果品种和水果品种[3.].苹果挥发性化合物的分布极为复杂,其香气组成和浓度受品种特异性性状和果实发育阶段的影响[5].挥发性化合物的形态随成熟而变化。醛类是果实发育早期的主要挥发性化合物[19]但随着果实成熟,其含量逐渐降低,醇含量急剧增加,最终以酯类为主[2].
对“瑞雪”、“粉红小姐”和“富士”苹果果实发育过程中的挥发性成分进行了测定。在“瑞雪”苹果、“红粉女”苹果和“富士”苹果中分别检测到40、46和32种挥发性化合物,包括酯类、醛类、醇类、萜类和酸类。醛类挥发物为主要挥发物,占果实发育早期挥发物总量的90%以上。醇类和酯类均在果实发育后期显著增加。“瑞雪”、“富士”和“粉夫人”在果实发育过程中共检测到54种挥发物,在热图上聚为A、B、C、D、E、F和G 7个类群。A组由AL1(己醛)和AL3(2-己烯醛)两种醛类组成,‘瑞雪’的AL1和AL3含量与其亲本存在差异。B组共6个化合物,其中E26(乙酸,丁基酯)和E28(乙酸,戊基酯)在3个品种中差异最显著,在亲本中较多,而在‘瑞雪’果实中仅检测到少量。C组为8种酯类和1醛类(2-庚烯醛,(Z)-),“瑞雪”果实的酯类含量均低于亲本。E组和F组‘瑞雪’和‘富士’苹果果实中酯挥发物最多。总之,“瑞雪”品种及其亲本的酯类和醛类是主要挥发物类群。 Our data show that esters and terpenoids were the main volatiles in ripening fruit of ‘Pink Lady’ and ‘Fuji’ apples, mainly including butyl 2-methylbutanoate; propanoic acid, hexyl ester; propanoic acid, hexyl ester; hexanoic acid, hexyl ester; acetic acid, hexyl ester and (Z, E)-α-farnesene. Among these, acetic acid, hexyl ester was putatively identified as a characteristic volatile compound [20.];但在“瑞雪”苹果中没有检测到乙酸、己酯。有趣的是,“瑞雪”果实成熟过程中主要挥发性物质为醛类,主要包括2-己烯醛;2-hexenal;octanal;(E) 2-octenal和壬醛。此外,“瑞雪”苹果中的1-丁醇、2-甲基含量明显高于“粉红小姐”和“富士”苹果,从而增加了甜味[17].结果表明,“瑞雪”以醛类口味为主,“粉红小姐”和“富士”则以酯类口味为主。研究表明,酯类化合物对水果风味的贡献最大,占“青霉”总挥发性化合物的80%以上[21、“Gala”和“Starking Delicious”苹果[22,23].类似的研究表明,酯是重要的挥发性化合物,显著影响香蕉和草莓的味道[24,25,26].然而,我们的数据显示,醛类和萜类是“瑞雪”果实的主要挥发性成分,需要进一步研究这些醛类和萜类挥发性成分对果实风味的影响,并采用色谱-嗅觉法(GC-O)和感官评价法[4].水果的甜度是消费者偏好的主要驱动力之一。研究表明,苹果的甜味是由一些挥发性化合物提供的,主要是酯和法尼烯[27].一般而言,“瑞雪”苹果果实在果实硬度、总可溶性固形物和可滴定酸度方面与亲本苹果在果实发育过程中存在差异。综合来看,“瑞雪”苹果及其亲本的糖、酸和挥发性物质的差异共同决定了果实风味的多样性。
果实发育过程中涉及脂肪酸、异亮氨酸和倍半萜代谢途径的挥发性化合物相关基因的表达模式分析
以前的研究表明,挥发性化合物的数量主要由脂肪酸,异亮氨酸,甲戊酯和苯丙醇丙二醇代谢途径合成[5]. 其中,脂肪酸和异亮氨酸代谢是合成醛、醇和酯的最重要途径,与β-氧化和脂氧合酶活性(LOX)有关。脂氧合酶途径主要由脂氧合酶(LOX)、过氧化氢酶(HPL)、醇脱氢酶(ADH)和醇酰转移酶(AAT)四种关键酶组成[6].这些基因在脂肪酸、异亮氨酸和倍半萜代谢途径中的大量差异表达可能影响挥发性芳香化合物的积累。研究表明,脂氧合酶(LOX)参与了脂肪酸降解中醛、醇和酯类生物合成的最初步骤,而亚油酸和亚麻酸是LOX的两种重要底物[28].金鲜苹果和皇家Gala苹果中分别鉴定出23、11个假定的LOX基因[5,7].最近的研究表明mdlox1a.和MdLOX5e参与水果挥发性物质的产生,主张采用分子育种的方法[7].在我们的研究中,我们推测在“瑞雪”、“富士”和“粉红女士”中鉴定出6个差异表达基因(LOX-1到LOX-6)。其中,4种脂氧加酶(LOX-1 ~ LOX-4)在果实发育过程中显著增加,在“瑞雪”中转录量高,而在“粉红女士”中转录量低。这些观察结果与果实发育过程中醛类物质的增加相一致,“瑞雪”果实的醛类物质浓度高于“粉红小姐”果实,表明LOX-1、LOX-2(mdlox1a.), LOX-3和LOX-4在醛类生物合成中起着关键的积极作用。以前在库尔勒香梨(Pyrus sinkiangensis Yu)中也报道过类似的结果[29].然而,LOX-5和LOX-6先升高后迅速下降。有趣的是,LOX1的表达高于LOX-2(mdlox1a.),参与果实挥发物的产生[7]. 需要进一步的功能研究来阐明LOX1在调节苹果挥发性物质生物合成中的调节作用。‘瑞雪’果实及其亲本LOX表达水平的差异可能导致醛类物质的多样性,这与无花果挥发物谱的结果一致。2.乙醇脱氢酶(ADH)将醛类从脂肪酸和异亮氨酸降解途径还原为醇类[2].研究表明,富士苹果在果实发育过程中ADH活性下降[21].相反,抗利尿激素(ADH)活性在‘乔纳金’苹果收获前有所增加[30.].此外,在水果发育过程中,ADH的转录水平降低[29].我们在这里鉴定了3个ADH基因,结果与之前的研究结果相似,即ADH-1、ADH-2和ADH-3的转录丰度在果实发育过程中不断降低。而醇类化合物的含量在果实发育过程中呈上升趋势。这些结果表明ADH的调控发生在转录后和翻译水平[8].醇酰基转移酶(AAT)是酯生物合成的限速酶。研究表明,在“史密斯奶奶”和“富士”苹果中,AAT活性随着果实成熟而增加[13].转录水平的AAT1-GS和AAT1-RG在'Granny Smith'和'皇家Gala'苹果的水果开发期间增加[31.]. 我们的数据还表明,AAT-1、AAT-2和AAT-3的转录物丰度在果实发育过程中不断增加。值得注意的是,“瑞雪”的AAT转录本丰度低于“富士”和“粉红女郎”。这与“瑞雪”的酯含量低于“富士”和“粉红女郎”的观察结果一致。萜烯是由细胞质中甲羟戊酸(MVA)途径产生的[5]. 萜烯合成酶(TPS)是合成萜烯挥发物的关键酶。到目前为止,已经确定了55个推测的苹果TPS,只有10个TPS基因被预测具有功能,能够合成“皇家盛典”中产生的大部分萜烯挥发物,如D-日耳曼烯、芳樟醇和a-蒎烯。然而,我们推测只有萜烯挥发性α-法尼烯(倍半萜)是由α-法尼烯合酶(MdAFS1)合成的。α-法尼烯合酶(AFS)的表达水平在果实发育过程中急剧上升,粉红女士的表达水平高于富士和瑞雪。香气相关基因的差异表达可能与“瑞雪”及其亲本苹果挥发性成分的变化有关。总之,这些结果表明,香气合成是一个复杂而精确的过程,涉及多个结构基因家族和代谢途径。
可能调节挥发性生物合成的候选转录因子的表达变化
已有研究表明转录因子(transcription factors, TFs)在调节植物挥发性次生代谢产物中起着主要作用[32.]. 为了阐明可能参与调节挥发性生物合成的潜在转录因子,我们进一步分析了果实发育过程中转录因子的表达模式,包括MYC2、ERF、WRKY、MYB、BZIP和MADS-box-TFs。据报道ATMYC2.,BHLH转录因子,通过与启动子结合来促进倍二萜产量TPS21和TPS11在拟南芥花就会激活它们的转录,调节GA和JA信号[32.].在这里,我们已经确定了两个MYC2基因(MYC2-1和MYC2-2)。MYC2-1的转录水平在果实发育的早期和后期都较高。这表明MYC2-1可能参与了果实发育早期醛的合成和后期酯的合成。然而,在果实发育过程中,MYC2-2的转录本丰度保持在较低水平。研究表明,AP2/ERF转录因子ERF1和ERF2参与调控倍半萜烯合酶紫花桃-4,11-二烯合酶[33.].在橘子,CitAP2.10通过激活萜烯合酶CsTPS1促进(+)-烯含量[14].最近,一种乙烯反应因子(faerf# 9)已被证明能够激活FaQR转录本并上调草莓中的呋喃酮生物合成[34.].这些结果表明,ERF主要调节萜烯生物合成。我们的结果表明,在水果开发期间,ERF-1,ERF-1,ERF-3和ERF-4的成绩单丰富增加;然而,ERF-2的转录性丰度首先增加然后减少。根据以前的研究和我们的数据,ERF可能参与苹果中的调节(Z,E)-α-法呢烯生物合成。据报道了这一点GaWRKY1, WRKY转录因子通过激活(+)- δ-卡二烯合酶(CAD1)转录因子调控棉花倍半萜的生物合成[35.].此外,MYB转录因子(FaMYB98)上调草莓中呋喃酮生物合成[34.].因此,需要进一步的功能研究来阐明这些转录因子在苹果挥发性物质合成中的调控作用。
结论
使用SPME-GC-MS鉴定果实开发期间'ruixue'及其父母苹果的挥发性概况。我们的研究结果表明,挥发性化合物的轮廓随成熟而变化。在果实发育的早期阶段期间醛是占优势挥发性化合物。在成熟的水果中,酯和三萜类化合物是在“粉红女士”和'富士'苹果的成熟果实中的主要香气挥发物,它们包括2-甲基丁酯的丁基;丙酸己酯;丙酸己酯;己酸己酯;乙酸己基酯和(Z, E)-α-法尼烯。有趣的是,醛和三萜类化合物是“瑞灵”成熟果实中的主要挥发性芳香化合物,主要包括己醛;2-hexenal; octanal, (E)-2-octenal; nonanal and (Z, E)-α-farnesene. By comparing the transcriptome profiles of ‘Ruixue’ and its parents during development, we identified a large number of aroma-related genes involved in the fatty acid, isoleucine and sesquiterpenoid metabolism pathways and identified transcription factors that may regulate aroma biosynthesis. Our initial study facilitates a better understanding of the volatile aroma compounds that affect fruit flavour as well as the mechanisms underlying differences in flavour between ‘Ruixue’ and its parents.
方法
植物材料
三个苹果品种的果实,新品种'瑞雪'(瑞雪'将申请国家保护'瑞雪')。根据国际植物品种权的规则,树木和芽木可用于研究目的,这可以从中国陕西杨岭镇西北农林大学园艺学院的郑洋朝获得。品种:CNA201514691)、“红粉佳人”和“富士”,分别来自白水县西北部渭南市市陕西省AF和中国大学的国家苹果模型。将3个苹果品种(6年生)嫁接到M26砧木上,在4.0℃条件下种植 × 1.5米地块。从“瑞雪”、“粉红淑女”和“富士”三个不同发育阶段(120、150、170、180、190和200d)采集了外观均匀、无机械损伤和病害的果实。每个样品进行三个独立的重复,包括15棵苹果树的10个果实。共有54个水果样品(3个品种) × 六个发展阶段 × 三个生物复制品)在液氮中冷冻,然后在-80℃下储存,用于GC-MS和RNA-Seq分析。
果实生理特性的测量
果肉硬度用GS-15果肉质地分析仪(Guss-Pty)测定。有限公司,南非开普敦)在水果赤道两侧的去皮水果(测试深度,8毫米;直径探头,10 mm)。总可溶性固形物(TSS)使用手持式折射计(Pocket PAL-1,ATAGO,Tokyo,Japan)测量。可滴定酸度(TA)用德国GMK-835F型数字式水果酸度计测定。在每个时间点(120、150、170、180、190和200 DAFB)对每个品种(“瑞雪”、“粉红女郎”和“富士”)的所有样品进行测量。
气相色谱-质谱联用分析挥发性芳香化合物
采用固相微萃取法(SPME)提取水果中的挥发性成分,每个样品三个生物重复[36.].约5.0 g冷冻水果(粉),1.0 g NaCl和10 μL 3-壬酮(0.04 μL mL−1.)作为密封在50 mL小瓶中的内标,然后使用涂有50/30μm二乙烯基苯/碳氧烷/聚二甲基硅氧烷(DVB/CAR/PDMS)的纤维在40℃下萃取顶空气体40 min。随后,样品在230°C下以无分裂模式直接注入GC-MS(美国赛默飞世尔科学公司,ISQ,痕量GC-ULTRA)的进样口2.5分钟。使用HP-INNO蜡柱(60 m)进行挥发性分析 × 内径0.25 mm × 0.25μm膜厚),载气氦气流速为34 cm s−1..初始烘箱温度保持在40°C 3分钟,然后以5°C min的速度升温−1.至150°C,然后以10°C min的速率至220°C−1.然后在220℃下保持5min,电子碰撞能量(EI)为70ev。转移温度和源温度为240℃。通过与NIST2014文库的质谱(MS)比较,对香气挥发物进行了定性分析。采用内标物(3-壬酮)的峰面积对香气挥发物进行相对定量。
RNA提取及序列分析
共54个样本(3个品种× 6个发育阶段× 3个生物学重复)进行转录组分析。采用CTAB法从120、150、170、180、190和200 DAFB的‘瑞雪’、‘粉夫人’和‘富士’果实中提取总RNA [37.].使用磁珠(DT)的磁珠与总RNA分离mRNA(含Pola)。使用Nebnext®ultraTRNA库预备套件为Illumina®(Neb,USA)构建五十四个cDNA库,并在Illumina Hiseq平台上测序。从原始RNA-SEQ读取中删除低质量读取和含N读取。
使用HISAT2软件对转录本丰度进行量化,并使用每千碱基转录本每百万测序片段(fragment -per kilobase-of Transcript -per million- maps -reads, FPKM)方法进行归一化。差异表达基因(DEGs)采用DESeq2进行鉴定,log2 (fold change)≥1,校正后P≤0.005。对所有鉴定出的DEGs进行基因本体富集和KEGG通路分析,padj≤0.05 [38.,39.].
定量逆转录酶-PCR验证转录组数据
使用CTAB方法提取总RNA [23]. qPCR使用StepOneplus进行™ 仪器(美国赛默飞世尔科技公司)。实时荧光定量PCR反应体积10μL,其中5μl2 × SYBR-Green-PCR-Master-Mix(Vazyme),cDNA 1μL,每个引物0.4μL,50μL × ROX参比品和3.4μL蒸馏去离子H2O(ddH)2qRT-PCR分析中使用的基因特异性引物(Primer Premier 6.0)见补充表S4.qPCR方法:95°C 5 min;40个循环,95°C 15秒,60°C 30秒。MdEF-1α作为内参基因,规范所有基因的表达水平。2−ΔΔCt方法计算基因的相对表达水平[40].
统计分析
使用ORIGIN 2019(Microcal Software,Inc.,Northampton,MA)绘制数据。显著差异分析(P < 0.05) were carried out using one-way ANOVA with Duncan’s test (SPSS 19.0, SPSS Inc., Chicago, IL). Gene ontology (GO) enrichment of the differential expressed genes (DEGs), Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis of the DEGs, PCA (principal component analysis) and Correlation analysis were performed using Tbtools Version 1.075 software [41.,42.,43.].
可用性数据和材料
在当前研究期间生成和/或分析的数据集可在NCBI数据库存储库中获得,登录号为:PRJNA728501。本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- 信使核糖核酸:
-
信使核糖核酸
- MYC2:
-
Myelocytomatosis蛋白2
- bHLH:
-
基本Helix-Loop-Helix
- qRT PCR:
-
定量逆转录聚合酶链反应
- CTAB:
-
Cetyltrimethylammonium溴化
- 核糖核酸:
-
核糖核酸
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
参考文献
- 1.
Song J,Forney CF.水果中风味挥发物的产生和调节。植物科学。2008;88:537–50.
- 2.
Espinodiaz M, Sepulveda DR, gonzezaguilar GA, Olivas GI。苹果香气的生物化学研究进展。食品科技。2016;54:375-94。
- 3.
Bonany J、Buehler A、CarbóJ、Codarin S、Schooll F。消费者对不同欧洲国家苹果新品种的食用质量接受程度。我更喜欢食物。2013;30:250–9.
- 4.
闫丹,史军,任鑫,等。洞察“蜜脆”苹果(苹果)的香气轮廓和特征香气。食品化学。2020;327:127074。
- 5。
Schaffer RJ, Friel EN, Souleyre EJ等。一种基因组学方法表明,苹果的香气生产主要是由乙烯控制在每个生物合成途径的最后一步。植物杂志。2007;144:1899 - 912。
- 6。
Echeverrı́a G, Graell J, López ML, Lara I.“富士”苹果成熟过程中挥发性物质的生成、品质和香气相关酶活性。采后生物技术。2004;31:17 - 27。
- 7.
Vogt J、Schiller D、Ulrich D、Schwab W、Dunemann F。苹果(Malus×domestica)果实风味形成相关基因的鉴定。树基因组。2013;9:1493–511.
- 8.
迪菲利比BG,卡德尔AA,丹德卡AM。苹果香气:醇酰基转移酶,酯生物合成的限速步骤,是由乙烯调节的。植物科学。2005;168:1199 - 210。
- 9
Souleyre EJ,Greenwood DR,Friel EN,Karunairetnam S,Newcomb RD.苹果醇酰转移酶(cv。皇家嘉年华(Royal Gala),MpAAT1,生产与苹果水果风味有关的酯。费布斯J。2005;272:3132–44.
- 10.
Yauk YK,Souleyre EJF,Matich AJ,等。醇酰基转移酶1连接两个不同的挥发性途径,在苹果果实中产生酯和苯丙烯。植物J。2017;91:292–305.
- 11.
李德、徐毅、徐庚、顾力、李德、舒赫。苹果醇酰基转移酶(MdAAT2)基因的克隆与表达。金色美味)。植物化学。2006;67:658–67.
- 12.
朱毅博士,马修士太平绅士。苹果果实成熟和成熟过程中醇酰基转移酶和1-氨基环丙烷-1-羧酸合酶基因表达及挥发性酯释放的品种差异特征采后生物技术。2008;49:330-9。
- 13.
Holland D, Larkov O, Bar-Ya 'akov I等。苹果(Malus domestica Borkh.)果实挥发性酯形成和乙酰辅酶a:醇乙酰转移酶活性的发育和品种差异。农业化学学报2005;53:7198-203。
- 14。
聂文慧珍,格林SA,陈昕,等。功能基因组学研究表明,一个紧凑的萜烯合酶基因家族可以解释苹果萜烯挥发性物质的产生。植物杂志。2013;161:787 - 804。
- 15.
苹果果皮组织中(E, E)- α -法烯合酶cDNA的克隆及功能表达。足底。2004;219:84 - 94。
- 16。
Vrhovsek U、Lotti C、Masuero D、Carlin S、Weingart G、Mattivi F。葡萄、苹果和树莓挥发性化合物(VOCs)的GC/MS/MS定量代谢分析。色谱分析技术与生物医学生命科学杂志。2014;966:132–9.
- 17
López ML、Villatoro C、Fuentes T、Graell J、Lara I、Echeverría G。不同贮藏条件下‘粉红女士®’苹果的挥发性成分、质量参数和消费者接受度。采后生物技术。2007;43:55–66.
- 18
李h,刘j,张x等。蓄冷储存过程中四种苹果品种纹理和超微结构特征的比较。int J Food Prop。2019; 22:659-69。
- 19
Mattheis JP,Fellman JK,Chen PM,Patterson我。苹果果实生理发育过程中顶空挥发物的变化。农业食品化学杂志。1991;39:1902–6.
- 20.
Lopez ML、Lavilla MT、Riba M、Vendrell M。金冠苹果和史密斯奶奶苹果两季挥发性成分的比较。J食品质量。1998;21:155–66.
- 21.
Lavilla T, Puy J, López ML, Recasens I, Vendrell M. .不同气调处理下青苹果挥发性物质产量、果实品质与感官评价的多元分析。农业化学学报1999;47:3791-803。
- 22.
关键词:苹果,挥发性化合物,贮藏,co2浓度,蒸发量农业食品化学,1998;46:634-43。
- 23.
Plotto A, MR . McDaniel, matthewjp。气相色谱-嗅觉技术Osme分析‘Gala’苹果在贮藏过程中的香气变化中国科学(d辑),2000;
- 24.
张勇,王庚,董杰,等。草莓品种‘兴都1号’和‘兴都2号’及其亲本挥发性成分分析。中国农业科学院。2009;8:441–6.
- 25.
朱浩,李XP,袁RC,陈YF,陈WX。香蕉果实挥发性成分的变化及其与其它成熟事件的关系。霍尔特科学生物技术杂志。2010;85:283–8.
- 26。
朱霞,李强,李娟,罗娟,陈伟,李霞。不同成熟期香蕉果实中挥发性化合物的比较研究。分子。2018;23:2456。
- 27。
阿普雷亚E、查尔斯M、恩德里齐I、劳拉卡罗拉罗M、贝塔E、比亚西奥利F、加斯佩里F。苹果的甜味:山梨醇、单糖、有机酸和挥发性化合物的作用。2017年;7:44950.
- 28。
脂氧合酶和环氧合酶催化的氧合控制。化学杂志。2007;14:473 - 88。
- 29
陈杰、陆杰、何Z、张F、张S、张H。库尔勒香梨挥发性成分产生的研究。食品化学。2020;302:125337.
- 30.
通过对表达序列标签的大规模统计分析,确定了在苹果果实发育和生物化学中可能发挥作用的基因。植物杂志。2006;141:811-24。
- 31.
苏雷等。AAT1基因座对于脂类的生物合成至关重要,脂类有助于“成熟苹果”的味道,在“皇家庆典”和“史密斯奶奶”苹果。植物j . 2014; 78:903-15。
- 32.
洪光军,薛晓云,毛义波,王丽娟,陈晓云。拟南芥MYC2与DELLA蛋白相互作用调节倍半萜合成酶基因的表达。植物细胞。2012;24:2635-48。
- 33.
于兹、李杰、杨聪、胡伟、王丽、陈×。茉莉酸敏感型AP2/ERF转录因子AaERF1和AaERF2正调控青蒿素的生物合成。摩尔植物。2012;5:353–65.
- 34.
张y,yin x,xiao y等。乙烯响应因子-MYB转录复合物通过激活醌氧化还原酶表达来调节呋喃酚生物合成,在草莓中的表达。植物理性。2018; 178:189-201。
- 35.
徐永红,王建伟,王松,王建勇,陈晓燕。GaWRKY1是调节倍半萜合酶基因(+)- δ -卡二烯合酶a的棉花转录因子。植物杂志。2004;135:507-15。
- 36.
Shalit M,Katzir N,Tadmor Y等。乙酰-CoA:乙酰转移酶活性和成熟瓜果实中的芳香形成。JAgric Food Chem。2001; 49:794-9。
- 37.
甘比诺G,佩罗一世,格里波多一世。从葡萄和其他木本植物的不同组织中提取RNA的一种快速有效的方法。植物化学分析。2008;19:520–5.
- 38。
序列计数数据的差异表达分析。基因组医学杂志。2010;11:1-12。
- 39。
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold BJ。通过RNA-SEQ映射和定量哺乳动物转录om。NAT方法。2008; 5:621-8。
- 40.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析−ΔΔCT方法。方法。2001;25:402–8.
- 41.
于刚,王乐根,韩燕,何启云。clusterProfiler:一个R包,用于比较基因簇之间的生物主题。组学。2012; 16(5): 284 - 7。
- 42.
年轻MD,Wakefield MJ,Smyth GK等。RNA-SEQ的基因本体分析:选择偏差算法。基因组生物。2010; 11:R14。
- 43.
关键词:生物信息学,大数据,交互分析,TBtools摩尔。2020;13(8):1194 - 202。
致谢
不适用。
资金
这项工作得到了国家现代农业产业技术体系建设专项资金(CARS-28)和中国现代农业产业技术研究体系(CARS-27)的支持;西北农林科技大学(2014 YB 086)。资助者在研究设计、数据收集、分析和解释以及手稿撰写方面没有任何作用。
作者信息
从属关系
贡献
X L和Z Z设计了本研究;X L写手稿;N H、R F、Z M和Y L进行了实验和分析。所有作者均已阅读并批准稿件。
相应的作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
补充文件1:补充表S1。
“瑞雪”及其亲本苹果果实发育过程中挥发物含量的变化。“处方”代表“瑞雪”;“陆地”代表“富士”;“PL”代表“粉红女士”。‘瑞雪’、‘粉红女士’和‘富士’果实发育的6个不同阶段分别为120、150、170、180、190和200 DAFB(盛花后天数)。“-”表示未检测到。不同字母的平均值在P <0.05时差异显著,Duncan 's new multiple range test。补充表S2。‘瑞雪’及其亲本苹果经过滤后rna序列的通量和质量。补充表S3。在果实发育过程中分析了瑞灵术中FPKM值的挥发性相关基因的表达水平。“F1,F2 F3,F4,F5和F6”分别代表在120,150,170,180,190和200和200之后的盛开之后的天数);“p1,p2,p3,p4,p5和p6”分别代表1,在120,150,170,180,190和200和200岁之后的盛开后的天数);“x1,x2,x3,x4,x5和x6”分别代表在120,150,170,180,190和200岁的“ruixue”中的200个dafb(盛开之后的几天)。用不同字母的手段显着不同P<0.05, Duncan’s new multiple range test。补充表S4。用于RT-QPCR分析的基因特异性引物。补充图。S1。利用热图分析了“瑞雪”及其亲本在果实发育过程中转录因子的表达模式。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
刘,X.,郝,N.,冯,R。等等。转录组分析和代谢物分析为研究“瑞雪”苹果品种及其亲本果实发育过程中的挥发性化合物提供了新思路。BMC植物BIOL.21,231(2021)。https://doi.org/10.1186/s12870-021-03032-3
收到了:
接受:
发表:
关键词
- 挥发性芳香化合物
- “瑞雪”(马吕斯 × 有明显Borkh)。
- 水果的味道
- 气相色谱-质谱联用
- 基因表达