抽象的
背景
黄酮类化合物具有抗氧化活性,可以保护植物免受极端温度和活性氧的影响。我们发现深紫色种皮颜色是由黄和深紫色种皮颜色自交系的两种基因互作(12:3:1)控制的。F2:3种子按种皮颜色分为3组,分别在低温(4°C)和非驯化(18°C)条件下萌发1周,正常(18°C)条件下萌发3周,再进行低温胁迫(4°C)诱导。我们分析各组的日平均发芽率。此外,为了研究不同种皮颜色对低温下种子萌发能力和幼苗生长性能的驯化关系,我们测定了叶绿素含量、清除ROS活性、清除ROS、类黄酮生物合成途径相关基因的表达水平,和幼苗的冷反应。
结果
黄色和深紫色之间的种子偏析结果表明了一种双基因模型。在发芽研究中,正常的环境条件诱导黄色种子的萌发,而在冷却条件下,深紫色的萌发比率高于黄色种子。我们还发现,基于ROS清除酶的ROS清除酶,类黄酮化生物合成途径和冷响应基因的ROS清除酶活性和基因表达,较暗的种子涂层对冷驯化具有高度响应。
结论
我们认为,深紫色种子在正常条件下可能处于先天的预先获得应激反应状态,以更有效地抵消应激。而在驯化后,另一胁迫应增强冷胁迫基因的表达响应,这可能会使深紫色种子幼苗的冷胁迫响应更有效。
低温对作物产量的影响很大。因此,了解种子涂层颜色反应对寒冷应力的益处,鉴定限制因素对于开发育种策略是有用的,以提高寒冷胁迫下小麦产量。
背景
人口增长和气候变化是未来农业生产的挑战。据估计,为了满足不断增长的人口的需求,到2050年农业产量必须翻一番[1].耐寒物种能够通过渗透调节适应低温,如增加糖、有机酸和氨基酸[2那3.].但是,温度突然变化可能主要从严重的脱水中造成植物[4.那5.].低温,也称为冷却温度,是低(0 - 15°C)但不冻结温度(0°C以下)[6.].先前的研究报道,低温可以抑制韧皮部输出[7.那8.那9.那10],减少碳固定[7.]通过调节光合作用基因的转录来打断昼夜节律[11,并降解受损反应PSII中心[12].
众所周知,冬小麦(Triticum aestivum.L.)需要春化,将植物暴露在低温下作为花形成控制的平均值[13那14].据报道,冬小麦的最佳春化响应在7至8°C之间,因为它显示出更高或更低的温度较慢的响应[15].此外,有证据表明,当幼苗在冷处理后放置在温暖的环境条件下时,可以发生去春化[13].
冬小麦可耐受高达-20°C的温度,通过冷适应[16].例如,耐冷耐寒性作物(冬小麦和冬季黑麦)可以在低温下延长幼苗生长和发育后获得最大的冷冻耐受性(0-5°C)[7.].因为在秋冬季节,植物会暴露在较低或零度以下的温度下[7.],需要植物将植物突然改变扰动其代谢稳态,并根据应力的幅度,频率和持续时间诱导应力响应[17].
对耐寒品种和不耐寒品种进行了比较研究。对耐寒草本植物低温暴露后的研究报道,碳代谢的重编程参与了基因表达、酶活性的变化,可能还包括磷酸盐区隔的变化[18].此外,在低温下生长后,对冬季黑麦的先前研究报告称细胞大小,气孔频率较低,叶绿素含量的增加[19].植物可以累积关键代谢物[20.]由酶(例如猫,豆荚,SOD)和非酶促(例如,抗坏血酸,类胡萝卜素,生育酚和黄酮类)产生的抗氧化成分[21那22]共同解毒活性氧(ROS) [22在生物/非生物胁迫条件下。种皮中发现的叶绿素、类胡萝卜素和花青素[23]是重要的抗氧化剂[24与种子萌发行为有关[25那26,因为它们具有抗氧化活性。黄酮类化合物是一组天然物质,由不同的酚类结构及其亚基组成,包括黄酮、黄酮、黄烷醇、黄烷醇(儿茶素)、花青素和查尔酮[27].它们可能通过清除ROS参与了冷冻过程中的保护机制[28那29那30.那31].
转录因子(TFs)可以通过参与DNA甲基化、染色质组织、二聚体化和序列特异性DNA结合的协调机制来调控基因表达。转录因子可以作为基因的激活因子或抑制因子[32].CBF/DREB1家族是研究最多的负责冷硬化和耐霜的转录因子家族。WSC120被冷和冷冻温度和冷却相似诱导[33那34那35].最近的研究报道,参与花青素生物合成途径的转录因子在冷驯化植物中高度表达[36].
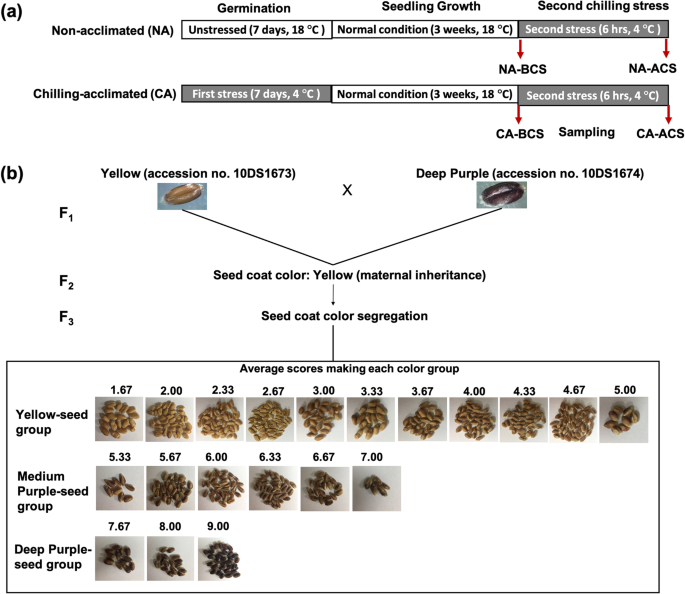
在这项研究中,我们假设种子涂层在低温条件下较较好的萌发性能,而不是其他组的萌发性能。此外,为了研究与不同种子涂层的关系的适应性,在寒冷的温度下的萌发能力和幼苗性能下,使用两组实验设计来分析种子涂层颜色和萌发温度如何影响幼苗对冷却的反应压力(CS)。首先,我们使用F对深紫色种子涂层进行遗传分析3.由黄与深紫种子自交系杂交获得的群体。其次,将分离后的种子分为黄(Ye)、中紫色(MP)和深紫色(DP)三类。各组种子分别在冷驯化(CA)(4℃)和非驯化(NA)(18℃)条件下萌发1周,在对照条件下正常生长3周。最后,在4°C下诱导第二个CS 6 h。本研究旨在研究冷胁迫对非驯化和冷驯化种子和幼苗不同种皮颜色的影响,并从叶绿素含量、酶活性和类黄酮相关通路的基因表达等方面进行研究。为了更好地表征种皮颜色对低温胁迫的响应,并找出有助于制定育种策略的限制因素,以提高小麦在低温胁迫下的产量。
结果
紫色种子颜色的遗传
裸眼部进行颜色偏析分析。观察者通过将整个种子除以从1(黄色)至9(深紫色)的不同颜色类别将整套种子分成了分析。执行分析后,计算并在附加文件中计算三个重复的平均得分1:表S1和附加文件2:表S2。
遗传分析结果表明,以13叶:3 DP和χ23.413和ap- 值为0.06(表1).然而,我们遵循我们的第二最好的χ2结果基于图中观察到的种子颜色变化。1B,将我们的种子分类为从平均得分的叶片(从1-5),MP-籽(高于5-7),DP-SEED(以上7至9),具有12:3:1的比例,χ21.988, ap值为0.37(表1).我们提出的双基因模型如表所示2在显性等位基因一种结果表明,叶种被毛颜色的表型和基因型不同A_B.或A_bb,无论在第二个轨迹处的基因型B..在没有主导的情况下一种等位基因(这AA.基因型),BB.或Bb导致MP-种子涂层颜色表型(AAB_),而BB.导致DP种子颜色外套(AABB.).
酚类和花青素量化
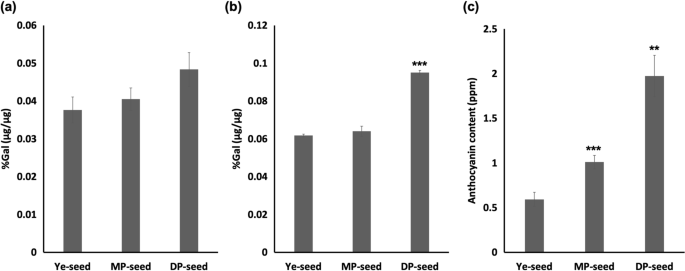
我们根据裸眼评分和遗传分析对种子进行膨化,生成组(Ye-、MP-和DP-seed),并提取游离酚(FP)、总酚(TP)和总花青素(AC)。虽然dp -种子组的FP含量最高,但DP-FP在MP-和ye -种子组间差异不显著。TP含量以dp种子组最高。但与其他组TP有显著性差异(p≤0.05)(图2a、b)。花青素含量在各组中均显著较高(p≤0.05),DP-、MP-和Ye-seed组的含量分别为1.974、1.010和0.593 ppm。2c)。这些结果表明,TP和AC内容随着紫色种子涂层的深度增加而增加。
非冷驯化和冷驯化条件下的发芽率
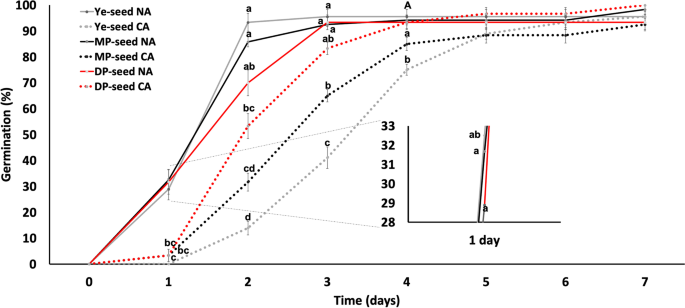
比较了Ye-、MP-和dp -种子组在NA和CA条件下的日发芽率。发芽率在第一天无明显差异(附加文件3.:图S1)。3组发芽率从第2天开始呈现显著差异。CA条件下dp种子组的日发芽率与NA条件下dp种子组的日发芽率有统计学差异。因此,与其他种皮颜色组相比,CS对dp -种子组的萌发性能没有影响。从第2天开始,dp种子组在低温萌发下的发芽率为53.33%,而MP-和ye种子组的发芽率分别为31.66%和12.88%。在CA处理第3天,DP-、MP-和ye种子组的发芽率分别为83.33%、65%和41.11%。在CA萌发条件下,dp组种子的发芽率高于MP-组和ye组,且MP组到第5天的发芽率高于ye组。然而,在第6天,mp种子组的发芽率没有任何变化。第5 d后,NA和CA条件下Ye-、MP-和dp -种子组的发芽率无显著差异。各种子组的萌发率均达到90%左右(图。3.).
幼苗叶绿素含量
叶绿素(的背影)已被用作不同作物胁迫和低温条件的指标[30.那37那38].我们分析了叶绿素含量是否受到种子涂料颜色的影响,通过测量通过测量在NA和CA条件下萌发的种子幼苗中的叶绿素含量来影响叶绿素含量和适应Chla那Chlb那总排名和Chla / Chlb比率。
表格3.表明,在种子颜色组之间的Na-和Ca-条件下,在颜色之间的颜色之间没有显着差异,而且,在种子颜色组之间的Na-和Ca-条件下,在冷却应力之后也没有显着差异。
ROS清除幼苗的酶活性
测定不同种皮颜色组的活性氧清除酶活性,分析CA对种子萌发期种子皮颜色与抗氧化清除活性的关系。表格4.显示NA和CA条件下萌发的幼苗总CAT、POD和SOD水平。与CA-ACS相比,在dp种子幼苗中NA-ACS的CAT活性显著升高((p0.53 U/gFW≤0.01)~ 257.513 U/gFW)。而在mp种子幼苗中,CA-ACS显著增加(p ≤ 0.05), with 0.711 U/gFW to 222.428 U/gFW, respectively. Even though there was no significant differences in total POD between the groups, it can be noted that ACS, DP-seed seedlings had the highest total POD (7.638 U/gFW), compared to Ye- or MP-seed seedlings ACS. In case of total SOD BCS, MP-seed seedlings under NA conditions had the highest amount at 5.685 U/gFW, compared to Ye- and DP-seed seedlings. Moreover, ACS, DP-seed seedlings germinated under CA conditions had the highest total SOD ACS with 7.865 U/gFW, but these results are not statistically significant.
清除ROS基因、类黄酮生物合成途径相关转录本、冷反应基因的表达
图中显示了ROS清除剂、类黄酮生物合成和冷反应相关基因表达模式的热图。4..在NA条件下,基因表达量最高的主要是NA- bcs dp -种子幼苗,除NA- bcs dp -种子幼苗外CAT1那PAP1 / MYB75,TTG1 / WD40.类黄酮生物合成基因的表达那如ANS,DFR,CHS那气和F3H,CA- acs dp -种子幼苗中活性氧清除相关基因的表达量降低。对于类黄酮生物合成途径中涉及的转录因子,PAP1 / MYB75在CA-ACS dp种子苗中表达量最高,而在CA-ACS dp种子苗中表达量最高TTG1 / WD40那MYB11,MYB111在Ca-AC的DP种子幼苗中减少。在冷响应基因中,CBF3.和WCS120在DP种子幼苗中显示出Ca-ACs的DP种子幼苗高表达。
讨论
种子涂层颜色评分和遗传分析
几种作物的种子颜色已被直观地测量过[39那40].为了我们的实验目的,颜色也通过视觉检查来评估,生成种子的分数从1到9,其中1代表黄色,9代表F的深紫色3.种子(附加文件1:表S1)。已知种子颜色由母体基因型确定[41那42那43].在本研究中,f3.种子(图。1b)采用x平方(χ2).χ2结果显示了本研究中的13:3(黄色:紫色)比(表1)以前报道紫色和蓝麦谷物之间的十字架[42,紫色颗粒对蓝色颗粒有抑制作用。因此,在我们的材料中,黄色颗粒对紫色颗粒有抑制作用。众所周知,这种比率只有两种表型分离[44].因此,我们考虑了第二好的χ2结果表明,dp -种子颜色是由两种基因互作(12:3:1)控制的。F2:3种子按种皮颜色12:3:1的比例分为三组[黄色(Ye-seed)、中紫色(MP-seed)、深紫色(DP-seed)]1),这已被证明是显性上位性的一个特征,通常有三种表现型[44].我们的实验和种子组颜色簇基于该分离比。因此,我们提出了叶片种子颜色含有优势等位基因(A)的主导外观模型。在主导的等位基因存在下一种,叶片制备为一种等位基因对两者都是上位性的B_和BB.组合。在没有主导的情况下一种等位基因(这AA.基因型),BB.或Bb导致mp种子颜色,而BB.导致DP种子颜色(表格2).该结果类似于在果皮中发现紫色沉积的遗传模型[45].
种子中的酚类物质和花青素
研究了黄色和黑色的酚类物质芸苔栗鸟[46]以及彩色玉米[47].两项研究都表明,颜色较深的种子(黑色和紫色)酚含量较高。我们的研究结果相似,dp种子组的FP和TP含量较高,MP-和ye种子组次之,但仅TP结果有统计学意义(图2)。2同样,颜色较深的种子花色苷含量较高,抗氧化活性高于颜色较浅的种子[47那48那49].这些结果与我们的数据一致,dp种子组的花青素含量较高,MP-和ye种子组次之(图2)。2c)。
发芽
在恶劣的条件下,据报道,由于ROS的清除,种子表现出高抗氧化活性的种子更好29那36那47].我们在冷却 - 适应(CA)(4℃)(4℃)下进行发芽测定,并不适应(Na)(18℃)一周。我们假设由于在其种子涂层上呈现的花青素,较暗的色素将显示出低温下的最快萌发。如图1所示。3.,正常的环境条件诱导较轻色泽的萌发(黄色种子),而在冷却条件下,较深的种子(深紫色)的发芽比率高于黄色种子。
NA和CA条件下CS处理后幼苗的叶绿素含量
叶绿素(的背影)已被用作不同作物胁迫和低温条件的指标[30.那37那38].我们的结果表明的背影NA和CA萌发条件下,BCS下小麦叶片的含量存在差异。在NA条件下Chla那Chlb那总排名,Chla/Chlb比率较高(表3.).另一方面,当种子在Ca条件下发芽时,结果表明的背影内容 (一个那b那总计,a / b比率)和NA条件下,叶和mp种子幼苗在灌浆前比NA条件下减少。然而,增加了的背影DP种子幼苗的内容。但是,这些结果没有显着差异。我们推测这些结果是由于冷却温度暴露的短期。
活性氧清除酶
压力诱导植物防御机制和次生代谢物的生产[50].测定活性氧清除酶,验证抗氧化剂对幼苗驯化的影响。ACS条件下,dp -幼苗中活性氧清除酶的含量最高(CAT、POD、SOD水平分别为257.513、7.638、7.865 U/gFW),高于其他条件(表2)4.).已有研究表明,活性氧清除酶如CAT、POD和SOD的存在在活性氧解毒中发挥重要作用,是对抗各种胁迫的防御机制[51那52].然而,当比较NA-BCS和Ca-BCS条件时,这些结果并不符合QRT-PCR的基因表达结果。QRT-PCR结果表明,在NA条件下,BCS除外cat1,其余ROS相关基因在dp种子苗中表达量最高(图2)。4.).在表4.结果表明,MP-和dp -种子中CA-ACS的CAT酶活性显著高于ye -种子和NA条件下的CAT酶活性。普拉萨德等人[53]的研究结果表明,4℃处理玉米幼苗7 d后,CAT活性升高,说明由于不明原因,CAT活性没有升高CAT3在非驯化幼苗中表达,说明CAT3表达是转录后或翻译后控制的。
根据这些结果,我们可以得出结论,在正常条件下,dp种子具有较高的ROS酶活性。dp种子具有较高的ROS清除活性,能够维持氧化还原稳态,保护各种胁迫引起的细胞损伤。
我们的Na和Ca条件的结果表明,在Na条件下促使低温暴露于低温促进POD和DP-Seed幼苗中的荚和SOD相关基因的累积。对于POD相关基因,PER2和RCl3在MP-籽幼苗中表达了高度表达。对于SOD基因,CSD2和CSD3也在mp种子苗中高表达那然而CSD1在DP种子幼苗中表达了高度表达。先前的研究表明,由于SOD,APX和猫类的活性增加,冷灌注植物具有比非灌注植物更有效的反应性氧清除系统,导致ROS生产的稳态更好地维持[54].同样,有报道称,暴露在低温下会导致ROS的积累[33].根据这些结果,我们可以假设,在正常条件下,dp种子幼苗对ROS的维护已经较好。因此,在低温条件下,dp种子幼苗在低温胁迫下受到的影响不如浅色种子幼苗。
黄酮类生物合成途径和冷响应基因
根据之前的报道[29那36[ochocyanin生物合成基因在更冻结的敏感性凝固中强烈抑制,但更诱导更冷冻耐腐蚀剂。我们的结果(图。4.)表明,大多数黄酮化生物合成基因转录物在Na-BCS条件下在DP种子幼苗中高度表达。在Ca-ACS条件下,DP种子幼苗表达了类黄酮生物合成基因的最高表达水平。此外,我们发现了气那UG78D1 / F3RT.,OMT由低温诱导,显示Na-AC下幼苗的转录水平的增加。
MBW,MyB-BHLH-WD40复合物与花青素和原霉素生物合成的调节有关。这些转录因子是激活与黄酮类生物合成途径相关的基因的关键[55那56].以往的报道表明,R2R3-MYB、PAP1/MYB75和MYB111可以控制花青素特异性生物合成步骤[55那57].本研究表明,转录水平的增加MYB11但不是MYB111.MYB11已知通过激活早期基因的启动子来调节类黄酮途径的早期步骤,例如CHS那气,F3h.[55].MYB111在小麦中可能是花青素途径的调控因子,而MYB11在小麦中可能是花青素途径的调控因子气在dp种子幼苗中的NA-ACS。[36研究也表明低温可以诱导花青素的生物合成。它们也在更适应环境的植物中被诱导。同样,我们的研究结果显示,花青素相关基因(答和DFR.)冷驯化后,在CA条件下萌发的dp种子。研究表明,TTG1/WD40可与PAP1/MYB75相互作用,进行花青素生物合成[57].然而,在我们CA-ACS条件下的结果中,PAP1 / MYB75, 但不是TTG1 / WD40,在DP种子幼苗中高度表达,类似于[36].我们可以得出结论,在小麦幼苗中,花青素的生物合成途径可能不受MBW复合物的调控。PAP1/MYB75可能是调控小麦幼苗花青素合成的关键转录因子。我们的研究结果表明,在dp -种子幼苗中,花青素途径响应CS的上游调控因子可能未被识别。
以前的研究[36证明了TTG1 / WD40和OMT在温暖条件下高度表达,但在寒冷条件下变化不大。相反,OMT仅在NA下萌发的dp种子苗中表达,而在CS后诱导表达。因此,OMT和TTG1 / WD40可能会受到小麦的寒冷的影响。
CBF和WSC120是编码通过冷和冷冻温度诱导的转录激活剂的基因[33那34那35].我们分析了CBF3.那CBF12,和WSC120转录物观察我们Na和Ca幼苗的低温响应。类似地,在NA植物中的BCS条件下的冷响应基因,在DP种子幼苗中检测到这些基因的最高转录物,而CBF3.和WCS120CA条件下,在NA-ACS植物中萌发的dp种子幼苗的转录水平较高。CBF12.结果表明,dp -种子幼苗NA-BCS的表达量高于CA- bcs,说明正常条件下dp -种子幼苗可能处于先天的预获得应激反应状态。这一数据支持了CA-BCS条件下dp -种子幼苗的研究结果,该结果表明,低温响应基因的表达量降低,说明dp -种子的低温驯化可以增强其应对胁迫的能力,从而降低基因表达量。驯化后,另一个胁迫应增强冷基因的表达响应,这可能导致更有效的冷胁迫响应,据[34],春小麦品种与冬小麦品种相比,由于不能保持低温基因处于上调状态,对低温的耐受性较低。虽然CBF12.和WCS120众所周知,响应于寒冷,根据具体情况,表达方式可能不同。如图所示。4.那CBF12.和WCS120Na-BCS的基因表达比对于DP种子幼苗的Ca-Acs较高,这可能是由于上述原因,DP种子幼苗在Na-BCS中处于防御状态。另一方面,当比较Ca-BCS和Ca-AC之间的基因表达水平时,冷却应力后存在增加,表明DP-种子幼苗中的冷响应基因更响应,这可以提供有效的耐受能力DP种子。另外,根据这些结果,我们建议CBF3.在本研究中可能是DP种子幼苗的主要反应基因。
结论
冬小麦在苗期经常暴露在低温和零度以下的混合温度下。当温度逐渐降低时,小麦植株能适应低温。然而,突然的温度变化会伤害植物。结果表明,种皮颜色对种子萌发有一定的影响。此外,种子颜色较深的幼苗对低温的反应更好。非驯化条件下,DP种子幼苗活性氧清除酶、活性氧清除、类黄酮生物合成途径相关基因的转录水平均升高。冷反应表明,深紫色种子在正常条件下可能处于先天的预先获得应激反应状态,以更有效地抵消应激。而在驯化后,另一胁迫应增强冷胁迫基因的表达响应,这可能会使深紫色种子幼苗的冷胁迫响应更有效。
低温条件通常会减少生理和生化过程。然而,本研究表明,种子颜色深的幼苗在低温胁迫下比颜色浅的幼苗表现更好。在全球范围内,低温对作物产量有很大影响。因此,了解种皮颜色及其益处将有助于培育出具有所需驯化性状的作物。
材料和方法
植物材料
不同种皮表型的重组自交系(RILs);10DS1673,高丽大学小麦子基因库)和深紫(accession no. 10DS1673)。10DS1674),使用[58].种子在湿润的滤纸上室温发芽24 h, 4℃暗室春化4周。然后将每棵幼苗移栽到高丽大学控制良好的温室中,光周期为16:8小时,温度为20-25℃,花盆(5 × 5 × 16厘米)内填充土壤(Sunshine mix #1, Sun Gro Horticulture, Canada)。F3.141 F种子2植物用于分析种子涂层颜色偏析。物料的详细描述显示在附加文件中1:表S1。
颜色隔离和萌发测定的遗传分析
F的颜色偏析分析3.人口进行裸眼。F3.每个141华氏度的种子2对植物进行了9个不同的颜色分类(1个为淡黄色,9个为深紫色)。遗传分析采用χ 2 (χ 22)在Microsoft Excel中测试。将种子用商用次氯酸钠(4%)洗涤3分钟,用蒸馏水冲洗,在洋红色盒(6.5×6.5×20cm; Greenpia Technology Inc.,Yeoju,Korea)中萌发,在聚丙烯网上进行,保持网眼下方的蒸馏水。在腔室中进行非适应(Na)条件,其光周期为16小时光:8小时暗,温度为18℃,湿度为60%,透气的发光功率为17,000次。在一个温度为4°C的冰箱中进行冷却 - 驯化(CA)一周。对NA和Ca条件进行三次重复。
发芽率[发芽率=(萌发的种子/总种子)* 100%][59每天用胚胎挤出记录7天作为标准[60.那61.].萌发试验7 d后,NA和CA幼苗均转入光周期为16 h、暗8 h、温度为18℃、湿度为60%的控制室内,培养3周。NA组和CA组分别在4℃下进行6 h的低温处理。在CS前后取样测定叶绿素含量、ROS和RNA提取以检测基因表达,如图所示。1a.根据遗传分析,以黄色(叶子,得分:1-5)、中紫色(mp -种子,得分:> - 5)和深紫色(dp -种子,得分:> - 9)分组为单位,各颜色分值的平均发芽率表示发芽结果。
种子中酚类物质和花青素的定量分析
使用遵循[中的议定书后的Folin-Ciocalteu试剂,测量游离酚类(FP)和总酚类(TP)。62.].F3.各组种子(Ye-、MP-、dp -)用液氮粉碎,测定颗粒粉20 mg。总花青素含量按[63.].FP和TP的吸光度在765 nm处读取,而花青素的吸光度在530 nm和657 nm处读取(使用microplate reader (HIDEX-Sense 425-301, Finland))。结果以遗传分析为基础,将叶-、MP-或dp -种子中各颜色评分种子的酚类或花青素3个生物学重复的平均值表示。
幼苗叶绿素含量分析
用第二次CS前后采集的叶样(Ye-、MP-和dp -种子)测定叶绿素含量。样品立即在液氮中冷冻,并保存在-80°C,直到进一步使用。叶绿素含量测定方法为[64.用酶标仪(HIDEX-Sense 425-301, Finland)在652和665 nm处测量吸光度。通过遗传分析,得到了叶-、MP-和dp -种子组各颜色分块种子的叶绿素含量平均值。
ROS清除酶
采用RILs(登录号)进行3个重复的发芽试验。10DS1673和10DS1674),以及mp种子组(F3.从MP-种子被评分的种子产生的种子)。将样品在第二个CS,在液氮中冷冻,并储存在-80℃直至进一步使用。用液氮研磨新鲜组织(0.5g)并在0.5ml蛋白质萃取缓冲液中均化[0.2M磷酸钾缓冲液(pH7.0)和0.1mM EDTA]。使用[框),使用蛋白质定量的总蛋白质定量,然后使用[中的方案)的总超氧化物歧化酶(SOD),过氧化物酶和过氧化物酶(POD)进行定量。58].
RNA提取,cDNA合成,实时PCR
从RILs第二次CS前后的样本中提取总RNA,共3个重复。10DS1673和10DS1674)和mp种子组(F3.种子生成的MP得分种子)。样品在液氮中研磨。采用TRIzol试剂(Invitrogen,美国)提取RNA。使用cDNA Takara PrimeScript™1st strand cDNA synthesis Kit (Takara, Japan)进行cDNA合成。利用Primer-BLAST (NCBI,https://www.ncbi.nlm.nih.gov/tools /prime r-blast /)或以前的出版物,如附加文件所述4.:表S3。采用EvaGreen 2X qPCR MasterMix (ABM,加拿大)在CFX-96 RT-PCR仪(Bio-Rad,美国)上进行3个重复的定量PCR。β肌动蛋白(加入编号.AB181991)用作内部控制。然后针对肌动蛋白表达标准化每个基因的CT值。2−ΔΔCT方法用于计算fold changes中的表达水平,如前所述[65.].使用Gene-E (https://software.broadinstitue.org/gene-e/).
统计分析
所有数据都以三次重复的方式显示。使用R Studio版本1.2.5033进行方差分析、Duncan或t检验(http://www.rstudio.com/)或IBM®SPSS®Statistics for MAC version 25 (IBM Corp., Armonk, NY, USA)。所有测试均以95%、99%和99.9%的置信度进行。
数据和材料的可用性
本研究产生的所有数据均包含在文章及其补充信息文件中,或可在合理要求的情况下从通信作者处获得。
缩写
- 交流:
-
花青素
- ACS:
-
后的压力
- BCS:
-
在寒冷的压力之前
- CA:
-
冷静适应
- 排名:
-
叶绿素
- 猫:
-
催化剂
- DP:
-
深紫色
- 外交政策:
-
免费的酚醛树脂
- 议员:
-
中等紫色
- 拿拿淋:
-
Non-acclimated
- 圆荚体:
-
过氧化物酶
- ROS:
-
反应性氧气
- 草皮:
-
超氧化物歧化酶
- TP:
-
总酚类
- 你们:
-
黄色
参考
- 1.
陈志强,陈志强,陈志强。气候变化对农业生产的影响。生物技术和生物工程的当前发展。爱思唯尔。2017;23-46。https://doi.org/10.1016/B978-0-444-63661-4.00002-5
- 2.
Parkin KL, Marangoni A, Jackman RL, Yada RY, Stanley DW。冷害。可能机制综述。食品生物化学。1989;13(2):127-153。https://doi.org/10.1111/j.1745-4514.1989.tb00389.x.
- 3.
Van Buer J,Prescher A,Baier M.叶绿体ROS信号传导的冷启动是发育调节的,并在紫花状膜上局部控制。SCI批准。2019; 9(1):3022。https://doi.org/10.1038/s41598-019-39838-3.
- 4.
陈志强,王志强,王志强,等。耐冷植物光合作用、光抑制和低温驯化的研究进展。第19 - 39 Photosynth杂志1993;37(1):中。https://doi.org/10.1007/BF02185436.
- 5.
托马斯休曼氏金融。植物冷驯化:抗冻基因及其调控机制。植物生理学报1999;50:571-99。https://doi.org/10.1146/annurev.arplant.50.1.571.
- 6。
Theocharis A,ClémentC,Barka EA。低温生长植物的生理和分子变化。Planta。2012; 235(6):1091-105。https://doi.org/10.1007/s00425-012-1641-y.
- 7。
赶快vm,猎人np。冷硬化对冬季和春小麦敏感性的影响叶片短期光合作用及恢复光合作用。植物理性。1992年; 100(3):1283-90。https://doi.org/10.1104/pp.100.3.1283.
- 8.
关键词:黑麦,低温,光合作用,核酮糖-1,5-二磷酸羧化酶/加氧酶,蔗糖磷酸合酶植物杂志。1994;106(3):983 - 990。https://doi.org/10.1104/pp.106.3.983
- 9.
Klotke J, Kopka J, Gatzke N, Heyer AG。可溶性糖浓度对拟南芥冷适应对比获得耐冻性的影响-棉子糖在冷适应中的作用的证据。植物学报。2004;27(11):1395-404。https://doi.org/10.1111/j.1365-3040.2004.01242.x..
- 10.
Strand A,Hurry V,Gustafsson P,GardeströmP.拟南芥叶片在低温下的叶片释放抑制光合作用和光合基因表达,尽管可溶性碳水化合物积累。工厂J.997; 12(3):605-14。https://doi.org/10.1046/j.1365-313x.1997.00605.x..
- 11.
低温干扰冷敏感植物转录活性的昼夜调节。中国科学院院刊1992;89(9):3731-5。https://doi.org/10.1073/pnas.89.9.3731.
- 12.
Krupa Z,Oquist G,Gustafsson P. phastafistis anacystis nidulans的PSBA基因灭活菌株中的光合作用和回收光合作用。植物理性。1990; 93(1):1-6。https://doi.org/10.1104/pp.93.1.1.
- 13.
郎A。花火生理。Diglerenzierung entwicklung /差异化与发展。1965年; 1380-536。https://doi.org/10.1007/978-3-642-50088-6_39
- 14.
方严L,李G,余米,T,曹年代,卡佛的男朋友。冬小麦品种春化需要时间的遗传机制。小麦遗传学进展:从基因组到田间。2015;117-25。https://doi.org/10.1007/978-4-431-55675-6
- 15.
Rawson HM,Zajac M,Penrose LDJ。幼苗温度的影响及其对络合反应不同不同的小麦品种发展的影响。f crop res。1998年; 57(3):289-300。https://doi.org/10.1016/s0378-4290(98)00073-2.
- 16.
弗雷德里克TM,克里斯托弗JT,博雷尔AK。澳大利亚北部小麦抽穗后的低温适应。第11届国际小麦遗传研讨会。2008;(1):1 - 3。
- 17。
Ensminger I, Busch F, Huner NPA。光合作用与冷驯化:通过光合作用感受低温。杂志。2006;126:28-44。https://doi.org/10.1111/j.1399-3054.2006.00627.x.
- 18。
Strand A,Hurry V,Henkes S等人。拟南芥的适应叶在低温下发展。增加细胞质体积伴随着Calvin循环和蔗糖 - 生物合成途径中酶活性的增加。植物理性。1999年; 119(4):1387-1398。https://doi.org/10.1104/pp.119.4.1387
- 19.
李鹏,李鹏。黑麦叶片解剖结构对低温胁迫下生长的响应。植物公报.1981; 142(1):55-62。检索到2021年3月22日,来自http://www.jstor.org/stable/2474787
- 20.
小波特,谢苗诺夫作物对气候变化的响应。中国生物科学(英文版)。https://doi.org/10.1098/rstb.2005.1752.
- 21.
鳃SS,Tuteja N.作物植物中非生物胁迫耐受性耐受性氧气和抗氧化机械。植物理性生物化学。2010; 48(12):909-30。https://doi.org/10.1016/j.plaphy.2010.08.016.
- 22.
你J,Chan Z.在作物植物中非生物应激反应期间的ROS规则。前植物SCI。2015; 6:1092。https://doi.org/10.3389/fpls.2015.01092.
- 23.
花青素和甜菜碱在植物、食品和人类营养中的功能特性。食品科学技术。2004;15(1):19-38。https://doi.org/10.1016/j.tifs.2003.07.004
- 24.
Delgado-Vargas F,JiménezAR,Paredes-LópezO.天然颜料:类胡萝卜素,花青素和贝甲虫 - 特征,生物合成,加工和稳定性。CRIT REV FOOD SCI NUTR。2000; 40(3):173-289。https://doi.org/10.1080/10408690091189257.
- 25.
Bajji M,M'hamdi M,Gastiny F,Rojas-Beltran,Ja,Du Jardin,P.过氧化氢酶抑制加速了休眠释放和在马铃薯(Solanum Tuberosum L.)块茎中发芽。最后的乔丹科希巴布巴。2007;11(22):121-131。
- 26.
亨德里克斯SB,泰勒森RB。用过氧化氢酶抑制打破种子休眠。中国科学院院刊1975;72(1):306-9。https://doi.org/10.1073/pnas.72.1.306.
- 27.
Panche An,Diwan Ad,Chandra SR。黄酮类化合物:概述。J Nutr Sci。2016; 5:E47。https://doi.org/10.1017/jns.2016.41.
- 28.
Nakabayashi R,Yonekura-Sakakibara K,urano K,等。抗氧化黄酮的抗氧化黄酮植物征收拟南芥氧化和耐旱性的增强。植物J. 2014; 77(3):367-79。https://doi.org/10.1111/tpj.12388.
- 29。
Schulz e,Tohge T,Zuther,E。et al。黄酮类化合物是拟南芥耐冻性和冷驯化的决定因素。Sci代表.2016; 6:34027。https://doi.org/10.1038/srep34027
- 30.
朱海涛,李旭东,翟伟,等。弱光对紫白菜光合特性、抗氧化酶活性和花青素积累的影响。对牧野)。《公共科学图书馆•综合》。2017;12 (6):e0179305。https://doi.org/10.1371/journal.pone.0179305
- 31.
宗义,席新,李胜,等。小麦tamyc1基因调控果皮花青素合成的等位变异和转录亚型。植物学报2017;8:1645。https://doi.org/10.3389/fpls.2017.01645.
- 32.
Feller A,Machemer K,Braun El,Grotewold E. MyB和BHLH植物转录因子的进化和比较分析。工厂J1111; 66(1):94-116。https://doi.org/10.1111/j.1365-313x.2010.04459.x.
- 33.
基于冷诱导CBF1因子依赖的信号通路通过影响赤霉素代谢调控生长抑制DELLA蛋白的积累。植物细胞。2008;20(8):2117 - 29。https://doi.org/10.1105/tpc.108.058941.
- 34.
李志刚,李志刚,李志刚,等。春化对小麦和黑麦低温诱导基因表达的调控作用[j]。中国科学(d辑:地球科学)1996;93(4):554-9。https://doi.org/10.1007/BF00417947.
- 35.
Houde M,Dhindsa Rs,Sarhan F.一种分子标记,可在禾本科中选择冷冻耐受性。Mol Gen Genet。1992年; 234(1):43-8。https://doi.org/10.1007/BF00272343.
- 36.
Schulz E, Tohge T, Zuther E, Fernie AR, Hincha DK。拟南芥植物冷驯化过程中黄酮醇和花青素代谢的自然变异植物学报。2015;38(8):1658-72。https://doi.org/10.1111/pce.12518.
- 37.
Kalisz A,JezdinskýA,Pokluda R,SękaraA,Glabowska A,Gil J.冷却对青少年罗勒品种的光合作用和叶绿素颜料含量的影响。Hortic Environ Biotechnol。2016; 57(4):330-9。https://doi.org/10.1007/s13580-016-0095-8.
- 38.
刘安华,高峰,刘志强,等。小麦种子成熟后休眠的调控是由特定的转录开关介导的,该开关可引起种子激素代谢和信号转导的变化。PLoS ONE。2013; 8 (2): e56570。https://doi.org/10.1371/journal.pone.0056570.
- 39.
Nandy S,Chen Q,Cheng S,Faiz S,Graf R,Kereliuk G.营养分析及其近红外光谱不同起源的彩色小麦种子系中的遗传性质。植物科学与生物技术杂志。2008; 2(2):74-9。
- 40。
van deynze Ae,Pauls Kp。使用近红外反射率光谱仪在芸苔的种子评估,适用于可见光测量。Euphytica。1994; 76(1-2):45-51。https://doi.org/10.1007/BF00024019.
- 41。
格里芬WB。用紫粒发生量测定新西兰小麦的异交。中国农业科学1987;30:287-90。
- 42.
郭志强,徐鹏,张志强,郭勇。杂交一代小麦色粒分离率的研究。作物育种与应用生物技术。2012;12(2):126-31。
- 43.
郭Z,徐P,张Z,王D.跨越小麦彩色谷物的分离比例。Aust J Croc SCI。2011; 5:589-94。https://doi.org/10.1590/S1984-70332012000200005.
- 44.
Griffiths AJF, Miller JH, Suzuki DT,等。遗传分析导论,第7版。纽约:W. H.弗里曼;2000.可以从:https://www.ncbi.nlm.nih.gov/books/NBK21766/
- 45.
拉赫曼MM,Lee Ke,Lee Es,等。互补基因PP和Pb的遗传构成确定了黑米饭中具有Cyanidin-3-O-葡糖苷沉积的Pericarps的紫色变化。J植物BIOL。2013; 56(1):24-31。https://doi.org/10.1007/s12374-012-0043-9.
- 46.
曲超,傅芳,陆坤,等。甘蓝型油菜黑、黄籽酚类化合物积累差异及相关基因表达J Exp Bot. 2013;64(10): 2885-98。https://doi.org/10.1093/jxb/ert148.
- 47.
邓斌,杨锴,张勇,等。温度对白、黄、红、紫玉米种子萌发行为的影响。植物学报。2015;37:174。https://doi.org/10.1007/s11738-015-1937-1.
- 48.
Furuta S,Takahashi M等人。黑色种子涂层大豆品种的根治性清除活动。食品SCI Technol Res。2003; 9(1):73-5。https://doi.org/10.3136/fstr.9.73.
- 49.
Slavin M,Kenworthy W,Yu LL。抗氧化性能,植物化学组合物和彩色种子涂层的马里兰生长大豆的抗增殖活性。JAgric Food Chem。2009; 57(23):11174-85。https://doi.org/10.1021/jf902609n..
- 50.
Rezaie R,Abdollahi Mandoulakani B,Fattahi M.冷胁迫改变抗氧化防御系统,苯丙醇丙烯酸含量和参与其生物合成中的基因的表达,在SOCIMACILICUM中。2020; 10(5290)。https://doi.org/10.1038/s41598-020-62090-z.
- 51。
陈志强,陈志强,陈志强,等。干旱和盐胁迫下活性氧的动态平衡及其信号转导。植物学报。2010;33(4):453-67。https://doi.org/10.1111/j.1365-3040.2009.02041.x..
- 52。
等。过氧化物酶活性作为大豆品种耐水分亏缺的指标。Biosci j . 2013; 29(5): 1664 - 71。
- 53。
玉米幼苗低温诱导氧化应激的证据和过氧化氢的调节作用。植物细胞。1994;6(1):65 - 74。https://doi.org/10.1105/tpc.6.1.65.
- 54.
Li X,Cai J等人。冷启动驱动亚细胞抗氧化系统,以保护光合电子输送在冬小麦中随后的低温胁迫。植物理性生物化学。2014; 82:34-43。https://doi.org/10.1016/j.plaphy.2014.05.005.
- 55.
Gonzalez A, Zhao M, Leavitt JM, Lloyd AM。TTG1/bHLH/Myb转录复合物对拟南芥幼苗花青素合成途径的调控植物j . 2008; 53(5): 814 - 27所示。https://doi.org/10.1111/j.1365-313X.2007.03373.x.
- 56.
徐伟,李志强,李志强,等。类黄酮生物合成的调控涉及到一个意想不到的复杂转录调控TT8的表达。acta botanica yunnanica(云南植物研究). 2013;198(1):59-70。https://doi.org/10.1111/nph.12142.
- 57.
关键词:拟南芥,MYB75/PAP1基因,蔗糖特异性诱导,花青素合成植物杂志。2005;139(4):1840 - 52。https://doi.org/10.1104/pp.105.066688.
- 58.
Shin OH, Kim DY, Seo YW。不同籽粒颜色深度对小麦吸胀过程中抗氧化能力的影响中国农业科学。2017;97(9):2750-2758。https://doi.org/10.1002/jsfa.8102
- 59.
Manmathan H,Lapitan N.测量小麦的萌发百分比。生物协议。2013;3(16),3-5。https://doi.org/10.21769/bioprotoc.866
- 60.
布雷JD。种子萌发与休眠。植物细胞。1997;9(7):1055 - 66。https://doi.org/10.1105/tpc.9.7.1055.
- 61.
Schopfer P,Plachy C.脱落酸的种子萌发控制:III。对甘蓝型植物理性生理基质胚胎生长潜力(最小Turgor压力)和生长系数(细胞壁伸展性)的影响。1985; 77(3):676-686。https://doi.org/10.1104/pp.77.3.676
- 62.
陈志强,陈志强,等。Laboratorio de calidad nutrition de maíz y análisis de tejido vegetal: Laboratorio协议2012。国际玉米和小麦改良中心。2012
- 63。
Hong Mj,Kim Dy,Ahn JW,康Sy,SEO YW,Kim JB。彩色小麦急性和慢性γ辐射辐射敏感性反应的比较。Genet mol Biol。2018; 41(3):611-23。https://doi.org/10.1590/1678-4685-gmb-2017-0189.
- 64。
用微平板阅读器快速测定叶绿素。植物营养学报2008;31:1321-32。https://doi.org/10.1080/01904160802135092.
- 65。
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25(4):402-8。https://doi.org/10.1006/meth.2001.1262.
确认
PCF承认CONACYT提供的奖学金。
资金
这项工作是在“农业与技术发展(项目编号PJ015666)”农村发展管理局“的”下一代生物格林21计划“的支持下进行了。大韩民国。
作者信息
从属关系
贡献
PCF和YWS构思和设计了实验。PCF进行了实验,分析了数据,并用来自Dyk和YWS的支持写了稿件。JSY帮助抗氧化酶表达和基因表达分析。Dyk和Yws贡献了有价值的讨论。所有作者都讨论了结果并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
卡尔德隆·弗洛雷斯,P.,尹,j.s.,金,D.Y.et al。冷驯化对不同种皮色小麦萌发及幼苗冷响应的影响(Triticum aestivum.l .)。BMC植物杂志21,252(2021)。https://doi.org/10.1186/s12870-021-03036-z
收到了:
公认:
发表:
关键字
- 耐寒性
- 类黄酮
- 低的温度
- 紫色的小麦
- ROS