- 研究gydF4y2Ba
- 开放访问gydF4y2Ba
- 发布:gydF4y2Ba
核桃的转录组和蛋白质组分析(gydF4y2Bajuglans regia.gydF4y2BaL.)果实响应感染gydF4y2BaCollettrichum gleooosporioidesgydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba21.gydF4y2Ba文章编号:gydF4y2Ba249.gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
核桃炭疽病诱导gydF4y2BaCollettrichum gleooosporioidesgydF4y2Ba是一种影响核桃生产的灾难性疾病。核桃水果的抵抗力gydF4y2Bac、gydF4y2Ba是一种高度复杂和转基本的过程。但是,潜在的机制尚未阐明。gydF4y2Ba
结果gydF4y2Ba
了解核桃防御的分子机制gydF4y2Bac、gydF4y2Ba,我们使用RNA测序和无标记定量技术来生成组织在不同生活方式转变的转录组和蛋白质组谱gydF4y2Bac、gydF4y2Ba,包括020hpi,48 hpi和72hpi的0 HPI,病理组织,120hpi的远端未诱导组织,在抗蒽糖F26果实苞片和炭疽糖易溶的F423果实苞片中,通过扫描电子显微镜定义。在5个时间点,在F26对F423中鉴定了总共21,798个差异表达的基因(DEGS)和1929个差异表达蛋白(DEPS),早期感染阶段的液位和DEP的数量显着较高。使用转录组的成对比较和加权基因共表达网络分析,我们鉴定了两种与转录表达基因网络中的抗病性和九个枢纽基因显着相关的模块。基因本体和京都基因和基因组细胞的细胞缺乏患者和DEPS的分析表明,许多基因主要与免疫应答,植物激素信号转导和次生代谢物相关,并且许多DEP涉及碳代谢和光合作用。转录组数据和蛋白质组数据之间的相关分析还表明,感染早期mRNA和相应蛋白质的差异表达的一致性相对较高。gydF4y2Ba
结论gydF4y2Ba
总的来说,这些结果有助于阐明核桃果实的分子反应gydF4y2Bac、gydF4y2Ba并为核桃抗病抗性的遗传改善提供基础。gydF4y2Ba
背景gydF4y2Ba
在植物和致病微生物的共同演变期间,植物演化了一种复杂的先天免疫系统,以防御病原体感染[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].植物先天免疫系统主要包括病原体相关的分子模式(PAMP) - 触发的免疫(PTI)和效应触发的免疫(ETI),其依赖Mapk级联信号通信网络和分子识别来调节相应基因的表达,发起防御反应,通过水杨酸(SA)介导的信令网络产生全身性获得的阻力(SAR)[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].PTI是一种由模式识别受体(PRRs)触发的基本防御反应,它检测保守的PAMPs [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].由抗性基因编码的大量蛋白质(gydF4y2BaRgydF4y2Ba)作为细胞内免疫受体识别病原体效应蛋白并激活ETI,进而诱导局部超敏反应(HR)细胞死亡以限制病原体的生长和繁殖[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].大多数细胞内受体是核苷酸结合,富含亮氨酸的重复蛋白(NLRS),其在植物免疫中起不同的作用[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba].到目前为止,有超过213个典型案例gydF4y2BaRgydF4y2Ba赋予多种类型病原体耐药的基因在小麦中(gydF4y2Ba小麦gydF4y2Bal .)、水稻(gydF4y2Ba栽培稻gydF4y2Bal .),大麦(gydF4y2BaHordeum Vulgare.gydF4y2BaL.),玉米(gydF4y2Ba玉米gydF4y2BaL.)和其他作物物种。本地HR还可以通过产生移动信号,防御激素SA的积累和抗微生物发病性相关(PR)蛋白质的分泌物来诱导全系统获得的电阻(SAR)。gydF4y2Ba
大量基因,蛋白质和代谢物参与植物先天免疫过程,并在复杂的网络系统中互相交流[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba].随着“OMICS”技术的不断发展,使用转录组和蛋白质组数据重建了网络和途径。然而,由于转录后,翻译或翻译后的调节机制以及替代剪接的复杂性,检测到的转录变化不一定反映在相应的测定蛋白的表达中[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15.gydF4y2Ba].因此,具有各种生物信息学研究方法的转录组和蛋白质组数据的整合可以改善我们对基础生物过程的分子网络的理解[gydF4y2Ba16.gydF4y2Ba].集线器基因和在小麦中运营的关键蛋白质 -gydF4y2Ba太平洋标准时间gydF4y2Ba(gydF4y2Ba柄锈菌striiformisgydF4y2BaF。sp。gydF4y2BatriticigydF4y2Ba)通过两两比较和加权基因共表达网络分析(WGCNA)确定相互作用[gydF4y2Ba13.gydF4y2Ba].在大豆(gydF4y2Ba甘氨酸最大gydF4y2Ba)发现与丛枝菌根真菌,关键途径和差异表达的蛋白质(DEP)参与与“苯丙氨酸代谢”相关的方法,“植物激素信号转导”,“植物 - 病原体相互作用”和“代谢途径”相关基因本体(GO)和Kyoto基因组(Kegg)分析[gydF4y2Ba17.gydF4y2Ba].转录组和代谢组数据集的整合极大地提高了基因调控网络(GRNs)的预测能力[gydF4y2Ba18.gydF4y2Ba].gydF4y2Ba
核桃 (gydF4y2Bajuglans regia.gydF4y2BaL.),为中亚山区的二倍体物种(2n = 32),在全球范围内培养螺母生产[gydF4y2Ba18.gydF4y2Ba].Martínez-garcía等。[gydF4y2Ba19.gydF4y2Ba]公布了“Chandler”的参考基因组(每1C基因组约606 Mb),使全基因组重测序成为可能[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba],核桃中重要农艺性状的遗传解剖[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba],以及高密度基因分型工具的发展[gydF4y2Ba23.gydF4y2Ba].核桃炭疽病诱导gydF4y2BaCollettrichum gleooosporioidesgydF4y2Ba(PENZ。)PENZ。和Sacc导致果实生成和叶片烧焦,导致高达50%的产量损失,并据报道核桃生产中的严重问题[gydF4y2Ba24.gydF4y2Ba].大多数gydF4y2Ba刺盘孢属gydF4y2Ba物种以血管营养方式完成致病过程。首先,Conidia发芽生成产生渗透栓的孕术以开始初始感染。渗透PEG在植物细胞中产生初级菌丝,分泌小分子蛋白,吸收次级代谢物进入生物养学。最后,由初级菌丝产生的次级菌丝在植物细胞中迅速生长,释放犬胞嘧啶和崩解植物细胞进入病症[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].炭疽病的特征在于长期潜伏期,浓缩的发作时间和强烈的爆发。化学杀菌剂的使用仍然是疾病控制的主要方法[gydF4y2Ba28.gydF4y2Ba].抗性分子机制的报道较少gydF4y2Bac、gydF4y2Ba在核桃。利用蛋白质组学和转录组学相结合的方法,可以进一步了解核桃抗病性的机理gydF4y2Bac、gydF4y2Ba.在这篇文章中,我们观察了生活方式的转变gydF4y2Bac、gydF4y2Ba在接种后在水果苞片中。组合无标记的定量和Illumina RNA测序技术(RNA-SEQ)以研究核桃基因和蛋白质抗性的血液基因和蛋白质gydF4y2Bac、gydF4y2Ba在不同的时间点。结果阐明了核桃抗性的分子机制gydF4y2Bac、gydF4y2Ba并且可用于促进核桃疾病抗药性和密集栽培。gydF4y2Ba
结果gydF4y2Ba
生活方式过渡gydF4y2Bac、gydF4y2Ba在感染的核桃水果中gydF4y2Ba
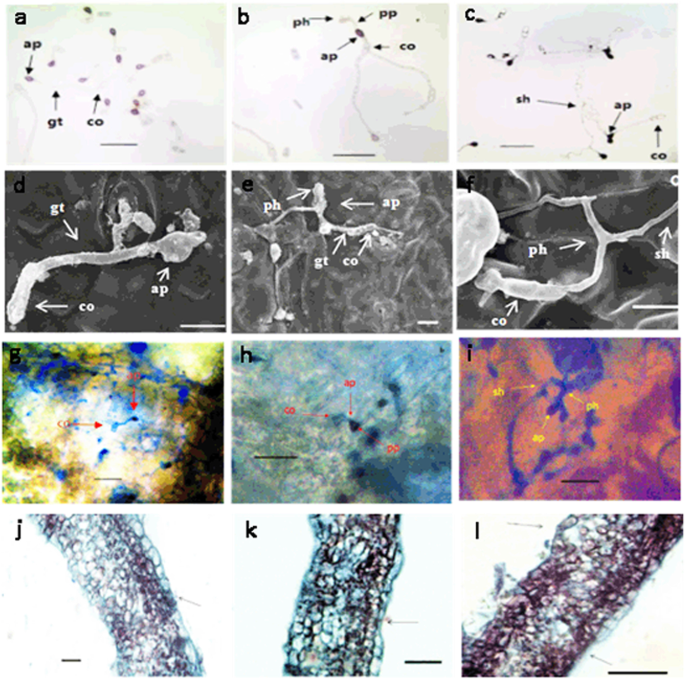
来定义生活方式的转变gydF4y2Bac、gydF4y2Ba在感染的核桃水果苞片中,果实的解剖学特征感染gydF4y2Bac、gydF4y2Ba扫描电镜、苯胺蓝染色、石蜡切片观察。结果表明gydF4y2Bac、gydF4y2Ba分生孢子在果苞片上萌发,在6 ~ 12 hpi范围内分化为附着孢子。附着膜在24 hpi处显示一个很薄的穿透钉(图。gydF4y2Ba1gydF4y2BaA,D,G,J)。通过渗透PEG产生的初级菌丝出现在48 HPI的细胞内空间中,标记生物养学的开始(图。gydF4y2Ba1gydF4y2Bab, e, h, k)。随后感染进入坏死营养阶段,真菌在72 hpi时形成次级和坏死营养菌丝(图。gydF4y2Ba1gydF4y2BaC,F,I,L)和远端未置入的组织可在120 HPI处获得电阻。因此,根据生活方式过渡的gydF4y2Bac、gydF4y2Ba,收集抗病果实(F26)和感病果实(F423),按照Feng等人的描述接种[gydF4y2Ba29.gydF4y2Ba].在120hPI,48hPi,72hPi和120hpi的24hpi,48hpi,72hpi和远端未诱导组织的病理组织的果实苞片组织用于转录组和蛋白质组分析。gydF4y2Ba
生活方式过渡gydF4y2Bac、gydF4y2Ba在葡萄糖溶液中培养并用光学显微镜观察(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba)或扫描电子显微镜(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba和gydF4y2BadgydF4y2Ba,萌发的分生孢子形成黑色附着体,附着于寄主细胞表面(24 hpi)。gydF4y2BabgydF4y2Ba和gydF4y2BaegydF4y2Ba,真菌增殖,附着菌形成球茎状初生生物营养菌丝(48 hpi)。gydF4y2BacgydF4y2Ba和gydF4y2BafgydF4y2Ba,则形成细丝状次级菌丝,与坏死转变有关(72 hpi)。gydF4y2BaggydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba生命周期的gydF4y2Bac、gydF4y2Ba在感染的完整叶子中(gydF4y2BaggydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba)和石蜡部分用苯胺蓝(gydF4y2BajgydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba),分别为24、48和72 hpi。有限公司,分生孢子;美联社,附着胞;gt,萌发管;ph值、主菌丝;pp、渗透挂钩;sh,次生菌丝。棒:50 μm (gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba),10μm(gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba), 100 μm (gydF4y2BaggydF4y2Ba- - - - - -gydF4y2BalgydF4y2Ba)gydF4y2Ba
F26和F423响应的比较分析gydF4y2Bac、gydF4y2Ba在转录组水平gydF4y2Ba
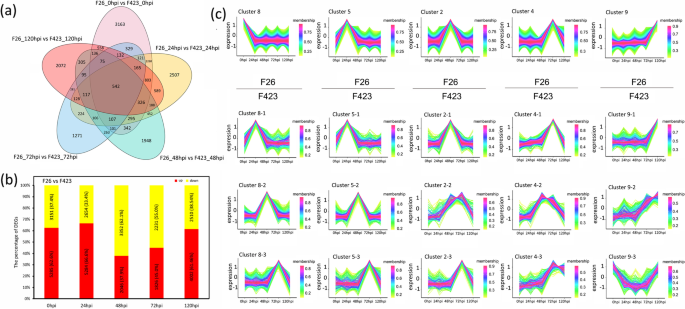
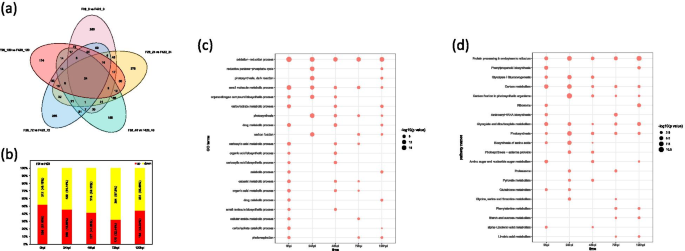
比较F26和F423的响应gydF4y2Bac、gydF4y2Ba,使用RNA-SEQ数据在不同阶段进行F26对F423的比较分析。在映射核桃的清洁读数后(表SgydF4y2Ba1gydF4y2Ba在F26和F423的5个不同阶段中,我们发现了21,798个差异表达基因(DEGs)。在5个比较中,0 hpi的DEGs数量分别为8436(5285上调),24 hpi的DEGs数量为7938(5284上调),48 hpi的DEGs数量为5398(2046上调),72 hpi的DEGs数量为4057(1826上调),120 hpi的DEGs数量为6512(4002上调)。在5个不同阶段共获得542个DEGs(图)。gydF4y2Ba2gydF4y2Baa, b). F26相对于F423在感染早期(0 hpi和24 hpi)的DEGs和上调的DEGs数量大于感染后期(48 hpi, 72 hpi和120 hpi)。随后,我们进行了聚类分析,以确定时间序列DEGs在F26和423中的表达趋势。聚类分析显示,聚类由10个聚类组成(图S)gydF4y2Ba1gydF4y2Ba),其中第8组(0 hpi)、第5组(24 hpi)、第2组(48 hpi)、第4组(72 hpi)和第9组(120 hpi)在图上的F26中具有分期特异性。gydF4y2Ba2gydF4y2Bac.据此,我们在图的下半部分F423中分析了这些基因在F26中分期特异的表达模式。gydF4y2Ba2gydF4y2BaC(图。gydF4y2Ba2gydF4y2Bac).聚类8在0 hpi处包含2528个DEGs,其中大部分在F423中表现出延迟表达(24 hpi,聚类8 - 1;48 hpi,簇8-2;72 hpi,集群8-3)。同样,F26中第5簇(24 hpi)和第2簇(48 hpi)的部分基因在F423 (48 hpi, 5 - 2;72 hpi,聚类5-3;72 hpi,簇2-3)(图2)gydF4y2Ba2gydF4y2BaC)。许多潜在的R基因的表达模式与上述结果一致。例如,G型凝集素S-受体样丝氨酸/苏氨酸 - 蛋白激酶CES101(gydF4y2BaLOM109000970gydF4y2Ba)在F26中在0 hpi高表达,而在F423中在48 hpi和72 hpi高表达(表SgydF4y2Ba2gydF4y2Ba).这些结果表明,抗性果实可能表现出较早的转录反应gydF4y2Bac、gydF4y2Ba感染比易感水果。gydF4y2Ba
GO和KEGG分析DEGSgydF4y2Ba
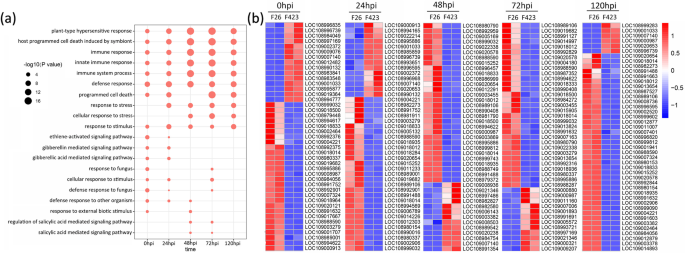
了解核桃抵抗力的DEGS功能gydF4y2Bac、gydF4y2Ba,我们在F26和F423的每个时间点对DEGs中的氧化石墨烯项进行了功能富集分析。结果显示,F26与F423在感染不同阶段的DEGs在许多生物学过程、细胞成分和分子功能方面都富集(图S)gydF4y2Ba2gydF4y2Ba).我们在富集的每个时间点过滤了前20个GO术语(表SgydF4y2Ba3.gydF4y2Ba).数字gydF4y2Ba3.gydF4y2Ba描绘了显着富集的术语(gydF4y2BaPgydF4y2Ba-adj≤0.05)至少在五个时间点中的两个。“植物型超敏反应”、“共生体诱导的宿主程序性细胞死亡”、“免疫反应”、“先天免疫反应”、“免疫系统过程”、“防御反应和对刺激的反应”等多个与植物免疫相关的术语在这5个时期内富集(图1)。gydF4y2Ba3.gydF4y2Baa).与免疫应答相关的抗病性蛋白At4g27190-like (LOC108988590)和推测的抗病性RPP13-like蛋白2 (LOC109018014)在F26中的表达在5个时期上调(图1)。gydF4y2Ba3.gydF4y2Bab)。“乙烯激活的信号通路”,“Gibberellin介导的信号传导途径”和“甘油酸介导的信号通路”在早期时间点更明显(图。gydF4y2Ba3.gydF4y2Ba一种)。gydF4y2BaEDR1.gydF4y2Ba(gydF4y2BaLOM109003279.gydF4y2Ba)gydF4y2Ba,ERF113.gydF4y2Ba(gydF4y2BaLOC108989001gydF4y2Ba)gydF4y2Ba,abi4.gydF4y2Ba(gydF4y2BaLOC108991752gydF4y2Ba)gydF4y2Ba,gydF4y2Ba和gydF4y2BaESR2.gydF4y2Ba(gydF4y2BaLOC108992901gydF4y2Ba)与这些途径相关的,在F26中在0 HPI和24hPI下呈现上调表达(图。gydF4y2Ba3.gydF4y2Bab)。然而,“水杨酸介导的信号传导途径”和“水杨酸介导的信号通路”的调节富集为48hPI和72hPi(图。gydF4y2Ba3.gydF4y2Baa,b)。gydF4y2Ba
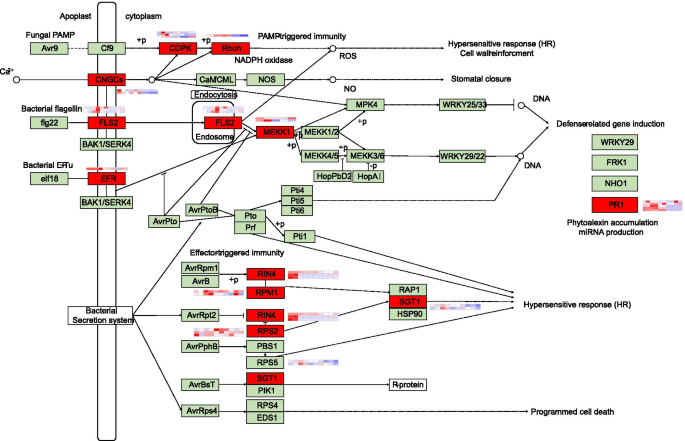
研究宿主代谢途径的改变gydF4y2Bac、gydF4y2Ba进展,我们进行了KEGG浓缩分析。我们发现许多与“苯丙烷生物合成”,“Cutin Suberine和Wax生物合成”相关的次数,“葡萄糖素生物合成”和“脂肪酸伸长率”至少在三个时间点富集(图SgydF4y2Ba3.gydF4y2Ba).鉴于在五个时间点富集所涉及“植物 - 病原体相互作用”的基因,进行了对植物 - 病原体相互作用途径的靶向分析。在F26与F423的比较中,与PAMP触发的免疫有关的次数(例如,gydF4y2BaCDPKgydF4y2Ba,gydF4y2BaFLS2.gydF4y2Ba,gydF4y2BaEFR,PR1gydF4y2Ba)在0 hpi和24 hpi时表达上调。与效应器触发免疫相关的deg(例如,gydF4y2Barin4.gydF4y2Ba,gydF4y2BaPBS1gydF4y2Ba,gydF4y2BaRPS2,RPM1,SGT1gydF4y2Ba)也发现在F26的早期时间点上升(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
与WGCNA进行相关网络分析gydF4y2Ba
获得与核桃果实抗性相关的轮毂基因gydF4y2Bac、gydF4y2Ba,使用DEG构造加权相关网络。在本研究中,我们确定了27个不同的模块,如图27所示。gydF4y2Ba5gydF4y2Baa,其中主要的树分支定义了模块(在图中用不同的颜色标记。gydF4y2Ba5gydF4y2Bab)。分析模块与核桃果实苞片的电阻性状的关系,并显着相关的模块(|gydF4y2BargydF4y2Ba|≥0.9)在'Darkturquoise'(gydF4y2BargydF4y2Ba = 0.97,pgydF4y2Ba = 3e − 12) and ‘lightsteelblue1’ (rgydF4y2Ba = 0.90,pgydF4y2Ba = 7e − 08) modules (Fig.5gydF4y2BaC)。为了进一步了解阻力响应的机制,分析了两种模块中的富核术语和unigenes的Kegg术语。In addition to the terms related to biological metabolism, the unigenes in the ‘darkturquoise’ module were mainly enriched in response to starvation (GO:0,009,267), response to nutrient levels (GO:0,031,669), and response to extracellular stimulus (GO:0,009,991) (Figure S7gydF4y2Ba一个),和the highly enriched terms of the ‘lightsteelblue1’ module were associated with induced systemic resistance (GO:0,009,864), jasmonic acid-mediated signaling pathway (GO:0,009,867), immune effector process (GO:0,002,252), and activation of innate immune response (GO:0,002,218) (Figures S4gydF4y2Ba和sgydF4y2Ba5gydF4y2Ba).“黑暗鲁西迪斯”和“LightSteelBlue1”模块的KEGG分析中最重要的条目分别是植物激素信号转导(KO04075)和淀粉和蔗糖代谢(KO00500)(图SgydF4y2Ba6gydF4y2Ba和sgydF4y2Ba7gydF4y2Ba).gydF4y2Ba
还进行WGCNA以构建转录表达基因网络,其中每个节点代表响应基因,基因之间的连接线代表共表达相关性。在网络中显示最大连接的集线器基因对于调节整个网络很重要。在“Darkturquoise”和“LightSteelBlue1”模块中,根据其体重值和模块中的连接确定九个轮毂基因,包括水上蛋白样(gydF4y2BaLOC108987002gydF4y2Ba)、snf1相关蛋白激酶催化亚基α kin10样(gydF4y2BaLOM109006307.gydF4y2Ba)、着丝粒蛋白Nuf2 (gydF4y2BaLOM109007030.gydF4y2Ba),硼转运蛋白1状(gydF4y2BaLOM109004147.gydF4y2Ba),转录抑制剂MyB6样(gydF4y2BaLOM109006329.gydF4y2Ba),增加DNA甲基化1(gydF4y2BaLOM109012343gydF4y2Ba)、激肽样蛋白KIN-4C (gydF4y2BaLOM109013712.gydF4y2Ba),eNOCYST复合组分EXO84B样(gydF4y2BaLOM109003106.gydF4y2Ba)和TMV抗性蛋白N样(gydF4y2BaLOC108996501gydF4y2Ba) (图。gydF4y2Ba5gydF4y2Bad). snf1相关蛋白激酶催化亚基α kin10样和TMV抗性蛋白n样是潜在的gydF4y2BaRgydF4y2Ba基因在核桃。网络中突出显示的基因详情见表SgydF4y2Ba4gydF4y2Ba.gydF4y2Ba
所选基因的定量实时(QRT)-PCR分析gydF4y2Ba
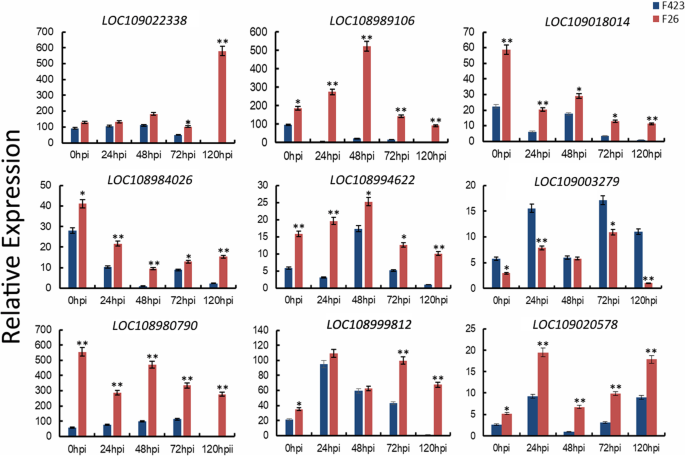
为了验证通过RNA-SEQ获得的F26和F423之间的表达分布,我们随机选择了9个基因进行QRT-PCR分析。将18S rRNA基因用作管家基因,通过与18S rRNA的组成型度进行比较,归一化九种基因的转录度丰度(图。gydF4y2Ba6gydF4y2Ba).用于qRT-PCR分析的基因特异性引物列表见表SgydF4y2Ba5gydF4y2Ba.所有检测的基因在RNA-seq数据中表现出相似的表达特征(表SgydF4y2Ba6gydF4y2Ba).gydF4y2Ba
蛋白质组分析及劣化功能性富集分析gydF4y2Ba
无标记定量分析总共产生10,623,699个光谱,其中1,109,228种匹配的已知肽。其中,鉴定了15,260个独特的肽,探索了5159个蛋白质(表SgydF4y2Ba7gydF4y2Ba).在F26与F423的比较中,0 hpi处共648个DEPs(336个蛋白上调,312个蛋白下调),24 hpi处共798个DEPs(366个蛋白上调,432个蛋白下调),48 hpi处共545个DEPs(227个蛋白上调,318个蛋白下调)。在72 hpi检测到524个DEPs(170个蛋白表达上调,354个蛋白表达下调),在120 hpi检测到415个DEPs(184个蛋白表达上调,231个蛋白表达下调)。gydF4y2Ba7gydF4y2Baa, b).在0 hpi和24 hpi时,F26相对于F423的DEPs数量大于晚期(48 hpi、72 hpi和120 hpi),这与DEGs数量的变化趋势一致。gydF4y2Ba
使用GO分类和KEGG通路注释显示功能注释DEPs的变化。与deg的功能富集分析方法相似,我们在每个dep富集的时间点过滤前20个氧化石墨烯项(表SgydF4y2Ba8gydF4y2Ba).图2中的GO条款。gydF4y2Ba7gydF4y2BaC显著富集(gydF4y2BaPgydF4y2Ba-adj≤0.05)至少在五个时间点中的两个。在五种感染期间,DEP参与氧化还原过程(GO:0.055,114)和小分子代谢过程(GO:0.044,281)。此外,许多DEP参与光合作用(GO:0,015,979),碳水化合物代谢过程(GO:0,005,975)和羧酸代谢过程(GO:0.019,752)。数字gydF4y2Ba7gydF4y2BaD显示了不同点的DEPS的KEGG途径浓缩分析(gydF4y2BaPgydF4y2Ba< 0.05)(表SgydF4y2Ba9gydF4y2Ba).在所有对照组中,最普遍富集的KEGG通路包括内质网蛋白加工(ko04141)、碳代谢(ko01200)、乙氧基酸和二羧酸盐代谢(ko00630)和光合作用(ko00195),与富集的GO项相似。F26与F423_0hpi相比,碳代谢途径最为丰富;F26与F423_24hpi相比,光合生物固碳途径最为丰富;F26与F423_48hpi、72hpi和120hpi相比,内质网蛋白加工途径最为丰富。这些结果表明,植物的光合作用和碳代谢等次生代谢途径可能与核桃对炭疽病的抗性有关。gydF4y2Ba
转录组数据与蛋白质组数据之间的相关分析gydF4y2Ba
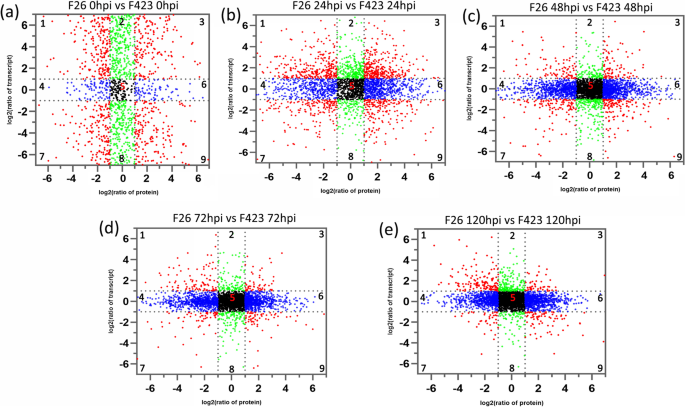
随着蛋白质组数据从用于产生转录组数据的相同的核桃果实样品获得,我们进行了转录om和蛋白质组的相关分析。使用LOM2转化比的散点图分析来显示相应MRNA的分布:蛋白质比率。在蛋白质组和转录组中检测到的基因根据其表达模式分成九个模块,建立九象限图(图。gydF4y2Ba8gydF4y2Ba).在蛋白质组和转录组中检测到3644,3031,3028,3034和3376个基因,在0hpi,24hpi,48 hpi,72hpi和120hpi中,在f26与f423中。象限1、2和4表明蛋白质丰度低于RNA丰度。在象限3和7中,rna与相关蛋白质相对应。象限5显示蛋白和rna普遍表达,无差异。象限6、8和9表明蛋白质丰度高于RNA丰度。其mRNA和相应蛋白质表现出一致表达的基因数为953(26.15%),511(16.85%),207(6.83%),121(3.99%)和92(2.73%)在五个时间点(表S.gydF4y2Ba10.gydF4y2Ba).在感染早期,mRNA与相应蛋白的差异表达一致性较高。这些结果表明,在感染的早期阶段,基因在转录后或翻译水平上的调控较少。但在后期,许多基因在转录后或翻译水平受到调控,如miRNA和lncrna介导的蛋白降解。gydF4y2Ba
根据蛋白质种类(x轴)和转录本(y轴)的log2比率将基因分为9组。象限1、2和4表明蛋白质丰度低于RNA丰度。在象限3和7中,rna与相关蛋白质相对应。象限5显示蛋白和rna普遍表达,无差异。象限6、8和9表明蛋白质丰度高于RNA丰度。mRNA和同源蛋白丰度变化的比较。丰度的相对变化以对数标度表示,来自五个比较组的样本。gydF4y2Ba一个gydF4y2BaF26_0HPI与F423_0HPI比较;gydF4y2BabgydF4y2BaF26_24HPI与F423_24HPI比较;gydF4y2BacgydF4y2BaF26_48HPI与F423_48HPI比较;gydF4y2BadgydF4y2BaF26_72hpi与F423_72hpi比较;gydF4y2BaegydF4y2BaF26_120HPI与F423_120HPI比较gydF4y2Ba
讨论gydF4y2Ba
刺盘孢属gydF4y2Ba物种是真菌病原体,在世界范围内破坏农作物。在这些物种中,已经确定了几种从坏死型到半生物型的生活方式[gydF4y2Ba30.gydF4y2Ba].在番茄中,gydF4y2Bac、gydF4y2Ba用静止阶段突破水果角质层,直到果实成熟信号发出切换到正向脱发[gydF4y2Ba31.gydF4y2Ba].此外,大多数物种以血管营养方式完成致病过程[gydF4y2Ba32.gydF4y2Ba],通常通过黑色化膜渗透宿主组织[gydF4y2Ba33.gydF4y2Ba]进入植物细胞以在切换到病症阶段之前开始缓解阶段[gydF4y2Ba34.gydF4y2Ba].在本研究中,通过扫描电子显微镜,苯胺蓝染色和石蜡截面观察,我们观察到在24 HPI形成渗透PEG,进入细胞内空间以在48 HPI开始生物养学,并最终进入病症阶段在72 hpi形成中学和病重养殖菌丝。所以,gydF4y2Bac、gydF4y2Ba导致核桃水果炭疽病以血管营养方式完成其生活方式过渡,这与先前的研究结果一致[gydF4y2Ba25.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].gydF4y2Ba
这些不同传染性过程的分子机制已经研究了几个gydF4y2Ba刺盘孢属gydF4y2Ba使用转录组和蛋白质组分析的物种。基因组和转录组分析gydF4y2BaC. HIGGINSIANUMgydF4y2Ba感染gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2BaC. Graminicola.gydF4y2Ba在玉米感染研究中发现,致病相关基因以连续波的形式转录,与致病转变相关[gydF4y2Ba27.gydF4y2Ba].在感染期间鉴定大量次级代谢物和膜转运蛋白gydF4y2BaC. Falcatum.gydF4y2Ba利用RNA-seq技术研究甘蔗[gydF4y2Ba35.gydF4y2Ba].共鉴定出304个蛋白gydF4y2BaC. LupinigydF4y2Ba在与质谱法与白羽羽的相互作用期间[gydF4y2Ba30.gydF4y2Ba].在本研究中,基于生活方式的转变gydF4y2Bac、gydF4y2Ba,在0hPI,24hpi,48hpi和72hpi的0 hpi,病理组织的核桃果实苞片组织在120hpi,40hpi的远端未诱导组织中用于转录组和蛋白质组分析。使用RNA-SEQ和无标记定量,在F26对F423中鉴定了总共21,798次和1929年的DEP。同时,转录组和蛋白质组的相关分析表明,后期基因和蛋白质表达之间的相关性非常弱。类似于多个其他研究[gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba,结果表明并非所有的mRNA: protein ratio都反映了相应的转录和蛋白水平的变化[gydF4y2Ba38.gydF4y2Ba],这是由于可能发生的后术语监管gydF4y2Bac、gydF4y2Ba核桃果苞片的反应。gydF4y2Ba
植物免疫系统由两层植物免疫机制组成:pamp触发免疫(PTI)和ETI。PTI是由等离子体成员锚定模式识别受体(PRRs)激活的一种基本防御反应,已在植物中得到广泛研究[gydF4y2Ba3.gydF4y2Ba].PRR FLS2可以与Bak1形成异二聚体络合物,以在结合22-氨基酸表位(FLG22)在细菌鞭毛中保守时激活免疫信号,[gydF4y2Ba39.gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].另一种PRR EFR可以识别细菌中PAMP EF-Tu的保守18-aa表位(elf18),从而触发十字花科免疫[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].在转基因小麦,水稻,烟草和番茄中引入EFR经常赋予细菌抗性[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].在这项研究中,gydF4y2BaFLS2.gydF4y2Ba和gydF4y2BaEFR声码器作为gydF4y2Ba在F26与F423比较中,F26在0 hpi和24 hpi水平上调了与PTI相关的基因,多个PRR途径同时被激活,这可能会增加整个植物对病原体感染的防御的稳稳性[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba].此外,早期F26对F423的次数和DEP的数量大于晚期的阶段。另外,与F26相比,F423中的许多基因显示出延迟表达模式。例如,潜在的抵抗基因(gydF4y2BaRgydF4y2Ba基因编码核桃G型凝集素S-受体样丝氨酸/苏氨酸 - 蛋白激酶CES101(gydF4y2BaLOM109000970gydF4y2Ba)在F26中高表达于0 hpi,而在F423中表达于48 hpi和72 hpi。这些发现表明F26可能表现出更早和更广泛的反应gydF4y2Bac、gydF4y2BaF423。gydF4y2Ba
病原体可以抑制宿主蛋白质抑制宿主PTI,这反过来会引出ETI [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].Eti由细胞内免疫受体激活,其中大部分是核苷酸结合的富含少氨酸的重复蛋白(NLRS)编码gydF4y2BaR基因gydF4y2Ba[gydF4y2Ba44.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba].许多gydF4y2BaR基因gydF4y2Ba和它们在病原体中的相应Avr效应已被鉴定。rpm1相互作用蛋白4 (gydF4y2Barin4.gydF4y2Ba)作为R蛋白质NLRRPM1的防护装置gydF4y2Ba拟南芥gydF4y2Ba和相互作用gydF4y2Ba假单胞菌含油gydF4y2Ba效果AVRRPM1和AVRB [gydF4y2Ba46.gydF4y2Ba].类似地,大豆GmRIN4b识别gydF4y2Ba假单胞菌含油gydF4y2Ba效应器AVRB作为大豆RPG1-B的瓜盖[gydF4y2Ba47.gydF4y2Ba].RRS1 / RPS4gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2BaRGA4 / RGA5gydF4y2Ba在水稻中,符合综合诱饵模型的NLR对得到了充分研究[gydF4y2Ba48.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba].在我们的研究中,gydF4y2Barin4 / rpm1.gydF4y2BaF26在早期富集(0 hpi和24 hpi)。的表达水平gydF4y2BaRPS2.gydF4y2Ba在48和72 hpi时,F26高于F423。然而,随着更多gydF4y2BaR-基因gydF4y2Ba克隆编码排毒酶和WAK,它变得显而易见,它们通过一系列不同的机制赋予阻力[gydF4y2Ba45.gydF4y2Ba].通过WGCNA分析检测到9个与抗病相关的中枢基因,其中snf1相关蛋白激酶催化亚基α KIN10-like (gydF4y2BaLOM109006307.gydF4y2Ba)和TMV抗性蛋白n样(gydF4y2BaLOC108996501gydF4y2Ba)是潜力的gydF4y2BaRgydF4y2Ba基因在核桃。Kin10(SNRK1.1和SNRK1α1)编码SNF1相关激酶1(SNRK1)的激酶α-亚基,其可以磷酸化关键代谢酶,以立即影响其活动[gydF4y2Ba45.gydF4y2Ba].烟草的n基因(gydF4y2Ba烟草gydF4y2Ba)是典型的gydF4y2BaR基因gydF4y2Ba从烟草叶片病毒(TMV)感染的定位和过敏坏死反应的诱导[gydF4y2Ba50.gydF4y2Ba].此外,三个枢纽潜力gydF4y2BaRgydF4y2Bag型凝集素s受体样丝氨酸/苏氨酸蛋白激酶LECRK1gydF4y2BaLOC108979712gydF4y2Ba;可能是无活泼的富含亮氨酸的重复受体样蛋白激酶AT2G25790,gydF4y2BaLOM109009481.gydF4y2Ba;和TMV抗性蛋白n样,gydF4y2BaLOC108988638gydF4y2Ba)在Feng等人的研究中获得。[gydF4y2Ba29.gydF4y2Ba]也存在于本研究的WGCNA模块中。因此,这些潜能的作用gydF4y2BaR基因gydF4y2Ba核桃对炭疽病的抗性值得进一步研究。gydF4y2Ba
ETI不作为对坏死性策略的策略,因为它在早期阶段的生物术和血管术中只会有效[gydF4y2Ba50.gydF4y2Ba].初始感染后,可以激活SAR,这保护植物中的远处部分[gydF4y2Ba50.gydF4y2Ba].SA已经建立为主要激素,触发对具有生物养化生活方式的病原体的反应。通常,SA的调解由其他激素进行微调,例如乙烯(Et)和赤霉素(气体)[gydF4y2Ba51.gydF4y2Ba].ET是一种涉及植物免疫的烃类气体。的gydF4y2Ba假单胞菌gydF4y2Ba番茄中的Avrpto和Avrptob Trigger ET生产,这可能间接地通过AVRPTOB的SA信号的下调来间接地工作[gydF4y2Ba52.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba].作为靶向GA信号传导与更重要的防御途径相互作用的病原体,避免生物营养病原体的SA反应增加gydF4y2BaDella.gydF4y2Ba突变体[gydF4y2Ba54.gydF4y2Ba].在本研究中,“乙烯激活信号通路”、“赤霉素介导信号通路”和“赤霉素介导信号通路”相关的DEGs在0 hpi和24 hpi条件下富集。gydF4y2BaEDR1.gydF4y2Ba(LOM109003279)gydF4y2Ba,ERF113.gydF4y2Ba(LOC108989001)gydF4y2Ba,abi4.gydF4y2Ba(LOM108991752)gydF4y2Ba,gydF4y2Ba和gydF4y2BaESR2.gydF4y2Ba(LOM108992901)与这些途径相关,呈现F26中的上调表达。此外,“水杨酸介导的信号传导途径”和“水杨酸介导的信号通路”的调节富集为48HPI和72 HPI。这些结果表明ET和气体参与核桃在早期核桃至炭疽病的抗性,并且SA介导的SAR可能在48 HPI和72 HPI中形成。此外,据报道,光合作用和二次代谢途径保护植物免受生物和非生物应激的影响[gydF4y2Ba55.gydF4y2Ba,gydF4y2Ba56.gydF4y2Ba].对F26和F423的DEPs进行GO和KEGG分析,发现F26和F423的碳代谢和光合作用相关途径在不同时期受到高度诱导。这些结果表明,光合作用相关基因可能在核桃抗病性中起重要作用gydF4y2Bac、gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
本研究采用比较转录组和蛋白质组分析的方法,研究核桃抗病性的机制gydF4y2Bac、gydF4y2Ba在F26和F423之间。我们表明生活方式过渡gydF4y2Bac、gydF4y2Ba在感染的核桃水果中,在不同阶段的F26对F423中检测到大量的果实和DEP。F26与F423在转录组水平上的比较分析表明,F26可以显示出较早和更广泛的反应gydF4y2Bac、gydF4y2BaF423。其中2个模块和9个中枢基因与抗性显著相关gydF4y2Bac、gydF4y2Ba通过WGCNA鉴定。同时,许多可与免疫应答,植物激素信号转导和次生代谢物相关的次数主要有关,并且DEPS参与碳代谢和光合作用。虽然需要许多额外的研究来阐明其功能,但我们的目前的结果改善了我们对核桃抵抗力监管网络的分子机制的理解gydF4y2Bac .、gydF4y2Ba鉴定了许多可用于核桃抗病育种的候选基因和蛋白质。gydF4y2Ba
方法gydF4y2Ba
植物材料及品系gydF4y2Ba
以B26无性系(即F26)和4-23无性系(即F423)的果实为实验材料。核桃苗木B26的接穗由山东省文商县白石镇东六岗村核桃农民专业合作社提供(35°46′56.2″N, 116°40′30.8″E)。4-23核桃树是我们2002年进行的核桃品种‘远林’(炭疽病易感)和‘青林’(炭疽病抗性)种内杂交的F1代后代。2009年5月下旬,在山东农业大学林业实验站(36°10′19.2″N, 117°09′1.3″E)核桃苗木砧木上进行了植芽保存。根据我们对炭疽病抗性的评价结果,如前所述[gydF4y2Ba24.gydF4y2Ba], 2015-2017年,我们发现B26无性系对果苞片炭疽病高度抗性,4-23无性系对果苞片炭疽病高度敏感。的菌株m9gydF4y2Bac、gydF4y2Ba(GenBank ID:GU597322)用于接种。gydF4y2Ba
核桃接种gydF4y2Ba
的gydF4y2Bac、gydF4y2Ba菌株在马铃薯葡萄糖琼脂(PDA,马铃薯200g·L)上培养gydF4y2Ba−1gydF4y2Ba,葡萄糖20 g·LgydF4y2Ba−1gydF4y2Ba,agar 17 g·lgydF4y2Ba−1gydF4y2Ba)培养液5 d后产生孢子。用含0.05% (v/v) Tween 80的无菌蒸馏水冲洗菌落,通过过滤器(孔隙度40 ~ 100 μm),用血细胞计数仪定量,用无菌蒸馏水稀释至106个孢子·mL,制备分生孢子悬浮液gydF4y2Ba−1gydF4y2Ba(Tween 80的最终浓度为0.001%)。如Li等人所述,对离体核桃果实进行了Punch接种[gydF4y2Ba57.gydF4y2Ba].gydF4y2Ba
核桃组织的解剖变化gydF4y2Bac、gydF4y2Ba感染gydF4y2Ba
观察萌发过程gydF4y2Bac、gydF4y2Ba孢子gydF4y2Ba
在光学显微镜的10×视场下,用1%葡聚糖水溶液(pH = 6.8)稀释备用孢子悬浮液,然后将其放置在凹形玻璃载玻片上并在HSX-150温度下培养湿度培养箱(温度28°C,湿度95%)。观察悬浮液并用每6小时用Eclipse 90i光学显微镜(尼康,日本)拍摄。gydF4y2Ba
观察苯胺蓝染色gydF4y2Ba
接种核桃组织先脱色(0.15%三氯乙酸(w·V .))gydF4y2Ba−1gydF4y2Ba)溶于3:l (V·VgydF4y2Ba−1gydF4y2Ba)乙醇和氯仿的混合溶液14小时,然后用苯胺蓝染色2小时。核桃组织感染gydF4y2Bac、gydF4y2Ba每6小时使用Eclipse 90i光学显微镜观察并拍摄分类。gydF4y2Ba
石蜡切片观察gydF4y2Ba
用FAA固定剂(10mL福尔马林,3mL乙酸,87mL 50%乙醇)固定感染的样品8-24小时,用梯度乙醇脱水,用二甲苯透明,然后嵌入蜡中。我们使用自动旋转式切片机(Leica RM2255,Germany)切片,脱蛋白,并清除二甲苯的部分,将它们的乙醇梯度再水化,然后用苯胺藏红花染色它们。最后,将部分密封并干燥。使用Eclipse 90i光学显微镜观察并拍摄链烷烃部分。gydF4y2Ba
扫描电子显微镜观察gydF4y2Ba
用4%戊二醛和十六颗氧化锇进行双固定的侵染样品过夜,然后用0.01mol·L洗涤gydF4y2Ba−1gydF4y2BapH6.8 PBS(磷酸盐缓冲盐水)6 - 8次。洗涤后,通过梯度乙醇脱水,将样品脱水,在100%丙酮中脱水两次,然后用异戊酯替换两次。使用K850 CO干燥样品后gydF4y2Ba2gydF4y2Ba临界点烘干机(EMITECH,英国)在室温下,它被胶合和涂层。使用JSM-6610LV扫描电子显微镜(日本JEOL)在15 kV下进行观察和摄影。gydF4y2Ba
核桃组织样品gydF4y2Ba
感染过程的解剖学观察表明,完成的生活方式过渡gydF4y2Bac、gydF4y2Ba在0,24,48和72 HPI。因此,收集在0,24,48和72hPI的接种位点和120hPI的远端未诱导组织以进行转录组和蛋白质组分析。收集样品,立即冷冻在液氮中,然后在-80℃下储存直至分析。在每个感染时间收集三种生物复制。gydF4y2Ba
RNA提取,图书馆建设和RNA-SEQgydF4y2Ba
根据制造商的协议,使用Thermo Genejet植物RNA净化迷你试剂盒(Thermo Fisher Scientific Inc,USA)用DNase治疗提取总RNA。使用Nanodrop 2000(Thermo Fisher Scientific Inc,USA)和Qubit 2.0 RNA宽范围测定(Invitrogen,USA)检查总RNA的完整性和质量。使用Agilent生物分析仪RNA纳米芯片生物分析仪(Agilent Technologies)检查RNA的质量,以获得RNA完整性数(rin)超过7.在聚(a)选择和rRNA耗尽后,使用碎片缓冲液纯化mRNA并碎片(Thermo Fisher Scientific Inc,USA)。使用随机六聚体引物进行RNA片段接受逆转录。然后用DNA聚合酶I,DNTP和RNase H合成第二链cDNA合成。在末端修复后,用Qiaquick PCR提取试剂盒纯化产物并扩增以产生最终cDNA文库。.使用Qubit 2.0 DNA宽范围测定(Invitrogen,USA)定量合成的cDNA。在Illumina Hiseq 4000平台(USLumina,USA)上测序测试样品的RNA文库,以产生2×150bp成对结束读数。gydF4y2Ba
对决基因组和转录组件gydF4y2Ba
使用FASTQC(版本0.1)以FASTQ格式评估序列的质量(gydF4y2Bawww.bioinformatics.bbsrc.ac.uk/projects/fastqc.gydF4y2Ba)。使用Trimmomatic从序列中修剪适配器和低质量的碱基。使用phred质量的Reads (Q > 30)进行进一步的比对和组装。过滤后的干净读取与NCBI对齐gydF4y2Bajuglans regia.gydF4y2Ba基因组序列(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/genome/?TERM=JUGLANS%20REGIA.gydF4y2Ba)使用Hisat(v 2.0.5)。使用Stringtie(V 1.3.1)组装每个样品的对齐读入转录物。stringtie汇编结果由stringtie-merge组合,使用stringtie自己的脚本prepde.py计算基因表达式。gydF4y2Ba
蛋白质提取与消化gydF4y2Ba
用不同侵染阶段的核桃果苞片提取蛋白质,采用冷丙酮提取,如前所述。样本在液态氮,然后磨成粉末溶解在10毫升的裂解缓冲(7 M尿素,2 M硫脲,0.1% (w / v)皮套裤,30毫米三,2%的蛋白酶抑制剂,pH值8.0),其次是在冰上孵化15分钟和离心14000 rpm 30分钟在4°C。然后将上清转移到新管中备用。根据制造商的协议,使用Bradford Regent Kit (Sigma, Poole, Dorset, UK)测量蛋白质浓度。gydF4y2Ba
将所得蛋白质在37℃下用5mM二硫代噻唑酯,在室温下用15mM碘乙酰胺烷基化1小时,用胰蛋白酶(猪测序级修饰的胰蛋白酶; Promega)用胰蛋白酶(Promega)涂抹(W/ w)胰蛋白酶:蛋白质比并在37℃下孵育过夜。将来自消化的肽在真空中干燥。gydF4y2Ba
液相色谱串联质谱(LC-MS / MS)分析gydF4y2Ba
通过纳米电喷雾离子在线耦合在线,对Utra-NaNoflow高性能液相色谱(HPLC)系统(HPLC)系统(Easy-NLC™1000,Thermo Fisher Scientific,CA,USA)进行了无标记的LC-MS / MS分析源于纳米HPLC Q辐射系统(Thermo Fisher Scientific,Sunnyvale,CA,USA)。用0.1%甲酸水溶液(FA)稀释胰蛋白酶摘要(2μg/μl),在陷阱柱上加载5μl,适应百分点100μl(100μm×2cm;c18,5μm,100埃)和然后在350nl / min的温度科学易喷雾柱(75μm×15cm,c18,3μm,100)上洗脱。两个柱用木星PROTEO树脂(现象,托兰斯,CA,USA)包装。在梯度之后洗脱肽:0-5分钟(4%缓冲液B),5-40分钟(15%-25%缓冲液B),40-65分钟(25%-35%缓冲液B),65-70分钟(35%-95%缓冲液B),70-82分钟(95%缓冲液B),82-85分钟(95%-4%缓冲液B),85-90分钟(4%缓冲液B)[缓冲液B(100%乙腈,0.1%甲酸),缓冲液A(0.1%甲酸)]。Xcalibur检索质谱(Views 2.2,Thermo Fisher Scientific,Bremen,Germany)。质谱仪以单位分辨率以正离子模式操作。在技术复制中以三份分析每个级分。 The mass spectrometer was operated under full scan mode, the scan range was 350 – 1800 m/z, the spray voltage was 2.0 kv, the capillary temperature was 250 °C, and the injection time was set 60 ms. The top-ten most intense ions were selected for collision induced dissociation (CID) using a normalized collision energy of 30%. Data were collected over a broad mass to charge (m / z.gydF4y2Ba)前驱离子选择扫描范围为350-1800 mgydF4y2Ba/ Z.gydF4y2Ba设有3米的隔离窗gydF4y2Ba/ Z.gydF4y2Ba.采用动态排除的方法,减少已选择的CID多肽的重复选择,重复次数为1,重复时间为30 s,排除名单大小为500,排除时间为90 s,有效期s /N阈值为3。gydF4y2Ba
蛋白质鉴定和无标记量化gydF4y2Ba
使用MaxQuant软件(version 1.6.1.0)对原始数据文件进行处理和量化,并针对NCBI进行搜索gydF4y2Bajuglans regia.gydF4y2Ba蛋白质组数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/genome/?TERM=JUGLANS+REGIA.gydF4y2Ba).肽前体质量容差设定为10ppm,MS / MS耐受设定为0.8Da。搜索标准包括半胱氨酸的氨基甲酰甲基化(+ 57.0214)作为甲硫氨酸的固定改性和氧化(+ 15.9949)。对于使用基于质谱的分析,Perseus软件平台产生高度多变量定量蛋白丰富数据的下游生物学分析(gydF4y2Bahttp://www.perseus-framework.org.gydF4y2Ba)用于数据标准化。分层群集是使用gplots包完成的。简短的时间序列表达矿工(Stem)介绍了短时间序列蛋白表达数据的分析。三种重复中的肽离子丰度用于计算每种蛋白质的表达水平。用胰蛋白肽最丰富的前体的离子峰强度的总和量化蛋白质的丰度水平。蛋白质的计算gydF4y2BaPgydF4y2Ba- 在所有经营中的标准化丰富的总和上进行了值(单向ANOVA)。gydF4y2Ba
分析差异表达模式gydF4y2Ba
用Deseq2(1.22.1)和Ballgown(2.14.0)分析在五个感染阶段的F26和F423之间差异表达的基因和蛋白质。在评估任何差异的重要性后,基因和蛋白质gydF4y2BaPgydF4y2Ba-Value≤0.05和a | log2foldchange |≥1被指定为差异表达基因和蛋白质。gydF4y2Ba
时间课程表达聚类分析gydF4y2Ba
采用TCseq (v1.4.0)分析所有DEGS和DEPs的时间序列表达数据。设置默认参数(k = 15, algo = cmeans),生成15个集群。gydF4y2Ba
加权基因相关网络分析gydF4y2Ba
根据Langfelder和Horvath的方法[gydF4y2Ba58.gydF4y2Ba], WGCNA (v1.63) (gydF4y2Bahttp://lab.genetics.ucla.edu/horvath/CoexpressionNetwork/gydF4y2Ba)用于在0,24,48,72和120 HPI下在核桃果实中构建加权基因/蛋白共表表达网络。首先,将适用于无垢拓扑结构和低平均连接的80%模块的重量(功率)作为软阈值gydF4y2BaβgydF4y2Ba价值。为了生成大量的集群,在消除或合并分支后定义模块。共表达模块动态剪切树参数按Gerttula描述[gydF4y2Ba59.gydF4y2Ba].最小基因数设置为30,分裂敏感性(深度分裂)设置为2,其他设置为软件的默认参数。计算各模块的模块特征基因(Module Eigengenes, ME),并根据ME计算模块相关性,筛选出相关系数大于0.90的模块。计算各模块与不同侵染阶段抗性性状之间的相关性,然后计算模块与基因之间的相关矩阵。根据性状与代谢能的相关关系gydF4y2BaPgydF4y2Ba-value时,挖掘与该特征相关的模块,并挖掘相关系数最高、最小的模块gydF4y2BaPgydF4y2Ba-Value被选为特征最相关的模块。用Cytoscape软件(3.7.1版)产生高度相关模块中的集线器的共表达网络。gydF4y2Ba
功能丰富分析gydF4y2Ba
从转录体测序中获得的所有注释基因被用作GO和KEGG分析的背景基因。Topgo(v 2.26.0)软件用于搜索Go数据库(gydF4y2Bahttp://geneontology.org/gydF4y2Ba)对于分析的基因/蛋白质,并且满足的术语gydF4y2BaPgydF4y2Ba≤0.05为显著富集的氧化石墨烯项。使用KOBAS (v 2.0)软件搜索KEGG数据库(gydF4y2Bahttp://www.genome.jp/kegg/gydF4y2Ba)确定显着富集的Kegg代谢途径(gydF4y2BaPgydF4y2Ba ≤ 0.05). The method of Benjamini–Hochberg was used to correct p-value.
qRT-PCR验证基因表达数据gydF4y2Ba
用于QRT-PCR的底漆采用信标设计器7软件设计,由Sangon Biotech(中国上海;表S合成gydF4y2Ba4gydF4y2Ba).采用TransStart Tip Green qPCR SuperMix (Transgen)和CFX Connect Real-Time System (Bio-Rad)进行qRT-PCR。扩增条件为95°C 3 min, 95°C 10 s和60°C 30 s循环40次。qRT-PCR的样本在三个生物重复中运行。结果用2归一化gydF4y2Ba−ΔΔCtgydF4y2Ba方法(软件IQ5 2.0)报告相对表达式[gydF4y2Ba60.gydF4y2Ba].对于基因表达的标准化,使用18℃的RRNA基因作为内标。gydF4y2Ba
转录组和蛋白质组数据的相关分析gydF4y2Ba
为了了解转录组和蛋白质组数据之间的相关性在感染阶段之间的相关性,根据转录组和蛋白质组之间的相对差异倍数,将默认筛选阈值设定为蛋白质和转录基团的2倍。在Log2转换之后,使用GraphPad Prism 8(V8.3.0.538)绘制七象限的转录物和差异表达蛋白质。gydF4y2Ba
可用性数据和材料gydF4y2Ba
测序原始数据保存在NCBI Sequence Read Archive中,登录号为GSE147083 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse147083.gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 可见:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DEPs:gydF4y2Ba
-
差异表达蛋白质gydF4y2Ba
- PTI:gydF4y2Ba
-
病原体相关分子模式(PAMP)引发免疫gydF4y2Ba
- eti:gydF4y2Ba
-
Effector-triggered免疫力gydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达网络分析gydF4y2Ba
- HPI:gydF4y2Ba
-
小时后接种gydF4y2Ba
- 去:gydF4y2Ba
-
基因本体论gydF4y2Ba
- Kegg:gydF4y2Ba
-
Kyoto基因和基因组的百科全书gydF4y2Ba
- ROS:gydF4y2Ba
-
反应性氧气gydF4y2Ba
- SA:gydF4y2Ba
-
水杨酸gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 人力资源:gydF4y2Ba
-
过敏反应gydF4y2Ba
- 地图:gydF4y2Ba
-
促丝糖型活化蛋白激酶gydF4y2Ba
- 特别行政区:gydF4y2Ba
-
系统获得的阻力gydF4y2Ba
- PRRS:gydF4y2Ba
-
模式识别受体gydF4y2Ba
- pamp:gydF4y2Ba
-
病原体相关的分子模式gydF4y2Ba
- NLRs:gydF4y2Ba
-
核苷酸结合,富含亮氨酸的重复蛋白gydF4y2Ba
- PR:gydF4y2Ba
-
病因相关gydF4y2Ba
- GRNS:gydF4y2Ba
-
基因监管网络gydF4y2Ba
- CDPK:gydF4y2Ba
-
钙依赖蛋白激酶gydF4y2Ba
- 弗尔斯:gydF4y2Ba
-
黄酮醇合成酶gydF4y2Ba
- R-基因:gydF4y2Ba
-
抗性基因gydF4y2Ba
- RIN4:gydF4y2Ba
-
RPM1相互作用蛋白4gydF4y2Ba
- 烟草花叶病毒:gydF4y2Ba
-
烟草花叶病毒gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
邓Y,宁y,杨德,翟k,Z。疾病抗性分子基础对养殖抗性育种策略的育种策略。莫尔植物。2020; 13(10):1402-19。gydF4y2Ba
- 2。gydF4y2Ba
植物是如何获得免疫力的?没有特殊免疫细胞的防御。免疫学报。2012;12(2):89-100。gydF4y2Ba
- 3.gydF4y2Ba
Saijo Y,Loo EP,Yasuda S.模式识别受体和植物微生物相互作用中的信号传导。植物J. 2018; 93:592-613。gydF4y2Ba
- 4.gydF4y2Ba
植物模式识别受体的功能、发现和开发。植物病理学杂志。2017;55(1):257-86。gydF4y2Ba
- 5。gydF4y2Ba
Miya A, Albert P, Shinya T, Desaki Y, Ichimura K, Shirasu K, Narusaka Y, Kawakami N, Kaku H, Shibuya N. CERK1是一种LysM受体激酶,在拟南芥中几丁质诱导子信号通路中是必不可少的。中国科学院院刊2007;104(49):19613-8。gydF4y2Ba
- 6。gydF4y2Ba
Zipfel C,Kunze G,Chinchilla D,AIRD AC,JONES J,Boller T,Felix G.受体EFR的细菌PAMP EF-TU的感知限制了农杆菌介导的转化。细胞。2006; 125(4):749-60。gydF4y2Ba
- 7。gydF4y2Ba
Zipfel C,Robatzek S,Navarro L,Oakeley EJ,Jones J,Felix G,Boller T.通过鞭毛素感知拟南芥的细菌性疾病抗性。自然。2004; 428(6984):764-7。gydF4y2Ba
- 8。gydF4y2Ba
崔华,津田K,派克JE。效应触发免疫:从病原体感知到强大的防御。植物学报。2014;66(1):487。gydF4y2Ba
- 9。gydF4y2Ba
Dodds Pn,Rthjen JP。植物免疫:朝向植物病原体相互作用的综合图。NAT Rev Genet。2010; 11(8):539-48。gydF4y2Ba
- 10.gydF4y2Ba
马菲德,Burdett H,张旭,Manik MK,史勇,陈杰,齐涛,Gilley J, Lai JS, Rank MX。NAD+在动物和植物细胞死亡途径中的裂解活性。科学。2019;365:793-9。gydF4y2Ba
- 11.gydF4y2Ba
王军,胡敏,王军,齐军,韩铮,王刚,齐勇,王宏伟,周建民,柴军。植物NLR免疫抗性体的重组与结构。科学。2019;364:eaav5870。gydF4y2Ba
- 12.gydF4y2Ba
傅志强,董欣。系统获得性抗性:将局部感染转化为全局防御。植物学报。2013;64(1):839-63。gydF4y2Ba
- 13。gydF4y2Ba
张H,傅y,郭H,张l,王c,宋W,yan z,王y,ji w.转录组和基于蛋白质组的网络分析显示了小麦抗性的基因激活模型。int j mol sci。2019; 20(5):1106。gydF4y2Ba
- 14。gydF4y2Ba
Reddy A,Marquez Y,Kalyna M,Barta A.植物中替代拼接景观的复杂性。植物细胞。2013; 25(10):3657-83。gydF4y2Ba
- 15.gydF4y2Ba
Janke C,Bulinski JC。微管细胞骨架的翻译后调节:机制和功能。NAT Rev Mol Cell Biol。2011; 12(12):773-86。gydF4y2Ba
- 16。gydF4y2Ba
Moreno-Risueno MA, Busch W, Benfey PN。组学与网络相结合——使用系统方法推断植物中的调控网络。植物学报。2010;13(2):126-31。gydF4y2Ba
- 17。gydF4y2Ba
张XQ,白升,太阳HB,杨C,CAI。转录组和蛋白质组学分析揭示了Funnelificis Mosseae在大豆根差异表达基因和蛋白质中的作用。J蛋白质组。2020; 19:3631-43。gydF4y2Ba
- 18。gydF4y2Ba
Walley JW,Sartor Rc,Shen Z,Schmitz RJ,Wu KJ,Urich Ma,Nery JR,Smith Lg,Schnable JC,Ecker Jr。OMIC网络在玉米发展地图中的集成。科学。2016; 353(6301):814-8。gydF4y2Ba
- 19。gydF4y2Ba
马丁内斯加西亚PJCM。核桃(Juglans regia)的基因组序列揭示了非结构多酚生物合成的基因编码的多样性。植物j . 2016; 87(5): 507 - 32。gydF4y2Ba
- 20。gydF4y2Ba
史蒂文斯ka,woeste k,chakraborty s,Crexeau Mw,Langley Ch。六种juglans种类中的基因组变异。G3基因基因类型。2018; 8(7):G3-200030。gydF4y2Ba
- 21。gydF4y2Ba
Bernard A,Marrano A,Donkpegan A,Brown PJ,Dirlewanger E.协会和联系映射到波斯核桃(Juglans Regia L.)的酚类特征和横向轴承的解开遗传建筑。BMC基因组学。2020; 21(1):203。gydF4y2Ba
- 22。gydF4y2Ba
Marranob A, Sideli GM, Leslie CA, Cheng H, Neale DB。波斯核桃物候、产量和膜色的遗传控制分析。植物学报。2019;10:1140。gydF4y2Ba
- 23。gydF4y2Ba
Marrano A, Arcía PM, Bianco L, Sideli GM, Neale DB。一种新的核桃基因组工具:高密度Axiom™J. regia 700K SNP基因分型阵列的开发和验证。植物学报2018;17(39):1027-1036。gydF4y2Ba
- 24。gydF4y2Ba
朱y,yin y,杨k,李j,桑Y,长H,舒F.使用特异性长度扩增片段标记的高密度遗传图的构建及核桃炭疽病抗性定量性状轨迹(Juglans RegiaL.)。BMC基因组学。2015; 16:614。gydF4y2Ba
- 25。gydF4y2Ba
Gan P,Ikeda K,Da I,Narusaka M,O'Connell RJ,Takano Y,Kubo Y,Shirasu K.比较基因组和转录组分析揭示了Colletottrichum真菌的血管阶级转变。新植物。2013; 197(4):1236-49。gydF4y2Ba
- 26。gydF4y2Ba
麦克道尔JM。半生物营养真菌病原体生活方式转变的基因组和转录组研究。新植醇。2013;197(4):1032 - 4。gydF4y2Ba
- 27。gydF4y2Ba
奥康奈尔RJTMHS。植物致病性炭疽菌的生活方式转变的基因组和转录组分析。Nat麝猫。2012;44(9):1060 - 5。gydF4y2Ba
- 28。gydF4y2Ba
核桃(Juglans Regia)赋予Colletotrichum卟啉卟啉卟啉卟啉卟啉卟啉卟啉卟啉植物的抗性基因类似物。Euphytica。2014; 197(2):175-90。gydF4y2Ba
- 29.gydF4y2Ba
冯胜,方辉,刘旭,董勇,杨克强。核桃抗炭疽菌长链非编码rna的全基因组鉴定与特性研究BMC基因组学。2021;22(1):15。gydF4y2Ba
- 30.gydF4y2Ba
利用转录组学和蛋白质组学分析方法对羽豆炭疽菌的感染过程进行了分析。微生物。2020;8(10):1621。gydF4y2Ba
- 31.gydF4y2Ba
番茄炭疽菌与番茄果实致病系统的同步转录组分析揭示了新的真菌致病性和番茄果实防御策略。新植醇。2015;205(2):801 - 15所示。gydF4y2Ba
- 32.gydF4y2Ba
Dean R,Kan J,Pretorius Za,Kosack Keh,Pietro Ad,Spanu Pd,Rudd JJ,Dickman M,Kahmann R,Ellis J.分子植物病理学中的前10名真菌病原体。莫尔植物途径。2012; 13(7):414-30。gydF4y2Ba
- 33.gydF4y2Ba
轮齿炭疽菌感染相关形态发生和发病机制的动态。植物病理学杂志。2013;79(4):233-42。gydF4y2Ba
- 34.gydF4y2Ba
陈志强,陈志强,陈志强,等。油橄榄炭疽菌的研究进展。Mycopathologia。2009;168(4):203。gydF4y2Ba
- 35.gydF4y2Ba
关键词:甘蔗,红腐病,转录组学,遗传多样性,遗传多样性糖科技。2017;3:1-12。gydF4y2Ba
- 36。gydF4y2Ba
6 .董涛,徐涛,朱敏。拟南芥耐盐性和耐盐性的转录组和蛋白质组学分析。植物学报。2020;11:572540。gydF4y2Ba
- 37。gydF4y2Ba
张L,Huang X,He C,张Qy,Zou X,Ke D,Gao Q. Collettrichum Fructicola和草莓感染的同时转录综合组分析揭示了新的真菌致病性和叶形防御策略。前植物SCI。2018; 9:434。gydF4y2Ba
- 38。gydF4y2Ba
Saad H,Ranadip P.转录组和蛋白质组学数据的综合分析。Curr基因组学。2013; 14(2):91-110。gydF4y2Ba
- 39。gydF4y2Ba
葡萄鞭毛蛋白受体VvFLS2在植物内生生长促进菌伯克霍氏菌(Burkholderia phytofirmans)和植物致病菌中具有差异识别鞭毛蛋白来源的表位。新植醇。2014;201(4):1371 - 84。gydF4y2Ba
- 40。gydF4y2Ba
高井R, Isogai A,高山S, Che FS。水稻flg22受体OsFLS2介导的鞭毛蛋白感知分析。植物营养与肥料学报。2009;21(12):1635-42。gydF4y2Ba
- 41。gydF4y2Ba
鲍勒·T,他SY。植物先天免疫:植物模式识别受体与微生物病原体效应器之间的军备竞赛。科学。2009;324(5928):742 - 4。gydF4y2Ba
- 42。gydF4y2Ba
植物模式识别受体信号通路的调控。2016;16(9): 537-52。gydF4y2Ba
- 43。gydF4y2Ba
Boller T,Felix G. eLitorors的文艺复兴:通过模式识别受体对微生物相关分子模式和危险信号的感知。Annu Rev植物Biol。2009; 60(1):379。gydF4y2Ba
- 44。gydF4y2Ba
李伟,邓艳,宁勇,何智,王光良。从分子解剖到育种,开发作物广谱抗病能力。acta botanica sinica(云南植物研究),2018;gydF4y2Ba
- 45。gydF4y2Ba
利用复杂性培育抗病作物。中国科学(d辑)2018;19(1):21。gydF4y2Ba
- 46。gydF4y2Ba
Mackey D,III B,WIIG A,Dangl JL。RIN4与拟合蛋白酶III型效应分子相互作用,并且是拟南芥中的RPM1介导的抗性所必需的。细胞。2002; 108(6):743-54。gydF4y2Ba
- 47。gydF4y2Ba
Selote D, Robin GP, Kachroo A. GmRIN4蛋白家族成员在大豆品种特异性抗丁香假单胞菌中发挥非冗余作用。新植醇。2013;197(4):1225 - 35。gydF4y2Ba
- 48。gydF4y2Ba
Baggs E Dagdas G Krasileva KV。NLR多样性、助手和集成域:理解NLR身份。植物学报。2017;38:59-67。gydF4y2Ba
- 49。gydF4y2Ba
Sarris P,Duxbury Z,Huh S,MA Y,Segonzac C,Sklenar J,Sklenar J,Cevik V,Rallapalli G,Saucet S.一种植物免疫受体检测靶标转录因子的病原体效应。细胞。2015; 161(5):1089-100。gydF4y2Ba
- 50.gydF4y2Ba
烟草花叶病毒对自身抗病基因N.表达的调控作用。植物生理学报,2004;135(4):2392-7。gydF4y2Ba
- 51.gydF4y2Ba
BürgerM,楚理J.强调荷尔蒙:植物如何协调免疫力。细胞宿主微生物。2019; 26(2):163-72。gydF4y2Ba
- 52.gydF4y2Ba
Chen H, Chen J, Li M, Chang M, Xu K, Shang Z, Zhao Y, Palmer I, Zhang Y, Mcgill J. A bacterial type III effector targets the master regulator of salicylic acid signaling, NPR1 to subplant immunity.(生物谷biosciences杂志)电子学报2017:S831720477。gydF4y2Ba
- 53.gydF4y2Ba
COHN JR,MARTIN GB。假单胞菌皂苷PV。番茄III型作用AVRPTO和AVRPTOB在番茄中促进乙烯依赖性细胞死亡。工厂J.2010; 44(1):139-54。gydF4y2Ba
- 54.gydF4y2Ba
Navarro L,Bari R,Achard P,LisónP,Nemri A,Harberd NP,Jones J. Dellas通过调节茉莉酸和水杨酸信号的平衡来控制植物免疫反应。Curr Biol。2008; 18(9):650-5。gydF4y2Ba
- 55.gydF4y2Ba
Bernacki MJ, czarnoka W, Witoń D, Rusaczonek A, Szechyńska-Hebda M, Ślesak I, Dąbrowska-Bronk J, Karpiński s。美洲山杨)- sciencedirect。植物生理学杂志。2018;426:91 - 102。gydF4y2Ba
- 56.gydF4y2Ba
陈志强,张晓东,张志强,等。油菜素内酯和油菜素内酯在植物抗环境胁迫中的作用。植物生长规律。2013;32(1):216-32。gydF4y2Ba
- 57.gydF4y2Ba
李伟,朱智,陈敏,尹建平,杨超,冉玲,程明,何敏,王凯,王建军。水稻广谱抗稻瘟病基因的一个自然等位基因。细胞。2017;170(1):114 - 26所示。gydF4y2Ba
- 58.gydF4y2Ba
Langfelder P,Horvath S.WGCNA:用于加权关联网络分析的R包。BMC生物信息学。2008; 9(1):559。gydF4y2Ba
- 59.gydF4y2Ba
杨志刚,李志刚,李志刚,等。杨树向地性的转录和激素调控。植物细胞。2015;27(10):2800 - 13所示。gydF4y2Ba
- 60.gydF4y2Ba
王N,刘W,Yu L,Guo Z,Chen X.热震动因子A8A调节黄酮合成和耐旱性。植物理性。2020; 184:1273-90。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Letpub(gydF4y2Bahttps://www.letpub.com.cn/gydF4y2Ba)编辑本手稿的草稿的英文文本。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金项目(no . 31870667, no . 31470680);山东省良种计划项目(no . 2020LZGC090102);山东省自然科学基金项目(no . ZR2020QC169)。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
K.Q.Y.构思了这个想法并修改了稿件。H.F.和X.L.画画并起草了手稿。Y.D.和s.f.收集实验材料。R.Z.和C.W.帮助绘制数字并起草了手稿。x.m. and J.L. helped in conducting meta-analysis. All authors listed have made direct and substantial efforts for improving the manuscript and approved the final version.
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
作者声明他们没有利益冲突。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1gydF4y2Ba
.F26下的时间课程测序数据分析gydF4y2BaC。gydF4y2Ba、gydF4y2Ba表达的基因。gydF4y2Ba
附加文件2:图S2gydF4y2Ba
.每次感染阶段的F26 VS F423中的DEG的转移条款。(a)F26_0HPI与F423_0HPI比较。(b)F26_24HPI与F423_24HPI比较。(c)F26_48HPI与F423_48HPI比较。(d)F26_72HPI与F423_72HPI比较。(e)F26_120HPI与F423_120HPI比较。gydF4y2Ba
附加文件3:图S3gydF4y2Ba
.每个感染阶段的F26 VS F423中的DEGS的显着性Kegg途径。gydF4y2Ba
附加文件4:图S4gydF4y2Ba
.Darkturquoise模块中的重大转移基因术语。gydF4y2Ba
附加文件5:图S5gydF4y2Ba
.lightsteelblue1模块基因中重要的GO项。gydF4y2Ba
附加文件6:图S6gydF4y2Ba
.Darkturquoise模块中基因的重要性Kegg路径。gydF4y2Ba
附加文件7:图S7gydF4y2Ba
.LightSelBlue1模块中基因的重要Kegg路径。gydF4y2Ba
附加文件8:表S1gydF4y2Ba
.RNA-seq数据的总结。gydF4y2Ba
附加文件9:表S2gydF4y2Ba
.F26下的时间课程测序数据分析gydF4y2BaC。gydF4y2Ba、gydF4y2Ba表达的基因。gydF4y2Ba
附加文件10:表S3gydF4y2Ba
.在每个阶段的F26 VS F423中的DEGS的GO术语列表。gydF4y2Ba
附加文件11:表S4gydF4y2Ba
.黑暗牙齿和LightSteelBlue1模块的轮毂基因。gydF4y2Ba
附加文件12:表S5gydF4y2Ba
.定量实时PCR引物的序列。gydF4y2Ba
附加文件13:表S6gydF4y2Ba
.RNA-SEQ数据中所有基因的表达。gydF4y2Ba
附加文件14:表S7gydF4y2Ba
.蛋白质定量信息。gydF4y2Ba
附加文件15:表S8gydF4y2Ba
.在每个阶段的F26 VS F423中的DEP中的GO术语列表。gydF4y2Ba
附加文件16:表S9gydF4y2Ba
.F26与F423各阶段DEPs的KEGG通路列表。gydF4y2Ba
附加文件17:表S10gydF4y2Ba
.F26和F423各阶段蛋白组和转录组中检测到的基因。gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有用入数据的信用额度。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
方鸿,刘旭东。gydF4y2Baet al。gydF4y2Ba核桃的转录组和蛋白质组分析(gydF4y2Bajuglans regia.gydF4y2BaL.)果实响应感染gydF4y2BaCollettrichum gleooosporioidesgydF4y2Ba.gydF4y2BaBMC植物BIOL.gydF4y2Ba21,gydF4y2Ba249(2021)。https://doi.org/10.1186/s12870-021-03042-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-021-03042-1gydF4y2Ba
关键字gydF4y2Ba
- 胡桃木gydF4y2Ba
- Collettrichum gleooosporioidesgydF4y2Ba
- 转录组gydF4y2Ba
- 蛋白质组学gydF4y2Ba
- 差异表达基因(DEGS)gydF4y2Ba