摘要
背景
BRS1 (brassinosteroids -insensitive 1 suppressor 1)是一种丝氨酸羧肽酶,介导油菜素内酯信号转导并参与拟南芥多个发育过程。然而,我们对BRS1在这一背景下的确切作用知之甚少。
结果
在本研究中,我们分析了拟南芥幼苗过表达的转录和蛋白质组学特征BRS1.发现该基因涉及冷应激反应和氧化还原调控。进一步的蛋白质组学证据表明,BRS1调节细胞氧化还原通过间接与细胞溶质NADP +依赖性异柠檬酸脱氢酶(CICDH)相互作用。一种新的替代剪接形式BRS1.在过表达突变体中鉴定出来BRS1-1D,这可能会在植物开发和压力反应中赋予新的作用。
结论
本研究强调了BRS1在植物氧化还原调控和胁迫反应中的作用,拓展了我们对细胞外丝氨酸羧肽酶的认识。
背景
丝氨酸羧肽(SCP)是一类真核蛋白水解酶,属于α/β.水解酶家庭。这些酶含有高度保守的催化氨基酸三合会,Ser-ASP-His [1].在拟南芥中,已经确定了54种SCP样基因并将其分为三个类[2那3.].然而,大多数这些基因的功能尚未被描述。
BRS1属于拟南芥SCP系列的II类[1].其过表达可以抑制芸苔类化合物(Br)受体突变体的表型,bri1-5,表示BRS1在BR信令中发挥着重要作用[4.那5.].在拟南芥中,BRS1.有五个接近的同源物,其中三个可以抑制bri1-5发育缺陷(6.].相反,在单个或双突变体中没有发现显著的表型BRS1.或其同源物[5.那6.那7.),表示BRS1.它的同源物在拟南芥中功能冗余。
越来越多的证据表明,SCP和SCP样(SCPL)蛋白在压力反应调节中起重要作用,包括调节伤口愈合[8.,程序性细胞死亡和对病原体感染的反应[9.那10.].BRS1包含一个信号肽,定位于细胞外空间[4.那5.].由于细胞外空间是调节植物应激反应的中心[11.那12.那13.],很可能是BRS1可能会介导这些信号传导途径中的一些。然后,这一假设在目前的理解中很大程度上不为人知。
在本研究中,转录组学和蛋白质组学分析证实了BRS1在冷胁迫反应中的作用。我们的研究结果表明,BRS1通过与cICDH的相互作用参与氧化还原调控,为SCPs在植物胁迫反应中的作用提供了新的线索。
结果
BRS1的幼苗发育表型
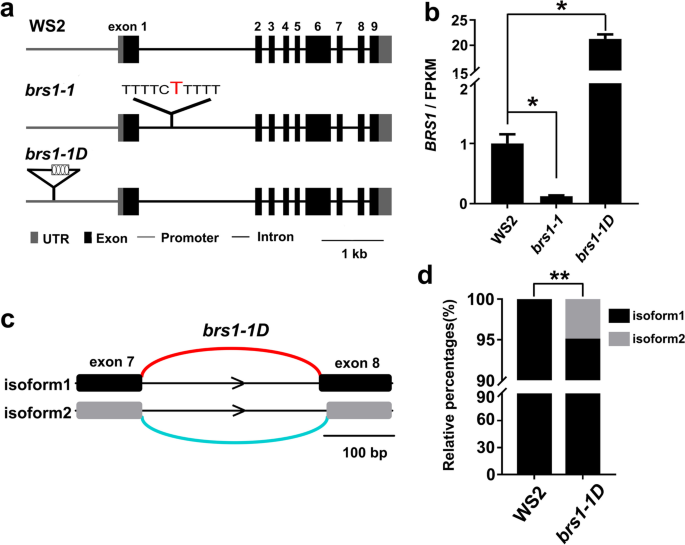
突变体BRS1-1D有一个增强者BRS1.推动者[4.那5.],导致大约增加15倍BRS1.与野生型WS2中的转录相比(图。1a),并显示较大的玫瑰花叶(图。1b)和较长的下胚轴(补充图S1).相反,BRS1基因敲除突变体,brs1-1,显示出显着的转录减少BRS1.(图。1a),但没有观察到显着表型[4.那5.那6.那7.].
BRS1幼苗转录组分析
对WS2进行RNA测序,brs1-1和BRS1-1D18、树苗,展而出之BRS1.在brs1-1在第一个内含子的位置533处插入一个胸苷(图。2a)和转录的显着降低(图。2b)。另外,在同源物中没有观察到的转录增加BRS1.在brs1-1(补充图S2)表示没有转录反馈环BRS1.及其同源物。相比之下,转录水平BRS1.增加了大约20次BRS1-1D突变体(无花果。2b),其与插入启动子区域中插入的CAMV 35S增强剂的四个副本一致BRS1.[5.].
基因序列的差异和BRS1.野生型转录BRS1.突变体。一种序列差异BRS1.在WS2中,brs1-1和BRS1-1D.外显子上方的数字表示从5'至3'的外显子1-9。在第一个内含子中插入单个胸苷碱(红色)brs1-1和4×35s增强剂(黑匣子中的四个椭圆)插入启动子中BRS1.在BRS1-1D.B.转录水平(FPKM值)BRS1.在WS2中,brs1-1和BRS1-1D.所有数据来自RNA-SEQ,并显示为平均值±SD。量化了三种生物重复。星号表示统计上有意义的差异(学生的T.以及,*P.< 0.05)。C中的可选拼接事件标识BRS1-1D.“IsoForm1”是TAIR 10注释中的形式。在我们的结果中新发现了“IsoForm2”。D.isoform1和isoform2在WS2和BRS1-1D.星号表示统计上显著的差异(**经fdr调整后)pvalue.< 0.01)
值得注意的是,检测到一种新的剪接变体同种型BRS1-1D,有替代5'拼接部位(图。2c).与TAIR 10数据库中注释的亚型相比,新亚型在8外显子5 '位点上少了11 bp。该新拼接产品占总数的5.02%BRS1.成绩单BRS1-1D(图。2d),但在野生类型中没有检测到brs1-1突变体中存在新的转录产物BRS1-1D除了转录水平变化BRS1-1D.
BRS1介导多种植物胁迫反应
通过RNA测序,鉴定了总共21,873种转录物,其中180分配为差异表达基因(折倍,折叠变化≥2.0,调整的FDR调整P.-Value <0.05,FPKM≥1)BRS1-1D其中114个基因增加,66个基因减少(见表)S1).相比之下,没有识别出缺陷brs1-1苗,除了BRS1.本身(表S1).
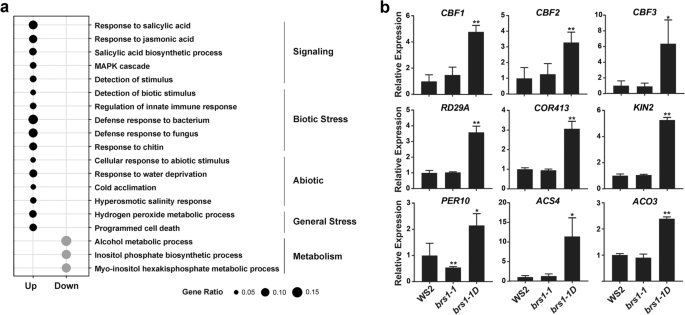
基因本体(GO)富集分析BRS1-1D显示与水杨酸和茉莉酸响应相关的术语显著富集(图。3.a).我们还发现涉及生物(固有免疫反应、细菌、真菌和几丁质)和非生物(缺水、寒冷和高渗盐)胁迫的基因显著富集(图。3.a).与这些发现一致的是,与氧化还原调节和细胞死亡相关的基因也被富集。这些结果有力地表明BRS1参与了环境应激反应。
参与非生物反应的基因。一种基因本体浓缩分析BRS1-1D和WS2(问:值< 0.01)。黑色和灰色的圆点代表GOs的上调和下调BRS1-1D分别。富集GOS的条款分为五类。基因比表明来自不同术语的次数的数量,除以含量的总数。B.冷相关基因的qRT-PCR检测(CBF1那CBF2那CBF3那RD29A那科413.那KIN2)、氧化还原相关基因(PER10)和乙烯合成相关基因(ACS4.那ACO3.).这些基因显著上调BRS1-1D与WS2相比,证实了RNA测序结果(表2)S1).所有结果至少从三个生物复制中呈现为平均值±SD。星号表示统计上有意义的差异(学生的T.以及,* *P. < 0.01, *P. < 0.05)
为了支持BRS1在应力响应中的作用,对参与氧化还原调控,乙烯合成和冷响应的基因进行QRT-PCR(图。3.b).该分析验证了不同基因型的转录变化(表)S1),支持BRS1在应激反应中发挥作用的观点。
耐寒性显着增强BRS1-1D
值得注意的是,三个核心基因涉及冷信号,C重复结合因子CBF1那CBF2和CBF3[14.,均表现出明显的转录增加BRS1-1D(图。3.b)。因此,我们检查了这些基因对冷应激的反应。结果表明,所有这些冷转录因子增加了两次转录水平BRS1-1D(图。4.a)冷冻处理(4°C 3 h)后,与野生型植物相比。一直以来,冷信号下游基因RD29A[15.],科413.[16.],KIN2[17.]显示出类似的增加趋势,而氧化还原和乙烯信号传导基因在冷冻处理后保持与野生型相同的转录水平(图。4.b),表明BRS1具有增强冷敏感性的作用。
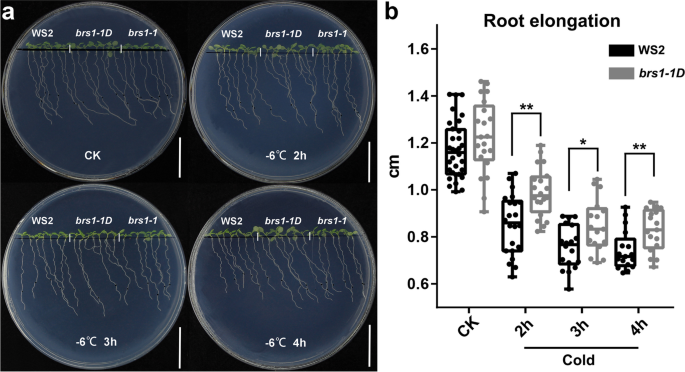
此外,研究了严重冷休克(-6℃,2小时,3小时和4小时后幼苗的表型(图。5.A),我们发现根伸长BRS1-1D冷休克后36小时的野生型显着长(图。5.b),表明过度表达BRS1.有助于提高耐冷性。
BRS1调节氧化还原相关的蛋白质
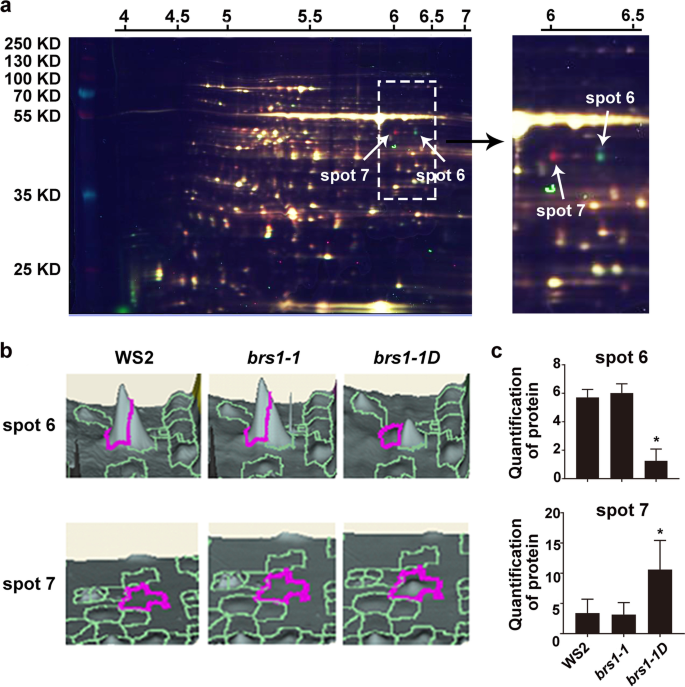
为了进一步理解BRS1的功能,对WS2进行蛋白质组学分析,brs1-1和BRS1-1D使用二维荧光差凝胶电泳(2D-Dige)的幼苗(图。6.a). 19个蛋白被划分为差异表达蛋白(t检验,P.鉴定值<0.01)和15个蛋白质,其中5个蛋白质与氧化还原调节有关(表1),支持BRS1参与氧化还原调控。
值得注意的是,与野生型相比,两个蛋白质点(6和7)具有显着改变的强度(图。6.b),表达表达的降低和增加BRS1-1D分别(图。6.c),但对应于相同的蛋白,胞质NADP +依赖的异柠檬酸脱氢酶(cICDH, at1g65930)(表1),一种关键的氧化还原调节剂[18.].这些数据在一起表明BRS1在氧化还原调节中起着重要作用。
BRS1通过与cICDH相互作用参与氧化还原调控
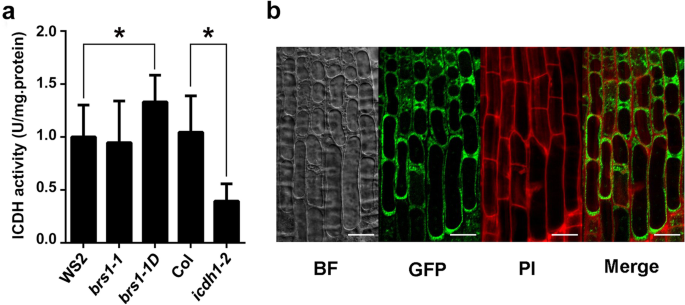
确认BRS1调节CICDH,测量CICDH的酶活性BRS1.突变体。我们发现CICDH活性显着增加BRS1-1D与野生型植物相比(图。7.a),虽然没有观察到变化brs1-1植物。这些发现与我们之前的研究结果一致,即过度表达BRS1.可以改变转录和表型。综上所述,提示BRS1调控cICDH的活性。
研究分泌蛋白BRS1如何调节定位于胞质的cICDH [19.那20.,评估BRS1的细胞定位。我们观察了BRS1在细胞膜和细胞壁的表达(图。7.b),其与细胞外空间的定位一致[4.那5.],表示BRS1与cICDH之间没有物理接触。一致地,酵母双杂交和下拉试验发现cICDH和BRS1之间没有直接相互作用(见表)S2),提示BRS1间接调控cICDH。
讨论
BRS1作为SCP的成员,其作用在SCP系列中是相对清晰的,其在植物生长和发展中的功能已经证明了[5.那6.那7.].在本研究中,转录组学和蛋白质组学分析表明BRS1在生物和非生物胁迫反应中也具有广泛的作用。
我们的研究结果表明,SA和JA信号传导,这是诱导植物防御的关键途径,以应对病原体和昆虫[21.那22.[还有助于BRS1相关的应力响应(图。3.一种)。类似地,水稻中的痉挛SCPL,OSBISCPL1,也通过SA和JA信号传导引起应力响应[9.,表明SCPLs可能以相同的机制调控应激反应。
质外体蛋白酶产生的触发效应是诱导植物应激反应的关键机制[13.].我们的结果表明,冷敏感性和耐寒耐耐力显着增强BRS1.过度表达,然后进一步研究潜在的机制,以阐明BRS1在冷感觉和/或冷信号中的精确作用。
与此概念一致,我们发现BRS1通过间接互动CICDH参与调节氧化还原性稳态。ICDH催化NADPH的产生,这对于氧化还原调节细胞代谢和促进氧化剂应激促进氧化还原信号传导是重要的[23.那24.].国际红十字会负责国际红十字会总活动的90%以上[23.那25.].因此,该酶在维持细胞中的氧化还原性稳态方面发挥着至关重要的作用,因此防御反应[18.].BRS1是如何参与这一途径的,尚需进一步研究。此外,ICDH的两种亚型具有相似的分子量,但等电点不同,这意味着它们可能是由蛋白质修饰产生的不同形式,如之前的报道所述[26.].
的敲除突变体BRS1.没有任何重要的表型[5.那6.那7.始终如一地,在突变体中没有鉴定任何可达brs1-1(桌子S1).在拟南芥中存在多个冗余同源基因可能解释了这一结果。相反,我们观察到许多表型[5.那6.那7.]并确定过表达后基因表达的显着改变BRS1.在这个研究中。本研究中确定的新型剪接变体为表型和转录变化的显着变化提供了新的解释brs1-1d。但是,它仍然需要进一步调查来澄清。
结论
在该研究中,转录组和蛋白质组学分析显示,BRS1在调节植物反应和氧化还原反应中起作用。我们发现BRS1可能通过与CICDH间接相互作用参与细胞中的氧化还原调节。完全,我们的工作揭示了SCP在生物和非生物应激反应中的角色。
方法
植物材料和生长条件
本研究中使用的植物材料如下:野生型Wassilewskija(WS2)和突变体BRS1.(brs1-1和BRS1-1D).这BRS1-1D通过用激活标记线路交叉WS2生成bri1-5 brs1-1D(CS6127)李佳博士(兰州大学,中国兰州)[4.那5.那7.].这brs1-1从威斯康星州拟南芥淘汰池中获得,并在本研究的第一个内含子中鉴定在533 bp中的插入胸苷。T-DNA插入突变体ICDH-2(SALK_056247)是从Salk研究所拟南芥生物资源中心(ABRC)收集的,并经基因分型验证,如前所述[18.].在22℃、16 h光照、8 h黑暗条件下(光照强度为100 μmol·m)生长-2·S.-1,湿度60%)萌发后两周时间进行表型观察。三种材料的幼苗在半强度MURASHIGE和SKOOG(1/2 ms)琼脂培养基(补充有1%(w / v)蔗糖和0.8%(w / v)琼脂,pH 5.6-5.8)。发芽后7天提取相同的室和培养条件,总蛋白质和RNA。
RNA提取和基因表达谱分析
七天历史的WS2,brs1-1, 和BRS1-1D在1/2 ms板上垂直生长的幼苗在液氮中冷冻,并收集各材料的三份。使用天根rnaprep纯植物试剂盒从整个幼苗中提取总RNA,并用Thermo Scientific Nanodrop2000评估其质量。RNA测序由Biomarker公司(北京,中国)完成。
鉴定差异表达基因(DEGS)并进行富集分析
使用Trimmomatic(v 0.36)清洁的原始转录组测序数据。干净的读数与之对齐拟南芥蒂利亚纳使用HisaT2(V 2.1.0)的参考基因组(Tair 10)和基因的表达使用Stringtie(v1.3.3)进行分析[27.那28.].
识别所有差异基因brs1-1和BRS1-1D与控制WS2相比。将基因的校正读数数据导入R包DESEQ2(V1.26.0)[29.],以识别fold change≥2.0,false discovery rate (FDR)‐调整的degP.-Value <0.05,以及每个比较的至少一个样品中的表达(FPKM≥1)。
通过AnnotationHub(“AH75734”)获得的GO描述,并使用R包群体预防器(V3.14.0)[30.通过“EnRichgo”功能进行富集分析。使用超细分布试验检查富集的富集的统计显着性,然后使用本杰里尼 - Hochberg方法进行多次测试校正。使用q -value <0.01进行术语,以进一步分析。
替代剪接分析
所有样品的清洁读数都对齐拟南芥蒂利亚纳参考基因组(Tair 10)使用明星(v 2.7.3a)[31.].使用Regtools (v0.5.2)从RNA-seq BAM文件中提取外显子-外显子连接,参数为-a 8 -m 50 -m 500,000。然后我们使用切叶刀(v 0.2.9) [32.]进行内含子聚类(-M 500,000)和差分剪接分析(-I 3)。测量内含子簇的差异拼接为“换量”(ΔPSI)的“变化”(ΔPSI),用|ΔPSI| 0.05和FDR调节鉴定差异替代剪接事件P.-Value <0.01。
二维荧光差凝胶电泳(2D-Dige)分析的蛋白质制剂
收获7日龄幼苗(1 g),在液氮中研磨成细粉,进一步与4 mL冰冷提取缓冲液(20 mM Tris-HCl, PH 8.0, 1 mM EDTA, 20 mM NaCl, 5 mM MgCl)混合2、10 mM DTT、2 mM苯甲磺酰氟、1 μg/mL白细胞介素、10 μg/mL抑肽酶、1 μg/mL凝乳酶和1%磷酸化酶抑制剂混合物)。4℃,18000 g离心20 min,收集上清,用3 mL提取缓冲液重悬重复提取。在混合上清液中加入冷冻丙酮至80% (V/V)(上清液丙酮体积的4倍),-20℃孵育过夜沉淀蛋白。蛋白质被溶解在颗粒状100μL裂解缓冲(7 M尿素,2 M硫脲,4% w / v皮套裤,20毫米Tris-HCl, pH值8.5),和碎片被离心20分钟的18000 g。最后,蛋白质样品的pH值调整到8.5盐酸和氢氧化钠,以牛血清白蛋白为标准,Bio-Rad Bradford法测定蛋白浓度[33.].最终蛋白质立即接收2D-Dige或在-80℃下储存在等分试样中。对于每个样品,进行至少四包蛋白质制剂。
2D-Dige和图像分析
根据制造商的说明(GE医疗),等量的brs1-1和BRS1-1D分别用Cy3和Cy5的最小荧光染料(400pmol染料/50μg蛋白)标记蛋白质。内标WS2蛋白质用Cy2标记,并以两种不同的标记蛋白混合。将混合标记的蛋白质用再水化缓冲液(8M尿素,13mM DTT,4%W / V CHAPA,0.5%Pharalyte pH 3-10)调节450μl的总体积,然后在IPG测试条支架上负载包含具有24cm pH 4-7线性梯度(GE Healthcare)的IPG测试条。如前所述的等电聚焦和SDS-PAGE的实验方法[34.].为了最大限度地减少系统性和固有的生物差异,建议将四种独立的蛋白质制剂组合每种样本[35.].
通过台风9400扫描仪(GE Healthcare)扫描凝胶的荧光图像,并根据解放器用户手册(GE Healthcare)使用Defyder 6.5软件进行分析图像[34.].在每个图像中检测到大约2000个斑点,然后通过ANOVA和学生的T检验确定显示出显着差异表达的斑点(P.< 0.05)。选择差异表达显著的19个点进行质谱鉴定。
蛋白质识别
对扫描后的2d - dige凝胶进行考马斯亮蓝染色,通过位置比较发现差异蛋白点,但很难检测低背景表达的蛋白。因此,使用含有1mg内标蛋白的2-DE凝胶进行染色,显示2D-DIGE凝胶中无法检测到的斑点。
在从2-D-Dige凝胶中切除19个差异蛋白质斑点后,每个斑点在脱离缓冲液中脱离(25mM碳酸氢铵,50%V / V乙腈)。脱水斑点通过乙腈和纺溶液体脱水,并在37℃下用测序级改性胰蛋白酶(Roche)进行排序16小时。在Ultroclex II Maldi飞行时间/飞行时间质谱仪(MALDI-TOF / TOF MS)(Bruker Daltonics,德国)使用的情况下生产基质辅助激光解吸电离(MALDI)质谱Flexanalysis 2.4软件。在将胰蛋白酶肽质量转移到生物溶胶3.0界面(Bruker Daltonics)后,针对NCBINR蛋白质数据库搜索肽质量指纹(PMF)(http://www.ncbi.nlm.nih.gov/;NCBInr 20071214;使用Mascot软件2.2.03(http://www.matrixscience.com.;矩阵科学,伦敦,u.k。)。
酶活
在液氮中研磨后7天的幼苗(0.1g)在液氮中磨成细粉末,并与提取物缓冲液混合(1ml 0.1m Nah2宝4.(pH 8.0), 5 mM氯化镁2, 14 mM 2-巯基乙醇)。旋涡匀浆,12,000 g离心5分钟去除不溶物,用分光光度法测定ICDH活性[18.那20.].用BSA作为标准的先前描述的Bio-rad Bradford方法确定蛋白质浓度的测定[33.].
共聚焦成像
对于BRS1的蛋白质定位,将来自转基因COL-0植物的相应的幼苗根尖在0.1mg / ml碘化丙锭中染色8分钟。使用共聚焦荧光显微镜(Leica,TCS SP8)拍摄幼苗。GFP激发了488nm激光,并在495-535 nm处检测到。用552nm激光激发碘化丙糖,并在530-680nm处检测。使用Adobe Photoshop和ImageJ进一步分析图像。
可用性数据和材料
本研究中生成或分析的所有数据都包含在本文中和补充文件中。使用Bioproject ID提交RNA测序的原始数据,使用Bioproject ID:prjna657702。
缩写
- SCP:
-
丝氨酸羧肽酶
- BRS1:
-
Brassinosteroid-imensited 1抑制器1
- ROS:
-
活性氧
- 度:
-
差异表达基因
- FPKM:
-
每百万片碎片每千碱基映射的碎片
- 山:
-
水杨酸
- JA:
-
茉莉酸
- cICDH:
-
细胞溶质NADP + - 依赖性异柠檬酸脱氢酶
参考文献
- 1。
弗雷泽厘米,骑手LW,Chapple C.拟南芥丝氨酸羧肽酶样基因家族的表达和生物信息学分析。植物理性。2005; 138(2):1136-48。
- 2。
Tripathi LP,Sowdhamini R.拟南芥和稻米丝氨酸蛋白酶的交叉基因组比较。BMC基因组学。2006; 7:200。
- 3.
朱丹,褚伟,王玉英,闫华,陈志祥,向阳。杨树丝氨酸羧肽酶样蛋白家族的全基因组鉴定、分类和表达分析。杂志。2018;162(3):333 - 52。
- 4.
周A,李J.Abridopsis BRS1是分泌的和活性丝氨酸羧肽酶。J Biol Chem。2005; 280(42):35554-61。
- 5。
Li J,Lease Ka,Tax Fe,Walker JC。BRS1,丝氨酸羧肽酶,调节BRI1信号拟南芥蒂利亚纳.Proc Natl Acad Sci U S A. 2001; 98(10):5916-21。
- 6。
Wen J,Li J,Walker J.过表达丝氨酸羧肽酶增加了Carpel数和种子生产拟南芥蒂利亚纳.食品和能源安全。2012; 1(1):61-9。
- 7。
邓Q,王X,张达,王X,冯C,徐S.BRS1在促进拟南芥侧根出现的作用。int j mol sci。2017; 18(7):1549。
- 8。
Moura DS,Bergey Dr,Ryan Ca.番茄植物叶片伤口诱导型丝氨酸型羧肽酶的表征及定位(Lycopersicon esculentum磨。)。Planta。2001; 212(2):222-30。
- 9。
刘H,王X,张h,杨y,ge x,song f.水稻丝氨酸羧肽酶样基因OsBISCPL1参与调节对抗生物和氧化应激的防御反应。基因。2008;420(1):57 - 65。
- 10。
Domínguez F, González MC, Cejudo FJ。在小麦籽粒和幼苗的维管组织分化过程中,一个编码丝氨酸羧肽酶的萌发相关基因被表达出来。足底。2002;215(5):727 - 34。
- 11.
朱镕基JK。植物的非生物胁迫信号与响应。细胞。2016;167(2):313 - 24。
- 12.
周杰米,张玉。植物免疫:危险感知与信令。细胞。2020; 181(5):978-89。
- 13。
质外体蛋白酶-植物抗病原体侵染的强大武器。植物Commun。2020;1:100085。
- 14。
Chinnusamy v,朱茹,朱杰克。植物基因表达的冷应力调节。趋势植物SCI。2007; 12(10):444-51。
- 15.
Msanne J,Lin J,Stone Jm,AWADA T.非生物应激响应性的特征拟南芥蒂利亚纳RD29A和RD29B基因及其转基因评价。足底。2011;234(1):97 - 107。
- 16。
Breton G,Danyluk J,Charron JB,Sarhan F.表达分析和生物信息分析谷物和拟南芥的新型压力调节的多杀型跨膜蛋白家族。植物理性。2003; 132(1):64-74。
- 17。
Kurkela S,Borg-Franck M. kin2的结构和表达,两个冷和ABA诱导基因中的一种拟南芥蒂利亚纳.植物mol biol。1992年; 19(4):689-92。
- 18。
MHAMDI A,紫红色C,Gouia H,Saindrenan P,Hodges M,Noctor G.依赖于胞嘧啶NADP依赖性的异柠檬酸脱氢酶有助于氧化还原稳态和拟南芥叶中病原体反应的调节。植物细胞环境。2010; 33(7):1112-23。
- 19。
GálvezS,霍奇尼斯·米,斯派维斯·宾夕法尼亚州,桑甘米,桑湾Rs,Dubois F,LemaréchalP,Crétinc,Gadal P.鉴定编码细胞溶质NADP-异柠檬酸脱氢酶的烟草cDNA的鉴定。植物mol biol。1996; 30(2):307-20。
- 20。
Galvez S,Biscuth E,Sarda C,GadaL P.来自混纺烟草细胞氯塑料NADP-异柠檬酸脱氢酶的纯化和表征(与细胞溶质同工酶的比较)。植物理性。1994; 105(2):593-600。
- 21。
浏览J. Jasmonate通过集合:防御激素的受体和目标。Annu Rev植物Biol。2009; 60:183-205。
- 22。
张Y,Li X.水杨酸:生物合成,感知和植物免疫的贡献。CurrOp植物BIOL。2019; 50:29-36。
- 23。
NADPH循环系统在氧化应激豌豆根瘤中的作用:NADP+依赖的异柠檬酸脱氢酶的关键作用。足底。2007;225(2):413 - 21所示。
- 24。
Hodges M,Flesch V,G S,Biscuth E.高等植物NADP + - 依赖性脱氢酶,铵同化和NADPH生产。植物Physiol Biochem 2003;41(6-7):577-85。
- 25。
2-氧戊二酸在植物铵态氮同化中的作用。中国农业科学(英文版)2002;53(370):905-16。
- 26。
唐伟,金TW, Oses-Prieto JA,孙勇,邓铮,朱胜,王锐,Burlingame AL,王志勇。bsk介导拟南芥受体激酶BRI1的信号转导。科学。2008;321(5888):557 - 60。
- 27。
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12(4):357-60。
- 28。
ertea m,pertea gm,antonescu cm,chang tc,mendell jt,salzberg sl。Stringtie使得能够从RNA-SEQ读取改进转录组的重建。NAT BIOTECHNOL。2015; 33(3):290-5。
- 29。
爱情MI,Huber W,Anders S.使用DESEQ2的RNA-SEQ数据的折叠变化和分散的调节估计。基因组Biol。2014; 15(12):550。
- 30.
于光,王磊,韩艳,何庆强。聚类分析器:用于比较基因簇间生物学主题的R包。组学。2012; 16(5): 284 - 7。
- 31。
Dobin A, Davis CA, Schlesinger F, Drenkow J, Zaleski C, Jha S, Batut P, Chaisson M, Gingeras TR. STAR:超快通用rna测序仪。生物信息学。2013;29(1):15至21。
- 32。
李毅,Knowles DA, Humphrey J, Barbeira AN, Dickinson SP, Im HK, Pritchard JK。用切叶机对RNA剪接进行无注释定量分析。Nat麝猫。2018;50(1):151 - 8。
- 33。
利用蛋白质-染料结合原理的一种快速、灵敏的微量蛋白质定量方法。学生物化学肛门。1976;72:248-54。
- 34。
徐某,Yu Ht,yan Lf,王T.储存阶段水稻胚乳的综合蛋白质组学及细胞学研究。J蛋白质组。2010; 9(10):4906-18。
- 35。
Barceló-Batllli S,Kalko SG,Esteban Y,Moreno S,Carmona MC,Gomis R. Dige和Bioinformatics分析的集成揭示了抗菌剂钨酸酯在棕色脂肪组织中氧化还原和能量稳态途径的作用。Mol细胞蛋白质组学。2008; 7(2):378-93。
致谢
我们感谢贾丽(兰州大学,兰州,中国)请诚挚地提供突变体BRS1..
资金
这项工作得到了中国国家重点研究和发展方案资助的中国(2016年,2016年)和中国国家自然科学基金(31370318)。这笔资金没有参与数据的设计和收集,分析和解释以及写作稿件,但刚刚提供了财务支持。
作者信息
隶属关系
贡献
SX构思和设计了研究,并为手稿的撰写和修改做出了贡献。DZ和YZ进行了实验工作和数据分析,DZ和JW对手稿进行了撰写和修改。PZ进行生物信息学分析。所有作者均已阅读并批准本稿件。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
DEGs的鉴定BRS1.突变体。表S2。BRS1-GFP下拉鉴定的蛋白质。
附加文件2:图S1。
WS2幼苗下胚轴表型brs1-1和BRS1-1D.一个。WS2的幼苗表型,brs1-1和BRS1-1D生长在1/ 2ms长日条件下。照片捕获了7个DAG。秤杆= 1厘米。湾WS2的缺苗表型,brs1-1和BRS1-1D在黑暗中在1/2 ms培养基上生长的幼苗。照片捕获了5个DAG。秤杆= 1厘米。C。缺口长度的比较(一种).意味着±SD显示在每个实验中的三个独立实验中,N≥20显示。星号表示统计上有意义的差异(学生的T.以及,*P.< 0.05)。天。下胚轴长度比较(b).平均值±SD为3个独立实验,每次实验n≥20。星号表示统计上有意义的差异(学生的T.以及,*P.< 0.05)。图S2。表达分析BRS1.野生型和BRS1突变体中的同源物。RNA测序用于计算五个的表达水平(FPKM值)BRS1.同源染色体:SCPL22那SCPL23那SCPL25那SCPL26和SCPL27在WS2中,brs1-1和BRS1-1D植物。显示平均值±SD。星号表示统计上有意义的差异(学生的T.以及,*P.< 0.05)。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
张,D.,赵,Y.,王,J.等等。BRS1介导植物氧化还原调节和冷响应。BMC植物BIOL.21,268(2021)。https://doi.org/10.1186/s12870-021-03045-y.
已收到:
公认:
发表:
关键词
- 丝氨酸羧肽酶
- 冷应激反应
- 氧化还原
- 拟南芥