抽象的
背景
当归(摘要)。一昼夜的(A. Sinensis.)是一种生长在不同地理位置的中草药。它含有许多具有治疗价值的活性成分。根际微生物影响着植物的营养获取、生长发育和抗病性。到目前为止,很少有研究探讨微生物组分对植物活性成分水平的影响A.中华。本研究调查了根际微生物社区的变化和代谢物A. Sinensis.与土壤微征化不同。来自两个主要的土壤A.中华-生产地区,甘肃和云南省用于进行盆栽实验。将土壤样品分为两部分,一部分被灭菌,另一部分被甘肃DangGui 90-01的幼苗品种株式化种植。使所有幼苗均得到180天。在实验结束时,基数A. Sinensis.收集并用于表征生长目标和化学成分。根际土壤进行微生物分析。
结果
代谢谱的变化和根际微生物群落A. Sinensis.在不同的土壤微环境下生长情况相似。GN(甘肃未灭菌)、YN(云南未灭菌)、GS(甘肃灭菌)和YS(云南灭菌)组之间存在显著性差异。尤其是拮抗细菌,如鞘粉,假单胞菌,Lysobacter,pseudoxanthomonas.等显著降低(p < 0.05) enriched in Gansu soil compared with Yunnan soil. Moreover, senkyunolide I and ligustilide dimers which were enriched in GS group were strongly positively correlated with假单胞菌parafulva;有机酸(包括绿色酸,二呋化酸和5-二硫酸)及其富集在Ys组的酯番茄素呈正相关芽单胞菌门细菌WY71和粘液菌sp。分别。
结论
土壤微环境影响植物的生长和活性成分的水平/类型A. Sinensis.. 进一步研究品质相关细菌的功能特性,确定关键反应基因,阐明基因与土壤环境的相互作用。这将揭示决定真品质量形成的机制A. Sinensis..
背景
地道中药材是经过长期临床实践而选择的中药。疗效满意,质量稳定,知名度高。特别是基数A. Sinensis.具有传统功效;例如,它滋养血液,促进血液循环,调节月经,缓解疼痛。它最初被推荐为妇科疾病的治疗选择[1],目前用于一般的心脏保护、免疫增强、抗心律失常、抗动脉粥样硬化等[2].在中国,A. Sinensis.在很大程度上在甘肃,云南,青海等地生产。甘肃省闽县长期以来一直被视为其传统地球教区,气候凉爽,暴雨,大多是肥沃的肉桂和黑土,这是理想的A. Sinensis.生长。通过强烈的相互作用,陆生植物和土壤微生物相互效益。植物提供土壤微生物的栖息地和可靠的碳和能源,直接或间接促进宿主植物的产量和质量。此外,它们通过改善土壤矿物营养,生产植物激素,植物毒性化合物的降解,抑制土壤传播病原体等来提高宿主的抵抗力。[3.,4].大量报告表明,植物种类、生长发育、宿主基因型、地理位置是根际微生物多样性的主要驱动因素[5,6,7]. 值得注意的是,地理位置和栽培方式是决定田间微生物群落变化的关键因素;然而,在控制温室条件下,微生物组成因土壤来源和基因型而异[6].在大规模的纵向场研究中报道了类似的结果,其在三个领域种植的27个玉米自交系中的微生物群落的变化[7].相反,植物遗传效应对根际微生物组具有显着影响,超越地理位置,植物年龄和气候事件。
令人信服的证据表明植物微生物相互作用对于健康植物生长至关重要[8]. 目前,探索真正的中药的关键兴趣主要是针对土壤性质和根际微生物。名药材长势和增产取得重要突破,包括人参,Rehmannia glutinosa,和三七根际微生物群落的变化和有毒物质的积累与中药回植失败密切相关。例如,报告显示土传病原体,镰刀菌素随植物生长而生长,而拮抗细菌假单胞菌和芽孢杆菌表现出相反的趋势[9,10.]. 尽管伊利诺克考察近年来的一项研究揭示了硝酸盐依赖性铁(II)氧化细菌驱动的根际铁、铝和锰的氧化和沉积与锈根病的潜在关联[11.]. 再者,经济的增长镰刀菌素邻苯二甲酸二异丁酯(DiBP)的积累与邻苯二甲酸二异丁酯(DiBP)的居群呈负相关假单胞菌,芽孢杆菌, 和洋葱等,造成土壤和人参之间的负反馈[9,12.].同样地,酚酸在根际酚酸的积累R. glutinosa.潜在抑制增长的假单胞菌SPP。,但对菌丝生长,孢子制作和毒素产生发挥积极影响Fusarium oxysporum[13.].进一步的研究表明,有益的不平衡(假单胞菌SPP。)和有害(肠杆菌SPP。)QS(Quorum感测)由QQ(Quorum猝灭)细菌介导的根际介导的细菌,占关键因素R. glutinosa.补充疾病[14.].
A. Sinensis.是典型的高山植物,对温度要求很高(20 ~ 24°C)、光照(长日光)和高海拔地区(2000年) ~ 2500米)。红景天的生产与质量A. Sinensis.在高度下降后劣化。因此,它变得更易于早期螺栓,这降低了药物功效。育种基地的不稳定性是影响其质量的第二大理由。传统的荒地幼苗举起的方式,通过所有的方式都是环保的。由于粮食和生态保护的粮食政策,土地苗木和耕地荒地的旋转被认为是主要选择。然而,它们不成熟,以保证质量A. Sinensis..土壤微生物群落报告的真实性A. Sinensis.由于独特的生活环境需求所带来的障碍,是很少的。此前,我们发现,与云南和四川省在内的其他非地赫尔(甘肃省根际)的占状微生物种类和群体的群体多样性和群体多样性的数量多样化。proteobacteria.和拟杆菌是整个生长季节的优势菌门A. Sinensis.真菌优势门随生长期而变化。此外,株重、根长、根径、土壤pH值、降水量和气候温度是影响土壤微生物群落组成变化的主要因素A. Sinensis.[15.].植物-微生物相互作用的研究主要集中在药用植物连作障碍、植物-微生物对环境胁迫的响应、根际营养条件的变化、根系生物量、和生长,但没有提供不同土壤微环境下活性成分积累的信息[16.]. 根际微生物对玉米品质改良的作用机制亟待阐明A. Sinensis.,获取A. Sinensis.质量稳定的材料。
本文采用四种处理方法进行盆栽试验:(1)甘肃GN无菌土,(2)甘肃GS无菌土,(3)云南YN无菌土,(4)云南YS无菌土,以甘肃当归90-01为试材,四个对照组均不进行插秧。通过代谢组学和16srrna焦测序技术的结合,我们旨在探索(i)根际微生物的潜在变异,以及植物的生长和品质A. Sinensis.在不同的土壤微环境下,并(ii)确定是否生长和质量A. Sinensis.通过根际微生物的变化积极影响。
结果
植物的形态和品质A. Sinensis.在不同的土壤微征下
无论土壤是否消毒,A. Sinensis.在甘肃土壤中(包括GN和GS组)p < 0.05)比云南土壤(包括YN和YS组)分枝多,直径大(图。1A和B)。与在未灭菌土壤中生长的植物相比,在灭菌土壤中生长的植物表现出更薄的根茎、更少的分枝数和更小的直径(图。1C和D)。植物在未灭菌土壤中的存活率(GN,0.77) ± 0.09; 伊恩,0.63 ± 0.18;n= 6)was remarkably (p< 0.05)高于灭菌土壤(GS, 0.48±0.15;Ys, 0.46±0.19;n = 6). 结果表明,GN处理的植株平均干重、根径、小根数和根长均显著高于对照(p < 0.05) larger than that of plants of YN group. Plants of GS group showed substantially (p< 0.05)降低了平均干重、根径和根长。YN组植株的根直径显著(p< 0.05)高于YS组,GS组高于YS组(表1).
进一步解释质量差异的原因A. Sinensis.在群体中,对药物组分(邻苯二甲酸和有机酸)和营养物(氨基酸,核苷和核酶)进行了压缩分析。结果表明,药用成分的含量显着(p< 0.05)组间差异。具体来说,绿原酸的含量Z川芎内酯在A. Sinensis.在云南土壤中成长显着(p < 0.05) higher than in plants grown on Gansu soil. The level of coniferyl ferulate and butylidenephthalide in the GN group was higher, whereas that of ferulic acid was lower than in other three groups. The level of senkyunolide A and butylphthalide in YN group was markedly (p < 0.05) higher than in the other groups. The level of senkyunolide I and senkyunolide H in YS group was significantly (p < 0.05) lower than in the other groups. However, the level of senkyunolide I and senkyunolide H was similar across GN, YN and GS groups (Table2).
以前,我们发现了A. Sinensis.富含核苷、碱基和游离氨基酸等营养成分[17.].胞嘧啶-5'-单磷酸盐的平均含量占总核苷和核酶的31.03%,而腺苷占27.68%,尿苷分别为12.84%,分别为12.46%,精氨酸的平均含量占86.91%总氨基酸,而γ-氨基丁酸占4.43%,谷氨酰胺为2.82%,脯氨酸为0.88%。Yn组中总核苷和核酸核酸酶的浓度显着低于其他基团,其中基本氨基酸如赖氨酸,色氨酸,Yn或Ys基团的基础碱基低于GN或GS组。跨越组化学成分的差异可以通过土壤微征的差异来解释(补充表S.1).
代谢物的变化A. Sinensis.在不同的土壤微征下
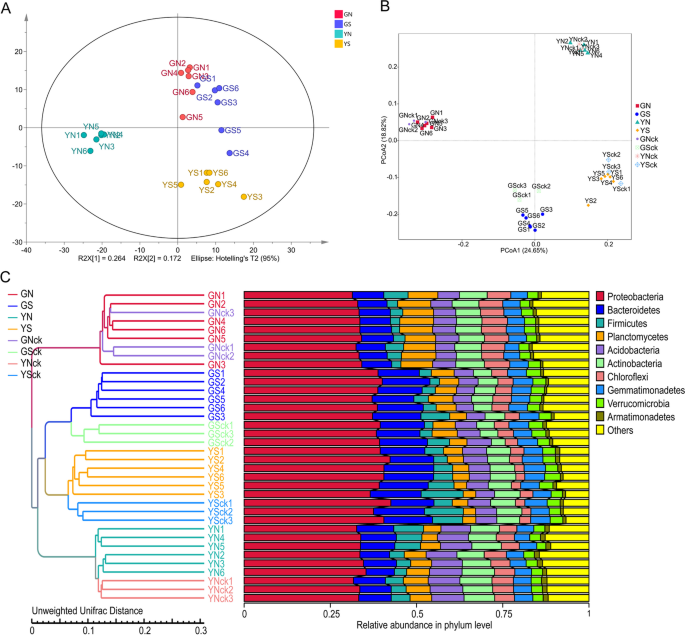
药用植物的质量受不同化合物的多样性和生物化学的影响[18.].本研究建立了一种简便、快速、灵敏的UPLC-UV-QTOF-MS/MS方法A. Sinensis.在不同土壤微环境下生长的样品。主成分分析(PCA)表明,不同的代谢特征显著不同(p < 0.05) across groups, and the samples were clustered into four groups: GN, YN, GS and YS groups. Notably, GS and YS samples were clustered close to GN samples, especially GS samples. However, GN, GS and YS samples formed distant clusters from YN samples (Fig.2A) 是的。R2X R2Y和Q2OPLS-DA模型的Y值分别为0.667、0.966和0.851。排列分析结果证实了OPLS-DA模型的稳定性和可靠性。层次聚类热图显示组内分子特征具有相似的聚类模式,而组间分子特征具有差异,这与PCA聚类模式一致(图。3.A) 是的。
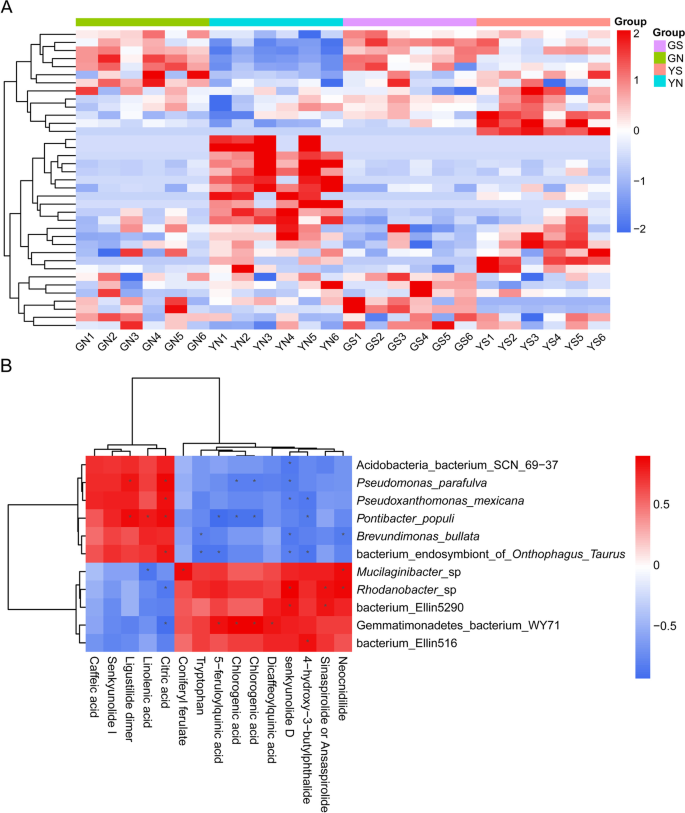
在UPLC-QTOF-MS/MS分析中,采用正离子模式和负离子模式进行定性鉴定。通过化学标准或与已知化合物的准分子离子、经验分子式和/或片段离子的比较,共鉴定出44种代谢物(补充表S2)[19.].我们选择了通过设置大于1.5的投影(VIP)值的变量重要性而对分组提供了大大贡献的标记p-在慢化t检验中小于0.05。总的来说,GN组和GS组植物中藁本内酯二聚体的含量较高,而绿原酸的含量则相反。更重要的是,GN组植株中藁本内酯二聚体含量较高,未知二聚体含量较低[19.[Senkyunolide A和绿原酸与Yn组相比。进一步的分析表明,GS组植物具有较高水平的锂硅脂二聚体,Z-6,7-环氧藁本内酯和senkyunolide I,绿原酸和二咖啡酰基奎宁酸含量较YS组低。结果表明,未灭菌组的植物比灭菌组的植物具有更高水平的藁本内酯二聚体(补充图S3.和S2,补充表S3.).
不同土壤微征下根际细菌的注释与社区组成
用PCR扩增了36份标本中16S rRNA基因的V4区,并用IonS5测序TMXL平台。每个样本平均获得80118个清洁读数。根据> 97%的序列特征将高质量reads聚为10583个OTUs,然后使用Silva132数据库进行标注。在门水平上注释的OTUs共65个,占总数的87.60%;在属水平上注释了721个OTUs。在门的层面上,我们发现proteobacteria.(相对丰度为55.38%),伯啉(10.65%)和Acidobacteria(7.26%)是主要的物种。在Genus级别,根源占主导地位寡养单胞菌(9.97%),Rhodanobacter(4.19%)和乳酸杆菌(1.48%)。
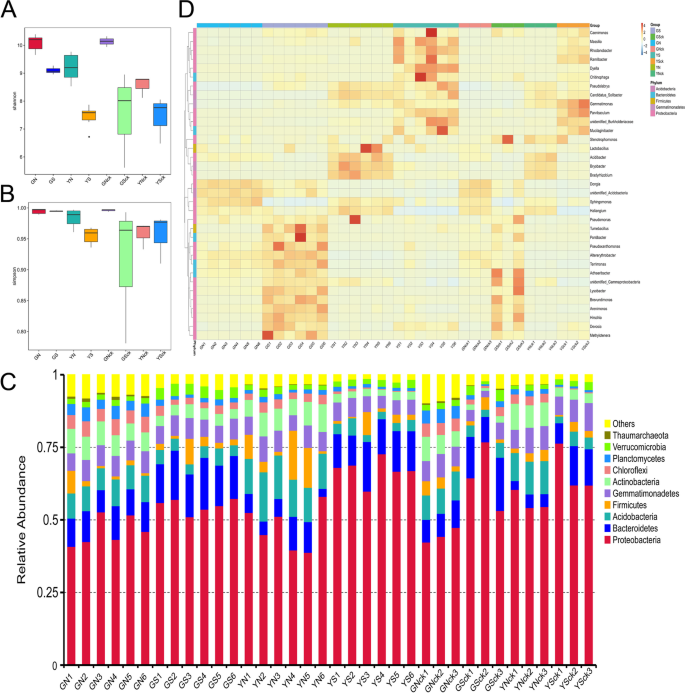
α-diversity为样品微生物多样性,通过计算Chao1、Shannon’s多样性指数、Simpson多样性指数等得出类似的结论(图1)。4A和B)。结果表明,非灭菌群体中的群落多样性高于灭菌群体,甘肃群体中的较高社区多样性而不是云南群体。然而,种植组和相应的非种植组之间的社区多样性并不不同。Anosim的结果表明,组之间的差异显着(p < 0.05) greater than that within groups, indicating that the results were reliable. Collectively, these results indicated that the diversity of the bacterial communities ofA. Sinensis.受土壤微环境的影响,植物效应影响不大。
基于加权Unifrac(WUF)距离度量的PCOA表明,种植组和相应的非种植基团的社区组成非常相似。沿第一轴分离的灭菌和非灭菌样品和PC1的总变异的38.65%,表明土着细菌是影响根际细菌群落的最重要因素。来自甘肃和云南的样品在第二轴上明确区分,PC2解释了总变异的23.35%,表明地理位置是导致根际细菌群落的变化的第二个最重要因素。然而,当使用未加速的UNIFRAC(UUF)距离时,地理位置对测试因子的变异显示出最大的贡献,土着细菌是第二个最重要的变异来源(图。2b)。
PCOA的结果与来自算术平均值(UPGMA)聚类的未加权对组方法的结果一致(图。2C) 是的。基于UUF距离度量的层次聚类显示了GN、GS、YN和YS组样本的完全聚类。然而,观察到种植群和相应的非种植群聚集在一起,表明植物对整个群落组成的影响有限。来自GS和YS的样本最初聚集成一个分支,然后聚集成YN样本,最后聚集成GN样本。这表明GN组与其他三组不同。为了对上述分析提供统计学支持,采用ADONIS和MRPP对不同组的样本进行了统计检验,得出了相似的结论。
根际细菌群组成比较
为了完全理解组中OTU的分布,我们构建了Venn图,并使用它们来计算在不同组之间的每组和Otus中唯一识别的OTU的比例。结果发现,GN和GNCK组,Yn和Yn基团,GN和Yn组,GN和YS组,GN和GS组,Yn和Ys组,Yn和Ys组之间的oTus的比例占48.74%,42.17%,38.17%,分别30.10%,35.88%和32.50%的奥特斯。这在种植组和相应的非种植组之间微生物群落结构方面表现出高相似性。所有种植组的Venn图表表明,属于GN组的独特OTU的数量是最高的,具有1692种;ys组的那个最少,226种。所有非种植组都记录了相同的现象。
在门水平,来自每个样品或组的前12个最丰富的门,用于产生累积柱图,显示所有物种的相对丰度。结果表明,微生物界占主导地位proteobacteria.,伯啉,和Acidobacteria. 此外,一个显著的(p < 0.05)相对丰度较高proteobacteria.和伯啉,和一个显著(p < 0.05) lower relative abundance ofAcidobacteria,actinobacteria., 和Chloroflexi与非灭菌组相比,在所有灭菌组中被发现。相对丰富的Chloroflexi和Planctomycetes很明显(p < 0.05)高于对照组Acidobacteria很重要(p < 0.05) lower than in GN group. In addition, the relative abundance of芽单胞菌门,actinobacteria., 和Chloroflexi是更高的,而相对丰度proteobacteria.GS组低于YS组。种植组和相应的非种植组之间微生物群落的差异并不重要(p > 0.05). Figure4C显示了门级的分布。
在属水平上,36个样品共鉴定出721个类群。根A. Sinensis.被优先殖民寡养单胞菌,Rhodanobacter和乳酸杆菌. 根据前35个最丰富属的层次聚类构建的热图显示(图。4d)微生物群落结构的不同差异和跨群体的最多占优势群的相对丰富。值得注意的是,相对丰富的Lysobacter和Brevundimonas在甘肃群体中有重大(p < 0.05) higher, whereas that ofRhodanobacter和Gemmatimonas.很明显(p< 0.05)低于云南组。此外,相对丰度鞘粉GN组高于YN组,而粘液杆菌.相对丰富的假单胞菌GS组高于YS组;而那样ramlibacter和鞘粉表现出相反的结果。值得注意的是,相对丰富的鞘粉在所有非灭菌群中都很明显(p < 0.05) higher than in the corresponding sterilized groups.
调节微生物与质量相关代谢产物之间关系的假定机制
的次生代谢产物A. Sinensis.主要由邻苯二甲酸,有机酸和多糖组成,其中邻苯二甲酸苷是主要的生物活性成分,具有多种的结构特征[2,20.].以前,我们发现了假单胞菌,Lysobacter,pseudoxanthomonas., 和Brevundimonas显着(p < 0.05) enriched in GS group than in the YS group. The contents of ligustilide dimer and senkyunolide I in GS group were significantly (p < 0.05)高于YS组,且与年龄呈显著正相关假单胞菌parafulva,Pseudoxanthomonas maxicana, 和Brevundimonas bullata(斯皮尔曼平均 > 0.5)(图。3.b)。其中,Ligustilide二聚体非常显着(p < 0.05) positively correlated withp . parafulva(斯皮尔曼r = 0.82)(补充表S4). 因此我们推测p . parafulvaGS组的邻苯二甲酸含量较高,有利于生长和质量的提高A. Sinensis..
阿魏酸酯等阿魏酸衍生物具有较强的生物活性和较低的毒性。在这项研究中,有机酸及其酯显著(p< 0.05) YS组富集。说明绿原酸、二咖啡酰基奎宁酸和5-阿魏酰基奎宁酸与Gemmatimonadetes细菌WY71(平均Spearman r > 0.8); 阿魏酸松柏醇与大豆产量呈正相关粘液杆菌sp。斯皮尔曼r = 0.85)(图。3.B)(补充表S4)[21.].粘液杆菌根际土壤中富含当归药用植物。例如,M. Herbaticus.SP 11月。[22.],m . polysacchareusSP 11月。[23.),而m . angelicaeSP 11月[24.].与根际,根表面分离A. Sinensis.,根际A. Polymorpha.Maxim。我们推测高度丰富粘液杆菌在ys土壤可能是由于高水平的阿魏酸衍生物。
讨论
确定质量的驱动因素A. Sinensis.在不同土壤条件下
大量报道表明,由于海拔、气候、土壤性质和根际微生物等因素的变化,中药质量与地理差异密切相关。土壤微环境是土壤质量改善的重要因素A. Sinensis.. 传统认为阿魏酸含量越高Z-藁本内酯与更好的药材质量有关答:中国。与Yn和GS组相比,GN组显着显示(p < 0.05) larger dry weight, root diameter, and root length (Table1),绿原酸和Z- 云南群体的脂素是显着的(p< 0.05)高于甘肃组(表2).此外,与云南群体相比,甘肃群中,丁胺醇I,丁基苯甲酸丁酯,丙酸丁酯二聚体的含量较高,而阿魏酸表现出降低趋势(表1,补充表S3.).Zhang等发现非地药区中阿魏酸和levistolide A的含量高于地药区,而senkyunolide I和butyliden酞的含量则相反[19.],同意目前的结论。相反,大规模的田间研究发现根长和头径与阿魏酸的负相关性,根部长度与根部之间存在负关联Z-藁本内酯[25.].但是,评价基数的质量A.sinensis根据他们的外观特征是不准确的。
酚醛酸已被广泛报告为药用植物的关键等化,包括香豆酸,阿魏酸,香草,4-羟基苯甲酸和注射酸,其根除渗出物p .人参,R. glutinosa., 和Pinellia Ternata.[26.].氟尿素,香草醛和阿魏酸是根际土壤中的潜在化感酶化物质,发现显着抑制了生长A. Sinensis.幼苗[27.].云南植物植物中的高含量表明,这些异种化学在很大程度上积聚在云南土壤中,从而降低了生长A. Sinensis..类似地,在灭菌基团中报道了比非灭菌基团的较高含量的含量,这可能证明植物在灭菌基团中的弱生长。
土壤类型对根际细菌组成的影响A. Sinensis.
对土壤细菌群体的大陆级研究表明,土壤细菌社区的丰富和多样性因生态系统类型而异,特别是土壤pH是最大的变异来源[28.].与黄土土和连作土相比,土壤中多糖和葡萄糖含量显著(p< 0.05)更高薯蓣属opposita研究。生长在沙质土壤中的。此外,土壤pH值低可能与连作土壤中半乳糖醛酸含量高有关[29.]. 甘肃土壤呈弱碱性,云南土壤呈弱酸性。值得注意的是,土壤pH值的变化归因于根际和根相关植物微生物群的显著差异。在GN组中,相对丰度鞘粉,溶杆菌,和pseudoxanthomonas.高于Yn组,而那个Rhodanobacter,Gemmatimonas,和粘液杆菌显著降低(p < 0.05) (Fig.4D).与YS组相比,YS组的相对丰度假单胞菌,Lysobacter和pseudoxanthomonas.GS组更高,而Rhodanobacter,ramlibacter,Dyella显示出相反的趋势(图。4D). Wu等人发现相对丰度Lysobacter,pseudoxanthomonas.,假单胞菌,和洋葱显着(p < 0.05)R. glutinosa.与持续的单剖性土壤相比[30.].同样,丰富的有益细菌,包括关节杆菌,洋葱,Rhodanobacter, 和鞘氨醇杆菌与土壤中毒性DiBP的积累呈负相关p .人参[12.].因此,我们推断属Lysobacter,假单胞菌,和伯克德利亚,等潜在的基因或根茎药草的必需微生物。
之前,鞘粉[31.],Lysobacter[32.,33.),而pseudoxanthomonas.[34.,35.]被发现能促进对病虫害的抗性,以及土壤中有害物质的降解。另外,鞘粉通过碳水化合物分泌进入根际的植物吸收[31.].Lysobacter菌株对几种病原菌具有较强的拮抗活性茄丝核菌,尖孢镰刀菌,和Xanthomonas carnpestris.等)(32.].额外的研究表明属假单胞菌属于一组植物生长促进relizobacteria(pgpr)[36.,37.].例如,假单胞菌无论生长期,土壤类型和农业实践如何,作为大蒜根际的关键PGPR。建造的六个假单胞菌菌株显示出强大的植物生长促进效果[38.].这些发现暗示了更强的生长特征A. Sinensis.在甘肃群中可能与这些拮抗微生物的高根根际丰度有关。
土壤微生物对植物根际细菌群落及生长的影响A. Sinensis.
多年种植单一作物,包括粮食作物、蔬菜作物、药用植物等,往往与广泛的连作挑战有关。据推测,土壤灭菌会影响土壤的物理结构和微生物学特性。随后,这触发了养分的释放和土壤病原体的抑制,从而促进植物生长。在本研究中,A. Sinensis.来自灭菌的补充土壤表现出较高的植物性能和增强活性氧气清除酶活性。这些效果可以由培养的微生物群和功能性细菌群的数量和多样性增加来驱动[39.].虽然土壤灭菌可以缓解土壤继承种植失败,但它消除了土着微生物,包括少数病原体,并限制了土壤微生物对宿主植物的潜在有益效果[40]. 一些报道表明,本土微生物在植物生长和农业生产中起着关键作用,在植物次生代谢中具有潜在的优势[41.].例如,用PGPR接种Bacillus flexus.通过修饰其生理和生化状态,促进光合作用,渗透压调节,抗氧化酶活性和治疗Na的调节,通过修改宿主盐度胁迫损伤+/ K.+体内平衡(42.].
在这里,我们发现在无菌土壤中生长的植物生长较差,成活率较低,这可能是由于新种植的土壤(Table .)1).这证实了本土微生物在植物生长发育中发挥重要作用的预测。同样的,glycyrrhiza uralensis灭菌土壤种植呈现较差的植物生长和光合作用。在灭菌土壤中与am(丛枝菌根)的灭菌剂被缺乏缺乏本土微生物群落,因此促进了植物生长和增加的甘草素和液体素内容物[40].此外,我们发现相对丰度鞘粉很明显(p< 0.05)更高the GN group compared to the GS group, whereasramlibacter,Gemmatimonas,和Brevundimonas表现出相反的趋势(图。4d)。相对丰富的鞘粉和缓生根瘤菌而YS组则明显高于YN组Rhodanobacter,拉姆利巴特,和Dyella显着(p< 0.05)低(图。4d)。此外,缓生根瘤菌是一种PGPR,能分泌植物激素和QS代谢产物,调节与宿主的共生关系和对环境变化的适应[43.]. QS缺陷(不能产生肉桂酰HSL)突变体缓生根瘤菌sp。菌株显着表现出来(p < 0.05)与野生型菌株相比,水稻根系定殖潜力降低,植株生长降低[44.].高丰度的有益细菌,包括鞘粉和缓生根瘤菌,在根际未灭菌组,占较好的生长和质量A. Sinensis.在不稳定的群体中。
根际微生物与代谢物的潜在机制关联
许多植物Endophytes可以合成各种次级代谢物,其中一些展示了良好的生物活性,这有助于提高药用植物[45.].接种与生物碱的基因型分离的内心细胞长春花在低生物碱产生基因型的根系中显着改善Ajmalicine和蛇形含量[46.].小分子,包括根系分泌的氨基酸,有机酸,糖和次生代谢物可以促进一些土壤微生物的生长,发起土壤微生物社区的迁移[47.].例如,Falciphora oryzae.通过来自根的感觉信号分子定植拟南芥的根。因此,它可以促进侧根的生长拟南芥通过吲哚衍生物的生物合成[48.].因此,我们推测根际微生物可能与宿主的生长和代谢过程有直接或间接的联系。特别是,PGPR从桔梗[49.],菌根真菌来自p .人参[50.]和放线菌姜黄[51.]显着促进植物生长和抗性。此外,代谢物分析A. Sinensis.根际土壤微生物群落组成在不同类群间表现出相似的变化规律。这些观察表明,在次生代谢物之间可能存在着特定的相关性A. Sinensis.及其根际微生物。
此外,我们的研究发现,GS组中的Ligustilide二聚体和Senkyunolide I的含量较高表现出正相关p . parafulva,P. Maxicana., 和B. Bullata.(平均Spearman r> 0.5)。ys组中的半结合状酸,5-铁合喹酸的含量较高含量与ys组呈正相关Gemmatimonadetes细菌WY71(平均SPEARMAN R> 0.8)。类似地,Coniferyl交叉和阳性关联粘液杆菌sp。斯皮尔曼r = 0.85) (Supplementary Table S4). 值得注意的是,代谢物和物种之间的这种正相关性可能表示代谢物促进了所讨论物种的生长,或者物种产生了这种代谢物[52.].研究表明,特定的微生物可以通过以下方式诱导代谢物的积累:(1)提高与次生代谢物合成相关的基因的表达,(2)激活宿主的防御反应,(3)合成将前体转化为有效成分的关键酶[53.].一项研究发现假单胞菌sp.和泛菌sp。在根际可以刺激植物生长和合成主要酚酸丹参通过其生产丰富的植物激素类型和含量[54.]. 在其他地方,接种Trichoderma asperellum.显着提高了蒿素浓度和干重青蒿L.叶通过近似的青蒿素生物合成至关重要的酶基因,hmgr1.,每秒,广告,CYP71AV1,CPR.,数据库,DXS1型,和DXR1[55.].Dark Septate Endophytes (DSE)可以与甘草建立共生关系,增加其对N、P的吸收、生物量和甘草酸和甘草酸的积累[56.].这p . parafulva基因组Encod一系列抗菌次级代谢产物,包括脂肽,吡啶,苯嗪和氰化氢,并对稻米和大豆植物病原体产生优异的拮抗作用,包括Rhizoctonia solani,Xanthomonas Axonopodis,和格氏伯克霍尔德菌[57.,58.]. 进一步的研究应该探索观察到的种群结构是否随着时间的推移而稳定,或者与动物体内代谢组学或微生物组学组成的变化相关A.中华。此外,学者们应该识别与这些分类相关的植物基因,并广泛地描述它们的功能[7].
结论
本研究探讨了玉米根际微生物群落和代谢物谱的变化A. Sinensis.在不同的土壤微环境下。它进一步提供了一些洞察根际微生物影响了真实的质量改善的机制A. Sinensis.. 目前的研究结果证实,存活率和生长状况A. Sinensis.甘肃土壤处理效果优于云南土壤处理,未灭菌组高于灭菌组。富含有益细菌,包括鞘粉,假单胞菌,Lysobacter,pseudoxanthomonas.在甘肃土壤和增强的增长特征A. Sinensis.来自甘肃土壤证明了根际微生物组是正常增长和发展的必要植物要求。此外,富含GS组的锂硅脂二聚体与相对丰度的显着正相关p . parafulva。富含Ys组的有机酸与相对丰度正相关Gemmatimonadetes细菌WY71和粘液菌综上所述,这些发现为进一步探索根际微生物与生长发育和品质形成的关系奠定了基础。A.中华,及其机制。这种方法是阐明微生物与药用植物生长关联机制的关键。
材料和方法
锅实验现场和设计
从Min visty药用植物生长技术延伸中心的实验基础上取样进行测试土壤(34°22'30“N,104°53'20”E;黑土,pH≈1.0)和药用植物研究所云南农业科学院(26°28°222“N,100°4'34”E;红壤,pH≈6.5),其中蚕豆根尖L.以前种植的作物。土壤样品被运输到甘肃省闽县的石利镇,平均每年降雨量为635.0±17.4毫米,年均温度为5.43±0.71°C,年平均阳光持续时间为2154.3±68.7小时。筛分(2毫米)后,将土壤样品分成二:一部分通过在121℃下高压灭菌4小时,而另一部分未灭菌。这A. Sinensis.闽县西寨镇竹材种草专业合作社提供的苗木(甘肃当贵90-01),在当地传统种植期间进行移植。将实验分为8组,包括4个实验组(GN、GS、YN、YS)和4个对照组(GN-ck、GS-ck、YN-ck、YS-ck)。不植苗土壤为对照组(每组6次重复)。
将土壤放入一个大塑料箱中,与基肥(磷酸二胺10.6g/盆,有机肥23.6g/盆)充分混合。将混合土置于4 ~ 容器口降低6cm并压实。然后,每盆栽植8株幼苗,深度3厘米,间隔4厘米左右。用表层土覆盖种子,并用少量水(约50毫升)湿润播种层。整个试验期间,未喷洒杀菌剂,及时完成人工除草和病虫害防治。当表层土下面2厘米的土层干了以后,我们用同样的水量灌溉每一盆。2018年,A. Sinensis.让植物生长180天。小心地将新鲜植物连根拔起,轻轻摇动,去除松散附着的土壤[30.].收集了根际土壤紧密附着在茎根上。将新鲜植物和土壤样品转移到冰冷料中的实验室中并储存在-80°C等待分析。
DNA提取,PCR扩增和测序
共从8组盆栽试验(GN、GS、YN、YS、GN-ck、GS-ck、YN-ck、YS-ck)中收集36个土壤样品,运往10015(中国)北京诺金生物技术有限公司,使用Ion S5™XL平台进行16S rRNA基因扩增子测序。我们采用CTAB或SDS法提取基因组DNA。采用琼脂糖凝胶电泳检测DNA纯度和浓度。然后用无菌水稀释DNA至1 ng·μL−1.使用简并PCR引物515F和806R扩增细菌16S rRNA基因的可变区V4 (Walters et al. 2016)。样品用2% (w/v)琼脂糖凝胶分离,并根据PCR产物浓度等量混合。混合PCR产物使用GeneJET™凝胶提取试剂盒(Thermo Scientific)进行纯化。简单地说,使用Ion Plus Fragment Library Kit 48 rxns (Thermo Scientific)按照制造商的说明提取16S rRNA基因扩增子。我们在Ion S5™XL平台上对构建的DNA扩增子库进行Qubit量化和基因组库检测后进行测序。
数据处理与分析
使用Cutadapt(V1.9.1)处理来自Ion AmpliSeq的原始测序数据(Martin M.,2011)。去除用于初步质量控制的条形码和引物序列以获得原始读数。为了获得清晰的读取,使用UCHIME算法检测嵌合体序列并将其从数据集中删除。使用Uparse软件(v7.0.1001)将干净的读取数据以97%的序列相似度聚集到操作分类单元(otu)中。通过SSUrRNA数据库的分类注释是使用Mothur(版本1.25.1)和SILVA132进行的(http://www.arb-silva.de/).利用MUSCLE (V 3.8.31)软件进行多序列比对,建立所有OTUs序列的系统发育关系。应用QIIME软件(V 1.9.1)和R软件(V 2.15.3)进行样品多样性分析。α-多样性评价考虑OTU表。使用素食包装对R进行斯皮尔曼等级相关分析。
一种多指标综合评价化学成分A. Sinensis.
方法1:制备次级代谢物分析用样品溶液
将0.2 g干燥粉末(40目)在50 mL玻璃塞锥形瓶中用4 mL 70%甲醇超声处理(100 Hz,25℃)45 min。样品离心(12000r/min,10min)。将上清液直接注射到A热同步子C上18.(2.1 mm × 100 mm, 1.7 μm)柱。流动相为A(0.1%甲酸)和B(乙腈)。优化的洗脱条件为:0 ~ 2 min, 5% ~ 10% B;2 ~ 10min, 10% ~ 40% B;10 ~ 14min, 40% ~ 58% B;14 ~ 20 min, 58% ~ 90% B;20 ~ 22 min, 90% ~ 90% B;22 ~ 22.5 min, 90% ~ 5% B;B.流速为0.4 mL·min−1,柱温保持在35℃,注射体积为2μL。在配备有电喷雾电离(ESI)源的水域Acquiry™Synapt仪上进行质谱检测。ESI-MS光谱在阳性(ESI+)和阴性(ESI−)离子模式通过100到1000da的扫描。优化的条件参考了化学中心期刊上发表的文章[59]。
方法2:制备核苷、碱基和氨基酸分析样品和标准溶液,用于定性和定量分析
引用在molecular上发表的文章[17.].用甲醇/水(9:1,v/v)配制28种参比化合物的混合标准母液,浓度为2′-脱氧鸟苷3.6667 μg·mL−1,胞苷4.3750μg·ml−12'-脱氧胞苷4.9167μg·mL−1,胞苷-5'-单磷酸4.1250μg·mL−1,2’-脱氧腺苷3.9167μg·mL−1,腺苷4.3750μg·ml−1,鸟苷4.0833μg·ml−1,肌苷3.5417 μg·mL−1,尿苷5.2083μg·ml−1,鸟氨酸3.6333 μg·mL−1,亮氨酸15.0000μg·ml−1,iso-亮氨酸15.0000μg·ml−1,苯丙氨酸15.3333μg·mL−1,色氨酸15.8333 μg·mL−1、氨基丁酸19.0000 μg·mL−1、蛋氨酸17.0000 μg·mL−1,脯氨酸18.5000μg·mL−1,缬氨酸17.1667μg·mL−1,反式4-羟基-1-脯氨酸21.0000μg·mL−1,谷氨酸15.6667μg·mL−1,谷氨酰胺13.8333μg·ml−1,天门冬酰胺23.8333 μg·mL−1,酪氨酸15.3333 μg·mL−1,苏氨酸17.3333μg·ml−1,赖氨酸18.5000μg·ml−1,丝氨酸15.5000μg·ml−1,瓜氨酸17.3333μg·mL−1精氨酸32.3333μg·mL−1. 用不同浓度的10%甲醇稀释混合标准溶液,制备校准曲线的工作标准溶液。
方法3:有机酸的制备和邻苯二甲酸分析样品和混合对照溶液
在超声辅助条件下,用20ml甲醇在50ml玻璃塞锥形瓶中提取0.2 g干粉(40目),温度为25℃,提取时间为40min。离心(13000 r/min, 10 min),过滤(0.22 μm膜过滤器),上清液注入UPLC系统进行分析。用甲醇/水(9:1,v/v)配制9种参比化合物的混合标准储备液,其浓度为:绿原酸24.1313 mg·L−1阿魏酸15.8838 mg·L−1,仙客来内酯I 7.5600 mg·L−1,仙客来内酯H 3.0208 mg·L−1,Coniferyl Ferulate 18.0340 Mg·L.−1,senkyunolide a 5.3025 mg·l−1,正丁苯酞199.9788 mg·L−1,z-ligustilide 17.9196 mg·l−1,丁酰萘酞15.0 mg·L−1.通过在不同浓度下用甲醇稀释混合的标准溶液来制备用于校准曲线的工作标准解决方案。分离是在Thermo Syncronis C上完成的18.(2.1毫米) × 100 mm,1.7μm)柱。流动相组成:A(0.1%甲酸)和B(乙腈),梯度洗脱:0 ~ 2分钟,5% ~ 10%硼;2. ~ 10分钟,10% ~ 40%硼;10 ~ 13分钟,40% ~ 40%硼;13 ~ 19分钟,40% ~ 50.8%硼;19 ~ 20分钟,50.8% ~ 90%硼;20 ~ 21分钟,90% ~ 90%硼;21 ~ 23分钟,90% ~ 5%B。柱温保持在35℃;流速为0.4ml·min−1,检测波长为260nm,280nm,320nm和注射体积为2μl。建立样品浓度和峰面积之间的线性回归模型,以产生半原酸,阿魏酸,Senkynolide,Senkyunolide H,Coniferyl,Senkylide A,正丁基苯二甲苯丙胺,Z-Ligustilide和丁基苯甲酸丁二酰基的线性回归方程和线性范围。
统计分析
所有的统计分析都是在R软件(V2.2.3)(R统计基金会,维也纳,奥地利)和IBM SPSS 20(IBM公司,美国)进行的。方差分析(ANOVA)和多重比较分析用于计算平均值和标准差并进行统计检验。利用方差分析和Kruskal-Wallis秩和检验对参数方差进行估计。事后比较采用Tukey诚实显著性差异检验和Wilcoxon配对符号秩检验。R(v3.2.2)用于热图、PCoA和层次聚类。R语言通过R的“vegan”包中的“adonis”函数对微生物进行了比较。前一组的多重零假设检验是使用R's‘vegan’软件包中的‘anosim’或‘adonis’函数实现的。根据Franzosa等人的方法[52.,我们通过自定义方法聚集了不同丰富的功能。然后,对差异丰富的化学成分与差异丰富的微生物进行相关分析(在所有聚类分析中,我们使用Spearman秩相关作为相似性度量,阈值为r = 0.7)。除非另有说明,显著性水平为p < 0.05.
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从相应作者处获得。
缩写
- 中医:
-
中国传统医学
- DiBP公司:
-
邻苯二甲酸二异丁酯
- q:
-
群体感应
- QQ号码:
-
群体淬火
- UPLC-UV-QTOF-MS / MS:
-
超高效液相色谱-紫外-四极杆飞行时间-质量/质量
- OPLS-DA:
-
正交偏最小二乘判别分析
- PCA:
-
主成分分析
- VIP:
-
投影的不同重要性
- OTU:
-
作战分类学单位
- ANOSIM:
-
分析相似之处
- PCOA:
-
主坐标分析
- WUF:
-
加权UniFrac
- 用户单元:
-
unwighted unifrac.
- UPGMA公司:
-
具有算术平均值的未加权对群方法
- 阿多尼斯:
-
级别多元分析方差
- 物料需求计划:
-
多响应排列法
- PGPR:
-
植物生长促进relizobacteria
- 是:
-
外生菌根
- DSE:
-
黑暗的edemophytes.
- ANOVA:
-
Varia分析
工具书类
- 1。
钩住伊犁。当归至当归根源:对欧洲女性的潜在好处是否在翻译中丢失了?复习一下。J Ethnopharmacol。2014;152(1):1-13。
- 2。
魏Wl,zeng r,gu cm,qu y,huang lf。当归在中国 - 培养植物外形,民生生理学,植物科学和化学分析述评。J属植物。2016; 190:116-41。
- 3.
Berendsen RL,Pietersecmj,Bakker Pahm。根际微生物组和植物健康。趋势植物SCI。2012; 17(8):478-86。
- 4.
Mendes R,Kruijt M,De Bruijn I,Dekkers E,Van der Voort M,Schneider Jhm等。解入根际微生物组的疾病抑制细菌。科学。2011; 332(6033):1097-100。
- 5。
Bulgarelli D,Rott M,Schlaeppi K,Van Themaat Ev,Ahmadinejad N,Assenza F等人。揭示结构和装配线索拟南芥root-inhabiting细菌微生物群。大自然。2012;488(7409):91 - 5。
- 6。
Edwards J,Johnson C,Santos Medellín C,Lurie E,Podishetty NK,Bhatnagar S等。水稻根系相关微生物群的结构、变异和组装。美国国家科学院学报。2015;112(8):E911-920。
- 7。
Walters Wa,Jin Z,YoungBlut N,Wallace JG,Sutter J,Zhang W等人。玉米根际的大规模复制现场研究确定遗传微生物。美国国家科学学会主办。2018; 115(28):7368-737。
- 8。
Lakshmanan V、Selvaraj G、Bais HP。功能性土壤微生物组:地上问题的地下解决方案。植物生理学。2014;166(2):689–700.
- 9。
罗磊,郭聪,王磊,张杰,邓磊,罗凯,等。根际微生物群落重组与植物生长的负反馈三七. 前微透镜。2019;10:1597.
- 10。
吴丽,陈杰,穆可汗,王杰,吴宏,肖Z,等。根际真菌群落动态与植物生长的关系地黄在连续栽培条件下再植病害。植物病理学。2018;108(12):1493 - 500。
- 11.
魏旭,王旭,曹鹏,高忠,陈爱杰,韩杰。健康锈菌根际土壤微生物群落的变化。生态学报,2015,34 (5):767 - 774人参发现与锈菌根有关的关键真菌属。生物医学研究国际,2020年;1:1–13.
- 12.
董立,徐茹,张立,程罗,魏g,su h等。流际微生物群落是驱动的人参在不同的生长阶段和生物防治细菌中减轻了重新种植的死亡率。Acta Pharm Sin B. 2018; 8(2):272-82。
- 13。
吴磊,王杰,黄伟,吴华,陈杰,杨勇,等。植物-微生物根际相互作用是由地黄连续单作条件下根系分泌物。Sci代表2015;5:15871.
- 14。
李强,吴勇,王军,杨斌,陈杰,吴华,等。连接短链n酰基高丝氨酸内酯介导的群体感应与再植疾病:一个案例研究地黄.植物科学与技术,2020;
- 15.
安Z,郭F,陈Y,白G,陈Z。植物生长过程中根际细菌和真菌群落的变化当归在高山未开垦的草地土壤中栽培的幼苗。同行J. 2020; 8:E8541。
- 16。
Canarini A,Kaiser C,商人A,Richter A,Week W.原发性代谢物的根除渗出:机制及其在植物对环境刺激的反应中的作用。前植物SCI。2019; 10:157。
- 17。
朱思,郭某,段j,钱d,yan h,sha x等。UHPLC-TQ-MS与多变量统计分析结合,表征核苷,核碱基和氨基酸Angelicae Sinensis.通过不同的干燥方法获得的基迹。分子。2017; 22(6):918。
- 18。
De Vos Rch,Moco S,Lommen A,Keurentjes JJB,Bino RJ,Hall Rd。使用液相色谱法偶联至质谱法未出现的大型植物代谢组。NAT PROTOC。2007; 2(4):778-91。
- 19。
张克,严明,韩S,丛力,王力,张力,等。中药鉴别化学标记的鉴定当归使用基于UHPLC-QTOF-MS / MS的代谢物生长在Geoherb和非Geoherb区域。分子。2019; 24(19):3536。
- 20。
邹杰,陈国栋,赵辉,王旭兴,张志军,曲永波,等。具有新骨架的生物活性邻苯二甲酸三聚体来自:当归及其生产机制。Chem Communce。2019; 55(44):6221-4。
- 21
马建平,郭志斌,金力,李YD。植物化学研究进展当归(奥利弗)迪尔斯。中华医学杂志。2015;13(4):241–9.
- 22
Lee Hr,Han Si,Rhee Kh,旺Ks。粘菌菌杆菌植物园从药用植物的根际中分离得到当归. 国际微生物系统杂志。2013;63(第8部分):2787–93。
- 23
韩思,李宏杰,李浩然,金国强,黄国强。粘杆菌粘土sp.nov.,一种产胞外多糖的细菌,从草本植物的根平面中分离出来当归.INT J SYST EVOL Microbiol。2012; 62(PT 3):632-7。
- 24.
Kim BC,Poo H,Lee Kh,Kim Mn,Kwon Oy,Shin Ks。Mucilaginibacter angelicaesp. 11月。isolated from the rhizosphere of拐芹格言。INT J SYST EVOL Microbiol。2011; 62(PT 1):55-60。
- 25.
Giacomelli N,Yongping Y,Huber F,Ankli A,Weckerle C.当归(oliv。)Diels:价值链对质量标准和标记物的影响和标记化合物阿魏酸和Z-rigustilide。药物。2017; 4(1):14。
- 26.
张B,韦斯顿,顾l,张B,李米,王F等。鉴定植物毒性代谢物释放出来地黄建议他们在形成其改造问题方面的重要性。植物土壤。2019; 441(1-2):439-54。
- 27.
Xin A,Li X,Jin H,Yang X,Zhao R,Liu J等。自诱毒等化学引起的根尖中反应性氧物种的积累 - 一种复位问题的重要因素当归(奥胺。)Diels。indacrops prod。2019; 138:111432。
- 28.
菲勒,杰克逊RB。土壤细菌群落的多样性和生物地理学。美国国家科学学会主办。2006年,103(3):626 - 31所示。
- 29.
马飞,王锐,朱军,张勇,王勇,胡伟,等。多糖的性质比较薯蓣属opposita研究。生长于沙土、黄壤及连作土壤。国际生物医学杂志。2019;126:776-85。
- 30.
吴磊,王杰,吴辉,陈杰,肖卓,秦鑫,等。根际微生物群落组成和功能潜力的宏基因组分析地黄连续单一栽培。国际分子科学杂志。2018;19(8):2394.
- 31。
Takeuchi M,Sakane T,Yanagi M,Yamasato K,Hamana K,Yokota A.植物中分离的细菌的分类学研究:玫瑰鞘氨醇单胞菌sp. 11月。Sphingomonas prunisp. 11月。细颈鞘氨醇单胞菌sp. 11月。和Sphingomonas马里国际细菌系统杂志。1995;45(2):334–41.
- 32。
ExpósitoRG,邮政j,raijmakers JM,De Bruijn I.多样性和活动Lysobacter来自疾病抑制土壤的物种。前微生物。2015; 6:1243。
- 33。
de Bruijn I,Cheng X,De Jager V,ExpósitoRG,Watrous J,Patel N等人。比较基因组学和属的代谢分析Lysobacter. BMC基因组学。2015;16:991.
- 34。
库马尔M、雷瓦西K、卡纳S。生物降解纤维素和木质纤维素废弃物的研究pseudoxanthomonas.sp R-28。碳水化合物聚合物。2015;134:761–6.
- 35。
Patel v,Cheturvedula S,Madamwar D.菲利的菲华德pseudoxanthomonas.从印度古吉拉特邦Amlakhadi运河碳氢化合物污染沉积物中分离到的DMVP2。J危险材料。2012;201–202:43–51.
- 36。
Silby MW, Winstanley C, Godfrey SAC, Levy SB, Jackson RW。假单胞菌基因组:不同和适应性。FEMS Microbiol Rev.2011; 35(4):652-80。
- 37。
Oteino N, Lally RD, Kiwanuka S, Lloyd A, Ryan D, Germaine KJ等。磷酸盐溶解内生植物诱导的植物生长促进假单胞菌隔离。前微生物。2015; 6:745。
- 38。
庄L,李义,王z,yu y,张n,yang c等人。综合界六假单胞菌从大蒜根际微生物群中筛选的菌株促进植物生长。微生物生物技术。2020;14(2):488–502.
- 39。
张新红,郎达元,张恩。土壤灭菌对水稻生长的影响当归连作土壤中植物和土壤微生物种群。国际农业生物学杂志。2016;18(2):458–63.
- 40
Yu M,谢W,张X,张S,王Y,Hao Z等。丛枝菌根真菌可以弥补土着微生物社区的丧失,以支持甘草的生长(glycyrrhiza uralensisFISCH。)。植物。2020; 9(1):7。
- 41。
Castrillo G,Teixeira PJPL,Paredes Sh,法律TF,De Lorenzo L,Feltcher Me,等。根微生物群驱动磷酸盐应激和免疫直接整合。自然。2017; 543(7646):513-8。
- 42。
熊yw,李xw,王tt,贡y,张cm,xing k等。根出渗出物驱动的根际招募植物生长促进的根瘤菌Bacillus flexus.KLBMP 4941及其对沿海烟道的增长效果Limonium sinense.在盐胁迫下。Ecotoxicol环保安全。2020; 194:110374。
- 43。
Bogino PC、Nievas FL、Giordano W。群体感应研究综述缓生根瘤菌. 应用土壤生态。2015;94:49–58.
- 44。
Cai W,Ou F,Staehelin C,Dai W.缓生根瘤菌sp.菌株ORS278促进水稻生长,其群体感应系统是最佳根系定殖所必需的。环境微生物代表2020;12(6):656-66。
- 45
Nicoletti R,Ferranti P,Caira S,Misso G,Castellano M,Di Lorenzo G,等。myrtucomomulone生产的一种应变南方新梭球菌桃金娘内生植物(Myrtus Communis.).世界J Microbiol Biotechnol。2014; 30(3):1047-52。
- 46
Singh S,Pandey Ss,Shanker K,Kalra A. Endophytes通过调节Terpenoid Indole生物碱途径来增强根生物碱和蛇形的生产长春花根。J appl microbiol。2020; 128(4):1128-42。
- 47
植物驱动的微生物选择。土壤植物。2009;321(1 - 2):235 - 57。
- 48.
孙鑫,王宁,李鹏,姜忠,刘鑫,王敏,等。植物内生真菌Falciphora oryzae.感应植物信号后,通过产生吲哚衍生物促进侧根生长。植物生态学报。2010;42(2):358-73。
- 49.
关键词:药用植物,根相关菌,根相关菌引用本文桔梗.微生物环境。2019; 34(4):413-20。
- 50.
Kim YS,Balaraju K,Jeon YH。植物的生物学特性解淀粉芽孢杆菌AK-0和抑制人参根腐烂引起的Cylindrocarpon Destructans..J appl microbiol。2017; 122(1):166-79。
- 51。
Nakaew N,Lumyong S,Sloan Wt,Sugthong R.生物活动和热调抗生素的基因组洞察力链霉菌TM32具有开发新药的潜力。你打开了。2019;8(11):1–7.
- 52。
Franzosa ea,sirota-madi a,avila-pacheco j,Fornetos N,Haiser Hj,Reinker S等人。炎症性肠病中的肠道微生物结构和代谢活性。Nat microbiol。2019; 4(2):293-305。
- 53。
Zhai X,Jia M,Chen L,Zheng CJ,Rahman K,Han T等人。真菌引发诱导的医疗植物中次生代谢物生物合成的调节机制。Crit Rev Microbiol。2017; 43(2):238-61。
- 54。
游慧,杨松,张玲,胡鑫,李欧。酚类化合物生产的推广丹参毛茸茸的根源根源根源根。eng生活sci。2018; 18(3):160-8。
- 55。
翟T,王Y,刘C,刘Z,赵M,常Y,等。Trichoderma asperellum.ACCC30536接种改善了土壤营养和叶蒿生产青蒿.acta physiol植物。2019; 41(4):1-11。
- 56。
他C,王W,Hou J.暗胚内食体真菌的表征,提高有机残留处理下甘草的性能。前微生物。2019; 10:1364。
- 57。
张Y,Chen P,Ye G,Lin H,Ren D,Guo L等。完整的基因组序列pseudomonas paraflefva.PRS09-11288,生物控制菌株产生抗生素苯吡啶-1-羧酸。Curr Microbiol。2019; 76(9):1087-91。
- 58。
Kakembo D,Lee Yh。生物防治性能的分析假单胞菌parafulvaJBCS1880对大豆细菌性脓疱的抑制作用。生物控制。2019;134:72–81.
确认
感谢唐彦鹏提出的宝贵建议,感谢郭正贤协助提供苗木样本,感谢郭正贤允许我们在闵县开展研究当归研究所,我们感谢我们的实验室同事从作物疾病和害虫昆虫的监测和管理重点实验室进行技术支持。
资金
本工作得到了中国国家自然科学基金(第81773848号),财政部的特别(FSUST19-SRI10),2019年佛山 - 香港医生基金(FSUST19-SRI10)和现代技术项目农业产业(汽车-21)。
作者信息
从属关系
贡献
朱立伦和严H参与了研究的设计。朱力进行了实验,数据采集,并起草了手稿。严赫、周格斯、蒋总也对人物生成、文献检索、手稿编辑等方面做出了贡献。刘平、于庚进行了统计数据分析。郭S、吴琴、段嘉对手稿的讨论作出了贡献。所有作者都阅读并批准了最后的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充资料
附加文件1:表S1。
核苷,核碱基和基本氨基酸含量在不同组中的比较A. Sinensis.样本。
附加文件2:表S2。
确定的次生代谢物A. Sinensis.非靶向代谢组学。
附加文件3:表S3。
鉴别的试探性标记A. Sinensis.两组间取样。注:A、GN、YN组;B、 GS和YS组;C、 GN和GS组;D、 YN和YS组。图S1。OPLS-DA评分(A), OPLS-DA模型排列检验(B), S-Plot (C), VIP值(D),用于正离子模式下GN和YN组代谢组学图谱的比较。图S2。OPLS-DA评分(A)、OPLS-DA模型排列检验(B)、S-Plot (C)、VIP值(D)用于正离子模式下GS组与YS组代谢组学图谱的比较。
附加文件4:表S4。
GS组和YS组代表代谢物和代表物种的Spearman秩相关评分。
权利和权限
开放访问本文是根据知识共享署名4.0国际许可证授权的,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供到知识共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用本文
朱磊,严浩,周国强。等。深入了解根际微生物对真品质量影响的机理当归在不同的土壤微环境下。BMC植物BIOL.21,285(2021)。https://doi.org/10.1186/s12870-021-03047-w
已收到:
接受:
发表:
关键词
- 当归
- 根际微生物
- 代谢组学
- 质量
- 相关性