摘要
背景
植物中类黄酮的生物合成主要是在转录水平上通过转录因子调节类黄酮通路中编码酶基因的表达来进行调控的。参与这一调控的转录因子复合物中研究最多的是MYB、bHLH和WD40。然而,在中国水仙(水仙tazettal . var。对),一种流行的单子叶灯泡花,黄酮类生物合成的调节机制仍然尚不清楚。
结果
在这项研究中,与调控复合体相关的基因,NtbHLH1和一个r2r3-mybntmyb6,被中国水仙克隆了。系统发育分析表明NtbHLH1属于bHLH IIIf亚群的JAF13分支,而NtMYB6对原花青素生物合成的阳性调节剂高度同源。两个都NtbHLH1和NtMYB6在水仙基板中表达量最高,那里有原花青素的积累。异位过表达NtbHLH1在烟草中导致花中的花青素积累增加,以及内源性烟草BHLH表达的上调AN1以及类黄酮生物合成基因。相比之下,表达水平守护神基因显著增加NtMYB6转基因烟草。双荧光素酶检测显示,共浸润NtbHLH1和NtMYB6显著激活中国水仙的启动子DFR基因。此外,酵母双杂交试验证实NtbHLH1与NtMYB6相互作用。
结论
我们的研究结果表明NtbHLH1可能通过与NtMYB6的直接互作促进水仙原花青素的积累而发挥调节伴侣的作用。
背景
黄酮类化合物,包括花青素和原花青素(PAs),是主要的代谢物,经常着色,在许多植物的种皮、叶、果实、花和树皮中含量丰富[9].编码类黄酮类生物合成酶的基因的表达由保守的转录因子复合物调节,其由R2R3-MYB,BHLH和WD40组分组成,称为MBW复合物。
BHLH转录因子家族是植物中发现的第二大转录因子家族,其通过含有蛋白质中的两个功能区域而区分。在蛋白质序列的N-末端的大约200个氨基酸参与与MYB转录因子的相互作用。接下来的200个氨基酸与WD40蛋白结合,也可以与RNA聚合酶II接触以产生转录活化[12].其余c端bHLH结构域可与其他bHLH蛋白形成同源二聚体或异源二聚体[16].BHLH转录因子被报道在光信号转导中起作用[34],形成根毛[25,赤霉素信号的转导[21]和黄酮类化合物和花青素的合成[24].
bHLH家族分为26个子家族[30.],提出IIIF亚家族,以调节黄酮类生物合成[15].Booster1.(乐队Red1(R)是在玉米中发现的第一种类黄酮相关bHLH转录因子[8].随后研究了与黄酮类生物合成相关的其他BHLHS,例如PhAN1和PhJAF13在矮牵牛[33,35],ATTT8和AtGLABRA3在拟南芥[14,27),而VVMYC1.和VvMYCA1在葡萄中[17].
IIIf亚科bHLHs可进一步分为两个演化枝:JAF13和AN1演化枝。在茄科植物中,AN1直接参与生物合成基因的激活,而JAF13参与AN1转录的调控[26].在玉米中,过度表达zmlc.可以促进表达吗ZMDFR.和ZMANS.,黄酮类生物合成途径的关键基因,促进花青素的积累[20.].因此,在不同的物种中,特别是在双子叶和单子叶分裂中,bhlh的功能可能不同。
R2R3-MYB蛋白是植物中最大的转录因子,并且参与各种调节功能,包括调节各种次生代谢物[10].R2R3-MYB转录因子具有高度保守的DNA-MYB结构域,该结构域由一系列高度保守的氨基酸序列和间隔序列组成[23].
玉米ZMC1是第一个被证实可以调控花青素生物合成的R2R3-MYB转录因子[29].在植物中发现的能促进类黄酮代谢的MYBs多为R2R3-MYBs。例如,PyMYB10调节梨花青素的生物合成[13],DkMYB4在柿子中,通过直接结合原花青素途径的一些结构基因的启动子来促进原花青素的积累[1,2].vvmybpa1.激活vvlar.和VvANR上调葡萄皮原花青素生物合成的启动子[7].
MYB-bHLH-WD40 (MBW)复合物在类黄酮的生物合成调控中起关键作用。在异种系统中,该复合物的单子叶成员可以激活双子叶中花青素的表达;佩妮转化与ZMC1激活了PhCHSJ和PhDFRA[32].烟草转化zmlc.能激活烟草的表达吗CHS和DFR[28].小苍兰FhGL3L和FhTT8L可与AtPAP1和AtTT2相互作用,从而调节类黄酮生物合成途径[22].
中国水仙(水仙tazettal . var。对),是一种多年生球茎植物,具有很高的观赏价值[39].中国水仙的花色只有黄色或白色。花瓣和花冠中黄酮类化合物主要为黄酮醇,未发现花青素。此外,原花青素主要在基板中积累,但在花中没有发现[36].我们最近的研究发现NtMYB2,NtMYB3和NtMYB5[38]是水仙类黄酮合成的转录抑制因子。然而,中国水仙类黄酮生物合成的激活机制尚不清楚[4,5].
在目前的调查中,jaf13样的bhlh同源物,NtbHLH1和一个R2R3-MYB同源物,NtMYB6从中国水仙中分离得到,并进行了功能特征分析。NtbHLH1和NtMYB6在转基因烟草中被异化表达,增加了黄酮类化合物和花青霉素生物合成基因的表达水平。双荧光素酶测定表明是共同表达NtbHLH1和NtMYB6显着激活了中国水仙的启动子DFR基因(NTDFR.).酵母双杂交(Y2H)分析证实了二者的相互作用NtbHLH1和ntmyb6。我们的结果表明NtbHLH1在黄酮类生物合成中起作用并与之互动NtMYB6直接促进中国水仙的原霉素生物合成。
结果
克隆与序列分析NtbHLH1
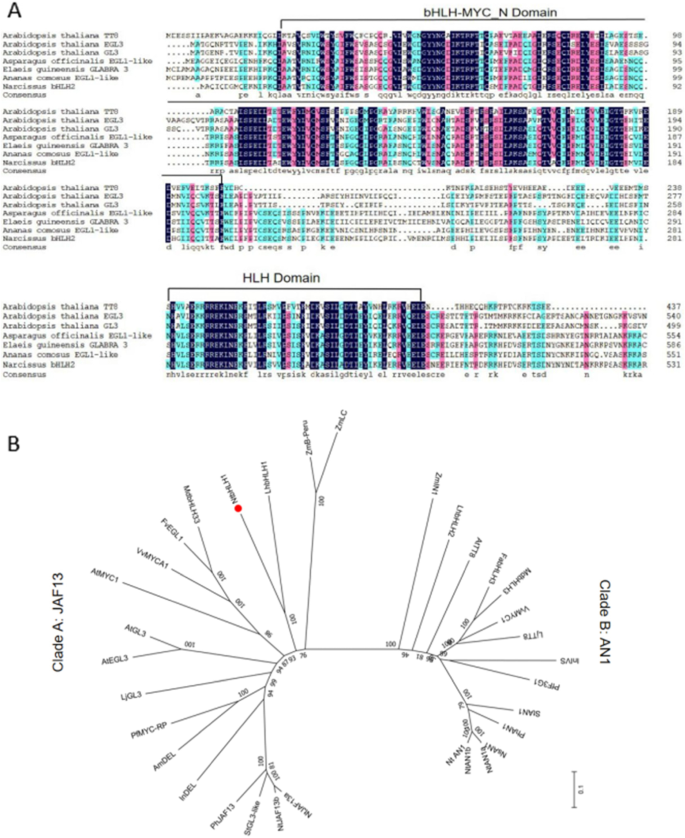
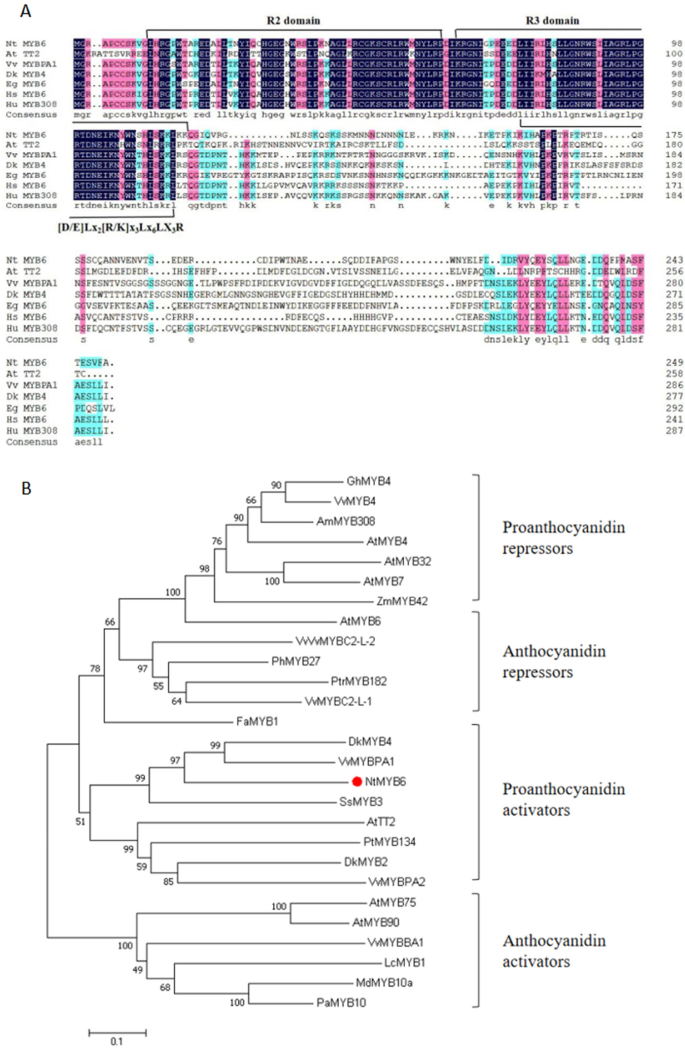
此前,从中国水仙花和基板中生成了基于rna - seq的转录组数据库[36].通过Blast-匹配在该数据库中序列,鉴定了一个潜在的类黄酮相关的BHLH基因并指定为NtbHLH1.的3´end序列NtbHLH1通过3'族获得,然后通过RT-PCR(逆转录PCR)克隆全长的开放阅读框(ORF)(补充图。1) (GenBank编号QDS02912.1)。NtbHLH1其ORF为1896 bp,编码632个氨基酸的多肽。预测的NtbHLH1蛋白包含两个结构域,n端bHLH-MYC_N结构域和c端HLH结构域,这两个结构域在类黄酮相关bhlh型转录因子中是保守的(图)。1A).这两个结构域已经被预测对bHLH蛋白执行转录调节功能非常重要[37].
(一个) NtbHLH1与六种类黄酮相关bHLHs的氨基酸序列比较。在已知bHLH转录因子中,有两个保守结构域(bHLH- myc_n结构域和HLH结构域)调控花青素类黄酮的生物合成。(B)IIIF亚家族植物BHLHS的邻近的系统发育树。节点旁边的数字是从1,000份复制的引导值。树被绘制到刻度,分支长度与用于推断系统发育树的进化距离的分支长度。从Genbank数据库中检索以下推导的氨基酸序列:拟南芥AtTT8 (NP_192720.2), egl3 (NP_001332705.1), AtGL3 (NP_001185302.1);芦笋officinalisEGL1-like (XP_020260845.1);豚鼠GLABRA(XP_010918535.1);菠萝comosusEGL1样(XP_020084606.1);中国水仙NtbHLH1(QDS02912.1)。玉米zmlc.(P13526.1),ZMB-PERU(CAA40544.1),ZmIN1(AAB03841.1);百合杂交司I lhbhlh1(BAE20057.1),lhbhlh2.(BAE20058.1);中国水仙NtbHLH1 (QDS02912.1);家蝇MdbHLH33 (ABB84474.1)、MdbHLH3 (ADL36597.1);Fragaria VESCA子公司。vesca.FvEGL1 (XP_004308377.1);葡萄VvMYC1 (NP_001268182.1),VvMYCA1(NP_001267954.1);拟南芥AtMYC (NP_191957.2),Lotus对虾LJGL3(BAJ10680.1),LJTT8(BAH28881.1);Perilla frutescens.PfMYC-RP (BAA75513.1), PfF3G1 (BAC56998.1);金鱼草majusAmDEL (AAA32663.1);Ipomoea ni.l Indel(XP_019171149.1),INIVS(XP_019197480.1);佩妮x矮牵牛PhJAF13(AAC39455.1),PHAN1(AAG25927.1);茄属植物tuberosumStGL3-like (NP_001275132.1), StAN1 (ALA13578.1);烟草NtAN1a (NP_001312042.1), NtAN1b (NP_001312452.1), NtJAF13a (NP_001311775.1), NtJAF13b (AHY00341.1);Fragaria x ananassa FabHLH3(AFL02463.1);Nicotiana sylvestris.nsan1(np_001289495.1);Nicotiana tomentosiformis.NTAN1(NP_001289454.1)
系统发育树分析表明,属于亚组IIIF的类黄酮相关的BHLH被清楚地分为两种枝条,JAF13样的疏水板和AN1样疏水膜(图。1b)。JAF13样的思工包括ATEGL3,ATGL3(拟南芥),PhJAF13 (佩妮x混合)及LhbHLH1 (百合杂交司我),而an1样枝包含ATTT8(拟南芥),NtAN1a,NtAN1b(烟草) 和lhbhlh2.(百合杂交司我).NtbHLH1被归入进化支A,靠近lhbhlh1..
的表达模式NtbHLH1在中国水仙
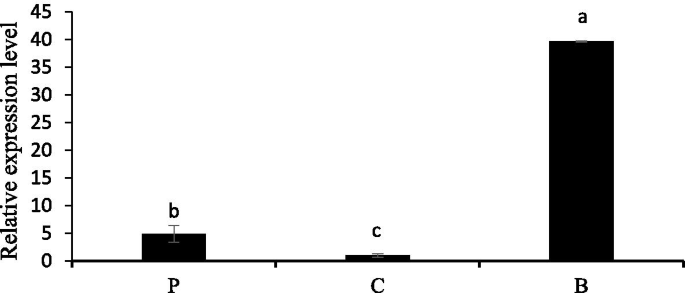
表达模式NtbHLH1采用实时荧光定量PCR (Quantitative real-time PCR)对水仙不同组织进行定量分析。2).的表达水平NtbHLH1基板中最高,与花瓣和冠相比。在之前的研究中,这个组织已经被证明可以积累原花青素[36].这结果表明NtbHLH1可能在基板中黄酮类化合物的生物合成中发挥作用。
表达的NtbHLH1在烟草
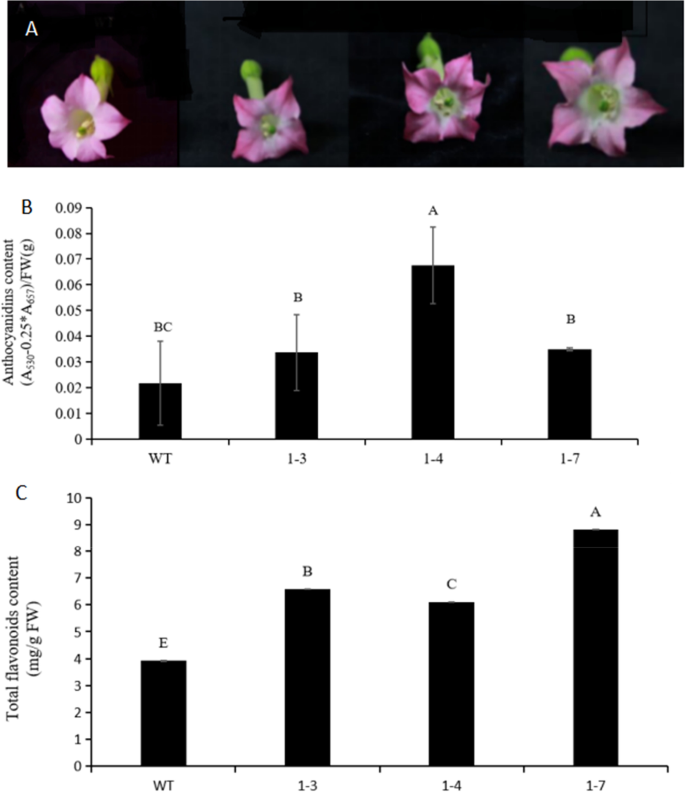
转基因烟草过度表达NtbHLH1与对照相比,在花瓣中的红色外观增加(图。3.A).转基因株系所有花的花青素含量均高于野生型烟草。3个转基因株系的花花青素含量比对照高1.7 ~ 3.24倍。3.B).与对照相比,3个转基因株系的花中总黄酮含量显著增加(图2)。3.C)。
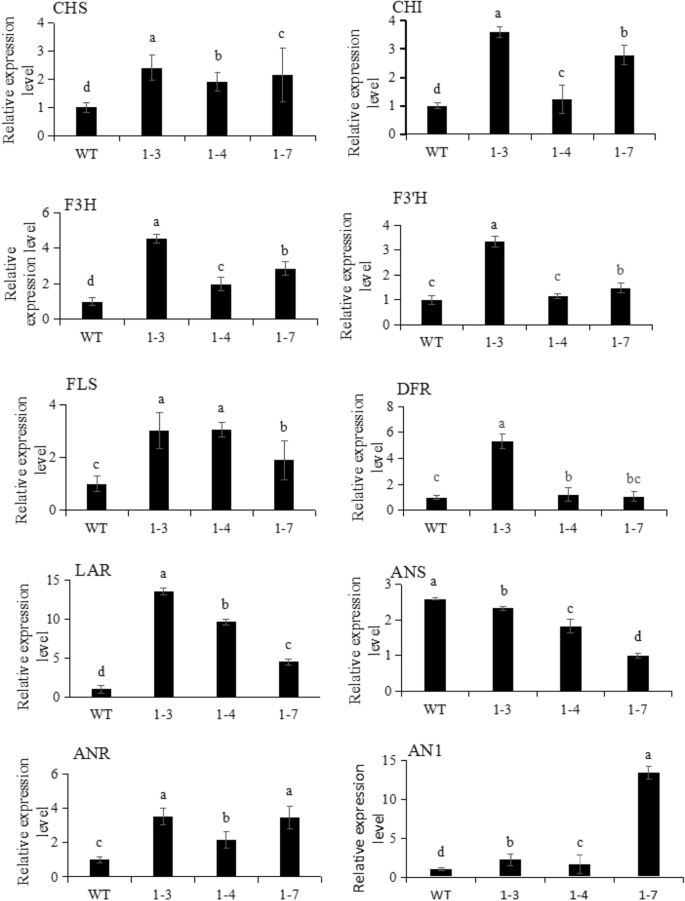
检查异位过表达的影响NtbHLH1在编码烟草类生物合成途径的内源性烟草基因上,进行QRT-PCR分析。结果表明过度表达NtbHLH1影响烟草类黄酮生物合成基因的转录物水平。烟草的表达bhlhAN1和结构基因CHS,FLS的,守护神,F3H,DFR,ANR差异(图。4).早期通路基因的转录水平CHS达到1.3〜2.3倍,途径晚期基因守护神比对照高4.5 - 13.5倍。这些数据表明NtbHLH1在转基因烟草植物中,不仅促进花瓣中花青素的合成,而且促进类黄酮的合成。
的克隆与序列分析NtMYB6
因为NtbHLH1主要表达于水仙基板,我们分析了RNA-Seq数据库[36]对于这种BHLH的潜在转录伙伴。鉴定了R2R3-MYB,其在基底板中也显示出更高的表达水平。克隆该R2R3-MYB基因(补充图。3.)和命名NtMYB6.序列分析表明NtMYB6全长768 bp,编码256个氨基酸的多肽(GenBank号KY645961)。蛋白质序列比对NtMYB6和其他R2R3-MYBS表明NtMYB6在n端包含保守的R2和R3 DNA结合域(图。5一种)。
(一个)氨基酸序列比较NtMYB6和九个r2r3- mybs。三个保守域(R2域,R3域和[D / E] LX2(R / K) x3.Lx6LX3.R)展露无遗。(B)邻近植物R2R3-MYB序列的邻近的系统发育树。节点旁边的数字是从1,000份复制的引导值。树被绘制到刻度,分支长度与用于推断系统发育树的进化距离的分支长度。从Genbank数据库中检索以下推导的氨基酸序列:中国水仙NTMYB6(KY645961.1);陆地棉GHMYB4(XP_016708004.1);金鱼草majusAMMYB308(P81393.1);拟南芥AtMYB4(NP_195574.1),ATMYB7(NM_127224.6),ATMYB32(NP_195225.1),ATMYB6(NP_192684.1),ATTT2(NP_198405.1),ATMYB75(NM_104541.4),ATMYB90(NM_105310.4);玉米ZmMYB42 (HQ858694.1);葡萄VvMYBC2-L-1 (NP_001268133.1), VvMYBC2-L2 (GQ903730.1), VvMYB4 (NP_001268129.1), VvMYBPA1 (NP_001268160.1), VvMYBPA2 (ACK56131.1), VvMYBBA1 (XP_010664911.1);草莓属x ananassaFaMYB1 (AF401220.1);佩妮x矮牵牛PhMYB27 (AHX24372.1);颤杨x颤杨PtrMYB182 (AJI76863.1);Diospyros柿子DkMYB2 (BAI49719.1), DkMYB4 (BAI49721.1),Solenostemon scutellarioidesSsMYB3 (EF522163.1);Populus Temuloides.PtMYB134 (ACR83705.1);荔枝中华人员LCMYB1(KY302802.1);马吕斯x有明显MDMYB10A(DQ267898.1);扁桃PaMYB10 (KR259845.1),芙蓉Syriacus.HsMYB6 (KAE8700978.1);Herrania umbraticaHuMYB308 (XP_021280377.1);(BAI49721.1);Elaeis guineensisEGMYB6(XP_019705406.1)
系统发育分析表明NtMYB6被置于R2R3-MYB蛋白的蛋白质中,包括DKMYB4,VVMYBPA1和ATTT2,该attt2已经表征为原霉素生物合成相关基因表达的调节激活剂,表明NtMYB6可能作为水仙原花青素生物合成的正调控因子(图。5b)。
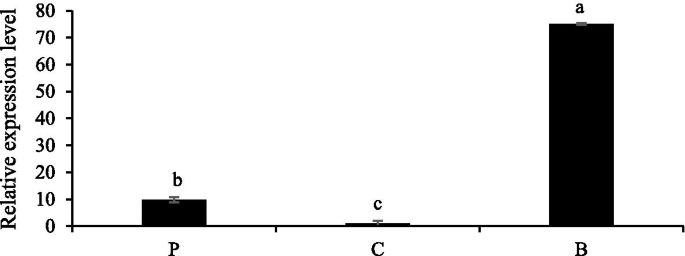
表达NtMYB6采用实时荧光定量rt - pcr技术检测中国水仙中相关基因的表达。结果证实了NtMYB6基底板中的表达更高。表达水平NtMYB6花被和花冠的数量显著降低(图。6).
表达的NtMYB6在烟草
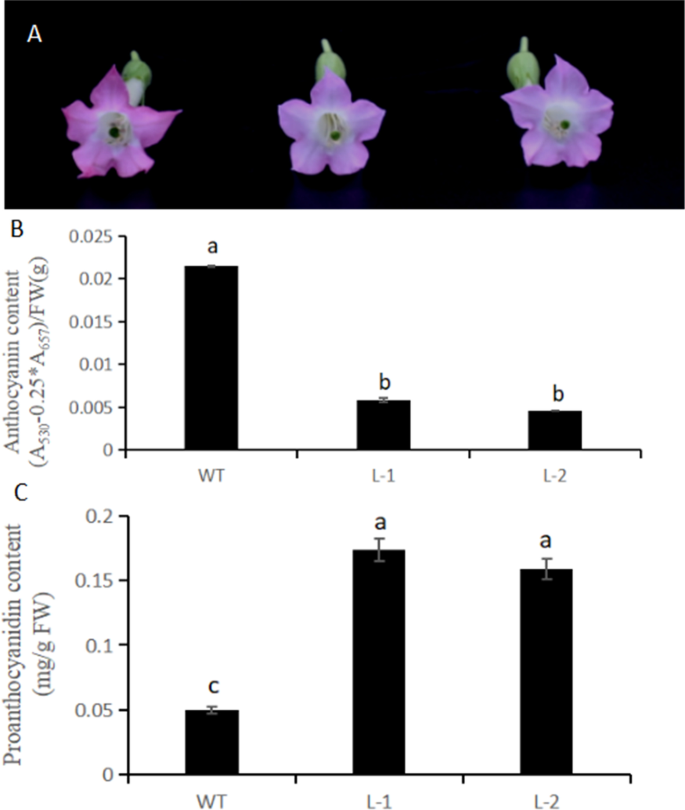
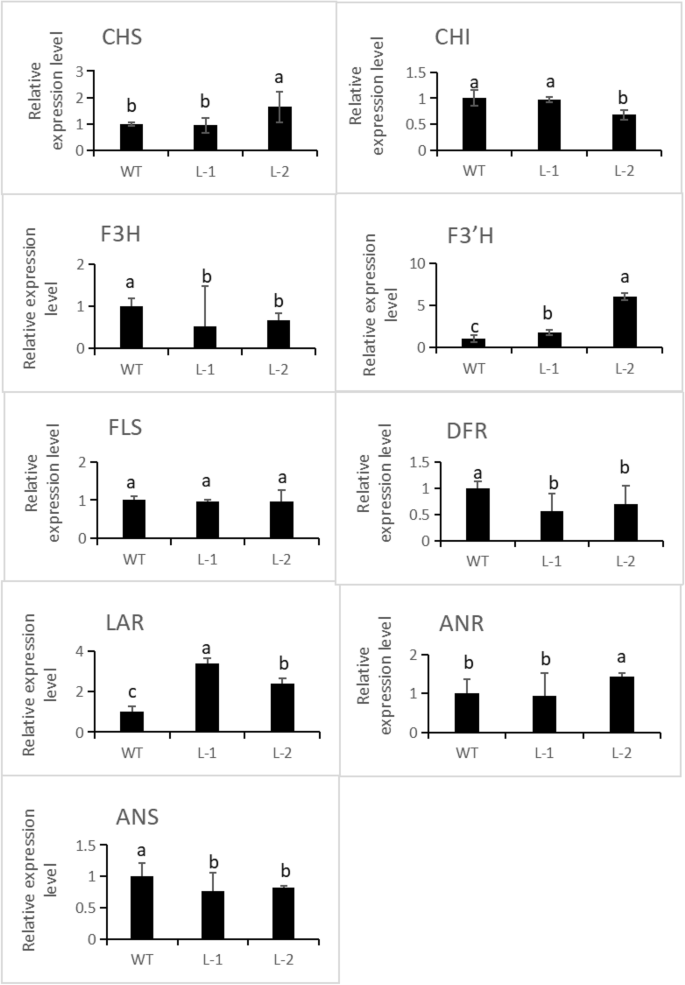
与野生型烟草相比,烟草的花表现出NtMYB6基因显示颜色下降(图。7一种)。在转基因花中,花青素含量下降,原霉素含量显着增加(图。7B, C). QRT-PCR分析显示,烟草F3'H和LAR的表达水平显著上调,而其他类黄酮通路基因的表达水平未受影响或下调(图1)。8).
双荧光素酶检测
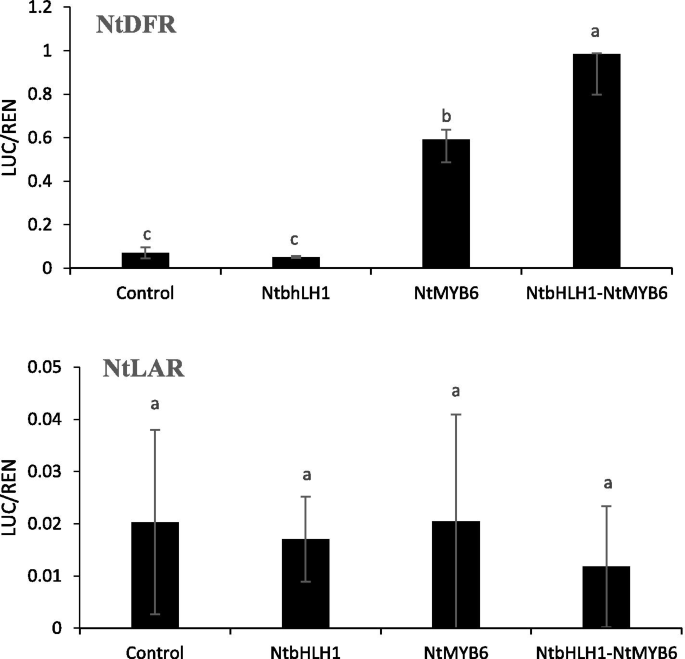
双荧光素酶系统农杆菌肿瘤术-infiltrated.烟草benthamiana以叶为研究对象,考察了叶的功能NtbHLH1和NtMYB6.NtbHLH1和NtMYB6与水仙的启动子一起独立或共同渗透到烟叶中DFR或守护神荧光素酶的融合。人们发现NtbHLH1独自没有激活NTDFR.然而,推动者,NtMYB6单独可以激活NTDFR.启动子(无花果。9).Co-infiltration两NtbHLH1和NtMYB6在…方面有显著的增长NTDFR.启动子活性,导致启动子活性增加约14倍NTDFR.与对照组相比增加了8倍NtMYB6一个人。NtbHLH1和NtMYB6单独或共渗对其影响不大NtLAR启动子(无花果。9).这些结果表明NtMYB6介导的激活NTDFR.启动子被bHLH TF增强NtbHLH1.
NTBHLH1和NTMYB6之间的蛋白质 - 蛋白质相互作用
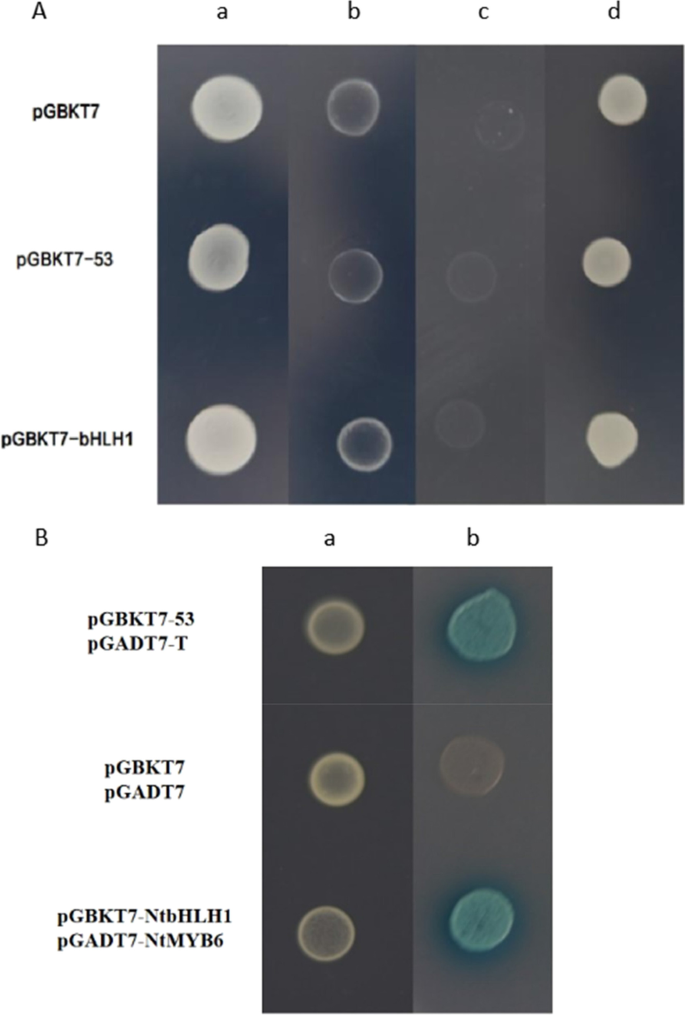
采用酵母双杂交(Y2H)研究二者的相互作用NtbHLH1和NtMYB6.首先,测试自动激活NtbHLH1.自动激活试验结果表明,pGBKT7-NtbHLH1在SD/- trp /- ade和SD/- trp /- his培养基中不能生长,在SD/- trp /X-ɑ- gal培养基中也不会变蓝。这表明NtbHLH1不具有自动激活活性(图。10A) pGADT7和pGBKT7空载体作为阴性对照。用BD-NtbHLH1和AD-NtMYB6转化的酵母细胞在SD/- trp /- leu和SD/- trp /- leu /- ade /- his培养基上均能生长,在SD/- trp /- leu /- his /- ade /X-ɑ- gal培养基上细胞颜色呈蓝色。相反,阴性对照在SD/-Trp/-Leu培养基上生长良好,而在SD/-Trp/-Leu/-Ade/-His培养基上生长不良。10B).这些结果证实了NtbHLH1和NtMYB6之间的蛋白相互作用。
讨论
NtbHLLH1是bHLH转录因子,调节类黄酮生物合成
在这项研究中,我们分离了BHLH转录因子NtbHLH1从中国水仙。NtbHLH1具有保守的bHLH-MYC_N端结构和HLH结构域,属于IIIf亚家族的JAF13分支,包括PhJAF13 (矮牵牛织布达), ZmLC (玉米)和AtGL3 (拟南芥).在双子叶植物中,JAF13-like bHLH与R2R3-MYB蛋白相互作用,促进AN1-like bHLH的表达,然后AN1与R2R3-MYB相互作用,激活类黄酮途径中生物合成基因的表达[3.].在拟南芥中,JAF13-likeAtGL3在花青素合成早期表达,并首次形成MBW复合物PAP1-GL3-TTG1。这种MBW复合物激活的表达ATTT8,然后另一个包含AtTT8的MBW复合物激活类黄酮生物合成相关结构基因的表达[6].
异位表达NtbHLH1在烟草中,它表明它用作黄酮类生物合成的阳性调节剂。表达NtbHLH1通过激活编码花青素相关酶的烟草基因和BHLH来增加转基因烟草瓣的花青素和总黄酮含量AN1,建议NtbHLH1可能同时调节AN1和结构基因直接。在单子圈子中,JAF13样BHLH可以与MYBS相互作用,以直接促进类黄酮生物合成途径中结构基因的表达。例如,小苍兰·雪茄FhGL3和FhTT8可以激活的转录atdfr.与AtPAP1结合的FhGL3的激活能力高于与AtPAP1结合的FhTT8 [20.].我们的结果表明NtbHLH1可能具有类似于单子圈子中的JAF13样BHLH的功能。
NTMYB6是原霉素生物合成的激活剂
系统发育分析表明,NtMYB6与R2R3-MYB转录因子DkMYB4和VvMYBPA1高度相似,这两种转录因子已被证明可以激活原花青素的生物合成。的异位过度表达vvmybpa1.在拟南芥在根,幼杆子和顶端商品中诱导原花青素的生物合成升高。瞬态表达测定揭示了能力vvmybpa1.激活原花青素特异性分支点基因VvANR和VvLAR1[7].异位表达DkMYB4诱导猕猴桃愈伤组织中原花青素的积累并直接激活DkANR转录[1,2].异位表达NtMYB6在烟草中激活守护神基因和转基因花中的PA积累暗示NtMYB6在原花青素的生物合成中可能具有类似的调节功能。
NTBHLH1与NTMYB6交互以激活NTDFR.表达并促进原花青素的生物合成
NtbHLH1研究发现,与中国水仙的花瓣和花冠相比,水仙基板中bHLH的表达水平更高。在同一组织中,表达水平NtMYB6也升高。以往的研究表明,原花青素主要积聚在中国水仙的基板中[36].因此表达概况NtbHLH1和NtMYB6与花青素积累的模式呈正相关。酵母双杂交实验证实了NTBHLH1与NTMYB6的相互作用。原花青素的积累可能是因为表达NTDFR.和NtLAR在基底板上显著上调[36].双荧光素酶报告基因检测显示NtbHLH1,NtMYB6激活的表达NTDFR.更重要的是,在这个异源系统中,这种组合并没有激活NtLAR.然而,异位表达NtMYB6在烟草中可以激活烟草的表达G.东北偏东。其他因素也可能与此有关NtbHLH1与NtMYB6促进水仙激活守护神基因。其中一个可能的原因是NTDFR.花瓣和花冠的表达水平低是什么NtbHLH1和NtMYB6.
我们的结果与先前的工作一致,显示BHLH和MYB蛋白质在原霉素生物合成中具有必要的作用。尽管NTBHLH1是像BHLH这样的JAF-13(Quattrocchio等,1998B; D'Amelia等,2014),它可以形成MBW复合物,其与R2R3-MYB直接在中国水仙中调节黄酮类生物合成的结构基因在其他单胶质细胞中看到。只有一个类化合物相关的BHLH在中国水仙中的特征是。无论NtbHLH1与其他R2R3-MYBs相互作用激活花中黄酮醇生物合成,有待进一步研究。
结论
我们已经证明了这一点NtbHLH1作为类黄酮生物合成的正调控因子NtMYB6正调控原花青素的生物合成。NtbHLH1可能与NtMYB6形成MBW复合物,调控其表达NTDFR.直接用在中国水仙花上。
方法
植物材料
中国水仙品种“金湛银泰”在本实验中使用。收集花瓣,电晕和基板,用于RNA提取。烟草(红花烟草)用于稳定的转化。中国水仙品种“金湛银泰”和烟草种子是从福建农业和林业大学园艺植物遗传学和育种研究所获得的。
基因克隆和序列分析
使用Up Plus RNA Kt (TransGen Biotech, Beijing, China)从基板中提取总RNA。第一链cDNA合成使用PrimeScript™RT试剂试剂盒与gDNA Eraser (Perfect Real Time) (Takara, BeiJing, China)。引物的序列与OligdT CCAGTGAGCAGAGTGACGAGGACTCGAGCTCAAGCTTTTTTTTTTTTTTTTT。的全长开放阅读框(ORF)NtbHLH和NtMYB3´RACE。3´RACE PCR三轮扩增的特异性引物见补充表1.在获得3'末端后,使用基因 - 特定前进和反向引物从cDNA中通过RT-PCR扩增全长ORF(补充表1).总共25μLPCR混合物(Yesen,上海,中国)含有12.5μL2×Canace®PCR缓冲液,1μLcDNA,每次底漆和8.75μL双蒸馏水。如下进行PCR反应:预热在98℃下,3分钟,98℃下的34个循环30秒,退火温度为60〜65℃,1分钟,72℃为72℃,然后延长72℃5分钟。
氨基酸序列NtbHLH1和NtMYB6采用带有默认参数的DNAMAN6.0软件(Lynnon Corporation, San Ramon, CA, USA)进行对齐。利用IIIf亚群转录因子中类黄酮相关bHLHs和类黄酮相关r2r3 - myb的全蛋白序列,使用MEGA7软件和默认参数建立系统发育树。引导是1000年。
实时QPCR分析
表达NtbHLH1和NtMYB6根据生产商的说明,使用Light cycler®480 real time PCR(罗氏诊断公司,印第安纳波利斯,in, USA)和SYBR Premix Ex Taq (Takara,北京,中国)对中国水仙的不同组织进行实时qRT-PCR分析。中存在的条件如下:一个周期的变性(95 C, 30年代),然后40放大周期(95℃,10年代,60℃,30年代),和一个信号采集(72℃,30年代)。Ntactin基因的相对表达水平估计作为内部标准(补充表1).采用比较Ct法测定基因表达水平。每个样品进行了三次技术和生物学重复。
病媒构建和烟草转化
植物表达载体使用融合高清烫箱套件(Takara,北京,中国)构建。向前底漆加入EcoR酶切位点和反向引物后III限制性位点(补充表1).将该序列克隆到表达载体pSAK277中。将构建的表达载体pSAK277-NtbHLH1和pSAK277-NtMYB6转移到载体中农杆菌GV3101采用冻融法。
烟草的稳定变换使用叶片光盘方法[18].在添加100 mg·L的MS基础培养基上筛选转化植株−1然后通过RT-PCR进行验证。然后将转基因烟草植株转移到混合土壤中,使其在正常条件下适应。
总花青素的提取与定量
样品采集于转基因烟草鲜花中心。样品在液氮中粉状,转移到一个含有10ml甲醇(1%盐酸)的干净管中,在室温下保存过夜。提取液均质并在13000 rpm (10 min, 4°C)下离心,上水相在530、620和650 nm处用分光光度计进行分光光度定量。相对花青素含量测定公式如下:OD = (A530−A620)−0.1(A650−A620)。总花青素浓度测定的摩尔消光系数为46,200 mol·cm−1[40].
酵母两个杂交测定
Y2H实验使用pGADT7(含GAL4激活域(AD))和pGBKT7(含GAL4 dna结合域(BD))。的ORF片段NtMYB6和NtbHLH1插入PGADT7和PGBKT7,单独的,产生AD-NTMYB6和BD-NTBHLH1构建体。使用PEG / LIAC法单独转化BD-NTBHLH1或与Ad-NTMyB6一起转化为酵母菌株Y2HGold。自动激活活动NtbHLH1进行了测试。在缺乏亮氨酸和色氨酸(SD/-Leu/-Trp)的SD培养基上筛选共转化菌落,在缺乏腺嘌呤、组氨酸、亮氨酸和色氨酸(SD/-Ade/-His/-Leu/-Trp)的四重dropout SD培养基上筛选共转化菌落。为了进一步证实二者之间的相互作用,用X-α-Gal测定β-半乳糖苷酶活性。
双荧光素酶检测
中国水仙LAR基因(NtLAR)启动子序列[31]及DFR基因(NtDFR) [19],分别克隆并插入载体pGreenII 0800-LUC的多个克隆位点,作为报告基因盒。pSAK277 -NtbHLH1和pSAK277 -NtMYB6由花椰菜马赛克病毒(CAMV)推动35s推动器用作效应盒。用β-葡糖醛酸酶(GUS)基因的PSAK277用作阴性对照。进行双荧光素酶测定法烟草benthamiana叶根据上一份报告[4,11].将融合菌重悬于渗透缓冲液(10 mM MgCl2、10 mM MES、200µM acettosyringone)中,室温下不摇匀培养3 h后再渗透。使用多功能酶标仪(Infinite M200 PRO,奥地利TECAN)测定萤火虫荧光素酶(LUC)相对于Renilla荧光素酶(REN)的值。
数据和材料的可用性
序列NtbHLH1已存入NCBI的GenBank,加入号为。QDS02912.1 (https://www.ncbi.nlm.nih.gov/protein/QDS02912).序列NtbMYB6已存入NCBI的GenBank,加入号为。KY645961.1 (https://www.ncbi.nlm.nih.gov/nuccore/ky645961.).本研究期间生成或分析的所有其他数据都包含在本公布的文章中。
缩写
- 不是:
-
花青素和花青蛋白
- MBW:
-
MYB-bHLH-WDR
- Y2H:
-
酵母2台混合动力
- 子:
-
开放阅读框
- rt - pcr:
-
实时聚合酶链反应
- 存在:
-
定量实时聚合酶链反应
- WT:
-
野生型
- 格斯:
-
β葡萄糖醛酸酶
- TFS:
-
转录因子
参考文献
- 1.
Akagi T, Ikegami A, Tsujimoto T, Kobayashi S, Sato A, et al.;DkMyb4是一个myb转录因子,参与柿子原花青素的生物合成。植物杂志。2009;151:2028-45。https://doi.org/10.1104/pp.109.146985.
- 2.
Akagi T,Ikegami A,Tsujimoto T,Kobayashi S,Sato A. Dkmyb4是柿子果实原花青素生物合成中的MYB转录因素。植物理性。2009; 4:2028-45。
- 3.
张海涛,张海涛,张海涛,等。一个保守的转录激活因子和抑制因子的网络调节花青素色素沉着。植物细胞。2014;26:962 - 80。https://doi.org/10.1105/tpc.113.122069.
- 4.
王光华,吴建军,王光华,等。中国水仙R2R3-MYB基因NtMYB2异位过表达抑制烟草花青素合成。分子。2018;23:781。https://doi.org/10.3390/molecules23040781.
- 5.
姚华,周鹏,周鹏,等。水仙R2R3-MYB基因NtMYB3调控类黄酮的生物合成。国际分子生物学杂志。2019;20:5456。https://doi.org/10.3390/ijms20215456.
- 6.
张志强,张志强,张志强,等。TT2、TT8和TTG1协同指定拟南芥中BANYULS的表达和原花青素生物合成。植物j . 2004; 39:366 - 80。https://doi.org/10.1111/j.1365-313X.2004.02138.x.
- 7.
Bogs J, Jaffé FW, Takos AM, Robinson ARWA。葡萄转录因子VvMYBPA1调控果实发育过程中原花青素的合成。植物杂志。2007;3:1347 - 61。
- 8.
玉米花青素途径的两个调控基因是同源的:利用R基因组序列分离B基因。植物细胞。1989;1:1175 - 83。https://doi.org/10.1105/tpc.1.12.1175.
- 9.
原花青素——类黄酮研究的最终前沿?新植醇。2005;165:9-28。https://doi.org/10.1111/j.1469-8137.2004.01217.x.
- 10.
杜博斯,斯特拉克,格罗特沃尔德等。拟南芥MYB转录因子的研究。植物生态学报。2010;15:573-81。https://doi.org/10.1016/j.tplants.2010.06.005.
- 11.
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S,等。苹果果实的红色着色是由于MYB转录因子MdMYB10的活性。植物j . 2007; 49:414-27。https://doi.org/10.1111/j.1365-313x.2006.02964.x.
- 12.
Feller A, Machemer K, Braun EL, Grotewold E. MYB和bHLH植物转录因子的进化和比较分析。植物j . 2011; 66:94 - 116。https://doi.org/10.1111/j.1365-313x.2010.04459.x.
- 13.
冯绍峰,王颖,杨胜,徐勇,陈晓霞。梨花青素的合成受r2r2 - myb转录因子PyMYB10的调控。足底。2010;232:245-55。https://doi.org/10.1007/s00425-010-1170-5.
- 14.
Feyissa DN, Vdal TL, Olsen KM, Slimestad R, Lillo C.拟南芥莲座期叶片氮素缺失诱导花青素积累所必需的外源基因是GL3,而非EGL3。J Exp Bot. 2009; 230:747-54。https://doi.org/10.1007/s00425-009-0978-3.
- 15.
赫姆马。植物中基本螺旋环 - 螺旋转录因子家族:蛋白质结构和功能多样性的基因组研究。mol Biol Evol。2003; 20:735-47。https://doi.org/10.1093/molbev/msg088.
- 16.
Hichri I,Barrieu F,Bogs J,Kappel C,Delrot S等人。黄酮类生物合成途径转录调控的最新进展。J Exp Bot。2011; 62:2465-83。https://doi.org/10.1093/jxb/erq442.
- 17.
陈志强,陈志强,陈志强,等。碱性的Helix-Loop-Helix转录因子MYC1参与调控葡萄藤类黄酮生物合成途径。摩尔。2010;3:509-23。https://doi.org/10.1093/mp/ssp118.
- 18.
玫瑰RB,Fry Je,Hoffmann NL,Eichholtz D,Rogers SG等人。一种将基因转移到植物中的简单和一般方法。科学。1985; 227:1229-31。https://doi.org/10.1126/science.227.4691.1229.
- 19.
姚H,周P,粉丝,Sun R,Muhammad A等人。水仙花塔塔塔瓦斯的DFR基因启动子克隆与功能分析。中国人。Chin J App Environ Biol。2019; 25:993-8。https://doi.org/10.19675/j.cnki.1006-687x.2018.10009.
- 20.
黄志,赵涛,范华,王宁,郑胜,等。低温下上调NtAN2的表达是转基因烟草(nictiana tabacum l.)幼叶花青素积累的必要条件。中国基因工程杂志。2012;39:149-56。https://doi.org/10.1016/j.jgg.2012.01.007.
- 21.
Lee S,Lee S,Yang K,Kim Y,Park S等人。Pre1及其同源基因的过表达激活拟南芥依赖于吉布林蛋白依赖性反应。植物细胞生理。2006; 47:591-600。https://doi.org/10.1093/pcp/pcj026.
- 22.
李勇,单旭,高锐,杨胜,王胜等。小苍兰两个IIIf分支bhlhs在拟南芥异位表达时在类黄酮合成和表毛形成中发挥不同的作用。科学报告。2016;6.https://doi.org/10.1038/srep30514。
- 23.
杨志强,王志强,王志强,等。植物MYB转录因子的研究进展。遗传学趋势 :TIG。1997; 2:67 - 73。https://doi.org/10.1016/s0168 - 9525 (96) 10049 - 4.
- 24.
Matus JT,Poupin MJ,CañónP,Bordeu E,Alcalde Ja,等。与黄酮合成相关的WDR和BHLH基因的分离(血管血管血管血管基因。植物mol biol。2010; 72:607-20。https://doi.org/10.1007/s11103-010-9597-4.
- 25.
Menand B,Yi K,Jouannic S,Hoffmann L,Ryan E,等。一种古老的机制控制了在土地植物中具有生根功能的细胞的发展。科学。2007; 316:1477-80。https://doi.org/10.1126/science.1142618.
- 26。
在茄科植物中,bHLHs的层次结构赋予了花青素调节复合物不同的靶向特异性。植物学报。2015;66(5): 1427 - 1436。
- 27。
等。TT8基因编码拟南芥中DFR和BAN基因表达所需的基本螺旋-环-螺旋结构域蛋白。植物细胞。2000;12:1863 - 78。https://doi.org/10.1105/tpc.12.10.1863.
- 28。
Pattanaik S,Kong Q,Zaitlin D,Werkman Jr,谢Ch,等。烟草中花组织特异性R2R3 MYB调节剂的分离和功能表征。Planta。2010; 231:1061-76。https://doi.org/10.1007/s00425-010-1108-y.
- 29。
PAZ-ARES J,GHOSAL D,WIIINAND U,Peterson PA,Saedler H. Zea的调节C1座位在Myb ProTo-oncogogene产品的同源性和与转录活化剂的结构相似性编码。Embo J. 1987; 6:3553-8。https://doi.org/10.1002/j.1460-2075.1987.tb02684.x.
- 30.
植物中碱性螺旋-环-螺旋蛋白的起源和多样性。生物学报2010;27:862-74。https://doi.org/10.1093/molbev/msp288.
- 31.
周鹏,范宇,姚玉华,彭杰,曾林。中国水仙LAR基因启动子的克隆及功能分析。植物学报2019;39:1353-60。https://doi.org/10.7606/j.issn.1000-4025.2019.08.1353.
- 32.
4 attrocchio F, Wing JF, Leppen H, Mol J, Koes RE.调控花青素色素沉着的基因在植物物种中是功能保守的,并有不同的目标基因集。植物细胞。1993;5:1497 - 512。https://doi.org/10.1105/tpc.5.11.1497.
- 33.
bHLH和MYB结构域蛋白的分析:种特异性调控差异是由靶花青素基因的不同进化引起的。植物j . 1998; 13:475 - 88。https://doi.org/10.1046/j.1365-313x.1998.00046.x.
- 34.
Roig-Villanova I,Bou-Torrent J,Galstyan A,Carretero-Paulet L,Portoles S等人。阴影避免和生长素反应的相互作用:两种新型非典型BHLH蛋白的作用。2007年EMBO J. 2007; 26:4756-67。https://doi.org/10.1038/sj.emboj.7601890.
- 35.
矮牵牛的Spelt C, Quattrocchio F, Mol JN, Koes R.花青素1编码一种基本的螺旋-环-螺旋蛋白,直接激活结构花青素基因的转录。植物细胞。2000;12:1619-32。https://doi.org/10.1105/tpc.12.9.1619.
- 36.
王G,Yang B,Wu J,Luo P,Anwar M,等人。鉴定参与中国水仙的类黄酮生物合成的基因(Narcissus Tazetta L. Var。Chinensis)。植物mol biol报告。2018; 36:812-21。https://doi.org/10.1007/S11105-018-1119-6.
- 37.
王颖,程凯,姚庆。bHLH转录因子家族的研究进展。Hereditas。2008;30(7):821 - 30。https://doi.org/10.3321/j.issn:0253-9772.2008.07.004.
- 38.
吴建军,王刚,吴建军,罗鹏,安华,曾磊,等。中国水仙R2R3-MYB基因NtMYB5的克隆及功能分析园艺学报。2018;45:1327-37。https://doi.org/10.16420/j.issn.0513-353x.2017-0889.
- 39.
周旭,冯勇,潘东。水仙遗传转化研究进展。亚热带植物科学。2013;373-378。doi:https://doi.org/10.3969/j.issn.1009-7791.2013.04.022
- 40。
谢X,赵杰,郝y,方c,王Y.苹果MyB1和BHLH3的异位表达差异激活烟草中的花青素生物合成。植物细胞。组织和器官培养(PCTOC)。2017; 131:183-94。https://doi.org/10.1007/S11240-017-1275-7.
致谢
不适用。
资金
该研究工作得到了福建省与中国和福建农业和林业大学科技创新基金(KFA17352A)的高原纪律建设。该资助者提供了Reeesrch基金,在实验设计,数据分析,发布的决定或准备稿件中没有作用。
作者信息
从属关系
贡献
YF和LZ对分析进行了构思和设计。YF、JP、JW、PZ和RH进行了实验,并对结果进行了讨论。YF, JP撰写并编辑了手稿。LZ, ACA对手稿进行了修改。所有作者都通过了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
范勇,彭军,吴军。等等。NtbHLH1是一种类似jaf13的bHLH,与NtMYB6相互作用,增强水仙原花青素的积累。BMC植物杂志21,275(2021)。https://doi.org/10.1186/s12870-021-03050-1
收到了:
接受:
发表:
关键词
- 中国水仙
- 类黄酮
- 原霉素
- BHLH
- my