摘要
背景
长非编码rna (Long non-coding RNAs, lncRNAs)是长度为> 200 nt的调控转录本,随着rna测序技术的快速发展,lncRNAs正在成为植物抗真菌防御网络中的重要节点。因此,我们调查了他们在葡萄(葡萄)对专性生物营养真菌植物病原的反应,白粉菌属necator(白粉病,PM)和霜霉(霜霉病,DM),它给世界各地的葡萄种植者带来了巨大的农业经济负担。
结果
利用基于RNA-seq数据的计算方法,71 PM-和83 dm -响应诉酿酒用葡萄我们鉴定了lncrna,并对其在植物防御反应中的作用进行了综合研究。诉酿酒用葡萄根据表达水平分析了蛋白编码序列(CDS),共鉴定了1037个pm响应的CDS和670个dm响应的CDS。接下来,基于共表达分析的功能注释揭示了它们与“应激反应”、“生物刺激反应”、“免疫系统过程”等基因本体论(GO)术语的关联。通过对结构域、酶分类、途径富集、转录因子(TFs)、与microrna (mirna)的相互作用、lncrna的实时定量PCR和共表达CDS对的分析,进一步的研究表明,它们参与了基础和特异性防御反应的调节,如:Ca2+活性氧代谢、发病机制相关蛋白积累、植物激素信号转导、次生代谢等。
结论
总的来说,识别出的lncrna提供了对葡萄藤转录重编程/转录后调控潜在复杂性的深入了解,以延缓或抓住活细胞依赖的病原体的生长。因此,除了TFs等防御反应基因外,已识别的lncrna还可以进一步检测,并用于生物技术改良/育种,以增强这种经济和营养重要性的易感水果作物的抗真菌胁迫能力。
背景
长链非编码rna (lncrna)是长度超过200 nt但缺乏已知编码潜能的转录本,它与其他调节rna一起帮助协调真核生物的生物过程。在植物中,除了调节发育转变和繁殖外,它们还与对应激条件的反应有关(在[1.,2.])。虽然lncRNAs研究植物的初始速度是慢而在哺乳动物(尤其是人类),势头在过去的几年里,高通量测序技术的进步和一些植物的基因组和转录组信息的可用性在高分辨率。
其中一种是葡萄由于它的商业重要性和世界范围的消费量,它已被广泛研究。它包括近5000个品种,广泛用于新鲜和干葡萄消费和葡萄酒生产[3.,4.].然而,这种经济上重要的水果作物受到非生物和生物胁迫条件的影响[5.,6.].易受多种病原体和害虫的影响;其中,真菌和卵菌属植物病原菌在生产的不同阶段构成严重风险。特别是由专性生物营养真菌引起的白粉病和霜霉病(PM和DM)白粉菌属necator和oomycete霜霉,分别与全球经济损失有关[7.].为了避免这些损失,化学处理,如杀菌剂已被广泛应用于葡萄栽培,这不仅是昂贵的作物种植者,而且环境[7.,8.].因此,人们正在努力了解其潜在的机制诉酿酒用葡萄对PM和DM的敏感性,进而改造栽培的葡萄对这些植物病原菌的抗性[4.,7.,8.].
在这个方向上,已经进行了研究,以在转录本、蛋白质和代谢物水平上分析植物防御反应[8.,9,10,11,12,13,14].此外,微rna (miRNAs)已被鉴定为响应大肠necator在中国抗性野生物种中,葡萄属pseudoreticulata[15].然而,监管诉酿酒用葡萄对于PM和DM与lncrna的反应迄今尚未进行研究。在之前的独立研究中,诉酿酒用葡萄lncrna已被确定为在不同发育阶段、应对冷胁迫以及感染半生物营养和坏死营养真菌病原体时的潜在调控因子Lasiodiplodia theobromae和葡萄孢菌分别为(16,17,18,19].不像坏死营养素和半生物营养素最终有利于植物细胞死亡的营养,专性生物营养植物病原体,如大肠necator和p . viticola只靠生活维持诉酿酒用葡萄细胞。因此,探索它们在依赖广泛转录重编程的植物防御反应调控中的作用将是一件有趣的事情。
在这个背景下,我们利用了56441个诉酿酒用葡萄lncrna(之前由我们实验室鉴定)来研究它们对大肠necator和p . viticola感染。我们分别发现了71和83个PM-和dm -应答的lncrna,这为我们研究植物对生物营养病原体的响应提供了新的思路。除了转录因子等防御反应基因外,识别的lncrna还可以进一步检测,并用于生物技术改良/育种,以增强这种多年生水果作物的抗真菌胁迫能力.
结果
白粉病和霜霉病应答lncrna的全基因组鉴定诉酿酒用葡萄
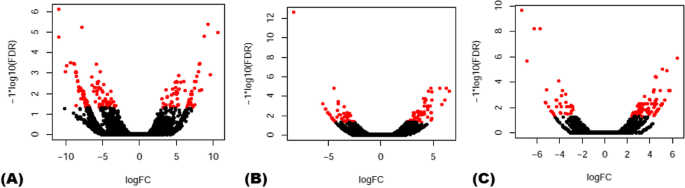
56,441 V的差异表达分析.vinfera基于不同生物应激条件的lncrna(附加文件1.表S1)显示71个PM-和83个dm响应型lncrna (P-values [FDR] < = 0.01 and fourfold change)(图4)1.;额外的文件2.:图S1)。类似的分析为37420 V.酿酒用葡萄CDS显示1037 PM-和670 dm响应蛋白编码转录本(附加文件)2.:图S2)。此外,我们观察到,许多未调控的lncrna(60.6%)在PM感染反应中表达了上调。在PM-responsive CDS中也观察到类似的趋势,63.4%的转录本在这种生物胁迫下上调。然而,超过一半(近67.5%)的lncrna在DM感染反应中被下调。DM-responsive CDS的表达趋势相似,近65.1%的转录本下调。在植物中识别出的PM-和dm -响应型lncrna中,只有TR78139在对专性生物营养病原体的响应中是共同的(附加文件)2.:图S3)。
已鉴定的生物应激反应的功能注释诉酿酒用葡萄lncRNAs
了解PM-和DM-响应的可能作用诉酿酒用葡萄进行lncrna的功能注释。这是基于它们与差异表达CDS共同表达对两种专性生物营养病原体的响应。用Pearson相关系数计算两个转录本类别之间的共表达相关性R> = 0.9(额外文件2.:图S4;额外的文件3.).高度相关的配对被识别(R> = 0.9),发现52个PM-responsive lncrna与33个CDS共表达。在83个差异表达dm响应的lncrna中,有29个可以被过滤掉P -值(FDR的截止值) < = 0.001和作为高置信度候选基因用于共表达分析。因此,观察到22个DM反应性lncRNAs与127个CDS共表达。表示基于共表达的lncRNAs和CDS对之间潜在相互作用的网络已包含在附加文件中2.:数字S5-S7。我们观察到,许多lncrna可能与CDS相关,反之亦然。
基因本体(GO)富集分析
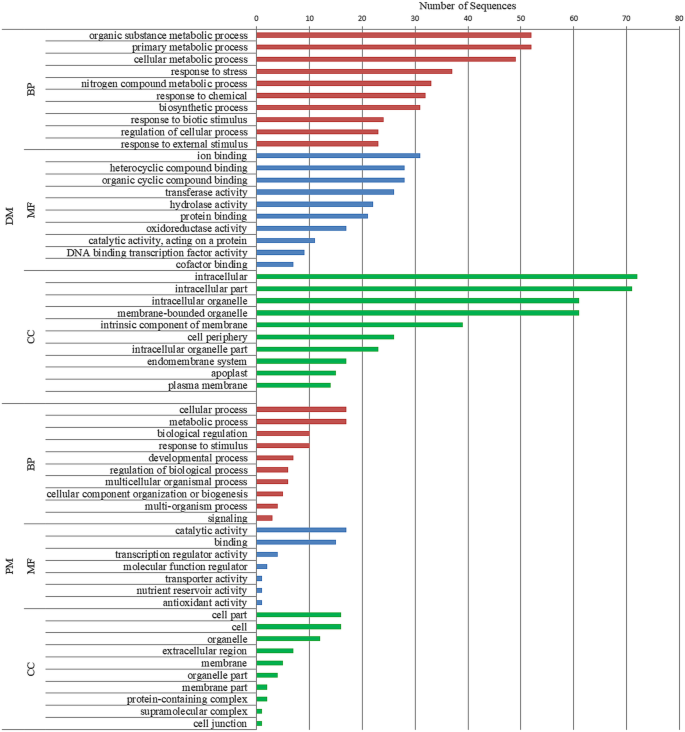
使用Blast2GO工具对上述所有共表达CDS进行GO富集分析[20.].作为分析的一部分,通过BLAST搜索得到所有pm响应序列的结果,其中90.91%的结果被映射到UniProt、EnsemblPlants、TAIR等不同的数据库来源,用于GO术语的检索。因此,81.81%的序列在以下三类中至少标注了一个GO项:细胞组分(CC)、分子功能(MF)和生物过程(BP)4.).例如,(i)在CC类别中,我们观察到GO的术语,如GO: 0,044464“细胞部分”,GO:0,005,576“细胞外区域”,GO:0,016,020“膜”。(ii)在MF类别中,发现了GO:0,003,824“催化活性”、GO:0,005,488“结合活性”和GO:0,140,110“转录调节活性”。(iii)最后,在BP类别中,观察到GO:0,065,007“生物调节”、GO:0,050,896“对刺激的反应”、GO:0,050,789“生物过程调节”和GO:0,002,376“免疫系统过程”。总的来说,这些结果表明lncRNA参与了植物对PM反应的“调控”。此外,对BP类别的直接GO计数进行了分析,它代表了除GO层次结构之外的数据集中最频繁的GO项(附加文件4.).观察到与“氧化还原过程”、“转录调节”、“dna模板化”、“对过氧化氢的响应”、“蛋白质水解”和“细胞壁组织”相对应的术语,这些术语突出了lncrna在植物抵抗真菌病原体入侵的基础防御反应中的假定作用。
同样,所有共同表达dm响应的CDS均获得BLAST命中。其中98.4%能被映射,94.48%能在上述三个类别中分配至少一个GO项(附加文件4.).例如,(i) CC类别包括如下术语:GO:0,005,622“细胞内”,GO:0,043,227“膜界细胞器”和GO:0,071,944“细胞外围”。(ii) MF类别包括GO:0,043,167“离子结合”、GO:0,016,491“氧化还原酶活性”和GO:0,003,700“DNA结合转录因子活性”等术语。(iii) BP类别包括GO:0,006,950“应激反应”、GO:0,009,607“生物刺激反应”和GO:0,009,605“外部刺激反应”。与PM-responsive lncrna一样,BP类的直接GO计数表明DM-responsive lncrna参与了“氧化还原过程”、“转录调控”、“dna模板化”、“细胞壁组织”等过程。此外,还观察到“对几丁质的反应”、“对真菌的防御反应”、“对卵菌的防御反应”、“对其他生物细胞的杀伤”、“细胞死亡的正调控”、“通过细胞壁胼胝质沉积的防御反应”等术语。这突出了dm响应型lncrna在介导与感染后植物防御反应相关的防卫导向转录程序中的潜在参与(附加文件4.).
广泛地说,无花果。2.显示了所有三个类别的前10个术语(考虑到GO层次),表明这些被识别的lncrna可能在响应PM和DM的植物中发挥的功能。
域分析
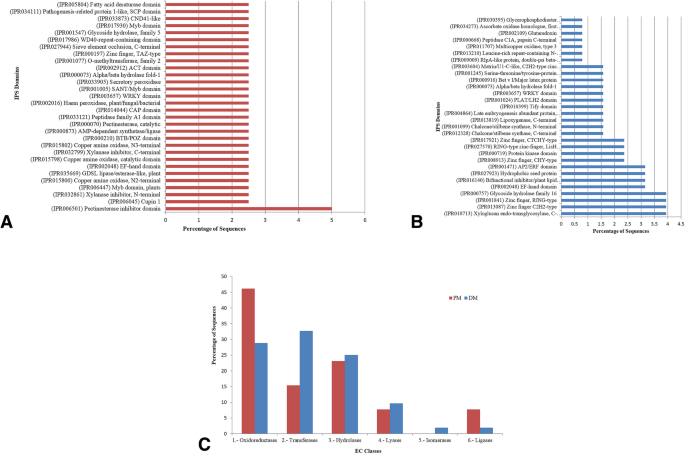
接下来,作为PM-和DM-应答lncrna功能分析的一部分,我们使用InterProScan对共表达的CDS进行了结构域分析。预测的结构域和位点进一步揭示了lncrna在应对生物胁迫中的潜在作用(图。3.A、B;额外的文件2.:图S8)。例如,果胶酯酶抑制剂结构域(IPR006501)、木聚糖酶抑制剂c端(IPR032799)、分泌过氧化物酶(IPR033905)和铜胺氧化酶n2端(IPR015800)表明,共同表达的lncrna可能参与了调节细胞氧化还原状态的变化和细胞壁增强,作为对PM感染的基础防御反应(图)。3.一个)。
在dm响应的共同表达lncRNAs-CDS对的情况下,预测的结构域与防御反应相关(图。3.B)如,(i)细胞壁修饰:木葡聚糖内转糖基化酶c端(IPR010713)、糖苷水解酶家族16 (IPR000757);(ii)植物抗毒素生产:查尔酮/二苯乙烯合酶c端和n端(IPR012328, IPR001099);致病相关蛋白:PR-10、Bet v I/主要乳胶蛋白(IPR000916);(iv) DNA/RNA/蛋白结合:锌指c2h2型和ring型(IPR013087, IPR001841);(v)蛋白激酶:丝氨酸-苏氨酸/酪氨酸-蛋白激酶催化域(IPR001245);(vi)富亮氨酸重复含n端植物型(IPR013210)。
此外,还发现了一些共同的结构域,表明植物对两种生物营养病原体的防御反应是平行的。这些结构域包括水解酶“GDSL脂肪酶/类酯酶植物”(IPR035669)、钙结合“EF-hand结构域”(IPR002048)、WRKY调节结构域(IPR003657)、致病相关蛋白1-like、SCP结构域(IPR034111)和/或富含半胱氨酸的分泌蛋白CAP结构域(IPR014044)。
酶编码分类
根据酶编码(EC)对与PM-和DM-应答lncrna共表达的注释编码序列进行进一步分类,并研究其分布规律(图)。3.C).在6个主要的EC类中,最大的共表达lncRNA-CDS对属于氧化还原酶、转移酶和水解酶类,响应这两种生物营养植物病原。
通路富集分析
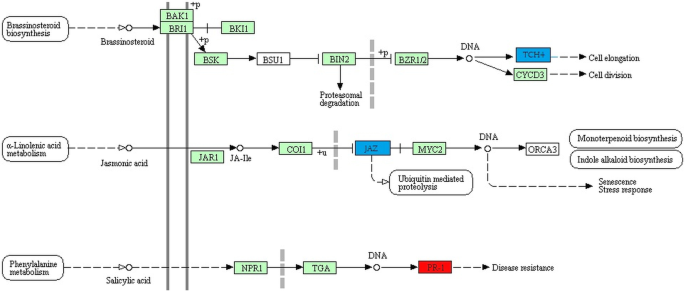
基于KEGG pathway数据库进行pathway富集分析诉酿酒用葡萄[21,结果表明,已鉴定的真菌和卵菌胁迫应答lncrna可能参与了39个通路的代表(附加文件5.额外的文件2.:图S9)。有10条通路在PM反应中完全富集;例如,“甘氨酸、丝氨酸和苏氨酸的代谢”,“异喹啉生物碱的生物合成”,“苯丙氨酸的代谢”和“苯丙氨酸的生物合成”。在DM反应中,观察到21种途径的特异性富集,包括“α -亚麻酸代谢”、“二苯乙烯、二苯基七烷和姜酚生物合成”、“类黄酮生物合成”和“二萜生物合成”。有趣的是,在这两种生物营养植物病原体的反应中,发现了8个共同的途径,包括“代谢途径”、“次生代谢产物的生物合成”、“植物-病原体相互作用”和“植物激素信号转导”。然而,在两种胁迫条件下,这些途径的共表达lncRNA-CDS对是不同的。Fig.中“植物激素信号转导”途径的差异可见一斑。4.以及附加文件中的“植物-病原体相互作用”途径2.:图S10。
共同表达的lncrna和转录因子对响应白粉病和霜霉病感染
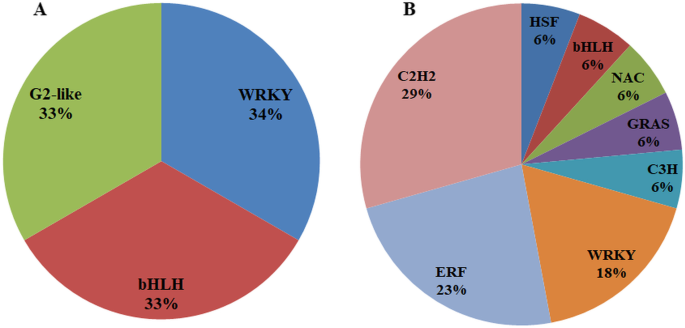
在功能注释分析过程中,我们观察到已鉴定的lncRNAs可能与转录调控(基于GO术语)相关,并且结构域分析也揭示了DNA/RNA/蛋白质结合域。因此,我们进一步研究了lncRNAs与转录因子(TF)的潜在关联.TF家族与PM-和DM-共表达诉酿酒用葡萄使用基于Plant TF数据库v5.0的预测服务器识别lncrna(图5)。5.).在PM反应中观察到三个共同表达的lncRNA-TF对,分别对应于WRKY、bHLH和G2-like。在DM应答中,17个lncrna与8个TF家族共表达,包括应激应答C2H2、ERF、HSF、GRAS、C3H和NAC。WRKY和bHLH对这两种生物营养病原体的反应是共同的。
白粉病和霜霉病的相互作用分析诉酿酒用葡萄与microrna lncRNAs
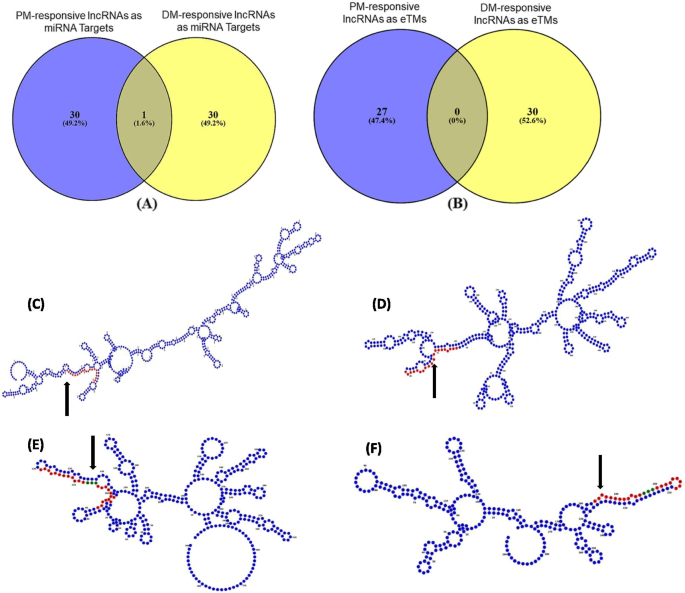
为了了解短、长ncrna对生物营养病原体攻击的调控关系,我们检测了识别出的lncrna的靶位点诉酿酒用葡萄-特异性成熟mirna(图6.A).我们发现了31个PM-和31个dm -应答的lncrna,分别作为78个和105个mirna的潜在靶点(Additional File)6.额外的文件2.:图S11)。其中,只有一种lncRNA在两种情况下是常见的;然而,观察到52种常见的靶向lncrna的mirna。接下来,在两种生物胁迫条件下,确定可以作为mirna的内源性靶拟态(eTMs)的lncrna(图)。6.B).我们分别鉴定了27个PM-和30个dm -应答的lncrna作为30个和35个mirna的假定eTMs(附加文件)6.额外的文件2.:图S12)。虽然在PM和DM反应中没有发现公认的eTMs lncrna,但有19个相关mirna被发现是常见的。这些被鉴定的lncrna可能与mirna相互作用,这些mirna已经被研究过响应生物应激条件,如miR156、miR159、miR164、miR172、miR319、miR396和miR482。此外,我们还发现,有49和42个mirna,其中dm响应的lncrna可以分别作为靶标和靶拟态,同时也可以靶向dm响应相关和共表达的mrna。此外,PM-responsive lncrna分别作为靶标和靶拟态的11和12个mirna也靶向相关和共表达的PM-responsive mrna (Additional File)6.).数据6.C-F代表了PM-和DM-responsive lncrna二级结构预测的例子,作为推测的靶点和eTMs诉酿酒用葡萄microrna。最后,PM-和dm -应答的lncrna与诉酿酒用葡萄mirna被可视化以获得相互作用体的概述(图。7.额外的文件7.).
PM和dm响应的lncrna作为假定靶点和内源性靶点模拟物(eTMs)葡萄microrna。A.维恩图显示PM和dm响应的lncrna可以作为vvi- mirna的靶点。B维恩图显示PM和dm响应的lncrna,可作为vvi- mirna的内源性靶模拟物。C蓝色显示PM-responsive lncRNA (TR36037)的二级结构,红色显示为miRNA (vvi-miR164d)的推定靶点。D一个dm响应的lncRNA (TR229744)的二级结构(蓝色显示),它作为miRNA (vvi-miR156h)的假定靶点(红色显示)。E一个PM-responsive lncRNA (TR63892)的二级结构(蓝色显示),作为miRNA (vvi-miR172c)的假定eTM(红色显示)。典型的3-nt突起用绿色表示。F一个dm响应的lncRNA (TR55735)的二级结构(蓝色显示),作为miRNA (vvi-miR172c)的假定eTM(红色显示)。典型的3-nt突起用绿色表示
选择生物应激应答lncrna和共表达蛋白编码序列的qRT-PCR
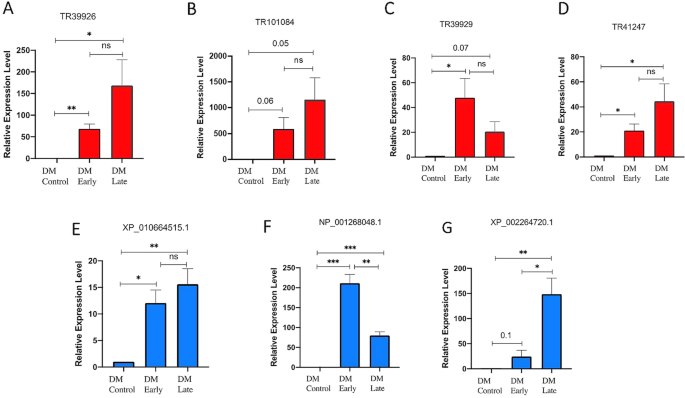
在本研究发现的差异表达的生物应激应答lncrna中,DM应答的高可信度lncrna (P -值[FDR] < = 0.001,四倍变化,FPKM > 100)考虑进行qRT-PCR分析。其中,一些候选基因被随机选中以验证它们的差异表达谱。因此,我们观察到与RNA-seq数据相似的表达趋势,特别是在常见的感染时间点,即24 hpi或1 dpi(额外文件2.:图向)。观察到LncRNAs TR39926、TR39929、TR41247和TR101084在DM反应中上调(图1)。8.).此外,我们发现lncRNAs TR39926和TR101084在DM感染的早期(1 dpi)和晚期(3 dpi)均上调(图)。8.有趣的是,lncRNAs TR39929和TR41247在DM感染后表现出相似的表达趋势,即上调表达,如XP_002264720.1,即致病相关蛋白(PR)-4的编码序列(图4)。8.此外,我们发现lncRNA TR39929与NP_001268048.1共表达,NP_001268048.1是另一种防御反应蛋白-酸性几丁质酶前体的编码序列(图)。8.同样,lncRNA TR101084和XP_010664515.1(可能编码独角金内酯酶DAD2)在DM感染应答中被上调。通过硅差异表达分析(FPKM值)和基于qrt - pcr的分析,这些选定的DM应答lncrna及其相应的防御应答蛋白CDS的共表达模式发现在DM感染时存在重叠,并已在附加文件中描述2.:图S14系列。
讨论
由于对真菌和卵菌植物病原体等引起的疾病敏感,诉酿酒用葡萄表现出在转录水平上由广泛变化驱动的防御反应。特别是对生物营养真菌植物病原的反应大肠necator, disease-susceptible诉酿酒用葡萄据报道,与抗病同类相比,它们经历了更大程度的转录重编程,葡萄-[9].相反,在抗病(诉锐利)及易受影响者(诉酿酒用葡萄)对生物营养卵菌的响应p . viticola.事实上,抗性植物表现出更快更强的防御导向的转录重塑,在易感葡萄藤中观察到对DM的反应更温和[22]在这两种情况下,了解生物营养病原体入侵时转录变化的潜在调节的重要性都不能削弱。
尽管lncRNAs本身是转录的产物,但它已经成为该过程的主要调节者。此外,这些转录物可以在转录后和翻译后水平上调节[23,24].鉴于其调节的多功能性,lncrna除了传统的过表达防御相关基因或转录因子(TFs)的方法外,还可以作为作物生物技术改进的候选基因[7.,24].迄今为止,对lncrna介导的植物对专性生物营养真菌病原体的响应的研究主要进行在小麦(小麦)Blumeria茎f . sp。tritici和柄锈菌striiformisf . sp。tritici,分别在植株中引起粉锈病和条锈病[25,26].据我们所知,这是第一次基于全基因组调查lncrna介导的对易感葡萄植株中引起PM和DM的专性生物营养病原体的应答。我们鉴定了71和83个PM和dm响应的lncrna诉酿酒用葡萄;其中常见的只有一种lncRNA。这一观察结果并非意外,因为已知lncrna在特定位点(组织/细胞)表达,并对特定条件/刺激作出反应[24,27].相比之下,在对两种生物营养病原体的反应中发现了94种差异表达的CDS。然而,需要指出的是,这一观察结果也可能是两项独立研究中植物材料和感染时间点差异的结果,这两项研究是当前研究的转录组数据来源(如附加文件所述)1.:表S1)。此外,我们的研究利用56,441 V.酿酒用葡萄-特异性lncrna,通过从头研究方法在不同的组织和发育阶段被识别[16].因此,基于新的测序策略来识别应答感染的额外lncrna,还有进一步研究的空间。
接下来,表达谱显示,大多数敏感CDS在对PM的反应中上调,在对DM的反应中下调,这在早期对易感葡萄植株的研究中也观察到[9,28].有趣的是,在本研究中发现PM-和dm -应答lncrna的表达谱相似。随后,我们根据这些差异表达的lncrna与CDS的共表达进行了功能注释,结果表明它们与参与生物营养应激反应的生物过程有关。尽管它们的系统发育距离遥远,但作为生物营养性病原菌,真正的真菌和卵菌具有某些共同的特征,帮助它们成功侵入宿主植物的活细胞(通过发育闭孔菌、感染菌丝和吸器)并维持[29].因此,宿主植物对这两种专性生物营养体的反应很可能是重叠的。在本研究中,对PM-和dm -应答lncrna共表达CDS的结构域分析揭示了一些与植物响应相关的常见结构域,如脂质代谢[30.,钙离子结合蛋白介导的信号传导[31, WRKY基因家族介导的转录调控[32致病相关蛋白1 (PR-1)的积累[33].这表明可能有被识别的人参与诉酿酒用葡萄lncrna在调节一些常见的针对生物营养的防御反应中的作用。最近,elf18诱导的长链非编码RNA1 (ELENA1)被鉴定为植物抗性的正调控因子假单胞菌注射器pv。番茄DC3000(半生物营养菌)基础上增加公关-1.表达式中观察到拟南芥[34].在最近的另一项研究中茄属植物lycopersicum(番茄),lncRNA33732被WRKY1激活,进而增强对番茄的早期防御反应5种(hemi-biotrophic oomycete) [35].此外,在本研究中,特别是在对PM的反应中,观察到具有细胞壁降解酶(CWDE)抑制剂(如果胶酯酶和木聚糖酶)相关域的CDS与lncrna共同表达。这表明PM-responsive lncrna可能调控对真菌分泌的CWDE的抑制,避免真菌侵入植物组织发育吸器时造成细胞壁损伤,从而有助于维持植物细胞壁完整性[8.,29,36,37].此外,pm响应型lncrna与铜胺氧化酶等结构域相关,铜胺氧化酶可产生活性氧(ROS),如过氧化氢(H2.O2.)在胺降解时[38],并与生物胁迫中氧化破裂、细胞死亡和过氧化物酶介导的木质素化等事件有关[39].同样,DM-responsive lncrna被发现与脂加氧酶结构域共同表达,脂加氧酶结构域与应激诱导的多不饱和脂肪酸加氢氧化相关,导致ROS的产生[40].这表明PM-和DM-responsive lncrna可能参与了ros介导的防御反应诉酿酒用葡萄.此前,也有报道称lncrna介导的ROS清道夫glutaredoxin在番茄中响应p . 5[41].
鉴定出的dm响应型lncrna也被发现与包括查尔酮/二苯乙烯合酶域在内的CDS共表达,这表明在敏感葡萄植株中可能调控次生代谢和植物抗毒素(如白藜芦醇)的生产[13,42].此外,与防卫相关PR-10蛋白相关的具有核酸酶活性的结构域,突出了共同表达dm应答lncrna在致病RNA降解和宿主程序性细胞死亡双重调控中的潜在参与[43].
进一步研究生物应激反应的假定功能诉酿酒用葡萄lncrna,通路富集分析。在对这两种生物营养物质的响应中,在植物激素信号转导途径中观察到lncrna的潜在参与。特别是PM-responsive lncrna被发现与水杨酸(SA)介导相关PR-1感应,能增强电阻。此外,sa信号通路与细胞死亡有关,因此参与了对生物营养物质的反应[44].然而,lncrna对卵菌生物营养的反应,即,p . viticola,发现与茉莉酸zim结构域(JAZ),作为茉莉酸(JA)介导信号传导的抑制因子。据报道,茉莉酸与抗性有关p . viticola在小道消息45].此外,dm响应的lncrna被发现与油菜素类固醇促进的木葡聚糖内转糖基酶(XET所表达的)业务信道(用于触摸)基因[46,47].由于木葡聚糖是葡萄细胞壁中主要的半纤维素[48],它们通过XETs等细胞壁修饰酶和共表达lncrna的调节可能调节细胞壁增强[49].总的来说,这些结果表明,PM-和dm -应答lncrna与植物激素信号转导之间的关联,介导了复杂的基础防御反应诉酿酒用葡萄.同样地,共表达的lncRNA-CDS对可能参与了葡萄次生代谢途径,进一步强调了植物对生物营养植物病原的响应的潜在调控。
作为调节分子,lncRNAs与其他基因表达调节因子如TFs和小ncRNAs如miRNAs协调[24].此外,如前所述,作为对PM和DM的回应,诉酿酒用葡萄经历大量的转录重编程;然而,潜在的机制仍不清楚。因此,我们从lncrna的角度重新审视了调控者之间的相互作用。在对这两种生物营养物质的反应中,发现lncrna与WRKY据报道,TFs作为植物防御的负/正调节因子,包括基础(病原体相关分子模式[PAMP]触发免疫,PTI)和特异性(效应触发免疫,ETI)免疫[50].例如,在对PM的响应中,共同表达' lncRNA和可能WRKY70两人都说。在SA诱导下,WRKY70与PR1对专性生物营养感染反应的表达[44,51].此外,WRKY70与协调植物激素之间的相互作用有关:SA和JA,它们可以拮抗和协同作用,调节局部和系统的防御反应[32,52].这说明了lncrna作为植物对生物营养物质反应的重要调控节点的潜力。
除了tf介导的转录水平调控外,lncrna还可能通过与mirna的相互作用在转录后水平上协调调控。一般认为TF mrna是miRNAs最常见的靶标[53].有趣的是,有报道称lncrna参与了靶拟态,由于其隔离,促进了miRNA活性的抑制[54].在本研究中,我们发现一些lncrna被认为是mirna的eTMs,其原始靶标是TFs mrna。例如,诉酿酒用葡萄在PM和DM反应中,我们观察到lncrna作为vvi-miR159c的假定etm,众所周知,vvi-miR159c具有靶向作用MYB TFs[15].TF家族的成员调节葡萄藤中类黄酮的生物合成[55],并与糖尿病的基础免疫反应有关[56].总的来说,lncrna、mirna和tf的相互作用反映了植物对PM和DM等生物营养病原体响应调控的复杂性。此外,我们还发现了vvi-miR482的推测eTMs。据报道,这个miRNA超家族可以靶向与抗病相关的疾病核苷酸结合位点-富亮氨酸重复序列(NBS-LRR)美国lycopersicum(番茄)和Gossypiumsp。(棉);然而,在真菌、细菌或病毒的致病性攻击下,mirna驱动的沉默级联被抑制[57,58].因此,我们还需要进一步的实验来探索被鉴定的推定eTMs在抑制上述级联反应中的作用,通过目标模拟有效诱导表达NBS-LRR基因在诉酿酒用葡萄对病原体的反应。
最后,基于qRT-PCR的高置信度分析诉酿酒用葡萄与对照组相比,候选lncRNA在早期(1 dpi)和晚期(3 dpi)对DM表现出不同的反应。有趣的是,这些lncrna与防御反应对应的CDS相关,例如1,3-beta-glucosidase和包含PR-4的Barwin结构域。此外,基于qRT-PCR的分析证实了与相应防御反应蛋白CDS PR-4、几丁质酶前体、独角兽内酯酶等具有相似的共表达趋势。综上所述,本研究形成了一个完整的系统,在响应生物营养真菌和卵菌病原体的lncrna介导的调控作用诉酿酒用葡萄.在未来,可以通过增加RNA-seq数据的样本量进行类似的研究,以研究敏感和抗性植物在感染后期对生物营养病原体的反应;这将进一步提高可靠性,并提供更深入的见解。在本研究的基础上,可以进行后续实验,以探索lncrna作为在驯化葡萄植株上工程增强基础抗性的新候选基因。由于PTI和ETI触发的植物对生物营养物质的防御反应存在重叠,因此lncrna介导的天然免疫调节也可以扩展到研究更具体的防御反应。
方法
转录组数据收集
为了研究生物营养应激反应的lncrna诉酿酒用葡萄,收集真菌侵染叶片样品相应的转录组数据大肠necator(白粉病;点)和oomycete -p . viticola(霜霉病;DM)基于使用国家生物技术信息中心(NCBI)序列读取档案(SRA)的早期研究(http://www.ncbi.nlm.nih.gov/sra) [59,60].收集的RNA-seq数据的详细信息已在附加文件中提供1.S1:表。
转录本差异表达分析
了解lncRNAs对PM和DM的反应诉酿酒用葡萄,我们对之前鉴定的56,441个lncrna进行了差异表达分析[16],使用上述收集的RNA-seq数据。表达量37420 V.酿酒用葡萄同时测定了编码序列(CDS)。首先,使用RSEM软件(Trinity package v2.4.0)对转录本进行定量,即计算转录本有效长度每千碱基对应所有转录本的RNA-Seq片段数(FPKM)。接下来,使用R (edgeR)中数字基因表达数据的实证分析,对不同样本的差异表达(DE)转录本进行分析。DE转录本显示至少四倍的变化P-value cut-off (for false discovery rate [FDR]) < = 0.01相对于相应的对照被选择。火山图显示了具有统计学意义的lncrna对PM和DM的响应。最后,使用Hierarchical Clustering Explorer v3.5生成的热图分析PM-和DM- responsive lncrna和CDS的表达模式。http://www.cs.umd.edu/hcil/hce).
差异lncrna的功能注释
通过对差异表达CDS(在各自感染中观察到)的共表达分析,对鉴定出的PM-和DM-应答lncrna进行功能注释。最初的步骤是使用生物信息学工具CoExpress v1.5 [61]和一个内部PERL脚本(https://github.com/ShivalikaP/Perl-script-tocalculate-Pearson-correlation-coefficient) [62],根据表达数据(FPKM)计算皮尔逊相关系数,识别正相关和负相关共表达的lncRNA和CDS对。基于共表达的lncrna和CDS对之间的潜在相互作用网络使用Pathania和Acharya描述的策略构建[62].下一步包括Blast2GO软件(现在是OmicsBox的一部分)[20.通过GO富集分析分别与PM-和DM-应答lncrna共同表达的CDS(皮尔森相关系数阈值为0.9)。接下来,借助web服务器、KEGG Orthology Based Annotation System或KOBAS 3.0对共表达CDS进行路径富集分析[63]使用京都基因和基因组百科全书(KEGG)路径数据库[21专为该物种准备的:葡萄.
鉴定与lncrna共同表达的转录因子对PM和DM的响应
PM-和dm -应答的CDS被发现与lncrna共同表达(如上所述),我们对转录因子(tf)进行了筛选。为此,基于PlantTF数据库v5.0 (PlantTFDB)的TF预测服务器[64使用了)。该工具依赖于ESTScan 3.0 [65,用于基于隐马尔可夫模型(HMM)的输入序列编码区域分析。
lncrna与mirna相互作用分析
为了对已鉴定的PM-和dm -胁迫应答lncrna与miRNA的相互作用进行分析,后者从miRNA数据库(miRBase)中获取[66)专门为诉酿酒用葡萄.首先,使用生物信息学工具植物小RNA靶标分析服务器(psRNATarget),采用默认参数识别靶标位点诉酿酒用葡萄已鉴定的lncrna中的成熟mirna。接下来,另一个工具,TAPIR (http://bioinformatics.psb.ugent.be/webtools/tapir/) [67的mfe_ratio > = 0.5用于预测PM和dm应答lncrna的内源性靶模拟物(eTMs)。进一步,使用Vienna RNAfold web服务器(http://rna.tbi.univie.ac.at/) [68]和福纳工具[69].最后,Gephi (https://gephi.org/) [70]用于获得lncRNAs和miRNAs之间相互作用的概述。
基于qrt - pcr的lncrna表达分析
为了验证lncrna在生物胁迫下的表达,我们选取了诉酿酒用葡萄简历。汤普森无籽葡萄是从印度农业研究委员会-印度国家葡萄研究中心(ICAR-NRCG)的葡萄园中采集的。利用液氮采集DM对照、早期(1 dpi)和晚期(3 dpi)侵染期的叶片样品。使用对富含次生代谢物的植物组织进行标准化的方案提取样本的总RNA [71].将提取的RNA用DNase I (Amplification grade, Invitrogen, USA)处理,去除污染基因组DNA。然后用Superscript III第一链cDNA合成试剂盒(Invitrogen USA)制备cDNA。利用Primer3 Input软件设计qRT-PCR分析引物[72)(附加文件2.表S2),后续PCR采用Bio-Rad CFX96™Real-Time PCR系统。为了使基因表达正常化,Actin7(ACT7) (NCBI参考序列ID: XM_002282480.4)作为内控基因。计算相对基因表达量,2——ΔΔCT方法已应用[73].所有实验均为3个重复。根据未配对数据进行统计分析t -使用GraphPad Prism软件(GraphPad软件公司,加利福尼亚州拉霍拉市)进行测试。
结论
为了了解植物对专性生物营养真菌植物病原的响应,我们利用计算机方法对71和83进行了全基因组分析葡萄(葡萄藤)lncrna的反应白粉菌属necator(白粉病,PM)和霜霉(霜霉病,DM)。表达分析诉酿酒用葡萄共鉴定出1037个pm响应的CDS和670个dm响应的CDS。根据与这些响应性CDS共表达的lncrna,对其进行全面的功能注释分析。分析揭示了它们与Ca的关联2+-结合蛋白,如钙调素/钙调素样蛋白,参与活性氧(ROS)代谢的酶,细胞壁修饰/强化,次级代谢途径,植物抗毒素(如白藜芦醇)的产生,致病相关蛋白,如PR-1, PR-4和PR-10,以及植物激素信号转导。此外,lncRNA-miRNA相互作用网络分析揭示了靶拟态调控植物防御反应潜在机制的可能性。转录因子(TFs),如WRKY,调节基础(PTI)和病原体特异性防御反应(ETI),也被发现与响应PM和DM的候选lncrna相关。总体而言,作为调节分子,PM-和DM-应答型lncrna可以与其他基因表达调控因子协调,促进转录重编程,以响应生物营养病原体诉酿酒用葡萄.鉴于其调节的通用性,已鉴定的lncrna,如本研究进行了定量聚合酶链反应分析的lncrna,或已鉴定为mirna介导的级联调控的有效节点的lncrna,可以进一步检测。在后续的研究中,这些lncrna除了传统的过表达防御相关基因或转录因子外,还可以作为易感葡萄作物生物技术改良的候选基因。
数据和材料的可用性
当前研究中分析的数据集可在NCBI SRA知识库中获得,(http://www.ncbi.nlm.nih.gov/sra).详情已包含在附加文件中1.S1:表。所有的56441葡萄这篇文章提供了lncrna: Bhatia,et al。2019 (https://doi.org/10.1038/s41598-019-38989-7)及其补充数据文件。
缩写
- 爆炸:
-
基本的局部对齐搜索工具
- 英国石油公司:
-
生物过程
- 帽子:
-
Cysteine-rich分泌蛋白
- 答:
-
蜂窝组件
- cd:
-
编码序列
- CWDE:
-
细胞壁降解酶
- 糖尿病:
-
霜霉病
- dpi:
-
接种后的天数
- 电子商务:
-
酶编码
- 指数:
-
Effector-triggered免疫力
- etm:
-
内源性目标模拟
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- 嗯:
-
隐马尔可夫模型
- 现病史:
-
小时后接种
- 是:
-
茉莉酸
- JAZ:
-
Jasmonate ZIM-domain
- KEGG:
-
京都基因和基因组百科全书
- KOBAS:
-
基于KEGG正交的标注系统
- lncRNAs:
-
长非编码rna
- MF:
-
分子功能
- microrna:
-
微rna
- NBS-LRR:
-
核苷酸结合位点-富亮氨酸重复序列
- nt:
-
核苷酸
- 下午:
-
白粉病
- 公关:
-
Pathogenesis-related蛋白质
- psRNATarget:
-
植物小RNA目标分析服务器
- PTI:
-
病原体相关分子模式(PAMP)引发免疫
- 存在:
-
实时定量聚合酶反应
- ROS:
-
活性氧
- 山:
-
水杨酸
- TAIR:
-
的拟南芥信息资源网站
- TFs:
-
转录因子
- XET:
-
Xyloglucan endotransglycosylases
参考文献
- 1.
植物中长链非编码rna的研究。非编码RNA。2017; 3:16。
- 2.
长链非编码rna在植物对生物和非生物胁迫反应中的新角色生物技术。2018;38:93-105。https://doi.org/10.1080/07388551.2017.1312270.
- 3.
《葡萄酒科学原理与应用》,1994年第3版。
- 4.
Vivier MA, Pretorius IS。为葡萄酒行业量身定制的葡萄。生物科技趋势》。2002;20:472-8。
- 5.
Ferrandino A, Lovisolo C.非生物胁迫对葡萄(Vitis vinifera L.)的影响:关注脱落酸介导的次级代谢和浆果质量的后果。Environ Exp Bot. 2014; 103:138-47。
- 6.
葡萄致病微生物:了解感染策略和宿主反应情景。植物科学学报2016;7:382。
- 7.
Ferreira RB, Monteiro SS, Piçarra-Pereira MA, Teixeira AR.在不影响葡萄酒稳定性的情况下增加对真菌病原体的抗性的工程葡萄。生物科技趋势》。2004;22:168 - 73。
- 8.
邱伟,费灿A,干I.葡萄对白粉病病原生物营养真菌(Erysiphe necator)的防御机制研究进展。Hortic杂志2015;2:15020。
- 9.
冯荣华,龚萨洛,费科特,科瓦奇等。白粉病诱导敏感而非抗性葡萄植株转录组的防御定向重编程。植物杂志。2008;146:236-49。
- 10.
翁凯,李志强,刘荣强,王磊,王玉军,徐勇。丹毒侵染葡萄叶片对白粉病抗性的研究进展。Hortic杂志2014;1:14049。
- 11.
Goyal N, Bhatia G, Sharma S, Garewal N, Upadhyay A, Upadhyay SK,等。全基因组特征揭示了NBS-LRR基因在葡萄白粉病感染中的作用。基因组学。2020;112:312-22。
- 12.
关键词:葡萄孢,RxLR效应基因,寄主,离寄主真菌医学杂志。2018;122:1125-33。
- 13.
[j] . acta photonica sinica, 2012, 39(5): 641 - 641。Rpv3-1介导的对葡萄霜霉病的抗性与特定的宿主转录反应和二苯乙烯的积累有关。BMC Plant Biol. 2019;19:343。https://doi.org/10.1186/s12870-019-1935-3.
- 14.
pirello C, Mizzotti C, Tomazetti TC, Colombo M, Bettinelli P, Prodorutti D,等。葡萄栽培中的突现子囊菌:跨学科综述。植物学报。2019;10:1394。
- 15.
韩磊,翁锴,马辉,向光,李志,王勇,等。中国野生假网葡萄丹毒响应microrna的高通量测序分析植物科学学报2016;7:621。
- 16.
长链非编码rna协调葡萄藤的发育转变和其他关键生物学过程。Sci众议员2019;9:3552。
- 17.
王鹏,戴丽丽,艾军,王颖,任飞。葡萄冷相关长链非编码RNA (lncRNA)的鉴定及功能预测。Sci众议员2019;9:6638。
- 18.
邢强,张伟,刘敏,李丽,李旭东,闫建军。葡萄植株对可可木霉感染应答的长链非编码rna的全基因组鉴定。另一个星球Bioinforma。2019;15:1176934319841362。
- 19.
batia G, Upadhyay SK, Singh K. Vitis vinifera(葡萄)lncrna是对坏死营养真菌和Botrytis cinerea感染反应的潜在调控因子。植物病理学杂志。2020;112:101553。
- 20.
Blast2GO:植物基因组学功能分析的综合套件。植物基因组学杂志,2008;https://doi.org/10.1155/2008/619832.
- 21.
Kanehisa M, Furumichi M, Tanabe M, Sato Y, Morishima K. KEGG:基因组、通路、疾病和药物的新视角。核酸Res. 2017;45: D353-61。https://doi.org/10.1093/nar/gkw1092.
- 22.
Polesani M, Bortesi L, Ferrarini A, Zamboni A, Fasoli M, Zadra C,等。敏感葡萄品种(葡萄属)和抗性葡萄品种(河岸葡萄品种)对霜霉病感染的一般和种特异性转录反应。BMC基因组学。2010;11:117。https://doi.org/10.1186/1471-2164-11-117.
- 23.
Long Y, Wang X, Youmans DT, Cech TR. lncrna如何调控转录?Sci放置2017;3:eaao2110。
- 24.
刘杰,王辉,蔡宁华。植物的长非编码RNA转录组。acta botanica yunnanica(云南植物研究);https://doi.org/10.1111/pbi.12336.
- 25.
辛敏,王颖,姚颖,宋宁,胡震,秦东,等。利用微阵列分析和SBS测序技术鉴定和鉴定小麦对白粉病和热胁迫响应的长链非蛋白编码rna。BMC Plant Biol. 2011;11:61。
- 26.
张华,胡伟,郝建军,吕胜,王超,童伟,等。小麦中新型和真菌应答lincrna的全基因组鉴定和功能预测。BMC基因组学。2016;17:238。
- 27.
刘建军,荣超,徐建军,等。拟南芥基因组分析揭示了拟南芥基因间长链非编码rna的调控作用。
- 28.
Polesani M,Desario F,Ferrarini A,Zamboni A,Pezzotti M,Kortekamp A,等。感染葡萄霜霉病的葡萄中表达的植物和病原基因的cDNA-AFLP分析。BMC基因组学。2008;9:142。
- 29.
Luis P,Gauthier A,Trouvelot S,Poinssot B,Frettinger P.鉴定葡萄上可能参与发病机制的葡萄浆菌基因表明卵菌和真真菌之间有新的相似性。植物病理学。2013;103:1035–44。
- 30.
脂质、脂肪酶和脂质修饰酶在植物抗病中的作用。植物病理学杂志。2005;43:229-60。https://doi.org/10.1146/annurev.phyto.43.040204.135951.
- 31.
王志强,王志强,王志强,等。植物钙调素和钙调素样蛋白在植物钙信号转导中的作用。Biochimie。2011;93:2048-53。https://doi.org/10.1016/j.biochi.2011.07.012.
- 32.
王敏,王刚,梁永红,梁永红,等。葡萄的基因组和转录组分析WRKY基因家族。Hortic杂志2014;1:14016。
- 33.
房龙LC,代表M, Pieterse CMJ。诱导性防御相关蛋白在受感染植物中的意义。植物病理学杂志。2006;44:135-62。
- 34.
徐建生,孙洪旭,朴宝生,黄昌华,叶世德,钟灿,等。elf18诱导的长链非编码RNA与介导物相关,增强拟南芥固有免疫应答基因的表达。植物细胞。2017;29:1024-38。https://doi.org/10.1105/tpc.16.00886.
- 35.
崔静,姜宁,杨国刚,刘伟,周旭,等。与WRKY1相关的lncrna33732呼吸爆发氧化酶模块在番茄-疫霉菌互作中的作用植物j . 2019; 97:933-46。
- 36.
Rodriguez-Moreno L, Ebert MK, Bolton MD, Thomma BPHJ。植物真菌病原体的弯曲感染策略的工具。植物j . 2018; 93:664 - 74。
- 37.
Wormit A,Usadel B.果胶甲基酯酶抑制剂(PMEIs)的多方面作用.国际分子科学杂志,2018;19:2878。https://doi.org/10.3390/ijms19102878.
- 38.
陈志强,陈志强,陈志强,等。植物活性氧种类、氧化损伤及抗氧化防御机制的研究进展。J机器人。2012;2012:1-26。
- 39.
铜胺氧化酶在豚鼠伤害防御反应中的表达。植物杂志。2002;128:865 - 75。
- 40.
植物活性氧(ROS)和抗氧化剂对环境胁迫的响应。前沿环境科学。2014;2:53。
- 41.
关键词:番茄,抗、感番茄,转录组比较分析,抗性基因lncRNA163975种共同表达glutaredoxin。植物j . 2017; 89:577 - 89。https://doi.org/10.1111/tpj.13408.
- 42.
李志强,李志强,李志强,等。对霜霉病差异敏感的葡萄种质中二苯乙烯合酶的转录调控。BMC Plant Biol. 2019;19:404。https://doi.org/10.1186/s12870-019-2014-5.
- 43.
Xu TF, Zhao xitc, Jiao YT, Wei jyi, Wang L, Xu Y. A mechanism related protein, VpPR-10.1 from Vitis pseudoreticulata: its mechanism of antitumor activity of Vitis pseudoreticulata: its mechanism of Vitis pseudoreticulata: its mechanism of Vitis pseudoreticulata: its mechanism of Vitis pseudoreticulata: its mechanism of Vitis pseudoreticulata: its mechanism of Vitis pseudoreticulataPLoS ONE。2014; 9: e95102。
- 44.
生物营养与坏死营养病原体防御机制的比较。植物病理学杂志2005;43:205-27。
- 45.
陈志强,陈志强,陈志强,等。茉莉酸与葡萄抗葡萄球菌的关系。植物学报2016;7:565。https://doi.org/10.3389/fpls.2016.00565.
- 46.
杨昌杰,张超,卢亚宁,金建强,王小林。油菜素内酯的作用机制:从信号转导到植物发育。摩尔。2011;4:588 - 600。
- 47.
拟南芥ch4在激素和环境的调控下编码木葡聚糖内转糖基化酶。植物细胞。1995;7:1555 - 67。https://doi.org/10.1105/tpc.7.10.1555.
- 48.
Moore JP, Nguema-Ona E, Fangel JU, Willats WGT, Hugo A, Vivier MA。利用高通量和分离方法分析葡萄叶的主细胞壁多糖。Carbohydr变异较大。2014;99:190-8。https://doi.org/10.1016/j.carbpol.2013.08.013.
- 49.
植物细胞壁是一种复杂的、动态的结构。植物科学学报,2016;
- 50.
acta botanica sinica(云南植物研究);acta botanica sinica(云南植物研究);畜牧与饲料科学。2016;18:35 - 51。
- 51.
Knoth C,Ringler J,Dangl JL,Eugem T.Arabidopsis WRKY70是完全RPP4介导的抗病性和对Hyaloperospora寄生菌的基础防御所必需的。Mol植物-微生物相互作用。2007;20:120–8。https://doi.org/10.1094/MPMI-20-2-0120.
- 52.
王东,董晓东。植物系统获得性抗性转录网络中调控节点的基因组识别方法。公共科学图书馆Pathog。2006;2:1042-50。https://doi.org/10.1371/journal.ppat.0020123.
- 53.
Samad AFA, Sajad M, Nazaruddin N, Fauzi IA, Murad AMA, Zainal Z,等。MicroRNA与转录因子:植物调控网络中的关键分子。植物学报,2017;
- 54.
Valli A, Todesco M, Mateos I, Puga MI, Rubio-Somoza I,等。靶拟态为调控microRNA活性提供了一种新的机制。Nat麝猫。2007;39:1033-7。https://doi.org/10.1038/ng2079.
- 55.
关键词:MYB转录因子,葡萄藤,类黄酮,生物合成途径原生质。2012;249(增刊。2): 109 - 18。https://doi.org/10.1007/s00709-012-0380-z.
- 56.
罗勇,白锐,李军,杨伟,李锐,王强,等。MYB15是中国野葡萄基础免疫(PTI)必需的转录因子。足底。2019;249:1889 - 902。https://doi.org/10.1007/s00425-019-03130-5.
- 57.
Shivaprasad PV, Chen HM, Patel K, Bond DM, Santos BACM, Baulcombe DC。microRNA超家族调控核苷酸结合位点-富亮氨酸重复序列和其他mrna。植物细胞。2012;24:859 - 74。
- 58.
朱庆华,范玲,刘艳,徐华,刘永强,刘志强。棉花nps - lrr防御基因的miR482调控。PLoS ONE。2013; 8: e84390。
- 59.
胡勇,李勇,侯飞,万东,程勇,韩勇,等。拟南芥广谱抗性基因RPW8.2的异位表达提高了葡萄对白粉病的抗性。植物科学。2018;267:20-31。https://doi.org/10.1016/j.plantsci.2017.11.005.
- 60.
葡萄二苯乙烯合酶多基因家族的全基因组分析:生物和非生物胁迫下的基因组组织和表达谱。BMC Plant Biol. 2012;12:1。https://doi.org/10.1186/1471-2229-12-130.
- 61.
等。microrna、转录因子和靶基因的相互作用:将动态表达变化与功能联系起来。核酸Res. 2013; 41:2817-31。https://doi.org/10.1093/nar/gks1471.
- 62.
“组学”数据的计算分析鉴定转录因子调节次生代谢的蛇舌草。植物生态学报。2016;34:283-302。
- 63.
谢超,毛欣,黄建平,丁勇,吴军,董胜,等。KOBAS 2.0:用于标注和识别富集途径和疾病的网络服务器。核酸学报2011;39(SUPPL。2): W316。
- 64.
金军,田芳,杨大川,孔林,罗军,等。植物转录因子和调控相互作用的中心枢纽。核酸Res. 2017;45: D1040-5。
- 65.
ESTScan:一种检测、评估和重建EST序列中潜在编码区域的程序。Proc Int Conf Intell Syst Mol Biol. 1999; 99:138-48。
- 66.
miRBase:从microRNA序列到功能。核酸Res. 2019;47: D155-62。https://doi.org/10.1093/nar/gky1141.
- 67.
用于预测植物microRNA靶点,包括靶点模拟的网络服务器。生物信息学。2010;26:1566-8。https://doi.org/10.1093/bioinformatics/btq233.
- 68.
霍福克尔。维也纳RNA二级结构服务器。核酸研究,2003年;31:3429–31.https://doi.org/10.1093/nar/gkg599.
- 69.
Forna (force-directed RNA):简单有效的在线RNA二级结构图。生物信息学。2015;31:3377-9。
- 70.
Bastian M, Bastian M, Heymann S, Jacomy M. Gephi:一个用于探索和操作网络的开源软件。Int AAAI Conf WEBLOGS Soc MEDIA;第三Int AAAI Conf WEBLOGS Soc MEDIA。2009.http://citeseerx.ist.psu.edu/viewdoc/summary?doi=10.1.1.172.7704.于2019年8月25日查阅。
- 71.
Ghawana S, Paul A, Kumar H, Kumar A, Singh H, Bhardwaj PK,等。富含次生代谢产物的植物组织的RNA分离系统。BMC Res Notes. 2011;4:85。https://doi.org/10.1186/1756-0500-4-85.
- 72.
刘志强,王志强,王志强,等。primer3 -新的功能和界面。核酸学报2012;40:e115。
- 73.
Livak KJ,Schmittgen TD.使用实时定量PCR和2−ΔΔCT法。方法。2001;25:402–8。https://doi.org/10.1006/meth.2001.1262.
确认
GB感谢印度ICMR颁发初级和高级研究奖学金。作者感谢Shivalika Pathania博士在共表达网络分析方面的帮助。
资金
作者没有从任何来源获得任何资金来开展这项工作。
作者信息
从属关系
贡献
GB进行了生物信息学分析,湿法实验室工作,并撰写了手稿。AU获取植物样本,进行真菌处理,参与lncrna和CDS的实时PCR分析。KS和SKU策划实验,分析结果,定稿。所有作者均已阅读并批准本稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
所有作者都声明不存在相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
补充信息
附加文件1:表S1。
详细的转录组数据收集自NCBI-SRA数据库。
附加文件2:表S2。
qRT-PCR引物列表。图S1。lncrna对(A)反应的表达谱白粉菌属necator(白粉病)在36 hpi(4倍变化,P-value <= 0.01)和(B)霜霉(霜霉病)感染24和48 hpi(4倍变化,P值< = 0.01)。基于表达趋势的较大的lncrna簇以红色字体显示,而蓝色代表较小的组。在(A) PM感染和(B) DM感染中分别观察到更多上调和下调的lncrna。色标对应对数表达比(FPKM)。值高的是鲜红色,值低的是鲜绿色。中间值为黑色。Hpi,接种后数小时;点,白粉病;DM,霜霉病。图S2。编码序列的表达谱葡萄回应(A)白粉菌属necator(白粉病,PM)感染在36 hpi和(B)霜霉(霜霉病,DM)感染24和48 hpi。色标对应对数表达比(FPKM)。值高的是鲜红色,值低的是鲜绿色。中间值为黑色。Hpi,接种后数小时图S3。(A) PM-和DM-responsive lncrna只有一个共同的转录本。(B) DM-和pm -应答型CDS有94个共同的转录本。图S4。基于(A)白粉病和(B)霜霉病的网络密度(ND),对lncRNAs-CDS共表达网络进行拓扑分析,确定皮尔逊相关系数(PCC)阈值。式中,最小ND对应的PCC以菱形表示,作为阈值(0.90)。用于此分析的内部脚本可以在GitHub (https://github.com/ShivalikaP/Perl-script-tocalculate-Pearson-correlation-coefficient).图S5。DM-responsive lncrna和CDS共表达网络:由红色和蓝色相互作用的lncrna和相关CDS组成的共表达网络分别代表正相关和负相关。绿色和紫色的菱形和圆形节点分别代表lncrna和相关的CDS。图S6。完整加权dm响应的lncRNAs-CDS网络。加权CDS-CDS与lncRNAs-CDS(正相关)共表达网络整合得到。lncrna和CDS分别用紫色和粉色描绘成菱形和圆形(边缘为实线)。图S7。完整的加权dm响应lncRNAs-CDS网络,是将加权CDS-CDS与lncRNAs-CDS(负相关)共表达网络整合而成。lncrna和CDS分别用紫色和粉色描绘成菱形和圆形(边缘为实线)。图S8。与(A) DM-和(B) pm -应答lncrna共表达的编码序列的InterProScan (IPS)位点分布。图S9。在富集分析与lncrna共同表达的mrna对不同PM、白粉病和DM、霜霉病的响应过程中观察到的通路数量。图S10。在(A)白粉病和(B)霜霉病感染中,lncrna(与mrna共同表达)可能参与了“植物-病原体相互作用”途径。图S11。诉酿酒用葡萄mirna可能针对已识别的PM-和dm -应答lncrna。图S12。诉酿酒用葡萄经鉴定的PM-和dm -应答lncrna可作为潜在内源性靶模拟物(eTMs)的mirna。图向。比较分析选择的高可信度lncrna在DM感染共同时间点(24 hpi或1 dpi)的RNA-seq和qRT-PCR数据。表达式级别已表示为日志自然折叠变化值。图S14系列。选择dm应答的lncrna和相应的蛋白编码序列(CDS)共表达模式。(A-D)描述了4对dm应答lncrna - CDS对的共表达模式。蓝色和红色对应于观察到的表情模式生物信息学差异表达分析(FPKM值);绿色和紫色为qRT-PCR分析后的表达趋势。CDS的lncrna名称和NCBI参考序列id在各面板的颜色图例中。y轴对应于折数变化值的自然对数。
额外的文件3:
共同表达粉状和霜霉反应葡萄在Pearson相关系数>= 0.9(使用CoExpress v1.5)处lncrna和成熟mrna,包括使用PERL Script基于Pearson相关系数的所有正相关和负相关共表达对。
额外的文件4:
与PM和dm响应的lncrna共表达的所有3类mrna的基因本体论分布和直接基因本体论(GO)计数,代表生物过程类别中最频繁的GO项。
额外的文件5:
与CDS共同表达的lncrna响应白粉病和霜霉病的途径富集分析
额外的文件6:
PM和dm响应的lncrna作为假定靶点和内源性靶点模拟葡萄microrna。PM-和dm -应答的蛋白编码序列(与PM-和dm -应答的lncrna共表达)作为推测的靶点葡萄microrna。
额外的文件7:
PM-和dm -应答的lncrna与诉酿酒用葡萄以获得相互作用组的概述。
权利和权限
开放获取本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者适当的信任和来源,提供到知识共享许可证的链接,并说明是否进行了更改。本文中的图像或其他第三方材料包括在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包括在文章的知识共享许可证和法定法规不允许我们的预期用途或超出允许用途,您需要直接获得版权持有人的许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
巴提亚,阿派德海耶,s.k.,阿派德海耶,A。et al。研究长链非编码rna作为葡萄对白粉病和霜霉病反应的调节者。BMC植物杂志21,265(2021)。https://doi.org/10.1186/s12870-021-03059-6
收到了:
认可的:
发表:
关键字
- 葡萄
- 白粉病
- 霜霉病
- LncRNAs
- microrna
- 转录因子
- 防御反应