抽象的
背景
根瘤菌和豆科植物的共生是一种特定的、协调的相互作用,导致根瘤的形成,在那里发生生物固氮。NADPH氧化酶,或植物中的呼吸爆发氧化酶同源物(RBOHs),是产生超氧化物(O2•−).超氧化物产生其他活性氧(ROS);这些ROS调节不同的互动互动阶段。例如,ROS水平的变化被认为是在共生相互作用期间诱导ROS清除,细胞壁重塑和植物激素稳态的变化。在常见的豆中(菜豆),PVRBOHB在结节形成的早期起着关键作用。
结果
在本研究中,探讨的作用PVRBOHB在根瘤间共生中,我们在控制条件下分析了来自普通豆根的转录组数据(转基因根没有构造)和具有下调表达的根源PVRBOHB(通过RNA干扰)未接种和接种r . tropici.我们的研究结果表明,PvRBOHB产生的ROS通过与黄酮类化合物、碳代谢、细胞周期调控以及植物激素生长素和细胞分裂素的交互作用,在侵染线形成和根瘤器官发生中发挥了核心作用。
结论
我们的发现为ROS在调节根瘤菌-豆科植物共生中的多重作用提供了重要的见解。
背景
豆科植物和根瘤菌之间的共生关系是一种特定的共生相互作用,导致生物固氮。共生固氮发生在一个称为根瘤的特殊结构中。这种相互作用的建立需要植物根和共生体之间交换化学信号[1].植物根系分泌酚类化合物(主要是异黄酮)到根际。这些化合物导致细菌合成和分泌被称为结瘤(Nod)因子(NFs)的脂质壳寡糖,它还调节对共生关系至关重要的其他根瘤菌反应,包括生长和运动的变化[2那3.].根瘤菌进入根毛细胞的亚根尖区,植物的质膜和细胞壁内陷,形成侵染线(IT)。IT引导根瘤菌迁移到根皮层的分裂细胞中,在那里原始根瘤形成。最后,这些细菌被释放到植物细胞中,形成根瘤并分化为类杆菌,类杆菌执行生物固氮[4.].在豆科植物中,根据原基的起源,有两种形态的结节形成:确定性结节,起源于外部皮层;不定结节,起源于中柱鞘。不定结节有持久的分生组织,是圆柱形的,而定结节一般是球形的,没有持久的分生组织[5.].
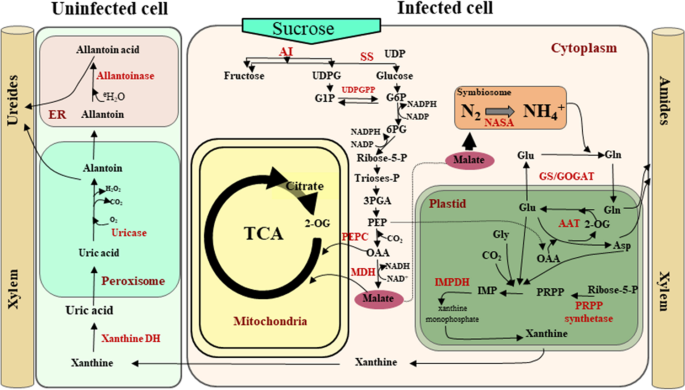
豆科根线互动需要细菌与宿主工厂之间的协调沟通。该通信允许根瘤菌容纳在结节中,其中大气中的二氮化被降低到氨中,提供可以通过植物同化的氮源来源。反过来,该植物为根瘤菌提供固定碳[4.].在确定的结节,最固定的氨通过菌体和共生体膜,在那里它迅速被谷氨酰胺合成酶/谷氨酸合成酶(GS / GOGAT)周期(图同化为谷氨酰胺(Gln)通过扩散转移到植物细胞质。1).后来Gln稍后用作酰胺(Asn和Gln)的氮供体在不确定的结节和嘌呤中,并且在测定结节中的uREIDE [6.那7.那8.那9.那10].以类似的方式,来自地上植物零件的蔗糖主要通过蔗糖合成酶(SS)活性分解,并且通过糖醇分解,该反应的产物以提供碳骨架,用于在植物中提供呼吸和植物中的铵同化中的碳骨架[11那12] (图。1).
豆科植物根瘤中主要代谢途径的示意图。该图显示了受感染和未受感染细胞中氮化合物的生物合成,以及从植物的地上部分到共生体的蔗糖分解代谢。美国国家航空航天局(NASA):固氮酶;Glu:谷氨酸;Gln:谷氨酰胺;2 og: 2-oxoglutarate;OAA:草酰乙酸;Asp:天冬氨酸;g:谷氨酰胺合成酶;GOGAT:谷氨酸合酶; AAT: aspartate aminotransferase; PRPP: phosphoribosyl pyrophosphate; IMPDH: inosine-5′-monophosphate dehydrogenase; Xanthine DH: xanthine dehydrogenase; UDP: uridine diphosphate; SS: sucrose synthase; AI: alkaline invertase; UDPGTP: uridine diphosphate glucuronosyltransferase; PEPC: phosphoenolpyruvate carboxylase; MDH: malate dehydrogenase
同时,在豆类根线互动的不同阶段的特定根组织中检测由NADPH氧化酶RBOHS(呼吸爆发氧化酶同源物)产生的活性氧物质(ROS)在不同阶段的特定根组织中检测到[13那14].紫花苜蓿(紫花苜蓿),超氧化物在IT和感染细胞中强烈积聚,随后形成结节苜蓿根瘤菌感染(15].在常见的豆中(菜豆),形成确定的结节,我们之前检测到在添加NFs几秒钟后ROS水平明显增加[16].观察结果进一步支持该发现,即ROS产生酶如诸如的转录物pvrboha.那PVRBOHB那PVRBOHC,PVRBOHD在结节发展期间累积[17那18].特别是,PvRBOHB和PvRBOHA在IT进展位点和根毛细胞的基底处检测到启动子活性PvRBOHA) [14那18].在功能分析中,rnai介导的基因沉默降低了ROS水平PVRBOHB在P.寻常魅力根,它的进步在表皮细胞的碱度中止[17].在Lotus对虾和Medicago Truncatula.在那里,IT受到了严重的影响LjROP6-RNAi和MTROP9.-RNAi根,导致更少的结节[19那20.].ROS水平和MTRBOHB.表达被抑制MTROP9.-根瘤菌接种后沉默的根,表明MtROP9可能与RBOH在结瘤过程中相互作用[21].此外,过表达PVRBOHB增加ROS生产,同时形成,结节生物质和菌体数量和SymbioSomes中的菌数和大小的相应增加,以及氮的生物学固定增加[22].
在不确定结节发育过程中,中柱鞘细胞产生大量超氧化物[15那23].在M. Truncatula.,MTRBOHE.那MTRBOHF.,MTRBOHG.启动子也活跃在血管束的结节中[24].同样,在P.寻常魅力的启动子活性PVRBOHB在结节原基的维管束和分裂的皮层细胞中观察到[17].这一观察结果被rnai介导的沉默所证实PVRBOHBLED在外皮中显着降低细胞分裂,表明该基因在显影结节中发挥着重要作用。此外,ROS和植物激素是用于根瘤菌感染和结节原始形成所需的[25那26那27].在它形成过程中发生植物化生物合成和信令M. Truncatula.根瘤菌感染的前五天的根毛[28].我们之前提出PvRBOHB在结节形成中起积极作用P.寻常魅力通过与这种共生过程所需的各种信号机制相互作用[17那22那29].
我们之前获得了P.寻常的Pvrbohb.:RNAi根在编组期间为了探索角色PVRBOHB在这种共生互动中;在根瘤共生的早期,我们检测到相当大的转录组变化P.寻常魅力[29].此外,我们还鉴定了一组与结瘤过程中清除ROS、细胞壁重塑和植物激素稳态相关的差异表达基因(DEGs)P.寻常魅力受到影响的影响PVRBOHB沉默。这些发现有力地表明PVRBOHB在这一过程的早期阶段,通过与这些代谢途径的相互作用,在共生中发挥关键作用。
在目前的研究中,我们执行的角色有更深入的分析PVRBOHB在结瘤中使用相同的转录组数据。揭示了根瘤共生的各种重要分子机制和代谢途径。另外,为了证实观察到的效应PVRBOHB沉默不是由于非活动共生程序,我们比较的同源基因的表达谱l .对虾[30.),M. Truncatula.[31在结瘤过程的同一阶段,利用现有的数据。我们的发现揭示了PVRBOHB在豆科根瘤菌中共生。
结果
在本研究中,我们分析了之前生成的转录组数据PVRBOHB-RNAi根接种r . tropici以阐明PvRBOHB与不同代谢途径和分子机制的相互作用,从而更好地理解该蛋白在根瘤共生中的作用。我们还将我们的数据与来自同源的其他可用转录组数据进行了比较l .对虾[30.那32),M. Truncatula.[31那33]基因在结瘤过程的相同阶段。
的影响PVRBOHB上的基因的结瘤的条件下与所述类黄酮生物合成途径的表达
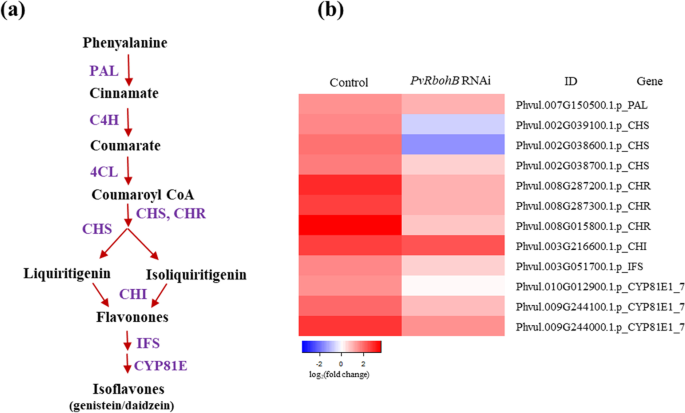
异黄酮类化合物是参与早期信号传导的次级代谢产物,具有趋化作用。异黄酮还调节根瘤菌的反应,这对共生关系至关重要,包括生长和运动[2那3.].事实上,根瘤菌定植增加了生产类黄酮,黄酮类特别需要参与该过程的信号通路的串扰[34那35那36那37那38].PVRBOHB沉默地将其进入内部根细胞沉默;它在根发底部被捕。因此,我们评估了异链类生物合成相关基因,因为在这种感染过程中,异黄酮生物合成响应根瘤菌或NFS而增加[39].
异黄酮类化合物是一种低分子量的次生代谢产物,由一个3碳链连接的两个苯环(a环和B环)组成的15碳骨架。异黄酮类化合物是通过苯丙酸途径通过查尔酮合成酶(CHS)的活性合成的。查尔酮合成酶是类黄酮生物合成的第一个酶,产生柚皮素查尔酮,并通过查尔酮异构酶(CHI)环化为柚皮素。2a).在本研究中,接种根瘤菌的对照根中12个类黄酮生物合成相关基因的表达水平高于未接种根瘤菌的对照根。这些基因中大多数编码这一途径中的关键酶,如苯丙氨酸解氨酶(PAL)、CHS、查尔酮还原酶(CHR)、CHI和异黄酮合酶(IFS)(图)。2然而,b)。PVRBOHB-沉默的根,这些基因的表达减少,两种CHS同工酶的水平显著下调,而CHI的水平未被修改(图。2这些结果表明PVRBOHB在共生过程中,优先调节异黄酮含量而非酚类化合物的含量。
类异黄酮生物合成途径相关基因的表达模式。一种豆科植物异黄酮生物合成途径示意图。B.在控制相关异黄酮的生物合成中差异表达的基因(DEGS)编码的蛋白质和PVRBOHB-RNAI.P.寻常魅力根在7dpi处r . tropici.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。PAL:苯丙氨酸氨酶;C4H:肉桂醛4-羟化酶;4CL:4-香豆素COA-连接酶;CHS:Chalcone合成酶;CHR:Chalcone还原酶;Chi:Chalcone异构酶;ifs:异黄酮合酶;CYP81E:异黄酮/ 4'-甲氧基脱氟洛酮2'-羟基酶
有趣的是,与类黄酮生物合成相关的同源基因在l .对虾和M. Truncatula.,除了编码CHI的基因外,这些基因在l .对虾(附加文件1:图S1)。这些结果表明,异黄酮的生物合成具有活性P.寻常魅力,主要是在非活动l .对虾,而在M. Truncatula.在共生的早期阶段。在PVRBOHB-RNAi根,在这条途径的所有步骤的调控呈下降趋势,指向对在后异黄酮的生物合成由PvRBOHB产生的活性氧作用P.寻常魅力.这一概念与发现类黄酮生物合成是由ROS刺激的结果是一致的[40ROS存在于结节原基和IT中。
的影响PVRBOHB关于根瘤菌固定氮的同化与运输
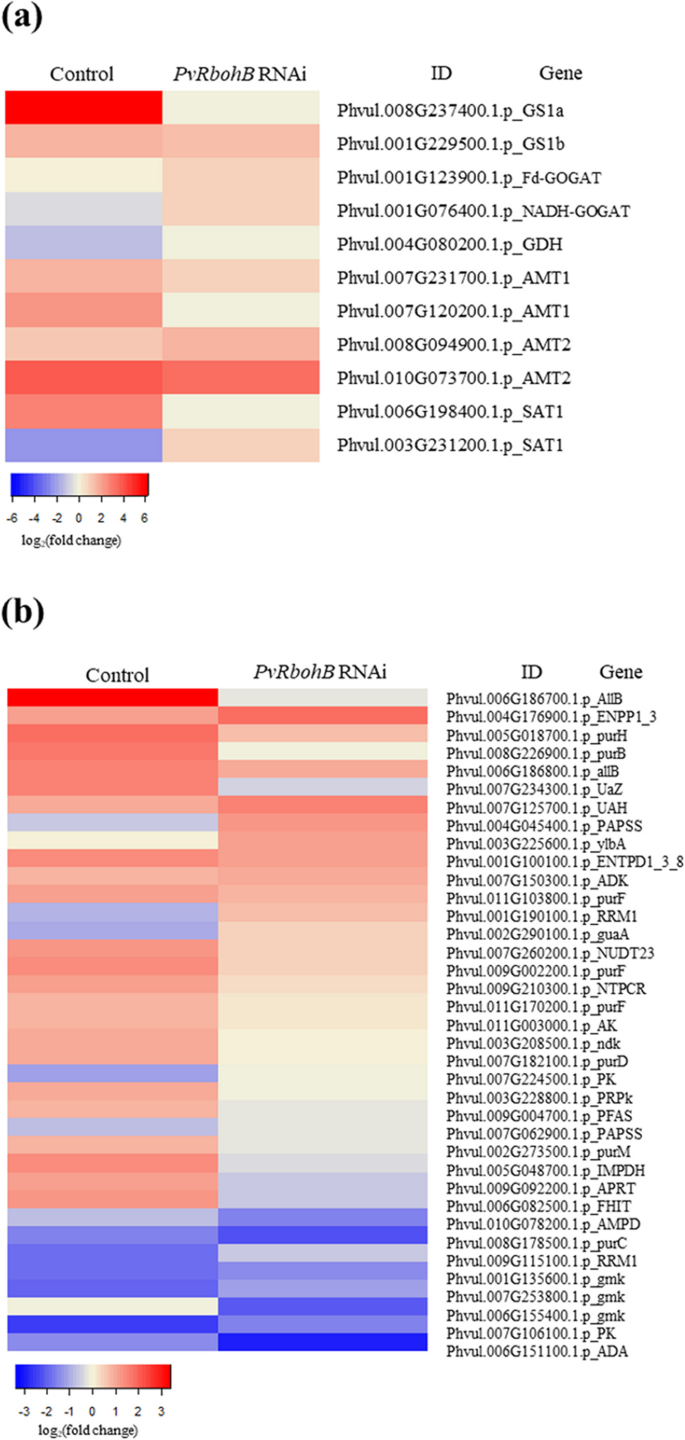
通过研究发现PVRBOHB使根瘤菌固氮量减少90% [17[我们评估了控制中氨的运输和同化PVRBOHB沉默的根源。参与GS1a/GOGAT周期的基因在对照根瘤体中上调GS1b表达几乎保持不变(图。3.一种)。这一结果是在与该结节特异性GS同种型在菜豆诱导的发现协议,GS是负责氨同化的主要酶[41].GS1a表达明显减少PVRBOHB-沉默植物,这与我们之前的发现一致,即这些植物的固氮作用降低[17].出乎意料,GOGAT基因表达在对照方面较低PVRBOHB沉默的植物。由于GOGAT催化谷氨酰胺的脱酰胺反应生成谷氨酸,我们的结果表明谷氨酰胺优先合成而不是谷氨酸。这一观点得到了对谷氨酰胺用于嘌呤和尿素生物合成的高需求的支持。在所分析的3种豆科植物中,编码谷氨酸脱氢酶(GDH)的基因均受到类似的抑制,表明该酶在共生过程中不参与氨同化(图)。3.a).大多数编码跨膜铵转运体的基因(AMT1-2和SAT1[共生铵转运体1])在对照根中表达上调,而在对照根中表达略有降低PVRBOHB沉默P.寻常魅力根(图。3.一个额外的文件1:图S2)。这些结果表明,铵态氮在豆科植物共生过程中被积极运输和吸收PVRBOHB微调该植物的氮代谢。
形式确定结节的豆类通常合成uREIDE,以分配和吸收固定的氮气与植物的空中部位,有一些例外情况[6.那7.那8.].尿囊素来源于新生合成的嘌呤,这些嘌呤随后在结节中心区未感染的细胞中氧化为尿囊素和尿囊酸。为了确定这一途径的起始和探索其在结节形成中的调控,我们分析了参与嘌呤代谢的基因。在对照根中,我们鉴定了23个上调基因和12个下调基因(图2)。3.b).产生尿酸和尿囊酸的主要酶尿酸酶和尿囊素酶的编码基因诱导最明显。然而,在PVRBOHB-RNAi根中,约75%的嘌呤合成基因和脲合成基因的表达量显著下降。然而,这种表达模式在l .对虾根,其中只有少数基因上调(附加文件1:图S3)。这些结果证实了莲藕和豆荚在根瘤共生的这一阶段具有不同的调节机制,尽管豆荚和豆荚都形成了特定的根瘤。
的影响PVRBOHB根瘤菌对转基因大豆根系碳代谢相关基因表达的影响
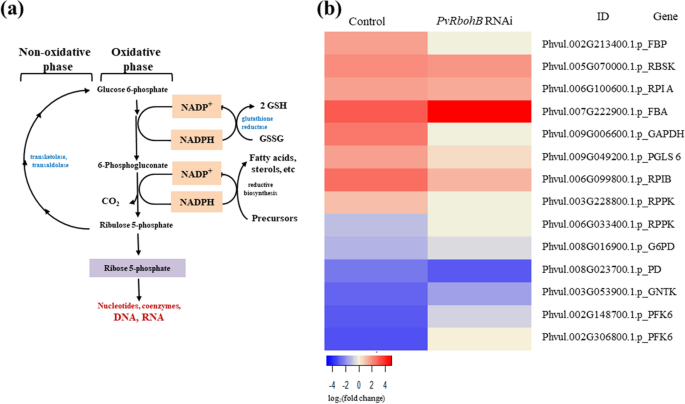
根瘤的正常功能需要碳氮代谢的正确平衡,因为这种平衡可以为植物发育提供充足的氮供应[4.].在目前的研究中,我们证明了氮素代谢在成熟的确定根瘤形成之前是活跃的。尽管如此,在P.寻常魅力根接种r . tropici,尿素的生物合成受到较大的影响PVRBOHB沉默。因此,我们研究了对硫化物途径的这种观察到的影响也受到结节共生期早期与碳代谢相关的其他因素的影响。为了评估该假设,我们分析了磷酸磷酸途径(PPP),因为核糖-5-磷酸盐是一个重要的嘌呤 - 硫化物前体(图。1).
PPP中参与氧化和非氧化阶段的关键基因表达上调P.寻常魅力用根瘤菌控制7 dpi的根(图。4.B),表明该途径在这些组织中与嘌呤-尿苷合成一起是活跃的。此外,我们检测到对照豆根中6-磷酸果糖激酶1 (PFK6)的积累急剧减少,表明通过糖酵解途径的葡萄糖代谢减少,支持碳流量通过PPP增加的观点。相反,这组PPP基因在中表达水平较低PVRBOHB:RNAi根与涨幅增加PFK6这表明在这些组织中,PPP活性明显降低,糖酵解增加。然而,观察到不同的表达模式l .对虾和M. Truncatula.样本(附加文件1(图S4),其中只有大约3个基因上调,支持了在这些模型豆科植物(分别发育确定性和不确定性根瘤)根瘤共生的这一阶段有不同的调控机制的观点。
在豆科植物-根瘤菌共生过程中,植物地上部分的蔗糖主要通过蔗糖合酶活性被分解,该反应的产物通过糖酵解代谢,为细菌呼吸和铵同化提供碳骨架[11那12] (图。1).由于效用合成和戊糖磷酸途径受到影响PVRBOHB:RNAI根,我们评估了参与从蔗糖到菌碳骨架的基因的表达。有趣的是,大多数与蔗糖分解代谢有关的基因被下调并控制PVRBOHB:RNAi根,后者表达比略有增加(附加文件1:图S5)。这一结果是在与碳的通过糖酵解流量减少的协议,因为PFK6在对照植株中受到抑制。这些结果表明,碳骨架是由PPP中产生的甘油醛3-磷酸生成的,而不是由糖酵解产生的。然而,蔗糖分解代谢在l .对虾和M. Truncatula.而不是P.寻常魅力(附加文件1:图S5),表明在这两种模型豆科植物中,为微共生体提供碳骨架的代谢在根瘤形成初期就被激活了。
的影响PVRBOHB根瘤细胞周期相关基因的表达
不同类型的细胞和层必须协调它们的发育,以确保成功的结节器官发生。在确定性结节中,第一次细胞分裂事件通常发生在外层皮层[5.].细胞增殖是通过周期蛋白依赖性激酶(CDKs)的周期性激活驱动的有丝分裂细胞周期发生的,CDKs与不同的周期蛋白(CYCs)结合,激活从G1到S期和G2细胞周期的M期(图5.) (42].因此,我们分析了对照中涉及细胞周期的基因的表达和PVRBOHB: RNAiP.寻常魅力的根源。
Cyc-CDK复合物等的活性由泛素介导的细胞周期蛋白的降解控制;这种降解对于细胞周期的及时进展是重要的[42].与Skp-Cullin1-F-Box (SCF) E3连接酶相关的两个RING/ u -box,与后期促进复合物/环体(APC/C)一起,主要参与了从M期到G1期的转变(图)。5.b). APC/C是一个11-13亚基蛋白的大型复合物,包括cullin (Apc2)和RING (Apc11)亚基,与SCF非常相似。当APC/C将抑制性伴侣安全蛋白泛素化时,后期开始。安全蛋白的破坏激活分离酶,分离酶随后分解内聚蛋白,内聚蛋白是一种负责将姐妹染色单体固定在一起的蛋白质,释放它们向细胞极移动。APC/C通过这种方式促进中期到后期的转变,使细胞有丝分裂完成,进入G1期[43].有丝分裂退出提供了一个强大的机制,在整个细胞分裂中维持细胞身份[44].编码这些蛋白的基因在对照植物中上调。同样,一个CDKF编码周期蛋白依赖性激酶20的基因在对照植物中也上调。该基因编码周期蛋白依赖的激酶复合物的催化亚基,其活性限制在细胞周期的G1-S阶段,当细胞在有丝分裂期间产生DNA复制所需的蛋白质时。
在PVRBOHB:RNAi根,与对照根相比,这些基因中约有75%的差异表达(图1)。5.b)。细胞周期蛋白B1那B2,CDKB2基因明显上调。这些基因主要参与G2-M期,其表达受到严格控制并局限于G2和M期晚期[45那46].当染色体在后期正确排列时,APC/C快速降解周期蛋白B1和B2是有丝分裂退出和细胞周期完成所必需的。在相同的方向上,CDK失活被认为是由于B2的蛋白水解。此外,B2的异位表达和不可降解B1细胞周期蛋白的表达中断了G2向M的传代,从而退出了有丝分裂[47那48].这些结果表明,在对照植物中,细胞周期基因的表达有利于退出M期,使细胞开始新的分裂周期。在PVRBOHB细胞周期基因的表达影响有丝分裂后期的推进和有丝分裂的退出。这些结果与7 dpi时结节分生组织开始发育的观察结果一致。
与我们在P.寻常魅力,在l .对虾在根中,这些基因的表达没有明显的变化,而在根中M. Truncatula.那CDKD1上调(附加文件1:图S6)。这些结果表明,细胞周期l .对虾和M. Truncatula.与根扎比亚共生有不同的监管机制P.寻常魅力,尽管两者都有l .对虾普通豆荚产生一定的结核。
RT-QPCR基因表达谱的验证
为了验证使用转录组数据获得的结果,我们使用RT-QPCR量化了控制和控制中的六个次数的转录性丰度PVRBOHB-RNAi根接种r . tropici.早期结节蛋白基因早期的果糖2(ENOD2.)作为结瘤过程的分子标记(图。6.一种)。我们还评估了表达式CYCB2:3(参与有丝分裂细胞周期),GS.和SAT1(参与无根瘤菌固定的氮气的同化和运输)和所有的b都和UA(参与福利的生物合成,以提供植物的固定氨的空中部位)。重要的是,响应于接种无根扎虫,所有所选基因表达了强烈的表达差异,在对照根中的高水平和低水平时表达PVRBOHB-RNAi的根,或反之基于RNA-seq。基于RT-qPCR,ENOD2.转录水平与根瘤菌接种控制根显著较高,但这种根瘤素标记不是在诱导PVRBOHB-RNAI根,支持我们以前的研究结果[17那29].而且,GS.那SAT1那所有的b都,UA在对照根中上调而在PVRBOHB-rnai根(图。6.是)。最后,CYCB2:3在调节PVRBOHB-RNAi在对照根中下调(图2)。6.f).因此,RT-qPCR和RNA-seq得到的结果高度一致,支持PVRBOHB调节与本研究评估的分子信令和代谢途径相关的基因的表达。
RT-qPCR验证RNA-Seq数据中观察到的基因表达谱。的转录水平PvENOD2(一种),pvg(B.),PVSAT1(C),PvALLB(D.),PvUA(E.),PvCYCB2; 3(F)被控制和PVRBOHB-RNAi转基因根7 dpir . tropici.日志2来自RT-QPCR和RNA-SEQ数据的相应基因的(折叠变化)分别由米色和橙子棒(A-F.).RT-qPCR数据归一化至表达PvEF1α并且条形图显示至少三种独立的生物重复的平均值±SE,具有三种技术重复(N> 10)。星号表示未接种和接种样本之间的显著差异,如使用未配对的学生的T.-测试 (*P.< 0.05;***P. < 0.001)
讨论
比较分析豆科根瘤中参与根瘤菌侵染和根瘤器官发生的代谢组分及其调控因子,对进一步了解共生固氮具有重要意义。在这里,我们分析了之前生成的对照根和rnai诱导下调的根的转录组分析数据PVRBOHB在普通菜豆中接种r . tropici.本研究的目标是阐明PVRBOHB与不同代谢途径的相互作用P.寻常魅力为了更好地了解其在根结节共生中的作用。为了比较,我们使用野生型的可用转录组数据l .对虾根(30.那32]和野生型结节M. Truncatula.植物(31那33].
豆类和共生土壤根瘤菌发生激烈的分子信号[49那50].植物根将类黄酮和异类黄酮排泄到根际[51].这些化合物被根瘤菌感知并诱导几个编码蛋白质的基因表达,这些蛋白质合成并释放NFs,为宿主植物提供信号[50那52].NFS在植物根系中增加异黄酮生物合成,从而产生阳性反馈信号,增加细菌殖民化[53那54].在这里,我们发现异戊类化合物生物合成起到积极作用P.寻常魅力在接种根瘤菌后的早期(7 dpi)(图。2).研究发现PVRBOHB导致CHS同工酶水平的降低,而CHI水平不受(图2b)表明,PVRBOHB产生的ROS产生异黄酮含量而不是共生期间酚类化合物的含量。相比之下,观察到黄酮类生物合成基因的下调l .对虾和M. Truncatula.(附加文件1:图1 s)。虽然异黄酮在结瘤中的作用已经引起了人们的广泛关注,但在植物与微生物的相互作用中,异黄酮的产生是如何调控的却知之甚少。我们的结果表明,异黄酮的生物合成受ROS的调控。这一概念与以下发现一致:白三叶草内皮层细胞在根瘤菌感染的最初数小时内,直到细胞分裂时,类黄酮生物合成被诱导(Trifolium Repens.根源[34那38];黄酮类化合物在根瘤形成中起重要作用M. Truncatula.[36];黄酮类化合物可能通过与过氧化物酶的相互作用来调节生长素的运输[36那38].
在测定结节豆类中,固定的大气氮被释放为氨进入感染细胞的细胞质[55].在细胞质中,氨通过GS-NADH-GOGAT循环从谷氨酸同化为谷氨酰胺。GS催化atp依赖性的谷氨酸酰胺化形成谷氨酰胺。对GS进行了多种分析P.寻常魅力器官(41那56].胞质GS酶由三个不同的基因编码:PvGln-α.那pvgln-β.和结核特异性基因pvGln-γ..启动子的分析pvgln-β.和pvGln-γ.在转基因中Lotus corniculatus显示,pvGln-γ.在根瘤菌感染的结节细胞中优先表达,而pvgln-β.在根中大量表达[57].在目前的研究中,有两个细胞质GS.基因(phvvul.008g237400.1.P.PvGS1a和phvvul.001g229500.1.P.PvGS1b)在结瘤早期高表达P.寻常魅力.Phvul.008G237400.1.pPvGS1a表明在7 dpi时,主要的GS活性发生在根瘤中(图2)。3.一个)。M. Truncatula.结节,三GS.基因已经被确认:MtGS1a和MtGS1b在细胞质中MtGS2在塑料中,在哪里MtGS1a占结核中总氧含量的90% [58那59].
此外,在M. Truncatula.使用膦素导致结节生长和结节衰老的促进抑制[60.].我们的数据显示phvull . 008g237400.1 .pPvGS1a表达明显受到PVRBOHB.考虑到在PVRBOHB:与对照根瘤相比,RNAi根减少90% [17],这些结果表明PvRBOHB产生的ROS与pvg基因P.寻常魅力有节的条件下。然而,Phvul.001G229500.1.pPvGS1b仍然上调PVRBOHB-沉默的根,可能是由于弱同化氨。
Gogat催化酰胺基团从谷氨酰胺转移到α-酮戊酸盐,得到两个谷氨酸分子(图。1) [61.那62.].这种酶以两种不同的同型存在,NADH-GOGAT和铁氧脱氧蛋白依赖(Fd) GOGAT。NADH-GOGAT主要存在于非绿色组织中,在结节发育过程中其活性和mRNA积累显著增加[55那63.那64.].在普通豆瘤中,NADH-GOGAT以两种亚型(I和II)的形式存在,其中同工酶II在根瘤发育过程中表现出最大的活性[64.].然而,对豆根瘤cDNA文库的分析表明,NADH-GOGAT的两个不同的cDNA在豆根瘤中高表达[55].在这项研究中,我们发现了这个Fd-GOGAT基因和一个NADH-GOGAT基因在对照组中下调P.寻常魅力根瘤菌的根,但有趣的是,两者都有GOGAT基因上调PVRBOHB: RNAi根(无花果。3.一种)。这些结果表明,谷氨酰胺而不是谷氨酸优先于对照植物中合成,支持对嘌呤和福利合成的对谷氨酰胺的高要求。
在氨水中同化到谷氨酰胺后,谷氨酰胺的酰胺基用于嘌呤合成,产生单磷酸喹啉(Imp)。脱氢酶催化Imp对黄嘌呤的转化,然后是感染细胞中的尿酸(通过黄嘌呤脱氢酶)(图。1).在未感染的细胞中检测到的尿组和丙二醇酶,催化尿酸的不可逆转化为含有丙氨酸和对丙二醇的[65.].尿囊素和尿囊酸是从根瘤输出到植物地上部分的最终氮形式(图。1) [66.].掌控之中P.寻常魅力7 dpi时,根瘤菌phvull . 005g048700.1 .p高度诱导了几个参与脲醛合成的关键基因PvIMPDH, Phvul.007G234300.1.pPvUricase, Phvul.006G186700.1.ppvallantoinase..相反,这些关键基因的尿素生物合成下调PVRBOHB: RNAi的根源。这些结果表明,即使一些转运基因(PvAMT2和PVSAT1),GS.,GOGAT基因在这些结节中略微上调(图。3.A),脲类化合物的合成没有维持氮化合物向芽的流动。
在豆类中,两个祖非氨基酶基因PvALN1和PvALN2而在大豆中已经描述了四个基因(GmALN1通过GmALN4).PvALN1具有最大的序列相似性GmALN1和GmALN2和PvALN2更像是GmALN3和GmALN4[67.].自从GmALN1据报道,曾经是大豆结节中最高表达的人[67.]我们可以假设这一点PvALN1是具有对照植物的豆结节中最高表达的人(Phvul.006G186700.1P),其表达在沉默的植物中大大降低。另一方面,Allantoinase基因(PhV4006G186800.1P)可以代表PvALN2在两个条件下表现出低表达的同种型。这结果表明了常见的beanPvALN1异位型可能是共生体中脲类化合物的合成。
在受感染细胞的质体和线粒体中,尿苷的合成始于嘌呤的从头合成[68.那69.] (图。1);用于嘌呤合成所需的氮气直接从谷氨酰胺,甘氨酸(GLY)和天冬氨酸(ASP)衍生的,而碳源是由从PPP核糖-5-磷酸作出了贡献。我们观察到,碳源也得到显着的削弱PVRBOHB沉默,因为参与PPP的氧化和非氧化阶段的基因显示出这些结节中表达的较弱变化而不是对照根部(图。4.b)。CE.NT.ral products of the PPP are ribose-5-phosphate and the cofactor NADPH [70那71.[后者用于脂肪酸生物合成,过氧化氢解毒,并通过植物减少谷胱甘肽的维持(图。4.一种)。植物雇用RBOHS(NADPH氧化酶)在不同植物组织中产生ROS。这些酶催化氧的还原以产生超氧化物阴离子,用NADPH作为电子给体和产生NADP+[13那14那72.].我们的研究结果表明PVRBOHB直接影响PPP减少NADP+作为电子供体,从而降低了共生体碳源的可用性。
在豆科植物与根瘤菌相互作用的早期,NFs诱导根皮层细胞分裂,进而发展成根瘤原基[73.].确定结节形成在外皮中的细胞分裂开始。迅速丧失的营养活动使球形结节形成在热带豆类上,例如常见的豆类[5.那73.].有趣的是,PPP是己糖和戊糖相互转化的中心,其中5-磷酸核糖也是核苷酸和核酸生物合成的前体,与细胞周期共享基本链接(图)。4.a).在植物中,分化细胞重新进入细胞周期通常发生在器官形成过程中或对环境变化的响应中[74.].核心细胞周期机制,包括CDK和CYC复合物,在细胞周期的不同阶段被激活,从而以特定的方式调节这些阶段(图)。5.a).在G1和S阶段,有许多CYCD和CYCA3基因被转录,其基因产物优先与cdka组装。而CYCD-CDKA复合物则优先存在于G1期到S期的细胞中。在G2和M期,CYCA2那CYCB1那CYCB2,CYCD3; 1基因被强烈表达,它们的基因产物与CDKB1S,CDKB2S和CDKA组装[42].
在这里,我们观察到可能参与细胞周期从G2期向M期过渡的基因表达谱P.寻常魅力(Phvul.002G115100.1.pPvCYCB2; 3,phvvul.001g119700.1.p.pvcycb1., Phvul.008G203300.1.ppvcycb1., Phvul.001G000500.1.pPvCDKB2, Phvul.004G152000.1.pPvCDKD1)受到强烈影响PVRBOHB沉默(图。5.b)。蒙蒂尔等人。(2012)证明了PVRBOHB: RNAiP.寻常魅力与对照根相比,外皮中的细胞分裂的根部接种的细胞分裂急剧减少。此外,参与细胞周期M阶段的术后调节的基因(phvul.001g197000.1.ppvr / U-box,phvvul.009g209800.1.P.pvr / U-box,phvvul.001g232800.1.P.PvCDC20 / FZR, Phvul.002G037700.1.pPvCDC20)显示出不同的表达曲线PVRBOHB:RNAi与控制根源(图。5.b)。
SCF E3连接酶相关的RING/ u -box,以及后期APC/C,促进细胞由M期向G1期过渡,使细胞有丝分裂完成,进入G1期。这个过程允许细胞准备重新开始细胞分裂和分生组织的发育。相比之下,在PVRBOHB: RNAi根,细胞周期蛋白B1那B2,CDKB2基因表达强烈增加。考虑到这些基因的蛋白质产物必须被降解以允许有丝分裂退出和细胞周期的完成,这些结果表明PVRBOHB:RNAi根,根瘤分生组织的形成受到影响,这与我们之前的研究结果一致[17].这些结果表明,PvRBOHB产生的ROS在与根瘤菌共生过程中对普通豆科植物的细胞周期调控具有不同水平的重要作用。我们的数据与之前关于侧根发育的研究结果一致,即分子和细胞事件受细胞氧化还原状态的调节[75.那76.那77.那78.那79.].
最后,生长素和细胞分裂素的生物合成和信号转导是IT形成和结节器官形成的关键[26那27那80].此外,ROS,生长素在一起,苜蓿[玩分化叶细胞在细胞周期的激活作用74.那81.].我们之前报道过,参与生长素和细胞分裂素生物合成和转运的基因可能与常豆根瘤器官发生过程中PvRBOHB产生的ROS相互作用[17那29].
结论
在本研究中,我们分析了控制条件下普通豆根和表达下调的根的转录组数据PVRBOHB未接种和接种R。tropici之前执行。基于目前和以前的研究结果,我们提出以下模型(图。7.): PvRBOHB产生的ROS通过与碳代谢、细胞周期调控、植物激素生长素和细胞分裂素的串扰,在IT和根瘤器官发生中发挥核心作用。通过对活性氧依赖分子与这些代谢途径相互作用的功能分析,我们将进一步了解活性氧与根瘤菌-豆科植物共生的相互作用。
材料和方法
转录组分析
我们之前对转基因进行了全球转录组分析P.寻常魅力简历。黑人Jamapa根表达PvRboh-rnai和非沉默的根源接种r . tropici或根瘤菌不规则[29].在本研究中,我们使用相同的转录组数据集,以更深入地分析PVRBOHB在根瘤菌 - 常见的bean交互中。为了加强我们的比较,我们包括来自野生型根部的可用转录组数据Lotus对虾接种Mesorhizobium洛蒂接种后7天(dpi),接种后7天(dpi)M. Truncatula.6 dpi结节伴苜蓿根瘤菌[31那33].我们应用了≥1.5 log的截止阈值2(折叠变化)和罗斯福调整P.值≤0.05,以选择所有转录组数据的DEGs。分布和丰度(对数2倍数变化[FC])的DEGS的在热图和使用函数heatmap.2(gplot封装)和draw.quad.venn(文氏图包),分别维恩图中呈现,在R包。Blast2GO软件[82.)(https://www.blast2go.com/)被用来常用注释。一个未配对的学生T.-test是使用stats包的t.test函数执行的。
植物生长的条件和RT-qPCR分析
在这项研究中,P.寻常魅力简历。采用RT-qPCR检测。普通豆籽是从当地市场获得的,使用时不需要特别许可。转基因PvRboh-rnai和非沉默(无沉默(控制没有施工)根源通过转换使用农杆菌属rhizogenes根据Instituto deBiotecnología-UNAM指南的实验室条件下K599 [83.].将复合植物转移到盆中并接种r . tropici应变CIAT899(1毫升,每在OD幼苗600= 0.05)在相同条件下[17那29那84.].接种根瘤菌后,用不含硝酸盐(KNO)的B&D培养基灌溉复合植株,可促进根瘤菌结瘤3.),而非常规的植物用B&D溶液浇水,互补8 mm Kno3.抑制瘤瘤。根源(N = 5–10 per condition) were harvested at 7 dpi for RNA isolation, frozen in liquid nitrogen, and stored at –80 °C.
采用RT-qPCR分析高表达或低表达的基因,以验证RNA-seq数据。按照制造商的说明,使用ZR植物RNA迷你prep试剂盒(Zymo Research)从储存的根中分离出高质量的总RNA。通过凝胶电泳验证RNA的完整性,并使用NanoDrop2000分光光度计(Thermo Fisher Scientific, Waltham, MA, USA)对RNA浓度进行定量。用RNase-free DNase (10 U/µl;使用Thermo Scientific RevertAid逆转录酶(200 U/µl)合成互补DNA (cDNA),按照制造商的说明,使用200 ng无DNA RNA作为模板。qPCR分析使用Maxima SYBR绿色/火箭qPCR工具包(热费希尔科学)如下:每个反应包含5μl Maxima SYBR绿色/火箭qPCR大师混合(2 x)(美国热科学),1μl cDNA样本(20 ng RNA为模板),每个引物和0.33μl(10μM)在反应系统中10μl。热循环条件为:95℃10 min, 95℃15 s, 60℃60 s循环40次。熔化曲线阶段采用以下热条件进行评估:95°C 15 s, 60°C 60 s,和96°C 5 s。为了证实没有污染的DNA,还包括一个不含逆转录酶的对照样本。用公式2计算相对表达式值-ct.,循环阈值ΔCt等于感兴趣基因的CT减去参考基因的CT(PvEF1α) [85.].进行有三个技术重复三个生物学重复。用于RT-qPCR测定基因特异性寡核苷酸的列表被报道在补充材料的其它文件2S1:表。
数据和材料的可用性
数据在NCBI数据库中以BioProject登录号PRJNA482464和Sequence Read Archive登录号SRR7693915-SRR7693917、SRR7696192-SRR7696194、SRR7696200-SRR7696202、SRR7696204-SRR7696206、SRR7696589-SRR7696591和SRR7696208-SRR7696210进行检索。
缩写
- ROS:
-
活性氧
- RBOH:
-
呼吸爆发氧化酶同源物
- 它:
-
感染的线程
- RNAi:
-
RNA干扰
- 度:
-
差异表达基因
- EF:
-
延长因子
- RT-qPCR:
-
聚合酶链反应的反转转录定量
- 罗斯福:
-
假发现率
参考
- 1.
在黑暗中测定年份:根对真菌信号的响应如何建立丛枝菌根共生关系。植物生态学报。2011;14:451-7。https://doi.org/10.1016/j.pbi.2011.03.014.
- 2.
Caetano-Anollés G, Crist-Estes DK, Wolfgang DB。木犀草根瘤菌对植物黄酮的趋化性需要功能性结瘤基因。J Bacteriol。1988;170:3164-9。
- 3.
Aguilar JMM,Ashby Am,Richards AJM,Loake GJ,Watson MD,Shaw Ch。Remuminosarum Biovar Phabooli的趋化性朝向西生物瘤瘤的黄酮型诱导剂。J Gen microbiol。1988; 134:2741-6。
- 4.
Roy S,Liu W,Nandety Rs,Crook A,Mysore Ks,Pislariu Ci等。庆祝豆科纺织瘤和共生氮固定中20年的遗传发现。植物细胞。2020; 32:15-41。
- 5.
Ferguson Bj,Indrasumunar A,Hayashi S,Lin M-H,Lin Y-H,Reid de等人。豆类结节发育和自疗的分子分析。J Intent Plant Biol。2010; 52:61-76。
- 6。
陈志强,陈志强,陈志强,等。尿素的早期信号转导、合成、转运和代谢研究进展。植物生理学杂志。2016;193:97-109。https://doi.org/10.1016/j.jplph.2016.01.013.
- 7。
Todd CD, Tipton PA, Blevins DG, Piedras P, Pineda M, Polacco JC。豆科植物尿素降解的最新进展。J Exp Bot. 2006; 57:5-12。
- 8。
RASO JM,谢穆尼奥斯A,Pineda的男,从法国菜豆(菜豆)的尿囊降解酶的彼德拉斯内格P.生化特征:苯肼的需求。Planta。2007; 226:1333年至1342年。
- 9。
Kanamori K, Weiss RL, Roberts JD。麦胶芽孢杆菌固氮过程中谷氨酸脱氢酶在氨同化中的作用。J Bacteriol。1987;169:4692-5。
- 10.
长谷H,清水M,瓦伦丁RC。固氮细菌氨同化的机理。拱Mikrobiol。1971;79:164 - 75。
- 11.
Gordon Aj,Minchin Fr,James Cl,Komina O.植物结节中的蔗糖合成酶对于氮固定至关重要。植物理性。1999年; 120:867-77。
- 12.
Aleman L, Ortega JL, Martinez-Grimes M, Seger M, Holguin FO, Uribe DJ等。在紫花苜蓿(Medicago sativa L.)根瘤中,蔗糖磷酸合酶基因成员(MsSPSA)的增强表达在碳氮代谢中发挥作用。足底。2010;231年。https://doi.org/10.1007/S00425-009-1043-Y..
- 13.
Damiani I, Drain A, Guichard M, Balzergue S, Boscari A, Boyer J-C, et al.;Nod因子对截形苜蓿根毛特异性转录组的影响 :质膜运输系统和活性氧物种网络的研究。植物科学学报,2016;7:第794条。
- 14.
Montiel J, Arthikala MK, Cárdenas L, Quinto C.豆类NADPH氧化酶在结瘤的不同阶段起着至关重要的作用。国际分子生物学杂志。2016;17:680。
- 15.
李志刚,李志刚,李志刚,等。紫花苜蓿与木本中华根瘤菌共生作用的研究进展。植物与微生物的相互作用。2001;14:86-9。
- 16。
Cárdenas L, Martínez A, Sánchez F, Quinto C.对Nod因子(NFs)响应的活根毛细胞内快速、短暂和特异的ROS变化。植物j . 2008; 56:802-13。
- 17。
引用本文:王志军,王志军,王志军,等。菜豆NADPH氧化酶基因是根瘤菌侵根的必需基因。植物生理学杂志。2012;53:1751-67。
- 18。
Arthikala M-K,Montiel J,Sánchez-Lópezr,纳瓦N,CárdenasL,Quinto C.呼吸爆发氧化酶同源物基因A对于根瘤菌感染和结节成熟和常见豆类的功能至关重要。前植物SCI。2017; 8:2003年第2003条。https://doi.org/10.3389/fpls.2017.02003.
- 19。
柯达,方q,陈c,zhu,chen t,chang x等。小GTPase ROP6与NFR5相互作用,涉及莲花粳稻的结节形成。植物理性。2012; 159:131-43。https://doi.org/10.1104/pp.112.197269.
- 20.
雷呒-J,王琪,李X,陈甲,罗升,谢Y,等人。蒺藜苜蓿小GTP酶ROP10需要根毛都顶端生长和Nod因子诱导根毛变形。植物细胞。2015; 27:806-22。https://doi.org/10.1105/tpc.114.135210.
- 21.
王志强,王志强,王志强,等。截茎紫花苜蓿中Rac1 GTPase MtROP9的沉默可以刺激早期菌根和卵菌的根定植,但对根瘤菌侵染有负面影响。植物杂志。2012;159:501-16。https://doi.org/10.1104/pp.112.193706.
- 22.
Arthikala MK, Sánchez-López R, Nava N, Santana O, Cárdenas L, Quinto C. RbohB是一种菜豆NADPH氧化酶基因,可以提高根瘤的共生体数量、类杆菌大小和固氮能力,并降低菌根定殖。新植醇。2014;202:886 - 900。
- 23.
截断紫花苜蓿结点因子诱导活性氧产生与早期结节蛋白基因rip1的表达相关。植物与微生物的相互作用。2002;15:522-8。
- 24.
Marino D, Andrio E, Danchin EGJ, Oger E, guciardo S, Lambert A, et al.;截茎紫花苜蓿NADPH氧化酶参与共生瘤功能。新植醇。2011;189:580 - 92。
- 25.
Suzaki T, Yano K, Ito M, Umehara Y, Suganuma N, Kawaguchi M.生长素对荷花根瘤发育过程中皮层细胞分裂的正调控和负调控。发展。2012;139:3997 - 4006。https://doi.org/10.1242/dev.084079.
- 26.
王志强,王志强,王志强,等。植物表皮生长素的生物合成对荷花根瘤菌侵染的影响。植物j . 2018; 95:101-11。
- 27.
细胞分裂素生物合成促进结节发育过程中皮层细胞的反应。植物杂志。2017;175:361 - 75。
- 28.
Breakspear A,Liu C,Roy S,Stacey N,Rogers C,Trick M等。Medicago Truncatula的根部毛发“感染物”揭示了细胞周期基因的变化,并揭示了在根瘤菌感染中的养肝信号传导的要求。植物细胞。2014; 26:4680-701。
- 29.
Fonseca-García C, Zayas AE, Montiel J, Nava N, Sánchez F, Quinto C.热带根瘤菌和不规则根瘤菌接种后菜豆根NADPH氧化酶基因RbohB差异效应的转录组分析。BMC基因组学。2019;20:1-18。
- 30.
Høgslund N, Radutoiu S, Krusell L, Voroshilova V, Hannah MA, Goffard N,等。利用整合转录组分析分析荷花突变体和野生型植物的共生关系和器官发育。PLoS ONE。2009; 4: e6556。
- 31.
Benedito Va,Torres-Jerez I,Murray JD,Andriankaja A,Allen S,Kakar K,等。模型豆类Medicago truncatula的基因表达式图集。工厂J. 2008; 55:504-13。
- 32.
陈志强,陈志强,陈志强,等。豆科植物荷花信息库的构建与应用。Sci众议员2016;6:39447。https://doi.org/10.1038/srep39447.
- 33.
何杰,Benedito VA,王敏,Murray JD,赵px,唐勇,等。截尾苜蓿基因表达图谱网络服务器。BMC生物信息学。2009;10:a441。
- 34.
白三叶草根瘤器官发生细胞中诱导的黄酮类化合物是过氧化物酶分解生长素的调节因子。J Exp Bot. 2001; 52:419-26。
- 35.
刘超,刘志强。黄酮类化合物在结瘤宿主范围特异性中的作用:最新进展。植物。2016;33。
- 36.
关键词:截茎苜蓿,黄酮通路,根瘤菌,根瘤形成,生长素调控植物细胞。2006;18:1617-29。
- 37.
Buer CS, Muday GK, Djordjevic MA。拟南芥中黄酮类化合物的不同提取和长距离运输。植物杂志。2007;145:478 - 90。
- 38.
Mathesius U, Bayliss C, Weinman JJ, Schlaman HRM, Spaink HP, Rolfe BG,等。白三叶根瘤起始时皮层细胞合成的黄酮类化合物是白三叶早期发育的标记物。植物与微生物的相互作用。1998;11:1223-32。
- 39.
王志强,王志强,王志强,等。大豆异黄酮生物合成的代谢工程研究。在:Sparks DL,编辑。农学的进步。加州圣地亚哥:爱思唯尔学术出版社;2005.153 - 4页。
- 40.
Agati G,在光保护黄酮Tattini M.多重功能性作用。新植物。2010; 186:786-93。
- 41.
陈志强,陈志强,陈志强,等。豆科植物谷氨酰胺合成酶多肽的研究进展[J] .植物生理学报,1984;76:1019-23。
- 42.
小牧S,由发育和环境线索植物细胞周期的杉本K.控制。植物细胞生理。2012; 53:953-64。
- 43.
霍尔特LJ,Krutchinsky An,Morgan Do。正反馈削减了一个不合作的开关。自然。2008; 454:353-7。
- 44.
Oh E, Mark KG, Mocciaro A, Watson ER, Prabu JR, Cha DD,等。后期促进复合物控制的基因表达和细胞特性。大自然。2020;579:136-40。https://doi.org/10.1038/s41586-020-2034-1.
- 45.
陈志强,李志强,李志强,等。苜蓿细胞周期蛋白:在细胞周期和植物器官中的差异表达。植物细胞。1992;4:1531-8。
- 46.
Fobert Pr,Coen Es,Murphy GJP,Doonan JH。细胞分裂模式通过在植物细胞周期中的基因转录调节而揭示。Embo J. 1994; 13:616-24。
- 47.
Weingartner M, Pelayo HR, Binarova P, Zwerger K, Melikant B, de la Torre C, et al.;植物细胞周期蛋白B2在有丝分裂早期被降解,其异位表达缩短了g2期,减轻了dna损伤检查点。中华细胞杂志2003;116:487-98。
- 48.
魏因加特纳男,Criqui M-C,梅萨罗斯T,Binarova P,施密特A-C,Helfer A,等人。通过抑制成膜体的形成影响植物生长发育,并导致丝分裂不可降解的细胞周期素B1的表达。植物细胞。2004; 16:643-57。
- 49.
Gualtieri G,Bisseling T.染色的演变。在:摩卡j,gaut b,编辑。植物分子演变。Springer:Dordrecht;2000. p。181-94。
- 50.
Pueppke SG。豆科植物根瘤菌结瘤的遗传和生化基础。《生物技术评论》1996;6:1-51。
- 51.
Barbour Wm,Hattermann Dr,Stacey G.Bradylizobium japonicum的Chemotaxis至大豆渗出物。申请环境微生物。1991年; 57:2635-9。
- 52.
Downie JA, Walker SA。植物对结瘤因子的反应。植物学报1999;2:483-9。
- 53.
Recourt K, Schripsema J, Kijne JW,布鲁塞尔AAN van, Lugtenberg巴西柔术。接种豇豆亚种。黑根与豆科根瘤菌(Rhizobium leguminosarum biovar viciciae)结合,可以释放激活黄酮和查尔酮的nod基因。植物学报1991;16:841-52。
- 54.
Van Brussel Aan,Recourt K,Pees E,Spaink HP,Tak T,Wijffelman Ca,等。Remuminosarum BV的生物公然特异性信号。维亚内诱导蚕豆菌株根除术中的瘤瘤诱导活性增加。nigra。J细菌。1990年; 172:5394-401。
- 55.
王志强。豆科植物根瘤的碳氮代谢。在:迪尔沃思MJ,詹姆斯EK,斯普伦特JI,牛顿我们,编辑。昆虫共生固氮豆科。固氮:起源、应用与研究进展。多德雷赫特施普林格;2008.p . 293 - 320。
- 56.
陈志强,陈志强,陈志强,等。豆科植物根发育过程中谷氨酰胺合成酶多肽的表达。植物生理学报,1998,18(2):489 - 494。
- 57.
Gebhardt C, Oliver JE, Forde BG, Saarelainen R, Miflin BJ。菜豆根瘤、根和叶中谷氨酰胺合成酶基因的一级结构及差异表达。EMBO j . 1986; 5:1429-35。
- 58.
Carvalho H,Sunkel C,Salema R,Cullimore JV。Medicago Truncatula的细胞溶胶谷氨酰胺合成酶多肽的异孔组装:用植物结构域 - 次酶的Glna大肠杆菌突变体的互补。植物mol biol。1997年; 35:623-32。
- 59.
Carvalho H, Lescure N, De BF, Chabaud M, Lima L, Salema R, et al.;截茎紫花苜蓿胞质谷氨酰胺合成酶基因在根瘤中的表达与调控。植物学报。2000;42:741-56。
- 60。
Seabra Ar,Pereira Pa,Becker JD,Carvalho HG。膦腈素抑制谷氨酰胺合成酶导致Medicago Truncatula根结节中的转录组重编程。Mol植物微生物相互作用。2012; 25:976-92。
- 61。
谷氨酰胺、谷氨酸、天冬酰胺和天冬氨酸代谢酶。印:辛格·B,编辑。植物氨基酸:生物化学与生物技术。纽约:Marcel Dekker;1999.49 - 109页。
- 62。
Templea SJ,Carroll PV,Gantt JS。谷氨酸合成酶和氮同化。趋势植物SCI。1998年; 3:51-6。
- 63。
Gregerson RG, Miller SS, Twary SN, Gantt JS, Carroll PV。苜蓿根瘤中nadh依赖性谷氨酸合成酶的分子特征研究。植物细胞。1993;5:215-26。
- 64.
Chen F,Cullimore JV。NADH依赖性谷氨酸合成酶的同工酶在寻常的L.植物理性的根结节中。1988; 88:1411-7。
- 65.
Atkins Ca,Smith PMC,Storer PJ。豇豆结节中De Novo嘌呤合成细胞内定位的复制。植物理性。1997; 113:127 LP - 135。https://doi.org/10.1104/pp.113.1.127.
- 66.
McClure Pr,以色列DW。大豆植物XYLEM中氮的运输。植物理性。1979; 64:411-6。
- 67.
4个尿囊素酶基因在固氮大豆中表达。植物生理与生物化学。2012;54:149-55。
- 68.
史密斯PMC,Atkins Ca.嘌呤生物合成。在细胞分裂中,氮素同化甚至更大。植物理性。2002; 128:793 LP - 802。https://doi.org/10.1104/pp.010912.
- 69.
Tajima S,Nomura M,Kouchi H. Ureide Biosynthesis在豆科结节中。前碧卡西。2004; 9:1374-81。
- 70.
嘌呤、嘧啶和单碳代谢。见于:爱思唯尔生物化学综合评论(第二版)。2011.p . 119 - 124。
- 71.
Andriotis VME,史密斯AM。质体磷酸戊糖途径是在拟南芥postglobular胚胎发育至关重要。PROC NATL ACAD SCI。2019; 116:15297-306。
- 72.
Lohar DP,Haridas S,甘特JS,凡登布希KA。短暂的下降在活性氧物种在根导致根毛变形在豆类的根瘤菌共生体系。新植物。2007; 173:39-49。
- 73.
李志刚,李志刚。苜蓿根瘤器官发生过程中的细胞周期调控。acta botanica sinica(云南植物学报),2000;43:773-86。
- 74.
Fehér A, Ötvös K, Pasternak TP, Szandtner AP.活性氧(ROS)在植物细胞周期激活(g0 - g1过渡)中的参与。植物信号行为。2008;3:823-6。
- 75.
Orman-Ligeza B, Parizot B, de Rycke R, Fernandez A, Himschoot E, Van Breusegem F, et al.;rboh介导的ROS的产生促进了拟南芥侧根的出现。发展。2016;143:3328-39。https://doi.org/10.1242/dev.136465.
- 76.
李丽娜,孙丽,张丽,宋颖,胡鹏,李超,等。AtrbohD和AtrbohF通过改变拟南芥初生根中超氧化物的局部积累负调控侧根发育。足底。2015;241:591 - 602。
- 77.
Manzano C, Pallero-Baena M, Casimiro I, De Rybel B, Orman-Ligeza B, Van Isterdael G, et al.;活性氧信号在侧根发育中的作用。植物杂志。2014;165:1105-19。
- 78.
活性氧对植物根系生长发育的控制。植物学报。2016;29:57-63。https://doi.org/10.1016/j.pbi.2015.10.012.
- 79.
雷帕霉素信号网络靶点在植物生长和代谢中的作用。植物杂志。2014;164:499 - 512。
- 80。
植物激素对豆科植物与根瘤菌相互作用的调控。J Chem Ecol. 2014; 40:770-90。
- 81。
紫花苜蓿原生质体来源的细胞分裂和氧化应激防御的连锁激活依赖于外源生长素。植物生长规律2007;51:109-17。
- 82。
Götz S, García-Gómez JM, Terol J, Williams TD, Nagaraj SH, Nueda MJ,等。使用Blast2GO套件的高通量功能注释和数据挖掘。核酸学报2008;36:3420-35。
- 83。
Estrada-Navarrete G, Alvarado-Affantranger X, Olivares JE, Guillén G, Díaz-Camino C, Campos F, et al.;发根农杆菌对菜豆的快速、高效和可重复遗传转化。Nat Protoc。2007;2:1819-24。
- 84。
Arthikala Mk,Montiel J,Nava N,Santana O,Sánchez-Lópezr,cárdenasl等。PVRBOHB在寻常的PhopoloLus of phopololus中否定了Rhizophagus Irregularis殖民化。植物细胞生理。2013; 54:1391-402。
- 85。
Islas-Flores T, Guillén G, Alvarado-Affantranger X, Lara-Flores M, Sánchez F, Villanueva MA。PvRACK1功能缺失损害细胞扩张和形态发生菜豆acta botanica sinica(云南植物研究),2011;24:819-26。https://doi.org/10.1094/MPMI-11-10-0261.
确认
我们感谢博士。Luis Cárdenas和Jesús Montiel对手稿的宝贵评论。作者还感谢dr。来自Unidad de Secuenciación Masiva y Bioinformática, Instituto de Biotecnología, UNAM的Alejandro Sánchez和Ricardo Grande和Verónica Jiménez感谢他们的支持。此外,我们感谢Unidad de Síntesis y Secuenciación的Paul Gaytan博士和Jorge Arturo Yañez MsC的技术贡献。
资金
大学提供的资金是根据墨西哥(自治)下DGAPA格兰特(IN204115)中国区和DGAPA CONACYT 268158博士后奖学金C.F.G.资金也由Consejo Nacional de Ciencia y Tecnologia在墨西哥(CONACYT) de la frontera Ciencia (FC)赠款FC-2016/1503 CV200519。
作者信息
从属关系
贡献
CQ和CF-G构思了这项研究。CF-G和ML分析了数据。NN进行RNA提取和纯化,cDNA合成和RT-QPCR分析。CQ,ML和CF-G起草,编辑和修订了所有作者批准的稿件。
相应的作者
道德声明
伦理批准和同意参与
P.寻常魅力简历。Negro Jamapa是在没有特定植物采集许可的情况下从当地市场获得的。这项研究不需要伦理上的批准或同意,因为没有涉及濒危或受保护的植物物种。转基因根的产生是根据Instituto de Biotecnología-UNAM的指导方针在实验室条件下进行的。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1
.豆科植物中异黄酮生物合成途径相关的基因的表达谱。编码与异氟类化合物生物合成相关的蛋白质的DEGS编码和PVRBOHB-RNAI.P.寻常魅力根在7dpi处r . tropici,以及来自野生型的同源基因l .对虾根接种M. Loti.7岁,还有M. Truncatula.6 dpi结节伴美国meliloti.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。图S2.结节与固定的氨同化和跨膜转运度的视角。热图显示了从控制所述DEGS和PVRBOHB-RNAI.P.寻常魅力根在7dpi处r . tropici,以及来自野生型的同源基因l .对虾根接种M. Loti.在7 dpi,以及M. Truncatula.6 dpi结节伴美国meliloti.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。图S3.尿素生物合成相关基因表达模式的热图。DEGs编码与尿苷代谢相关的蛋白PVRBOHB-RNAI.P.寻常魅力7 dpi的根与根瘤菌。从野生型各自的同源基因,l .对虾根接种M. Loti.在7dpi被纳入分析,连同M. Truncatula.6 dpi结节伴美国meliloti.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。图S4.与戊糖磷酸术途径(PPP)的氧化和非氧化相有关的DEG。数据被控制和数据分析PVRBOHB-RNAI.P.寻常魅力7 dpi的根与根瘤菌。各自的同源基因来自野生型l .对虾根接种M. Loti.在7DPI时被包括在分析中,伴随着M. Truncatula.6 dpi结节伴美国meliloti.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。图S5.为结节提供碳骨架的蔗糖分解代谢相关基因的表达谱。与蔗糖分解代谢相关的酶PVRBOHB-RNAI.P.寻常魅力在7 dpi与根根亚洲的根;他们从野生型的外贸基因l .对虾根接种M. Loti.7岁的孩子被包括在分析中,还有M. Truncatula.6 dpi结节伴美国meliloti.颜色条表示日志2(折叠变化),具有红色表示上调基因的上调基因的蓝色。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。图S6.deg参与调控细胞周期PVRBOHB-RNAI.P.寻常魅力的根源。它们各自的同源基因来自野生型根l .对虾接种M. Loti.在7DPI时被包括在分析中,伴随着M. Truncatula.6 dpi结节伴美国meliloti颜色条表示日志2(fold change),红色和蓝色分别代表上调和下调的基因。日志的截止阈值2使用Fc≥1.5,使用Padj /FDR≤0.05。
附加文件2:表S1。
用于RT-qPCR分析的基因特异性寡核苷酸。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Fonseca-García, C.,纳瓦,N.,劳拉,M.等等。NADPH氧化酶在普通豆类的根末结节共生期间调节碳代谢和细胞周期(菜豆).BMC植物杂志21,274(2021)。https://doi.org/10.1186/s12870-021-03060-z
收到了:
公认:
发表:
关键词
- 转录组
- 菜豆
- PVRBOHB
- 有节
- 共生